|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Коррозия металлов и способы защиты от нее. Коррозия металлов и способы защиты от коррозии
Коррозия металлов и способы защиты от нее
Категория: Выбор стройматериалов
Коррозия металлов и способы защиты от нее
Коррозия металлов — процесс разрушения металлов и сплавов вследствие химического или электрохимического взаимодействия с внешней средой, в результате которого металлы окисляются и теряют присущие им свойства. Коррозия — враг металлических изделий. Ежегодно в мире в результате коррозии теряется 10…15% выплавляемого металла, или 1… 1,5% всего металла, накопленного и эксплуатируемого человеком.
Химическая коррозия — разрушение металлов и сплавов в результате окисления при взаимодействии с сухими газами при высоких температурах или с органическими жидкостями — нефтепродуктами, спиртом и т. п.
Электрохимическая коррозия — разрушение металлов и сплавов в воде и водных растворах. Для развития коррозии достаточно, чтобы металл был просто покрыт тончайшим слоем адсорбированной воды (влажная поверхность). Из-за неоднородности строения металла при электрохимической коррозии в нем образуются гальванические пары (катод — анод), например между зернами (кристаллами) металла, отличающимися один от другого химическим составом. Атомы металла с анода переходят в раствор в виде катионов. Эти катионы, соединяясь с анионами, содержащимися в растворе, образуют на поверхности металла слой ржавчины. В основном металлы разрушаются от электрохимической коррозии.
Для повышения долговечности и сохранения декоративности металлоконструкции защищают от коррозии. Сущность большинства способов защиты от коррозии — предохранение поверхности металла от проникновения к ней влаги и газов путем создания на металле защитного слоя. Существуют и другие методы, например электрохимическая защита.
Наиболее простой, но недолговечный метод защиты металла — нанесение на его поверхность водонепроницаемых неметаллических покрытий (битумных, масляных и эмалевых красок). В последние годы все большее применение находит метод защиты от коррозии покрытием металла тонким слоем пластмассы.
Защитить металл от коррозии можно также, покрывая его слоем другого более коррозионностойкого металла: оловом, цинком, хромом, никелем и др. Защитный слой металла наносят путем никелирования, хромирования, лужения, цинкования и свинцевания. Покрытие цинком используют для защиты от коррозии закладных деталей железобетонных изделий, водопроводных труб, кровельной жести. Защитный слой наносят гальваническим (электролитическим осаждением из раствора солей) или термическим (окунанием в расплав металла или распылением расплава) методами.
Применяют химические способы образования покрытий (плотных оксидных пленок) на металле: фосфатирование (для черных металлов) и анодирование (для алюминиевых сплавов).
Для получения металлов, хорошо противостоящих корне розии, применяют легирование. Так, вводя в сталь хром и никель в количестве 12…20 %, получают нержавеющие стали, стойкие не только к воде, но и к минеральным кислотам.
Выбор стройматериалов - Коррозия металлов и способы защиты от нееgardenweb.ru
Коррозия металлов и способы защиты от коррозии
При обычных условиях металлы могут вступать в химические реакции с веществами, содержащимися в окружающей среде, — кислородом и водой. На поверхности металлов появляются пятна, металл становится хрупким и не выдерживает нагрузок. Это приводит к разрушению металлических изделий, на изготовление которых было затрачено большое количество сырья, энергию и количество человеческих усилий.
Коррозией называют самопроизвольное разрушение металлов и сплавов под воздействием окружающей среды.
Яркий пример коррозии — ржавчина на поверхности стальных и чугунных изделий. Ежегодно из-за коррозии теряют около четверти всего производимого в мире железа. Затраты на ремонт или замену судов, автомобилей, приборов и коммуникаций, водопроводных труб во много раз превышают стоимость металла, из которого они изготовлены. Продукты коррозии загрязняют окружающую среду и негативно влияют на жизнь и здоровье людей.
Химическая коррозия происходит в различных химических производствах. В атмосфере активных газов (водорода, сероводорода, хлора), в среде кислот, щелочей, солей, а также в расплавах солей и других веществ происходят специфические реакции с привлечением металлических материалов, из которых сделаны аппараты, в которых осуществляется химический процесс.
Газовая коррозия происходит при повышенных температурах. Под ее влияние попадают арматура печей, детали двигателей внутреннего сгорания. Электрохимическая коррозия происходит, если металл содержится в любом водном растворе.
Наиболее активными компонентами окружающей среды, которые действуют на металлы, является кислород О2, водяной пар Н2О, карбон (IV) оксид СО2, серы (IV) оксид SО2, азота (IV) оксид NО2. Очень сильно ускоряется процесс коррозии при контакте металлов с соленой водой. По этой причине корабли ржавеют в морской воде быстрее, чем в пресной.
Суть коррозии заключается в окислении металлов. Продуктами коррозии могут быть оксиды, гидроксиды, соли и т.д. Например, коррозии железа можно схематично описать следующим уравнением:
4Fe + 6h3O + 3O2 → 4Fe (OH) 3.
Остановить коррозию невозможно, но ее можно замедлить. Существует много способов защиты металлов от коррозии, но основным приемом является предотвращение контакта железа с воздухом. Для этого металлические изделия красят, покрывают лаком или покрывают слоем смазки. В большинстве случаев этого достаточно, чтобы металл не разрушался в течение нескольких десятков или даже сотен лет.
Другой способ защиты металлов от коррозии электрохимическое покрытие поверхности металла или сплава другими металлами, устойчивых к коррозии (никелирование, хромирование, оцинковка, серебрение и золочение). В технике очень часто используют специальные коррозионностойкие сплавы. Для замедления коррозии металлических изделий в кислой среде также используют специальные вещества — ингибиторы.
xn----7sbfhivhrke5c.xn--p1ai
| Коррозия — процесс химического или электрохимического разрушения металлов под действием окружающей среды. Установлено, что от коррозии ежегодно теряется безвозвратно около 10 % производимых металлов, т. е. годовая продукция крупного металлургического завода. В процессе химического разрушения на поверхности металла образуется пленка из продуктов коррозии, обычно оксидов. В некоторых случаях эта пленка может защищать лежащий под ней металл от дальнейшей коррозии. Сравнительно плотные оксиды пленки образуются на поверхности алюминия, свинца, олова, никеля, хрома. При окислении железа в сухом воздухе или в атмосфере сухого кислорода образуется также достаточно плотная пленка, но она по мере роста растрескивается и отслаивается от металла. Чаще всего химическая коррозия происходит в среде сухих газов при высокой температуре (металлическая арматура печей, клапаны двигателей, лопатки газовых турбин и т.п.) или в жидкостях неэлектролитов (окисление металла в спирте, бензине, нефти, мазуте и т. п.). При электрохимической коррозии металл разрушается вследствие его растворения в жидкой среде, являющейся электролитом. Сущность процесса электрохимической коррозии заключается в том, что атомы, находящиеся в узлах кристаллической решетки металла, при контакте с раствором электролита переходят в раствор в форме ионов, оставляя эквивалентное количество электронов в металле. Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах (например, свинец растворяется значительно медленнее, чем железо). Данный вид коррозии может также возникнуть при контакте двух разнородных металлов в присутствии электролита, когда между этими металлами возникает гальванический ток. В гальванической паре любых двух металлов будет растворяться тот металл, который обладает более отрицательным электродным потенциалом. Например, железо имеет более низкий отрицательный электродный потенциал, чем цинк, и более высокий, чем медь. Следовательно, при контакте железа с цинком будет разрушаться цинк, а при контакте железа с медью — железо. Гальванические пары при коррозии образуются не только между отдельными участками контактирующих металлов, но также и между микроскопически малыми кристалликами одного и того же сплава, если они различаются по химическому составу и физическим свойствам. В результате возникает коррозионное разрушение, которое может проникнуть очень глубоко и идти по границам раздела зерен (межкристаллическая коррозия). Например, в перлите феррит более электроотрицателен, чем цементит, он и будет разрушаться в соответствующих условиях. Таким образом, электрохимическая коррозия — это разрушение сплава, сопровождающееся появлением электрического тока в результате работы множества микрогальванических элементов на корродирующей поверхности металла. На скорость растворения металла в электролите влияют примеси, способы обработки металла, концентрация электролитов. Металл, находящийся под нагрузкой, корродирует значительно быстрее ненагруженного, так как нарушается целостность защитной пленки и образуются микротрещины (коррозионное растрескивание). Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью. В зависимости от характера окружающей среды электрохимическая коррозия может быть подводной, атмосферной, почвенной, вызванной блуждающими токами. Электрохимическая коррозия металлов в воде обусловливается присутствием в ней растворенного кислорода. При атмосферной коррозии электролитом служит тонкая пленка влаги, сам же процесс коррозии ничем не отличается от коррозии в воде. В результате коррозии стали на ее поверхности появляется смесь различных гидратированных оксидов железа, имеющих состав «FeO-ph3O+mFe2O3-<?h3O (ржавчина). Активному протеканию процесса коррозии способствует углекислый и в особенности сернистый газы, хлористый водород, различные соли. Защиту от коррозии следует начинать с правильного подбора химического состава и структуры металла. При конструировании необходимо избегать форм, способствующих задержке влаги. Для защиты металла от коррозии применяют различные способы. Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные стали, содержащие в большом количестве хром, который, образуя на поверхности оксидные пленки, приводит сталь в пассивное состояние. Существенно повышается (в 1,5...3 раза) коррозионная стойкость строительных сталей при введении в их состав меди (0,2...0,5 %). Повышенной стойкости нержавеющих сталей против коррозии способствуют также их однородность и небольшое содержание вредных примесей. Защитные покрытия представляют собой пленки (металлические, оксидные, лакокрасочные и т.п.). Металлические покрытия бывают двух типов — анодные и катодные. Для анодного покрытия используют металлы, обладающие более отрицательным электродным потенциалом, чем основной металл (например, цинк, хром). Для катодного покрытия выбирают металлы, имеющие меньшее отрицательное значение электродного потенциала, чем основной металл (медь, олово, свинец, никель и др.). Металлические покрытия наносят горячим методом, гальваническим и металлизацией. При горячем методе покрытия изделия погружают в ванну с расплавленным защитным металлом, температура которого ниже, чем температура плавления изделия (цинк, олово, свинец). Гальванический метод защиты состоит в том, что на поверхности изделия путем электролитического осаждения из растворов солей создается тонкий слой защищаемого металла. Покрываемое изделие при этом служит катодом, а осаждаемый металл — анодом. Металлизация — покрытие поверхности детали расплавленным металлом, распыленным сжатым воздухом. Преимуществом этого метода защиты металла является то, что покрывать расплавом можно уже собранные конструкции. Недостаток заключается в том, что получается шероховатая поверхность. Металлические покрытия можно наносить также посредством диффузии металла покрытия в основной металл— алитирование, силицирование, хромирование (см. с. 316), а также способом плакирования, т.е. наложения на основной металл тонкого слоя защитного металла (биметалл) и зарепления его путем горячей прокатки (например, железо — медный сплав, дюралюминий — чистый алюминий). Оксидирование — защита оксидными пленками. Для этого естественную оксидную пленку, всегда имеющуюся на металле, делают более прочной путем обработки сильным окислителем, например концентрированной азотной кислотой, растворами марганцевой или хромовой кислот и их солей. Частным случаем оксидирования является воронение стали. В этом случае на поверхности также создается оксидная пленка, но более сложными приемами, связанными с многократной термической обработкой при температуре ЗО0...40О°С в присутствии древесного угля. Фосфатирование состоит в получении на изделии поверхностной пленки из нерастворимых солей железа или марганца в результате погружения металла в горячие растворы кислых фосфатов железа или марганца. Лакокрасочные покрытия основаны на механической защите металла пленкой из различных красок и лаков. Ванны, раковины, декоративные изделия для защиты от коррозии покрывают эмалью, т. е. наплавляют на металл при температуре 750...800°С различные комбинации силикатов. При временной защите металлических изделий от коррозии (транспортировании, складировании) используют для покрытия металла невысыхающие масла (технический вазелин, лак этиноль), а также ингибиторы, т. е. вещества, замедляющие протекание реакции (нитрит натрия с углекислым аммонием, с уротропином, ингибитор ную бумагу и др.). |
megalektsii.ru
Коррозия металлов и способы защиты от неё
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
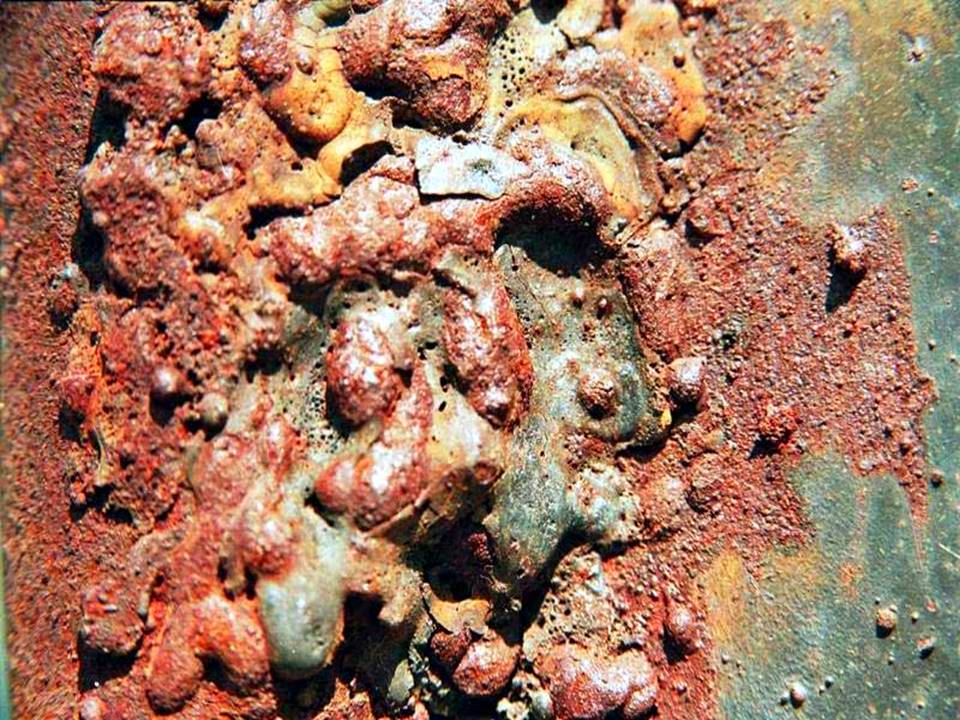
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.

Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования - защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них - закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
blastingservice.ru
|
Поиск Лекций
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь. Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты. Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
Виды коррозии металлов Наиболее часто встречаются следующие виды коррозии металлов: 1. Равномерная – охватывает всю поверхность равномерно 2. Неравномерная 3. Избирательная 4. Местная пятнами – корродируют отдельные участки поверхности 5. Язвенная (или питтинг) 6. Точечная 7. Межкристаллитная – распространяется вдоль границ кристалла металла 8. Растрескивающая 9. Подповерхностная
Основные виды коррозии |
|
poisk-ru.ru
Виды коррозии металлов и способы защиты от нее.
Количество просмотров публикации Виды коррозии металлов и способы защиты от нее. - 477
Из определения процесса коррозии видно, что она бывает электрохимическая и химическая.
Электрохимической коррозией называют процесс разрушения на границе раздела поверхностей контакта двух разнородных металлов в растворах электролитов, в т.ч. и воде. При этом создается гальванический элемент. Однофазные сплавы в данном случае являются более стойкими. Этот тип коррозии характеризуется протеканием электрического тока, переходом атомов в ионизированное состояние (анодный), восстановления окислителя (катодный) и другими электрохимическими процессами (перенос электронов от одного участка поверхности к другому). Их скорость зависит от электродного потенциала, она определяется законами электрохимической кинетики и должна быть выражена в электрических единицах (к примеру, А/м2·ч).
Электрохимическую коррозию вызывают загрязнения и примеси, находящиеся в металле, а также неоднородность его поверхности. Согласно теории электрохимической коррозии, в этих случаях при соприкосновении металла с электролитом, в частности с водой, на его поверхности возникает множество микрогальванических элементов. При этом анодами будут частички металла, а катодами – загрязнения и примеси. Аноды растворяются, на катодах происходит связывание электронов. Совершенно чистые металлы разрушению практически не подвергаются.
На скорость электрохимической коррозии влияют внутренние и внешние факторы. Внутренними причинами являются состав, структура и состояние поверхности металла и напряжения. Повышение чистоты обработки увеличивает коррозионную стойкость. К внешним факторам относятся: температура, давление, скорость движения сред и др.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, при электрохимической коррозии (как в случае разнородных металлов, так и в ходе образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее возбужденному (проводнику), и первый корродирует. Скорость коррозии тем выше, чем дальше расположены друг от друга в ряду напряжений металлы, из которых сформировалась гальваническая пара. На нее также влияет и характер раствора электролита͵ т. е. его кислотность (рН – водородный показатель среды). Чем он ниже (лежит в интервале 0 - 7), тем больше содержание окислителей в растворе и тем скорее протекает коррозия. Значительно быстрее проходит процесс разрушения и с повышением температуры.
При химическомтипе коррозия является следствием чисто химических реакций металла с окружающей средой. При этом процессы окисления и восстановления протекают в одном акте. Скорость данного вида разрушения определяется кинетикой химических реакций.
Химическая коррозия обуславливается взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Наибольший вред приносят разрушения под действием газов. Газовая коррозия наружной поверхности труб и стоек пароперегревателей происходит под воздействием кислорода, двуокиси углерода, водяных паров, сернистого и других газов.
Разновидностью ее является кислородная коррозия, которая заключается во взаимодействии металлов и сплавов с кислородом, т. е. в переходе его в наиболее термодинамически устойчивое состояние за счёт того, что окислитель отнимает у него валентные электроны, переводя в связанное состояние - оксид, образующий на поверхности металла пленку.
От состава, структуры и свойств этих пленок зависит скорость химической коррозии. Защитные свойства данных слоев в значительной степени определяются их плотностью и сплошностью. Условие сплошности: молекулярный объём соединения, возникающего из металла и окислителя Vок, должен быть больше объёма металла VМе, пошедшего на образование молекулы вещества. Хорошие защитные свойства имеют пленки с отношением Vок/VМе = 1,0 - 2,5. Она затрудняет перемещение ионов металла и окислителя друг к другу. По этой причине по мере утолщения пленки рост ее идет с самоторможением. Процесс состоит из нескольких последовательных стадий: адсорбция кислорода, его ионизация, диффузия ионов металла с его восстановлением и кислорода через пленку и реакция образования оксида. С увеличением размеров пленки возникающие внутренние напряжения могут приводить к образованию трещин и их скалыванию, и окисление опять будет происходить с начальных стадий. При высоких температурах скорость окислительного разрушения многих металлов сильно возрастает.
У некоторых металлов образующиеся в процессе химической коррозии слои оксидов являются защитными. Это обусловлено их химической неактивностью (пассивностью). По этой причине дальнейшее соприкосновение его с кислородом сильно замедляет процесс коррозии. Такая пленка всегда имеется на поверхности алюминия, хрома, никеля, титана, вольфрама, молибдена и еще некоторых металлов. Также, к примеру, концентрированные азотная и серная кислоты легко делают железо пассивным, создавая на его поверхности защитную пленку и оно далее не реагирует с этими кислотами, т. е. не разрушается.
Под слоем отложений на внутренней поверхности труб в контакте с котловой водой развивается подшламовая коррозия, имеющая язвенный характер и приводящая к образованию свищей. Язвы заполняются продуктами коррозии и трудно обнаруживаются При рН меньше 7,0 скорость коррозии определяется процессами восстановления ионов водорода, формирующихся при диссоциации котловой воды, на катодных участках и растворения получающегося водорода в металле. Происходит интенсивное разрушение и насыщение металла водородом. Растворенный в стали атомарный водород вызывает снижение прочности и пластичности. При высоких температурах он уменьшает длительную прочность и ускоряет ползучесть. Это явление принято называть водородной хрупкостью (охрупчивание). При рН больше 7,0 образование ионов водорода сильно подавлено. Выделившийся водород становится частью потока пароводяной смеси. Имеет место коррозионное поражение, но отсутствует водородное охрупчивание.
При сжигании топлив с большим содержанием серы поверхности нагрева, стальные короба газоходов и дымовые трубы подвергаются низкотемпературной сернистой коррозии, которая состоит в следующем.
Сгорание мазута и углей, окисление серусодержащих органических соединений происходит с образованием диоксида SO2 по реакции:
2h3S + 3О2 = 2SO2 + 2Н2О
При температуре 400 – 1400 °С небольшая часть SO2 окисляется до триоксида SO3.
Водяные пары и SO3 перемещаются по газовому тракту котла и охлаждаются. При определенной температуре, называемой точкой росы кислотных паров, начинается выпадение серной (h3SO4) кислоты, которая конденсируется и оседает на поверхностях нагрева. При взаимодействии ее с металлом образуются сульфаты железа Fe2(SO4)3 и FeSO4.
Около 80 % металлических конструкций эксплуатируется на открытом воздухе. Сухая атмосферная коррозия происходит по механизму химического окисления и роста пленки. Мокрое атмосферное разрушение является электрохимическим процессом. Скорость его возрастает с ростом относительной влажности. Наиболее агрессивны сильно загрязненные индустриальные и приморские среды, наименее - чистые и сухие континентальные атмосферы.
Почва и грунт содержат различные химические реагенты, в т.ч. и влагу, и обладают ионной проводимостью. Подземная коррозия происходит по электрохимическому процессу. Ее подразделяют на грунтовую и блуждающими токами (электрическую). Грунтовая коррозия зависит от влажности, электропроводности (количества солей), кислотности грунта (рН находится в пределах 3 - 9) и от деятельности микроорганизмов, которые могут ускорить процесс разрушения в 20 раз. Наиболее опасны анаэробные сульфатредуцирующие бактерии. Οʜᴎ восстанавливают содержащиеся в грунте сульфаты по схеме:
MgSO4 + 4Н ® Mg(OH)2 + h3S +О2
Кислород ускоряет ход катодного процесса коррозии.
Электрическая или электрокоррозия вызывается блуждающими токами (токи утечки), исходящими от трамваев, метро, электрических железных дорог и различных электроустановок, работающих на постоянном токе. Οʜᴎ разрушают подземные металлические сооружения, трубопроводы и электрокабели. Различного рода токи утечки, проходя в грунте и встречая металлическую поверхность, проникают в нее и вызывают появление участков входа и выхода тока. Это приводит к образованию на металле катодных и анодных зон. В месте протекания и выхода тока происходит усиленное анодное растворение металла, а в районе входа - катодное подщелачивание грунта.
Блуждающие токи от источников переменного тока вызывают слабую коррозию у подземных изделий из стали и сильную – из цветных металлов и их сплавов.
При большом разнообразии природных вод от чистых деминерализованных источников, речной и морской воды до подземных вод из геотермальных скважин с содержанием солей до 100 г/л и с температурой до 200 – 250 °С коррозия металлов в большинстве случаев протекает по электрохимическому виду с катодным процессом восстановления кислорода.
Также к электрохимическому типу относится стояночная коррозия. Это разрушения металлов в воде, содержащей кислород, протекающее при комнатной температуре после остановки оборудования ТЭЦ.
Характерные особенности стояночной коррозии - образование язв на поверхности металла и накопление большого количества продуктов разрушения.
После останова котла на трубах остаются мокрый шлак и зола, в которых интенсивно протекает коррозия. Снаружи труба покрывается толстым слоем бурого гидрооксида железа – Fe(OH)3.
Эрозия - коррозия поверхностного слоя металла под действием ударяющихся в него твердых частиц, капелек или потока жидкости, а также потока пара.
Это сложный в химическом отношении процесс. В основном он состоит в разрушении оксидной пленки металла.
Коррозия поверхностного слоя металла под влиянием многократных гидроударов принято называть кавитационной эрозией. Кавитация - это процесс образования и быстрого исчезновения пузырьков паров жидкости вследствие локального изменения давления в ее потоке.
При исчезновении пузырька поверхность металла испытывает локальный гидравлический удар. Размещено на реф.рфЭрозия развивается в результате разрушения менее прочных структурных составляющих (к примеру, феррита в перлитных сталях).
referatwork.ru
Способы защиты от коррозии
Коррозия — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер.
Более всего подвержены коррозии чистые металлы. Сплавы, пластики и прочие материалы в этом отношении характеризуются термином «старение». Вместо термина «коррозия» также часто применяют термин «ржавление».
Виды коррозии
Коррозионный процесс портит жизнь людям многие века, поэтому он изучен достаточно широко. Существуют различные классификации коррозии в зависимости от типа окружающей среды, от условия использования коррозирующих материалов (находятся ли они под напряжением, если контактируют с другой средой, то постоянно или переменно и пр.) и от множества других факторов.
Электрохимическая коррозия
Коррозировать могут два различных металла, соединенных между собой, если на их стык попадет, например, конденсат из воздуха. У разных металлов различные окислительно-восстановительные потенциалы и на стыке металлов образуется фактически гальванический элемент. При этом металл с более низким потенциалом начинает растворяться, в данном случае, коррозировать. Это проявляется на сварочных швах, вокруг заклепок и болтов.
Для защиты от такого вида коррозии применяют, например, оцинковку. В паре металл-цинк коррозировать должен цинк, но при коррозии у цинка образуется оксидная пленка, которая сильно замедляет процесс коррозии.
Химическая коррозия
Если поверхность металла соприкасается с коррозионно-активной средой, и при этом нет электрохимических процессов, то имеет место т.н. химическая коррозия. Например, образование окалины при взаимодействии металлов с кислородом при высоких температурах.
Борьба с коррозией
Несмотря на то, что сгнивающие на дне моря корабли с сундуками не так уж и плохи для экологии, коррозия металлов ежегодно приносит огромные убытки людям. Поэтому неудивительно, что уже давно существуют различные методы защиты от коррозии металлов.
Различают три вида защиты от коррозии:
Конструкционный метод включает в себя использование сплавов металлов, резиновых прокладок и др.
Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя. Применяется наложение постоянного электрического поля с помощью источника постоянного тока, напряжение выбирается с целью повышения электродного потенциала защищаемого металла. Другой метод — использование жертвенного анода, более активного материала, который будет разрушаться, предохраняя защищаемое изделие.
Пассивная борьба с коррозией – это применение эмалей, лаков, оцинковки и т.п. Покрытие металлов эмалями и лаками направлено на изоляцию металлов от окружающей среды: воздуха, воды, кислот и пр. Оцинковка (как и другие виды напыления) кроме физической изоляции от внешней среды, даже в случае повреждения ее слоя, не даст развиваться коррозии металла, т.к. цинк коррозирует охотнее железа (см. «электрохимическая коррозия» выше по тексту).
Наносить защитные покрытия на металл можно различными способами. Оцинковку можно проводить в горячем цеху, «на холодную», газотермическим напылением. Окраску эмалями можно проводить распылением, валиком или кистью.
Большое внимание надо уделять подготовке поверхности к нанесению защитного покрытия. От того, насколько качественно будет очищена поверхность металла, во многом зависит успех всего комплекса мер по защите от коррозии.
real-color.ru
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)