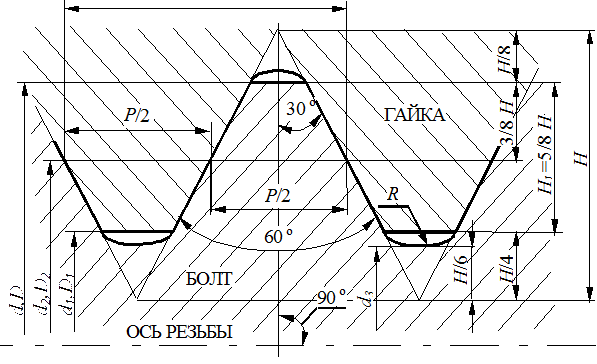
|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Состав, строение и свойство металлов. Строение и свойства металлов
Строение и свойства металлов
ГЛАВА I. СТРОЕНИЕ И СВОЙСТВА МЕТАЛЛОВ
1. КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
Типы кристаллических решеток. Твердые тела делят на кристаллические и аморфные. Кристаллические тела при нагреве остаются твердыми до определенной температуры (температуры плавления), при которой они переходят в жидкое состояние. Аморфные тела при нагреве размягчаются в большом температурном интервале; сначала они становятся вязкими и лишь затем переходят в жидкое состояние.
Все металлы и их сплавы - тела кристаллические. Металлами называют химические элементы, характерными признаками которых являются непрозрачность, блеск, хорошая электро- и теплопроводность, пластичность, а для многих металлов также способность свариваться. Не потеряло своего научного значения определение металлов, данное более 200 лет назад великим русским ученым М. В. Ломоносовым: "Металлы суть светлые тела, которые ковать можно". Для металлов характерно то, что, вступая в химические реакции с элементами, являющимися неметаллами, они отдают последним свои внешние валентные электроны. Это объясняется тем, что у атомов металла внешние электроны непрочно связаны с его ядром. Металлы имеют на наружных оболочках всего 1 -2 электрона, тогда как у неметаллов таких электронов много (5-8).
Чистые химические элементы металлов (например, железо, медь, алюминий и др.) могут образовывать более сложные вещества, в состав которых могут входить несколько элементов-металлов, часто с примесью заметных количеств элементов-неметаллов. Такие вещества называются металлическими сплавами. Простые вещества, образующие сплав, называют компонентами сплава.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка- это воображаемая пространственная сетка, в узлах которой располагаются атомы (ионы), образующие металл. Частицы вещества (ионы, атомы), из которых построен кристалл, расположены в определенном геометрическом порядке, который периодически повторяется в пространстве. В отличие от кристаллов в аморфных телах (стекло, пластмассы) атомы располагаются в пространстве беспорядочно, хаотично.
Формирование кристаллической решетки в металле происходит следующим образом. При переходе металла из жидкого в твердое состояние расстояние между атомами сокращается, а силы взаимодействия между ними возрастают. Характер взаимодействия атомов определяется строением их внешних электронных оболочек. При сближении атомов электроны, находящиеся на внешних оболочках теряют связь со своими атомами вследствие отрыва валентного электрона одного атома положительно заряженным ядром другого и т. д. Происходит образование свободных электронов, так как они не принадлежат отдельным атомам. Таким образом, в твердом состоянии металл представляет собой структуру, состоящую из положительно заряженных ионов, омываемых свободными электронами.
Связь в металле осуществляется электростатическими силами. Между ионами и свободными электронами возникают электростатические силы притяжения, которые стягивают ионы. Такую связь между частицами металла называют металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Ионы находятся на таком расстоянии один от другого, при котором потенциальная энергия взаимодействия минимальна. В металле ионы располагаются в определенном порядке, образуя кристаллическую решетку. Такое расположение ионов обеспечивает взаимодействие их с валентными электронами, которые связывают ионы в кристаллической решетке.
Элементарные ячейки кристаллических решеток:
1 — кубическая объемно-центрированная (а-железо), II— кубическая гранецентрированная (медь), III — гексагональная плотноупакованная; а и с — параметры решеток.
Типы кристаллических решеток у различных металлов различны. Наиболее часто встречаются решетки: объемно-центрированная кубическая (ОЦК) — α-Fе, Сг, W, гранецентрированная кубическая (ГЦК) — γ-Fе, А1, Сu и гексагональная плотноупакованная (ГПУ) - Мg, Zn и др. Наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, называют элементарной кристаллической ячейкой (рис. 1). Кристаллическая решетка характеризуется ее параметрами, например длиной ребра куба для ОЦК и ГЦК, которая составляет для металлов 2,8-6 • 10ˆ(-8) см.
Дефекты в кристаллах. В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки..
а — вакансия, б — внедренный атом, в — краевая линейная дислокация, г — неправильное расположение атомов на границе зерен 1 и 2
Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные. Атомы совершают колебательные движения возле узлов решетки, а с повышением температуры амплитуда этих колебаний увеличивается. Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией значительно большей средней энергии и перемещаются из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находился такой атом, называется вакансией (рис. 2, а). На это место через некоторое время перемещается один из атомов соседнего слоя и т. д. Таким образом вакансия перемещается в глубь кристалла. С повышением температуры количество вакансий увеличивается и они чаще перемещаются из одного узла в другой. В диффузионных процессах, протекающих в металлах, вакансии играют определяющую роль. К точечным дефектам относят также атом, внедренный в междоузлие кристаллической решетки (рис. 2, б), и замешенный атом, когда место атома одного металла замещается в кристаллической решетке другим, чужеродным атомом. Точечные дефекты вызывают местное искажение кристаллической решетки.
Линейные дефекты являются другим важнейшим видом несовершенства кристаллической решетки, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой вдоль какой-либо плоскости число рядов атомов в верхней части решетки на один больше, чем в нижней. В данном случае в верхней части решетки появилась как бы лишняя атомная плоскость (экстра-плоскость). Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой или линейной дислокацией (рис. 2, в), длина которой может достигать многих тысяч межатомных расстояний. Ширина дислокации мала и составляет несколько атомных расстояний.
Кристаллическая решетка в зоне дислокации упруго искажена, поскольку атомы в этой зоне смещены относительно их равновесного состояния. Для дислокации характерна их легкая подвижность. Это объясняется тем, что атомы, образующие дислокацию, стремятся переместиться в равновесное состояние. Дислокации образуются в процессе кристаллизации металлов (см. гл. 1, 2), а также при пластической деформации, термической обработке и других процессах.
Поверхностные дефекты представляют собой границы раздела между отдельными кристаллами (рис. 2, г ).На границе раздела атомы расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов. При этом сами кристаллы разориентированы, т. е. могут быть повернуты относительно друг друга на десятки градусов. Прочность металла может либо увеличиваться в следствии искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.
Анизотропия кристаллов. Неодинаковость физических свойств среды в разных направлениях называют анизотропией. Анизотропия кристаллов обусловлена различием плотности упаковки атомов в решетке в различных направлениях. Все кристаллы анизотропны, аморфные тела (стекло, смола) изотропны, т. е. имеют одинаковую плотность атомов в различных направлениях.
Анизотропия свойств важна при использовании монокристаллов— одиночных кристаллов, частицы которых расположены единообразно по всему их объему. Монокристаллы имеют правильную кристаллическую огранку (в форме естественных многогранников), анизотропны по механическим, электрическим и другим физическим свойствам. Так, для монокристалла меди предел прочности δв изменяется от 120 до 360 МПа в зависимости от направления приложения нагрузки.
Металлы и сплавы, применяемые в технике, обычно имеют поликристаллическую структуру, т. е. состоят из множества мелких и различно ориентированных кристаллов, не имеющих правильной кристаллической огранки и называемых кристаллитами (или зернами). В каждом зерне поликристалла наблюдается анизотропия. Однако вследствии разнообразной, беспорядочной ориентировки кристаллографических плоскостей в различных зернах поликристалл может иметь одинаковые свойства по разным направлениям и не обнаруживать анизотропию (когда размеры зерен значительно меньше размеров поликристалла и количество их весьма велико). Это обстоятельство во многих случаях позволяет рассматривать поликристаллическое тело как подобное изотропному, несмотря на анизотропию свойств отдельных составляющих его зерен.
2. КРИСТАЛЛИЗАЦИЯ
Переход из жидкого состояния в твердое (кристаллическое) называют кристаллизацией. Процессы кристаллизации зависят от температуры и протекают во времени, поэтому кривые охлаждения строятся в координатах температура - время (рис. 3). Теоретический, т.е. идеальный, процесс кристаллизации металла без переохлаждения протекает при температуре Тs (рис. 3). При достижении идеальной температуры затвердевания Тs падение температуры прекращается. Это объясняется тем, что перегруппировка атомов при формировании кристаллической решетки идет с выделением тепла (выделяется скрытая теплота кристаллизации). Каждый чистый металл (не сплав) кристаллизуется при строго индивидуальной постоянной температуре. По окончании затвердевания металла температура его снова понижается.
Практически кристаллизация протекает при более низкой температуре, т.е. при переохлаждении металла до температур Тn, Тn1, Тn2, (например, кривые 1,2). Степень переохлаждения (ΔТ=Тs-Тn) зависит от природы и чистоты металла и скорости охлаждения. Чем чище жидкий металл, тем он более склонен к переохлаждению. При увеличении скорости охлаждения степень переохлаждения возрастает, а зерна металла становятся мельче, что улучшает его качество. Для большинства металлов степень переохлаждения при кристаллизации в производственных условиях составляет от 10 до 30°С. При больших скоростях охлаждения она может достигать сотен градусов.
Кривые кристаллизации металла при охлаждении с разной скоростью
Процесс кристализации состоит из двух стадий: зарождения кристаллов (зародышей или центров кристаллизации) и роста кристаллов из этих центров. При переохлаждении сплава ниже Тп на многих участках жидкого металла (рис. 4, а, б) образуются способные к росту кристаллические зародыши. Сначала образовавшиеся кристаллы растут свободно и имеют более или менее правильную геометрическую форму (рис. 4, в, г, д). Затем при соприкосновении растущих кристалов их правильная форма нарушается, так как в этих участках рост граней прекращается.
Последовательные этапы процесса кристаллизации металла
Рост кристалла продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате кристаллы, имевшие сначала геометрически правильную форму, после затвердевания получают неправильную форму, их называют кристаллитами или зернами (рис. 4, е).
Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем мельче зерно металла.
Величина зерен, образующихся при кристаллизации, зависит не только от количества самопроизвольно зарождающихся центров кристаллизации, но также и от количества нерастворимых примесей, всегда имеющихся в жидком металле. Такие нерастворимые примеси являются готовыми центрами кристаллизации. Ими являются оксиды (например, Аl2O3,), нитриды, сульфиды и другие соединения. Центрами кристаллизации в данном металле или сплаве могут быть только такие твердые частицы, которые соизмеримы с размерами атомов основного металла. Кристаллическая решетка таких твердых частиц должна быть близка по своему строению и параметрам решетке кристаллизующегося металла. Чем больше таких частичек, тем мельче будут зерна закристаллизовавшегося металла.
На образование центров кристаллизации влияет и скорость охлаждения. Чем выше скорость охлаждения, тем больше возникает центров кристаллизации и, следовательно, мельче зерно металла Схема дендритного роста кристалла
Чтобы получить мелкое зерно, создают искусственные центры кристаллизации. Для этого в расплавленный металл .(расплав) вводят специальные вещества, называемые модификаторами. Так, при модифицировании магниевых сплавов зерно уменьшается от 0,2—0,3 до 0,01-0,02 мм, т.е. в 15-20 раз. Модифицирование отливок проводят введением в расплав добавок, которые образуют тугоплавкие соединения (карбиды, оксиды). При модифицировании, например, стали применяют алюминий, титан, ванадий; алюминиевых сплавов — марганец, титан, ванадий.
Иногда в качестве модификаторов применяют поверхностно-активные вещества. Они растворяются в жидком металле. Эти модификаторы осаждаются на поверхности растущих кристаллов, образуя очень тонкий слой. Этот слой препятствует дальнейшему росту кристаллов, придавая металлу мелкозернистое строение.
Строение металлического слитка. Форма растущих кристаллов определяется не только условиями их касания друг с другом, но и составом сплава, наличием примесей и режимом охлаждения. Обычно механизм образования кристаллов носит дендритный (древовидный) характер (рис. 5). Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет в тех плоскостях и направлениях решетки, которые имеют наибольшую плотность у паковки атомов и минимальное расстояние между ними. В этих направлениях образуются длинные ветви будущего кристалла — так называемые оси (1) первого порядка (рис. 5). В дальнейшем от осей первого порядка начинают расти новые оси (2) — оси второго порядка, от осей второго порядка- оси (3) - третьего порядка и т.д. По мере кристаллизации образуются оси более высокого порядка, которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
stud24.ru
Состав, строение и свойство металлов
Тема урока:
«Состав, строение и свойства металлов»
Тип урока: комбинированный.
Урок проводится в 8 классе, в теме «Простые вещества», программа О.С.Габриелян.
Цель: ознакомить учащихся с металлами - простыми веществами,
изучить особенности образования химической связи и кристаллической решетки в металлах.
Задачи: - образовательные: сформировать представления о составе, строении и свойствах простых веществ металлов;ознакомить обучающихся с представителями металлов
- развивающие: углубить знания обучающихся о строении веществ;продолжить формирование умений устанавливать причинно - следственные связи, анализировать знания, формулировать выводы;
- воспитательные - создавать условия для увлеченного учения, воспитать чувство гордости за совместный результат своей деятельности;
- валеологические – привитие учащимся навыков стремления заботиться о своем здоровье
Оборудование и реактивы: коллекция «Металлы», Периодическая система химических элементов Д.И.Менделеева, компьютер, медиапроектор.
Ход урока:
Организационный момент
-Приветствие.
-Подготовка обучающихся к работе.
Итоги контрольной работы по теме: «ПСХЭ Д.И.Менделеева и строение атома». Корреция знаний.
Изучение нового материала.
Мотивация учебной деятельности: сообщение темы, цели занятия и значения данной темы.
Актуализация знаний
Изучив строение атома возьмемся за более сложную задачу: Как образуются из атомов вещества?(Слайд 1)
Центральным вопросом химии является вопрос как образуется химическая связь между атомами?
Что об этом вопросе говорит история химии?
Что такое химическая связь в современной трактовке? (Связь между атомами химических элементов за счет электронов, находящихся на ВЭУ).
Сегодня на уроке объектом нашего исследования будут металлы. (слайд 2)
Какие химические элементы называем металлами?( На ВЭУ от1 до 3 электронов).
Где в ПСХЭ находятся металлы?( Левый нижний угол ПС, I-III группы,главные подгруппы и все побочные подгруппы.( слайд3)
Объяснение новой темы.
88 элементов образуют вещества металлов. Возьмите карточки ХЭ и выберите металлы (Сколько их? (10) Назовите их).
Для изученмя будем руководствоваться логической схемой:
Состав – строение – свойства.
Состав: определяется химической формулой (слайд 4)
Формулы простых веществ металлов совпадают с символом их химических элементов.
Строение: (слайд 5)
Механизм образования связи следующий:
Чтобы завершить ВЭУ металлы отдают электроны:
Ме – пē = Ме п+ пē - число електронов на ВЭУ
атом металла ион металла
Оторвавшиеся электроны перемещаются по всему куску металла: от одного иона к другому, связывая их в единое целое. Процесс отрыва и присоединения электронов бесконечен.
(слайд7) Определение хим.связи в металлах: «Связь между ионами металлов и обобществленными электронами называется металлической».
(Слайд 6) Ориентация частиц осуществляющих металическую связь в пространстве (в куске металла)- кристаллическая решетка. В узлах этой решетки находятся атомы, ионы и обобществленныек электроны. КР называется тоже – металлическая.
Задание: Найдите среди карточек ХЭ Натрий.
Ставим в карточке пункт №5. Формула простого вещества натрия - Na;
ХС - металлическая, схема образования связи: Na - 1ē = Na+
КР - металлическая: рисуем фрагмент КР (на доске).
Как вы думаете, какие силы взаимодействия в КР металлов? (Электрические)
Записываем в тетрадь: Силы взаимодействия в КР металлов – электрические, отрицательно заряженные электроны притягиваются к положительно заряженным ионам металлов.
Состав и строение определяют физические свойства металлов (слайд 8).
Натрий режется ножом, а хром самый твердый – царапает стекло.
Рекордсмены: Ag, Cu, Fe, Al, Hg, Pb. В этом ряду токсичность веществ увеличивается. Сообщения учащихся о ртути, свинце.
Имеют блеск, особенно: ртуть, серебро, свинец (слайд 11).
В порошке все металлы – серые, кроме алюминия и магния. Блестят потому, что свободные электроны отражают свет.
можно ковать (изменять форму при ударе)
протягивать в проволоку
прокатывать в листы
Рекордсмены: золото, серебро и медь.
Олово бывает белое (ß) и серое (α). Белое олово может существовать до температуры 13,2оС. Белое олово при низких температурах переходит в серое олово – рассыпается в порошок. «Оловянная чума».
Гибель экспедиции Р. Скотта к Южному полюсу.
В 1910 году английский полярный исследователь капитан Роберт Скотт снарядил экспедицию, целью которой было добраться до Южного полюса, где в то время еще не ступала нога человека. Много трудных месяцев продвигались отважные путешественники по снежным пустыням антарктического материка, оставляя на своем пути небольшие склады с продуктами и керосином ― запасы на обратную дорогу. В начале 1912 года экспедиция, наконец, достигла Южного полюса, но к своему великому разочарованию Скотт обнаружил там записку: выяснилось, что на месяц раньше здесь побывал норвежский путешественник Руаль Амундсен. Но главная беда поджидала Скотта на обратном пути. На первом же складе не оказалось керосина: жестянки, в которых он хранился, стояли пустые. Уставшие, продрогшие и голодные люди не могли согреться, им не на чем было приготовить пищу. С трудом добрались они до следующего склада, но и там их встретили пустые банки: весь керосин вытек. Будучи не в силах сопротивляться полярной стуже и страшным буранам, разразившимся в это время в Антарктиде, Роберт Скотт и его друзья вскоре погибли.
В чем же крылась причина таинственного исчезновения керосина? Почему тщательно продуманная экспедиция окончилась так трагически? Какую ошибку допустил капитан Скотт? Причина оказалась простой. Жестяные банки с керосином были запаяны оловом. Должно быть, путешественники не знали, что на морозе олово «заболевает»: блестящий белый металл сначала превращается в тускло-серый, а затем рассыпается в порошок. Это явление, называемое «оловянной чумой», и сыграло роковую роль в судьбе экспедиции. А ведь подверженность олова «заболеванию» на холоде была известна задолго до описанных событий. Еще в средние века обладатели оловянной посуды замечали, что на морозе она покрывается «язвами», которые постепенно разрастаются, и в конце концов посуда превращается в порошок. Причем стоило «простудившейся» оловянной тарелке прикоснуться к «здоровой», как та вскоре тоже начинала покрываться серыми пятнами и рассыпалась.
Вывод: все физические свойства металлов обеспечивают свободные (обобществлённые) электроны.
Физкультминутка (слайд 14).
1. Качания головой (упражнение стимулирует мыслительные процессы): дышите глубоко, расслабьте плечи и уроните голову вперёд.
Позвольте голове медленно качаться из стороны в сторону, пока при помощи дыхания уходит напряжение (глаза закрыты) .
Подбородок вычерчивает слегка изогнутую линию на груди по мере расслабления шеи. Выполнять 30 секунд.
2. “Шапка для размышлений” (улучшает внимание, ясность восприятия и речь): “наденьте шапку”, то есть мягко заверните уши от верхней точки до мочки три раза.
3. Зоркие глазки” (упражнение служит для профилактики нарушений зрения): глазами нарисуйте 6 кругов по часовой стрелке и 6 кругов против часовой стрелки.
4. “Стрельба глазами” (упражнение служит для профилактики нарушения зрения): двигайте глазками вправо-влево, вверх-вниз по 6 раз.
Лабораторная работа (слайд 15). Работа в парах, оформление в рабочих тетрадях.
Оборудование на столах: коллекция металлов и таблица характеристик физических параметров металлов.
Задание:
ознакомьтесь с выданными вам металлами (алюминий, железо, медь).
запишите знаки выданных вам металлов
расположите их в порядке возрастания:
плотности
твёрдости
металлического блеска (визуально)
теплопроводности
Ответы (слайд 16).
Закрепление знаний:
тест «Самый-самый-самый!».
Жидкий металл при комнатной температуре:
а) железо б) ртуть в) золото г) литий
Самый пластичный из драгоценных металлов:
а) серебро б) платина в) золото г) рутений
Наиболее мягкий металл:
а) натрий б) железо в) алюминий г) медь
Наиболее твёрдый металл:
а) хром б) натрий в) алюминий г) медь
Лучше всех отражает свет:
а) свинец б) серебро в) ртуть г) железо
Обладает лучшей электропроводностью:
а) медь б) алюминий в) серебро г) железо
Наиболее тугоплавки (температура плавления):
а) алюминий б) железо в) медь г) свинец
Учитель: «поменяйтесь друг с другом листочками с выполненными заданиями и проверьте своего соседа. Поставьте друг другу оценки и сдаем тесты».
(Слайд 17 – ответы на тест).
Домашнее задание (слайд 18).
Подведение итогов урока.
infourok.ru
Строение и свойства металлов — Мегаобучалка
Сведения о твердых телах, описанные еще Платоном, незначительно изменились к XVII в. Представления о геометрическом строении кристаллов, завершенные в XX в. Е.С.Федоровым и А. Шенфлисом, не касались физических свойств твердых тел. Открытие электрона (1897), дифракции рентгеновских лучей в кристаллах (1912) и строения атома (1913) положили начало микроскопическим теориям в области физики твердого тела.
Внутренняя энергия твердого тела состоит из кинетической энергии колебаний и энергии связи; подведенная к телу энергия расходуется примерно поровну на эти две части. В твердых телах атомы и молекулы почти неподвижны, они закреплены электромагнитными взаимодействиями с соседними частицами и не могут свободно перемещаться. При уменьшении расстояния между соседними частицами атомы начинают отталкиваться, при увеличении — притягиваться, т. е. каждый атом находится в потенциальной яме и способен колебаться вокруг точки равновесия. Эти скудные возможности перемещений атомов отражены в тепловых свойствах твердых тел. При поступлении теплоты энергия распределится между всеми атомами, вынуждая ионы в узлах кристаллической решетки колебаться с большей амплитудой. Но из-за жесткости связей колебания (их сопоставляют с фононами) будут передаваться, Обусловив распространение энергии. Следовательно, эти колебания ионов не индивидуальны, для них характерна коллективная динамика.
Обратимся к экспериментально определенным значениям удельной теплоемкости твердых тел (табл. 7.1). Все они содержат множитель 1,0 • 10-23 Дж на ГС на молекулу, т.е. в 2 раза больший, чем для идеальных газов. Сообщаемая атому твердого тела энергия 1,0- 10-23 Дж поровну расходуется на увеличение потенциальной и колебательной энергий связанного атома. Если все атомы получат равную энергию колебаний, то температура твердого тела возрастет на 1 °С, т.е. предложенная выше модель качественно объясняет особенности теплоемкости твердых тел.
Изобразим потенциальную яму, в которой находится атом внутри твердого тела. При усилении колебаний атомы начинают смещаться, колебания происходят уже около нового положения равновесия и среднее расстояние между атомами возрастает. Этим объясняется расширение тел при нагревании. Но расширение нельзя объяснить только увеличением амплитуды, должны измениться сами равновесные состояния, поэтому и потенциальная яма должна быть асимметричной (рис. 7.6). Химическая энергия связи, приходящаяся на один атом, составляет 1,6 • 10-19 Дж. Средняя энергия теплового движения при комнатной температуре равна примерно 1/26 этой величины. Это значит, что атомы в твердом теле находятся в глубокой потенциальной яме, и их колебания не позволяют им подняться высоко по ее стенкам. Связь между кинетической энергией колебаний атомов и температурой примерно такая же, как и в газах.
Обычно хорошие проводники электричества являются и хорошими проводниками теплоты. В металлах один или несколько электронов могут свободно перемещаться по телу проводника, образуя электронный газ. В изоляторах электроны «прикреплены» к своему атому. Электроны проводимости более подвижны, чем закрепленные атомы, и они быстрее переносят теплоту по образцу проводника. Если даже от каждого атома в металле высвободится всего по одному электрону, то концентрация свободных электронов будет равна числу атомов — в 1 м3 металла окажется 1028—1029 свободных электронов. Тот факт, что носителями тока являются именно электроны, был доказан экспериментально в 1938 г. И. К. Кикоиным и С. В. Грабарем. В соответствии со способностью проводить ток все вещества подразделяются на проводники, полупроводники и изоляторы (диэлектрики). В ионных и кова-лентных кристаллах внешние электроны практически связаны, поэтому их проводимость очень мала и они называются изоляторами.
На основе представлений о носителях тока в металлах — электронах — немецким ученым П.Друде разработана классическая теория металлов (1900). Впоследствии эту теорию усовершенствовал голландский ученый Г. А. Лоренц. Электроны проводимости ведут себя как атомы идеального газа, но в отличие от них сталкиваются не между собой, а с ионами, образующими кристаллическую решетку. Столкновения устанавливают равновесие между двумя подсистемами — решеткой и электронным газом. По кинетической теории средняя скорость теплового движения электронов равна 105 м/с. Наложение электрического поля на
хаотическое движение электронов придает им упорядоченное движение, но его скорость меньше скорости теплового движения.
Сопротивление металлов объясняли соударениями электронов с ионами, и плотность тока прямо пропорциональна напряженности поля (закон Ома) с коэффициентом (проводимость): (здесь — плотность электронов, — заряд электрона, - его масса, — скорость теплового движения, — длина свободного пробега). К концу свободного пробега электрон приобретает дополнительную кинетическую энергию, которую теряет при столкновении с ионом. Эта энергия, переходя во внутреннюю, приводит к повышению температуры. Количество этой энергии пропорционально квадрату напряженности поля (закон Джоуля—Ленца). Но с ростом температуры сопротивление металлов росло быстрее, чем предсказывала эта теория. Кроме того, теория дает большее значение теплоемкости металлов по сравнению с опытным. В 1819 г. французские ученые П.Дюлонг и А.Пти установили, что теплоемкость почти всех твердых тел не зависит от температуры и равна 25,2 Дж/моль. Этот закон многократно подтверждался опытами при разных температурах. По классической теории 1 грамм-моль вещества, содержащий N частиц, должен обладать энергией 3RT или теплоемкостью 25,2 Дж/моль. Отклонение от теории при более точных измерениях наблюдали многие ученые. В конце XIX в. проверили закон Дюлонга и Пти при низких температурах, и оказалось, что теплоемкости металлов при очень низких температурах стремятся к абсолютному нулю.
Квантовая теория металлов сняла эти и другие несоответствия классической теории. В 1906 г. Эйнштейн объяснил малую теплоемкость твердых тел при низких температурах. Он предположил, что все атомы колеблются с одинаковой частотой, квантованной в соответствии с гипотезой Планка. П. Дебай и М. Борн уточнили: теплоемкость твердых тел при низких температурах стала меняться пропорционально кубу температур, что привело закон в согласие с опытом вплоть до самых низких температур. Грюнайзен вывел новое уравнение состояния твердых тел и получил из него зависимость между линейным коэффициентом расширения твердого тела и его сжимаемостью. В 1924 г. Я.И.Френкель показал, что классическая концепция газа электронов, приписывающая им среднюю кинетическую энергию 3/2кТ, ошибочна. Внешние электроны обладают коллективными свойствами, и их кинетическая энергия должна быть в 200 раз больше тепловой. Затем были учтены разработанная для электронов статистика Ферми—Дирака, волновая природа электронов, и движение их в решетке металла стали рассматривать как рассеяние электронных волн. «Валентные электроны» в металле приобрели черты очень сжатого газа, который подчиняется уже не статистике Максвелла, а статистике Ферми—Дирака.
Итак, энергетическое состояние любого электрона определяется четырьмя квантовыми числами. Невозбужденное состояние соответствует минимуму свободной энергии. В индивидуальном атоме электроны на орбитах удерживаются ядром и занимают определенные энергетические уровни, причем по квантовой теории электрон не может иметь энергию, лежащую между уровнями. В твердом теле все сложнее. Близкие расстояния атомов в твердом теле приводят к взаимодействию, и электроны будут иметь несколько отличные значения энергии в силу принципа Паули. Если кристалл содержит 1020 атомов, получится такое огромное количество индивидуальных уровней, что они образуют почти непрерывную зону (зону разрешенных энергетических уровней). Учет влияния решетки (атомного остова) на электроны в кристаллических твердых телах показывает, что в кристалле можно выделить определенные энергетические области, для которых уравнение Шредингера не имеет решений. Этими запрещенными полосами (или зонами) в распределении энергии по квантовым состояниям отделены друг от друга «разрешенные» энергетические зоны (рис. 7.7, я, б). Характер зон определяет электронные свойства твердого тела, позволяя классифицировать их на проводники и непроводники. Такое описание во многом упрощено, но удобно. Разрешенную зону, возникшую из того уровня, на котором находились валентные электроны в основном состоянии атома, называют валентной зоной. При Т = О К валентные электроны заполняют попарно нижние уровни валентной зоны, а более высокие раз-
решенные зоны останутся свободными от них. Каждый энергетический уровень при сближении атомов расщепляется, образуя целую зону плотно расположенных уровней. Эти зоны разрешенных уровней разделены промежутками — зонами запрещенных уровней. Ширина зон не зависит от размеров кристалла. Но чем плотнее атомы расположены, тем теснее располагаются уровни в зоне. Валентные электроны заполняют нижние энергетические уровни разрешенной зоны, а более высокие уровни этой зоны остаются свободными. В зависимости от степени заполнения зоны возможны различные ситуации. Они и лежат в основе разделения твердых тел на проводники, полупроводники и диэлектрики.
В зависимости от степени заполнения валентной зоны и ширины запрещенной зоны и возможны три случая, показанные на рис. 7.8. Когда электроны заполняют валентную зону не полностью (рис. 7.8, а), достаточно сообщить находящимся на верхних уровнях электронам небольшую энергию (порядка 1,6-10-42 Дж) для перевода их на более высокий уровень. Для сравнения: энергия теплового движения при температуре 1 К составляет 1,6 • 10-23 Дж. Дополнительная энергия, вызванная действием электрического поля, также способна перевести электроны на более высокие уровни. Электроны будут ускоряться полем и приобретать дополнительную скорость в направлении против поля. Кристалл с такой схемой уровней — металл, и валентная зона называется зоной проводимости. Кусок металла можно представить совокупностью ядер, между которыми находятся электроны, играющие роль «клея». Некоторые из них мигрируют по пространству между ионами металла, но большая часть не может оторваться от своих ядер. Мигрирующие электроны называют морем Ферми, или просто морем электронов, поэтому металл являет собой как бы погруженный в море Ферми каркас из ионов. Именно свобода перемещения электронов
обусловливает электро- и теплопроводность металлов. Такое свойство железа, как ковкость, связано с возможностью групп ионов сдвигаться относительно друг друга в электронном море. Когда уровни валентной зоны полностью заняты электронами — зона заполнена (рис. 7.8, б, в). Для увеличения энергии электронов нужно сообщить им энергию, достаточную для преодоления запрещенной зоны. Поэтому электрические свойства кристалла определяются шириной запрещенной зоны. Если она невелика, то тепловая энергия способна перевести часть электронов в верхнюю свободную зону, и для них эта зона станет зоной проводимости. Одновременно станет возможным переход электронов валентной зоны на свободные верхние уровни. Такое вещество является полупроводником.
Полупроводники стали активно входить в технику с 20-х гг. XX в. Появились выпрямители и фотоэлементы, но теории не было. Разработанная в конце 30-х гг. в Ленинградском физико-техническом институте теория дала физическую основу, на которой во всем мире быстро стала развиваться полупроводниковая технология. Установили, что примеси могут менять и электропроводность, и ее знак. Собственная проводимость возникает в результате переходов электронов с верхних уровней валентной зоны в зону проводимости. Освобождаемое место назвали дыркой. Так идут два процесса: появление попарно свободных электронов и дырок и рекомбинация, которая приводит к попарному исчезновению электронов и дырок. В отсутствие поля они движутся хаотически, а при включении — происходит перенос заряда в кристалле, который накладывается на хаотическое движение. Каждой температуре соответствует определенная концентрация электронов и дырок. Примесная проводимость полупроводников возникает, если некоторые атомы в узлах решетки заменить на другие, валентность которых отличается на единицу. Так, при введении в кристалл германия пятивалентного фосфора пятый электрон оказывается как бы лишним и может легко отщепиться от атома за счет теплового движения. Атомы примесей, которые поставляет электрон проводимости, называют донорами. Если же введен элемент с меньшей валентностью, он может поставить только дырку, и называют его акцептором.
Кристалл кремния или германия можно изготовить так, чтобы одна его половина была полупроводником акцепторного р-типа, когда ток переносится положительно заряженными дырками, а другая — донорного n-типа, когда ток переносят отрицательно заряженные электроны. Между этими половинами будет тонкая прослойка, которую называют «р — n-переходом». Такой кристалл обладает уникальным свойством — проводит ток только в одном направлении, т. е. действует как выпрямляющий элемент. Полупроводники типа п —р — п применяют в транзисторах.
Изоляторы (диэлектрики) имеют большую ширину запрещенной зоны, и тепловой энергии уже не достаточно для перевода через нее электронов.
Сегнетоэлектрики — особая группа кристаллических диэлектриков, которая способна к самопроизвольной поляризации при отсутствии внешнего электрического поля. У пластинки кварца, вырезанной перпендикулярно его кристаллографической оси, например, при сжатии вдоль оси на гранях появляются связанные заряды. Название связано с сегне-товой солью, у которой это свойство было обнаружено. В этих кристаллах нет центра симметрии. Для каждого сегнетоэлектрика существует область, когда эти особые свойства проявляются. Так, для сегнетовой соли — это диапазон температур от -15 до +22,5 ˚С (точка Кюри). Поляризация в них возникает при механической нагрузке в степени, пропорциональной степени упругой деформации. В этом состоит пьезоэлектрический эффект. Кристаллическая решетка может быть представлена в виде нескольких простых решеток, вставленных одна в другую. Если у кристалла нет центра симметрии, при деформации происходит относительное перемещение простых решеток и возникает поляризация.
Сейчас в связи с широкой распространенностью в природе и практическим применением особый интерес вызывают конденсированные среды, для которых характерно неупорядоченное расположение атомов: стекло, сталь, сплавы. Среди твердых сред — это аморфные металлические сплавы с неупорядоченным расположением атомов в пространстве. Оказалось, что свобода расположения атомов в пространстве изменяет электрические, магнитные, сверхпроводящие свойства этих тел. Такие сплавы используют для изготовления магнитных головок и высокочувствительных датчиков, сенсорных устройств и малогабаритных трансформаторов.
megaobuchalka.ru
СТРОЕНИЕ МЕТАЛЛОВ И СПЛАВОВ
РЕДКИЕ МЕТАЛЛЫ
Еталлы, как и все окружающие нас тела, состоят из отдельных невидимых даже в самый сильный микроскоп частиц, называемых атомами. Но атомы в свою очередь построены из ещё более мелких частиц: протонов, электронов и нейтронов. Протоны и электроны имеют электрические заряды: протон — положительный заряд, а электрон — отрицательный, нейтрон же не имеет никакого электрического заряда.
Если два протона «находятся близко, они отталкиваются друг от друга, так как они заряжены одноимённым электричеством. Так же ведут себя и два электрона. Напротив, протон и электрон притягиваются друг к другу, причём силы взаимного притяжения протона и электрона равны между собой, т. е. протон обладает элементарным электрическим зарядом, равным заряду электрона.
Атом в нормальном состоянии, т. е. когда он содержит одинаковое количество протонов и электронов, не обладает электрическим зарядом. Но бывают такие состояния атома, когда он приобретает или теряет электроны. Тогда атом становится электрически заряженным. При избытке электронов атом заряжен отрицательным электричеством, а при нехватке электронов он заряжен положительным электричеством. Вот такие атомы, в которых имеется избыток или недостаток электронов, называются ионами.
Как же располагаются элементарные частицы в атоме?
В настоящее время считают, что атом построен следующим образом. Протоны и нейтроны составляют ядро, находящееся в центре атома. Вокруг ядра обращаются электроны, которые образуют электронную оболочку атома. В каждом атоме количество электронов равно количеству протонов.
Электроны в электронной оболочке расположены слоями. В каждом слое может поместиться лишь опреде* лённое количество электронов. Первый слой, окружающий непосредственно ядро, может вместить лишь два электрона, второй слой — 8, третий — от 8 до 18 электронов. Каждый новый слой электронов при переходе от одного атома к другому образуется обычно после заполнения близлежащего к ядру внутреннего слоя.
Например, ядро атома натрия, как установлено, имеет 11 протонов, а его 11 электронов распределены в трёх оболочках: в первой — 2, во второй — 8 и в третьей —
1 электрон. Ядро атома рубидия содержит 37 протонов и окружено 37 электронами, котс^рые расположены в пяти оболочках: в первой — 2, во второй — 8, в третьей—18, в четвёртой — 8, в пятой — 1 электрон. Ещё более сложное строение имеет атом урана. Его ядро содержит 92 протона, а в электронной оболочке имеется 92 электрона.
Протон и нейтрон почти одинаковы по весу, а электрон почти в 1840 раз легче протона. Значит, основная масса атома содержится в его ядре. Чем большее количество нейтронов и протонов содержится в ядре, тем больший вес имеет атом.
Вес атома, например, в граммах выражать очень неудобно: потребовалось бы писать десятки нулей после запятой. Поэтому ввели понятие об относительном весе атомов, об атомном весе. Вначале за единицу был принят атомный вес водорода; с ним сравнивали атомные веса всех других элементов.
Стройную систему химических элементов создал великий русский химик Д. И. Менделеев в 1869 году, на основе открытого им периодического закона.
Сущность закона Менделеева состоит в том, что все химические элементы, расположенные один за другим в порядке возрастания атомных весов, образуют ряд, в котором химические свойства элементов через определённое количество элементов периодически повторяются.
Д. И. Менделеев расположил химические элементы в своей таблице так, что элементы, помещённые в одних и тех же вертикальных столбцах, обладают сходными химическими свойствами. Зная место элемента в таблице, можно определить большинство химических свойств элемента и его соединений. Каждый химический элемент в таблице Менделеева имеет порядковый номер. Его теперь называют числом Менделеева. Этот номер указывает число протонов в ядре. В одни и те же вертикальные столбцы таблицы попадают атомы с одинаковым числом электронов во внешней оболочке.
В зависимости от числа электронов во внешней оболочке меняются химические и физические свойства элемента.
Атомы одного и того же элемента, отличающиеся друг от друга лишь числом нейтронов в ядре, называются изотопами. «Изотоп» — греческое слово. Оно обозначает «занимающий одно и то же место». Изотопы каждого элемента располагаются в одной и той же клетке таблицы Менделеева, поскольку заряд ядра (количество прогонов) у изотопов одного и того же элемента одинаков. Металлы в отличие от жидких и газообразных тел в обычных условиях являются кристаллическими телами. Кристалл — это правильная фигура, ограниченная плоскими поверхностями.
Внутреннее строение кристаллов в настоящее время изучено довольно хорошо с помощью рентгеновских лучей. Освещая ими кристаллы, получают рентгенограмму, т. е. картину на фотопластинке, по которой определяют расположение атомов в кристаллической решётке и расстояния между ними. Рентгенограммы показали, что ионы металлов «укладываются» в кристалле примерно так же, как располагаются в ящике твёрдые шары.
Атомы разных металлов образуют неодинаковые кристаллические решётки. Чаще всего встречаются три типа решёток.
Первый тип — кубическая объёмноцентрированная решётка (рис. 1). Атомы металла в такой решётке находятся в вершинах и центре куба. Каждый атом окружён
| Рис. 1. Кубическая объёмноцентрированная кристаллическая решётка Металла. |
Восемью атомами. Такую решётку имеют металлы ванадий, вольфрам, молибден, литий, хром и другие.
Второй тип решётки — кубическая гранецентрирован - иая (рис. 2). Атомы металла в ней расположены по вершинам граней куба. Такой решёткой обладают, например, алюминий, свинец, золото, серебро, никель, торий.
Третий тип — гексагональная (шестиугольная) плотно упакованная решётка (рис. 3). Она встречается у цинка, магния, кадмия, бериллия.
На рис. 1—3 атомы условно изображены в виде шариков. В зависимости от типа решётки атомы занимают в ней больше или меньше места. Например, в кубической объёмноцентрированной решётке атомы занимают 68% пространства, а в кубической гранецентрированной—74%.
Расположение атомов в кристаллической решётке оказывает большое влияние на свойства металла.
У некоторых металлов кристаллическая решётка может перестраиваться из одного типа в другой. Например, чистое железо при температурах ниже 910° имеет кубическуюобъёмноцентрированную решётку, а выше 910° решётка становится гранецентрированной. Свойством изменять кристаллическую решётку обладают и такие металлы, как олово, уран, титан, таллий, цирконий, лантан, церий.
| Рис. 2. Кубическая гранецентрированная решётка металла. |
Свойство веществ образовывать решётки разной формы называют аллотропией; в переводе с греческого
| Рис. 3. Гексагональная (шестиугольная) плотно упакованная решётка. |
Языка это слово означает «другой поворот», «другое свойство». Общеизвестна аллотропия у кристаллического углерода. Он может находиться в виде графита и в виде алмаза. Графит и алмаз построены из атомов углерода; отличие их только в строении кристаллической решётки. А какая огромная разница в свойствах! Графит — мягкий,
Непрозрачный минерал чёрного цвега, алмаз, напротив, прозрачен, бесцветен и твёрд.
Атомы в кристаллической решётке металлов расположены столь близко друг к другу, что их внешние электроны имеют возможность двигаться не только вокруг одного атома, а вокруг многих атомов. Следовательно, внешние электроны, распределяющиеся в металле равномерно, свободно перемещаются по всему куску металла, образуя своеобразный электронный газ.
Таким образом, любой металл представляет собой решётку из правильно расположенных положительных ионов, заполненную электронным газом. Высокая прочность металлов и объясняется наличием электронного газа, который обволакивает все ионы, превращая металлический кристалл как бы в одно целое.
Ионы, находящиеся в определённых местах (узлах) кристаллической решётки, могут совершать, однако, движение — колебание. В ненагретом металле колебания ионов замедлены, в нагретом — ионы испытывают сильное колебание. Чем выше температура, тем сильнее раскачиваются ионы. Наконец, наступает момент, когда силы взаимодействия уже не могут удержать ионы в узлах кристаллической решетки и она разрушается; металл из твёрдого состояния переходит в жидкое. Это и есть температура плавления.
Если два расплавленных металла тщательно перемешать, то после затвердевания получится сплав этих металлов. Сплавы получаются и при сплавлении металла с неметаллом, например железа с углеродом, алюминия с кремнием и т. д. Свойства полученного сплава зависят не только от того, какие элементы входят в сплав, но и от внутреннего строения, или, как говорят, структуры сплава. Сплав является тоже кристаллическим телом.
Строение сплавов может быть различно. Составные части сплава могут образовать либо механическую смесь, либо твёрдый раствор, либо химическое соединение. Но есть сплавы, в которых имеются одновременно и механические смеси, и твёрдые растворы, и химические соединения.
Механическая смесь получается в том случае, когда составные части не взаимодействуют химически, а находятся в сплаве в виде самостоятельных мелких кристал
Ликов. Их можно наблюдать при рассматривании отполированной поверхности в микроскоп. Механические смеси образуются, например, при сплавлении свинца с сурьмой, висмута с кадмием и др.
Каждый знает раствор сахара или поваренной соли в иоде. Растворяя сахар или поваренную соль в воде, можно получить однородное вещество — жидкий раствор. В стакане воды можно растворить различное количество сахара
Или поваренной соли. Поэтому такие растворы являются однородными веществами переменного состава.
| Чр—ф—^—ф - 0) Атом тда Т Атом ткеля Рис. 4. Кристаллическая решётка твёрдого раствора замещения. |
Оказывается, что подобные однородные системы переменного состава образуются и в твёрдых телах. Их называют твёрдыми растворами. В них атомы растворённого вещества и растворителя «рассеяны», перемешаны между собой. В кристаллической решётке вещества, являющегося растворителем, некоторые его атомы замещаются атомами растворённого вещества (рис. 4). Такие растворы называются твёрдыми растворами замещения. Их образуют при сплавлении, например, металлы медь и никель, железо и хром, золото и медь, серебро и золото, медь и платина и др.
Замещение одних атомов другими в кристаллической решётке происходит в том случае, если атомы растворяемого металла близки по своим размерам атомам раство* рителя. Если разница в размерах атомов превышает 15%, твёрдый раствор замещения образоваться не может.
При очень большой разнице в размерах атомов образуются твёрдые растворы внедрения. Они чаще всего получаются тогда, когда металл растворяет в себе неметаллические элементы, атомы которых значительно меньше атомов металла. Самым распространённым сплавом, построенным по типу твёрдых растворов внедрения, является сплав железа с углеродом; этот сплав называется сталью. При образовании твёрдого раствора внедрения атомы внедряющегося элемента располагаютсяв промежутках кристаллической решётки между атомами растворителя. Кристаллическая решётка твёрдого раствора внедрения показана на рис. 5.
А много ли можно растворить одного металла в другом? Неограниченная растворимость присуща далеко не всем металлам. В меди, например, может раствориться сколько угодно никеля, точно так же и в никеле можно растворить любое количество меди. Растворителем считают тот металл, которого больше в сплаве по весу.
| О йтом дзота Рис. 5. Кристаллическая решётка твёрдого раствора внедрения. |
Многие металлы обладают ограниченной растворимостью. Например, в алюминии можно растворить не более 5,5% меди по весу. При большем количестве медь находится в сплаве в виде отдельных нераст - ворённых частиц. Чем выше температура твёрдого раствора, тем больше меди можно растворить в алюминии (но не более 5,5%).При охлаждении этого сплава медь выделяется в виде мельчайших, очень твёрдых и хрупких частиц.
Какова природа этих частиц? Оказывается — это не чистая медь, а её х и м и ч е - ское соединение с алюминием. Избыток меди в сплаве взаимодействует с алюминием химически. Кристаллики любого химического соединения в сплаве имеют вполне определённый состав. Так, например, при образовании химических соединений: железа с углеродом, называемого карбидом железа, три атома железа химически связаны с одним атомом углерода; алюминия с медью—два атома алюминия соединены с одним атомом меди. Для образования карбидов вольфрама или ванадия нужно, чтобы соотношение атомов этих металлов и атомов углерода было равно 1 : 1, а в карбиде хрома 23 атома хрома взаимодействуют с шестью атомами углерода.
Кристаллические решётки химических соединений очень сложны. При сильном разогревании сплава кристаллы химических соединений могут растворяться в твёр-
Дом растворе сплава, а при снижении температуры нагревания образовываться вновь.
Сплавы, применяемые в технике, имеют сложный химический состав. Высокопрочные стали, например, имеют в своем составе до десятка различных химических элементов. Чем сложнее состав и строение сплава, тем разнообразнее его свойства.
Редкие металлы, вводимые в состав сталей и сплавов, улучшают их качество, коренным образом изменяют первоначальные свойства сплавов, так как они часто образуют кристаллы химических соединений, упрочняющих твёрдый раствор.
Металлурги пользуются редкими металлами для того, чтобы выплавленные стали и сплавы были более прочны, более твёрды, обладали нужной пластичностью, упругостью, жароупорностью, химической' стойкостью и т. д. О том, какие это свойства и как они изменяются при добавке редких металлов, будет рассказано ниже.
С Реди редких металлов имеются такие, которые обладают особым физическим свойством — радиоактивностью. К ним относится радий, торий, уран. Изучение их началось с конца XIX века. В 1898 году молодой …
М Ного лет назад, исследуя золу, получающуюся при сжигании каменного угля, химики обнаружили в её составе 46 химических элементов. В их числе было немало редких и рассеянных элементов. Исследование морских …
В прежние времена, когда наука и техника были на низком уровне развития, природа для человека была единственным источником, откуда он брал в готовом виде всё, что ему нужно было для …
msd.com.ua
Тема №1. Строение и свойства металлов. — МегаЛекции
Лекции по дисциплине
«Электротехническое и конструкционное материаловедение»
Тема №1. Строение материалов.
Основными элементарными частицами, из которых строятся все вещества, являются протоны, нейтроны и электроны. Протоны имеют положительный заряд, электроны – отрицательный, нейтроны являются нейтральными частицами, не имеющими заряда. Согласно упрощенной модели Нильса Бора атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, компенсируя положительный заряд ядра. Ядро состоит из протонов и нейтронов. Электроны располагаются вокруг ядра несколькими слоями – оболочками.
Газы, жидкие и твердые тела состоят из атомов, молекул или ионов. Молекулами называют электрически нейтральные частицы, образованные из двух или более связанных ковалентными связями атомов (часто к молекулам причисляют также и свободные атомы). Ион – это электрически заряженная частица (атом или молекула), получаемая в процессе ионизации.
В зависимости от строения внешних электронных оболочек атомов в молекулах могут образовываться различные виды связей.
Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. Иными словами происходит образование общей пары электронов, которые ранее принадлежали отдельным атомам. При образовании общей одной пары электронов от каждого объединяемого атома вносится по одному валентному электрону. Например: 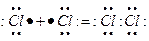
Молекулы, в которых центры положительных и отрицательных зарядов совпадают, являются неполярными. Если же в отдельных молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называются полярными или дипольными.
 Ионная связь определяется силами притяжения между положительными и отрицательными ионами.
Ионная связь определяется силами притяжения между положительными и отрицательными ионами.
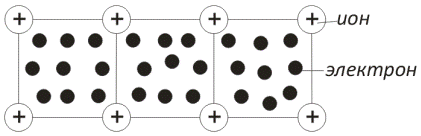 Металлическая связь. Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов
Металлическая связь. Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов
Молекулярная связь (связь Вандер-Вальса). Такая связь существует в некоторых веществах между молекулами с ковалентными внутримолекулярными связями. Межмолекулярное притяжение в этом случае обусловливается согла 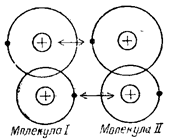 сованным движением валентных электронов в соседних молекулах. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит.
сованным движением валентных электронов в соседних молекулах. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит.
Раздела 1. Конструкционные материалы.
Тема №1. Строение и свойства металлов.
Металлы обычно имеют кристаллическое строение. В узлах кристаллической решетки металлов расположены положительно заряженные ионы, а часть валентных электронов, отщепившихся от атомов, становятся свободными. Свободные электроны обобществляются, образуя электронный газ, который взаимодействует с положительными ионами металла и связывает их в прочную систему.
Наиболее распространенными являются три типа кристаллической решетки: кубическая объемноцентрированная (о.ц.к.), кубическая гранецентрированная (г.ц.к.) и гексагональная плотноупакованная (г.п.у.)
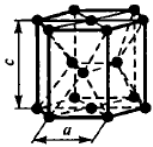
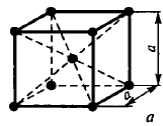
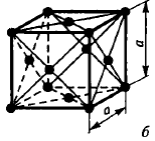 Чистые металлы обладают низкой прочностью, поэтому в технике используют редко. Наиболее широко применяют в технике в качестве конструкционных материалов металлические сплавы.
Чистые металлы обладают низкой прочностью, поэтому в технике используют редко. Наиболее широко применяют в технике в качестве конструкционных материалов металлические сплавы.
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Большинство сплавов, кроме сплавов с неорганической растворимостью компонентов в твердом состоянии, можно представить как систему, состоящую из нескольких фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Фазой называют однородную по химическому составу и строению часть системы, отделенную от другой части системы поверхностью раздела, при переходе через которую изменяются состав, строение и свойства сплава.
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы:
1. Механические смеси (гетерогенная структура) – образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Каждая фаза имеет кристаллическую решетку, соответствующую данному компоненту.
2. Химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
3. Твердые растворы – это сплавы, в которых кристаллическая решетка построена из атомов двух или большего числа компонентов, при этом один из них является растворителем, а другой – растворимым. Твердый раствор имеет сильно деформированную кристаллическую решетку, тип которой соответствует типу решетки одному из образующих компонентов.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Различные кристаллические формы одного вещества называются полиморфными модификациями. Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ.
Железо с углеродом образует сплавы: твердые растворы внедрения и химические соединения, которые, в свою очередь, образуют сплавы гетерогенной структуры. В зависимости от содержания углерода С в Fe получают стали (содержание С до 2,14%) или чугуны (С от 2,14% и более).
В углеродистых сталях эти компоненты взаимодействуют, образуя, в зависимости от их количественного соотношения и температуры, разные фазы, представляющие собой однородные части сплава. Это взаимодействие заключается том, что углерод может растворяться как в жидком (расплавленном) железе, так и в различных его модификациях в твердом состоянии.
Кроме того, он может образовывать с железом химическое соединение. Таким образом, в углеродистых сталях различают следующие фазы:
Феррит – твердый раствор углерода и других примесей в α-железе (кристаллическая решетка – о.ц.к.). Предельная растворимость углерода – 0,02% в низкотемпературном феррите и 0,1% в высокотемпературном. Имеет невысокую прочность и твердость (НВ=800 МПа; σ = 250 МПа) и высокую пластичность.
Аустенит – твердый раствор углерода и других примесей в γ-железе (кристаллическая решетка – г.ц.к.). Предельная растворимость углерода – 2,14%. Механические свойства: НВ=1600-2000 МПа; σ = 500-800 МПа; δ = 40-50%.
Цементит – химическое соединение железа с углеродом – карбид железа Fe3C2, содержащий 6,67% углерода. Имеет очень высокую твердость (НВ=8000 Мпа) и очень малую пластичность.
Перлит – эвтектоидная механическая смесь двух фаз: феррита и цементита, которая образуется из аустенита с содержанием С 0,8 % при постоянной температуре t = 727оС.
Как следует из приведенных выше характеристик, главной составляющей стали, определяющей ее свойства, является углерод. С увеличением содержания углерода возрастают прочность и твердость стали, снижаются показатели пластичности (относительное удлинение и относительное сужение), а также ударная вязкость. При 0,8 % углерода прочность стали достигает максимального значения, после чего она начинает снижаться.
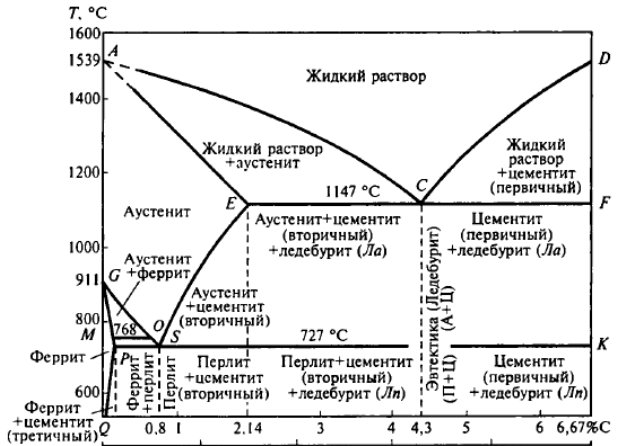
ACD – линия ликвидуса. Показывает температуру начала затвердевания сталей и чугунов.
AECF – линия солидуса. Показывает температуру конца затвердевания сплавов.
При охлаждении твердых сплавов в них происходят фазовые и структурные изменения, связанные с аллотропическими превращениями Fe и изменением растворимости в нем углерода. Эти изменения (фазовые превращения) в сплавах Fe-С характеризуют линии GSE, PSK, GPQ.
megalektsii.ru
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)