|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






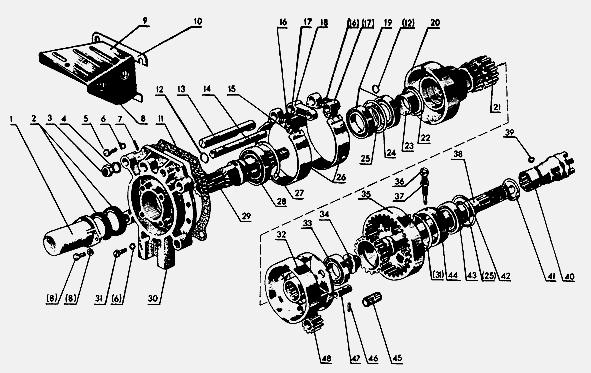
Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Реферат по химии на тему Металлы читать бесплатно. Сообщение о металле
Интересные факты о металлах - описание и содержание
В своё время металл стал неотъемлемым атрибутом промышленной революции и символом индустриальной мощи. Важность данного ресурса, безусловно, очень велика, но многие ли задумывались, сколь многообразной является данная группа химических элементов? Или какие любопытные свойства наблюдаются у некоторых металлов, а также какие невероятные качества им порой приписывают? Вряд ли. Так что стоит расширить понимание данной темы и перечислить некоторые интересные факты о металлах.
Подгруппы
На данный момент в периодической таблице насчитывают 94 химических элемента, которые рассматриваются в качестве металлов. Все разделены на 7 подгрупп:
- щелочные;
- щелочноземельные;
- переходные;
- легкие;
- полуметаллы;
- лантаноиды;
- актиноиды.
Особого рассмотрения требуют металлы первых четырех подгрупп.
Щелочные металлы
Своё название они обрели за счет свойства преобразования в щелочи в условиях водной среды.
Малоизвестный интересный факт о щелочных металлах: литий обладает некоторыми живительными свойствами. В частности – способствует лечению подагры. Так, ещё в древности люди заметили целебные свойства глины, которая обогащена литием. Мази и компрессы из этого материала способствовали ослаблению симптомов подагры.
Своё применение элементы данной группы нашли и в построении атомных подводных лодок. Натрий используется как теплоноситель в электрогенераторах, установленных на атомном реакторе подводной лодки. Он обеспечивает вращение паровых лопастей.
Но натрий требует особого обращения. При взаимодействии с ним следует учитывать его бурную реакцию с жидкостями. Даже простое прикосновение к натрию голой влажной рукой может спровоцировать небольшой взрыв.
Важны щёлочи и для здоровья. Дефицит натрия и калия в организме человека вызывает сильные судороги и боль, ввиду чего не следует ограничивать себя в воде и соли.

Щелочноземельные металлы
Данной группе присуща высокая плотность и большая температура плавления. Интересный факт о металлах: барий и радий обладают высокой токсичностью. Любопытно, что попавший в организм радий склонен транспортироваться более чем на 70 % в кости, но в силу своей высокой токсичности способствует образованию онкологических поражений костной ткани.
В 1950 году в республиканскую больницу Республики Коми поступило сразу 4 человека, с процентом поражения скелетных тканей злокачественными опухолями в районе 70-85 %, что было вызвано длительными разработками подземных минерализованных месторождений радия.
Переходные металлы
Эта группа заслуживает особого внимания. Интересные факты про металлы, относящиеся к ней, нельзя не упомянуть, так как она является наиболее многочисленной. Эта группа объединяет элементы с самыми разными свойствами.
Многие цветные металлы переходной группы задействованы в сфере производства продуктов электротехнической индустрии, так как обладают свойствами проводников электричества.
Забавный факт: общеизвестно, что Япония является лидером по поставкам хай-тек-оборудования на мировом рынке. В городе Сува была произведена оценка концентрации золота в пепельной массе, полученной от сожжения осадочных отложений городского коллектора. Итоговые показатели превосходили результаты аналогичных опытов в самых богатых рудниках на планете примерно в 50 раз, что объяснялось наличием огромной промышленной зоны, где изготавливают изделия электроники с применением сплавов драгоценных металлов, главным образом – золота. Кстати, о нём можно поведать немало интересного.

Золото
Всем известно, что изделия из этого материала сочетают в себе престиж, изысканность и роскошь. Украшения из золота являются замечательным подарком. Но кто бы мог подумать, что в Швейцарии есть ряд компаний, производящих из него фрагментированные плитки на манер шоколадных, которые могут быть использованы в качестве подарка? Либо же в расчетных операциях. Занимательно, что каждая плитка состоит из долей достоинством в 1 грамм и легко делится на части.
Интересный факт о металле: по состоянию на 2014 год во всем мире было добыто примерно 179 тонн золота, около половины которого приходится на Южно-Африканскую Республику. Почти такое же количества железа добывается из недр Земли ежечасно.
Золото – очень мягкий металл, по этой причине в изготовлении ювелирной продукции его обычно сплавляют с примесями меди или серебра.
Ртуть
Это - единственный металл, способный пребывать в жидком агрегатном состоянии в комнатных условиях. О токсичности ртутных испарений известно всем, но только химики знают, как данный элемент влияет на свойства алюминия.
Законодательными актами и документами, регламентирующими порядок и правила перемещения грузов на борту самолетов в некоторых странах, строго запрещается транспортировка ртути, так как при попадании на алюминиевую поверхность, она способна прожечь отверстие, что особенно важно на борту самолета, конструкция которого включает множество деталей, сделанных из этого материала.

Медь и кобальт
Перечисляя интересные факты о металлах по химии, стоит упомянуть и данные элементы. Медь является объектом особого интереса вандалов и охотников за цветными металлами. Она встречается в трансформаторных будках, так как медные элементы не способны давать искру.
Но на Востоке, главным образом в Японии, медь применяется в рыбных хозяйствах как вещество, препятствующее появлению в водоемах водных грибковых заболеваний.
А возникновение кобальта сопряжено со скандинавской мифологией. Норвежские кузнецы, которые занимались плавкой кобальтосодержащих минералов, получали мышьяковое отравление. Недомогание и головную боль они объясняли местью горного демона – Кобольда, мстящего людям за разорение его рудников. Так и появилось название данного металла. Аналогично происхождение названия никеля.
Железо
Является самым популярным элементом переходной группы. Интересный факт о металле: в глубокой древности, когда человечество еще не было знакомо с технологиями производства стали, железо укреплялось посредством обжига в навозе и лоскутах кожи, за счет чего происходило углеродное обогащение материала и значительно повышалась прочность. Поэтому кузницы зачастую строились возле конюшен.
Нельзя не упомянуть и о коррозии металла. Интересный факт: то, что железо окисляется при взаимодействии с кислородом, в первую очередь учитывается космонавтами при снаряжении инвентарного отсека космического корабля. И ясное дело, почему! Ведь в условиях космического вакуума железо не способно окислиться, а при соприкосновении с другими металлами они буквально слипаются.
Во избежание данной проблемы, инструменты для работы в открытом космосе обволакивают специальной пластиковой основой либо подвергают окислению на Земле.

Серебро
Многим знакомо выражение: «Серебро дороже золота». Оно не соответствует действительности. Тем не менее данное утверждение произрастает на почве благотворных, целебных, очистительных свойств серебра. Вода, долгое время пребывавшая в посуде из этого материала, приобретает антитоксичные свойства. Чем и объяснялась высокая популярность серебряной утвари в старые времена. Из этих соображений, на современных космических станциях функционируют серебряные водоочистители.
Первые изделия из данного металла были обнаружены в Египте, и насчитывают они возраст более 6 тысяч лет. На территории современной Индии принято употреблять в пищу десерты, покрытые тончайшей серебряной фольгой, что помогает поддерживать здоровье желудочно-кишечного тракта в условиях высокой антисанитарии.
Данный металл активно применяется азиатскими производителями терморегуляционной техники, главным образом - при сборке кондиционеров с функцией воздушной очистки.
В старину серебро служило средством предотвращения молочного окисления. Ложку из этого металла помещали в крынку с молоком, за счет чего оно не окислялось долгое время. И наконец, он стимулирует репродукцию гемоглобина, положительно влияет на центральную нервную систему. Такой вот удивительный металл – серебро. Интересных фактов о нём ещё много, но это – основные.
Легкие металлы
Данная категория является особо токсичной и трудно выявляемой. Полоний, чрезвычайно ядовитый металл, неоднократно использовался при покушениях на высокопоставленных чиновников и политиков. Его особенность состоит в том, что его трудно обнаружить в организме на ранних этапах, а его токсический эффект очень высок. Человек, чья пища была отравлена полонием, обречен на мучительную кончину.
Очень вредными являются испарения цинка. Тем не менее цинк благоприятно воздействует на репродуктивную функцию мужских тестикул. У индийских работников змеиных ферм, занимающихся добычей змеиного яда, после неоднократных укусов кобр или гадюк наблюдается сильная эрекция и интенсивная выработка половых гормонов, что объясняется повышенным содержанием цинка в яде змей.

Коррозия
Это сугубо негативный процесс, хотя есть у него и свои преимущества. Ещё 100 лет назад кавказские джигиты осознали всю полезность коррозийного процесса для производства прочных, не тупящихся клинков.
Так, они первые стали зарывать свои сабли и клинки в землю на пару лет, где те обретали прочность и способность разрезать даже самые твердые волокна. Данные характеристики металла достигались за счет абсорбирующего свойства ржавчины, которая, находясь в земле, впитывала в себя органические элементы и углеродистые соединения.
Индийское инженерное научное сообщество изобрело собственный инновационный метод защиты металлических поверхностей посредством катализа коррозии и последующего нанесения оксидированной краски на заржавевшую поверхность. Таким образом, специальная краска вступает в реакцию с ржавчиной и образует однородный, крепкий защитный слой.
В производстве инструментов для разделки туш применяются сплавы с небольшим процентом хрома, меди и никеля, за счет чего изделие быстро покрывается коррозией, под которой со временем образовывается прочный защитный слой, препятствующий дальнейшему образованию ржавчины.

Другие любопытные факты
Невероятно прочный титан, на удивление, находит свое наивысшее признание не в металлургии, не в машиностроении или технике, а в производстве синтетических пластиков, бумаги и красок.
Алюминий в 1885 году считался одним из самых дорогих металлов. И ценился он выше золота и серебра. Наличие алюминиевых пуговиц у офицеров французской армии расценивалось как знак высшего благородства.
При строительстве спутников и космических радиационных дозиметров американцы в свое время решились на распиливание затонувшего в конце Первой мировой войны корабля «Кронпринц Вильгельм», так как сталь, изготавливаемая после 1945 года, содержит слишком большой процент радиации. Использование такого металла воспрепятствовало бы сбору достоверных данных.
И наконец, факт о калифорнии. Он является самым дорогостоящим синтезированным металлом. Его стоимость превышает 6,5 миллиона за грамм. Фото, кстати, представлено выше.
На самом деле, ещё можно рассказать много интересных фактов про металлы. Химия – удивительная наука, и каждый элемент периодической таблицы обладает уникальными, неповторимыми свойствами и качествами.
fb.ru
Доклад по химии «Металлы» | Kratkoe.com

Металлы сообщение по химии кратко расскажет Вам много полезной информации об этих химических элементах. Также сообщение о металлах поможет подготовиться к занятию.
Доклад по химии «Металлы»
На сегодняшний день металлы широко распространены в природе и встречаются в водах рек, морей, океанов, озер, в недрах земли, даже в телах растений, животных и атмосфере.
Свойства металлов:
- Кристаллическая плотная структура
- Металлический блеск
- Электрическая проводимость
- Высокая теплопроводность
- С повышением температуры уменьшается электрическая проводимость
- Легко отдает электроны
- Тягучесть и ковкость
- Могут образовывать сплавы
Металлы и сплавы, разделяются на 2 группы:
- Черные металлы и его сплавы
К сплавам относятся сталь и чугун. В технике используются никель, хром, вольфрам, кобальт, титан, молибден, ванадий другие металлы. Они получаются путем легирования. Обладают высокой прочностью, сопротивляемостью к истиранию, коррозионной устойчивостью.
2.Цветные металлы и его сплавы
Они так называются, потому что их раскраска разнообразна. Медь, к примеру, медь светло-красная, олово, серебро, никель – белого окраса, золото – желтое, а свинец — голубовато-белый. Сплавы цветных металлов широко используются в ювелирном деле.
Часто с цветными и черными металлами выделяют и благородные металлы — золото, серебро, рутений и платину. Они на воздухе не окисляются и не разрушаются даже при воздействии щелочей и кислот.
Химические свойства металлов
Основное химическое свойство – способность атомов с легкостью отдавать валентные электроны и переходить в состояние положительно заряженных ионов. Типичные металлы не присоединяют электронов – их ионы всегда положительные. Поэтому они считаются энергичными восстановителями. И чем легче определенный металл отдает электроны, тем он стает активнее и энергичнее вступает в действие с другими металлами. Данное химическое свойство изучил русский ученый Бекетов, который расположил их по убыванию химической активности, так именуемый «вытеснительный ряд». Расположенные по возрастанию металлы образовывают электрохимический ряд напряжений. Выглядит он следующим образом: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Химические свойства металлов:
- Чем электродный потенциал у металла меньше, тем выше его восстановительная способность.
- Металл может вытеснять из растворов солей металлы, которые в ряду напряжений стоят после него.
- Металлы с отрицательным стандартным электродным потенциалом могут вытеснять из растворов кислот металлы, которые стоят левее водорода в ряду напряжений.
- Металлы обладают электромеханической и химической активностью.
Где применяют металлы?
Металлы применяются в следующих областях:
- В конструкционной промышленности
Металлы являются главным конструкционным материалом из-за их однородности, высокой прочности и непроницаемости для газов и жидкостей. Благодаря возможности менять рецептуру сплавов можно и изменять их свойства.
- В электротехнической промышленности
Металлы являются прекрасными проводниками электричества, особенно алюминий и медь. Их используют для электронагревательных элементов и резисторов как материал с повышенным сопротивлением.
- Для изготовления инструментальных материалов
Сплавы и металлы применяются для изготовления рабочей части инструментов. Преимущественно это сталь, твердые сплавы, алмаз, керамика и нитрид бора.
Надеемся, что доклад на тему «Металлы» помог Вам узнать новую информацию об этих химических элементах. А сообщение по химии на тему «Металлы» Вы можете дополнить через форму комментариев ниже.
kratkoe.com
Металлы

Металлы и их сплавы - один из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Почти все металлы, имеющие промышленное значение, используются в виде сплавов. Все выплавляемое железо почти целиком идет на изготовление обычных и легированных сталей, а также чугунов. Дело в том, что сплавлением с некоторыми компонентами можно существенно улучшить механические, электрические, магнитные, термические свойства многих металлов.
Люди узнали о существовании металлов еще на заре цивилизации. Они обнаружили, что некоторые камни, которые потом назвали рудой, при нагреве превращаются в блестящее вещество - металл, который при высокой температуре является жидкостью, а при комнатной - твердым телом. Для практического применения металлов и изготовления металлических изделий (оружия, сельскохозяйственных орудий) люди научились обрабатывать металл. Возникли первые технологии обработки металлов.
Металлургия - область науки и техники и отрасль промышленности, охватывающие процессы получения металлов из руд или других материалов, изменения химического состава, структуры и свойств металлических сплавов, придания металлу определенной формы. Металлургия является одной из наиболее динамично развивающейся отраслью мировой экономики. Развитие производственных мощностей металлургии заметно опережает динамику роста мировой индустрии. Конкуренция в отрасли велика, поставки импортной продукции нарастают. Так, по данным IISI, мировое производство стали за 2006 г. составило 1,219 млрд т, что на 7,93% выше уровня предыдущего года.
Раздел содержит справочную информацию об основных промышленных металлах: нахождение в природе, физические и химические свойства, получение и промышленное применение металлов, а также биологическое воздействие металлов и их соединений на человека. Вы можете выбрать интересующий Вас металл, кликнув по ссылке в левом меню страницы.
www.allmetals.ru
Доклад - Металлы - Химия
Металлы – этоэлементы, проявляющие в своих соединениях только положительные степениокисления, и в простых веществах которые имеют металлические связи. Металлическаякристаллическая решетка — решетка, образованная нейтральными атомами и ионами металлов, связанными междусобой свободными электронами./> У металловв узлах кристаллической решетки находятся атомы и положительные ионы.Электроны, отданные атомами, находятся в общем владении атомов и положительныхионов. Такая связь называется металлической. Для металлов наиболее характерны следующие физические свойства: металлическийблеск, твердость, пластичность, ковкость и хорошая проводимость тепла иэлектричества. Теплопроводность и электропроводность уменьшается в рядуметаллов: Аg Сu Аu Аl Мg Zn Fе РЬ Hg.
Многие металлы широкораспространены в природе. Так, содержание некоторых металлов в земной кореследующее: алюминия — 8,2%; железа — 4,1%; кальция — 4,1%; натрия — 2,3%;магния — 2,3%; калия — 2,1%; титана — 0,56%.
С внешней стороны металлы, какизвестно, характеризуются прежде всего особым “металлическим” блеском, которыйобусловливается их способностью сильно отражать лучи света. Однако этот блескнаблюдается обыкновенно только в том случае, когда металл образует сплошнуюкомпактную массу. Правда, магний и алюминий сохраняют свой блеск, даже будучипревращенными в порошок, но большинство металлов в мелкораздробленном видеимеет черный или темно-серый цвет. Затем типичные металлы обладают высокойтепло- и электропроводностью, причем по способности проводить тепло и токрасполагаются в одном и том же порядке: лучшие проводники — серебро и медь,худшие — свинец и ртуть. С повышением температуры электропроводность падает,при понижении температуры, наоборот, увеличивается.
Оченьважным свойством металлов является их сравнительно легкая механическаядеформируемость. Металлы пластичны, они хорошо куются, вытягиваются впроволоку, прокатываются в листы и т.п.
Характерныефизические свойства металлов находятся в связи с особенностями их внутреннейструктуры. Согласно современным воззрениям, кристаллы металлов состоят изположительно заряженных ионов и свободных электронов, отщепившихся отсоответствующих атомов. Весь кристалл можно себе представить в видепространственной решетки, узлы которой заняты ионами, а в промежутках междуионами находятся легкоподвижные электроны. Эти электроны постоянно переходят отодних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Таккак электроны не связаны с определенными ионами, то уже под влиянием небольшойразности потенциалов они начинают перемещаться в определенном направлении, т.е.возникает электрический ток.
Наличиемсвободных электронов обусловливается и высокая теплопроводность металлов. Находясьв непрерывном движении, электроны постоянно сталкиваются с ионами иобмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в даннойчасти металла вследствие нагревания, сейчас же передаются соседним ионам, отних — следующим и т.д., и тепловое состояние металла быстро выравнивается; всямасса металла принимает одинаковую температуру.
Поплотности металлы условно подразделяются на две большие группы: легкие металлы,плотность которых не больше 5 г/см3, и тяжелые металлы — всеостальные.
Частицыметаллов, находящихся в твердом и жидком состоянии, связаны особым типомхимической связи — так называемой металлической связью. Она определяетсяодновременным наличием обычных ковалентных связей между нейтральными атомами икулоновским притяжением между ионами и свободными электронами. Таким образом,металлическая связь является свойством не отдельных частиц, а их агрегатов.
/> /> /> /> /> /> /> /> />Методы получения металлов
/> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> />пирометаллургические
гидрометаллургические
электрометаллургические
/> /> /> /> /> /> /> />Восстановление металлов из соединений при высокой температуре
/>Восстановление металлов из водных растворов их соединений
/>Восстановление металлов из расплавов соединений под действием электрического тока
/>
Химическиесвойства металлов
Взаимодействие с простыми веществами:
1. с галогенами:
Na + Cl2 → 2NaCl
2. с кислородом:
4Al + 3O2 → 2Al2O3
В реакциях с галогенами и кислородомметаллы наиболее энергично проявляют восстановительные способности.
3. с серой:
2Na + S→ Na2S
4. с азотом:
3Mg + N2 →Mg3N2
5. с фосфором:
3Ca + 2P→ Ca3P2
6. с водородом:
Ca + h3 →Cah3
Наиболее активные металлы главных подгруппявляются сильными восстановителями, поэтому восстанавливают водород до степениокисления -1 и образуют гидриды.
Взаимодействиесо сложными веществами:
1. с кислотами:
2Al+3h3SO4 → Al2(SO4)3+ 3h3
2Al+ 6H + 3SO4 → 2Al + 3SO4 + 3h3
2Al + 6H→ 2Al + 3h3
Металлы, которые в электрохимическом рядунапряжений металлов находятся до водорода, восстанавливают ионы водорода изразбавленных кислот, а те, которые находятся после водорода, восстанавливаютатом основного элемента, образующего данную кислоту.
2. с водными растворами солей:
Zn+ Pb(NO3)2 → Zn(NO3)2 + Pb
Zn+ Pb + 2NO3 = Zn + 2NO3 + Pb
Zn + Pb = Zn + Pb
При взаимодействии с водными растворамисолей металлы, находящиеся в электрохимическом ряду напряжений металлов левее,восстанавливают металлы, находящиеся в этом ряду правее от них. Однако металлыс сильными восстановительными свойствами (Li, Na, K, Ca) в этихусловиях будут восстанавливать водород воды, а не металл соответствующей соли.
3. с водой:
Самые активные металлы реагируют с водой при обычныхусловиях, и в результате этих реакций образуются растворимые в воде основания ивыделяется водород.
2Na + 2HOH→ 2NaOH + h3
Менее активные металлы реагируют с водой при повышеннойтемпературе с выделением водорода и образованием оксида соответствующегометалла.
Zn + h3O→ ZnO +h3
Характеристика металлов главной подгруппы Iгруппы.
Главную подгруппу I группыпериодической системы составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Все щелочные металлы имеют один s-электрон на внешнемэлектронном слое, который при химических реакциях легко теряют, проявляястепень окисления +1. Поэтому щелочные металлы являются сильнымивосстановителями. Радиусы их атомов возрастают от лития к францию. Электронвнешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силыпритяжения ослабевают и, следовательно, увеличивается способность к отдачеэтого электрона, т.е. химическая активность. В электрохимическом рядунапряжений металлов все щелочные металлы стоят левее водорода. Все щелочныеметаллы в твердом состоянии хорошо проводят электрический ток. Они легкоплавки,быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги,чаще всего под керосином. Щелочные металлы образуют соединения спреимущественно ионной связью. Оксиды щелочных металлов – твердыегигроскопичные вещества, легко взаимодействующие с водой. При этом образуютсягидроксиды – твердые вещества, хорошо растворимые в воде. Соли щелочныхметаллов, как правило, тоже хорошо растворяются в воде.
Всещелочные металлы — очень сильные восстановители, в соединениях проявляютединственную степень окисления +1. Восстановительная способность увеличиваетсяв ряду ––Li–Na–K–Rb–Cs. Все соединения щелочных металлов имеют ионный характер. Практически все соли растворимы в воде.
1. Активно взаимодействуют с водой:
2Na + 2h3O→ 2NaOH + h3 2Li + 2h3O → 2LiOH + h3
2. Реакция с кислотами:
2Na + 2HCl →2NaCl + h3
3. Реакция с кислородом:
4Li + O2→ 2Li2O(оксид лития) 2Na + O2 → Na2O2(пероксид натрия) K + O2 → KO2(надпероксид калия)
На воздухе щелочные металлымгновенно окисляются. Поэтому их хранят под слоем органических растворителей(керосин и др.).
4.В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2→ 2LiCl(галогениды) 2Na + S → Na2S(сульфиды) 2Na + h3 → 2NaH(гидриды) 6Li + N2 → 2Li3N(нитриды) 2Li + 2C → 2Li2C2(карбиды)
Реагируют со спиртами и галогенопроизводными углеводородов (смотри«Органическую химию») 5. Качественная реакция на катионы щелочных металлов — окрашивание пламени вследующие цвета:
Li+– карминово-красный Na+ – желтый K+, Rb+ и Cs+ – фиолетовый
Характеристикаэлементов главной подгруппы IIгруппы.
Главнуюподгруппу II группы Периодической системы элементовсоставляют бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Атомы этихэлементов имеют на внешнем электронном уровне два s-электрона:ns2. В хим. реакциях атомы элементовподгруппы легко отдают оба электрона внешнего энергетического уровня и образуютсоединения, в которых степень окисления элемента равна +2.
Всеэлементы этой подгруппы относятся к металлам. Кальций, стронций, барий и радийназываются щелочноземельными металлами.
В свободномсостоянии эти металлы в природе не встречаются. К числу наиболеераспространенных элементов относятся кальций и магний. Основнымикальцийсодержащими минералами являются кальцит CaCO3 (егоразновидности – известняк, мел, мрамор), ангидрит CaSO4, гипс CaSO4 ∙ 2h3O<sub/>,флюорит CaF2 ифторапатит Ca5(PO4)3F. Магнийвходит в состав минералов магнезита MgCO3, доломита MgCO3 ∙ CaCo3,карналлита KCl ∙ MgCl2 ∙ 6h3O.Соединения магния в больших количествах содержатся в морской воде.
Свойства.Бериллий, магний, кальций, барий и радий – металлы серебристо-белого цвета.Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотностиимеют кальций, магний, бериллий.
Радийявляется радиоактивным химическим элементом.
Бериллий,магний и особенно щелочноземельные элементы – химически активные металлы. Ониявляются сильными восстановителями. Из металлов этой подгруппы несколько менееактивен бериллий, что обусловлено образованием на поверхности этого металлазащитной оксидной пленки.
1. Взаимодействиес простыми веществами. Все легко взаимодействуют с кислородом и серой, образуяоксиды и сульфаты:
2Be+ O2 = 2BeO
Ca+ S = CaS
Бериллий имагний реагируют с кислородом и серой при нагревании, остальные металлы – приобычных условиях.
Все металлыэтой группы легко реагируют с галогенами:
Mg + Cl2 = MgCl2
Принагревании все реагируют с водородом, азотом, углеродом, кремнием и другиминеметаллами:
Ca + h3 = Cah3 (гидридкальция)
3Mg + N2 = Mg3N2 (нитридмагния)
Ca + 2C = CaC2 (карбидкальция)
Карибиткальция – бесцветное кристаллическое вещество. Технический карбит, содержащийразличные примеси, может иметь цвет серый, коричневый и даже черный. Карбиткальция разлагается водой с образованием газа ацетилена C2h3 – важногопродукта хим. промышленности:
CaC2 + 2h3O = CaOH)2+ C2h3
Расплавленныеметаллы могут соединяться с другими металлами, образуя интерметаллическиесоединения, например CaSn3, Ca2Sn.
2. Взаимодействуютс водой. Бериллий с водой не взаимодействует, т.к. реакции препятствуетзащитная пленка оксида на поверхности металла. Магний реагирует с водой принагревании:
Mg + 2h3O = Mg(OH)2 + h3
Остальныеметаллы активно взаимодействуют с водой при обычных условиях:
Ca + 2h3O = Ca(OH)2 + h3
3. Взаимодействиес кислотами. Все взаимодействуют с хлороводородной и разбавленной сернойкислотами с выделением водорода:
Be + 2HCl = BeCl2 + h3
Разбавленнуюазотную кислоту металлы восстанавливают главным образом до аммиака или нитратааммония:
2Ca + 10HNO3(разб.)= 4Ca(NO3)2 + Nh5NO3 + 3h3O
Вконцентрированных азотной и серной кислотах (без нагревания) бериллийпассивирует, остальные металлы реагируют с этими кислотами.
4.Взаимодействие с щелочами. Бериллий взаимодействует с водными растворамищелочей с образованием комплексной соли и выделением водорода:
Be + 2NaOH + 2h3O = Na2[Be(OH)4]+ h3
Магний ищелочноземельные металлы с щелочами не реагируют.
5.Взаимодействие с оксидами и солями металлов. Магний и щелочноземельные металлымогут восстанавливать многие металлы из их оксидов и солей:
TiCl4 + 2Mg = Ti + 2MgCl2
V2O5 + 5Ca = 2V + 5CaO
Бериллий,магний и щелочноземельные металлы получают электролизом расплавов их хлоридовили термическим восстановлением их соединений:
BeF2 + Mg = Be + MgF2
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + Al2O3
3BaO + 2Al = 3Ba + Al2O3
Радийполучают в виде сплава с ртутью электролизом водного раствора RaCl2 с ртутнымкатодом.
Получение:
1) Окисление металлов (кроме Ba, которыйобразует пероксид)
2)Термическое разложение нитратов или карбонатов
CaCO3 –t°→CaO + CO2
2Mg(NO3)2 –t°→ 2MgO + 4NO2 + O2
Характеристикаэлементов главной подгруппы IIIгруппы. Алюминий.
Алюминий находится в главной подгруппе III группыпериодической системы. На внешнем энергетическом уровне атома алюминия имеютсясвободные р-орбитали, что позволяет ему переходить в возбужденное состояние. Ввозбужденном состоянии атом алюминия образует три ковалентные связи илиполностью отдает три валентных электрона, проявляя степень окисления +3.
Алюминий является самым распространенным металлом на Земле:его массовая доля в земной коре составляет 8,8%. Основная масса природногоалюминия входит в состав алюмосиликатов – веществ, главными компонентамикоторых являются оксиды кремния и алюминия.
Алюминий – легкий металл серебристо-белогоцвета, плавится при 600°C, очень пластичен, легковытягивается в проволоку и прокатывается в листы и фольгу. Поэлектропроводности алюминий устпает лишь серебру и меди.
Взаимодействие с простымивеществами:
1. с галогенами:
2Al + 3Cl2 → 2AlCl3
2. с кислородом:
4Al + 3O2 → 2Al2O3
3. с серой:
2Al+ 3S → Al2S3
4. с азотом:
2Al + N2 →AlN
С водородом алюминий непосредственно не реагирует, но егогидрид Alh4 полученкосвенным путем.
Взаимодействиесо сложными веществами:
1. с кислотами:
2Al+ 6HCl → 2AlCl3 + 3h3
2. со щелочами:
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3
Если NaOH в твердом состоянии:
2Al+ 2NaOH + 6h3O → 2NaAlO2 + 3h3
3. с водой:
2Al + 6h3O→2Al(OH)3 + 3h3
Свойстваоксида и гидроксида алюминия:
Оксидалюминия, или глинозем, Al2O3 представляетсобой белый порошок. Оксид алюминия можно получить, сжигая металл илипрокаливая гидроксид алюминия:
2Al(OH)3→ Al2O3 + 3h3O
Оксид алюминия практически не растворяется в воде.Соответствующий этому оксиду гидроксид Al(OH)3 получают действием гидроксида аммония или растворов щелочей, взятых внедостатке, на растворы солей алюминия:
AlCl3+ 3Nh4 ∙ h3O → Al(OH)3 ↓ + 3Nh5Cl
Оксид и гидроксид этого металлаявляются амфотерными, т.е. проявляют как основные, так и кислотные свойства.
Основные свойства:
Al2O3 + 6HCl→2AlCl3 + 3h3O
2Al(OH)3 + 3h3SO4 → Al2(SO4)3 + 6h3O
Кислотныесвойства:
Al2O3 + 6KOH +3h3O →2K3[Al(OH)6]
2Al(OH)3+ 6KOH → K3[Al(OH)6]
Al2O3 + 2NaOH→2NaAlO2 + h3O
Алюминий получают электролитическим методом. Он не можетбыть выделен из водных растворов солей, т.к. является очень активным металлом.Поэтому основным промышленным методом получения металлического алюминияявляется электролиз расплава, содержащего оксид алюминия и криолит.
Металлический алюминий широко используется впромышленности, по объему производства занимает второе место после железа.Основная масса алюминия идет на изготовление сплавов:
Дуралюмин – сплав алюминия, содержащий медь и небольшоеколичество магния, марганца и других компонентов. Дуралюмины – легкие прочные икоррозионностойкие сплавы. Используют в авиа- и машиностроении.
Магналин – сплав алюминия с магнием. Используют в авиа- имашиностроении, в строительстве. Стоек к коррозии в морской воде, поэтому егоприменяют в судостроении. Силумин – сплав алюминия, содержащий кремний. Хорошо подвергаетсялитью. Этот сплав используют в автомобиле-, авиа- и машиностроении,производстве точных приборов. Алюминий – пластичный металл, поэтому из негоизготавливают тонкую фольгу, используемую в производстве радиотехническихизделий и для упаковки товаров. Из алюминия делают провода, краски «подсеребро».
Переходные металлы.
Железо.
Впериодической системе железо находится в четвертом периоде, в побочнойподгруппе VIII группы.
Порядковыйномер – 26, электронная формула 1s2 2s2 2p6 3d64s2.
Валентныеэлектроны у атома железа находятся на последнем электронном слое (4s2)и предпоследнем (3d6). В химических реакциях железо может отдаватьэти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Железо является вторым пораспространенности металлом в природе (после алюминия).Наиболее важныеприродные соединения: Fe2O3 · 3h3O – бурый железняк;Fe2O3– красный железняк;Fe3O4(FeO · Fe2O3) –магнитный железняк;FeS2 — железный колчедан (пирит).Соединенияжелеза входят в состав живых организмов.
Железо – серебристо серый металл,обладает большой ковкостью, пластичностью и сильными магнитными свойствами.Плотность железа – 7,87 г/см3, температура плавления 1539°С.
В промышленности железо получаютвосстановлением его из железных руд углеродом (коксом) и оксидом углерода (II)в доменных печах. Химизм доменного процесса следующий:
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3+ CO = 2Fe3O4 + CO2,
Fe3O4+ CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
В реакциях железо являетсявосстановителем. Однако при обычной температуре оно не взаимодействует даже ссамыми активными окислителями (галогенами, кислородом, серой), но принагревании становится активным и реагирует с ними:
2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III)
3Fe + 2O2 = Fe3O4(FeO· Fe2O3) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железореагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3C Карбид железа (цементит)
3Fe + Si = Fe3Si Силицид железа
3Fe + 2P = Fe3P2 Фосфид железа (II)
Во влажном воздухе железо быстроокисляется (корродирует):
4Fe + 3O2 + 6h3O= 4Fe(OH)3,
Железо находится в середине электрохимическогоряда напряжений металлов, поэтому является металлом средней активности.Восстановительная способность у железа меньше, чем у щелочных, щелочноземельныхметаллов и у алюминия. Только при высокой температуре раскаленное железореагирует с водой:
3Fe + 4h3O = Fe3O4+ 4h3
Железо реагирует с разбавленнымисерной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2+ h3
Fe + h3SO4= FeSO4 + h3
При обычной температуре железо невзаимодействует с концентрированной серной кислотой, так как пассивируется ею.При нагревании концентрированная h3SO4 окисляет железо досульфита железа (III):
2Fe + 6h3SO4= Fe2(SO4)3 + 3SO2 + 6h3O.
Разбавленная азотная кислота окисляетжелезо до нитрата железа (III):
Fe + 4HNO3 =Fe(NO3)3 + NO + 2h3O.
Концентрированная азотная кислотапассивирует железо.
Из растворов солей железо вытесняетметаллы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO4 =FeSO4 + Cu, Fe0+ Cu2+ = Fe2+ + Cu0.
Оксид железа (II) FeO – черное кристаллическое вещество,нерастворимое в воде. Оксид железа (II) получают восстановлением оксидажелеза(II,III) оксидом углерода (II):
Fe3O4 + CO =3FeO + CO2.
Оксид железа (II) – основной оксид,легко реагирует с кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2+ h3O, FeO + 2H+ = Fe2+ + h3O.
Гидроксид железа (II) Fe(OH)2 – порошок белого цвета, нерастворяется в воде. Получают его из солей железа (II) при взаимодействии их сощелочами:
FeSO4 + 2NaOH =Fe(OH)2¯ + Na2SO4,
Fe2+ + 2OH- =Fe(OH)2¯.
Гидроксид железа (II) Fe(OH)2проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2 + 2HCl= FeCl2 + 2h3O,
Fe(OH)2 + 2H+ =Fe2+ + 2h3O.
При нагревании гидроксид железа (II)разлагается:
Fe(OH)2 = FeO + h3O.
Соединения со степенью окисленияжелеза +2 проявляют восстановительные свойства, так как Fe2+ легкоокисляются до Fe+3:
Fe+2 – 1e = Fe+3
Так, свежеполученный зеленоватыйосадок Fe(OH)2 на воздухе очень быстро изменяет окраску – буреет. Изменениеокраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородомвоздуха:
4Fe+2(OH)2+ O2 + 2h3O = 4Fe+3(OH)3.
Оксид железа (III) Fe2O3 – порошок бурого цвета, нерастворяется в воде. Оксид железа (III) получают:
А) разложением гидроксида железа(III):
2Fe(OH)3 = Fe2O3+ 3h3O
Б) окислением пирита (FeS2):
4Fe+2S2-1+ 11O20= 2Fe2+3O3 + 8S+4O2-2.
Оксид железа (III) проявляетамфотерные свойства:
А) взаимодействует с твердымищелочами NaOH и KOH и с карбонатами натрия и калия при высокой температуре:
Fe2O3+ 2NaOH = 2NaFeO2 + h3O,
Fe2O3+ 2OH- = 2FeO2- + h3O,
Fe2O3+ Na2CO3 = 2NaFeO2 + CO2.
Феррит натрия
Гидроксид железа (III) получают из солей железа (III) привзаимодействии их со щелочами:
FeCl3 + 3NaOH =Fe(OH)3¯ + 3NaCl,
Fe3+ + 3OH- =Fe(OH)3¯.
Гидроксид железа (III) является болееслабым основанием, чем Fe(OH)2, и проявляет амфотерные свойства (спреобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3легко образует соответствующие соли:
Fe(OH)3 + 3HCl « FeCl3 + h3O
2Fe(OH)3 + 3h3SO4« Fe2(SO4)3+ 6h3O
Fe(OH)3 + 3H+ « Fe3+ + 3h3O
Реакции с концентрированнымирастворами щелочей протекают лишь при длительном нагревании.
Соединения со степенью окисленияжелеза +3 проявляют окислительные свойства, так как под действиемвосстановителей Fe+3 превращается в Fe+2:
Fe+3 + 1e = Fe+2.
Так, например, хлорид железа (III)окисляет йодид калия до свободного йода:
2Fe+3Cl3+ 2KI = 2Fe+2Cl2 + 2KCl + I20
Хром.
Хром находится в побочной подгруппе VI группы Периодическойсистемы. Строение электронной оболочки хрома: Cr3d54s1.
Массовая доля хрома в земной коре составляет 0,02%.Важнейшими минералами, входящими в состав хромовых руд, являются хромит, илихромистый железняк, и его разновидности, в которых железо частично заменено намагний, а хром – на алюминий.
Хром – серебристо серый металл. Чистый хромдостаточно пластичный, а технический самый твердый из всех металлов.
Хромхимически малоактивен. В обычных условиях он реагирует только с фтором (изнеметаллов), образуя смесь фторидов. При высокихтемпературах (выше 600°C) взаимодействует с кислородом,галогенами, азотом, кремнием, бором, серой, фосфором:
4Cr + 3O2 –t°→ 2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В азотной и концентрированной серной кислотах онпассивирует, покрываясь защитной оксидной пленкой. В хлороводородной иразбавленной серной кислотах растворяется, при этом, если кислота полностьюосвобождена от растворенного кислорода, получаются соли хрома(II), а если реакция протекаетна воздухе – соли хрома (III):
Cr + 2HCl → CrCl2 + h3
2Cr + 6HCl + O2 → 2CrCl3 + 2h3O + h3
Оксидхрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2h3O
Соединенияхрома (II) — сильные восстановители;переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + h3
4Cr(OH)2 + O2 + 2h3O → 4Cr(OH)3
Соединения трёхвалентного хрома
Оксидхрома (III) Cr2O3 – зелёный, нерастворимый вводе порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия иаммония:
2Cr(OH)3 –t°→ Cr2O3 + 3h3O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(Nh5)2Cr2O7 –t°→ Cr2O3 + N2+ 4h3O
Амфотерныйоксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаютсясоединения хрома со степенью окисления (+3):
Cr2O3+ 2NaOH → 2NaCrO2 + h3O
Cr2O3+ Na2CO3 → 2NaCrO2 + CO2
Cr2O3+ 6KHSO4 → Cr2(SO4)3 + 3K2SO4+ 3h3O
Присплавлении со смесью щёлочи и окислителя получают соединения хрома в степениокисления (+6):
2Cr2O3 + 4KOH + KClO3 → 2K2Cr2O7(дихромат калия) + KCl + 2h3O
Гидроксидхрома (III) Cr(OH)3 — нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3+ 6NaOH →2Cr(OH)3¯ + 3Na2SO4
Обладаетамфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3h3SO4→ Cr2(SO4)3 + 6h3O
Cr(OH)3 + KOH →K[Cr(OH)4]
Оксидхрома (VI) CrO3 — ярко-красные кристаллы,растворимые в воде.
Получаютиз хромата (или дихромата) калия и h3SO4(конц.).
K2CrO4+ h3SO4 → CrO3 + K2SO4+ h3O
K2Cr2O7+ h3SO4 → 2CrO3 + K2SO4+ h3O
CrO3 — кислотный оксид, сощелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + h3O
Вкислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + h3SO4 → K2Cr2O7 + K2SO4 + h3O
В щелочной среде эта реакцияпротекает в обратном направлении:
K2Cr2O7+ 2KOH → 2K2CrO4+ h3O
Всесоединения хрома (VI)- сильные окислители.
4CrO3 + 3S → 3SO2+ 2Cr2O3
Медь.
Медьнаходится в побочной подгруппе I группы Периодическойсистемы. Строение электронных оболочек атомов элементов этой подгруппывыражается формулой (n-1)d10ns1. Навнешнем энергетическом уровне атома находится один электрон, однако вобразовании хим. связей могут принимать участие и электроны с d-подуровняпредпоследнего уровня. Поэтому они могут проявлять степени окисления +1, +2,+3, для меди наиболее устойчивы соединения со степенью окисления +2.
Медь –мягкий пластичный металл, имеет розово-красную окраску. Обладает высокойэлектрической проводимостью.
Медь –химически малоактивный металл. С кислородом реагирует только при нагревании:
2Cu + O2 = 2CuO
Нереагирует с водой, растворами щелочей, хлороводородной и разбавленной сернойкислотами. Медь растворяется в кислотах, являющихся сильными окислителями:
3Cu + 8HNO3 (разб.) =3Cu(NO3)2 + 2NO + 4h3O
Cu + 2h3SO4 (конц.)=CuSO4 + SO2 +2h3O
Во влажнойатмосфере, содержащей диоксид углерода, поверхность меди обычно покрываетсязеленоватым налетом основного карбоната меди:
2Cu + O2 + CO2 +h3O= Cu(OH)2 ∙ CuCO3
Оксид меди(II) CuO – черное вещество, можетбыть получен из простых веществ или путем нагревания гидроксида меди (II):
Cu(OH)2 = CuO + h3O
Гидроксидмеди (II) представляет собой малорастворимое в водесоединение голубого цвета. Легко растворяется в кислотах и при нагревании вконцентрированных растворах щелочей, т.е. проявляет свойства амфотерногогидроксида:
Cu(OH)2 + h3SO4 =CuSO4 + 2h3O
Cu(OH)2 + 2KOH = K2[Cu(OH)4]
Основнаямасса производимой меди используется в электротехнической промышленности. Вбольших количествах медь идет на производство сплавов.
Цинк.
Цинкнаходится в побочной подгруппе II группы. Атомы элементовэтой подгруппы имеют следующую электронную оболочку: (n-1)s2p6d10ns2. Проявляютв соединениях степень окисления +2.
Цинк –серебристо-белый металл. Обладает хорошей электро- и теплопроводимостью. Навоздухе цинк покрывается защитной пленкой оксидов и гидроксидов, котораяослабляет его металлический блеск.
Цинк –химически активный металл. При нагревании легко взаимодействует с неметаллами(серой, хлором, кислородом):
2Zn + O2 = 2ZnO
Растворяетсяв разбавленных и концентрированных кислотах HCl, h3SO4, HNO3 и в водныхрастворах щелочей:
Zn + 2HCl = ZnCl2 + h3
4Zn + 10HNO3 = 4Zn(NO3)2+ Nh5NO3 + 3h3O
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4]+ h3
Оксид цинка– белое вещество, практически нерастворимое в воде. Оксид и гидроксид цинкаявляются амфотерными соединениями; они реагируют с кислотами и щелочами:
ZnO +2HCl = ZnCl2 + h3O
ZnO + 2KOH + h3O = K2[Zn(OH)4]
Гидроксидцинка растворяется в водном растворе аммиака, образуя комплексное соединение:
Zn(OH)2 + 6Nh4 = [Zn(Nh4)6](OH)2
Приполучение цинка его руды подвергают обжигу:
2ZnS + 3O2 = 2ZnO + 2SO2
ZnCO3 = ZnO + CO2
Далее оксидцинка восстанавливают углем:
ZnO + C = Zn + CO
Дляполучения более чистого металла оксид цинка растворяют в серной кислоте ивыделяют электролизом.
Цинкиспользуют для производства сплавов. Цинком покрывают стальные и чугунныеизделия для защиты их от коррозии.
Понятие о сплавах.
Характернойособенностью металлов является их способность образовывать друг с другом или снеметаллами сплавы. Чтобы получить сплав, смесь металлов обычно подвергаютплавлению, а затем охлаждают с различной скоростью, которая определяетсяприродой компонентов и изменением характера их взаимодействия в зависимости оттемпературы. Иногда сплавы получают спеканием тонких порошков металлов, неприбегая к плавлению (порошковая металлургия). Итак сплавы — это продуктыхимического взаимодействия металлов.
Кристаллическаяструктура сплавов во многом подобна чистым металлам, которые, взаимодействуядруг с другом при плавлении и последующей кристаллизации, образуют: а)химические соединения, называемые интерметаллидами; б) твердые растворы; в)механическую смесь кристаллов компонентов.
Тот илииной тип взаимодействия определяется соотношением энергии взаимодействияразнородных и однородных частиц системы, то есть соотношением энергийвзаимодействия атомов в чистых металлах и сплавах.
Современнаятехника использует огромное число сплавов, причем в подавляющем большинстве случаевони состоят не из двух, а из трех, четырех и большего числа металлов.Интересно, что свойства сплавов часто резко отличаются от свойствиндивидуальных металлов, которыми они образованы. Так, сплав, содержащий 50%висмута, 25% свинца, 12,5% олова и 12,5% кадмия, плавится всего при 60,5градусах Цельсия, в то время как компоненты сплава имеют соответственнотемпературы плавления 271, 327, 232 и 321 градус Цельсия. Твердость оловяннойбронзы (90% меди и 10% олова) втрое больше, чем у чистой меди, а коэффициентлинейного расширения сплавов железа и никеля в 10 раз меньше, чем у чистыхкомпонентов.
Однаконекоторые примеси ухудшают качество металлов и сплавов. Известно, например, чточугун (сплав железа и углерода) не обладает той прочностью и твердостью, которыехарактерны для стали. Помимо углерода, на свойства стали влияют добавки серы ифосфора, увеличивающие ее хрупкость.
Средисвойств сплавов наиболее важными для практического применения являютсяжаропрочность, коррозионная стойкость, механическая прочность и др. Для авиациибольшое значение имеют легкие сплавы на основе магния, титана или алюминия, дляметаллообрабатывающей промышленности — специальные сплавы, содержащие вольфрам,кобальт, никель. В электронной технике применяют сплавы, основным компонентомкоторых является медь. Сверхмощные магниты удалось получить, используя продуктывзаимодействия кобальта, самария и других редкоземельных элементов, асверхпроводящие при низких температурах сплавы — на основе интерметаллидов,образуемых ниобием с оловом и др.
www.ronl.ru
Реферат Металлы
скачатьРеферат на тему:
План:
- Введение
- 1 Нахождение в природе
- 2 Свойства металлов
- 2.1 Характерные свойства металлов
- 2.2 Физические свойства металлов
- 2.3 Химические свойства металлов
- 2.4 Легирование
- 3 Микроскопическое строение
- 3.1 Некоторые металлы
- 4 Применение металлов
- 4.1 Конструкционные материалы
- 4.2 Электротехнические материалы
- 4.3 Инструментальные материалы
Примечания
Введение
Металлы — один из самых распространённых материалов, используемых цивилизацией на протяжении практически всей её истории.
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 [1] химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов,
6 в группе щёлочноземельных металлов,
38 в группе переходных металлов,
11 в группе лёгких металлов,
7 в группе полуметаллов,
14 в группе лантаноиды + лантан,
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
вне определённых групп бериллий и магний.
Таким образом, к металлам возможно относится 96 элементов из всех открытых.
1. Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
2. Свойства металлов
2.1. Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки (см.: пластичность; однако, некоторые металлы, например германий и висмут, непластичны)
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями
2.2. Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:
| 0.3 | Рубидий | очень легко царапается ногтем (прикосновение опасно) |
| 0.4 | Калий | очень легко царапается ногтем (прикосновение опасно) |
| 0.5 | Натрий | очень легко царапается ногтем (прикосновение опасно) |
| 0.6 | Литий | очень легко царапается ногтем (прикосновение опасно) |
| 1.2 | Индий | очень легко царапается ногтем, даже мнётся (пары индия токсичны) |
| 1.2 | Таллий | легко царапается ногтем (прикосновение смертельно опасно) |
| 1.25 | Барий | легко царапается ногтем |
| 1.5 | Стронций | царапается ногтем |
| 1.5 | Галлий | царапается ногтем |
| 1.5 | Олово | царапается ногтем |
| 1.5 | Свинец | царапается ногтем |
| 1.5 | Ртуть | царапается ногтем (в твёрдом состоянии) |
| 1.75 | Кальций | царапается ногтем |
| 2.0 | Кадмий | царапается алюминиевой ложкой |
| 2.25 | Висмут | царапается алюминиевой ложкой |
| 2.5 | Магний | царапается медной проволокой |
| 2.5 | Цинк | царапается медной проволокой |
| 2.5 | Серебро | царапается медной монетой |
| 2.5 | Золото | царапается медной монетой |
| 3.0 | Медь | царапается кухонным ножом |
| 3.0 | Сурьма | царапается кухонным ножом |
| 3.5 | Платина | царапается кухонным ножом |
| 4.0 | Железо | царапается кухонным ножом (из нержавеющей стали) |
| 4.0 | Никель | царапается кухонным ножом (из нержавеющей стали) |
| 4.75 | Палладий | царапается кухонным ножом (из нержавеющей стали) |
| 5.0 | Кобальт | царапается стеклом и стальным гвоздём |
| 5.0 | Цирконий | царапается стеклом и стальным гвоздём |
| 5.0 | Бериллий | царапается напильником и полевым шпатом |
| 5.5 | Молибден | царапается напильником и полевым шпатом |
| 5.5 | Гафний | царапается напильником и полевым шпатом |
| 6.0 | Титан | царапает стекло; царапается стеклом и напильником |
| 6.0 | Марганец | царапает стекло; царапается стеклом и напильником |
| 6.0 | Германий | царапает стекло; царапается стеклом и напильником |
| 6.0 | Ниобий | царапает стекло; царапается стеклом и напильником |
| 6.0 | Родий | царапает стекло; царапается стеклом и напильником |
| 6.5 | Рутений | царапает стекло; царапается кварцем |
| 6.5 | Тантал | царапает стекло; царапается кварцем |
| 6.5 | Иридий | царапает стекло; царапается кварцем |
| 7.0 | Ванадий | царапает все виды сталей; царапается топазом |
| 7.0 | Рений | царапает все виды сталей; царапается топазом |
| 7.0 | Осмий | царапает все виды сталей; царапается топазом |
| 7.5 | Вольфрам | царапает все виды сталей; царапается топазом |
| 8.5 | Хром | легко царапает стекло и все металлы; царапается рубином |
Температуры плавления металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
2.3. Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
4Li + O2 = 2Li2O оксид лития2Na + O2 = Na2O2 пероксид натрияK + O2 = KO2 надпероксид калияЧтобы получить из пероксида оксид, пероксид восстанавливают металлом:Na2O2 + 2Na = 2Na2OСо средними и малоактивными металлами реакция происходит при нагревании:3Fe + 2O2 = Fe3O42Hg + O2 = 2HgO2Cu + O2 = 2CuO
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
6Li + N2 = 2Li3NПри нагревании:2Al + N2 = 2AlN3Ca + N2 = Ca3N2
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:Fe + S = FeS
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
2Na + h3 = 2NaHMg + h3 = Mgh3
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
2Na + 2C = Na2C2Na2C2 + 2h3O = 2NaOH + C2h32Na + h3 = 2NaH
2.4. Легирование
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
3. Микроскопическое строение
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
3.1. Некоторые металлы
Осмий
Алюминий
Барий
- Щелочные:
- Литий
- Натрий
- Калий
- Рубидий
- Цезий
- Франций
- Щёлочноземельные:
- Кальций
- Стронций
- Барий
- Радий
- Переходные:
- Титан
- Железо
- Платина
- Медь
- Цинк
- Золото
- Серебро
- Палладий
- Ртуть
- Никель
- Кобальт
- Вольфрам
- Лёгкие:
- Алюминий
- Галлий
- Свинец
- Олово
- Другие:
- Бериллий
- Магний
4. Применение металлов
4.1. Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
4.2. Электротехнические материалы
Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
4.3. Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
Примечания
- Международный химический союз признал 112-й химический элемент - lenta.ru/news/2009/06/11/e112/
wreferat.baza-referat.ru
Применение металлов и их сплавов — урок. Химия, 8–9 класс.
О том, что свойства металлов меняются при их сплавлении, стало известно ещё в древности. \(5\) тысяч лет тому назад наши предки научились делать бронзу — сплав олова с медью. Бронза по твёрдости превосходит оба металла, входящие в её состав.
Свойства чистых металлов, как правило, не соответствуют необходимым требованиям, поэтому практически во всех сферах человеческой деятельности используют не чистые металлы, а их сплавы.
Сплав — это материал, который образуется в результате затвердения расплава двух или нескольких отдельных веществ.
В состав сплавов кроме металлов могут входить также неметаллы, например, такие как углерод или кремний.
Добавляя в определённом количестве примеси других металлов и неметаллов, можно получить многие тысячи материалов с самыми разнообразными свойствами, в том числе и такими, каких нет ни у одного из составляющих сплав элементов.
Сплав по сравнению с исходным металлом может быть:
- механически прочнее и твёрже,
- со значительно более высокой или низкой температурой плавления,
- устойчивее к коррозии,
- устойчивее к высоким температурам,
- практически не менять своих размеров при нагревании или охлаждении и т. д.
Например, чистое железо — сравнительно мягкий металл. При добавлении в железо углерода твёрдость его существенно возрастает. По количеству углерода, а следовательно, и по твёрдости, различают сталь (содержание углерода менее \(2\) % по массе), чугун (\(С\) — более \(2\) %). Но не только углерод изменяет свойства стали. Добавленный в сталь хром делает её нержавеющей, вольфрам делает сталь намного более твёрдой, добавка марганца делает сплав износостойким, а ванадия — прочным.
Применение сплавов в качестве конструкционных материалов
Сплавы, используемые для изготовления различных конструкций, должны быть прочными и легко обрабатываемыми.
В строительстве и в машиностроении наиболее широко используются сплавы железа и алюминия.
Такие сплавы железа, как стали, отличаются высокой прочностью и твёрдостью. Их можно ковать, прессовать, сваривать.
Чугуны используют для изготовления массивных и очень прочных деталей. Например, раньше из чугуна отливали радиаторы центрального отопления, канализационные трубы, до сих пор изготавливают котлы, перила и опоры мостов. Изделия из чугуна изготавливаются с применением литья.
Сплавы алюминия, используемые в конструкциях, наряду с прочностью должны отличаться лёгкостью. Дюралюминий, силумин — сплавы алюминия, они незаменимы в самолёто-, вагоно- и кораблестроении.
В некоторых узлах самолётов используются сплавы магния, очень лёгкие и жароустойчивые.
В ракетостроении применяют лёгкие и термостойкие сплавы на основе титана.
Для улучшения ударопрочности, коррозионной стойкости, износоустойчивости сплавы легируют — вводят специальные добавки. Добавка марганца делает сталь ударопрочной. Чтобы получить нержавеющую сталь, в состав сплава вводят хром.
 |  |  |
| Конструкция из стальных балок | Радиаторы центрального отопления | Ажурные перила, отлитые из чугуна |
Инструментальные сплавы
Инструментальные сплавы предназначены для изготовления режущих инструментов, штампов и деталей точных механизмов. Такие сплавы должны быть износостойкими и прочными, причём при разогревании их прочность не должна существенно уменьшаться. Таким требованиям отвечают, например, нержавеющие стали, которые прошли специальную обработку (закалку).
Добавление к сплавам веществ, улучшающих их свойства, называют легированием.
Для придания необходимых свойств инструментальные стали, как правило, легируют вольфрамом, ванадием или хромом.
Применение сплавов в электротехнической промышленности, электронике и приборостроении
Сплавы служат незаменимым материалом при изготовлении особо чувствительных и высокоточных приборов, различного рода датчиков и преобразователей энергии.
Например, на изготовление сердечников трансформаторов и деталей реле идёт сплав никеля. Отдельные детали электромоторов изготавливаются из сплавов кобальта.
Сплав никеля с хромом — нихром, отличающийся высоким сопротивлением — используется для изготовления нагревательных элементов печей и бытовых электроприборов.
Из сплавов меди в электротехнической промышленности и в приборостроении наиболее широкое применение находят латуни и бронзы.
Латуни незаменимы при изготовлении приборов, деталью которых являются запорные краны. Такие приборы используются в сетях подачи газа и воды.
Бронзы идут на изготовление пружин и пружинящих контактов.
 |  |  |
| Нагревательные элементы бытовых электроприборов | Запорные краны для водопроводов и газопроводов | Пружинящие контакты электрических розеток |
Применение легкоплавких сплавов
Главным востребованным свойством легкоплавких сплавов является заданная низкая температура плавления. Это свойство, в частности, используется для пайки микросхем. Кроме того, эти сплавы должны иметь определённую плотность, прочность на разрыв, химическую инертность, теплопроводность.
Легкоплавкие сплавы производят из висмута, свинца, кадмия, олова и других металлов. Такие сплавы используют в термодатчиках, термометрах, пожарной сигнализации, например, сплав Вуда. А также в литейном деле для производства выплавляемых моделей, для фиксации костей и протезирования в медицине.
Сплав натрия с калием (температура плавления \(–\)\(12,5\) °С) используется как теплоноситель для охлаждения ядерных реакторов.
 |  | |
| Припой (сплав для паяния) имеет невысокую температуру плавления | Легкоплавкие сплавы используются в литейном деле | Легкоплавкие сплавы незаменимы в датчиках пожарной сигнализации |
Применение сплавов в ювелирном деле
Применение в чистом виде драгоценных металлов в ювелирном деле не всегда оправдано и целесообразно из-за их дороговизны, физических и химических особенностей.
Для придания ювелирным изделиям из золота большей твёрдости и износостойкости используются сплавы с другими металлами.
Самая лучшая добавка — это серебро (понижает температуру плавления) и медь (повышает твёрдость). Чистое золото используют очень редко, так как оно слишком мягкое, легко деформируется и царапается.
Из сплавов золота с \(10–30\) % других благородных металлов (платины или палладия) изготавливают форсунки лабораторных приборов, а из сплава с \(25–30\) % серебра — ювелирные изделия и электрические контакты.
 | |
| Ювелирные изделия из сплавов золота | Позолоченные электрические контакты |
Сплавы в искусстве
Оловянная бронза (сплав меди с оловом) — один из первых освоенных человеком сплавов металлов. Она обладает большей, по сравнению с чистой медью, твёрдостью, прочностью и более легкоплавка. Бронзы успешно применяют для получения сложных по конфигурации отливок, включая художественное литьё. Классической маркой бронзы является колокольная бронза.Одно из новых направлений в искусстве — производство художественных литых изделий из чугуна. Литые изделия из чугуна существенно превосходят по качеству кованые изделия.
Чугун — металл гораздо более хрупкий и не такой ковкий, как сталь. Но даже из такого, казалось бы, грубого материала можно получать настоящие произведения литейного искусства способом литья, например, такие как литые лестницы или решётки на окна. Такие изделия подвержены лишь поверхностной коррозии и не требуют тщательного ухода.
 |  |  |
Бронзовая скульптура
| Колокола отливают из специального сорта бронзы | Чугунная лестница. Практично и очень красиво |
www.yaklass.ru
Реферат по химии на тему Металлы читать бесплатно
Металлы
Металлами называют химические элементы, которые обладают свойством высокой электропроводности. Атомы металлов могут отдавать определенное количество своих расположенных на внешнем или предвнешних энергетических уровнях электронов, при этом создавая ионы (положительно заряженные частицы).
На сегодня известно 114 химических элементов. Из них 96 – это металлы. Без металлов жизнь на Земле была бы невозможной, так как они в чистом виде или их соединения являются важнейшей составляющей органической и минеральной среды, активно участвуя в процессах жизнедеятельности всех живых организмов.
Молекулы всех металлов, за несколькими исключениями, обладают большими радиусами и малым числом расположенных на внешнем энергетическом уровне электронов. Число таких электронов может быть равно от одного до трех. Исключениями выступают свинец, число электронов на внешнем уровне которого, равняется 4; висмут с 5 электронами; полоний с 6 электронами; германий, сурьма и олово.
Также характерной чертой всех элементов данной группы являются небольшие значения электроотрицательности и возможность восстановления.
Таблица Менделеева делит все элементы на металлы и неметаллы весьма условно. Чтобы выяснить принадлежит ли вещество к металлам, нужно провести диагональ астат-бор. Справа в главных подгруппах будут располагаться неметаллы, а слева – металлы (за исключением инертных газов). Все элементы, которые находятся в непосредственной близости к данной черте, имеют название металлоиды, что означает присутствие у них как металлических свойств, так и неметаллических. Такими элементами являются бор, кремний, мышьяк, германий, теллур, сурьма и полоний.
Также разделяют металлы на переходные и непереходные. Такая классификация исходит из месторасположения элемента в таблице периодичности Менделеева. Переходные металлы относят к побочным подгруппам, а непереходные – к главным. Молекулы металлов главных подгрупп имеют заполненными электронами s- и p-подуровни; а молекулы побочных подгрупп – d- и f-уровни.
По своим химическим свойствам все металлы отличаются легкой отдачей валентных электронов, образуя положительные ионы. Поэтому все металлы в свободном состоянии относятся к восстановителям.
Такая восстановительная способность у каждого элемента своя, и определяется она местоположением металла в электрохимическом ряду напряжения. Этот ряд дает характеристику той химической активности металлов, которую они проявляют при протекании в водной среде окислительно-восстановительных реакций, и имеет следующий вид:
Li K Rb Cs Ca Na Mg Al Mn Zn Cr Cr Fe Ni Sn Pb Cu Hg Ag Pt Ag Pt Au
Самыми первыми в ряду стоят металлы с максимальными восстановительными свойствами и минимальными окислительными способностями. По убыванию у элементов уменьшаются восстановительные свойства и увеличиваются окислительные.
Щелочные металлы могут легко окисляться присутствующим в воздухе кислородом. Также они вступают в реакции с простыми веществами, в то время как медь и железо будут реагировать только при нагревании, а платина и золото не будут окисляться совсем. Некоторые металлы создают оксидную пленку на поверхности, и процесса дальнейшего окисления уже не будет.
см. также: Все рефераты по химии
www.sdamna5.ru
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)