|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Расчет горения угольной пыли. Формула горения угля
Горение угля — Какова формула горения угля? — 22 ответа
Горение угля
В разделе Прочее образование на вопрос Какова формула горения угля? заданный автором Мария Насонова лучший ответ это Уголь + кислород и огонь= Айайайгорячтотокак!!!
Ответ от 2 ответа[гуру]Привет! Вот подборка тем с ответами на Ваш вопрос: Какова формула горения угля?
Ответ от CoBRA7992[гуру]2C+O2--->2COвот так вот !!
Ответ от Ирина Заречкова[новичек]Выяснять химическую формулу угля — тоже самое, что выяснять химическую формулу борща. Уголь (угли, они очень различные и имеют различающийся сотав) — это смесь разных химических веществ, в основном высокомолекулярных полициклических ароматических соединений (аренов) с высоким содержанием углерода. Уголь — это не углерод в чистом виде с кристаллической решеткой, как полагают многие. Наиболее наглядно можно представить уголь как затвердевшую нефть. Ведь нефть также является смесью углеводородов даже с бо́льшим содержанием углерода по отношению к углю, но никто ведь не утверждает, что нефть — это жидкий углерод в чистом виде.Таким образом, если Вас интересует состав конкретной марки угля, то ищите информацию по аренам (антрацен С14Н10 — одна из самых крупных молукул, состоящая из трех бензольных колец, заметно даже по упрощенной формуле большое количество углерода в ней; нафталин С10Н8 — два бензольных кольца; бензол С6Н6 — одно бензольное кольцо; а так же их модификации и прочие варианты). Кроме полициклических углеводородов в углях содержатся в разном количестве вода и минеральные примеси. По содержанию углеводорода угли подразделяются на бурые (65—70 [не более 76] % углерода, до 50 % летучих веществ и около 43 % воды) , каменные (прядка 80 % улерода, до 32 % летучих веществ и до 12 % воды) , антрациты (до 96 % углерода, менее 8 % летучих веществ). Антрацит — этот самый древний, блестящий и плотный уголь, который даже дает название благородным черным оттенкам краски, уже является похожим на то, каким принято считать уголь: чистый углерод, ну слегка загрязненный примесями. Образуются антрациты при повышенных давлении и температуре на бо́льшей глубине, поэтому по составу наиболее близки к графиту, который как раз и является аллотропной модификацией углерода в чистом виде (с кристаллической решеткой) и так же может считаться углем.
Ответ от 2 ответа[гуру]Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru
Химическая формула угля, процесс его образования и использование в промышленности
Уголь в различных своих модификациях может иметь цвет от коричневого до черного. Он является хорошим топливом, поэтому его используют в преобразовании тепловой энергии в электрическую. Образуется он в результате накопления растительной массы и прохождения в ней физико-химических процессов.
Различные модификации угля
Накопление древесной массы в болотистой почве приводит к образованию торфа, который является предшественником угля. Формула торфа достаточно сложная, кроме того, для этой разновидности угля не существует конкретного стехиометрического соотношения. Сухой торф состоит из атомов углерода, водорода, кислорода, азота и серы.
Далее торф при длительном воздействии высокой температуры и больших давлений, возникающих в результате протекания геологических процессов, претерпевает ряд следующих угольных модификации:
- Бурый уголь или лигнит.
- Битум.
- Каменный уголь.
- Антрацит.

Конечным продуктом этой цепи преобразований является твердый графит или графитоподобный уголь, формула которого представляет собой чистый углерод C.
Древесина карбонового периода

Около 300 млн лет назад в карбоновый период большая часть суши нашей планеты была покрыта гигантскими папоротниковыми лесами. Постепенно эти леса вымирали, и древесина накапливалась в болотистых почвах, на которых они произрастали. Большое количество воды и грязи создавали препятствия для проникновения кислорода, поэтому мертвая древесина не разлагалась.
В течение длительного времени вновь отмершая древесина покрывала более старые слои, давление и температура которых постепенно увеличивались. Сопутствующие геологические процессы в конечном итоге привели к образованию залежей угля.
Процесс карбонизации
Термин "карбонизация" подразумевает метаморфические преобразования углерода, связанные с увеличением толщины древесных пластов, тектоническими движениями и процессами, а также с увеличением температуры в зависимости от глубины напластований.
Увеличение давления в первую очередь изменяет физические свойства угля, химическая формула которого остается неизменной. В частности, изменяется его плотность, твердость, оптическая анизотропия и пористость. Увеличение же температуры изменяет саму формулу угля в сторону увеличения содержания углерода и уменьшения кислорода и водорода. Эти химические процессы приводят к увеличению топливных характеристик угля.
Каменный уголь
Эта модификация угля очень богата углеродом, что приводит к высокому коэффициенту теплоотдачи и обуславливает ее использование в энергетической промышленности к качестве основного топлива.
Формула каменного угля состоит из битумных субстанций, дистилляция которых позволяет выделить из него ароматические гидрокарбонаты и вещество, известное под названием кокс, которое широко используется в процессах металлургии. Помимо битумных соединений, в каменном угле много серы. Этот элемент является главным источником загрязнения атмосферы при сжигании угля.

Каменный уголь имеет черный цвет и медленно горит, создавая пламя желтого цвета. В отличие от бурого угля, его теплота сгорания больше и составляет 30-36 МДж/кг.
Формула угля имеет сложный состав и содержит множество соединений углерода, кислорода и водорода, а также азота и серы. Такое разнообразие химических соединений стало началом развития целого направления в химической промышленности – карбохимии.
В настоящее время каменный уголь практически вытеснен природным газом и нефтью, однако два важных его направления использования продолжают существовать:
- основное горючее на тепловых электростанциях;
- источник кокса, получаемого путем бескислородного горения каменного угля в закрытых домнах.
fb.ru
Ответы@Mail.Ru: Какая химическая формула угля?
Каменный уголь - это углерод в чистом виде, просто спрессованный под большим давлением настолько, что молекулы углерода приблизились друг к другу образовав кристаллическую решетку. То есть, чем больше молекул соединены вместе, тем плотнее получается материал. При максимальном сжатии (соединении каждой молекулы со всеми соседними) получается уже не уголь, а алмаз. Таким образом, грифель (уголек в карандаше) , уголь, и алмаз имеют одну формулу "C", а отличаются лишь строением кристаллической решетки. Это ископаемый уголь средней степени углефикации, содержит в горючей массе от 75% до 92 % углерода, от 7 до 72 % летучих веществ. Подразделяется на марки: длиннопламенные, газовые, газово-жирные, жирные, коксово-жирные, коксовые, отощённоспекающиеся, тощие, слабоспекающиеся. Выяснять химическую формулу угля — тоже самое, что выяснять химическую формулу борща. Уголь (угли, они очень различные и имеют различающийся сотав) — это смесь разных химических веществ, в основном высокомолекулярных полициклических ароматических соединений (аренов) с высоким содержанием углерода. Уголь — это не углерод в чистом виде с кристаллической решеткой, как полагают многие. Наиболее наглядно можно представить уголь как затвердевшую нефть. Ведь нефть также является смесью углеводородов даже с бо́льшим содержанием углерода по отношению к углю, но никто ведь не утверждает, что нефть — это жидкий углерод в чистом виде. Таким образом, если Вас интересует состав конкретной марки угля, то ищите информацию по аренам (антрацен С14Н10 — одна из самых крупных молукул, состоящая из трех бензольных колец, заметно даже по упрощенной формуле большое количество углерода в ней; нафталин С10Н8 — два бензольных кольца; бензол C6H6 — одно бензольное кольцо; а так же их модификации и прочие варианты) . Кроме полициклических углеводородов в углях содержатся в разном количестве вода и минеральные примеси. По содержанию углеводорода угли подразделяются на бурые (65—70 [не более 76] % углерода, до 50 % летучих веществ и около 43 % воды) , каменные (прядка 80 % улерода, до 32 % летучих веществ и до 12 % воды) , антрациты (до 96 % углерода, менее 8 % летучих веществ) . Антрацит — этот самый древний, блестящий и плотный уголь, который даже дает название благородным черным оттенкам краски, уже является похожим на то, каким принято считать уголь: чистый углерод, ну слегка загрязненный примесями. Образуются антрациты при повышенных давлении и температуре на бо́льшей глубине, поэтому по составу наиболее близки к графиту, который как раз и является аллотропной модификацией углерода в чистом виде (с кристаллической решеткой) и так же может считаться углем.
С-это углерод, основная составляющая угля.
Это углерод (ну и какие-то примеси присутствуют, конечно).
H(CO3),троечка внизу под кислородом
Подскажите формулу угольного порошка?
touch.otvet.mail.ru
Расчет горения угольной пыли
Горючая масса Буланашского каменного угля.
Состав горючей массы угольной пыли, массовые %
| Сг | Нг | Ог | Nг | Sг | Сумма |
| 80,5 | 5,5 | 11,2 | 1,5 | 1,3 | 100,0 |
Содержание золы Ас = 24,0%, содержание влаги в рабочем (пылевидном) топливе Wр = 2,0%. Принимаем коэффициент избытка воздуха= 1,2.
Температура подогрева вторичного воздуха tвозд= 400°С, доля первичного (холодного) воздуха 30%. Температура угольной пылиtтопл= 50°С.
Определяем состав рабочего топлива.
Содержание золы в рабочем топливе по формуле (0):
Ар = Ас= 24,0= 23,5%
Содержание других элементов в рабочем топливе:
Ср = Сг= 80,5= 80,5·0,745 =60,0%;
Нр = 5,5.0,745 = 4,1%;
Nр = 1,5.0,745 = 1,1%;
Ор = 11,2.0,745 = 8,3%;
Sр = 1,3.0,745 = 1,0%.
Результаты пересчета состава сводим в таблицу.
Состав рабочего топлива
| Компонент | Ср | Нр | Ор | Nр | Sр | Aр | Wр | Сумма |
| Обозначение | С | Н | О | N | S | A | W | |
| Количество, массовые % | 60,0 | 4,1 | 1,1 | 8,3 | 1,0 | 23,5 | 2,0 | 100,0 |
Определяем теплоту сгорания рабочего топлива по формуле (0):
= 339 · 60,0 + 1030 · 4,1 108,9 (8,3 1,0) 25 · 2,0= 23732 кДж/кг.
Тепловой эквивалент согласно формуле (0) составляет:
Эт== 0,810.
Находим теоретически необходимое количество сухого воздуха по формуле (0):
L0 = 0,0889 · 60,0 + 0,265.4,10,0333 (8,31,0) = 6,18 нм3/кг.
Определяем действительное количество воздуха при = 1,2:
Lд= 1,2 · 6,18 = 7,41 нм3/кг.
Определяем количество атмосферного воздуха:
Lд= (1 + 0016d)Lд= 1,016 · 7,41 = 7,53 нм3/кг.
Определяем состав продуктов горения по формулам (0) – (0):
VСО2= 0,01855 · 60,0 = 1,113 нм3/кг;
VSО2= 0,007 · 1,0 = 0,007 нм3/кг;
VН2О= 0,112.4,1 + 0,0124.2,0 + 0,0016·10·7,41 = 0,603 нм3/кг;
VN2= 0,79.7,41 + 0,008.1,1 = 5,863 нм3/кг;
VО2= 0,21.0,2.6,18 = 0,260 нм3/кг.
Общий объем продуктов горения при = 1,2 по формуле (0):
V= 1,113 + 0,007 + 0,603 + 5,863 + 0,260 = 7,85 нм3/кг.
Процентный состав продуктов горения:
CO2 = ·100% = 14,2%; SO2 = ·100% = 0,1%;
Н2O = ·100% = 7,7%; N2 = ·100% = 74,7%;
О2=·100% = 3,3%. Всего 100,0 %.
Составляем материальный баланс процесса горения на 100 кг угольной пыли при = 1,2.
Материальный баланс процесса горения угольной пыли
| Приход | кг | Расход | кг |
| Топливо | 100,0 | Зола (шлак) | 23,5 |
| Воздух: | Продукты горения | ||
| O2 = 100 . 7,41 . 0,21 . 1,429 | 222,0 | CO2 = 100 .1,113 . 1,977 | 220,0 |
| N2 = 100 . 7,41.0,79.1,251 | 731,0 | h3O= 100.0,603.0,804 | 48,4 |
| h3О = 100 . 0,0016 . 10 . 7,41. 0,804 | 9,5 | N2= 100.5,859 . 1,251 | 732,0 |
| O2 = 100 . 0,26 . 1,429 | 37,2 | ||
| SO2 = 100 . 0,007 . 2,852 | 2,0 | ||
| Невязка | -0,6 | ||
| Итого: | 1062,5 | Итого: | 1062,5 |
Невязка баланса составляет: = 0,056%.
Определяем теоретическую температуру горения угольной пыли. Для этого находим общее теплосодержание продуктов горения с учетом подогрева угольной пыли до 50°С (теплоемкость Суг.пыли= 0,92 кДж/(кг К)) и подогрева вторичного воздуха (70% от общего количества воздуха). Поi–t-диаграмме (рис. 1) находим теплосодержание воздуха приtвозд = 400°С:iвозд.= 536 кДж/нм3, тогда по формуле (0):
i общ = ++= 3393 кДж/нм3.
По i–t-диаграмме находим теоретическую температуру горения (при коэффициенте= 1,20)tтеор= 1970°С.
Расчетное теплосодержание продуктов горения с учетом пирометрического коэффициента = 0,75:
iобщ = i общ. = 3393.0,75 = 2545 кДж/нм3.
По i–t-диаграмме (рис. 2) находим действительную температуру горенияtдейств= 1570°С.
studfiles.net
Горение угля в кислороде - Справочник химика 21
Опыт 31. Горение угля в кислороде [c.28]Поскольку гетерогенные процессы проходят на поверхности раздела фаз, то величина поверхности играет существенную роль в течении данного процесса. Например, горение угля в кислороде будет протекать с различной скоростью, если сжигаемый уголь находится в виде больших кусков или в виде пыли. Вот почему предпочтительнее сжигание пылевидного топлива. По этой же причине в форсунках проводят распыление (разбрызгивание) нефтяного горючего — создается наибольшая поверхность — процесс горения проходит более интенсивно. [c.163]
ГОРЕНИЕ УГЛЯ В КИСЛОРОДЕ [c.16]Оксид углерода (IV) — продукт горения угля в кислороде (или в избытке кислорода) [c.324]
Запись данных опыта. Написать уравнение реакции горения угля в кислороде. К какому типу окислов относится полученная двуокись углерода Написать уравнение ее взаимодействия с водой. [c.128]
Положить в ложечку для сжигания небольшой кусочек древес- ного угля, накалить и внести в банку с кислородом. Как изменяется интенсивность горения угля в кислороде [c.47]
Горение угля в кислороде. Этот опыт описан в разделе Кислород . [c.222]
Выполнение работы. Сделать из металлической проволоки не большую петельку и укрепить в ней кусочек древесного угля. Накалить уголь в пламени горелки и внести в пробирку с кислородом. Написать уравнение реакции горения угля в кислороде. К какому типу оксидов относится полученный диоксид углерода Написать уравнение взаимодействия его с водой. [c.168]
Внесите в первый цилиндр тлеющую лучинку или уголек на ложке для сжигания. Наблюдайте горение угля в кислороде. Напишите уравнение реакции. [c.21]
Чем внешне отличается горение угля в кислороде от горения его на воздухе [c.37]
Несмотря на внешнее различие, механизм рассматриваемой реакции сходен с механизмом горения угля в кислороде, СОг и в парах воды. Хотя речь идет в данном случае не об уничтожении, а о возникновении твердой фазы, но этот достаточно сложный процесс образования кристаллов графита может начаться лишь после того, как появятся атомы углерода. [c.248]
Реак г,ию соединени я возмоя но рассматр1н ать и на примере горения угля в кислороде (данная реакция, как и получение сернистых металлов, является окислмтельио-восстаповител >ной). Для этого в цилиндре или стакане, заполненном кислородом, сжигают кусочек древесного угля. Рассматривают данную реакцию как соединение углерода с кислородом, в результате чего получается новое вещество — углекислый газ, который можно обнаружить при помощи известковой воды (это известно учащимся из уроков ботаники). [c.31]
chem21.info
Уголь, сжигание - Справочник химика 21
Отработанный активный уголь Сжигание [c.285]УГОЛЬ, ЕГО СЖИГАНИЕ И ХИМИЧЕСКАЯ ПЕРЕРАБОТКА [c.265]
Рассчитать и выбрать нормализованную печь по условиям, приведенным в табл. 11.7. Температура топлива на входе в печь = 20° С температура воздуха, подаваемого на сжигание, = 50 С угол естественного откоса я] = 40- -45°. [c.332]
Конструкция АГГ разработана на принципиально новой теоретической основе с применением акустического резонатора, создающего мощный вихревой эффект смешения топливного газа с атмосферным воздухом. Сочетание враш,ательного и поступательного движения газовоздушной смеси приводит к появлению зоны осевых обратных токов, росту центробежных сил, интенсивному перемешиванию компонентов и пропорциональному распределению газа в объеме окислителя. На выходе из горелки вихревым движением смеси создаются большой угол раскрытия зоны горения и настил пламени на излучающую стенку огнеупорной кладки топки с малой осевой дальнобойностью, а наличие зоны разрежения по оси закрученного потока способствует возникновению встречного высокотемпературного потока дымовых газов из топки, который стабилизирует фронт настенного горения (иначе называемого настильное сжигание топлива ). [c.65]
Получение тепловой энергии от сжигания топлива. Основным источником тепловой энергии для печей является топливо. Топливом называется вещество, которое при нагревании в присутствии кислорода активно окисляется (сгорает) с выделением значительного количества тепла. Наибольшее значение для промышленных печей имеет углеродистое топливо. Углеродистое топливо бывает твердое, жидкое и газообразное. По происхождению топливо подразделяется на природное и искусственное. Основные разновидности топлива — уголь, нефть и природный газ. [c.13]В первом приближении можно сопоставить реальные потоки с движением в двух модельных поточных реакторах кубовом и трубчатом. Напрпмер, в печи для сжигания угля газовый поток подобен потоку в трубчатом реакторе. Уголь постепенно потребляется, и реакционная зона медленно движется в направлении газового потока. Если уголь более или менее непрерывно загружают в печь, а золу непрерывно удаляют из нее, то такой процесс близок к идеальному процессу в трубчатом реакторе. [c.39]
Коксовая мелочь обычно является побочным продуктом, т. е. остатком, получающимся в результате грохочения кокса на сите с отверстиями около 10 мм. Недостаток коксовой мелочи вынуждает иногда измельчать мелкие классы кокса для ее получения. Можно также производить коксовую мелочь путем коксования в кипящем слое. Лишь в данном процессе имеется в виду коксование при частичном сжигании с воздухом. Для производства коксовой мелочи, температуру следует доводить, по крайней мере, до 800° С. Варианты зависят от того, каким образом уголь сушат, нагревают или иногда окисляют, возможно за счет рекуперации тепла реакций. Выбор варианта влияет на издержки производства кокса, но практически никак не влияет на его свойства. [c.255]
Коксовые печи относятся к печам косвенного нагрева — в них теплота к коксуемому углю от греющих газов передается через стенку. Коксовая печь, или батарея (рис. 14), состоит из 61—77 параллельно работающих камер, представляющих собой длинные, узкие каналы прямоугольного сечения, выложенные из огнеупорного кирпича. Каждая камера имеет переднюю и заднюю съемные двери (на чертеже не показаны), которые в момент загрузки камеры плотно закрыты. В своде камеры находятся загрузочные люки, которые открываются при загрузке угля и закрыты в период коксования. Уголь в камере нагревается через стенки камеры дымовыми газами, проходящими по обогревательным простенкам, находящимся между камерами. Горячие дымовые газы образуются при сжигании доменного, обратного коксового или, реже, генераторного газов. Теплота дымовых газов, выходящих из обогревательного простенка, используется в регенераторах для нагрева воздуха и газообразного топлива, идущих на обогрев коксовых печей, благодаря чему увеличивается тепловой КПД печи. При работе коксовой камеры следует обеспечить равномерность прогрева угольной загрузки. Для этого необходимо равномерно распределить греющие газы в обогревательном простенке и правильно выбрать габариты камеры. Равномерное распределение греющих газов достигается разделением обогревательных простенков вертикальными перегородками на ряд каналов, называемых вертикалами. По вертикалам движутся греющие газы, они отдают теплоту стенкам камеры и уходят в регенераторы. При установившемся режиме количество теплоты Q, переданное за единицу времени, в печах косвенного нагрева определяется по уравнению [c.40]
Каменный уголь всегда содержит около 1—3% серы. При сжигании угля в топках сера сгорает и выделяется в виде SO2 в атмосферу. Разработаны абсорбционно-десорбционные способы обезвреживания дымовых газов, при которых ЗО2 извлекается из газа и может быть использована для производства серной кислоты, Однако себестоимость диоксида серы, извлеченной из дымовых газов, в несколько раз выше, чем полученной обжигом колчедана, поэтому она используется лишь в ничтожной степени. Во всем мире выбрасывается в атмосферу диоксида серы в 2 с лишним раза больше, чем используется в мировом производстве серной кислоты. [c.117]
Применяемый уголь содержит 23,5% золы. При сжигании [c.395]
Важное практическое и теоретическое значение имеют процессы превращения, которые претерпевают сернистые соединения при сжигании твердого топлива и при его нагревании без доступа воздуха. Было отмечено, что при сжигании углей окисляется вся органическая, а также элементарная и пиритная сера с образованием ЗОг и частично 0з, которые улетучиваются с дымовыми газами. Только небольшая часть этой серы, а также и содержащаяся в углях сульфатная сера остаются в шлаке в виде сульфатов. Сера, которую содержит уголь, приносит большие убытки народному хозяйству. При использовании угля в энергетических целях сера снижает его теплоту сгорания. Кроме того, превращение серы в 50г и 50з наносит значительный вред большим городам и уничтожает растительность в районах крупных промышленных центров, где расположены мощные тепловые электростанции. [c.110]
При сжигании угля весь азот выделяется в свободном состоянии и отчасти в виде окислов. Поэтому азот рассматривают как инертную составную часть, когда уголь используется для горения. В процессах газификации и коксования твердого топлива азот выделяется в виде летучих соединений (главным образом — аммиака), которые находят широкое применение. [c.123]
Штраус [824] предложил другой тип активированного угля, обладающего аналогичными свойствами. Такой уголь изготовляют экструзионным гранулированием пламенного угля. Последний получают из каменноугольной омолы, к которой до- ее сжигания в строго контролируемых условиях добавляются активирующие добавки. [c.178]
На производство пара и электроэнергии затрачивается достаточно большое количество топлива, которое к потребителю поступает по магистральным газо- и нефтепроводам, а также по железной дороге (уголь, мазут). Для крупномасштабного производства пара и электроэнергии СНГ не используются, так как сжигание в кот- [c.325]
Опыт 19. Сжигание металлов и неметаллов в атмосфере диоксида азота (ТЯГА ). В два толстостенных стеклянных цилиндра наберите диоксид азота. Магний (медь, цинк) предварительно нагрейте до 200—300° С и внесите в цилиндр. Подожгите серу (фосфор, уголь) и вносите в атмосферу диоксида азота. Объясните наблюдаемое. [c.68]
Ископаемый уголь используется как непосредственно для сжигания, так и для переработки в более ценные виды топлива — кокс, жидкое горючее, газообразное топливо. [c.652]
У сплошных не слишком малых частиц твердого тела, как кристаллических, так и аморфных, доля поверхностного слоя невелика. Однако она может быть увеличена на несколько порядков, если твердое тело имеет пористую структуру. Такими телами являются, например, активированный уголь и силикагель. Первый получается путем сжигания древесины при малом доступе воздуха. При этом основная масса древесины обугливается. Однако часть материала сгорает и улетучивается, оставляя многочисленные поры. Силикагель получается обезвоживанием геля кремниевой кислоты. Как уже указывалось в 8.5, гель представляет собой сетку, образованную полимерными молекулами, в данном случае молекулами кремниевой кислоты, с захваченными в большом количестве молекулами воды. У таких материалов поверхность может достигать сотен квадратных метров па грамм адсорбента, и это делает возможным адсорбцию значительного количества газа или растворенного вещества. [c.315]
Применение топлива. Практически нет ни одной отрасли на родного хозяйства, в которой бы ни использовалось топливо Наибольшее количество топлива расходуется электростанциями транспортом, промышленными печами и аппаратами. На тепло вых электростанциях используется твердое (уголь, сланцы и др.) жидкое и газовое топливо. Основным видом жидкого топлива применяемого на электростанциях и в промышленности, является мазут. На новых тепловых электростанциях в нашей стране нефтепродукты в качестве топлива практически уже не используются. Коэффициент использования топлива в промышленных печах и аппаратах, как правило, невелик. Поэтому важнейшей задачей, стоящей перед инженерами, является снижение расхода топлива путем создания новых технологических процессов, новых аппаратов и печей, устранения потерь топлива. Примером экономичных аппаратов могут служить каталитические генераторы теплоты, разработанные в СССР под руководством академика Г. К. Борескова. Процесс сжигания топлива происходит в присутствии катализаторов по схеме [c.384]
Поскольку гетерогенные процессы проходят на поверхности раздела фаз, то величина поверхности играет существенную роль в течении данного процесса. Например, горение угля в кислороде будет протекать с различной скоростью, если сжигаемый уголь находится в виде больших кусков или в виде пыли. Вот почему предпочтительнее сжигание пылевидного топлива. По этой же причине в форсунках проводят распыление (разбрызгивание) нефтяного горючего — создается наибольшая поверхность — процесс горения проходит более интенсивно. [c.163]
Оборудование и реактивы. Колба, заполненная кислородом, металлическая ложечка длл сжигания , горелка древесный уголь. [c.16]
Идея использования химической энергии окисления (сжигания) горючих веществ, в частности природного топлива, для непосредственного получения электроэнергии в гальваническом элементе уже давно привлекает внимание исследователей [32]. В настоящее время к группе топливных элементов относят не только элементы, использующие в качестве активных материалов кислород, уголь или другие горючие материалы, но и все гальванические системы, в которых активные материалы вводятся в элемент извне по мерс их расходования. [c.564]
Частично животные и растительные остатки превращались в горючие ископаемые каменный уголь, нефть, природные газы. Горючие ископаемые извлекаются человеком из недр земли и используются как топливо. В результате сжигания в топках печей содержащийся в них углерод опять-таки возвращается в атмосферу в составе продукта горения — двуокиси углерода. [c.101]
Какой объем воздуха потребуется для сжигания угля массой 10 кг Объемная доля кислорода в воздухе составляет 21%. Уголь содержит углерод (массовая доля 96%), серу (0,8%) и негорючие примеси. Объем воздуха 118 [c.118]
Снсигание простых спиртов производится легко если они в твердом виде, то они сжигаются непосредственно, если же они н идкие, то их сжигают в маленькой лампочке при посредстве асбестового фитиля, который сам не горит. Но сжигать твердые неплавкие тела, каковы сахар, крахмал и другие, представляет затруднение, потому что они при сжигании разлагаются и выделяют не только много газов, но и уголь, сжигание которого вполне невозможно, что более или менее точному определению вредит, и поэтому придумывали много способов сжигания твердых сложных тел. Из них укажем на сжигание с бертолетовой солью в особых калориметрах производится вспышка смеси твердого тела с бертолетовой солью. Вычисление производится по остатку, но это вычисление не- [c.211]
Предположим, что электростанция в час сжигает 1,0 10 кг (или 1000 метрических тэнн 1 метрическая тонна = 1000 кг = 1-10 г) угля. Уголь содержит 3,0 масс. % серы. Если при сжигании сера превращается в 802(газ), сколько молей 802(газ) будет выброшено в атмосферу за один час Сколько тонн [c.417]
Пример 11.1. Рассчитать и подобрать нормализованную барабанную вращающуюся печь по следующим исходным данным производительность печи по готовому продукту О = 2600 кг время пребывания материала в печи т = 4ч температура материала на входе в печь t = Ю °С, на выходе из печи = 1000 °С температура отходящих газов = 350 °С температура топлива на входе в печь = 20 °С температура воздуха, подаваемого на сжигание, = 50 °С плотность материала = 2700 кг/м насыпная плотность материала Рн = 1900 кг/м угол естественного откоса 1 ) = 40° темплоемкость продукта = 1250 Дж/(кг- К) начальное влагосодержание сырья w, = 0,3 максимальный радиус уносимых частиц Гц=2-10 м унос из материала готового продукта Хун = 0,2, летучих продуктов = 0,15 плотность летучих продуктов Рд = 1,2 кг/м теплоемкость летучих Сд = = 1400 Дж/(кг-К). Вид топлива — газ месторождения Ставро-польское-1. Теплотой реакции обжига можно пренебречь. [c.320]
Пример 11.2. Рассчитать и подобрать нормализованную вращающуюся муфельную печь по следующим исходным данным производительность печи по готовому продукту О = 800 кг/ч время пребывания материала в печи г = 2 ч температура материала на входе в печь = 20 °С на выходе из печи = = 600 °С температура отходящих газов = 300 °С температура топлива на входе в печь = 20 °С температура воздуха, подаваемого на сжигание, д = 50 °С насыпная плотность материала Рн = 1900 кг/м угол естественного откоса материала г(з = 40° теплоемкость продукта Сп = 1300 Дж/(кг-К) начальное влагосодержание сырья = 0,3 кг/кг ,, унос летучих из материала Хт=0,1 кг/кг Iплотность летучих г рд=1,2 кг/м теплоемкость летучих Сл = 1350 Дж/(кг К) вид топлива — мазут. [c.328]
В настоящее время в общем газовом анализе часто применяют сжигание свободным кислородом в присутствии катализаторов. Из больного числа исследованных катализаторов наилучшие результаты получены с металлическими платиной и палладием. Пал.тгадий и платину применяют в виде проволочной спирали, впаянной в верхнюю часть стеклянной шшетки (рис. 4), или в осанчденнсм виде на носителях (асбест, активированный уголь, керамика), С лучшими образцами катализаторов этого типа [2,31 водород количественно окисляется при комнатной температуре, а метан сгорает при 400—500° С. [c.29]
Топливом для проведения реакции служит природный газ. Горючая газовоздушная смесь приготавливается в горелке. Сжигание топлива осуществляется в горелочном камне и в реакционной камере. Форсунка установлена на откатной тележке под углом 5°. Угол наклона форсунки может изменяться, В верхней части горел очного камня имеется отверстие для распылительной форсунки, в которую подается 56% раствор СаС12- [c.103]
Этот метод заключается в сжигании угольной пробы в электрической печи ири температуре 1200—1250° С в присутствии фосфата железа или при температуре 1300—1350° С в присутствии окиси алюминия. Образующиеся серный и сернистый ангидриды поглощаются перекисью водорода, и их концентрацию определяют ацидометри-ческим методом, за вычетом соляной кислоты, которая образуется, если уголь содержит хлор. В случае угля с высоким выходом летучих веществ сжигание его можно осуществлять в две стадии, заключающиеся в удалении летучих веществ в аргоне с последующим сжиганием их в кислороде, затем сжиганием и образующегося коксового остатка [38]. Такой способ работы более прост, чем способ непосредственного сжигания всей пробы угля. [c.50]
На рис. 6.2 показана схема установки для отдувки летучего компо - из сточных вод продуктами сжигания природного газа. Топочные газы, нась к 1 ные в скруббере 1 парами летучего вещества, проходят через колонну 2 с акти углем, где летучий компонент задерживается. Активный уголь, насыщенны аь тучим компонентом, периодически регенерируется паром. Парй воды и лет компонента конденсируются в холодильнике 3 и направляются в сборик- откуда летучий компонент подается на утилизацию. [c.339]
Метод определения элементного состава золы с помощью эмиссионного анализа [165 состоит в получении спектров элементов золы на спектрографе ИСП-28 при сжигании их в дуге угольных электродов. Навеску золы смешивают с основой (фтористый литий и уголь) в определенных соотношениях. Методика позвиляет одновременно определять присутствие и количество 23 элементов Ре, РЬ, 2п, Си, 8п, Са, М , Ва, А1, 81, Р, Т1, V, Сг, Со, Ч, 5г, Мо, g, Сс1, 5Ь. В1 и 2г. [c.190]
| Рис. 6.11. Схема способа Когаз 1, 2, 3, 4,-ступени полукоксования 5-аппарат для сжигания полукокса 6, 7-сепараторы 1-уголь П-газ полукоксования П1-сьфой газ 1У-водяной газ У-пар УТ-полукокс УП-воздух УПГ-шлак 1Х-пьыь Х-дымовой газ | 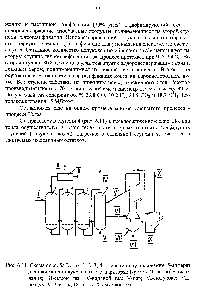 |
Для поддержания реакции образования водяного газа уголь подвергают сжиганию, при котором он раскаляется до необходимой температуры за счет теплоты реакции. Затем прекращают доступ воздуха и пропускают водяной пар над раскаленным углем. По охлаждении угля (так как реакция образования водяного газа сопровождается поглощением 117,1 кджна. 1 моль оксида углерода) в печь вместо водяного пара нагнетают воздух и т. д. [c.480]
Для работы требуется Прибор (см. рис. 52, пробирка прибора имеет отверстие в дне). — Прибор (см. рис. 54). — Газометр с кислородом. — Аппарат Киппа. — Барометр. — Термометр комнатный. — Линейка металлическая. — Цилиндр мерный емк. 250 мл. — Пробка с газоотводной трубкой. — Стекла к цилиндрам, 2 шт. — Воронка. — Ванна стеклянная. — Лучины..— Хлорат калия. — Двуокись марганца. — Перманганат калия. — Персульфат аммония. — Цинк, гранулированный. — Уголь кусковой. — Сера кусковая. — Эфир серный.—Азотная кислота концентрированная.— Серная кислота разбавленная (1 6). — Перманганат калия, 0,1 н. раствор. — Иодид калия, 0,5 н. раствор. — Ацетат свинца, 0,5 н. раствор. — Едкий натр, 2 н. раствор. — Сульфид натрия, 1 н. раствор. — Хлорид марганца, 0,5 н. раствор. — Раствор индиго или индиго красного. — Вата. [c.157]
Какой объем воздуха потребуется для сжигания угля массой 10 кг Объемная доля кислорода в воздухе составляет 21 %. Уголь содержит углерод (массовая доля 96%), серу (0,8%) и негорючие примеси. Объем воздуха рассчитайте при температуре 30°С и давлении 202,6 кПа. Omaim 47,36 м . [c.96]
Уголь — твердое вещество со скрытокристаллической и разу-порядоченной структурой графита. Плотность его 1,8—2,1 г/см , температура плавления 3500°С (при остывании превращается в графит). Уголь растворяется в расплавленных металлах (например, в железе), а при затвердевании их выделяется в виде кристаллов графита. Наиболее чистый уголь — это сажа, получаемая сжиганием органических веществ в условиях недостатка воздуха. [c.320]
Двуокись теллура образует бесцветные кристаллы, плавящиеся при 733° С, переходя в темно-красную жидкость ДЯ испарения ее 55 ккал/моль, а теплота плавления 3 ккал/моль. Получается двуокись теллура при обезвоживании теллуристой кислоты, при сжигании Те в кислороде и при разложении 2Те0г НЫОз при 400° С. В воде ТеОг хорошо растворяется при 500° С ТеОг окисляет уголь, алюминий, цинк. [c.217]
chem21.info
Формула угля в химии
Определение и формула угля
Строение атома углерода приведено на рис. 1. Помимо древесного угля, углерод может существовать в виде простого вещества алмаза или графита, принадлежащих к гексагональной и кубической системам, кокса, сажи, карбина, поликумулена графена, фуллерена, нанотрубок, нановолокон, астралена и т.д.
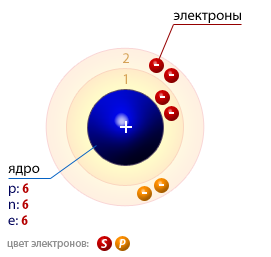
Рис. 1. Строение атома углерода.
Химическая формула угля
Химическая формула угля – С. Она показывает, что в составе молекулы этого вещества находится один атом углерода (Ar = 12 а.е.м.). По химической формуле можно вычислить молекулярную массу угля:
M(С) = Mr (С) × 1 моль = 12,0116 г/моль
Структурная (графическая) формула угля
Более наглядной является структурная (графическая) формула угля. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 2).
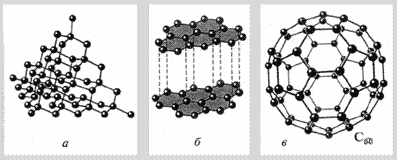
Рис. 2. Строение аллотропных модификаций углерода: а) алмаза; б – графита; в) – фуллерена.
Электронная формула
Электронная формула, показывающая распределение электронов в атоме по энергетическим подуровням показана ниже:
6С 1s22s22p2
Она также показывает, что углерод относится к элементам р-семейства, а также число валентных электронов — на внешнем энергетическом уровне находится 4 электрона (2s22p2).
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)