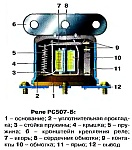
|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Энциклопедия по машиностроению XXL. Кривые охлаждения и нагревания чистого железа
Металлы кривые охлаждения и нагревания
ВНОСИТ большие затруднения и не позволяет применять к ним динамические методы. Если к металлам можно применять как метод кривых нагревания, так и метод кривых охлаждения, то в случае силикатов Егер исключает применение кривых охлаждения. Кривые же нагревания можно использовать в определенных специфических условиях. [c.370] На рис. 63 представлены кривые нагревания и охлаждения чистого металла. При температуре Т на кривых возникает горизонтальный участок, свидетельствующий об остановке температуры. Температура, которая указывает на какое-нибудь превращение, совершаемое в системе, называется критической точкой [176]. [c.159] На рис. 71 представлены кривые нагревания и охлаждения чистого металла. При температуре Т на кривых возникает [c.177]Важные сведения о свойствах металлов дают так называемые кривые нагревания (при плавлении металла) и к р и-вые охлаждения (при затвердевании металла). Для построения таких кривых измеряют температуру металла через определенные равные промежутки времени. [c.50]
Для высоких температур, при исследовании металлов, силикатов и некоторых других химических соединений, большое значение имеет другой метод, основанный на наблюдении за скоростью изменения температуры при охлаждении или нагревании системы и на построении кривых зависимости температуры от времени. [c.200]Для исследования влияния температуры на действие противозадирных присадок полезно использовать термографический метод анализа, позволяющий судить о температуре, при которой происходит химическая реакция между металлом и исследуемыми веществами. Критерием является нарушение плавного хода кривых нагревания или охлаждения, возникающее вследствие выделения или поглощения тепла в результате протекания реакции [231]. [c.175]
Изучением оптимальной температуры прокаливания осажденного золота занимался целый ряд исследователей. Исин [424] )екомендует температуру выше 230°, Киба и Икеда [425] — 700°. Ламп, Фоконье и Дюваль [426] пытались объяснить выбор разной температуры прокаливания. Предполагают, что некоторое влияние оказывает окклюдированный органический восстановитель. Дюваль, наблюдая явление, до сих пор не нашедшее объяснения, писал, что золото адсорбирует кислород в количестве, зависящем от природы осадителя и атмосферы, в которой проводится нагревание. Поглощение кислорода сопровождается увеличением веса металла примерно на 1%. Этот процесс обратим, и если кривая охлаждения идентична кривой нагревания, то количество освобождающегося кислорода равно поглощенному при нагревании. Наиболее отчетливо такое взаимодействие с кислородом заметно при прокаливании золота, осажденного пирогаллолом. [c.74]
Как известно, для перевода металла из одного полиморфного оостояния в другое необходимо затратить некоторое. количество теплоты, если этот переход наблюдается при повышении температуры и, наобор.от, перестроенный уже -металл при охлаждении выделит эту теплоту при переходе из одного состояния в другое. Эти переходы должны отмечаться остановками на кр ивых охлаждения. Для цинка самые тщательные опыты не обнаружили таких остановок на кривых застывания. На рис. 33 [130Т приведены кривые нагревания и охлаждения цинка, полученные параллельно путем прям й и диференцяальной записи, показывающие отсутствие остановок, соответствующих полиморфным превращениям. [c.168]
Летучий компонент испаряется и вступает во взаимодействие с расплавом металла. После установления равновесия при постоянном давлении летучего компонента температуру горячей зоны Т постепенно снижают, одновременно регистрируя наступление начала кристаллизации визуально или при помощи автоматической записи кривых температура (разность температур) — время. Температура фазового перехода обычно отме-. чается как при охлаждении, так и при нагревании системы (кривые охлаждения и нагревания). После нахождения точки трехфазного равновесия устанавливается более высокое давление в системе (повышением температуры Т1), вновь регистрируется равновесная точка трехфазного равновесия. Таким способом получают Р-Г-проекцию фазовой диаграммы. [c.241]
Принято считать, что в обычных условиях типичные металлы обладают фиксированной температурой перехода твердая фаза жидкость. Однако если металл подвергнуть непрерывному у-облучению, то температура фазового перехода понижается, причем при кристаллизации в большей степени, чем при плавлении. Это наглядно видно из рис. 7.17, на котором приведены термографические кривые, полученные Б. А. Данильченко, М. П. Круликовской, Л. И. Чирко для лития при постоянной интенсивности у-источника. Цифры указывают очередность нагревания и охлаждения образца без 7-излучения и под облучением. Видно, что под влиянием 7-сблучения температура перехода жидкая твердая фаза понижается по сравнению с наблюдаемой в обычных условиях. При этом обнаруживается гистерезис температур плавления и кристаллизации, т. е. степень влияния 7-облучения на процесс предкристаллизации и предплавления неодинакова. Можно предположить, что понижение температуры кристаллизации расплава обусловлено нарушением ближнего порядка за счет ослабления межатомных связей. При этом усиливается различие между структурой твердого и жидкого металла под действием 7-излучения. [c.199]
Влияние суспендированных твердых частичек онределяется прежде всего размером их. Так, при добавлении самого незначительного количества (следов) хлорного золота к расплавленнному стеклу оно остается бесцветным или желтоватым после охла к-дения, но при повторном нагревании стекло приобретает густой синевато-красный цвет рубинового золота. Перегрев изменяет цвет до темнокоричневого в отраженном свете и синего—в нрохо-дяш ем свете. Такая окраска стекла возникает благодаря наличию в стекле коллоидного золота (стр. 127). Вследствие высокого разбавления соли золота размер частичек вначале так мал, что их влияние на окраску незначительно. При подогревании происходит коагуляция или аггломерация частичек, вызывающая явления коллоидной окраски. Перегрев способствует увеличению размера частичек и соответственно понижает интенсивность окраски, особенно синих и красных компонентов. Меднорубиновое стекло получается таким же образом при применении закиси меди СпаО, повидимому, растворяющейся при высокой температуре, но нерастворимой при низкой, или, возможно, восстанавливающейся до металла. Здесь опять-таки для возникновения окраски необходимо повторное нагревание. Окись селена дает красную окраску без повторного нагревания. Матовые бесцветные стекла получаются при добавках плавикового шпата, криолита или фосфорнокислого кальция в виде костяной золы. Избыток окисей олова, цинка или алюминия производит такое же действие, но в меньшей степени. Прежде опаловые стекла вырабатывались из сплавов, в которых нерастворимые вещества выделялись при охла-,кденпи стекла самопроизвольно. Теперь есть возможность управлять этим процессом, создавая сплавы, в которых рост кристаллов опалесцирующих компонентов определяется кривой 2 рис. 9, а скорость образования зародышей — кривой А того же рисунка. При охлаждении стекла в области ниже кривой А в течение заданного периода времени может возникнуть [c.306]
Термический анализ — важный метод физико-химического анализа (см. стр. 7). Он основан на определении температур фазовых превращений и применяется для чистых веществ и. цля систем из двух или большего числа компонелтов. Существуют различные разновидности термического анализа. В простейших случаях определение производят путем зрительного наблюдения. Это — визуальный метод термического анализа он заключается в том, что,при медленном нагревании или охлаждении отмечают температуру, при которой происходит выделение или исчезновение данной фазы (например, выделение первых кристаллов растворенного вещества из раствора при определении растворимости), Этот метод успешно применяется при изучении прозрачных веществ при не слишком высоких температурах. Для высоких температур, при исследовании металлов, силикатов и некоторых других химических соединений, большое значение имеет другой метод, основанный на наблюдении за скоростью изменения температуры при охлаждении или нагревании системы и на построении кривых зависимости температуры от времени. [c.190]
Как,было установлено [17], с катионом хрома (HI) образуются три комплексных соединения. Трехвалентный хром реагирует с этилендиаминтетрауксусной кислотой при комнатной температуре очень медленно. При нагревании или активации следами ионов хрома (II) образуется фиолетовый комплексонат хрома (III). При охлаждении сильно концентрированных растворов выделяются кристаллы состава ( ioHjgOsNa) НзО или rHY HgO. Вода связана координационно, так как не выделяется при нагревании до 100° и даже в высоком вакууме. При потенциометрическом титровании этого соединения щелочью оно ведет себя как одноосновная кислота, ион водорода которой нейтрализуется уже при pH ниже 3, и не происходит изменения окраски. Это доказывает, что ближайшая сфера атома металла не подвергается изменению. При дальнейшей нейтрализации форма кривой значительно изменяется при рК 7,5, что сопровождается переходом фиолетовой окраски в синюю. В этом случае нейтрализуется ион водорода из молекулы воды и комплексное соединение превращается в гидроксокомплекс. Весь процесс можно схематически выразить следующим образом [c.31]
Структурные превращения в металлах и сплавах сопровождаются выделением или поглощением скрытой теплоты превращения (например, при расплавлении металшов поглощается скрытая теплота плавления) или же связаны с аномальной удельной теплоемкостью, которая наблюдается, например при образовании сверхструктуры в Р-латуни. Отсюда следует, что при нагревании или охл1аждении металла или сплава в одинаковых условиях структурные изменения должны вызвать изменение хода кривой температура — время. По перегибу кривой можно найти температуру структурного превращения. В условиях истинного равновесия температура (или температурный интервал), при которой происходит данное структурное превращение, является постоянной дл я данного металла ил1и сплава, но практически часто наблюдается температурный гистерезис структурного превращения. Например, при медленном охлаждении в условиях истинного равновесия жидкое олово затвердевает при постоянной температуре 231,9 но в обычных опытах часто оказывается возможным, прежде чем начнется кристаллизация, охладить жидкое олово на 20 или 30° ниже его истинной температуры затвердевания. Эго явление обычно называется переохлаждением. Переохлаждение является результатом кристаллизации, происходящей путем зарождения центров и их роста. [c.120]
chem21.info
Построение кривых охлаждения сплавов Железо-Цементит
Цель работы: ознакомление с принципами построения диаграмм состояния сплавов; изучение диаграммы состояния железо-цементит и превращений в железоуглеродистых сплавах в равновесных условиях. Оборудование, приспособления, инструмент, материалы: диаграмма железо-цементитТеоретические сведения Имеется много методов построения диаграммы состояния (дилатометрический, электрический, магнитотермический, термический и др.). Сущность любого из них сводится к нахождению критических точек при нагреве или охлаждении металлов и сплавов. Критическими точками называются температуры, при которых начинаются и/или заканчиваются какие-либо превращения в сплавах. Определив экспериментально критические точки серии сплавов, строят полную диаграмму состояния в координатах "температура – концентрация". Диаграмма состояния железо-цементит (рисунок) охватывает сплавы, содержащие углерод в количестве от 0 до 6,67 %. При содержании 6,67 % углерода он образует химическое соединение с железом Fe3C – карбид железа, называемый также цементитом. Один из компонентов сплавов – железо – имеет несколько аллотропических модификаций: - до 911°С железо имеет объемно-центрированную кубическую кристаллическую решетку(ОЦК) с периодом 0,286 нм; - в интервале температур 911…1392 °С – гранецентрированную кубическую (ГЦК) кристаллическую решетку, а выше 1392 °С – снова объемноцентрированную кубическую кристаллическую решетку, но с другим периодом – 0,293 нм. В зависимости от содержания углерода железоуглеродистые сплавы подразделяются на техническое железо (≤0,02 % С), углеродистые стали (от 0,02 до 2,14 % С) и чугуны (от 2,14 до 6,67 % С). Стали подразделяются на доэвтектоидные (0,02-0,8 % С), эвтектоидные (0,8 % С), заэвтектоидные (0,8…2,14 % С). Чугуны по содержанию углерода классифицируются на доэвтектические (2,14…4,3 % С), эвтектические (4,30 % С), заэвтектические (4,30…6,67 % С). Процессы, происходящие в сплавах при их фазовых превращениях, подчинены общему закону равновесия, который носит название правила фаз и выражает зависимость числа степеней свободы системы «с» от количества компонентов «к», фаз «ф» и внешних переменных факторов «n» в условиях равновесия:с = к + n – ф.
При рассмотрении равновесия в металлических сплавах, находящихся под воздействием атмосферного давления, единственным внешним переменным фактором является температура и поэтому n = 1. Система железо-цементит является двухкомпонентной, то есть к = 2. Отсюда следует, что
с = 2 + 1 – ф = 3 – ф.
Для построения кривой охлаждения (или нагрева) сплава, прежде всего, необходимо найти на концентрационной оси диаграммы состояния координату, соответствующую содержанию углерода в сплаве. Затем из найденной точки следует восстановить перпендикуляр до области существования жидкой фазы. Кривая охлаждения (или нагрева) строится справа от диаграммы состояния в координатах температура (ось абсцисс) - время (ось ординат). Масштаб оси времени произвольный, а масштаб оси температуры такой же, как и на диаграмме состояния.Во время охлаждения сплава в нем происходят фазовые превращения. Каждое превращение протекает за определенный промежуток времени, поэтому соответствующие им участки кривой охлаждения имеют различные углы наклона по отношению к горизонтальной оси. Чем быстрее происходит превращение, тем круче кривая. Перитектическое, эвтектическое и эвтектоидное превращения идут во времени при постоянной температуре (так как с = 0), следовательно, им на кривой охлаждения будут соответствовать горизонтальные участки .Построение кривой охлаждения рассмотрим на примере чугуна, содержащего 5 % углерода (см. рисунок). Восстанавливаем перпендикуляр из отметки 5 % углерода на оси абсцисс до точки 1, находящейся в области жидкого состояния сплавов. Переносим пунктиром температуру точки 1 на ось температур нашего графика. В точке 1 рассматриваемый сплав находится в жидком состоянии (то есть существует только одна фаза жидкий раствор углерода в железе), следовательно с = 3 – 1 = 2. При двух степенях свободы равновесие в системе не нарушается даже при одновременном изменении температуры и концентрации сплава в определенных пределах. При понижении температуры в сплаве не будет происходить никаких превращений, и температура будет падать быстро, кривая охлаждения идет круто вниз до точки 2. Точкой 2 обозначено пересечение нашей вертикали с линией CD диаграммы состояния, соответствующей началу кристаллизации цементита. Следовательно, в сплаве появляется вторая фаза цементит, число степеней свободы уменьшается (с = 3 – 2 = 1), кривая охлаждения станет более пологой до температуры, соответствующей следующей критической точке 3. На участке кривой 1-2 указываем фазовое состояние сплава “ж” и число степеней свободы, равное 2, соответственно на участке 2-3 фазовое состояние “ж + ц”, а число степеней свободы с = 1. При изменении температуры в пределах точек 2 и 3 изменяется соотношение между жидкой и твердой фазами, но равновесие не нарушается.Точка 3 (пересечение вертикали с линией ECF) соответствует эвтектическому превращению, то есть совместной кристаллизации цементита и аустенита с образованием ледебурита. При этом одновременно существуют три фазы: жидкость, цементит и аустенит, следовательно число степеней свободы с = 3 – 3 = 0, и система нонвариантна, три фазы могут находиться в равновесии только при строго постоянной температуре. На кривой охлаждения это отражено отрезком 3-3*. Между точками 3 и 4 сплав имеет двухфазное состояние (аустенит и цементит) и с = 3 – 2 =1. При температуре, соответствующей точке 4, в сплаве происходит эвтектоидное превращение, аналогичное эвтектическому. Отличие только в том, что в нем участвуют только твердые фазы: аустенит, цементит и феррит. На кривой охлаждения делаем соответствующие записи.
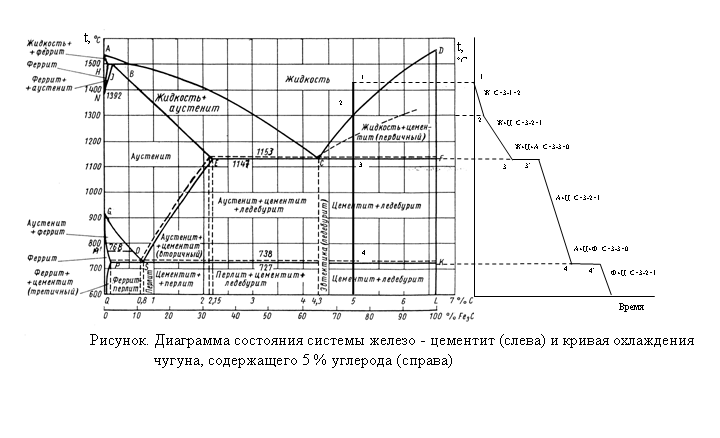
Содержание отчетаДиаграмма состояния железо-цементит с обозначением критических точек и областей диаграммы. Кривая охлаждения (или нагрева) сплава с заданной концентрацией углерода. Определение феррита, аустенита, перлита, ледебурита и зарисовка их структур.Выводы.Контрольные вопросы1. Что такое фаза?2. Что называется структурной составляющей?3. Что такое феррит, аустенит, цементит, перлит, ледебурит?4. Что такое критическая точка?5. Как обозначаются критические точки?6. Что такое эвтектическое превращение?7. Чем эвтектоидное превращение отличается от эвтектического?8. Как расшифровывается правило фаз?9. Как строятся кривые охлаждения?
 | ОБРАТИТЕ ВНИМАНИЕ! На нашем сайте Вы можете заказать любые задания по всем разделам материаловедения. Решение предоставляется в печатном виде с детальными комментариями |


matved.ru
Железо кривые охлаждения и нагрева
Превращения в железе легко обнаруживаются по кривым охлаждения и нагрева благодаря выделению или поглощению тепла при превращениях (фиг. 1). [c.319]На рис. 1.6 приведены кривые охлаждения и нагрева железа, характеризующие его полиморфные превращения. При температурах ниже 911 °С и выще 1392 °С железо имеет объемно-центрированную кубическую решетку и обозначается Fe . При температурах 911... 1392 °С оно имеет гранецентрированную к) ическую решетку и обозначается Fe . Высокотемпературную модификацию Fe иногда обозначают F g. [c.13]
А. Кривые охлаждения и нагрева, полученные при термическом анализе чистого железа, приведены на рис. 1.56. В реальных [c.29]Некоторые замечания к построению ДЖУ А. Кривые охлаждения и нагрева,. полученные при термическом анализе чистого железа, приведены на рис. 1.56. В реальных [c.29]
На рис. 9 приведены кривые охлаждения и нагрева чистого железа, равновесная температура 8 плавления и затвердевания кото- [c.22]Критические точки железа — температурные остановки на кривых охлаждения — обозначаются буквой А с цифровым индексом аллотропического превращения, т. е. А , Л , А . При этом если скорость охлаждения или нагревания не позволяет достигнуть равновесия, то между критическими точками и при нагревании и при охлаждении наблюдается разница, так называемый гистерезис, который тем больше, чем выше скорость нагревания или охлаждения. Критические точки железа при нагреве обозначаются Асд, Ас , а при охлаждении Аг и Аг . [c.116]
Превращение одной модификации в другую при охлаждении сопровождается выделением тепла, а при нагреве — поглощением тепла и протекает при постоянной температуре. На кривой охлаждения чистого железа при температурах, отвечающих аллотропическим превращениям, можно видеть горизонтальные площадки (рис. 24). [c.76]
Перед тем как рассмотреть этот вопрос, ознакомимся с кривыми нагрева и охлаждения железе и уясним их физическую сущность (рис. 1.4). [c.11]
| Рис. 14. Кривые нагрева и охлаждения железа |  |
Изменение длины образцов, сопровождающее а у-превра-щение, неодинаково при нагреве и охлаждении [51]. Дилатометрическая кривая, полученная от образца железа высокой чистоты (фиг. 5, а), показывает, что в этом случае а -превращения сжатие при нагреве составляет 0,52%, а расширение при охлаждении — 0,77% таким образом, после полного цикла длина образца увеличивается. Если такой образец подвергнуть циклической термообработке с переходом через точку превращения, его длина возрастает примерно пропорционально количеству циклов. Напротив, для образца железа технической чистоты кривые совершенно обратимы (фиг. 5, б) ж после циклической термообработки размеры образца лишь слегка изменяются. [c.451]
Никель является ценным легирующим элементом. Однако ввиду сравнительно высокой стоимости никеля его применяют лишь там, где замена его другими, более дешевыми элементами нецелесообразна. Диаграмма состояния сплавов железа с никелем (фиг. 183) обнаруживает расширенную -[-область никель повышает точку и понижает точку Л д. Эта диаграмма также показывает, что по мере увеличения содержания никеля разница между критическими точками при нагреве и охлаждении (гистерезис) резко увеличивается. Точечным пунктиром отмечено магнитное превращение в -[-твердом растворе. Сплавы с 24—26% N1 немагнитны, но при дальнейшем повышении содержания никеля при обычной температуре (20%) становятся магнитными чистый никель также магнитен. Никель растворяется в феррите, упрочняет его и увеличивает ударную вязкость стали как при обычных, так и при пониженных температурах. Никель понижает критические точки стали A J и Лсд, Аг и Аг и увеличивает интервал между ними (гистерезис). Наряду с этим никель сдвигает вправо кривые на диаграммах изотермического превращения аустенита (фиг. 182, б) и увеличивает устойчивость аустенита. [c.287]
Структурные превращения металла в зоне термического влияв ия происходят в соответствии с температурой, до которой нагревается металл при сварке, и скоростью охлаждения. Участки металла, расположенные на разных расстояниях от оси сварного шва, нагреваются неодинаково. Если сопоставить кривую распределения максимальных температур с диаграммой состояния железо— углерод, позволяющей определить фазовые и структурные превращения стали с определенным содержанием углерода, то станет очевидным, что зона термического влияния неоднородна по структуре. [c.382]
В сплавах Ре — РедС в твердом состоянии протекают аллотропическое превращение Ре в РСа и распад твердых растворов V и а, о словленный изменением растворимости углерода в железе у я а при понижении температуры. Как известно, Ре при 910° С р-очка С) превращается в Рва —модификацию, которая растворяет углерод в незначительном количестве (0,02% при 723° С). В связи с аллотропическим превращением образовавшийся при первичной кристаллизации аустенит ниже линии Р8К диаграммы (см. рис. 40) существовать не может и при медленном охлаждении распадается на эвтектоидную смесь перлита или с избыточным ферритом или с избыточным вторичным цементитом. Выделение феррита происходит по линии 03, а вторичного цементита — по линии Линия 08 является геометрическим местом точек Ас при нагреве и и Лгз — при охлаждении, а линия 8Е — геометрическим местом точек, соответствующих выделению из аустенита вторичного цементита. Эти точки обозначают Аст ст — цементит). Окончание аллотропического превращения Ре в Рса и распада твердого раствора V у всех сплавов (как сталей, так и чугунов) наблюдается при одной температуре (723° С) точку, соответствующую этой температуре, обозначают Л1 (Лс — при нагреве и Аг — при охлаждении). Кроме указанных превращений, в нижнем левом углу диаграммы ниже кривой PQ (область IX) происходит распад -твердого раствора с выделением из него третичного цементита. [c.80]
Первая остановка (точки Ас и ЛГг) наблюдается как на кривой нагрева, так и на кривой охлаждения при температуре 768° С и соответствует переходу железа из магнитного состояния (а-железо) в немагнитное (Р-железо) без изменения кристаллического строения металла. Ре , и Ре имеют одинаковую элементарную кристаллическую рещётку—объёмно-центрированного куба с параметром, равным 2,86-10" сд . [c.319]
В интервале температур 450—600 К отжиговая зависимость %(300, Т) (см. рис. 3.14) практически постоянна. Следовательно, состояние суперпарамагнитной примеси, т. е. число и размер частиц, при нагреве в этом температурном интервале и последующем охлаждении не меняется. Для температурной зависимости %(Т) это подтверждается результатами расчета (рис. 3.15, кривые 1 и 2), из которого следует, что растворение железа при 450— 600 К пренебрежимо мало. Наблюдаемый после отжига при температурах от 650 до 975 К рост восприимчивости х(300, Т) (см. рис. 3.14) примерно на 110 эме/г частично связан с увеличением размеров суперпарамагнитных частиц в охлажденной до 300 К меди и соответственно с ростом вклада от примеси при 300 К. Однако этим можно объяснить повышение х(300, Т) лишь на величину примерно 2-10 эме/г. Остальное повышение восприимчивости связано с другими факторами, например, с меньшей намагниченностью насыщения Л/, наночастиц в сравнении с массивным кристаллом или выделением большего количества ферромагнитной фазы при охлаждении. Согласно [176], понижение восприимчивости в интервале 1000—1225 К наблюдается лишь при большой скорости охлаждения образца, т. е. при закалке высокотемпературного состояния, когда вся ферромагнитная примесь растворена в меди. Если охлаждение после отжига проводить медленно, то примесь железа успевает выделиться в ферромагнитную фазу и наблюдаемое на рис. 3.14 уменьшение восприимчивости х(300, Т) после максимума отсутствует. [c.108]
В интервале температур 450-600 К отжиговая зависимость х(300,Г) (рис. 3.14) практически постоянна. Это означает, что состояние сунернарамагнитной примеси, т.е. число и размер частиц, при нагреве в этом температурном интервале и последующем охлаждении не меняется. Для температурной зависимости х(Г) это подтверждается результатами расчета (рис. 3.15, кривые 1 и 2), из которого следует, что растворение железа при 450-600 К пренебрежимо мало. Наблюдаемый после отжига при температурах от 650 до 975 К рост восприимчивости %(300,Г) (рис. 3.14) примерно на 1 10 эме/г частично связан с увеличением размеров сунернарамагнитных частиц в охлажденной до 300 К меди и, соотвественно, с увеличением вклада от иримеси при 300 К. Однако этим можно объяснить рост %(300,Г) лишь приблизительно на величину 2 10 эме/г. Остальное повышение восприимчивости связано с другими факторами, например, с меньшей намагниченностью насыщения Mg наночастиц в сравнении с массивным кристаллом или выделением большего количества ферромагнитной фазы при охлаждении. [c.122]
Железо имеет несколько аллотропических форм. На рис. 1.14 показаны кривые охлаждения (а) и нагрева (б) железа в координатах температура — время. Другие металлы, обладающие аллотропией. имеют тот же характер кр 1вых, но различаются количеством форм, температурами и временем, при которых они происходят. [c.21]
Разница между температурами фазового превращения при нагреве и охлаждении тем больше, чем меньше чистота образцов железа она слегка уменьшается (но не до полного исчезновения) при очень малых скоростях нагрева и охлаждения. Эта разница составляет 10° С для чистого (после зонной плавки) железа и достигает 25° С для армко-железа при очень малой скорости нагрева и охлаждения—около 15 град1час [51]. С увеличением скоростей нагрева и охлаждения гистерезис дилатометрических кривых также возрастает. [c.451]
Форму и размеры микроскопических инородных неметаллических включений в металле часто можно изменять путем соответствующей термической обработки параллельная ориентировка их в структуре металлов может быть достигнута прокаткой или волочением. В малоуглеродистой стали мелко или крупно пластинчатый перлит может быть получен путем нагрева и при надлежащих скоростях охлаждения. Чистое а-железо (ферритовые кристаллы в малоуглеродистой стали)—очень мягкий, легко деформируемый металл. Возможно, что высокое значение резко выраженного предела текучести, которое наблюдается при испытаниях на растяжение нормализованной (отожженной при температуре, несколько превышающей критическую температуру 906° С, при которой а-железо перестает существовать) мягкой стали, состоящей из а-железа с несколькими сотыдш долями процента углерода и небольшими следами марганца, кремния и т. п., обусловлено мельчайшими твердыми частицами цементита, которые группируются по границам, разделяющим небольшие ферритовые зерна. Так как вообще легко деформируемые ферритовые кристаллы окружены твердой оболочкой, то они не деформируются ири низких напряжениях. Прочная оболочка не допускает деформации зерен, пока напряжения не достигнут высоких значений, достаточных для разрушения этой оболочки. Именно тогда и наблюдается перелом кривой напряжений—деформаций, отвечающий определенному пределу текучести металлов с [c.58]
На рис. 14 изображены кривые нагрева и охлаждения электролитического железа, полученные на дифференциальном дилато- метре. [c.161]
mash-xxl.info
ТКМ (Вальтер А.И.) / Лекции / Лекция-2
Лекция № 2
1. Теоретические и технологические основы производства материалов.
2. Основные методы получения твёрдых тел.
Кристаллическое строение металлов. У веществ в твердом состоянии, строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно.
У всех металлов и их сплавов строение кристаллическое. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы - многогранники, поэтому их называют кристаллитами, зернамиили гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов.
Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемыекристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (- и- железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (- железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк,- титан,- кобальт).
Элементарная ячейкаповторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла.
Элементарная ячейка центрированного куба (рис.1) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре.
Рис.1. Часть пространственной решетки центрированного куба
Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств.
Рис.2. Часть пространственной решетки куба с центрированными гранями
На рис.1приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.1) состоит из 14 атомов, из них 8 атомов расположены по вершинам - куба и 6 атомов — по граням.
На рис.2приведена часть пространственной решетки куба с центрированными гранями ( гранецентрированного куба). На схеме имеется восемь элементарных ячеек; узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка (рис.3) состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре оснований и 3 атома — внутри призмы. Для измерения расстояния между атомами кристаллических решеток пользуются специальной единицей, называемойангстремом см.
Рис.3. Гексагональная ячейка
Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д.
Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называютсясвободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами.
Таким образом, в узлах решеток, обозначенных кружками, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается.
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов.
Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 - 50 %, а предел прочности—от 14 до 35 кГ/мм2для различных образцов. Это свойство кристаллов называютанизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве.
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называютсяплоскостями спайности.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность.
Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью(кажущейся изотропностью).
Аллотропия металлов(или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см.рис.1), а выше — решетку гранецентрированного куба (см.рис.2).
Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами , , и т. д., причем буквойобозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале.
Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец).
Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
На рис.4, априведена кривая нагрева металла. Здесь точка а- начало плавления, точкаb — окончание плавления.
Рис.4. Кривые нагревания (а) и охлаждения (б - без петли, в - с петлей) металла
Участок аbуказывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления).
Переход из жидкого состояния в твердое, при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладитьнесколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.4,6) находится несколько нижеtпл при температуре переохлажденияtпр.
У некоторых металлов переохлаждение (tпл — tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлажденияtпр(рис. 4, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти доtпл. В этом случае на графике вычерчивается петля теплового гистерезиса.
При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку.
Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен).
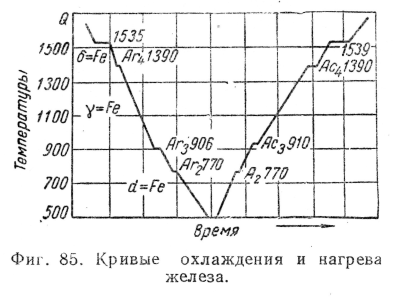
Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа.
Рис.5. Кривые охлаждения и нагревания железа
На рис.5приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 15390С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе.
Критические точки обозначаются буквой А, при нагревании обозначаютАcи при охлажденииArиндексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состоянияFe - Fe3C.
При температурах ниже 768 0С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют-железо ; при нагревании она в точкеАс2переходит в немагнитную модификацию-железо. Кристаллическая структура при этом не меняется.
В точке Ас3при температуре 9100С-железо переходит в-железо с кристаллической решеткой гранецентрированного куба.
В точке Ас4при температуре 14010С-железо переходит в-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб.
При охлаждении происходят те же переходы, только в обратной последовательности.
Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3).
Превращение в точке А3сопровождается изменением объема, так как плотность кристаллической решетки-железа больше плотности решетки-железа, в точкеАс3 объем уменьшается, в точкеAr3- увеличивается.
Основные свойства металлов. Металлы обладают механическими, технологическими, физическими и химическими свойствами.
К физическим свойствам относятся: цвет, плотность, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании и фазовых превращениях;
к химическим - окисляемость, растворимость, коррозионная стойкость, жароупорность;
к механическим - прочность, твердость, упругость, вязкость, пластичность, хрупкость;
к технологическим - прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
Прочность - способность металла сопротивляться действию внешних сил, не разрушаясь.
Удельная прочность- отношение предела прочности к плотности.
Твердостью- называется способность тела противостоять проникновению в него другого тела.
Упругость- свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызывающих изменение формы (деформацию).
Вязкость- способность металла оказывать сопротивление ударным внешним силам. Вязкость - свойство обратное хрупкости.
Пластичность- свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил.
Современными методами испытания металлов являются механические испытания, химический, спектральный, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах.
Механические свойства. Первое требование, предъявляемое ко всякому изделию, - это достаточная прочность. Многие изделия, кроме общей прочности, должны обладать еще особыми свойствами, характерными для данного изделия. Например, режущие инструменты должны обладать высокой твердостью. Для изготовления режущих и других инструментов применяют инструментальные стали и сплавы, а для рессор и пружин - специальные стали, обладающие высокой упругостью.
Вязкие металлы применяют в тех случаях, когда детали при работе подвергаются ударной нагрузке.
Пластичность металлов дает возможность обрабатывать их давлением (ковать, прокатывать, штамповать).
Физические свойства. В авиа-, авто-, приборо-, и вагоностроении вес деталей часто является важнейшей характеристикой, поэтому сплавы алюминия и магния являются здесь особенно полезными.
Плавкостьиспользуется для получения отливок путем заливки расплавленного металла в формы. Легкоплавкие металлы (свинец) применяют в качестве закалочной среды для стали. Некоторые сложные сплавы имеют столь низкую температуру плавления, что расплавляются в горячей воде. Такие сплавы применяются для отливки топографических матриц, предохранителей в приборах пожарной безопасности.
Металлы с высокой электропроводностью(медь, алюминий) используют в электромашиностроении, в линиях электропередач, а сплавы с высоким электросопротивлением - для ламп накаливания, электронагревательных приборов.
Магнитные свойстваметаллов используются в электромашиностроении при производстве электродвигателей, трансформаторов в приборостроении (телефонные и телеграфные аппараты).
Теплопроводностьметаллов дает возможность равномерно нагревать их для обработки давлением, термической обработки, кроме того, она обеспечивает возможность пайки и сварки металлов.
Некоторые металлы имеют коэффициент линейного расширения, близкий к нулю; такие металлы применяют для изготовления точных приборов при сооружении мостов, путепроводов и др.
Химические свойства. Коррозионная стойкость особенно важна для изделий, работающих в химически активных средах (детали машин в химической промышленности). Для таких изделий используют сплавы с высокой коррозионной стойкостью - нержавеющие, кислотостойкие и жароупорные стали.
13
studfiles.net
Основные сведения из теории сплавов » Привет Студент!
При определенном химическом составе свойства сплава определяются его структурой, а структура в свою очередь определяется характером обработки, которой был подвергнут сплав.
Свойства сплавов устанавливают лабораторным испытанием. Структуру сплава определяют по виду излома или травленого шлифа под микроскопом, а также исследуют рентгеновским методом.
Изучая одновременно свойства сплава и его структуру и зная, какой термической или механической обработке подвергался изучаемый сплав, можно установить для каждого сплава зависимость между его свойствами, структурой и обработкой. Когда такая зависимость установлена, можно по свойствам образца сплава определенного химического состава сделать выводы относительно его структуры и обработки, которой образец подвергался; или же, установив структуру образца сплава определенного химического состава, можно определить его свойства и обработку. Эта зависимость лучше всего может быть выражена графически в виде соответствующих диаграмм. Особенно плодотворным оказывается применение графического метода при изучении зависимости между химическим составом сплава, его структурой и термической обработкой.
Наука, занимающаяся изучением зависимости между составом сплавов, их структурой и свойствами, называется металлографией.
Кривые нагрева и охлаждения. Одним из основных понятий, которым пользуются, применяя металлографический метод к изучению свойств металлов и сплавов, является понятие о критической температуре. Критической температурой или критической точкой называется температура, при которой происходит структурное изменение нагреваемого или охлаждаемого вещества и изменяется при этом число или природа его фаз; например,
температура перехода воды из жидкого состояния в твердое равна 0°; следовательно, критическая температура воды будет 0°.
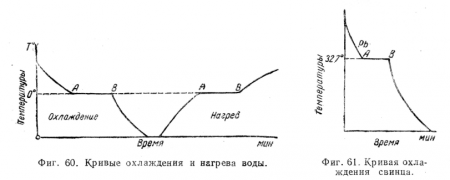
Выражая графически зависимость между изменением температуры какого-либо вещества при охлаждении и временем, в течение которого эти изменения происходят, получим кривую, называемую кривой охлаждения. Так, откладывая в соответствующем масштабе по оси X время и по оси Y температуры, получим кривую охлаждения воды (фиг.60). Рассматривая кривую охлаждения воды, замечаем, что на некотором участке ее АВ она горизонтальна, т. е., что температура охлаждаемой воды в течение времени, определяемого отрезком АВ, оставалась постоянной и равной 0°.
Из опытов, производимых с охлаждением воды, известно, что точка А кривой охлаждения соответствует началу замерзания воды, а точка В — концу замерзания; таким образом, участок кривой А В соответствует времени, в течение которого происходит замерзание воды.
Так как во время процесса охлаждения воды от нее отнимается тепло, то очевидно, что постоянство температуры во время процесса кристаллизации воды может быть объяснено только притоком тепла, а поскольку никакого внешнего источника тепла во время опыта нет, то, следовательно, восполнение отнимаемого от воды тепла может происходить лишь за счет тепла, развивающегося в самой воде.
Таким образом, мы убеждаемся, что процесс кристаллизации воды сопровождается выделением тепла в количестве, равном отнимаемому во время этого процесса.
При нагреве льда на отрезке АВ (фиг. 60) будет происходить превращение льда в воду.
Сравнивая построенные для воды кривые нагревания и охлаждения, убеждаемся, что температура плавления и температура затвердевания для нее одинаковы или, другими словами, одинакова критическая температура перехода воды из жидкого состояния в твердое и из твердого в жидкое.
Подобно тому как это было сделано для воды, строятся кривые охлаждения и кривые нагрева для металлов.
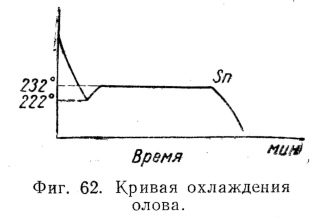
На фиг. 61 дана кривая охлаждения свинца; температура начала кристаллизации 327°, как видно из фигуры, сохраняется до конца кристаллизации.
Рассматривая кривую охлаждения свинца, видим, что в точке А свинец находится в жидком состоянии; между точками А и В он представляет собой смесь кристаллов и жидкости; ниже точки В — в твердом состоянии.
Таким образом, до точки А свинец представляет одну жидкую фазу; ниже точки В — одну твердую и на участке АВ — две фазы — жидкий свинец и кристаллы.
Явления переохлаждения. Переохлаждением называется запаздывание кристаллизации, свойственной какому-либо веществу при определенной температуре.
Если переохлаждение имеет место при переходе вещества из жидкого состояния в твердое, то рассматриваемое вещество остается жидким ниже температуры, свойственной его затвердеванию. Для того чтобы вызвать кристаллизацию переохлажденной жидкости, обычно достаточно толчка или внесения в переохлажденную жидкость кристалла. После начала кристаллизации температура переохлажденной жидкости повышается до уровня, соответствующего нормальной кристаллизации; в случае кристаллизации чистого вещества температура системы остается постоянной вплоть до окончания процесса кристаллизации.
В сплавав затвердевание (или плавление) обычно происходит не при постоянной температуре, а в интервале температур.
Некоторые металлы также способны переохлаждаться при затвердевании. В виде примера можно указать олово, температура затвердевания которого 232°; олово способно при переохлаждении оставаться в жидком виде при температурах, снижающихся до 222°.
На фиг. 62 представлена кривая охлаждения олова; явление переохлаждения получило отражение в снижении кривой до 222° и последующем подъеме до 232° с образованием на этом уровне горизонтального отрезка, соответствующего времени затвердевания жидкого олова.
Следует отметить, что явление переохлаждения в большей или меньшей степени наблюдается во всех случаях — как при кристаллизации из жидкости, так и при превращениях в твердом состоянии (вторичная кристаллизация). Теоретическое рассмотрение процесса кристаллизации показывает, что некоторое переохлаждение всегда необходимо для начала превращения. Степень переохлаждения зависит от скорости охлаждения.
Кристаллизация расплавленных металлов. Скорость охлаждения всякого вещества зависит от его теплопроводности, количества вещества, теплопроводности окружающей среды и разности температур вещества и окружающей среды. Как указал впервые выдающийся русский металловед Д. К. Чернов, скорость затвердевания металла и величина зерна в слитках определяются скоростью зарождения кристаллов в данном веществе и скоростью роста кристаллов. Скорость зарождения кристаллов определяется числом центров кристаллизации (зачатков кристаллизации по Чернову), возникающих в единице объема за единицу времени. Под скоростью роста кристаллов понимается линейная скорость кристаллизации. Эти величины, называемые параметрами кристаллизации, зависят от степени переохлаждения.
Если тело обладает способностью к образованию большого количества кристаллизационных центров при малой скорости роста кристаллов, то при затвердевании образуется мелкозернистая масса; в случае большой скорости роста кристаллов при малом числе кристаллизационных центров образуется крупнозернистая структура.
Чем медленнее совершается процесс кристаллизации, тем больше будут размеры отдельных кристаллов; вследствие этого в слитках размер кристаллических зерен увеличивается от поверхности к центру.
Поскольку параметры кристаллизации определяются степенью переохлаждения, а последняя в свою очередь зависит от скорости охлаждения, то, очевидно, регулируя условия охлаждения, можно изменять структуру слитка (величину и форму зерен слитка).
Рекристаллизация. При обработке металлов давлением изменяется не только внешняя форма обрабатываемого куска металла, но также деформируются и раздробляются кристаллические зерна, из которых состоит металл, что вызывает нарушение правильности расположения атомов, приводит к возникно
вению внутренних напряжений и изменяет механические качества металла. Такой металл называется наклепанным.
Если наклепанный металл подвергнуть нагреву до надлежащей температуры, то среди деформированных обломков кристаллов начинают образовываться и расти новые, которые полностью поглотят все деформированные кристаллиты, и даже после того, как в процессе роста новые зерна приходят в соприкосновение между собой, некоторые из них частично вырастут одно за счет другого. Такая перекристаллизация наклепанного металла, называемая рекристаллизацией, возвращает ему утраченные при обработке механические качества.
Температура рекристаллизации для различных металлов неодинакова, она находится в зависимости от абсолютной температуры плавления и для чистых металлов определяется, как показал акад. А. А. Бочвар, формулой
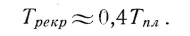
Нужно, однако, иметь в виду, что процесс рекристаллизации наклепанного металла при температурах, определяемых приведенной формулой, имеет затухающий характер: быстрый вначале он сильно замедляется со временем.
Поэтому на заводах после холодной деформации (прокатки, волочения) изделия для снятия наклепа нагревают до температур, лежащих на 100—200° выше, чем температура рекристаллизации.
Например, для технически чистой меди температура рекристаллизации по приведенной выше формуле лежит около 270° С (абсолютная температура плавления Тпл = 1083 + 273 = 1356° К; Трекр = 0,4-. 1356° К; tpeкp =
270° С), но практически рекристаллизационный отжиг меди проводят при температуре около 350—400° С.
Несколько иначе поступают при отжиге после холодной деформации стальных изделий. В углеродистых сталях температура рекристаллизации лежит около 500—600°. Но поскольку выше примерно 700° в сталях происходят-фазовые превращения, то при выборе температуры рекристаллизационного отжига руководствуются температурами критических точек. Обычно этот же отжиг одновременно используют и для получения мелкозернистой структуры за счет фазовых превращений (вторичная кристаллизация).
Аллотропические превращения. Аллотропическим превращением называют изменение структуры вещества, заключающееся в изменении его кристаллической решетки.
Аллотропические превращения вещества сопровождаются выделением или поглощением тепла, а также и изменением его свойств. Различные аллотропические состояния вещества называются его модификациями. Способность какого-либо вещества существовать в разных модификациях называется полиморфизмом.
Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного тела интервала температур; модификации, устойчивые в интервале наиболее низких температур, принято обозначать через а, модификации следующего температурного интервала -— через р и т. д.
На кривых охлаждения и нагрева переход тела из одного аллотропического состояния в другое получает отражение в виде температурной остановки (для чистых металлов) или изменения характера кривой (для сплавов).
В виде примеров полиморфизма можно указать углерод, известный в модификациях графита и алмаза, из металлов — железо, имеющее три модификации а, у и 3. Аллотропические превращения железа будут подробно рассмотрены ниже.
В сплаве, если компоненты его взаимно нерастворимы и в твердом состоянии, структура представляет собой механическую смесь чистых компонентов, аллотропическое превращение, свойственное какому-либо из компонентов, происходит при постоянной температуре, как и для чистого вещества.
В том случае, когда образуется твердый раствор компонентов сплава, аллотропическое превращение обычно происходит в интервале температур.
Вторичные фазы. Изменение растворимости легирующего компонента сплава в твердом состоянии при понижении температуры часто приводит к тому, что при достаточно медленном охлаждении сплава из твердого раствора выделяется избыточный компонент или в виде какого-либо химического соединения, или в виде твердого раствора на основе этого избыточного компонента. Выделения этих фаз, называемых избыточными или вторичными, располагаются или по границам зерен исходного твердого раствора, или внутри его зерен. При повышении температуры происходит обратный процесс — процесс растворения ранее выделившихся фаз. Эти структурные изменения существенно отражаются на свойствах сплава.
Явления вторичной кристаллизации, т. е. превращения в сплавах в твердом состоянии, подчиняются тем же общим законам кристаллизации, сформулированным выше.
Превращения в твердом состоянии широко используются в практике термической обработки сплавов для изменения свойств сплавов в необходимых направлениях.
Например, термическая обработка стали базируется на использовании аллотропических превращений железоуглеродистых сплавов; эти превращения имеют довольно сложный характер. При термической обработке важного технического сплава дуралюмина (или кольчугалюмина), состоящего в основном из алюминия с добавкой меди, используется распад пересыщенного твердого раствора меди и алюминия.
Скачать реферат: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ
Пароль на архив: privetstudent.com
privetstudent.com
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Цельработы
Ознакомиться с термическим методом исследования, научиться применять его для определения критических точек сплавов Pb–Sb.
Приборы, материалыиинструмент
Термоэлектрический пирометр; шихтовые материалы: Pb, Sb, порошок древесного угля; металлические тигли, щипцы, песочная ванна, шахтная электропечь.
Краткиетеоретическиесведения
Термический анализ основан на измерении теплового эффекта, сопровождающего все превращения (перестройки в расположении атомов, молекул) вещества при соответствующих температурах. Переход из одного агрегатного состояния в другое, изменение кристаллического строения или структурных составляющих сплава происходят с выделением тепла при охлаждении или поглощением его при нагревании. Например, при охлаждении, когда пар конденсируется в жидкости, жидкость переходит в твёрдое состояние, процессы сопровождаются выделением тепла. И, наоборот, при нагревании процессы таяния льда, испарения жидкости сопровождаются поглощением тепла.
Сущность метода термического анализа заключается в следующем: если вещество нагревать или охлаждать с заданной скоростью, изменяя непрерывно его температуру, то к моменту выделения или поглощения тепла температура вещества будет изменяться со скоростью, отличной от заданной. Это отражается на форме кривых охлаждения или нагревания, построенных в координатах температура–время.
Материаловедение. Лаб. практикум | -31- |
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
Температура, °С
| 1 539 °С | |
Немагнитное | 1 392 °С | |
γ | ||
| ||
| 911 °С | |
| 768 °С | |
Магнитное | α | |
|
0 Время, с
Рис. 4.1. Кривые нагревания и охлаждения чистого железа
Вид кривой охлаждения (кристаллизации) для чистого железа представлен на рис. 4.1. Горизонтальный участок при температуре 1 539°С соответствует кристаллизации жидкого металла, так как отвод тепла при охлаждении компенсируется выделением скрытой теплоты кристаллизации. Тепловые эффекты на кривых охлаждения (нагревания) наблюдаются не только на переходе одного агрегатного состояния в другое, но и в твёрдом состоянии. Выделение или поглощение тепла в этом случае связано с изменением формы кристаллической решётки железа.
В твердом состоянии железо находится в двух полиморфных модификациях: α иγ.α-железособъемно-центрированнойкубической решеткой (ОЦК) существует в двух интервалах температур: от 1 539 до 1 392°С и от 911 до 0°С. В интервале 1392–911°С появляетсяγ-железос кубической гранецентрированной решеткой (ГЦК). Поэтому при охлаждении при 1 392°С происходитα → γ превращение, а при 911°Сγ → α превращение. На это указывают горизонтальные участки при соответствующих температурах.
Процесс образования новой кристаллической решётки взамен старой называется вторичной кристаллизацией, которая происходит по тем же законам, что и первичная кристаллизация жидкости. Указанные температуры на кривых охлаждения (и нагревания) принято называть критическими точками.
Металлический сплав обладает свойствами металлов и получается в результате взаимодействия двух или нескольких элементов. Основу любого металлического сплава составляют металлы. Составной частью может быть
Материаловедение. Лаб. практикум | -32- |
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
любой химический элемент, а также химическое соединение, не диссоциирующее при нагревании. Сплавы получают методом сплавления, порошковой металлургией, диффузией, осаждением из газовой среды различных металлов и неметаллов. В сплавах положение критических точек связано с их составом. Определение этой зависимости лежит в основе построения диаграмм состояния изучаемой системы сплавов.
Термический анализ осуществляется следующим образом: готовится несколько сплавов исследуемой системы с различными соотношениями компонентов. Сплавы помещают в огнеупорные тигли и согревают в печи. После расплавления тигли со сплавами медленно охлаждают и фиксируют скорость охлаждения с помощью термопары и секундомера. По полученным точкам строят термические кривые охлаждения в координатах температура–время.
Вид кривых охлаждения чистых металлов и сплавов различных концентраций для системы Pb, Sb показан на рис. 4.2.
Кривая охлаждения III сплава с содержанием сурьмы 13 % (87 % Pb) подобна кривой охлаждения чистых металлов I (рис. 4.2).
На участке 2–2′ жидкий расплав затвердевает с образованием смеси кристаллов свинца и сурьмы. Такие смеси называютсяэвтектикой.
Кривая II на рис. 4.2 показывает охлаждение сплава с содержанием сурьмы менее 13 %. В точке 1 появляются первые зародыши кристаллов свинца, избыточного по отношению к эвтектическому составу, но т. к. процесс только начинается, на кривой охлаждения заметен лишь легкий перегиб за счет изменения скорости охлаждения. Выделение и рост зерен свинца продолжаются до точки 2 (кривая II нарис. 4.2). В точке 2 затвердевает вся оставшаяся жидкость, состав которой соответствует эвтектическому. Выделяющееся при кристаллизации тепло поддерживает температуру постоянной на участке2–2′.Ниже точки 2′ твердый сплав охлаждается с заданной скоростью. Процесс поясняет схема структур для заданной кривой (рис. 4.2).
Материаловедение. Лаб. практикум | -33- |
Температура С
°,
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
I | II | III | IV |
100 % Pb | 6 % Sb | 13 % Sb | 25 % Sb |
Ж
11′
Ж+ кр. Pb
Кр. Pb
| Ж |
|
| Ж |
| Ж |
|
|
|
|
| ||
|
|
|
|
|
| |
|
|
|
| 1 |
| Ж + кр. Sb |
|
|
|
|
|
| |
1 |
|
|
| Ж + эвт. |
|
|
|
|
|
|
|
| |
| Ж + кр. Pb |
|
| (Pb + Sb) |
|
|
|
|
|
|
|
| |
2 | 2′ | 2 | 2′ | Ж + кр. Sb + | 2 | 2′ |
|
|
|
|
|
|
+ эвт. (Pb + Sb)
Ж+ кр. Pb +
+эвт. (Pb + Sb)
Кр. Pb + эвт. | Эвт. (Pb + Sb) | Кр. Sb + эвт. | |
(Pb + Sb) | |||
(Pb + Sb) | |||
|
|
Время, с
Рис. 4.2. Кривые охлаждения чистых металлов и сплавов системы Pb–Sb
Материаловедение. Лаб. практикум | -34- |
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
В сплавах с содержанием сурьмы более 13 % (кривая IV на рис. 4.2) при кристаллизации в первую очередь выделяются избыточные зерна сурьмы (участок1–2).На участке2–2′ происходит кристаллизация эвтектики. Ниже точки 2′ идет охлаждение твердого сплава из эвтектической смеси и первичных кристаллов сурьмы (схема структур нарис. 4.2).
n1 n2
b a
Гальванометр
n0
Рис. 4.3 Схема термоэлектрического пирометра
Для термического анализа используется термоэлектрический пирометр (рис. 4.3), который представляет собой два разнородных проводника, сваренных в точкеn0 (горячий спай). Пирометр состоит из термопары и гальванометра. При нагревании горячего спая на холодных концах термопарыn1 иn2 возникает термоэлектродвижущая сила. Величина её зависит от температуры горячего спая. Если соединить проводниками холодные концы термопары с гальванометром, то через него потечет электрический ток, величина его зависит оттермо-ЭДС,а следовательно, от температуры в точкеn0. Пирометр предварительно градуируют в°С.
Порядоквыполненияработы
У каждого прибора в термической лаборатории работают два студента. В соответствии с заданием по составу сплава они получают шихтовые материалы.
1.Шихту загрузить в металлический тигель, который поместить в разогретую тигельную электропечь.
2.Сплав расплавить, нагреть до температуры 500–600°С и быстро извлечь из печи, установить на песочную ванночку, посыпать порошком древесного угля (толщиной1–1,5мм) и перемешать. Штатив приблизить к ванночке так, чтобы надёжно поддерживалась термопара, погруженная в тигель.
3.При охлаждении сплава произвести отсчет и записать показания гальванометра через каждые 15 секунд в интервале температур от 450–180
°С.
Материаловедение. Лаб. практикум | -35- |
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Порядок выполнения работы
4.Охлажденный до 180 °С сплав термопары перенести в печь и нагревать до 600°С, затем опыт повторить.
5.После повторного охлаждения тигель с термопарой снова помес-
тить в печь, нагревать до 400 °С, после чего извлечь из сплава термопару; тигель охладить до комнатной температуры.
Содержаниеотчета
1.Кратко описать ход работы, указать состав сплава из отчетов, привести данные, полученные при охлаждении сплавов (в виде таблицы).
2.По полученным результатам построить термические кривые охлаж-
дения в масштабе: 10 °С – 5 мм; 15°С – 5 мм.
3. По кривым охлаждения определить критические точки сплава, соответствующие началу его кристаллизации и образованию эвтектики.
Материаловедение. Лаб. практикум | -36- |
studfiles.net
Железо кривые охлаждения - Справочник химика 21
| Рис. 54. Кривая охлаждения железа (по оси абсцисс — время) |  |
Температуры фазовых превращений железа хорошо видны на кривой охлаждения в виде остановок [c.523]
На кривых охлаждения имеются остановки, соответствуюш,ие кристаллизации из расплава твердых растворов хлористого алюминия и хлорного железа (или твердого раствора пентахлоридов ниобия и тантала), и остановки, соответствующие затвердеванию тройной эвтектики. Температура плавления эвтектики не отличается заметно от температуры плавления чистого четыреххлористого титана. Растворимость хлорного железа в четыреххлористом титане заметно повышается в присутствии хлористого алюминия растворимость их смеси является средней величиной между растворимостью чистых хлоридов железа и алюминия и зависит от соотношения между содержанием этих хлоридов в растворе. [c.164]
Изучение кривой охлаждения воды ничего принципиально нового не дает, но иногда дело обстоит иначе. Например, первая остановка на кривой охлаждения жидкого железа (схема рис. Х -4) отвечает переходу Ре при 1538°С в твердое состояние, [c.357]
Закончим рассмотрение превращений, совершающихся в чугунах, при их охлаждении низке 1147 °С. При этой температуре растворимость углерода в 7-железе максимальна. Поэтому к моменту окончания первичной кристаллизации содержащийся в чугуне аустенит наиболее богат углеродом (2,14%). При охлаждении ниже этой температуры растворимость углерода в аустените падает (кривая Е5 на рис. 32..2) и углерод выделяется из него, превращаясь обычно в цементит. По достижении температуры 727 °С весь остающийся аустенит, в том числе входящий в состав эвтектики, превращается в перлит. Из сказанного следует, что области 7 отвечает смесь эвтектики с кристаллами аустенита и цементита, образовавшегося при распаде аустенита, области 8 — смесь эвтектики с кристаллами цементита. Поскольку при температурах ниже 727 °С аустенит эвтектики превращается в перлит, то областям 12 и 13, подобно области И, отвечает смесь перлита и цементита. Однако сплавы, принадлежащие к той и другой области, несколько различаются по структуре. Это различие обусловлено тем, что цементит сплавов области 13 образуется при первичной кристаллизации, в области 12 [c.621]
Температуры фазовых превращений железа хорошо видны на кривой ох.ла-ждения в виде остановок — горизонтальных площадок (см. рис. 167). Как видно, кроме площадок, отвечающих перечисленным точкам, на кривой охлаждения имеется еще одна остановка — при 768 °С. Эта температура связана не с перестройкой решетки, а с изменением магнитных свойств а-железа. При температурах выше 768 Х железо немагнитно, а ниже 768 "С — магнитно. Немагнитное а-железо иногда называют р-железом, а модификацию а-железа, устойчивую при температурах от 1394 °С до плавления, — 6-железом. [c.653]
Изображенная на рис. 54 кривая охлаждения для железа не требует особых пояснений. Ограничимся только констатацией [c.197]
Температуры фазовых превращений железа хорошо видны на кривой охлаждения в виде остановок — горизонтальных площадок (см. рис. 167). Как видно, кроме площадок, отвечающих перечисленным точкам, на кривой охлаждения имеется еще одна остановка — при 768 °С. Эта температура связана не с перестройкой решетки, а с изменением магнитных свойств а-железа. При темиерату-рах выше 768 °С железо немагнитно, а ниже 768 С — магнитно. Немагнитное [c.673]
СаА1251208. Эти вещества образуют между собой твердые растворы. При кристаллизации расплава, содержащего 40% анортита и 60% альбита, при температуре 1420 °С начинается образование кристаллов твердого раствора, что соответствует первому перегибу на кривой. Полная кристаллизация твердого раствора заканчивается при температуре 1280 °С, что соответствует второму перегибу на кривой. Кривая, 4 представляет кривую охлаждения железа. При температуре 1539 °С происходит кристаллизация железа, и это сопровождается остановкой на кривой охлаждения. При дальнейшем охлаждении происходят переходы одной аллотропической формы железа в другую. Форма 8 при 1401 °С переходит в форму 7, которая при 898 °С превращается в форму р при 768 °С форма В переходит в форму а. Каледому из этих превращений соответствует остановка на кривой охлаждения. [c.508]
Твердое тело не всегда охлаждается по плавной кривой, так как вследствие полиморфных превращений возможны изломы. При переходе одной кристаллической формы в другую выделяется теплота превращения, вследствие чего падение температуры приостанавливается и на кривой охлаждения появляется горизонтальный участок. На рис. 32 представлено охлаждение железа от температуры 1600 до 600°. [c.138]
Сначала охлаждается жидкое железо, которое, достигнув температуры 1539°, кристаллизуется в б-форму. Выделяется теплота кристаллизации, на кривой охлаждения появляется первый горизонтальный участок. Затем б-форма охлаждается до температуры 1410°, переходя при этом в у-форму с соответствующим тепловым эффектом. При температуре 898° проис ходит переход уформы к р-форму, а при 768° — р-формы в а-форму. Все эти превращения ясно видны на кривой охлаж дения. Длины горизонтальных участков пропорциональны теп ловым эффектам превращений. [c.138]
Катализатор Р1—Не (90 10)/С с содержанием металла 9,4% восстановлен Нг при 743 К, охлажден до 298 К, откачан и вынесен на воздух. Цифры показывают спектр, получен-ный разложением экспериментальной кривой с помощью ЭВМ на дублет, обусловленный объемным железом (2 и 3), и дублет, связанный с поверхностным железом (1 и 4). [c.436]
На кривых охлаждения смесей разреза 2, кроме упомянутых остановок, получены еще остановки, соответствующие кристаллизации из слоя четыреххлористого титана хлорного железа, избыточного по сравнению с составом NaFe U, находящегося в нижнем слое. [c.170]
Определения растворимости были сделаны путем изотермического насыщения растворов в эбонитовых пробирках, закрытых резиновыми пробками, помещенных в водяной термостат. Состав равновесных растворов устанавливался путем повторного отбора проб. Динни льда получены термическим анализом, снятием кривых охлаждения. Температура кипения насыщенных растворов определялась в аппарате Бекмана для эбулиоскопических измерений [2]. Состав растворов и твердых фаз вычислялся о содержанию катиона. Железо определялось путем непосредственного титрования растворов кремнефтористой соли бихроматом в присутствии индикатора дифениламин-сульфоната натрия. Медь определялась иодометрически путем непосредственного титрования раствора. [c.1232]
В случае применения ацетона как восстановителя, обеспечивающего увеличение чувствительности метода и предотвращающего быстрое уменьшение я1 тарно-желтой окраски расгворов [650], анализируемый раствор выпаривают или разбавляют таким образом, чтобы он содержал 5 — 1000 мкг Мо в 20 мл. Помещают 20 мл раствора в мериую колбочку емкостью 50 мл и прибавляют такое количество соляной кислоты, чтобы ее концентрация после разбавления раствора до 50 мл была 1,2—2 N. Если был взят водный раствор молибдена, то достаточно прибавлять 7 мл концентрированной соляяой кислоты. Прибавляют 3 мл 10%-ного раствора роданида калия и 15 мл ацетона, все нагревают 20 мин. на водяной бане при 60—70° С (при этом, кроме шестивалентного молибдена, так же восстанавливается трехвалентное железо, если его было не слишком много). Если количество молибдена находится в указанных выше границах, то потери ацетона в процессе нагреваиия не имеют большого значения, даже когда оно продолжается 2—3 часа. После охлаждения раствор разбавляют до метки, измеряют оптическую плотность при 420 ммк. Количество молибдена находят по калибровочной кривой, построенной по растворам с известным содержание.м молибдена. [c.211]
Возможность такого процесса при восстановлении закиси железа, медленном охлаждении окалины на железе (полученной при i>570° ), а также железистых шлаков отмечалась многими авторами. Например, А. С. Тумарев [244], изучавший восстановление РеО при 500° С, обнаружил, что на кривой, построенной в координатах % СОз — время, имеется горб, отвечающий 59% СОг, в то время как содержание СОг над магнетитом составляло 47%. [c.489]
Если изучение кривой охлаждения воды ничего принципально нового не дает, то иногда дело обстоит иначе. Например, первая остановка на кривой охл ждения жидкого железа (схема рис. Х1-23) отвечает его переходу при 1536°С в твердое состояние, наличие же на кривой еще трех остановок указывает на какие-то процессы, протекающие в твердом железе. Такими процессами могут быть только переходы одной [c.208]
Если изучение кривой охлаждения воды ничего принципиально нового не дает, то иногда дело обстоит иначе. Например, первая остановка на кривой охлаждения жидкого железа (схема рис. Х1-23) отвечает сго переходу при 1536°С. твердое состояние, наличие же на кривой еще трех остановок указывает на какие-то процессы, протекающие в твердом железе. Такими процессами могут быть только переходы одной аллотропической формы в другую. Кривая охлаждения позволяет, следовательно, сделать выеюд о существовании четырех аллотропических модификаций железа — а, р, у и б. Одновременно она точно определяет области их устойчивости. Как показывают более детальные исследования, все четыре модификации действительно существуют и различаются по некоторым свойствам. Очевидно, что обнаружение их при помощи обычного химического анализа вообще невозможно. [c.52]
В работе Дженкинса и Гэйлера [69] были впервые изучены методы достижения условий абсолютно черного тела и снятия кривых охлаждения. Одним из первых успешных применений этого метода была работа Эдкока по построению диаграммы равновесия хром — железо [34]. На рис. 96 показана установка Эдкока, которая состоит, по-сущест-ву, из корундизовой смотровой трубы, погружаемой в расплав, находящийся в корундизовом тигле. Сплав нагревается с помощью концентрического молибденового цилиндра, который создает равномерное распределение температуры и нагревается индуктивно токами высокой частоты. Корундизовая смотровая труба соединена с кварцевой, вставленной в короткую металлическую трубу, присоединенную к головке печи. Кривые охлаждения снимаются в вакууме, но так как смотровая труба оказывается не вполне газонепроницаемой, через нее пропускают небольшой поток аргона, чтобы ограничить проникновение металлических паров. Глубина погружения прубы около 2 см. Экраны не применялись, но тем не менее считалось, что условия абсолютно черного тела выполнены. [c.180]
Выполнение работы. 1. Приготовление стандартного раствора железоаммонийных квасцов. Навеску квасцов массой около 0,43 г взвешивают на аналитических весах, переносят с помошью воронки в мерную колбу вместимостью 50 мл и растворяют в 10 мл h3SO4 при нагревании. После растворения и охлаждения доводят раствор до метки водой (раствор А). Рассчитывают точное содержание железа в полученном растворе, мг/мл. Раствор Б готовят разбавлением водой раствора у4 в 10 раз в другой мерной колбе вместимостью 50 мл. Раствор Б используется для снятия кривой светопоглощения и для построения градуировочного фафика. [c.156]
Если исходный расплав содержит более 0,8% углерода (но менее чем 2,14%), например 1,5%, то распад аустенита начнется с выделения цементита (точка 3 на рис. 32.4). Вследствие выделения ГезС — фазы, богатой углеродом — остающийся аустенит обогащается железом, так что при дальнейшем охлаждении его состав изменяется по кривой Е8. В точке 5 начинается выделение перлита. В итоге получается сталь со структурой, состоящей из цементита и перлита. Таким образом, области б на диаграмме (рис. 32.2) отвечает смесь кристаллов цементита и аустенита, а области 11 — смесь перлита с кристаллами цементита. [c.620]
С помощью рис. 25.6 посмотрим, что происходит при охлаждении расплавов различного состава ниже эвтектической температуры 1130°С. Сплав, состав которого определяется на диаграмме точкой 1, при охлаждении затвердевает в эвтектической точке Е, образуя смесь цементита РезС и аустенита последний представляет собой твердый раствор углерода в железе. Описанная смесь называется ледебуритом. Расплав, состав которого отвечает точке 2, при отвердевании образует кристаллы аустенита, а остающийся расплав обогащается углеродом до тех пор, пока не будет достигнута эвтектическая точка. После этого получается твердая фаза, содержащая аустенит и ледебурит. Таким образом, расплавы состава 1 и 2 в итоге дают смеси одинаковых твердых веществ, аустенита и цементита, но в различных пропорциях. Интересно отметить, что максимальная растворимость углерода в гамма-железе 1,7%. Эта величина характеризует максимальное содержание углерода в его твердом растворе с железом, а также определяет верхний предел содержания углерода в обычных углеродистых сплавах. При наличии большего количества углерода сплавы железа называются чугуном. При охлаждении расплава с составом 3 сначала образуются аустенитные кристаллы, более бедные углеродом, чем расплав расплав же, наоборот, обогащается углеродом. При охлаждении до температуры, соответствующей точке на кривой солидуса, которая отвечает составу исходного расплава, он кристаллизуется с образованием а устенита. В результате дальнейшего охлаждения твердый аустенит превращается в точке X в смесь феррита (твердый раствор [c.450]
ОКИСИ алюминия) железный катализатор с окисью углерода при различных давлениях и измеряли полную адсорбцию (включающую хемосорбцию и физический слой, расположенный выше). В каждом случае при иагревании до 0° физический слой удалялся и оставался только хемосорбированный слой, так что при повторном охлаждении до —183° и адсорбции количество поглощенного газа служило мерой физической адсорбции. Разность между полной и физической адсорбцией (см. рис. 67, две нижние кривые) давала величину хемосорбции. Таким образохм, здесь производилось два определения —объема газа, необходимого для заполнения монослоя (см. стр. 169— 170), давшее совпадающие результаты и позволившее сделать предположение, что все поверхностные атомы железа хемосорбируют окись углерода. Однако в случае одно- или дважды промотированного катализатора площадь хемосорбиро-вавшей поверхности (железо) была меньше полной поверхности, хотя обе они и превышали поверхность непромо-тированного катализатора (табл. 33). Около 60% поверхности приходилось на долю промоторов и только около [c.299]
chem21.info
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)