|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Внутреннее строение металлов и сплавов Кристаллическое строение металлов. Кривые нагревания и охлаждения чистого железа
Превращения, происходящие в железе и стали при нагреве и охлаждении :: Технология металлов
Строение стали
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа. При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Перестройка кристаллической решетки при медленном охлаждении происходит в обратном порядке: дельта-железо при 1390° превращается в гамма-железо, а гамма-железо при 898° превращается в альфа-железо.
Рис. 1. Строение кристаллической решетки: а — альфа и дельта железа; б — гамма железа.
Критические точки превращения
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.
Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
На рис. 3 представлена диаграмма состояния углеродистой стали при медленном охлаждении и нагревании.
.jpg)
Рис.3. Диаграмма состояния углеродистых сталей.
Структура стали
Структурой стали называется внутреннее ее строение. Углерод в стали находится в виде химического соединения с железом, и это соединение называется — цементит. Кроме цементита, в стали имеется феррит, представляющий собой почти чистое железо. В зависимости от содержания углерода большая или меньшая часть феррита находится в механической смеси с цементитом, образуя новую структуру — перлит. Если небольшой кусок металла прошлифовать, отполировать и протравить в специальном реактиве, то под микроскопом можно различить структуры. Ниже приводится описание структур железоуглеродистых сплавов.
Аустенит представляет собою твердый раствор углерода и других элементов в гамма-железе. Наибольшее содержание углерода, которое может раствориться в ау-стените — это 2%. Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
В обычных сталях аустенит устойчив только лишь при температуре выше критических точек. При охлаждении, даже самом быстром, с этих температур аустенит превращается в другие структуры. При комнатной температуре аустенит полностью сохраняется в ряде марок нержавеющих сталей, в высокомарганцовистой стали и в незначительном количестве остается при закалке некоторых марок инструментальной и конструкционной сталей.
Аустенит мягок, пластичен, тягуч, мало упруг. Твердость его по Бринелю находится в пределах 170—220.
Аустенит немагнитен, обладает невысокой электропроводностью.
Феррит представляет собой твердый раствор углерода и других элементов в альфа-железе. Наибольшее содержание углерода, которое может раствориться в феррите, это 0,04%. Феррит устойчив при температурах ниже критической точки AC1. Он выделяется из аустенита при медленном охлаждении последнего ниже A6i. Феррит мягок, сильно тягуч. Твердость HB= 60—100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Цементит представляет собой химическое соединение железа с углеродом Fe3C—карбид железа. Цементит содержит углерода 6,67%. Выделяется из жидкого и твердого раствора при медленном охлаждении. Цементит весьма тверд и хрупок. Твердость его НB= 800—820. Он магнитен до 210°. Выше этой температуры цементит теряет магнитные свойства.
Перлит представляет собой механическую смесь феррита и цементита. Он образуется из аустенита при медленном его охлаждении. Температура превращения аустенита в перлит 723°С. При весьма медленном переходе через эту температуру цементит образуется в виде зерен (глобулей), и тогда перлит называется зернистым. При более быстром охлаждении цементит приобретает форму пластинок, и такой перлит называется пластинчатым. При весьма быстром охлаждении в результате значительного переохлаждения аустенита вместо перлита получаются другие структуры, о которых речь будет ниже.
Перлит магнитен, прочен и пластичен. Твердость его находится в пределах от 160 до 230 кг/мм2 по Бринелю. При обработке резанием наиболее чистую поверхность дает структура зернистого перлита.
Мартенсит образуется в результате весьма быстрого охлаждения (закалки) аустенита. При быстром охлаждении успевает произойти перестройка кристаллической решетки гамма-железа в решетку альфа-железа, выделение же углерода в карбид железа не успевает произойти, и он весь остается растворенным в решетке альфа-железа. Так как нормально альфа-железо может растворить в себе не более 0,04% углерода, то такой раствор называют пересыщенным. Он отличается весьма большой твердостью (свыше Rc= 60) и хрупкостью. Следует указать, что решетка альфа-железа, получающаяся в результате закалки, имеет искаженную форму. Так, размеры ее граней не одинаковы — в одном направлении они удлинены за счет других (см. рис. 4). Такая решетка называется тетрагональной. Чем больше в стали углерода, тем больше тетрагональность решетки и тем более велики внутренние напряжения. При нагревании до температур 100—200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
.jpg)
Рис. 4. Строение кристаллической решетки стали, закаленной на мартенсит.
Троостит представляет собой высокодисперсную (мелкораздробленную) смесь феррита и карбидов. Он образуется при охлаждении аустенита с замедленной против закалки скоростью или в результате нагрева (отпуска) мартенсита в пределах 250—400°.
При нагреве закаленной стали происходит постепенное выделение углерода из кристаллической решетки с образованием карбидов. Троостит менее прочен, более пластичен, чем мартенсит. Твердость его НB330—400. При охлаждении аустенита в горячих средах в интервале 250—400° (изотермическое превращение аустенита) происходит образование игольчатого троостита, несколько более прочного, чем обычный троостит.
Сорбит представляет собой дисперсную смесь феррита и карбидов. Он образуется при охлаждении аустенита с небольшой скоростью или при нагреве (отпуске) мартенсита до 400—650°. Карбиды сорбита более крупные, чем троостита. Сорбит пластичен, вязок и магнитен. Твердость НВ 270—320.
Ледебурит представляет собой эвтектическую смесь аустенита и цементита. Он содержит углерода 4 3% Образуется ледебурит при затвердевании жидкого сплава с содержанием углерода свыше 2%. Ледебурит хрупок.
На рис. 5. представлены фотоснимки структур стали с различным содержанием углерода.
Структура стали с содержанием углерода 0,83% состоит из сплошного перлита и называется эвтектоидной; при меньшем содержании углерода структура стали состоит из перлита и феррита и носит название доэвтектоидной, а при большем содержании углерода — из перлита и цементита и называется заэвтектоидной. Температура 723°, при которой перлит переходит в аустенит, также называется критической и обозначается Ас.
Для того чтобы доэвтектоидную и эвтектоидную сталь полностью отжечь, нормализовать или закалить, их нужно нагреть до такой температуры, при которой они перешли бы в аустенитное состояние.

Рис. 5. Микроструктура отожженной углеродистой стали:
а - с содержанием углерода -0,1%
б - с содержанием углерода -0,85%
в - с содержанием углерода -1,1%
Превращения, происходящие в стали при нагревании
По диаграмме на рис. 3 можно проследить за изменениями структуры трех разных марок стали при нагревании:
- Сталь с содержанием углерода 0,83%. Структура стали представляет собой перлит. При температуре 723° в точке Aс1 перлит переходит в аустенит.
- Сталь с содержанием углерода 0,4%. Структура стали представляет собой перлит и феррит. При температуре 723° в точке К1 перлит переходит в аустенит, и по мере повышения температуры происходит растворение свободного феррита в аустените. При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.
- Сталь с содержанием углерода 1,2%. Структура стали представляет собой перлит и цементит. При температуре 723° в точке Pi перлит переходит в аустенит, и при дальнейшем повышении температуры происходит постепенное растворение цементита в аустените. При пересечении линии SEв точке Р2 это растворение закончится. Для этой стали точка Р1 явится нижней критической точкой Ас1, а точка Ρ2 — верхней критической точкой, которая для заэвтектоидных сталей обозначается Асm.
Линия на диаграмме, обозначенная буквами GS, соответствует окончанию растворения феррита в аустените в доэвтектоидных сталях, а линия SE соответствует окончанию растворения цементита в аустените в заэвтектоидных сталях.
Следует указать, что заэвтектоидные стали при операциях термической обработки не нагревают выше линии Аcт(такая высокая температура нагрева приведет к перегреву и ухудшению свойств стали), а ограничиваются нагревом выше первой критической точки ACl, что полностью обеспечивает получение необходимых свойств.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры - мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей — сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле — троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.

Рис. 6. Микроструктура закаленной стали:
а — игольчатый мартенсит;
б — сорбит.
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей — и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит—при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250—400° — мартенсит и троостит и при нагреве от 400—650° — троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.

Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной— температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн — образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45—55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Источник:Остапенко Н.Н.,Крапивницкий Н.Н. Технология металлов. М. Высшая школа,1970г. Каменичный И.С. Практика термической обработки инструмента. Киев, 1959 г.
markmet.ru
Критические точки железа и железоуглеродистых сплавов » Привет Студент!
Кривые охлаждения и нагрева чистого железа представлены на фиг. 85. На них видим четыре критические точки: для кривой нагрева 770, 910, 1390 и 1539°; для кривой охлаждения 1539, 1390, 906 и 770°. Критическая точка 1539° соответствует переходу железа из жидкого состояния в твердое и из твердого в жидкое; температура 770° является температурой точки Кюри, остальные критические точки указывают на структурные превращения железа в твердом состоянии.
Неполное совпадение второй снизу критической точки на кривой охлаждения с аналогичной точкой на кривой нагрева указывает на склонность железа к переохлаждению (гистерезису) при переходе через эту критическую точку.
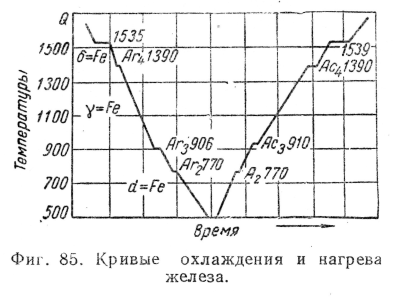
Обозначая различные модификации железа соответствующими буквами греческого алфавита, имеем: 1) a-Fe—при нагреве до 910°; y-Fe — от 910 до - 1390° и б-Fe — от 1390 до 1539°; 2) б-Fe — при охлаждении в интервале температур от 1539 до 1390°; y-Fe — от 1390 до 906°; a-Fe— от 906° и ниже. При 770° железо претерпевает магнитное превращение.
Критические точки на кривых охлаждения и нагрева железа принято обозначать буквой А с индексом r, если точка находится на кривой охлаждения, и с индексом с на кривой нагрева; кроме того, при r и с ставится цифра, указывающая положение рассматриваемой точки на кривой.
При охлаждении температура перехода от б к у обозначается точкой Ar4, от y к а — Ar3, при нагревании от а к у —- Ac3, от у к б — Aс4; при магнитном превращении явление гистерезиса не имеет места, поэтому соответствующая температура обозначается просто A2.
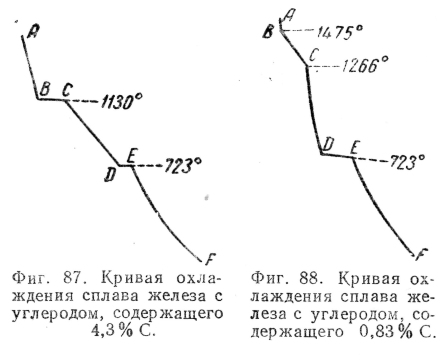
Точки Ar1 и Ac4 отсутствуют на кривых охлаждения и нагрева чистого железа; они появляются на кривых охлаждения и нагрева различных сплавов железа с углеродом и соответствуют равновесной температуре 723°
(фиг. 87 и 88).
Железо в модификациях y и б, а также а выше 770° не обладает ферромагнитными свойствами. Железо модификации у способно к образованию твердых растворов с углеродом; a-Fe и б-Fe обладают этой способностью в весьма слабой степени. Все модификации железа способны к образованию твердых растворов с Mn, Si, Cr, W, Mo, V, Ni, Al, P.
Твердый раствор на основе a-Fe носит название феррит, твердый раствор на основе y-Fe принято называть аустенитом.
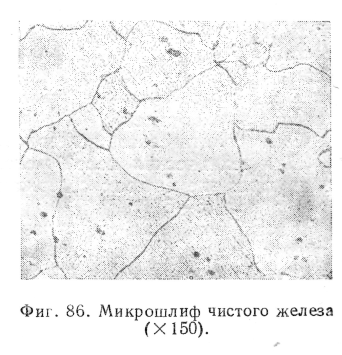
Модификации а- и б-железо имеют одинаковую пространственную кристаллическую решетку — пространственно - центрированный куб, у-Fe имеет решетку гранецентрированного куба. На фиг. 86 представлена микрофотография шлифа чистого железа (структура феррита). Для сплавов железа с углеродом кривые охлаждения и нагрева будут иметь уже другой вид.
Так, например, для сплава, содержащего 4,3% С, кривая охлаждения будет иметь вид, представленный на фиг. 87, для сплава, содержащего 0,83% С, — вид, представленный на фиг, 88, и т. д. Анализ этих кривых дается ниже.
Скачать реферат: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ
Пароль на архив: privetstudent.com
privetstudent.com
Пример выполнения задания по кривым охлаждения
Вычертите диаграмму состояния железо-цементит, укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую охлаждения для сплава, содержащего 0,6 % С. Какова равновесная структура этого сплава при комнатной температуре и как такой сплав называется?
Сплав с содержанием углерода 0,6 % называется доэвтектоидной сталью.
В исходном состоянии сталь имеет структуру, состоящую из зерен феррита (твердый раствор внедрения углерода в ОЦК-решетке железа) и зерен перлита (механическая смесь из феррита и цементита).
Микроструктура доэвтектоидной стали
(но это не сталь с содержанием 0,6 % С, здесь примерно 0,4 %С)
Для того, чтобы проследить, какие превращения претерпевает сплав (сталь 60) при охлаждении, проведем линию сплава и пронумеруем точки пересечения линии сплава с линиями диаграммы. Это и есть критические точки.
Критическая точка – это температура, при которой начинается, заканчивается или полностью протекает фазовое или другое превращение в сплаве. На кривых охлаждения им соответствуют остановки или линии перегиба.
1 – температура Ликвидус (линия AВCD) – при охлаждении начинается процесс кристаллизации, из жидкого раствора выпадают кристаллы аустенита;
2 – температура Солидус (линия AECF ) – при охлаждении заканчивается кристаллизация аустенита;
3 – критическая точка А3 (линия GS) – температура начала выделения феррита из аустенита;
4 – критическая точка А1 (линия PSK) – превращение (распад) оставшегося аустенита в перлит – эвтектоидное превращение;
5 – (на диаграмме не обозначена) – магнитное превращение цементита – 210С
1. Кристаллизация аустенита из жидкости Ж0,6 А0,6 (в интервале 1–2)
2. превращение части аустенита в феррит (путем полиморфного превращения):
А0,6 Ф0,02 (в интервале 3–4)
При этом оставшаяся часть аустенита обогащается по углероду до 0,8 %, согласно правилу отрезков.
3. Эвтектоидное превращение оставшейся части аустенита А0,8 П0,8 (Ф0,02 + Ц6,67) (на кривой охлаждения – горизонтальная линия 4–4/)
4. Выделение избыточного цементита третичного (ЦIII) из феррита: Ф0,02 Ц6,67
Кривая охлаждения:
Равновесная структура этого сплава – смесь феррита и перлита (рис. в начале)
Количественное оотношение феррита и перлита можно определить следующим образом (и нарисовать схему структуры надо в соотвествии:
Это только для доэвтектоидных стей
0,8 % С 100 % перлита
0,6 % С % перлита для данной марки стали
–это столько перлита содержится в стали с 0,6 % углерода
Вычертите диаграмму состояния железо-цементит, укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую охлаждения для сплава, содержащего 0,8 % С. Какова равновесная структура этого сплава при комнатной температуре и как такой сплав называется?
Кривая охлаждения:
|
от 2 до 3 в интервале от 3до3/ |
1. Кристаллизация аустенита из жидкости Ж0,8 А0,8
2. Эвтектоидное превращение А0,8 П0,8 (Ф0,02 + Ц6,67)
Сплав с содержанием углерода 0,8 % называется эвтектоидная сталь.
Равновесная (окончательная) структура этого сплава – перлит (механическая смесь феррита и цементита).
Вычертите диаграмму состояния железоцементит, укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую охлаждения для сплава, содержащего 1,0 % углерода. Какова равновесная структура этого сплава при комнатной температуре и как такой сплав называется?
Кривая охлаждения
Превращения, происходящие при охлаждении сплава от жидкого состояния до комнатной температуры
1. Кристаллизация аустенита из жидкости (от 1 до 2)
Ж1,0 А1,0
2. Выделение избыточного цементита вторичного из аустенита (от 3 до 4)
А1,0 А0,8+ Ц6,67
3. Эвтектоидное превращение (4–4/) А0,8 П0,8 (Ф0,02 + Ц6,67)
Формирование структуры
от 2 до 3 от3 до 4 сначала
В интервале 4…4/присмходит распад аустенита на (Ф-Ц)-смесь
Сплав, содержащий 1,0 % С – это заэвтектоидная сталь.
Структура при комнатной температуре – перлит + цементит вторичный
Структура после медленного охлаждения – перлит и цементит вторичный в виде сплошной цементитной сетки, что является браком.
Здесь по правилу отрезков можно определить количественное соотношение перлита и цементита. За основу берётся отрезок РSК.
Количество цементита =
Здесь учтен весь цементит: в составе перлита + в виде вторичного
Это мы рассматривали на практическом занятии
Вычертите диаграмму состояния железо-цементит, укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую охлаждения для сплава, содержащего 3,2 % углерода. Какова равновесная структура этого сплава при комнатной температуре и как такой сплав называется?
Сплав, содержащий 3,2 % С называется доэвтектическим чугуном.
Кривая охлаждения:
1. Кристаллизация аустенита из жидкости Ж3,2А2,14
2. Кристаллизация из оставшейся жидкости эвтектики (ледебурита), состоящей из кристаллов аустенита и цементита Ж4,3 Л4,3 (А2,14 + Ц6,67)
3. Выделение избыточного цементита вторичного (ЦII) из аустенита
А2,14 Ц6,67
4. Эвтектоидное превращение А0,8 П0,8 (Ф0,02 + Ц6,67)
5. Выделение избыточного цементита третичного (ЦIII) из феррита
Ф0,02 Ц6,67
Равновесная структура состоит из перлита (П), ледебурита (Л) и цементитаII (ЦII).
studfiles.net
Внутреннее строение металлов и сплавов Кристаллическое строение металлов
У веществ в твердом состоянии строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно.
У всех металлов и их сплавов строение кристаллическое. На рис.12показана структура чистого железа. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы - многогранники, поэтому их называюткристаллитами, зернамиили гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов.
Рис.12.Микроструктура чистого железа (х - 150)
Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемыекристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (- и- железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (- железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк,- титан,- кобальт).
Элементарная ячейкаповторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла.
Элементарная ячейка центрированного куба (рис.13) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре.
Рис.13. Элементарная ячейкаРис.14. Часть пространственной решет-
центрированного куба ки центрированного куба
Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств.
Рис.15. Элементарная ячейка кубаРис.16. Часть пространственной ре-
с центрированными гранями шетки куба с центрированными
гранями
На рис.14приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.15) состоит из 14 атомов, из них 8 атомов расположены по вершинам - куба и 6 атомов — по граням.
На рис.16приведена часть пространственной решетки куба с центрированными гранями ( гранецентрированного куба). На схеме имеется восемь элементарных ячеек; узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка (рис.17) состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре оснований и 3 атома — внутри призмы. Для измерения расстояния между атомами кристаллических решеток пользуются специальной единицей, называемойангстремом см.
Рис.17. Гексагональная ячейка
Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д.
Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называютсясвободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами.
Таким образом, в узлах решеток, обозначенных кружками рис.14и16, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается.
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов.
Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 - 50 %, а предел прочности—от 14 до 35 кГ/мм2для различных образцов. Это свойство кристаллов называютанизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве.
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называютсяплоскостями спайности.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность.
Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью(кажущейся изотропностью).
Аллотропия металлов(или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см.рис.14), а выше — решетку гранецентрированного куба (см.рис.16).
Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами , , и т. д., причем буквойобозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале.
Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец).
Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
На рис.18, априведена кривая нагрева металла. Здесь точка а- начало плавления, точкаb — окончание плавления.
Рис.18. Кривые нагревания (а) и охлаждения (б- без петли,
в - с петлей) металла
Участок аbуказывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления).
Переход из жидкого состояния в твердое при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладитьнесколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.19,6) находится несколько нижеtпл при температуре переохлажденияtпр.
У некоторых металлов переохлаждение (tпл — tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлажденияtпр(рис. 18, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти доtпл. В этом случае на графике вычерчивается петля теплового гистерезиса.
При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку.
Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен).
Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа.
Рис.19. Кривые охлаждения и нагревания железа
На рис.19приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 15390С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе.
Критические точки обозначаются буквой А, при нагревании обозначаютАcи при охлажденииAr индексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состоянияFe - Fe3C.
При температурах ниже 768 0С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют-железо ; при нагревании она в точкеАс2переходит в немагнитную модификацию-железо. Кристаллическая структура при этом не меняется.
В точке Ас3при температуре 9100С-железо переходит в-железо с кристаллической решеткой гранецентрированного куба.
В точке Ас4при температуре 14010С-железо переходит в-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб.
При охлаждении происходят те же переходы, только в обратной последовательности.
Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3).
Превращение в точке А3сопровождается изменением объема, так как плотность кристаллической решетки-железа больше плотности решетки-железа, в точкеАс3 объем уменьшается, в точкеAr3 - увеличивается.
studfiles.net
Внутреннее строение металлов и сплавов Кристаллическое строение металлов
У веществ в твердом состоянии строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно.
У всех металлов и их сплавов строение кристаллическое. На рис.12показана структура чистого железа. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы - многогранники, поэтому их называюткристаллитами, зернамиили гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов.
Рис.12.Микроструктура чистого железа (х - 150)
Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемыекристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (- и- железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (- железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк,- титан,- кобальт).
Элементарная ячейкаповторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла.
Элементарная ячейка центрированного куба (рис.13) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре.
Рис.13. Элементарная ячейкаРис.14. Часть пространственной решет-
центрированного куба ки центрированного куба
Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств.
Рис.15. Элементарная ячейка кубаРис.16. Часть пространственной ре-
с центрированными гранями шетки куба с центрированными
гранями
На рис.14приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.15) состоит из 14 атомов, из них 8 атомов расположены по вершинам - куба и 6 атомов — по граням.
На рис.16приведена часть пространственной решетки куба с центрированными гранями ( гранецентрированного куба). На схеме имеется восемь элементарных ячеек; узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка (рис.17) состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре оснований и 3 атома — внутри призмы. Для измерения расстояния между атомами кристаллических решеток пользуются специальной единицей, называемойангстремом см.
Рис.17. Гексагональная ячейка
Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д.
Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называютсясвободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами.
Таким образом, в узлах решеток, обозначенных кружками рис.14и16, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается.
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов.
Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 - 50 %, а предел прочности—от 14 до 35 кГ/мм2для различных образцов. Это свойство кристаллов называютанизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве.
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называютсяплоскостями спайности.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность.
Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью(кажущейся изотропностью).
Аллотропия металлов(или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см.рис.14), а выше — решетку гранецентрированного куба (см.рис.16).
Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами , , и т. д., причем буквойобозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале.
Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец).
Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
На рис.18, априведена кривая нагрева металла. Здесь точка а- начало плавления, точкаb — окончание плавления.
Рис.18. Кривые нагревания (а) и охлаждения (б- без петли,
в - с петлей) металла
Участок аbуказывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления).
Переход из жидкого состояния в твердое при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладитьнесколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.19,6) находится несколько нижеtпл при температуре переохлажденияtпр.
У некоторых металлов переохлаждение (tпл — tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлажденияtпр(рис. 18, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти доtпл. В этом случае на графике вычерчивается петля теплового гистерезиса.
При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку.
Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен).
Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа.
Рис.19. Кривые охлаждения и нагревания железа
На рис.19приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 15390С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе.
Критические точки обозначаются буквой А, при нагревании обозначаютАcи при охлажденииAr индексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состоянияFe - Fe3C.
При температурах ниже 768 0С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют-железо ; при нагревании она в точкеАс2переходит в немагнитную модификацию-железо. Кристаллическая структура при этом не меняется.
В точке Ас3при температуре 9100С-железо переходит в-железо с кристаллической решеткой гранецентрированного куба.
В точке Ас4при температуре 14010С-железо переходит в-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб.
При охлаждении происходят те же переходы, только в обратной последовательности.
Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3).
Превращение в точке А3сопровождается изменением объема, так как плотность кристаллической решетки-железа больше плотности решетки-железа, в точкеАс3 объем уменьшается, в точкеAr3 - увеличивается.
studfiles.net
Кривая охлаждения чистого железа — КиберПедия
Анизотропия свойств кристаллов
Анизотропия – это зависимость свойств кристалла от направления. Возникает в результате упорядоченного расположения атомов в пространстве.
Свойства кристаллов определяются взаимодействием атомов
В кристалле расстояния между атомами в различных кристаллографических плоскостях различны, поэтому различны и свойства.
Например, прочность и пластичность монокристалла меди изменяются в зависимости от направления 180-350 Мпа, и 10-50 %. Для поликристалла прочность 250 Мпа, пластичность 40%.
В природе кристаллические тела – поликристаллы, т.е. состоят из множества мелких различно ориентированных кристаллов. В этом случае анизотропии нет, т.к. среднестатистическое расстояние между атомами по всем направлениям оказывается примерно одинаковым.
В связи с этим поликристаллические тела считают квазиизотропными (мнимо).
Все аморфные тела – изотропны - свойства у них одинаковы во всех направлениях
ДЕФЕКТЫ КРИСТАЛЛОВ
Строение реальных кристаллов отличается от идеальных. В реальных кристаллах всегда содержатся дефекты, которые подразделяются на точечные, линейные, поверхностные и объемные. Дефекты имеют различные размеры. У точечных размеры близки к атомным, у линейных длина на несколько порядков больше ширины, объемные дефекты (поры, трещины) могут иметь макроскопические размеры.
Точечные дефекты
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей.
Рис.2.1. Точечные дефекты
Линейные дефекты
Основными линейными дефектами являются дислокации. Априорное представление о дислокациях впервые использовано в 1934 году Орованом и Тейлером при исследовании пластической деформации кристаллических материалов, для объяснения большой разницы между практической и теоретической прочностью металла.
Дислокация
Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей.
Простейшие виды дислокаций – краевые и винтовые.
Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край «лишней» полуплоскости.
Рис. 2.2. Краевая дислокация (а) и механизм ее образования (б)
Винтовая дислокация
Другой тип дислокаций был описан Бюргерсом, и получил название винтовая дислокация
Плотность дислокаций
Свойства кристаллов зависят от количества дефектов, которые формируют понятие «плотность дислокаций». Плотность дислокации – это суммарная длина всех линий дислокации в одном кубическом сантиметре кристалла.
cyberpedia.su
Термические кривые нагрева и охлаждения металлов.
Дом  Термические кривые нагрева и охлаждения металлов.
Термические кривые нагрева и охлаждения металлов.
просмотров - 199
Процесс кристаллизации.
Аллотропические превращения в металлах.
Классификация металлов.
Тема 1. Строение и кристаллизация металлов.
Вопросы:
2. Кристаллическое строение металлов. Типы кристаллических решёток.
1. Большое число различных металлов, которые применяют в технике, можно разделить на черные и цветные.
Черные металлы имеют темно-серый цвет, большую плотность, высокую температуру плавления, относительно высокую твердость и во многих случаях обладают полиморфизмом.
Цветные металлы имеют красную, желтую, белую окраску; обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления; для них характерно отсутствие полиморфизма.
К черным металлам относят железо и его сплавы, к цветным – все остальные металлы и их сплавы.
Учитывая зависимость отсодержания углерода чёрные сплавы делят на стали и чугуны.
Сталями называют сплавы железа с углеродом, в которых углерода содержится до 2,14%, а чугунами – свыше 2,14%.
Цветные металлы подразделяют на тяжелые (медь, свинец, олово, никель и др.), легкие (алюминий, магний и др.), редкие (молибден, вольфрам, ванадий и др.) и благородные (золото, платина, серебро).
2.Все тела состоят из атомов. Тела, в которых атомы расположены беспорядочно, называют аморфными (стекло, канифоль, воск, смола и др.). Кристаллические тела (все металлы и металлические сплавы), характеризуются упорядоченным расположением атомов. В металлах и металлических сплавах атомы находятся в узлах пространственных кристаллических решеток.
В процессе кристаллизации металлов и сплавов могут образовываться кристаллические решетки разного типа. Наиболее распространенными являются объемно- центрированная кубическая (К, V, Сr, Fеα, Мо, W), гранецентрированная кубическая (Аl, Feγ, Ni, Сu, Аg, Аu, Рb) и гексагональная решетки (Ве, Мg, Со, Zn, Тi). Гранецентрированная кубическая и гексагональная решетки характеризуются наиболее плотной упаковкой атомов и их компактным размещением (рис.1).
Расстояния между соседними атомами в кристаллической решетке (параметр решётки) исключительно малы. Для их измерения пользуются особой единицей – ангстремом (А°), который равен 1А° = 10-8 см, или нанометром (1 нм = 10-9 см).
Рис. 1. Расположение атомов в кристаллических решетках:
а – объемно-центрированная кубическая; б – гранецентрированная кубическая; в – гексагональная
3.Некоторые металлы в твердом состоянии (железо, марганец, кобальт и др.) в зависимости от температуры нагрева могут иметь кристаллические решетки различного строения и, следовательно, обладать различными свойствами. Это явление принято называть аллотропией, или полиморфизмом. Вместе с тем, известен полиморфизм под влиянием температуры и давления. При нагреве до 2000 °С и давлении ~ 1010 Па углерод в форме графита перекристаллизовывается в алмаз.
Аллотропические формы принято обозначать буквами греческого алфавита: альфа, бета͵ гамма и т. д.
К металлам, не претерпевающим аллотропических превращений в твердом состоянии при нагревании и охлаждении, относятся алюминий, магний, медь и др. Большое число технически важных металлов (олово, цинк, никель, кобальт и др.) подвержено аллотропическим изменениям.
4.Кристаллизацией принято называть образование кристаллов в металлах и сплавах при переходе из жидкого состояния в твёрдое (первичная кристаллизация), а также перекристаллизация в твёрдом состоянии (вторичная кристаллизация).
Процесс кристаллизации металла складывается из двух элементарных процессов: образования центров кристаллизации (зародышей) и роста кристаллов из этих центров. При температуре кристаллизации в жидком металле сначала образуются центры кристаллизации, причем их роль играют разные примеси, мельчайшие шлаковые и неметаллические включения. После образования зародышей атомы жидкого металла, расположенные беспорядочно, начинают располагаться вокруг этих зародышей и образуют кристаллы правильной геометрической формы. Так как кристаллизация начинается одновременно во многих местах и рост кристаллов идет по всем направлениям, то смежные кристаллы, сталкиваясь между собой, мешают свободному росту каждого. Это приводит к тому, что кристаллы приобретают неправильную внешнюю форму, несмотря на их упорядоченное внутреннее строение. Кристаллы неправильной формы принято называть кристаллитами, полиэдрами, или зернами. Образовавшиеся реальные кристаллы имеют те или иные несовершенства (дефекты) кристаллического строения, которые принято классифицировать по характеру их измерения в пространстве на точечные (нульмерные), линейные (одномерные), поверхностные (двухмерные), объемные (трехмерные).
Наиболее распространены точечные. К ним относят вакансии (узлы в кристаллической решетке, свободные от атомов), межузельные атомы (атомы, находящиеся вне узлов кристаллической решетки), а также примесные атомы, (рис.2).
Рис. 2. Точечные дефекты в кристаллической решетке:
а – вакансия; б – межузельный атом; в – примесный атом внедрения
5.При наблюдении за охлаждением и нагревом чистого металла бывают построены кривые охлаждения и нагревания в координатах температура – время. Горизонтальный участок а кривой соответствует температурной остановке – температуре затвердевания или расплавления чистого металла.
Вследствие поглощения металлом скрытой теплоты плавления температура остается постоянной (tпл), что отмечено на графике горизонтальным участком кривой нагревания (рис. 3, а). Только после того как металл расплавился полностью, его температура повышается по наклонному участку кривой.
Рис. 3. Кривые нагревания и охлаждения чистого металла, аморфного тела и сплава:
а – кривая нагревания; б – кривая охлаждения без переохлаждения; в – кривая с переохлаждением; г – кривая с петлей переохлаждения; д – кривая охлаждения аморфного тела; е – кривая охлаждения сплава
oplib.ru
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)