|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Коррозия металлов и сплавов и меры защиты от нее. Коррозия металлов и способы защиты металлов от коррозии
КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
⇐ ПредыдущаяСтр 4 из 7Следующая ⇒Коррозией называется окислительно-восстановительный процесс разрушения металлов и сплавов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой. Причиной коррозии является термодинамическая неустойчивость чистых металлов. «Corrosio» означает разъедание. Разрушение материала истиранием относится к процессу эрозии.
По механизму процессы коррозии делятся нахимические и электрохимические.
При химической коррозии металл взаимодействует со средой, не проводящей электрический ток. Передача электронов от атома металла к окислителю происходит при их непосредственном контакте за один акт без разделения на стадии. Например, коррозия в сухих газах Н2, О2, NO2,SO2,h3S,Cl2и др. Это – газовая коррозия. Так, кислород взаимодействует с металлом, образуя на его поверхности оксидную пленку. С повышением температуры скорость коррозии возрастает. Например, железо при 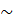 300
300  С тускнеет на воздухе, образуя оксидную пленку, а при температуре около 600
С тускнеет на воздухе, образуя оксидную пленку, а при температуре около 600  С возникает слой окалины, т.е. толстый слой оксидной пленки.
С возникает слой окалины, т.е. толстый слой оксидной пленки.
Более опасна водородная коррозия. Водород растворяется в металле, при этом он атомизируется. Атомы водорода подвижнее его молекул, и поэтому проникают в глубинные слои металла, взаимодействуя с карбидом железа Fe3C – источником прочности стали. Сталь обезуглероживается, при этом ухудшается ее прочностные свойства. Углерод карбида железа, соединяясь с водородом, образует метан, который нерастворим в металле. Образовавшиеся пузырьки метана испытывают огромное давление, металл из-за них становится хрупким. Это так называемое водородное охрупчивание. Таким образом, при водородной коррозии может наблюдаться потеря прочности, вследствие умягчения стали и возникновения ее хрупкости.
Коррозия в присутствии кислорода, например атмосферного, разрушает металл с поверхности, превращая его в оксидную пленку. Лишь у некоторых металлов (Zn, Al, Cr и некоторых других) эта пленка защищает их от дальнейшей коррозии. Газовая коррозия протекает в сухих газах или в присутствии воды, но при температуре выше температуры ее конденсации, т.е. когда вода находится в виде пара.
Другой разновидностью химической коррозии является коррозия является коррозия в неэлектролитах, когда коррозионно-агрессивный агент, например, сероводород, растворен в углеводородах, что может иметь место в моторном масле. Но даже в присутствии в неэлектролитах следов влаги механизм коррозии будет уже нехимической.
Электрохимическая коррозия протекает по законам электрохимии при наличии всех ее необходимых условий, т.е. электролита, катода и анода. По сути, эта работа гальванического элемента, сопровождаемая химическими изменениями веществ и выделением электрического тока или тока коррозии.
Электрохимическая коррозия подразделяется на следующие разновидности: коррозия в электролитах, атмосферная коррозия, грунтовая, морская, электрическая.
Катодом служит какая-либо примесь в металле, например карбид железа Fe3C, анодом – любой прилегающий участок железа. На анодном участке железо окисляется Fe = Fe2+ + 2e, а свободные электроны движутся к катоду, где они присоединяются к ионам водорода
2Н+ + 2е = Н2↑
При этом свободный водород выделяется в виде пузырьков.
Пример. В железной конструкции содержатся детали из меди. Составьте схему процесса коррозии в растворе соляной кислоты. Как отразится контакт железа с медью на процессе коррозии?
Решение. При контакте железа с медью, т.е. металлов, отличающихся по активности, в присутствии электролита возникает короткозамкнутый гальванический элемент, в котором железо, как более активный металл ϕ0Cu2+/Cu=0,34 Bявляется катодом. Схему гальванического элемента можно записать в виде
(-) Fe | HCl | Cu(+)
Схему протекания электрохимической коррозии можно представить электронными уравнениями
А (-) Fe – 2е = Fe2+
К (+) 2Н+ + 2е = Н2
В наибольшей мере металлы разрушаются от атмосферной коррозии. Необходимым условием ее возникновения является наличие воды и кислорода. Основной причиной атмосферной коррозии является неравномерная аэрация поверхности металла. Участки, где кислорода меньше, являются анодными; участки, где его больше – катодными. Схема возникновения и развития атмосферной коррозии на участке железа с неравномерной аэрацией – неравномерным контактом атмосферы с поверхностью металла.
Атмосферный кислород достигает поверхности трещины или зазора в металле позднее, чем основной поверхности металла. Взаимодействуя с металлом, кислород образует оксид, т.е. пассивную пленку, которая является катодом, а участок металла, до которого не успел дойти кислород, - анодом. Возникает гальванический элемент, и металл поверхности трещины начинает окисляться. В этом месте образуется каверна, которая разрастается. Ионы железа, взаимодействуя с водой, превращаются в гидроксид железа (II) – первичный продукт коррозии
Fe2+ + 2ОН- = Fe(OH)2,
А ионы водорода восстанавливаются до свободного водорода. В избытке кислорода гидроксид железа (II) превращается в гидроксид железа (III):
4Fe(OH)2 + O2 + 2h3O = 4Fe(OH)3.
Смесь Fe(OH)2 и Fe(OH)3 называется ржавчиной. Оксидная формула ржавчины имеет вид nFeO*mFe2O3*ph3O.
Разновидностью атмосферной коррозии являются грунтовая и морская коррозия.
Для предотвращения больших потерь от коррозии применяются различные методы для ее ослабления:
защита путем изменения коррозионной среды;
неметаллические покрытия;
металлические покрытия;
легирование металлов;
электрохимическая защита.
Скорость процессов коррозии может быть существенно уменьшена введением в коррозионную среду ингибиторов (замедлителей) коррозии. К числу ингибиторов относятся многие вещества неорганического или органического характера, например, нитриты и нитраты, хроматы, альдегиды, гетероорганические соединения и другие. Ингибиторы вводятся в среду в малых количествах, порядка долей процента, при этом скорость коррозии уменьшается в сотни и тысячи раз. Если вводить ингибитор, например в кислоту, то она не изменяет своих свойств по отношению к разным химическим соединениям, но теряет свою агрессивность по отношению к металлам. Это происходит вследствие того, что ингибиторы адсорбируются на поверхности металла, образуя тонкие пленки, которые выводят из строя коррозионные микрогальванопары, препятствуя протеканию электродных процессов.
Неметаллические покрытия делятся на неорганические и органические. К неорганическим покрытиям относятся оксидные и фосфатные пленки на железе. При кипячении железа в растворах солей фосфорной кислоты (обычно солей железа и марганца) получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере.
Широко распространены органические покрытия, например, лаки, краски, консервационные смазки.
При защите металлов другими металлами различают анодные и катодные покрытия. Анодное покрытие обладает более отрицательным электродным потенциалом, чем защищаемый металл, и при образовании гальванопары служит анодом, т.е. разрушается, выполняя защитную функцию. К катодным относятся покрытия с противоположным соотношением в свойствах металлов, например, железо луженое или покрытое медью. В этом случае покрытие выполняет изолирующую функцию до тех пор, пока оно не разрушено. Если целостность катодного покрытия нарушается, то возникает гальванический элемент, работа которого сводится к разрушению защищаемого металла.
Для защиты металловот наиболее распространенного и вредного вида химической коррозии – газовой коррозии – используют жаростойкое легирование, т.е. введение в состав сплава компонентов, повышающих жаростойкость. Единой теории, объясняющей механизм этого вида защиты, не существует. Две из трех наиболее обоснованных теорий объясняют механизм этого вида защиты образованием защитных пленок легирующим металлом.
Электрохимическая защита подразделяется на протекторную и катодную. При протекторной защите защищаемая конструкция находится в среде электролита (вода, грунт).
Для протекторной защиты используется специальный электрод – протектор с более отрицательным потенциалом, чем потенциал защищаемой конструкции.
В других методах, называемых катодной защитой, аналогичный результат достигается присоединением металла к отрицательному полюсу внешнего источника постоянного тока. Защитное действие осуществляется благодаря повышению концентрации электронов в поверхностном слое металла, что затрудняет его растворение.
Газы и жидкости
Законы идеального газа
Состояние газа можно охарактеризовать тремя параметрами: температурой, давлением и объемом.
Единицей измерения термодинамической температуры Тв Международной системе единиц СИ является 1 кельвин (К). Для выражения результатов практических измерений температуры tприменяется градус Цельсия (ºС) – единица температуры Международной практической температурной шкалы:
1 градус Цельсия (ºС) = 1 К.
Температура по Международной термодинамической и Международной практической шкалам может быть выравнена как в градусах Цельсия, так и Кельвина. Соотношение между данными шкалами выражается уравнением Т =t+273,15, или Т ≈t+273.
Давление газа р в системе СИ выражается в паскалях. Паскаль – это давление, при котором на площадь 1 м2 действует сила в один ньютон (1Н):
р = 1Н/1 м2 = Н/м2 = 1 Па (паскаль).
В качестве единицы объема в системе Си принят кубический метр (м3). Допускается применение дольных и кратных единиц (дм3, см3, мм3). В химии в качестве единицы объема используется литр (л):
л = 1,000028 дм3 = 1,000028 ∙ 10-3 м3.
При вычислениях с точностью до четвертого знака можно считать, что 1 л ≈ 1 дм3 ≈ 1 ∙ 10-3 м3.
Температура 0º С (273 К) и давление 101 325 Па характеризуют нормальные условия для газа (н. у.). Объем, занимаемый газом при этих условиях, обозначают через υ0.
В производственных условиях довольно часто приходится иметь дело с газами, находящимися при низких давлениях и высоких температурах. В этом случае при расчетах без больших погрешностей можно использовать простые закономерности, установленные для идеальных газов.
Для данной ассы газа при постоянной температуре произведение давления (р) на объем (υ) есть величина постоянная (закон Бойля – Мариотта), или при постоянной температуре объемы данной массы газа обратно пропорциональны давлениям, под которыми находится газ:
р1/ р2 = υ2 / υ1.
Плотность газа ρ и его концентрации С при постоянной температуре прямо пропорционально давлениям:
ρ1 / ρ2 = р1/ р2,
С1/ С2= р1 / р2.
При постоянном давлении объемы данной массы газа прямо пропорциональны абсолютным температурам (закон Гей-Люссака). При постоянном объеме давления данной массы газа прямо пропорционально абсолютным температурам (закон Шарля):
υ1/ Т1= υ2 / Т2 = υ3 / Т3;
р1 / Т1= р2 / Т2 = р3 / Т3.
Плотности и концентрации газа, находящегося под постоянным давлением, изменяются обратно пропорционально абсолютным температурам:
ρ1 / ρ2 = Т2 / Т1 ,
С1 / С2 = Т2 / Т1.
Пример 1. Газ под давлением 1,2 ∙105 Па занимает объем 4,5 л. Каково будет давление если, не изменяя температуры, увеличить объем до 0,0055 м3?
Р е ш е н и е. Дано:
р1 = 1,2 ∙ 105 Па Используем формулу закона
υ1= 4,5 л = 4,5 ∙ 10-3 м3Бойля – Мариотта
υ2 = 0,0055 м3 р1/ р2= υ2/ υ1 , откуда
t = const р2= р1υ1/ υ2
р2= 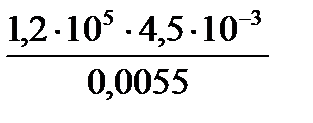 = 9,8 ∙ 104 Па
= 9,8 ∙ 104 Па
Пример 2.При 37º С объем газа равен 0,5 м3. Какой объем займет газ при 100º С, если давление останется постоянным?
Р е ш е н и е. Определяем объем газа, применяя закон Гей-Люссака:
υ2= υ1Т2 / Т1.
В градусах термодинамической шкалы температура равна:
Т1= 37 + 273 = 310К, Т2 = 100 + 273 = 373 К,
υ2= 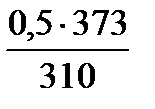 = 0,60 м3 .
= 0,60 м3 .
Пример 3.При н. у. концентрация метана равна 0,0447 кмоль/м3. Вычислить, при какой температуре и нормальном давлении масса 10 м3 метана будет равна 8 кг?
Р е ш е н и е. Определяем Т :
Т = С0Т0/ С ; Т0 = 273 К.
Число киломолей метана равна 8/16 = 0,5 , а концентрация С = 0,5/10 = 0,05 кмоль/м3 ;
Т = 0,0447 ∙ 273 / 0,05 = 244 К; t = 244 – 273 = -29º С.
ЗАДАЧИ
1. В стальном баллоне емкостью 12 л находится кислород под давлением 1,418 ∙ 107 Па и при 0º С. Какой объем (м3) займет это количество кислорода при н. у.?
2. При н. у. плотность ацетона 1,16 кг/м3. Определить плотность этого же газа под давлением 1,216 ∙ 106 Па и 0º С.
3. Масса 1 м3 воздуха при н. у. 1,293 кг. Какова масса этого же объема воздуха при 435 Па и 0º С?
4. Под давлением 6,078 ∙ 105 Па 2,4 кг кислорода занимают объем 3 м3. Вычислить давление, при котором концентрация кислорода равна 0,1 кмоль/м3. Температура постоянная.
5. При 17º С газ занимает объем 680 м3. Какой объем займет этот газ при 100º С, если давление его остается неизменимым?
6. При 17º С газ занимает объем 68,25 м3. До какой температуры нужно охладить газ при постоянном давлении, чтобы его объем стал 50,42 м3?
7. При 17º С давление газа в закрытом сосуде 95 940 Па. На сколько понизится давление, если охладить газ до -50º С?
8. Давление газа в баллоне при 17º С равно 1,52 ∙ 107 Па. При какой температуре оно будет составлять 60% от первоначального?
9. Плотность газообразного хлора при н. у. 3,124 кг/м3. Вычислить плотность хлора, принимая его за идеальный газ, при 37º С и том же давлении.
10. Плотность оксида углерода при 80º С и нормальном давлении 0,967 кг/м3. Определить плотность его при н. у.
Читайте также:
lektsia.com
Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё Урок химии в 11 классе Автор: Наумов Сергей
КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. Химический энциклопедический словарь
Слово коррозия происходит от латинского «corrodo» – «грызу» (позднелатинское «corrosio» означает «разъедание» ). Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.
Химическая коррозия 0 +4 0 t +3 +6 -2 2 Fe+ 3 SO 2 + 3 O 2 Fe 2(SO 4)3 0 0 t +3 -1 2 Fe + 3 Cl 2 2 Fe. Cl 3 0 0 t +2 -2 2 Zn + O 2 2 Zn. O Коррозия происходит в непроводящей ток среде. Например, взаимодействие металла с сухими газами или жидкостями - неэлектролитами (бензином, керосином и т. д. )
Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха.
Электрохимическая коррозия Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Металлы не однородны и содержат различные примеси. При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.
Рассмотрим разрушение железного образца в присутствии примеси олова. 1. В кислой среде: На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит: Fe 0 – 2 e = Fe 2+ (анод) На катоде (олово) происходит восстановление катионов водорода: 2 H+ + 2 e H 20 Ржавчина не образуется, т. к. ионы железа (Fe 2+) переходят в раствор
2. В щелочной или нейтральной среде: Fe 0 – 2 e Fe 2+ (на аноде) O 20 + 2 H 2 O + 4 e 4 OH – (на катоде) ____________________________ Fe 2+ + 2 OH - Fe(OH)2 4 Fe (OH)2 + O 2 + 2 H 2 O = 4 Fe (OH)3 ( Ржавчина)
В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением: 4 Fe + 6 H 2 O (влага) + 3 O 2 (воздух) = 4 Fe(OH)3
Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид железа(III). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.
Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности
Значительноусиливает коррозию повышение температуры
Зимой для удаления снега и льда с тротуаров используют техническую соль. Образующиеся растворы создают благоприятную среду для электрохимической коррозии подземных коммуникаций и деталей автомобилей.
Способы защиты от коррозии
1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение легированных сплавов, содержащих специальные добавки : хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой(например Cr 2 O 3). Общеизвестные легированные стали – «нержавейки» , из которых изготовляют предметы домашнего обихода(ножи, вилки, ложки), детали машин, инструменты.
3. Нанесение защитных покрытий Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы. Химические – искусственно создаваемые поверхностные плёнки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению – это процесс получения тончайшей плёнки оксидов железа на поверхности стального изделия.
Металлические – это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные плёнки. Нанесение хрома- хромирование, никеля - никелирование, цинка - цинкование и т. д. Покрытием может служить и пассивный в химическом отношении металл – золото, серебро, медь.
4. Электрохимические методы защиты *Протекторная (анодная) – к защищаемой металлической конструкции присоединяют кусочек более активного металла (протектора), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и др. стальных изделий используются магний, алюминий, цинк. *Катодная – металлоконструкцию подсоединяют к катоду внешнего источника тока , что исключает возможность её анодного разрушения.
5. Специальная обработка электролита или другой среды, в которой находится защитная металлическая конструкция Введение веществ - ингибиторов, замедляющих коррозию. Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота –азотной кислотой; летучий диэтиламин впрыскивают в различные ёмкости. Ингибиторы действуют только на металл, делая его пассивным по отношению к среде. Науке известно более 5 тыс. ингибиторов коррозии. Удаление растворённого в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.
Спасибо за внимание!
present5.com
Коррозия металлов и способы защиты от коррозии | Учеба-Легко.РФ
При обычных условиях металлы могут вступать в химические реакции с веществами, содержащимися в окружающей среде, - кислородом и водой. На поверхности металлов появляются пятна, металл становится хрупким и не выдерживает нагрузок. Это приводит к разрушению металлических изделий, на изготовление которых было затрачено большое количество сырья, энергию и количество человеческих усилий.
Коррозией называют самопроизвольное разрушение металлов и сплавов под воздействием окружающей среды.
Яркий пример коррозии - ржавчина на поверхности стальных и чугунных изделий. Ежегодно из-за коррозии теряют около четверти всего производимого в мире железа. Затраты на ремонт или замену судов, автомобилей, приборов и коммуникаций, водопроводных труб во много раз превышают стоимость металла, из которого они изготовлены. Продукты коррозии загрязняют окружающую среду и негативно влияют на жизнь и здоровье людей.
Химическая коррозия происходит в различных химических производствах. В атмосфере активных газов (водорода, сероводорода, хлора), в среде кислот, щелочей, солей, а также в расплавах солей и других веществ происходят специфические реакции с привлечением металлических материалов, из которых сделаны аппараты, в которых осуществляется химический процесс. Газовая коррозия происходит при повышенных температурах. Под ее влияние попадают арматура печей, детали двигателей внутреннего сгорания. Электрохимическая коррозия происходит, если металл содержится в любом водном растворе.
Наиболее активными компонентами окружающей среды, которые действуют на металлы, является кислород О2, водяной пар Н2О, карбон (IV) оксид СО2, серы (IV) оксид SО2, азота (IV) оксид NО2. Очень сильно ускоряется процесс коррозии при контакте металлов с соленой водой. По этой причине корабли ржавеют в морской воде быстрее, чем в пресной.
Суть коррозии заключается в окислении металлов. Продуктами коррозии могут быть оксиды, гидроксиды, соли и т.д.. Например, коррозии железа можно схематично описать следующим уравнением:
4Fe + 6h3O + 3O2 → 4Fe (OH) 3.
Остановить коррозию невозможно, но ее можно замедлить. Существует много способов защиты металлов от коррозии, но основным приемом является предотвращение контакта железа с воздухом. Для этого металлические изделия красят, покрывают лаком или покрывают слоем смазки. В большинстве случаев этого достаточно, чтобы металл не разрушался в течение нескольких десятков или даже сотен лет. Другой способ защиты металлов от коррозии электрохимическое покрытие поверхности металла или сплава другими металлами, устойчивых к коррозии (никелирование, хромирование, оцинковка, серебрение и золочение). В технике очень часто используют специальные коррозионностойкие сплавы. Для замедления коррозии металлических изделий в кислой среде также используют специальные вещества - ингибиторы.
uclg.ru
Коррозия металлов и защита от не
Коррозией ( от лат. «corroder – разъедать» ) называется самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды. Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозий мала, ежегодно из–за коррозии теряется безвозвратно огромное количество металла. По ориентировочным подсчетам безвозвратные потери металла от коррозии составляют 10 – 15 % мировой продукции стали. Но еще больший вред связан не с потерей металла, а с порчей изделий, вызываемой коррозией. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, трубопроводов, приборов, во много раз превышают стоимость металла, из которого они изготовлены. Наконец, существенными бывают косвенные потери, вызванные коррозией. К ним можно отнести, например, утечку различных продуктов ( нефть, газ, вода, пар) из подвергшихся коррозии трубопроводов, порчу продуктов питания, потерю здоровья, иногда и жизни людей в тех случаях, когда это вызвано коррозией представляет собой важную проблему, а на защиту от коррозии тратятся большие средства. К основным видам коррозии относятся химическая и электрохимическая коррозии.
Химическая коррозия металлов.
Коррозия металлов может протекать при взаимодействии металлов с сухими газами или растворами не электролитов. Такая коррозия называется химической. Взаимодействие металлов с газами ( газовая коррозия ) происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т.д. Газовую коррозию претерпевает также металл, подвергаемый термической обработке.
Например, сталь при температурах выше 200 о С начинает интенсивно коррозировать в присутствии многих других газов ( хлора, оксидов азота, углерода, серы ), но главным реагентом для стали является кислород. Медь активно взаимодействует с окислами углерода и серы, содержащимися в атмосфере. Из цветных металлов устойчив к газовой коррозии в воздушных средах никель, а его сплавы с хромом устойчивы к коррозии даже при температурах, превышающих 1000 о C. Отдельной проблемой выступает коррозия энергетических трубопроводов, предназначенных для транспортировки воды и пара. Металл трубопровода подвергается коррозии (окислению) под воздействием растворенного в ней (или конденсате) кислорода. Так как большинство современных систем водоснабжения такие, где обеззараживание воды достигается с помощью хлорсодержащих компонентов, материал трубопровода подвергается интенсивному воздействию ионов хлора. При взаимодействии образуются двух – и трехвалентные хлориды железа, очень трудно растворимые в воде, которые разрушают металл стенки трубопровода и в дальнейшем приводят к его разрушению (образованию свищей, разрушению сварных швов, порывов стенки трубопровода и т.п. ). Отдельным видом коррозии металлов является электрохимическая коррозия. К электрохимической коррозии относятся все случаи коррозии в водных растворах. Электрохимической коррозии подвергаются, например, подводные части судов, паровые котлы, проложенные в земле трубопроводы. Коррозия металла, находящегося во влажной атмосфере, также представляет собой электрохимическую коррозию. В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла в растворе в виде ионов.
Однако, физические и химические свойства отдельных металлов (алюминия) являются одним из защитных средств от коррозии. Так, оксиды алюминия образуют на стенке металла химически прочный продукт, который плохо реагирует с кислородом и другими окислителями. Пленка оксида, образующаяся на стенках алюминиевых деталей, препятствует разрушению металла стенки и является одним из способов защиты от коррозий. К важным случаям электрохимической коррозии относятся коррозия в природных водах, в растворах, атмосферная коррозия, коррозия в грунте, коррозия при неравномерной аэрации, контактная коррозия. Атмосферная коррозия – коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от ряда условий. В частности, на нее влияет влажность воздуха и содержание в нем газов образующих с водою кислоты (CO 2, SO2, и др.). Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию влаги.
Коррозия в грунте ( почвенная коррозия ) приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный воздух. В зависимости от состава грунтовых вод, а также от структуры и минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Коррозия при неравномерной аэрации – наблюдается в тех случаях, когда деталь или конструкция находится в растворе, но доступ растворенного кислорода к различным ее частям неодинаков. При этом те части металла, доступ кислорода к которым минимален, коррозируют значительно сильнее тех частей, доступ кислорода к которым больше. Локализация процесса окисления приводит к местной коррозии – интенсивному разрушению металла на отдельных участках. Местная коррозия приводит к появлению на поверхности металла углублений («язв»), которые со временем могут превращаться в сквозные отверстия. Этот вид коррозии особенно опасен для обшивки судов, для промышленной химической аппаратуры и в ряде других случаев.
Современные методы защиты металлов от коррозии
Для предупреждения коррозии и защиты от нее применяются многие способы, которые включают в себя изменение коррозионных свойств металла, изменение свойств коррозионной среды.
К электрохимическим методам защиты металлов относятся катодная защита, протекторная защита и др. При катодной защите защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анодов используется куски железа или специально изготовленные сплавы. И протекторы и катодная защита применимы в средах, хорошо проводящих электрический ток, например, в морской воде. В частности, протекторы широко применяются для защиты подводных частей морских судов. Следующим методом защиты от коррозии является изменение коррозионных свойств металла, которое достигается его легированием или нанесением на поверхность металла защитных покрытий.
Наиболее широко применение имеют нержавеющие стали, в состав которых входит до 18 % хрома и до 10% никеля. В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются драгоценные металлы – серебро, золото. Отдельным направлением служит сохранение металла неметаллическими методами. К ним относятся покрытия с защитными материалами: лаками, красками, грунтовками, эмалями, фенолоформальдегидными смолами. Для длительной защиты от атмосферной коррозии металлических сооружений, деталей машин, приборов чаще всего применяются лакокрасочные покрытия. Покрытия, создаваемые химической или электрохимической обработкой металла, представляют собой в основном защитные оксидные или солевые пленки. Примерами могут служить оксидирование алюминия, фосфатирование стальных изделий. Изменение свойств коррозионной среды пригодно для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода ( деаэрация ) или в добавлении к этому раствору веществ, замедляющих коррозию, - ингибиторов. В зависимости от вида коррозии, природы металла и раствора применяются различные ингибиторы. Защитное действие ингибиторов обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металла и каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы ) переводят металл в пассивное состояние.
biofile.ru
Коррозия металлов и методы защиты от нее
 Коррозия металлов и методы защиты от нее
Коррозия металлов и методы защиты от нее Категория:
Промышленные материалы
 Коррозия металлов и методы защиты от нее
Коррозия металлов и методы защиты от нее Коррозией называется разрушение металла вследствие химического или электрохимического взаимодействия его с окружающей средой. Коррозии подвержены все металлы, но в зависимости от условий эксплуатации, хранения и транспортирования протекает она по-разному. Примерно около 10% выплавляемых черных металлов ежегодно теряются в виде коррозионной пыли.
Первоначальная стадия коррозии выражается в потускнении поверхности металла, появлении на изделиях темных точек или участков, окрашенных в другой цвет, например медь становится зеленоватой.
Коррозию классифицируют по механизму разрушения (окисления), виду агрессивной среды, характеру разрушения.
В зависимости от механизма разрушения коррозию подразделяют на химическую и электрохимическую.
Химическая коррозия характеризуется только окислительными процессами. Протекает она в неэлектролитах — бензине, керосине, сухих газах. Этот вид коррозии часто наблюдается при высоких температурах. При комнатной температуре металлы также окисляются с образованием на поверхности оксидной пленки, которая препятствует проникновению агрессивных элементов вглубь.
Электрохимическая коррозия в отличие от химической характеризуется наличием окислительных и восстановительных процессов при протекании электрического тока. Она является наиболее распространенной и сложной. К ней относится коррозия в атмосферных условиях, в морской и речной воде, в электролитах.
По виду агрессивной среды коррозию подразделяют на атмосферную, морскую и речную, почвенную, коррозию в электролитах и др.
Атмосферная коррозия является наиболее распространенной, на ее долю приходится около 80% всех коррозионных разрушений. Атмосферную коррозию подразделяют по виду атмосферы и по виду климата. По виду атмосферы ее делят на промышленную, сельскую, приморскую и др. Наиболее агрессивной является приморско-про-мышленная среда, так как в ней наряду с высокой влажностью частыми туманами находятся и различные газы (сернистые, серные, оксиды углерода и др.), поступающие с промышленных предприятий. По виду климата атмосферную коррозию подразделяют на коррозию в умеренном и коррозию в тропическом климате. Последняя значительно сильнее действует на металл, так как кроме высокой влажности влияет температура, солнечная радиация и другие факторы.
Морской и речной коррозией называют разрушение металла соответственно в морской или речной воде, например разрушение корпусов, гребных винтов морских и речных судов, лодок и т. п.
Почвенная коррозия вызывает коррозию металлов в почве, например, водопроводных, газовых или других металлических труб, свай, находящихся в земле.
Коррозией в электролитах называется разрушение металла в водных растворах кислот, щелочей и солей. Этот вид коррозии встречается при травлении металлов, в химической промышленности.
По характеру разрушения металла коррозию подразделяют на четыре вида (рис. 1).
Защита металлов от коррозии. Для защиты металлов от коррозии применяют следующие методы: повышение коррозионной стойкости металлов, снижение агрессивности среды, отделение металла от агрессивной среды-
Повышение коррозионной стойкости металлов осуществляют легированием, удалением из металлов вредных примесей (очистка), модифицированием, химико-термической обработкой.
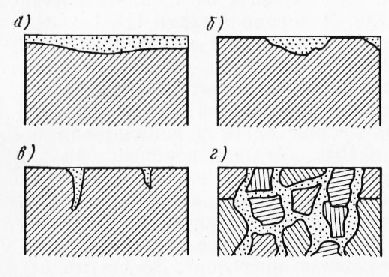
Рис. 1. Виды коррозии: а —сплошная; б — местная; в—язвенная; г — межкристаллитная
Для снижения агрессивности среды уменьшают концентрацию агрессивных газов, удаляют влагу, пыль и другие загрязнения. Эти способы особенно эффективны при хранении металлоизделий на складах и при их транспортировании. Для этой цели в складских помещениях поддерживают постоянную температуру и влажность, помещения хорошо проветриваются.
Кроме того, применяют ингибиторную защиту, т. е. в агрессивную среду вводят вещества, уменьшающие степень ее коррозионной агрессивности, называемые ингибиторами. Чаще всего ингибиторы вводят в смазки.
Защиту металлов от коррозии, связанную с их отделением от агрессивной среды, осуществляют нанесением металлических и неметаллических покрытий, смазочных масел (индустриальные масла).
По способу нанесения металлические покрытия подразделяют на гальванические и нанесенные горячим методом. Для гальванических покрытий характерна пористость. Поэтому их наносят на предварительно нанесенные слои других металлов. Например, при покрытии металла никелем в качестве подслойного материала применяют медь. Сущность гальванического метода заключается в осаждении металла из раствора солей на изделии при пропускании через раствор электрического тока. При горячем методе готовое изделие опускают на несколько секунд в расплавленный металл, предназначенный для нанесения покрытий. Этим методом наносят покрытия из легкоплавких металлов.
В качестве неметаллических покрытий для защиты от коррозии применяют лакокрасочные, силикатные, полимерные и другие покрытия. Защищают металл и путем создания оксидных пленок на его поверхности — оксидированием.
—
Коррозией называется процесс разрушения металлов и сплавов под воздействием внешней среды. Типичными примерами коррозии является ржавление стали, разъедание подводных частей судов морской водой, разрушение деталей химической Аппаратуры под влиянием растворов солей и кислот, от действия высокой температуры и т. д.
Известно, что от коррозии ежегодно пропадает до 10% всех добываемых металлов. Это огромные потери, и борьба с ними приобретает серьезное значение. Для борьбы с коррозией применяют следующие способы:
Оксидирование — нагрев стального изделия и охлаждение-в минеральном масле. На поверхности стали образуется тонкая пленка окисла черного цвета, защищающая ее от ржавления. Такое покрытие называется оксидированием или воронением стали. Оксидирование часто применяется для покрытия оружия: пистолетов, охотничьих ружей и т. п.
При сухом воронении стальные изделия покрывают тонким слоем асфальтового лака и выдерживают в течение 10—20 минут в печи при температуре 300—450°. Поверхность изделия приобретает блестящий синий или черный цвет.
Легирование — процесс сплавления стали с другими металлами, значительно улучшающими ее свойства. Коррозионная стойкость стали возрастает, если в ее состав входят не поддающиеся окислению на воздухе металлы. Таким путем получают нержавеющую сталь, в которой легирующими элементами являются хром (12—18%) или никель (4—8%).
Металлическое покрытие. В целях экономии стойких от коррозии металлов ими покрывают металлические изделия только поверхностным тонким слоем. Для покрытия стальных изделий широко применяются цинк (оцинкованное железо) и олово (луженая жесть). Это покрытие осуществляется погружением деталей с тщательно очищенной поверхностью в расплавленный металл или гальваническим способом с помощью постоянного электрического тока (никелирование, хромирование).
Окраска. Самый простой и распространенный способ предохранения металлов от коррозии — это покрытие их красками, лаками и эмалями. После высыхания растворителя изделие оказывается защищенным слоем краски или эмали, который, кроме защиты от коррозии, придает металлу желаемый цвет.
Смазка. Предохранение металлических изделий от коррозии хорошо осуществляет слой густого масла, которое выполняет эту роль так же, как краски, но в отличие от них легко может быть Удалено в случае необходимости. Смазка маслом широко применяется для защиты от коррозии станков, инструментов, оружия, особенно в период их храпения (консервация).
Читать далее:
Факторы, обусловливающие качество металлоизделий
Статьи по теме:
pereosnastka.ru
Коррозия металлов и сплавов и меры защиты от нее
Коррозия - это самопроизвольное разрушение металлов и сплавов, вызванное химическим или электрохимическим взаимодействием металла с окружающей средой. Химическая коррозия протекает при воздействии на металл сухих газов и неэлектролитов. Электрохимическая коррозия происходит при действии на металл жидких электролитов - водных растворов солей, кислот, щелочей, а также влажного воздуха, то есть сред, содержащих ионы.
В основе электрохимической коррозии лежит гидратация ионов металла, то есть их взаимодействие с молекулами воды. Гидратация происходит за счет электростатического взаимодействия между заряженными ионами металла и полярными молекулами растворителя.
Переход иона металла в раствор термодинамически возможен в том случае, если энергия гидратации больше, чем энергия связи с электронами металла. Когда часть гидратированных ионов металла переходит в электролит, металл получает отрицательный заряд. За счет пришедших в раствор ионов электролит получает положительный заряд. Так возникает двойной электрический слой противоположных зарядов – электродный потенциал. Его величина зависит от вида металла и состава электролита.
Строительные металлические конструкции эксплуатируются в самых различных условиях, поэтому в них могут встречаться различные виды коррозии металлов. Наиболее распространена электрохимическая коррозия в нейтральных и щелочных растворах, протекающая с участием кислорода. Если в растворе электролита есть кислород, то он в присутствии воды принимает электрон, образуя гидрооксид:
Fе+2OН=Fе (ОН)2 ;
4Fе(ОН)2+O2+2Н2O = 4Fе(ОН)3.
При дальнейшем взаимодействии с кислородом и последующем отщеплении воды образуется FеО(ОН) – важнейшая составляющая ржавчины nFe2О3mН2О.
Довольно часто строительные конструкции поражаются атмосферной коррозией. Эта разновидность электрохимической коррозии металлов развивается под тонким, часто невидимым слоем влаги, образующимся на поверхности вследствие адсорбции или конденсации, агрессивность которой повышается при последующем растворении в ней газов и солей. Атмосферная коррозия металлов может развиваться при относительной влажности воздуха 70 % и выше. Оксидные соединения серы, содержащиеся в воздухе, повышают точку росы, снижают критическую влажность, при которой возможна атмосферная коррозия.
При коррозии в среде сухих газов, обычно протекающей при высоких температурах, имеет место непосредственное соединение металла с агрессивными химическими агентами. К химическому виду коррозии относится окалинообразование в кислородосодержащих газах. Например, при высоких температурах железо окисляется кислородом с образованием окалины - прочного и плотного слоя оксидов.
По характеру распространения различают коррозию:
1) - равномерную поверхностную, которая приводит к равномерному уменьшению толщины изделия. Скорость равномерной коррозии выражают глубинным показателем - проникновением коррозии в глубину в мм/год;
2) – точечную, или язвенную. Это неравномерная коррозия, при которой относительно небольшая потеря в массе может вызвать очень глубокие повреждения;
3) - межкристаллитную, при которой разрушение происходит по границам зерен металла и распространяется вглубь металла. Межкристаллитная коррозия, при воздействии на металлическую конструкцию знакопеременных нагрузок, вызывает коррозионную усталость металла;
4) - контактную, при которой происходит преимущественное разрушение одного из металлов пары.
Для предотвращения коррозии металлов применяют различные способы защиты. Широко известны защитные лакокрасочные покрытия. Образующаяся при их нанесении пленка изолирует металл от действия внешней среды.
К более эффективным способам защиты от коррозии относят легирование, воронение, металлическое покрытие. Легирование состоит в сплавлении металла с легирующими веществами. Воронение способствует образованию на поверхности изделия защитного слоя, состоящего из оксидов данного металла.
Металлические покрытия производят осаждением на поверхности изделия металла из раствора (гальванические покрытия), обрызгиванием или погружением в ванну с другим расплавленным металлом. При этом возникает плотный контакт двух металлов – основного и защитного. Из двух металлов, находящихся в контакте, коррозии будет подвергаться металл, у которого электродный потенциал в данном растворе более электроотрицателен. Этот металл в паре металлов будет являться анодом. Второй металл будет более электроположительным электродом – катодом. Электроны с анода будут перемещаться на катод по внешней цепи. Ионы водорода из электролита будут присоединять электроны, переходить в состояние молекул и выделяться из раствора электролита.
Бельгийская кампания Zinga Metall разработала покрытие, сочетающее преимущества активного и пассивного способов защиты. Это антикоррозионный состав Zinga для холодной гальванизации. Состав представляет собой однородное соединение, состоящее на 96 % из электролитического цинка с чистотой 99,995 % с размерами частиц 3…5 мкм, затворенного полимерным связующим. Покрытие толщиной 40 мкм гарантирует защиту стальных конструкций на 10 лет, а при толщине 120 мкм соответственно более чем на 25 лет. Защита оказалась лучше, чем горячая оцинковка. Возможно проведение противокоррозионных работ при высокой влажности в широком диапазоне температур. Холодная гальванизация - одно из лучших защитных покрытий в мире.
К числу основных мероприятий по предупреждению коррозии арматуры в железобетонных конструкциях относят понижение проницаемости бетона интенсивным уплотнением при укладке, введением уплотняющих добавок и увеличением толщины защитного слоя.
При влажности среды более 70 % регламентируется предельное значение водоцементного отношения. Устраивается наружная защита бетона покраской поверхности, покрытием цементосодержащими составами проникающего действия, повышающими водонепроницаемость, или устройством оклеечной изоляции с применением стеклоткани на эпоксидной смоле. Вводят в бетон ингибиторы коррозии, например, нитрид натрия в количестве до 2 % от массы цемента.
9. ПРИРОДНЫЕ КАМЕННЫЕ МАТЕРИАЛЫ
Горные породы – это огромные скопления минеральных масс, представляющие собой продукты природных физико-химических процессов или жизнедеятельности растительных или животных организмов. Горные породы состоят из одного или нескольких минералов - природных веществ, отличающихся более или менее однородным химическим составом и постоянными физическими свойствами. Все горные породы, применяемые в строительстве, принято называть природными каменными материалами. Природные каменные материалы отличаются высокой прочностью, долговечностью, исключительной архитектурной выразительностью. Большая группа горных пород используется в производстве строительных материалов как сырье.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)












