|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Кислотные аккумуляторы; чтобы больше не было отвратительно читать то что люди о них пишут. Кислотные аккумуляторы
устройство, емкость. Зарядное устройство для кислотных аккумуляторов. Восстановление кислотных аккумуляторов
Кислотные аккумуляторы характеризуются повышенным параметром стойкости. По конструкции устройства довольно сильно отличаются. Емкость кислотного аккумулятора всегда указана в инструкции. На рынке представлены модификации на 2 и 4 вывода. Показатель саморазряда у них может отличаться.
Электролит в устройствах чаще всего применяется серии КС. Выходное напряжение, как правило, не превышает 10 В. Для того чтобы более подробно разобраться в указанном вопросе, надо рассмотреть устройство кислотного аккумулятора.
Устройство аккумуляторной батареи
Стандартный аккумулятор средней емкости состоит из блока, герметичной оболочки, пластин, электролита, а также клемм. Крышки в устройствах производятся с выходным контактами. Пластины у моделей фиксируются на стойках. Некоторые модификации производятся с клапанами. Если рассматривать аккумуляторы с высокой емкостью, то у них имеется сепаратор. Указанный элемент устанавливается с перемычкой. Как правило, минусовые выводы соединяются с платинами напрямую. Непосредственно блок батареи обрабатывается каучуком.

Модификации с емкостью 8 Ач
Аккумуляторы кислотные (необслуживаемые) данного типа используются часто для компрессоров на 2 кВт. Частота в данном случае равняется минимум 30 Гц. Электролит в устройствах применяется разных серий. Проводимость напряжения у них отличается. Показатель перегрузки батарей в среднем равняется 40 А.
У некоторых модификаций установлена система защиты от перегрева. Если рассматривать устройства на две клеммы, то у них имеются проводные пластины. Сепаратор, как правило, устанавливается в нижней части блока. Камера у моделей обрабатывается смолой. Показатель герметичности в среднем колеблется в районе 85 %. Параметр саморазряда, как правило, не превышает 0.2 %.
Допустимый уровень температуры зависит от электролита. Для приводов указанные аккумуляторы подходят плохо. Также важно отметить, что современные устройства производятся с блоками рекомбинации. Процесс восстановления у них много времени не отнимает. Однако важно отметить, что стоят они на рынке довольно много.
Модели на 20 Ач
Аккумуляторные батареи на 20 Ач производятся под приводные устройства. Также модели подходят для освещения местности. На рынке представлены модификации на 2 и 4 клеммы. Перемычки в устройствах используются с различной проводимостью. Электролит чаще сего применяется с маркировкой КС202. Заряд устройства осуществляется при напряжении в 10 В. Пластины в данном случае устанавливаются в вертикальном положении.
По степени герметичности устройства довольно сильно отличаются. Блоки рекомбинации установлены не во всех модификациях. Для компрессоров малой мощности устройства подходят плохо. Параметр допустимой температуры у батарей в среднем равняется 40 градусов. Сепараторы чаще всего используются коммутируемого типа. У некоторых модификаций выходное напряжение достигает 15 В. Параметр порогового сопротивления находится в пределах 18 Ом. Срок службы устройств колеблется от 3 до 10 лет.

Аккумуляторные батареи указанной емкости используются для компрессоров на 6 кВт. В данном случае устройства выпускаются с пластинами из свинца. Многие модификации оснащаются проводными сепараторами. Положительный выход в устройствах устанавливается на крышке. Модификации с двумя клеммами обладают проводимостью на уровне 3 мк. Клапана у моделей, как правило, находятся в нижней части блока. Выходное напряжение у моделей составляет около 13 В.
Система защиты от перегрузок используется второй либо третей степени. Герметичность блоков в среднем составляет 90 %. Заряд аккумуляторных батарей осуществляется при напряжении в 4 В. Допустимый уровень температуры, как правило, не превышает 45 градусов. По плотности энергии модификации довольно сильно отличаются. Для приводных устройств модели не подходят. Диоксидные пластины в них устанавливаются редко.
Устройства на 100 Ач
Кислотные аккумуляторы на 100 Ач производятся для контрольных блоков. Для облуживания генераторов и котлов модификации подходят отлично. Допустимая температура устройств в среднем равняется 35 градусов. Современные батареи производятся с четырьмя пластинами. Система защиты от перегрузок имеется не во всех модификациях.
Уровень внутреннего сопротивления, как правило, не превышает 30 Ом. По герметичности устройства довольно сильно отличаются. Срок службы аккумуляторных батарей колеблется от 5 до 10 лет. В среднем параметр проводимости у них равняется 3 мк. Выходное напряжение, в свою очередь, составляет не менее 15 В. Электролит в устройствах используется серии КС200. Для силового оборудования батареи применяются часто. Клапана, как правило, соединены с положительными выходами.

Модели с емкостью 120 Ач
Кислотные аккумуляторы на 120 Ач имеют высокую плотность энергии. В среднем проводимость у них равняется 3 мк. Показатель выходного напряжения зависит от размеров пластин. Многие модификации производятся с четырьмя клеммами. Для компрессоров на 5 кВт устройства подходят замечательно. Крышки у моделей используются герметичного типа. Допустимая температура батарей составляет около 40 градусов. Для приводов низкочастотного типа устройства подходят плохо.
Параметр герметичности, как правило, не превышает 80 %. Кислотные аккумуляторы для фонарей со свинцовыми пластинами встречаются не часто. По параметру саморазряда модели отличаются. В данном случае многое зависит от чувствительности сепаратора. Плюсовые выводы в устройствах, как правило, находятся на крышке. Плотность энергии аккумуляторных батарей - в пределах 3 %.
Аккумуляторные батареи на 150 Ач
Кислотные аккумуляторы на 150 Ач производятся с проводными сепараторами. Некоторые модификации оснащаются коммутируемыми клапанами. Пластины чаще всего изготовлены из свинца. В среднем показатель проводимости не превышает 3 мк. Выходное напряжение модификаций зависит от чувствительности сепаратора. Срок службы моделей колеблется от 3 до 10 лет.
Электролит в устройствах чаще всего применяется серии КС200. Плотность энергии - около 3 %. Блоки рекомбинации встречаются редко. Для компрессоров на 10 кВт устройства подходят замечательно. Однако важно отметить, что у некоторых моделей отсутствует выходной клапан. Показатель герметичности находится в пределах 90 %. Однако в данном случае многое зависит от торговой марки.

Восстановление устройств
Восстановление кислотных аккумуляторов осуществляется при помощи зарядных устройств. Указанные приборы выпускаются различной чувствительности. Параметр перегрузки в среднем равняется 20 А. Чтобы ускорить восстановление кислотных аккумуляторов используются триггеры с переходниками. Если рассматривать батареи малой емкости, то у них зарядка в среднем занимает 2 часа. Однако в данном случае важно учитывать параметры модели. Аккумуляторные батареи на 120 Ач восстанавливаются около 10 часов при среднем напряжении.

Зарядные устройства Pulso BC-15860
Зарядные устройства данной серии хорошо подходят для аккумуляторных батарей емкостью до 20 Ач. Расширитель у модели применяется аналогового типа. Параметр проводимости, как правило, не превышает 3 мк. В среднем рабочая частота составляет 35 Гц. Система защиты от импульсных скачков имеется. Восстановление батарей занимает не более двух часов. Обкладка у данного зарядного устройства отсутствует. Всего в комплекте имеется два зажима. Стабилитрон у зарядного устройства указанной серии отсутствует. Если работать с батареями на 15 Ач, то выходное напряжение следует выбирать 10 В.
Особенности зарядных устройств Pulso BC-15855
Зарядные устройства представленной серии производятся с двумя зажимами. Для аккумуляторных батарей на 50 Ач модель подходит хорошо. Параметр выходного напряжения у модификации регулируется контроллером. Расширитель в устройстве применяется лучевого типа. Диодный мост имеет высокую проводимость, и сбои в системе происходят не часто. Защита от импульсных скачков есть.
Преобразователь в данном случае отсутствует. Для аккумуляторных батарей на100 Ач устройство не подходит однозначно. Демпфер у модификации применяется переменного типа. Параметр чувствительности в среднем составляет 4 мВ. В свою очередь показатель перегрузки не превышает 50 А. С моделями на две клеммы зарядное устройство для кислотных аккумуляторов работать может.
Параметры зарядных моделей Lavita 192204
Зарядное устройство представленной серии состоит и проводного расширителя. Триггер в данном случае используется электродного типа. Также важно отметить, что у модели имеется преобразователь. Зажимы установлены с фиксаторами и соединены в устройстве с выпрямителем.
Параметр проводимости модификации равняется не менее 4 мк. Перегрузка системы в среднем составляет 30 А. Для аккумуляторных батарей на 100 Ач устройство подходит замечательно. Процесс зарядки в среднем времени занимает не более 5 часов. Стабилизатор используется с фильтром. Система защиты от импульсных скачков отсутствует.

Зарядные устройства Lavita 192212
Зарядное устройство указанной серии имеет массу преимуществ. В первую очередь важно отметить, что у модификации используется два фильтра. Расширитель стандартно установлен проводного типа. Преобразователь у зарядного устройства производителем не предусмотрен. Параметр перегрузки системы, как правило, составляет 33 А. Выпрямитель применяется с обкладкой. Для аккумуляторных батарей на 150 Ач устройство подходит хорошо. Импульсные скачки в системе наблюдаются редко. Стабилитрон применяется регулируемого типа.
Особенности зарядных устройств TESLA ЗУ-10642
Зарядные устройства указанной серии производятся с двумя расширителями. Преобразователь у них используется коммутируемого типа. В среднем проводимость модели составляет 3 мк. Для аккумуляторных батарей на 10 Ач устройство подходит замечательно. Параметр пороговой чувствительности в устройстве невысокий. Проблемы с перегрузками наблюдаются очень редко. Система защиты от скачков есть. Фильтр у зарядки используется на 12 В.
Для аккумуляторных батарей на две клеммы устройство подходит. В данном случае выходное напряжение можно регулировать. Держатели в устройствах применяются довольно широкие. Непосредственно ручка в комплекте есть. Регулятор у зарядки применяется поворотного типа. Зажимы используются без фиксаторов. Для аккумуляторов на 100 Ач устройство не подходит. Показатель перегрузки в среднем составляет 33 А. Для моделей на четыре клеммы модификация не подходит.
Параметры зарядных моделей Deltran
Указанное зарядное для кислотных аккумуляторов производится с выпрямителем. Триггер применяется с фильтрами. Для аккумуляторных батарей на 10 Ач устройство подходит хорошо. Проводимость в данном случае составляет не менее 4 мк. Допустимый уровень перегрузки равняется 30 А. Система защиты от импульсов есть. Преобразователь у зарядки отсутствует.
С аккумуляторами на 20 Ач модель используется часто. Всего у модификации есть один держатель. Фиксаторы установлены на выходных контактах. Показатель напряжения максимум равняется 20 В. Компаратор в представленной зарядке отсутствует. Зажимы используются довольно широкие. Регулятор у зарядки установлен с поворотным механиком. По габаритам модель является компактной и весит крайне мало. Селектор в устройстве применяется открытого типа.

Зарядные устройства Tenex
Зарядка данной серии подходит для аккумуляторов на 100 Ач. В данном случае расширитель используется переходного типа. Показатель выходной проводимости у модели невысокий. Проблемы с диодным мостом наблюдаются редко. Зарядка кислотных аккумуляторов на 20 Ач примерно происходит за один час. Система защиты от импульсов имеется.
Динистор у модификации используется с двумя фильтрами. Показатель предельного напряжения находится на отметке 30 В. Регулятор тока у модели есть. При необходимости можно включать циклический режим. Зарядить кислотный аккумулятор на 500 Ач можно в среднем за три часа. Проблемы с кроткими замыканиями наблюдаются не слишком часто.
fb.ru
Кислотные аккумуляторы; чтобы больше не было отвратительно читать то что люди о них пишут
Случайно узрел статью с комментариями к ней, и так злость во мне закипела по поводу безграмотности людей в области кислотных (свинцовых в простонародье) аккумуляторов, что не выдержал и решил написать «гикам» (чтобы быть гиком, как оказывается, мало купить дорогой телефон) краткую статью об аккумуляторах. С рассмотрением тех ошибок, которые мне постоянно мусолят глаза и вызывают праведное желание их исправить.Начнем с названия. Я очень часто вижу что тремя буквами А-К-Б называют все что можно зарядить, абсолютно любой аккумулятор. Особенно тремя буквами люди любят называть аккумуляторы типа Li-ion. На самом-же деле АКБ аббревиатура от Аккумуляторная Кислотная Батарея. Под ними подразумевается лишь один тип аккумулятора — свинцовый кислотный. С современной точки зрения это название вызывает некоторый когнитивный диссонанс т.к. на данный момент значение слова «батарейка» т.е. гальванического элемента который зарядить нельзя перешло на слово «батарея». И получается как будто бы из-за слова «аккумуляторная» это аккумулятор который зарядить можно, а из-за слова «батарея» это как будто батарейка которую зарядить нельзя. В реальности-же батарея — просто цепь гальванических элементов и со словом «батарейка» имеет общий лишь корень.
Далее перейдем к некоторым мифам, а именно главный миф — АКБ для автомобиля имеет некие существенные отличия от АКБ для ИБП. И вот нельзя их применять и там и там. С химической точки зрения любые АКБ абсолютно одинаковы. Как-же они устроены? Очень кратко — если аккумулятор заряжен, то один электрод представляет собой свинцовую решетку с нанесенной на нее пастой из PbO2, второй -такую-же решетку с пастой губчатого свинца. Электролитом служит раствор серной кислоты. В процессе разряда PbO2 восстанавливается и взаимодействуя с серной кислотой образует PbSO4. Свинец на другом электроде окисляется и опять-же образует PbSO4. В конце разрядки мы имеем обе решетчатые пластины заполненные (более или менее) сульфатом свинца. При зарядке аккумулятора происходит электролиз и из сульфата свинца вновь образуется диоксид и металлический свинец. Конечно-же, тут нужно подчеркнуть, что электроды при этом не равны и путать их полярность не стоит т.к. еще на стадии производства в намазку электродов вводятся соответствующие добавки, улучшающие их эксплуатационные свойства. При этом добавки полезные для одного электрода вредны для другого. В очень старые времена, где-то в начале прошлого века, в условиях простых аккумуляторов, вероятно, была допустима переполюсовка аккумулятора по ошибке или с какими-то целями и он какое-то время после этого работал. В том что она допустима сейчас я сомневаюсь.
Таких ячеек в 12В аккумуляторе 6 шт, в 6В — 3 шт. и т.д. Многих вводит в заблуждение значение напряжения на аккумуляторах. Причем значений напряжения номинального, заряда, разряда. С одной стороны, аккумуляторы называются 12В (и 6В, 24В тоже есть, по-моему, даже 4В изредка встречаются) но на корпусе тех-же аккумуляторов для ИБП производитель указывает напряжение выше 13.5В.
Например:
Тут мы видим, что в форсированном режиме напряжение заряда может быть аж 15В.
Все разъяснит кривая напряжения на АКБ:

Слева мы видим напряжение для аккумулятора из 12 ячеек (24В номинальных), 6 (12В номинальных) и, самое полезное, для одной ячейки. Там-же отмечены области нежелательных напряжений при разряде/ заряде. Из кривой можно сделать выводы:
1 Напряжение 12В, 24В и т.д. являются номинальными и показывают лишь число гальванических ячеек (путем деления на два) в батарее. Это просто название для удобства.
2 Напряжение при заряде могут достигать 2.5 В/ ячейку что для 12В аккумулятора соответствует 15В.
3 Напряжение заряженной батареи считается допустимым при значении 2.1-2.2 В/ячейку, что для 12В аккумулятора соответствует 12.6-13.2В.
Теоретически, батарею можно зарядить и до значений 2.4 В/ячейку или даже немного выше, однако, такая зарядка будет негативно сказываться как на состоянии электродов, так и на концентрации электролита. Однажды, перед сдачей в утиль, я легко зарядил 12В батарею до напряжения ок. 14.5В (уже не помню точное значение).
Итак, автор статьи с которой я начал, решил, что напряжение заряда автомобильной АКБ и АКБ от ИБП отличаются. Это неверно, у них одинаковый тип электродов и одинаковая концентрация серной кислоты в электролите (подобранная давным-давно экспериментальным путем, чтобы предоставлять максимальное напряжение и минимальном саморазряде). Однако, что-же происходит в батарее, почему ее нельзя заряжать при слишком высоком значении напряжения?
Почему в автомобильную АКБ нужно подливать воду, а в АКБ от ИБП не нужно? Эти вопросы позволяют нам плавно перейти в область напряжения разложения воды. Как я написал выше, при зарядке аккумулятора происходит электролиз. Однако, не весь ток расходуется на превращение PbSO4 в PbO2 и Pb. Часть тока будет неизбежно расходоваться и на разложение воды, составляющей значительную часть электролита:
2h3O = 2h3 + O2
Теоретический расчет дает значение напряжения для этой реакции ок. 1.2В. Напоминаю, что напряжение на ячейке при заряде заведомо более 2В. К счастью, активно вода начинает разлагаться только выше 2В, а в промышленности для получения водорода и кислорода из нее процесс ведут и вовсе при 2.1-2.6В (при повышенной температуре). Как бы то ни было, тут мы приходим к выводу, что в конце процесса заряда АКБ будет неизбежно происходить процесс разложения воды в электролите на элементы. Образующиеся кислород и водород попросту улетучиваются из сферы реакции. Про них бытуют следующие мифы:
1. Водород крайне взрывоопасен! Перезарядишь аккумулятор и как минимум лишишься комнаты где тот был!
На самом деле, водорода в процессе электролиза выделяется ничтожно мало по сравнению с объемом комнаты. Водород взрывается при концентрации от 4% в воздухе. Если мы допустим, что электролиз ведется в комнате размером 3*3*3 метра или 27 метров куб., то нам понадобится наполнить помещение 27*0.04=1.1 метров куб. водорода. Для получения такого количества h3 нужно было бы полностью разложить ок. 49 моль воды или 884 грамма ее. Если кто-то наблюдал электролиз, то поймет насколько это много. Или попробуем перейти ко времени. При силе тока в стандартной зарядке для крупногабаритных АКБ в 6А, уравнение Фарадея дает время, необходимое для получения этого количества водорода, аж 437 часов или 18.2 дня. Чтобы наполнить комнату водородом до взрывоопасной концентрации нужно забыть про зарядку на 2 с половиной недели! Но даже если это случится, концентрация серной кислоты просто будет расти пока ее раствор не приобретет слишком высокое сопротивление для жалких 12В зарядки и сила тока не станет ничтожной. Да и водород попросту улетучится.
Очень редко случаются взрывы непосредственно в корпусах крупногабаритных АКБ из-за того, что выделяющийся водород по какой-то причине не может покинуть замкнутого пространства. Но и в этом случае нечего страшного не бывает — чаще всего взрыва хватает только на небольшую деформацию верхней части корпуса, но не на разрыв свинцовых соединений. И АКБ еще может работать дальше даже после таких повреждений.
2. При электролизе может образоваться смертельно ядовитый и, не менее взрывоопасный чем водород, сероводород!
Не наш, периодически попадался миф в англоязычных постах. Теоретически конечно возможно подать такое большое напряжение и создать т.о. такую большую силу тока, что на катоде начнется процесс восстановления сульфат-иона. Напряжение для этого будет достаточным, а продукты восстановления не будут успевать диффундировать подальше от электрода и восстановление будет идти дальше. Но зарядка в пределах десятка-трех вольт и с ограничением силы тока в 6А на такое едва ли способна. Однажды, я наблюдал процесс восстановления сульфата до SO2, да, это возможно; однокурсницы по ошибке что-то сделали не то во время опыта. Но это большая редкость т.к. там концентрация серной кислоты была заметно выше той, что используется в АКБ, была иная конструкция электрода и иной его материал и, естественно, напряжения и сила тока были были непомерными. И SO2 не h3S.
3. При электролизе мышьяк и сурьма из материала решеток будут восстанавливаться до ядовитых арсина и стибина!
Действительно, решетки содержат относительно много сурьмы, мышьяка в современных решетках, вероятно, нет вообще. При работе АКБ та решетка на которой происходит восстановление, т.е. катод, разрушению не может подвергаться. Выделяйся даже каким-то образом стибин, он бы тут-же взаимодействовал с PbSO4, восстанавливая его до металла.
Однако, некоторая практическая неприятность тут есть. Газообразные водород и кислород могут увлекать за собой капельки электролита, создавая аэрозоль серной кислоты. Аэрозоль серной кислоты, даже концентрированной, для человека не опасен и просто вызывает кашель. Однако, серная кислота — кошмар для тканей и бумаги. Стоит даже небольшому количеству серной кислоты попасть на одежду и там обязательно появятся дырки или ткань разорвется по этому месту. Через недели, если кислоты много, через месяц, но одежда истлеет.
Так что газовыделения опасаться не стоит с бытовой точки зрения или стоит, но нужно ориентироваться именно на аэрозоль серной кислоты.
Итак, вода начала разлагаться на водород кислород, ее в электролите становится все меньше, что-же дальше? Если это АКБ в котором электролит просто налит в виде слоя жидкости, то начнется повышение саморазряда из-за повышения концентрации серной кислоты. Занятно, что это будет сопровождаться небольшим повышением напряжения (концентрация кислоты растет) на ячейке. Именно поэтому автовладельцы должны постоянно контролировать концентрацию серной кислоты в своих АКБ (при помощи ареометра) и доливать туда воду. Процедура доливания воды — необходимая часть процесса обслуживания любой АКБ. Кроме одного их типа, и мы сейчас об этом поговорим.
Иметь аккумулятор в котором болтается слой едкой, по отношению к металлам, жидкости конечно-же неудобно, а потому попытки избавиться непосредственно от жидкости предпринимались давно, начались чуть ли не в первой половине 20-го века. К слову сказать, не то чтобы слой серной кислоты прямо плескался вокруг электродов. В реальности она неплохо распределена между электродами и окружающими их сепараторами даже в дешевых моделях. Итак, первым вариантом было использование стекловолокна. Достаточно просто окружить электроды стекловолокном которое пропитано серной кислотой и большинство проблем решится. Этот тип АКБ носит название AGM (absorbent glass mat) и таких АКБ для ИБП подавляющее большинство. Хотя такие АКБ малого форм-фактора и зачастую позиционируются как те, которые можно эксплуатировать в любом положении, с этим нельзя вполне согласиться. Вскрытие крышки стандартного дешевого AGM аккумулятора показывает, что никаких особых крышек там нет, а следовательно, электролит от вытекания удерживают лишь капиллярные силы. Я почти уверен, что если погонять AGM аккумулятор перевернутым вверх дном, то уже после одной зарядки из него польется серная кислота под давление газов.
Второй распространенный тип интереснее, это т.н. гелевые АКБ. А получаются они благодаря следующему. Если подкислять растворимые силикаты, то будет происходить выделение кремневой кислоты:
Na2SiO3 + h3SO4 = Na2SO4 + SiO2 + h3O
Если исходный раствор силиката не отличается качеством, то кремневая кислота будет выделяться в виде стекловидной массы, но если он достаточно чист, то кремневая кислота осадится в виде красивого куска однородного полупрозрачного геля. На этом и основан способ получения гелевых АКБ — простое добавление силикатов к электролиту вызывает его затвердение в гелеобразную массу. Соответственно, вытекать оттуда уже нечему и АКБ действительно можно эксплуатировать в любом положении. Сам по себе процесс образования геля не повышает емкости АКБ и не улучшает его качеств, однако, производители его используют при производстве наиболее качественных моделей, а потому эти АКБ отличаются высоким качеством и большей емкостью. Занятно, что в обоих случаях носителем электролита является SiO2 в той или иной форме.
Оба типа АКБ объединяются в славный тип VRLA — valve-regulated lead-acid battery который и применяется в ИБП. Формально они считаются необслуживаемыми и терпящими эксплуатацию в любом положении, но это не совсем так. Более того, многие уже встречались с эффектом, когда буквально несколько мл воды возвращают к жизни, казалось бы, дохлую АКБ от ИБП. Так получается, потому что и эти аккумуляторы не капли не застрахованы от электролиза воды в электролите, а следовательно, и пересыхания. Все происходит точно так-же, как в крупногабаритных АКБ. А вот самые дорогие и крутые необслуживаемые АКБ содержат катализатор для рекомбинации выделяющихся газов обратно в воду и вот уже у них корпус действительно выполнен абсолютно герметичным. Обращаю внимание, что по-настоящему герметичным и необслуживаемым может быть и аккумулятор типа AGM и GEL, но они-же могут ими и не быть и не содержать катализатора рекомбинации кислорода и водорода. Тогда, несмотря на казалось бы продвинутую конструкцию, пользователю придется либо чаще покупать новые аккумуляторы, либо доливать воду при помощи шприца.
Хотелось бы добавить несколько слов о режимах разряда. Производители АКБ указывают какой ток максимально допустим для той или иной модели, но нужно понимать, что аккумулятор — просто смесь химических веществ и ЭДС генерируется исключительно химическим путем. Это не конденсатор который, по электрогидравлической аналогии, можно сравнить с неким механическим сосудом (с гибкой мембраной). Хотя АКБ могут выдавать очень большие значения силы тока, в реальности они лучше всего эксплуатируются как раз при небольших токах, что в разряде, что в заряде. Поэтому ИБП, рассчитанные на заряды небольших АКБ, при работе с крупногабаритными будут заряжать их в наиболее щадящем режиме. Впрочем, в течении далеко не одних суток. Интересно обратить внимание на то, что чем выше мощность ИБП, тем больше аккумуляторов последовательно предпочитает собирать производитель. Тут все логично — большие токи разряда маленькие АКБ выдерживают очень плохо.
Подводя итоги:
1. Малогабаритные и крупногабаритные АКБ идентичны по устройству.
2. Для подавляющего большинства АКБ любого размера доливание воды является необходимой частью текущего обслуживания.
3. Лишь немногие из дорогих моделей АКБ содержат механизм рекомбинации газов и могут быть названы действительно необслуживаемыми.
4. Сам по себе водород, который выделяется при заряде (а это равно постоянной работе в ИБП) АКБ, не является существенной угрозой или проблемой.
5. Нужно очень внимательно работать с АКБ, тщательно избегая пролива даже малейших капель электролита, или лишитесь одежды.
6. Разряд и заряд малыми токами являются наиболее предпочтительными режимами эксплуатации АКБ.
habr.com
Аккумуляторы
Лекция 7.
Аккумулятором называют химический источник тока многократного действия. При разряде аккумулятора химическая энергия активных веществ, входящих в состав катода, анода и электролита, преобразуется в электрическую энергию, при этом активные вещества превращаются в продукты разряда. При заряде аккумулятора подводимая электрическая энергия расходуется на регенерацию продуктов разряда.
В зависимости от состава электролита аккумуляторы бывают кислотными и щелочными.
В кислотных аккумуляторах электролитом служит водный раствор серной кислоты (Н2SO4), в котором некоторая часть молекул последней распадается на положительные ионы водорода (Н2+) и отрицательные ионы кислотного остатка (SO4--). При этом раствор в целом остаётся электрически нейтральным.
При погружении в электролит пластины из чистого свинца положительные ионы (Pb++) переходят в раствор электролита. Часть этих ионов, вступая в реакцию с ионами кислотного остатка, образуют нейтральные молекулы сульфата свинца (PbSO4), оседающего на пластине, что повышает концентрацию положительных ионов водорода в электролите. Сама пластина ввиду избытка электронов заражает отрицательно (отрицательный электрод).
Если в электролит погрузить вторую пластину из диоксида свинца (PbO2), то ввиду повышенной концентрации ионов водорода диоксид свинца частично переходит в раствор, образуя положительные четырёхвалентные ионы свинца (Pb++++) и отрицательные ионы гидроксида (НО-). Сама пластина из-за избытка положительных ионов свинца заряжается положительно (положительный электрод). Повышение концентрации серной кислоты увеличивает потенциалы положительного и отрицательного электродов относительно электролита.
Электродвижущая сила Е такого простейшего аккумулятора определяется разностью равновесных потенциалов положительного и отрицательного электродов относительно электролита и не зависит от размеров и конструкции самих электродов.
При подключении к аккумулятору нагрузки под действием ЭДС во внешней цепи будет протекать ток, обусловленный перемещением электронов от отрицательного электрода, присоединяя на свой внешний энергетический уровень по два электрона, становятся двухвалентными ионами, которые, вступая в реакцию с отрицательными ионами кислотного остатка, образуют молекулы сульфата свинца. При уменьшении числа электронов на отрицательном электроде нарушается равновесное состояние, в результате чего новые положительные ионы свинца (Рb++) переходят в раствор электролита и вступают в реакцию с ионами кислотного остатка. Ток внутри аккумулятора обусловлен перемещением положительных ионов водорода к положительному электроду. При этом в результате взаимодействия ионов водорода с отрицательными ионами гидроксида образуются молекулы воды. Следовательно, при разряде аккумулятора на обоих электродах выделяется сульфат свинца и уменьшается плотность электролита. При заряде аккумулятора сульфат на одном электроде превращается в свинец, а на другом – в диоксид свинца РbО2, причём концентрация Н2SO4 в электролите повышается.
Протекающие в кислотных аккумуляторах обратимые процессы можно изобразить следующим образом: Pb+РbО2+2h3SO42PbSO4+2h3O. При разряде равновесие сдвигается слева направо, а при заряде справа налево. Кроме того, при заряде на отрицательном электроде возможно восстановление ионов водорода и образование газообразного водорода.
Электродвижущая сила полностью заряженного кислотного аккумулятора, зависящая от плотности электролита, лежит в пределах 2,06…2,15 В. плотность электролита заряженного аккумулятора составляет 1,21…1,3 г/см3. Верхний уровень плотности относится к стартерным аккумуляторам, эксплуатируемым в зимнее время. Изменение температуры незначительно влияет на ЭДС. Повышение температуры на 10C увеличивает ЭДС на 0,002…0,003 В.
При разряде аккумулятора напряжение между его выводами всегда меньше ЭДС за счёт падения напряжения на омическом сопротивлении и поляризации электродов. Омическое сопротивление аккумулятора, представляющее собой сумму омических сопротивлений электролита, электродов и других токоведущих частей, не зависит от силы разрядного тока. Под поляризации электрода понимают разность между потенциалом электрода относительно электролита при разряде (или заряде) и его значением при равновесии. Отношение суммы поляризации положительного и отрицательного электродов к силе разрядного тока называется поляризационным сопротивлением. Это сопротивление зависит от силы тока. Внутреннее сопротивление аккумулятора при разряде rр представляет собой сумму поляризационного и омического сопротивлений.
Поляризация аккумулятора связана, прежде всего, с изменением плотности электролита непосредственно у электродов, так как образование сульфата свинца, имеющего существенно больший объём по сравнению со свинцом или диоксидом свинца, затрудняет диффузию серной кислоты к активной массе электродов. Уменьшение плотности электролита непосредственно у пластин тем больше, чем больше разрядный ток. Кривые изменения напряжения во времени при разряде и заряде неизменным током показаны на рис. 1.3.
Рис. 1.3. Напряжение и ЭДС кислотного аккумулятора при разряде и заряде.
Как видно из рис. 1.3, разрядное напряжение быстро спадает до 2,0 В, затем медленно понижается до 1,8 В, после чего наблюдается резкое снижение напряжения. Предельное значение разрядного напряжения, до которого можно разряжать аккумулятор стационарного типа, составляет 1,8 В для режимов разряда не короче одночасового (аккумуляторов типа СН для режимов разряда не короче трёхчасового) и 1,75 В для более коротких режимов разряда. Дальнейший разряд приводит к образованию крупнокристаллического сульфата свинца на пластинах, что исключает возможность последующего эксплуатационного заряда аккумулятора. Номинальным напряжением принято считать напряжение 2,0 В.
Количество электричества (Ач), которое может отдать полностью заряжённый аккумулятор при нормальных условиях разряда, указанных для него, называется номинальной ёмкостью.
Под номинальной ёмкостью стационарных аккумуляторов, применяемых на предприятиях связи, понимают то количество электричества, которое он может отдать при 10 – часового режима разряда (СЦ) неизменном токе и температуре электролита +25С (для аккумуляторов типа СН принята температура +20С). Величина тока 10 - часового режима разряда численно равна частному от деления номинальной ёмкости на 10.
Ёмкость аккумулятора зависит от его конструкции, количества активных материалов и режима разряда (тока разряда и температуры окружающей среды). При увеличении разрядного тока ёмкость, которую может отдать аккумулятор до достижения его предельного разрядного напряжения, уменьшается, так как при этом возрастают его поляризации и омические потери (например, для аккумулятора типа СН номинальной ёмкостью С10=72 Ач при часовом режиме разряда током 18 А завод – изготовитель гарантирует ёмкость С3=54 Ач). Поляризация и омическое сопротивление аккумулятора возрастают также с понижением температуры электролита.
Под удельной ёмкостью аккумулятора понимают отношение его номинальной ёмкости к объёму или массе. Под энергией аккумулятора А понимают произведение его ёмкости С на среднее напряжение при разряде Ucp(A=Cucp). Отношение энергии аккумулятора, которую он отдаёт при разряде, к энергии, необходимой для его заряда А3 при определённых условиях, называется отдачей по энергии (КПД аккумулятора).
При заряде кислотного аккумулятора неизменным по величине током напряжение его сравнительно быстро возрастает до 2,10…2,15 В (рис. 1.3). Затем напряжение медленно растёт до 2,3…2,35 В по мере восстановления активной массы пластин и повышении плотности электролита. При напряжениях выше 2,4…2,5 В начинается бурное выделение водорода и кислорода, связанное с электролизом воды. К концу заряда, когда восстановление активных масс пластин закончено, энергия заряда расходуется только на электролиз воды. При этом напряжение на аккумуляторе остаётся неизменным.
Температура электролита существенно влияет на напряжение во время его заряда. Понижение температуры, вызывающее увеличение его внутреннего зарядного сопротивления, приводит к повышению напряжения на нём. Следует отметить, что при низких температурах (близких к нулевой) не удаётся осуществить заряд кислотного аккумулятора, так как напряжение на нём сразу возрастает до значения, при котором начинается электролиз воды.
В отключённом состоянии (без нагрузки) заряженный аккумулятор теряет часть запасной им ёмкости. Это явление носит название саморазряда. Саморазряд аккумулятора увеличивается с повышением плотности электролита и его температуры.
На предприятиях связи в настоящее время находят широкое применение, как стационарные кислотные аккумуляторы, так и стартёрные.
Каждый кислотный аккумулятор состоит из сосуда, изготовленного из кислотоустойчивого материала (стекло, пластмасса, деревянные сосуды, выложенные внутри свинцом), положительного и отрицательного электродов (пластин), разделителей между ними – сепаратов, электролита и токоведуших частей.
В стационарных аккумуляторах открытого типа С и СК, не имеющих крышек, электролит непосредственно соприкасается с окружающим воздухом. Такие аккумуляторы требуют частой доливки воды и хорошо вентилируемого помещения. Положительными электродами в них служат поверхностные пластины, т.е. работающие за счёт своего поверхностного слоя. Такой электрод состоит из свинцовой пластины, на поверхности которой электрически формируется слой активной массы (PbO2). Для увеличения активной поверхности положительные пластины имеют ребристую форму. Отрицательными электродами в этих аккумуляторах служат коробчатые пластины. Пластины этого типа представляют собой решётку, в ячейках которой помещается активная масса. Для предотвращения выпадания активной массы из ячеек пластины закрываются перфорированными свинцовыми листами.
В стационарных аккумуляторах закрытого типа положительные и отрицательные электроды представляют собой пастированные пластины (аккумуляторы типа СН). В пастированных электродах активная масса удерживается в решётке из свинцово-сурьмяного сплава толщиной 1…4 мм. Аккумулятор типа СН имеет в крышке специальную пробку, задерживающую аэрозоли серной кислоты.
В аккумуляторах несколько отрицательных пластин соединяют параллельно. Между ними помещают положительные пластины, также соединённые параллельно. Параллельное соединение одноимённых пластин позволяет увеличить ёмкость аккумулятора. Каждая группа положительных и отрицательных пластин работает как одна пластина, площадь которой равна сумме площадей, проницаемых для раствора электролита (из вулканизированного каучука – ми пор, поливинилхлорида – ми пласт и стекловолокна).
В условных обозначениях стационарных аккумуляторов открытого типа буква С обозначает «стационарный», две буквы СК указывают, что аккумуляторы пригодны для коротких режимов разряда большими токами. Число, стоящее после букв, указывает номер аккумулятора (С10=5328 Ач). минимальное время разряда аккумуляторов типа СК составляет 0,5 ч. при этом разрядный ток не должен превышать 25 А. на номер аккумулятора. Следовательно, допустимый разрядный ток аккумулятора СК-148 при длительности разряда 0,5 ч составит 148х25=3700 А, а ёмкость, которую он при этом может отдать, С0,5=0,5х3700=1850 Ач. удельная энергия аккумуляторов типа С и СК составляет 10…23 Втч/кг. Промышленность выпускает аккумуляторы типа С и СК ёмкостью от 36 до 5328 Ач (45 типов).
В условном обозначении аккумуляторов закрытого типа СН, выпускаемых в Югославии цифры указывают не номер аккумулятора, а непосредственно его номинальную ёмкость С10 (аккумуляторы типа СН72…СН-1152). Эти аккумуляторы имеют несколько лучшие удельные показатели по сравнению с аккумуляторами типа СК и также пригодны для коротких режимов разряда.
В настоящее время на предприятиях связи применяется в основном один способ эксплуатации батарей, составленных из аккумуляторов типа С, СК и СН – непрерывный подзаряд. При этом способе эксплуатации в условиях нормального электроснабжения (при наличии сети переменного тока) аппаратура питается от этих выпрямительных устройств. Полностью заряженная аккумуляторная батарея получает непрерывный подзаряд от этих выпрямительных устройств или от отдельного стабилизированного выпрямительного устройства (для компенсации саморазряда). Напряжение содержания (непрерывного подзаряда) аккумуляторной батареи определяется в зависимости от числа последовательно соединённых аккумуляторов из условия обеспечения напряжения 2,2 В2% на аккумулятор. При этом ток подзаряда 0,03 А, где - индексный номер аккумулятора.
В настоящее время в основном применяются послеаврийный (после её разряда на нагрузку) заряд батарей в две степени. На первой ступени заряд осуществляется стабильным зарядным током зар<0,25xC10 до тех пор, пока напряжение на аккумуляторе не повысится до 2,30…2,35 В. На этой ступени заряда аккумулятор получает основной заряд энергии. Вторая ступень заряда происходит при стабильном напряжении 2,2 В на аккумулятор. Заряд считается законченным, когда зарядный ток спадает до 0,02…0,03 А на индексный номер аккумулятора.
В переносной аппаратуре связи, а также на сельских АТС небольшой ёмкости, применяются щелочные аккумуляторы, которые в отличие от кислотных, могут эксплуатироваться при низких отрицательных температурах окружающей среды.
Наибольшее применение находят щелочные никель-кадмиевые (НК) и никель-железные (НЖ) аккумуляторы. Активная масса положительных электродов состоит из гидроксида никеля (Ni Ooh), активная масса отрицательных электродов – соответственно из кадмия или железа. Электролитом служит раствор гидроксида калия КОН плотностью 1190…1210 кг/м3 с добавкой 20 г/л гидроксида лития (LiOH). Ёмкость КН-аккумуляторов при температуре – 20С составляет не менее 0,6 номинальной ёмкости.
НК и НЖ-аккумуляторы чаще всего выполняются с ламельными электродами. Ламели – плоские коробочки из стальной никелированной перфорированной ленты, в которые набивают активную массу. Ламели закрепляют в рамки. Они образуют пластины электродов. Аккумуляторы, помещённые либо в стальные никелированные, либо в полиэтиленовые сосуды, представляют собой аккумуляторы закрытого типа (подобно кислотным аккумуляторам типа СН). В аппаратуре связи находят применение также герметичные никель-кадмиевые аккумуляторы без ламельными электродами. Герметичные аккумуляторы разделяют на дисковые (обозначаются Д), цилиндрические (ЦНК) и удельными значениями ёмкости и энергии, меньшим значением внутреннего сопротивления. Однако по сроку службы они уступают ламельным аккумуляторам.
Электродвижущая сила щелочных аккумуляторов ниже, чем у кислотных, у полностью заряженного КН-аккумулятора ЭДС составляет 1,30...1,35 В; у НЖ-аккумулятора – 1,35…1,40 В. Кривые изменения напряжения на зажимах КН-аккумулятора при его разряде и заряде показаны на рис 1.4.
Рис. 1.4. Напряжение щелочного
аккумулятора при разряде и заряде.
Номинальное напряжение КН-аккумулятора составляет 1,2 В, напряжение в конце разряда – 1 В, конечное напряжение заряда – 1,75…1,8 В.
НЖ-аккумуляторы, по сравнению с никель-кадмиевыми, характеризуются большим внутренним сопротивлением, меньшими удельными ёмкостью и энергией и большим саморазрядом. Кроме того, заряд НЖ-аккумуляторов должен производиться относительно большими зарядными токами, что делает их непригодными для эксплуатации в режиме непрерывного подзаряда.
В современной технике находят применение щелочные серебряно-цинковые аккумуляторы, активными веществами в которых являются оксид серебра (AgO) и цинк, электролитом – раствор КОН. СЦ-аккумуляторы характеризуются высокой удельной энергией (до 130 Втч/кг), малым внутренним сопротивлением (тысячные доли ома) и малым саморазрядом. Номинальное их напряжение равно 1,5 В. недостатками СЦ-аккумуляторов являются высокая стоимость и малый срок службы (10…100 циклов заряда – разряда).
studfiles.net
Аккумуляторы и принцип их работы
Министерство науки и образования Республики Казахстан
Актюбинский государственный университет им. К. Жубанова
Факультет: технический.
Специальность: металлургия.
Реферат.
По дисциплине: Физическая химия.
На тему: Аккумуляторы и принцип их работы.
Выполнил: студент Тихонов Тимур
Проверил(а):Байманова
Актобе 2010.
Содержание
1. Свинцово-кислотный аккумулятор
2.Принцип действия
3. Устройство
4. Физические характеристики
5. Эксплуатационные характеристики
6. Эксплуатация
7. Свинцово-кислотный аккумулятор при низких температурах
8. Хранение
9. Износ свинцово-кислотных аккумуляторов
10. Электри́ческий аккумуля́тор
11. Принцип действия
12. Никель-ка́дмиевый аккумуля́тор
13. Параметры
14. Области применения
Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области применения: стартерные батареи в автомобильном транспорте, аварийные источники электроэнергии.
Принцип действия
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде. Во время разряда происходит восстановление диоксида свинца на катоде и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция (слева-направо — разряд, справа-налево — заряд):
· Катод:

· Анод:

В итоге получается, что при разрядке аккумулятора расходуется серная кислота с одновременным образованием воды (и плотность электролита падает), а при зарядке, наоборот, вода «расходуется» на образование серной кислоты (плотность электролита растет). В конце зарядки, при некоторых критических значениях концентрации сульфата свинца у электродов, начинает преобладать процесс электролиза воды. При этом на катоде выделяется водород, на аноде — кислород. При зарядке не стоит допускать электролиза воды, в противном случае необходимо ее долить.
Устройство

Элемент свинцово-кислотного аккумулятора состоит из положительных и отрицательных электродов, сепараторов (разделительных решеток) и электролита. Положительные электроды представляют собой свинцовую решётку, а активным веществом является перекись свинца (PbO2 ). Отрицательные электроды также представляют собой свинцовую решётку, а активным веществом является губчатый свинец (Pb). На практике в свинец решёток добавляют сурьму в количестве 1-2 % для повышения прочности. Сейчас в качестве легирующего компонента используются соли кальция, в обеих пластинах, или только в положительных (гибридная технология). Электроды погружены в электролит, состоящий из разбавленной серной кислоты (h3 SO4 ). Наибольшая проводимость этого раствора при комнатной температуре (что означает наименьшее внутреннее сопротивление и наименьшие внутренние потери) достигается при его плотности 1,26 г/см³. Однако на практике, часто в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1,29 −1,31 г/см³. (Это делается потому, что при разряде свинцово-кислотного аккумулятора плотность электролита падает, и температура его замерзания, т.о, становится выше, разряженный аккумулятор может не выдержать холода.)
В новых версиях свинцовые пластины (решетки) заменяют вспененным карбоном, покрытым тонкой свинцовой пленкой, а жидкий электролит может быть желирован силикагелем до пастообразного состояния. Используя меньшее количество свинца и распределив его по большой площади, батарею удалось сделать не только компактной и легкой, но и значительно более эффективной - помимо большего КПД, она заряжается значительно быстрее традиционных аккумуляторов. [1]
Физические характеристики
· Теоретическая энергоемкость: около 133 Вт·ч/кг.
· Удельная энергоемкость (Вт·ч/кг): 30-60 Вт·ч/кг .
· Удельная энергоплотность (Вт·ч/дм³): около 1250 Вт·ч/дм³.
· ЭДС заряженного аккумулятора = 2,11 В, рабочее напряжение = 2,1 В (6 секций в итоге дают 12,7 В).
· Напряжение полностью разряженного аккумулятора = 1,75 — 1,8 В (из расчета на 1 секцию). Ниже разряжать их нельзя.
· Рабочая температура: от минус 40 до плюс 40
· КПД: порядка 80-90%
Эксплуатационные характеристики
· Номинальная ёмкость , показывает количество электричества, которое может отдать данный аккумулятор. Обычно указывается в ампер-часах, и измеряется при разряде малым током (1/20 номинальной емкости, выраженной в а/ч).
· Стартерный ток (для автомобильных). Характеризует способности отдавать сильные токи при низких температурах. В большинстве случаев замеряется при -18°С (0°F) в течение 30 секунд. Различные методики замера отличаются, главным образом, допускаемым конечным напряжением.
· Резервная емкость (для автомобильных). Характеризует время, в течение которого аккумулятор может отдавать ток 25А. Обычно составляет порядка 100 минут.
Эксплуатация

Ареометр может быть использован для проверки удельного веса электролита каждой секции
При эксплуатации «обслуживаемых» аккумуляторов (с открываемыми крышками над банками) на автомобиле при движении по неровностям неизбежно происходит просачивание проводящего электролита на корпус акуумулятора. Во избежание сильного саморазряда необходимо периодически нейтрализовывать электролит протиранием корпуса, например слабым раствором пищевой соды. Кроме того, особенно в жаркую погоду, происходит испарение воды из электролита, что увеличивает его плотность и может оголить свинцовые пластины. Поэтому необходимо следить за уровнем электролита и своевременно доливать дистиллированную воду.
Такие нехитрые операции вместе с проверкой автомобиля на утечку тока и периодической подзарядкой аккумулятора могут на несколько лет продлить срок эксплуатации батареи.
Свинцово-кислотный аккумулятор при низких температурах
По мере снижения окружающей температуры, параметры аккумулятора ухудшаются, однако в отличие от прочих типов аккумуляторов, свинцово-кислотные снижают их относительно медленно, что не в последнюю очередь обусловило их широкое применение на транспорте. Очень приблизительно можно считать, что емкость снижается вдвое при снижении окружающей температуры на каждые 15°С начиная от +10°С, то есть, при температуре -45°С свинцово-кислотный аккумулятор способен отдать лишь несколько процентов первоначальной емкости.Снижение емкости и токоотдачи при низких температурах обусловлено, в первую очередь, ростом вязкости электролита, который уже не может в полном объеме поступать к электродам, и вступает в реакцию лишь в непосредственной близости от них, быстро истощаясь.Еще быстрее снижаются зарядные параметры. Фактически, начиная с, примерно -15°С, заряд свинцово-кислотного аккумулятора почти прекращается, что приводит к быстрой прогрессирующей разрядке аккумуляторов при эксплуатации в режиме коротких частых поездок (так называемый, "режим доктора"). В этих поездках аккумулятор практически не заряжается, его необходимо регулярно заряжать внешним зарядным устройством.Считается, что не полностью заряженный аккумулятор в мороз может растрескаться из-за замерзания электролита. Однако раствор серной кислоты в воде замерзает совсем не так, как чистая вода - он постепенно густеет, плавно переходя в твердую форму. Такой режим замерзания вряд ли способен вызвать разрыв стенок незамкнутого сосуда (а банка аккумулятора - незамкнутый объем). Электролит, в массовой литературе называемый "замерзшим" фактически еще можно перемешивать.Растрескивание стенок аккумулятора при морозах действительно бывает, но в основном является следствием изменения свойств применяемого для стенок материала, а не расширением электролита при замерзании.
Хранение
Свинцово-кислотные аккумуляторы необходимо хранить только в заряженном состоянии. При температуре ниже −20 °C заряд аккумуляторов должен проводиться постоянным напряжением 2,275 В/секцию, 1 раз в год, в течение 48 часов. При комнатной температуре — 1 раз в 8 месяцев постоянным напряжением 2,35 В/секцию в течение 6-12 часов. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется.
Слой грязи и накипи на поверхности аккумулятора создает проводник для тока от одного контакта к другому и приводит к саморазряду аккумулятора, после чего начинается преждевременная сульфатизация пластин и поэтому поверхность аккумулятора необходимо поддерживать в чистоте (то есть его надо мыть перед хранением) Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере их работоспособности.
При длительном хранении аккумуляторов и разряде их большими токами (в стартерном режиме), или при уменьшении ёмкости аккумуляторов, нужно проводить контрольно-тренировочные (лечебные) циклы, то есть разряд-заряд токами номинальной величины.[2]
Износ свинцово-кислотных аккумуляторов
При использовании технической серной кислоты и недистиллированной воды ускоряются саморазрядка, сульфатация, разрушение пластин и уменьшение емкости аккумуляторной батареи.
mirznanii.com
Свинцово–кислотный аккумулятор - Help for engineer
Свинцово–кислотный аккумулятор
Свинцово–кислотный аккумулятор – на данный момент, этот тип аккумуляторов считается наиболее распространённым, нашел широкую область применения как автомобильный аккумулятор.
Принцип действия аккумулятора
Принцип действия, как говорилось ранее в статье про аккумуляторы, основан на окислительно-восстановительной электрохимической реакции. В данном случае на реакции свинца с диоксидом свинца, находящихся в сернокислотной среде. Во время использования аккумулятора, происходит разряд – на аноде будет происходить восстановление диоксида свинца, а на катоде – окисление свинца.
Окислительно-восстановительная химическая реакция на аноде:

Окислительно-восстановительная химическая реакция на катоде:

Во время зарядки аккумулятора, будут проходить ровно обратные реакции, с выделением кислорода на положительном электроде, и выделением водорода на отрицательном. Следует учесть, что на критических значениях, когда происходит зарядка и аккумулятор почти заряжен, может начать преобладать реакция электролиза воды, что приведет к её постепенному исчерпанию.
В итоге, можно сказать, что при заряде серная кислота будет выделяться в электролит, что влечет за собой повышение плотности электролита, а при разряде серная кислота будет расходоваться, и плотность будет падать.
Устройство аккумулятора
Свинцово-кислотный аккумулятор состоит из электродов, разделительных сепараторов (ячеек, изоляторов), которые находятся в электролите. Сами электроды на вид – это свинцовые решетки, только с разным активным веществом, положительный электрод имеет активное вещество – диоксид свинца (PbO2), отрицательный электрод – свинец.

Рисунок 1 – Общий вид свинцово-кислотного аккумулятора

Рисунок 2 – Ячейка аккумулятора с положительными и отрицательными электродами, разделёнными сепараторами
На рисунке 1 вы можете видеть в моноблоке отдельные ячейки подробно рассмотренные на рисунке 2 – в которых находятся положительные и отрицательные электроды, разделённые сепараторами.
Эксплуатация свинцово-кислотного аккумулятора при низких температурах
В отличии от других типов аккумуляторов, свинцово-кислотные более-менее устойчивы к холоду, как мы видим в последствии – широкое применение на автотранспорте. Свинцово-кислотный аккумулятор теряет 1% своей ёмкости на каждый градус отличный от +20°C, что говорит о том, что при 0°C ёмкость свинцово-кислотного аккумулятора будет составлять лишь 80% его ёмкости. Это обусловлено увеличением вязкости электролита при низких температурах, из-за чего он не может поступать в нормальной степени к электродам, а тот электролит что поступает, быстро истощается.
Зарядка аккумулятора
Для большинства аккумуляторов ток зарядки должен быть написан на корпусе, примерно, он может находиться в пределах от 0.1 до 0.3 емкости аккумулятора. Вообще, общепринятым считается зарядка аккумулятора 10% током от его ёмкости, на протяжении 10 часов. Максимальное напряжение при зарядке не должно превышать 2.3 ± 0.023 В на каждый из элементов аккумулятора. То есть, можно сказать что для свинцового аккумулятора с напряжением в 12 В, напряжение во время зарядки не должно превышать 13.8 ± 0.15 В.
Хранение свинцово кислотных аккумуляторов
Свинцово-кислотные аккумуляторы хранятся только в заряженном состоянии. Хранение их в разряженном состоянии приводит к потере работоспособности.
Добавить комментарий
h4e.ru
Свинцово-кислотные аккумуляторы
Строительные машины и оборудование, справочник

Категория:
Электрооборудование трактора
 Свинцово-кислотные аккумуляторы
Свинцово-кислотные аккумуляторыЭлектрические аккумуляторы тракторов и автомобилей являются электрохимическими устройствами, в которых при зарядке электрическая энергия внешнего источника тока используется на образование химических соединений, при разрядке химическая энергия превращается в электрическую в результате перехода образовавшихся ранее химических соединений в первоначальное состояние.
Поскольку в системах электрического оборудования тракторов и автомобилей применяется напряжение 6, 12 или 24 В, аккумуляторы напряжением около 2 В объединяют в батареи. Свинцово-кислотные аккумуляторные батареи состоят из трех (6 В) или шести (12 В) последовательно соединенных аккумуляторов.
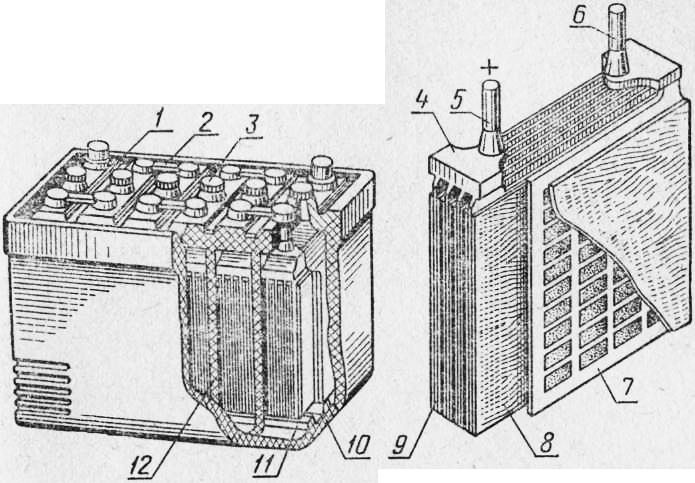
Рис. 1. Устройство кислотной аккумуляторной батареи: 1 — крышка; 2 — перемычка; 3 — пробка заливного отверстия; 4 — баретка; а и б — выводные полюсные штыри; 7 — отрицательная пластина; 8 — сепаратор; 9 — положительная пластина; 10 — эбонитовый бак; 11 — ребра; 12 — перегородка бака
Свинцово-кислотный аккумулятор состоит из бака, в который заливается водный раствор серной кислоты (электролит) и опускаются положительные и отрицательные пластины.
Бак имеет перегородки (рис. 1), отделяющие аккумуляторы друг от друга, и ребра на днище для опоры пластин и образования пространства для накопления выпавшего шлама (частиц активной массы пластин). Сверху бак закрывается крышками с отверстиями: для прохода палюсныхштырей, залива электролита и контроля его уровня в аккумуляторе. Бак изготовляют из эбонита или асфальтопека с кислотостойкими вставками из полистирола.
Крышки бака уплотняют кислотостойкой мастикой из нефтяного битума и авиационного масла.
Пластины отливают в виде решеток, ячейки которых заполняют активной массой. Материалом для решеток служит сплав химически чистого свинца с добавкой 6…8% сурьмы, которая улучшает прочность и литейные свойства сплава.
Активная масса пластин представляет собой порошок из окислов свинца (свинцового сурика и свинцового глета) с добавками для увеличения пористости готовых пластин.
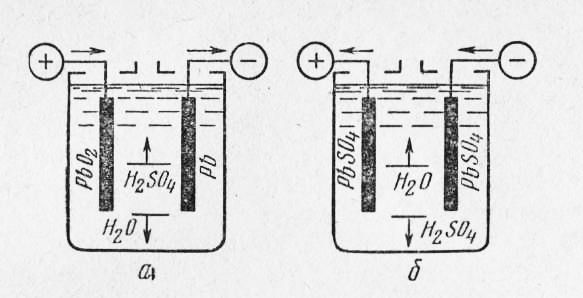
Рис. 2. Схема работы кислотного аккумулятора: а — зарядка: б — разрядка: t и 1 — соответственно увеличение и уменьшение содержания h3SO в электролите
Свинцовый порошок замешивается серной кислотой и в виде пасты вмазывается в ячейки решетки.
В процессе зарядки под действием электрического тока сернокислый свинец пластин вступает в химическую реакцию с электролитом (рис. 2). При этом активная масса положительных пластин превращается в перекись свинца РЬ02 темно-коричневого цвета, отрицательных — в губчатый свинец РЬ светло-серого цвета, а концентрация серной кислоты в составе электролита повышается. Разрядка аккумулятора сопровождается вступлением серной кислоты h3S04 электролита в химическую реакцию с активной массой положительных и отрицательных пластин, переходом активной массы пластин в сернокислый свинец PbS04 и снижением концентрации серной кислоты в составе электролита.
Сепараторы предотвращают соприкосновение положительных и отрицательных пластин, но дают электролиту свободный доступ к их активной массе. Материалом сепараторов служат мипор (микропористый эбонит), пластмассы (мипласты — микропористые пластмассы, изготовляемые на основе полихлорвиниловой смолы), стекловойлок (из-за недостаточной механической прочности применяется только в комбинации с другими материалами).
Однополюсные пластины собираются в пакеты и объединяются баретками с выводными полюсными штырями.
Пакеты положительных и пакеты отрицательных пластин вместе с сепараторами образуют блоки. В блоке отрицательные и положительные пластины чередуются, между каждыми двумя соседними пластинами ставят сепаратор, крайними пластинами являются отрицательные с более прочной активной массой.
Выводные штыри отдельных аккумуляторов соединяются перемычками таким образом, что в батарее аккумуляторы имеют последовательное соединение. При этом свободные клеммы крайних аккумуляторов служат для присоединения нагрузки.
Основные электрические характеристики стартерных аккумуляторов — электродвижущая сила (э. д. е)., внутреннее сопротивление, напряжение на клеммах, емкость и коэффициент электрической отдачи.
В зависимости от режима разрядки различают номинальную и стартерную емкость.
Номинальную емкость определяют при 10-часовом разрядном режиме до напряжения 1,7 В при начальной плотности электролита 1,285 и температуре электролита 30 °С.
Стартерную емкость определяют при температуре +30 °С и -18 °С. Разрядный ток при этом равен утроенному значению номинальной емкости аккумуляторной батареи.
При параллельном соединении нескольких аккумуляторов в батарею их емкости складываются, а напряжение остается равным напряжению одного аккумулятора. Последовательное соединение аккумуляторов в батарею суммирует напряжение отдельных аккумуляторов, однако емкость аккумуляторной батареи при этом остается такой же, как и емкость отдельного аккумулятора.
Аккумуляторные батареи с сухозаряженными пластинами имеют в маркировке букву 3.
—
Электрическим аккумулятором называется устройство, служащее для периодического накопления в нем электрической энергии (заряда), переходящей в химическую, которая получается от источников постоянного тока (при заряде) и по мере надобности отдается аккумулятором потребителю (при разряде).
Процесс превращения в химическом источнике тока электрической энергии в химическую называется зарядом, а химической энергии в электрическую — разрядом.
При заряде аккумулятора на его пластинах в результате электролиза (разложения) образуются новые химические вещества. Во время разряда образовавшиеся активные вещества переходят в первоначальные химические соединения. Через некоторое время работы аккумулятора на разряд запас активных веществ в нем истощается и разрядный ток прекращается. Для возобновления действия аккумулятор надо зарядить снова.
Выпускаются различные типы аккумуляторов, отличающиеся друг от друга составом активных веществ и электролитом. В настоящее время наиболее распространены свинцовые (или кислотные) и щелочные аккумуляторы.
Читать далее: Техническая эксплуатация свинцово-кислотных аккумуляторных батарей
Категория: - Электрооборудование трактора
Главная → Справочник → Статьи → Форум
stroy-technics.ru
Кислотные аккумуляторы разряд - Справочник химика 21
Задание. Запишите уравнения реакцнй, протекающих на электродах кислотного аккумулятора прн его разряде, суммарную реакцию и определите ЭДС. Убедитесь, что ЭДС зависит от концентрации серной кислоты и в процессе разряда уменьшается. [c.249]При заряде свинцовых кислотных аккумуляторов на отрицательном электроде в принципе могли бы идти два процесса образование металлической свинцовой губки и выделение водорода. Потенциал водорода положительнее, чем свинца и он должен был бы выделяться раньше, но высокое перенапряжение для выделения водорода на свинце препятствует его разряду. При заряде аккумуляторов в нормальных условиях в начале заряда выделение водорода незначительно. Точно также на положительном электроде,кислород должен был бы выделяться при потенциалах более отрицательных, чем потенциал образования двуокиси свинца, но высокое перенапряжение для выделения кислорода на РЬОз задерживает его образование. [c.478]
Степень использования никеля, кадмия и железа в щелочных аккумуляторах меньше зависит от условий разряда, чем использование свинца в кислотных аккумуляторах. В активные массы щелочных аккумуляторов никеля (считая на металл) закладывается от 3,85 до 5,1 г на 1 а-ч номинальной емкости. Это дает коэффициент использования никеля порядка 42—57%. Кадмия на 1 а-ч расходуется от 2,8 до 3,5 г коэффициент использования кадмия колеблется от 60 до 75%. Железо, как материал более дешевый, обычно закладывается в аккумулятор с большим избытком. [c.522]
Широкое использование натрий-серных батарей, энергоемкость которых на порядок превышает свинцово-кислотные аккумуляторы, тормозится из-за отсутствия высокоэффективной технологии керамического электролита, способного многократно выдерживать без разрушения операции заряда и разряда. [c.86]
Некоторые типы кислотных аккумуляторов могут требовать до 12 циклов заряд — разряд, прежде чем они достигнут гарантируемой (номинальной) емкости [3]. [c.54]
Конечное напряжение разряда для кислотных аккумуляторов при нормируемых режимах разряда составляет 1,7—1,8 В, а для щелочных 1 В. Конечное напряжение заряда составляет для кислотных аккумуляторов 2,6—2,7 В, а для щелочных 1,56—2,05 В. [c.405]
Испытания на саморазряд кислотных аккумуляторов и батарей проводят следующим образом. У каждого испытываемого аккумулятора или батареи проверяют величину емкости и сообщают им не менее двадцати тренировочных циклов. Перед испытанием на саморазряд аккумуляторы и батареи должны быть подвергнуты трем контрольным циклам заряд — разряд. После 3-го контрольного разряда производится 4-й контрольный заряд, по окончании которого аккумуляторы и батареи ставят на хранение (на время 3, 15 или 30 суток). В помещении, в котором хранят аккумуляторы, должна поддерживаться температура 20 5°С. [c.68]
Никель-кадмиевые и никель-железные аккумуляторы, в которых применяется составной электролит, должны выдерживать 750 циклов заряд—разряд с момента их изготовления и после гарантийных 3,5 лет хранения с сохранением величины отдаваемой емкости не ниже номинальной. Учитывая же практическую возможность использования аккумуляторов при несколько пониженной емкости, срок их службы можно считать более продолжительным. Снижение емкости на 25% против номинальной у НК и НЖ аккумуляторов происходит примерно к 1500 циклу. Фактический срок хранения НК и НЖ аккумуляторов во много раз превышает гарантированный. Известны случаи эксплуатации НК и НЖ аккумуляторов на протяжении более 25 лет. Срок службы и срок хранения НК и НЖ аккумуляторов должен учитываться при оценке экономической эффективности их эксплуатации. Так, например, если фактический максимальный срок эксплуатации кислотных аккумуляторов составляет 5 лет, а НК и НЖ аккумуляторов — 20 лет, то при оценке экономической эффективности это обстоятельство должно учитываться. При этом необходимо принять во внимание и эксплуатационные расходы на протяжении определенного отрезка времени. [c.119]
Наибольшую скорость заряда имеют кислотные аккумуляторы, которые за 3—4 час при постоянном напряжении 2,4 в способны воспринять 80—90% номинальной емкости [2]. Именно на эту емкость следует рассчитывать при определении времени аварийного разряда аккумуляторных батарей. [c.142]
Таким образом, процесс разряда сопровождается уменьшением концентрации серной кислоты. Для кислотных аккумуляторов в еще большей степени, чем для серебряно-цинковых, вредны глубокие разряды. Для каждого режима разряда имеется низший предел напряжения, переступать который нельзя, поскольку образующийся слишком толстый слой сульфата свинца в порах активных веществ может значительно затруднить последующий заряд аккумуляторов (табл. 37). [c.246]
Срок службы кислотных аккумуляторов зависит от их типа и режима эксплуатации. Для стартерных аккумуляторов он равен нескольким десяткам циклов, для некоторых типов стационарных аккумуляторов — более тысячи циклов. Кривая зависимости емкости от числа циклов заряд — разряд кислотных аккумуляторов (рис. 126) имеет в начале некоторый подъем, а к концу некоторый спад. Рост емкости объясняется более глубокой формировкой активных масс, а спад — различными необратимыми процессами, такими, как уплотнение структуры электродов, выкрашивание активной массы. [c.248]
Такое соотношение удельных сопротивлений между отдельными компонентами активных масс определяет характер изменения внутреннего сопротивления кислотных аккумуляторов при заряде и разряде в первом случае оно уменьшается, во втором — растет. [c.251]
Поскольку при разряде кислотных аккумуляторов плотность электролита уменьшается от 1,26—1,28 примерно до 1,1, то электропроводность электролита сначала несколько возрастает, а затем уменьшается. Такие же изменения происходят и при заряде. Активное (омическое) сопротивление одного аккумулятора типа РН-60 в заряженном состоянии составляет несколько тысячных ома. В разряженном состоянии оно в несколько раз больше. [c.251]
Разрядные кривые кислотных, никель-цинковых и никель-кадмиевых аккумуляторов имеют падающий характер, т. е. напряжение этих аккумуляторов в процессе разряда изменяется непрерывно. Однако кислотные аккумуляторы (кривая /) имеют более пологую разрядную кривую по сравнению с никель-цинковыми (кривая 3) и безламельными никель-кадмиевыми аккумуляторами (кривая 6), разрядные кривые которых идут почти параллельно. [c.373]
Щелочные батареи после ряда усовершенствований получают широкое распространение на тепловозах. Их достоинствами являются сравнительно малая чувствительность к механическим воздействиям, простота обслуживания, малая способность к саморазрядам, также малая чувствительность к разрядам большими токами. Однако меньшая э. д. с и емкость, большая масса и объем, более высокая стоимость пока не позволяют заменить ими кислотные аккумуляторы. [c.262]
Среди заводских аккумуляторщиков и работников эксплуатации длительно существовало мнение, что для сохранения емкости и работоспособности свинцово-кислотных аккумуляторов необходимы их регулярные разряды не менее чем на 75% емкости и заряды напряжением до 2,7—2,8 в на элемент. При переходе с режима заряд-разряд на режим постоянного подзаряда необходимость регулярных технологических разрядов была полностью исключена. Аккумуляторные батареи, установленные на электростанциях и подстанциях, при отсутствии аварии могут годами не разряжаться. [c.151]
Опыт эксплуатации свинцово-кислотных аккумуляторов показал, что их без опасности сульфатации можно заряжать любым напряжением в пределах 2,1—2,75 в на элемент. Вся разница лишь в длительности заряда. Установлено было также отсутствие необходимости в регулярных профилактических тренировочных разрядах и в регулярных уравнительных зарядах с предварительным разрядом. [c.152]
Емкость аккумуляторов измеряют в ампер-часах (А-ч). Номинальная мощность одной банки свинцово-кислотного аккумулятора СК-1 36 А-ч, что соответствует 10-часовому режиму работы с током разряда 3,6 А. Емкость аккумулятора с другим типовым номером (СК-2, СК-3...), определяют по формуле [c.147]
Степень использования никеля, кадмия и железа в щелочных аккумуляторах меньше зависит от условий разряда, чем использование свинца в кислотных аккумуляторах. В активные массы щелочных аккумуляторов никеля (в пересчете на металл) закладывается от 3,1 до 3,8 г на 1 А-ч номинальной. емкости, что соответствует [c.495]
При длительных режимах конечное напряжение свинцово-кислотных аккумуляторов устанавливается в пределах от 1,7 до 1,8 Б, при коротких (стартерных) режимах —в пределах 1,0—1,5 В на элемент. Разряжать аккумулятор ниже установленного конечного напряжения не рекомендуется, так как глубокий разряд вызывает необратимые изменения активной массы электродов. [c.9]
Отдача по энергии зависит от тех же факторов, что и отдача по емкости и, кроме того, от отношения напряжений при заряде и разряде батареи. В среднем для кислотных аккумуляторов тношения напряжения разряда к напряжению заряда составляет около 80—85 %. [c.15]
Под электрической батареей понимается соединение двух или более элементов, способных преобразовывать химическую энергию в электрическую. Таким образом, элемент является частью батареи. Однако термин батарея применяют и к одному элементу. Главными частями элемента являются два электрода, помещенных в электролит в соответствующем сосуде. Наиболее известным примером электродов являются медные и цинковые пластины в простейшем первичном элементе или пластины свинца и двуокиси свинца в свинцово-кислотном аккумуляторе. Электролит представляет собой водный раствор определенных кислот, щелочей или солей, найденных пригодными для этой цели. В практике используется большое количество разнообразных элементов. Они могут быть условно разделены на две главные группы первичные и вторичные элементы. Наиболее известными из первичных элементов являются так называемые сухие элементы . Вторичные элементы обычно называются аккумуляторами. Различие между первичными и вторичными элементами лежит в характере химических реакций, протекающих в них во время их работы. При преобразовании в первичных элементах химической энергии в электрическую элемент истощается. Отработавший сухой элемент выбрасывается. Мокрый элемент можно восстановить сменой электродов и электролита. Преобразование химической энергии в электрическую в аккумуляторах происходит при помощи обратимых реакций. Поэтому они могут быть заряжены пропусканием через них тока в направлении, обратном направлению тока разряда. Во время заряда электрическая энергия преобразовывается в химическую. При последующем разряде она опять преобразуется в энергию электрическую. Аккумулятор не накапливает электричество как таковое. Б аккумуляторе накапливается химическая энергия, которая в потенциале может быть превращена в электрическую. [c.11]
Относительная емкость свинцово-кислотных аккумуляторов при различных режимах разряда и температуры [c.240]
Как ранее было указано, цинк уже давно используется в качестве активного материала отрицательного электрода. Однако во всех случаях он использовался как растворимый электрод, что приводило к потере (вследствие вторичных процессов) части активного материала, к неравномерному осаждению его при заряде, образованию дендритов и возникновению коротких замыканий. Андре же использовал способность цинкатов разлагаться в растворах щелочи по реакции Кг2п02 + НгО = 2К0Н -+ 2пО с образованием окиси цинка. В условиях, когда в качестве электролита применяется раствор едкой щелочи, насыщенной окисью цинка, цинк во время разряда аккумулятора переходит в раствор не в виде цинката, а выделяется в осадок на поверхности электрода, подобно сульфату свинца в кислотном аккумуляторе. Во время заряда окись цинка через ряд промежуточных стадий вновь превращается в металлический цинк. Таким образом, процессы, протекающие в Ц-С аккумуляторе, при заряде выразятся так [c.527]
Железо-никелевые аккумуляторы. Емкости положительных и отрицательных пластин железо-никелевых аккумуляторов могут быть определены также с помощью вспомогательных элект1родов в основном тем же способом, который был описан для свинцово-кислотных аккумуляторов. Для лабораторнЫ Х целей подходящими электродами являются каломельный полуэлемент или же отрезок положительной трубки, взятый из щелочного аккумулятора. Вывод к этому электроду должен быть сделан из того же самого металла, который применен для удержания активного материала, или же трубка должна быть сделана достаточно длинной для того, чтобы она выступала из жидкости. Электрод должен быть изолирован так, чтобьи он не мог касаться пластин. Для этой цели пригоден лист перфорированного эбонита. Как это было показано в разделе о железо-никелевых аккумуляторах, в положительных пластинах, после того как заряд закончен, происходит самопроизвольное разложение перекиси никеля до низшей степени окисления ввиду этого необходимо производить частичный разряд промежуточного электрода (трубки) после предварительного его заряда для того, чтобы привести его в устойчивое состояние. Помимо этой предосторожности, желательно также дать электроду до употребления постоять день или два в электролите аккумулятора. [c.264]
Разряд кислотных аккумуляторов в зависимости от их назначения может производиться различными токами. Нормальным разрядным током для радионакальных аккумуляторов, как, впрочем, и для многих других, является ток 10-час режима. Для радио-анодных аккумуляторов нормальным режимом разряда является 25-час. Разрядная кривая имеет три характерных участка (рис. 124). В начале разряда наблюдается довольно резкое снижение напряжения, в дальнейшем напряжение уменьшается плавно вплоть до самого конца разряда, где оно вновь резко падает. [c.245]
На отрицательном электроде свинец последовательно окисляется до сульфата и двуокиси свинца, после чего на нем будет происходить выделение кислорода. Таким образом, глубоко переполюсованный кислотный аккумулятор, в отличие от всех других известных типов аккумуляторов, оказывается заряженным в обратном направлении и теоретически может отдавать при разряде емкость. Однако такого положения нельзя допускать, поскольку при этом емкость и срок службы аккумулятора значительно сокращаются из-за совершенно различной технологии изготовления положительного и отрицательного электродов. [c.262]Причины порчи аккумуляторов. Основными причинами порчи кислотных аккумуляторов являются саморазряд, достигающий около 1 % его емкости в сутки, и сульфатация — отложение на поверхности пластин Маг504, плохо проводящего ток. Быстрый саморазряд может возникнуть из-за коротких замыканий между пластинками вследствие выпадения активной массы из пластин, а также из-за чрезмерных токов при заряде и разряде. Сульфатация является результатом несвоевременного заряда разряженных аккумуляторов. Особенно бурно происходит сульфатация пластин при переплюсовке аккумулятора, т. е. вследствие неправильного подключения аккумулятора к источнику постоянного тока при заряде. Об определении полярности электродов см. приложение 3. [c.405]
С момента создания свинцово-кислотного аккумулятора (1869 г.) было предложено много теорий, объясняющих процессы его заряда и разряда. Однако лишь одна теория, теория двойной сульфатации (Гладстон и Трайб, 1882 г.), несмотря на выдвигавшиеся против нее возражения, является общепринятой. Теория двойной сульфатации означает, что при разряде аккумулятора активная масса обоих электродов превращается в сульфат свинца (сернокислый свинец РЬ504). Основные положения этой теории состоят в следующем. [c.28]
Вообще величина внутреннего сопротивления кислотных аккумуляторов невелика и зависит от конструкции п размеров аккумуляторов. Внутреннее сопротивление аккумулятора >эденьщается во В(ремя заряда и возрастает при разряде. Особенно сильно возрастает внутреннее сопротивление аккумуляторов при наличии засульфатированных пластин, так как при образовании крупных кристаллов сульфата свинца происходит отставание активной массы от решеток. [c.220]
При разряде кислотных аккумуляторов пользуются различной силой разря Дного тока в зависимости от на-31наче(ния alккyi Iyлятoipo.в или батарей. Для сравнения же свойств аккумуляторов, проявляющихся при их разряде, пользуются для каждого типа аккумулятора определенной и постоянной по величине силой тока, называемой нормальной. Нормальной считают разрядную силу тока, равную номинальной емкости аккумулятора, деленной на десять. Режим разряда в этом случае называют 10-часовым режимом. При эксплоатации стартерных аккумуляторов пользуются ускоренным режимом разряда, снимая с аккумулятора или батарей большие разрядные силы тока. В этом случае допускаются конечные напряжения разряда значительно меньшие 1,8 в. Например, при 5-минутном режиме [c.227]
Влияние разряднойсилы тока. В кадмиевоникелевых аккумуляторах емкость, в отличие от кислотных аккумуляторов, очень мало зависит от разрядной силы тока, при разряде их до разных, заранее установленных конечных напряжений. Вызывается это тем, что в кислотных аккумуляторах при больших разрядных силах тока процесо протекает в слоях, близких к поверхности. Благодаря этому сульфат свинца, занимающий значительно больший объем, чем исходные активные вещества, закупоривает капиллярные отверстия и препятствует проникновению серной кислоты в толщу пластин. В щелочных же аккумуляторах объемы продуктов, получающихся из активных веществ при разряде пластины, мало отличаются по объемам от исходных активных веществ. Поэтому закупорки капиллярных отверстий в толще активной массы не происходит. [c.288]
Фирма Дженерал Электрик разрабатывает ряд герметичных цилиндрических перезаряжаемых свинцовыч элементов напряжением 2 В, а также аккумуляторные батареи. Первым и пока единственным элементом этого ряда, относительно которого имеются данные, является элемент В, обладающий при 10-часовом разряде емкостью 2,5А-ч. Конструкция этого элемента аналогична конструкции стандартных цилиндрических никель-кад-миевых элементов. Он герметичен, имеет предохранительный клапан, в нем использованы свернутые в цилиндрическую спираль электроды. Элемент можно заряжать и разряжать в любой ориентации. Свинцовые элементы со спиральными электродами обладают малой скоростью саморазряда, которая на 30 % меньше, чем у других типов свинцово-кислотных аккумуляторов. [c.183]
chem21.info
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)