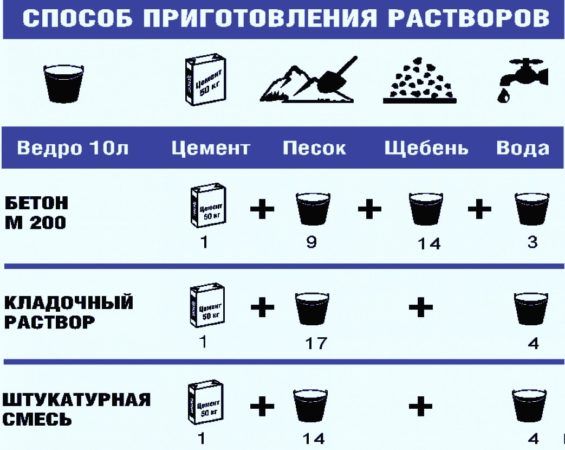
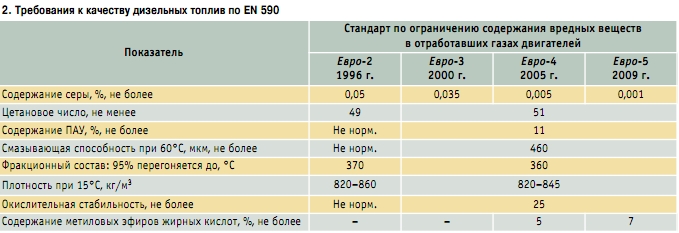
|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Щелочь: формула, свойства, применение. Щелочные растворы
Почему в алюминиевой посуде нельзя хранить щелочные растворы
В рекомендациях по приготовлению и хранению различных средств в домашних условиях часто можно встретить фразу, что стоит использовать эмалированную, стеклянную или нержавеющую посуду. При этом отмечают, что алюминиевая – не пригодна. Чтобы разобраться в таком отношении, стоит обратиться к химии и коррозии металлов. Именно они подскажут: почему в алюминиевой посуде нельзя хранить щелочные растворы.
Основные факты про вещество
Элемент, занимающий ячейку №13 Периодической системы химических элементов Д.И. Менделеева, относится к главной подгруппе третьей группы. Это промежуточное положение между металлами и неметаллами. Потому совмещает в себе свойства как первых, так и вторых.Его характерная валентность в соединениях III, а степени окисления: 0 – для простого вещества, и +3 – для соединений.Это прочный, но мягкий металл, серебристо-белого цвета. Низкая плотность позволяет легко придавать ему любую форму. Отсюда, широкое использование алюминия, в том числе и в бытовых целях. Достаточно вспомнить погнутые вилки и ложки в общественных столовых.
Что же расскажет химия про алюминий?
С точки зрения химии, алюминий это реакционно-активное вещество. Обычно, во всех взаимодействиях он ведет себя как восстановитель, а сам окисляется, то есть легко отдает все свои 3 валентных электрона. Потому в природе в чистом виде не существует.Вся тайна неординарного поведения этого металла заключается в его двойственности или, как ее еще называют в амфотерности. Состоит она в проявлении кислотных или основных свойств в зависимости от среды, основной или кислой соответственно. Так, алюминий (Al), как простое вещество, реагирует с разбавленными кислотами и выделяет из них молекулы водорода (Н2). С щелочами в растворе, образует красивые комплексные соединения. С теми же щелочами, но в расплаве образует соли алюминиевой кислоты (h4AlO3) – алюминаты.
Коррозионная стойкость алюминия
Метал алюминий – любимый материал в производстве. Помимо перечисленных выше его достоинств: мягкости и прочности, сюда можно добавить высокую коррозионную прочность в обычных условиях.Коррозией называют разрушение веществ без внешнего механического воздействия. Это понятие привычно для металлов и сплавов, хотя на самом деле применимо, к любому другому материалу тоже.Чистые металлы или сплавы вступают в реакцию с веществами окружающей среды и окисляются, нарушая целостность изделия. Самым распространенным примером является образование и отслоение ржавчины на железной поверхности. Коррозия алюминиевых деталей выглядит в виде темных точек, царапин и провалов.
Устойчивость алюминия к коррозии обусловлена наличием оксидной пленки (Al2O3) на поверхности. Пленка тонкая и прочная, внешне практически незаметная. Полностью покрывает поверхность металла, тем самым защищая его от негативного воздействия внешних факторов.Образуется Al2O3 легко взаимодействием с кислородом воздуха. Получается, что в атмосфере алюминий сам себя защищает от коррозионных процессов. Он проявляет стойкость даже в средах с большим содержанием сероводорода, аммиака, хлороводорода и других газов. Этим обосновано применение алюминия как материла для оборудования в химической промышленности или емкостей для хранения в сельском хозяйстве.
Если говорить о посуде, то в ней происходят процессы разрушения под действием водных растворов. Обессоленная (дистиллированная) вода, как и горячий пар, не будут иметь никакого влияния на алюминиевую поверхность. Коррозию могут вызвать минеральные соли или щелочи в воде, если оксидная пленка потеряет свою целостность (например, поцарапается ложкой) и откроет молекулярный алюминий. В таком случает, он прореагирует с водой, образуя белый гидрооксид (Al(OH)3), и выделит водород (Н2).
Что понимать под щелочными растворами?
Щелочи – это соединения, в состав которых входят металлы главной подгруппы первой группы и ион гидрооксида (ОН-). Они растворимы в воде, где находятся в виде соответствующих ионов. Эти растворы и являются щелочными. Например, натрия гидрооксид (NaOH), калия гидрооксид (КОН) и т.д.Тем не менее, к щелочным растворам можно отнести те, чья среда имеет водородный показать (рН) выше 7. Этот параметр зависит от концентрации ионов водорода (Н+) в растворе, и показывает реакцию среды: кислую, нейтральную или щелочную.Щелочную среду имеют: раствор пищевой соды (NaHCO3), нашатырный спирт (Nh5ОН) и прочие. Высокое значение рН показывают мыльные растворы.
Что происходит с алюминиевой посудой в щелочных растворах?
Под действием щелочей оксидная пленка на поверхности алюминия растворяется. Открытый при этом металл взаимодействует с водой, образуя, как уже указывалось ранее, гидрооксид алюминия.Например, если в емкость из алюминия налить едкий натр (NaOH), то появится голубое окрашивание раствора, обусловленное тетрагидроксоалюминатом натрия (Na[Al(OH)4]). Окрашивание может исчезнуть при добавлении избытка воды или кислоты, например, уксуса. В реакции также выделиться молекулярный водород, который можно наблюдать в виде пузырьков.
Раствор пищевой соды тоже бурно прореагирует с алюминиевой посудой, при этом будет наблюдаться обильная пена. После тару можно промыть водой, и поверхность заблестит, как новенькая.Объяснить это можно тем, что гидрокарбонат натрия (сода) вступит в реакцию с оксидом алюминия, образуя комплексную соль и угольную кислоту (Н2СО3), которая неустойчива и распадается с выделением газа, диоксида углерода (СО2). Подобная реакция наблюдается в кулинарии при гашении соды уксусом.Таким образом, алюминий прекрасный материал для изготовления тары. Он коррозионно-устойчивый там, где другие металлы и сплавы пасуют. Даже агрессивные среды не способны его разрушить. Но, оказывается, щелочные растворы, даже такие безобидные как смесь пищевой соды с водой, могут разрушающе действовать на изделия из чистого алюминия и его сплавов.
pochemu24.ru
ВОДНЫЕ ЩЕЛОЧНЫЕ РАСТВОРЫ
Бикарбонат натрия NaHCO3 - питьевая сода.
В холодной воде дает нейтральную реакцию. В горячей воде имеет щелочную реакцию, так как разлагается с выделением углекислого газа.
Бисульфит натрия NaHSO3 - кислая натриевая соль серной кислоты, получаемая из едкого натра и двуокиси серы. Имеет вид бесцветных кристаллов, растворимых в воде. Применяется в производстве препаратов для химической завивки ("Зави-толь", "Минтокс").
Сульфит натрия Na2SO3 - белое кристаллическое вещество, растворимое в воде. Получают взаимодействием раствора Na2CO3 c SO,, является побочным продуктом при производстве фенола. Применяется в производстве препаратов для химической завивки, в парикмахерских используется для термической перманентной завивки.
При работе с химическими веществами парикмахеру важно знать величину водородного показателя (рН среды), так как от этого зависит успех окраски или завивки волос. Для определения характера среды (нейтральная, кислая или щелочная) вводится понятие рН - водородный показатель.
Вода, являясь слабым электролитом, в незначительной степени диссоциирует (распадается) на ионы Н+ и ОН", которые находятся в равновесии с недиссоциированными молекулами: Н2О = Н+ + ОН'.
Опытным путем установлено, что в 1 л воды при комнатной температуре (22°С) диссоциации подвергаются лишь 10"7 моль и при этом образуется ICr7 моль/л ионов Н+ (водорода) и 1(г7 моль/л ионов ОН' (гидроксид-ионов). Произведение концентрации ионов водорода и гидроксид-ионов в воде, называемое ионным произведением воды, при определенной температуре - величина постоянная. Постоянство ионного произведения воды означает, что в любом водном растворе ни концентрация ионов водорода, ни концентрация гидроксид-ионов не может быть равна нулю. Иными словами, любой водный раствор кислоты, основания или соли содержит как ионы Н+, так и гидроксид-ионы ОН".
Из постоянства ионного произведения следует, что при увеличении концентрации одного из ионов воды соответствен-• но уменьшается концентрация другого иона. Таким образом, кислотность и щелочность раствора можно выражать через концентрацию либо ионов Н"1", либо ионов ОН'. На практике пользуются первым способом.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называется десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
Рн = -lg[Н+],
где Н + - концентрация ионов водорода, моль/л.
Понятие "водородный показатель" было введено датским химиком Сёренсеном в 1909 г.: буква "р" - начальная буква датского слова potenz - математическая степень, буква "Н" - символ водорода.
С помощью рН реакция растворов характеризуется так: нейтральная - рН = 7; кислая -рН <7; щелочная- рН> 7.
Например, рН желудочного сока равен 1,7 (сильнокислая реакция), торфяной воды - 4 (слабокислая), дождевой воды - 6 (слабокислая), слюны - 6,9 (слабокислая), слез - 7 (нейтральная), крови - 7,4 (слабощелочная), водопроводной воды - 7,5 (слабощелочная).
Качественно кислотность или щелочность среды определяют с помощью обычных индикаторов (лакмус, фенолфталеин, метиловый оранжевый). В условиях производства применяют весьма точные инструментальные методы определения рН приборами - рН-метрами.
Как сильные щелочи, так и сильные кислоты разрушающе действуют на волосы. Поэтому парикмахер должен знать, при каких рН должны протекать те или иные процессы. Например, мыть волосы желательно с рН, близким к 7, а завивать-с рН от 9 до 11, но не более.
ЖИРЫ
Жиры - вещества растительного или животного происхождения, состоящие главным образом из смесей полных эфиров глицерина и одноосновных жирных кислот.
В состав жиров входят предельные (насыщенные) и непредельные (ненасыщенные) жирные кислоты; первые преобладают в твердых жирах, вторые - в жидких.
Жиры делятся на растительные и животные. В зависимости от содержания в них твердых глицеридов они разделяются на жидкие и твердые. Жиры легче воды, в воде нерастворимы, но хорошо растворяются в органических растворителях - эфире, бензоле, бензине и др.
Характерной особенностью жиров является их способность поглощать из воздуха, растворять и удерживать различные пахучие вещества, что влияет на их органолептические свойства. Жиры способны омыляться. Процесс омыления состоит в том, что жир в особых условиях, присоединяя воду, расщепляется на глицерин и жирные кислоты.
При действии на жиры водных и спиртовых растворов щелочей жиры омыляются, при этом жирные кислоты соединяются со щелочами и образуют соли жирных кислот, которые называются мылами. Жиры - биологически активные вещества. Впитываясь кожей, они делают ее упругой, эластичной, защищают от ветра, мороза, воды. Содержат витамины A, D, Е, G.
В косметических изделиях используются жиры, которые по составу близки к кожному жиру, не имеют сильных запахов, с мягкой и нежной консистенцией.
Дата добавления: 2015-10-02; просмотров: 426 | Нарушение авторских прав
Кислоты | РАСТИТЕЛЬНЫЕ ЖИРЫ | ЖИВОТНЫЕ ВОСКИ | РАСТИТЕЛЬНЫЕ ВОСКИ | ЭМУЛЬГАТОРЫ | ДУШИСТЫЕ ВЕЩЕСТВА РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ | ДУШИСТОЕ СЫРЬЕ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | ДУШИСТЫЕ ВЕЩЕСТВА СИНТЕТИЧЕСКОГО ПРОИСХОЖДЕНИЯ | ЖЕЛИРУЮЩИЕ ВЕЩЕСТВА | БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА |mybiblioteka.su - 2015-2018 год. (0.059 сек.)mybiblioteka.su
формула, свойства, применение :: SYL.ru
Каждый сталкивался с таким понятием, как щелочь, но не каждый может точно сказать, что же это такое. Особенно это относится к тем, кто давно окончил школу и начал забывать уроки химии. Что же это за вещество? Какова формула щелочи в химии? Каковы ее свойства? Рассмотрим все эти вопросы в данной статье.
Определение и основная формула
Начнем с определения. Щелочью называется хорошо растворимое в воде вещество, гидроксид щелочного (1-ая группа, основная подгруппа в таблице Менделеев) или щелочноземельного (2-ая группа, основная подгруппа в таблице Менделеева) металла. Стоит заметить, что бериллий и магний, хотя и принадлежат к щелочным металлам, щелочей не образуют. Их гидроксиды относят к основаниям.
Щелочи - самые сильные основания, растворение которых в воде сопровождается тепловыделением. Примером этого служит бурная реакция с водой гидроксида натрия. Из всех щелочей наименее растворим в воде гидроксид кальция (известный также как гашеная известь), который в чистом виде представляет собой порошок белого цвета.
Из определения можно сделать вывод, что химическая формула щелочи - ROH, где R - щелочноземельный (кальций, стронций, радий, барий) или щелочной (натрий, калий, литий, цезий, франций, рубидий) металл. Приведем некоторые примеры щелочей: NaOH, KOH, CsOH, RbOH.
Реакции
Абсолютно все щелочи реагируют с кислотами. Реакция протекает так же, как кислоты и основания - с образованием соли и воды. Пример:
NaOH+HCl=NaCl+h3O
Приведенная реакция - соляная кислота + щелочь. Формулы реакций различных щелочей с кислотами:
КОН+HCl=KCl+h3O
NaOH+HNO3=NaNO3+h3O
Помимо кислот, щелочи реагируют также с кислотными оксидами (SO2, SO3, CO2). Реакция проходит по тому же механизму, что и щелочи с кислотой - в результате взаимодействия образуется соль и вода.
Щелочи взаимодействуют и с амфотерными оксидами (ZnO, Al2O3). При этом образуются нормальные или комплексные соли. Самая типичная из таких реакций оксид цинка + едкая щелочь. Формула такой реакции:
2NaOH+ZnO=Na2ZnO2+h3O
В показанной реакции образуется нормальная соль натрия Na2ZnO2 и вода.
Реакции щелочей с амфотерными металлами протекают по тому же механизму. Приведем в качестве примера реакцию алюминий + щелочь. Формула реакции:
2KOH+2Al+6h3O=2K(Al(OH)4)+3h3
Это пример реакции с образованием комплексной соли.
Взаимодействие с индикаторами
Для определения pH исследуемого раствора используются специальные химические вещества - индикаторы, которые меняют свой цвет в зависимости от значения показателя водорода в среде. Самый распространенный индикатор, используемый в химических исследованиях, - лакмус. В щелочной среде он приобретет интенсивный синий цвет.
Другой доступный индикатор, фенолфталеин, в щелочной среде приобретает малиновый окрас. Однако в очень концентрированном растворе (показатель водорода близок к 14) фенолфталеин остается бесцветным, как и в нейтральной среде. Потому лакмус при работе с концентрированными щелочами использовать предпочтительнее.
Метиловый оранжевый индикатор в щелочной среде приобретает желтый окрас, при уменьшении pH среды цвет меняется от желтого до оранжевого и красного.
Физические свойства щелочей
Помимо этого, щелочи также хорошо растворяются в этаноле. Концентрированные и умеренные растворы имеют pH от 7.1 и выше. Растворы щелочей мыльные на ощупь. Концентрированные составы - довольно едкие химические соединения, контакт с которыми вызывает химические ожоги кожи, глаз, любых слизистых оболочек, поэтому работать с ними следует осторожно. Воздействие едкого вещества можно нейтрализовать раствором кислоты.
Щелочи могут находиться как в твердом, так и в жидком состоянии. Гидроксид натрия - самая распространенная щелочь (формула NaOH), которая в твердом состоянии представляет собой вещество белого света.
Гидроксид кальция при нормальных условиях - белый порошок. Гидроксиды радия и бария в твердом агрегатном состоянии - бесцветные кристаллы. Гидроксиды стронция и лития также бесцветны. Все твердые щелочи поглощают воду из воздуха. Гидроксид цезия - самая сильная щелочь (формула CsOH). Щелочные свойства металлов 1-ой группы основной подгруппы возрастают сверху вниз. Эти вещества нашли применение в химической промышленности. В основном их используют в щелочных аккумуляторах в качестве электролитов. Чаще всего применяют гидроксиды калия и натрия.
Химический ожог щелочью
При использовании неразбавленных щелочей всегда стоит помнить, что они являются едкими веществами, которые при попадании на открытые участки тела вызывают покраснение, зуд, жжение, отек, в тяжелых случаях образуются пузыри. При длительном контакте такого опасного состава со слизистой органов зрения возможно наступление слепоты.
При химическом ожоге щелочью необходимо промыть пораженное место водой и очень слабым раствором кислоты - лимонной или уксусной. Даже незначительное количество едкой щелочи может вызвать обширное поражение кожи и ожог слизистых, поэтому с такими веществами стоит обращаться аккуратно и держать подальше от детей.
www.syl.ru
Кислоты и щелочные растворы
Строительные машины и оборудование, справочник

Категория:
Автомобильные материалы и шины
 Кислоты и щелочные растворы
Кислоты и щелочные растворыСерная кислота — h3S04 представляет собой маслянистую, бесцветную жидкость с удельным весом 1,84. Она обладает очень сильными окислительными свойствами. Органические вещества под воздействием кислоты обугливаются. Серная кислота хорошо соединяется с водой и поглощает водяные пары, соединение протекает бурно с выделением большого количества тепла. Во избежание ожогов рук и лица при смешивании с водой следует кислоту вливать в воду небольшими дозами, тщательно перемешивая раствор стеклянной палочкой. Концентрированная серная кислота окисляет большинство металлов.
Соляная кислота НС1 является раствором хлористого водорода в воде и представляет собой бесцветную жидкость. Соляная кислота, применяемая для технических целей, подкрашивается различными примесями и имеет обычно желтоватый цвет и едкий, удушливый запах. Удельный вес—1,19. Техническая соляная кислота вследствие постоянного выделения из нее хлористого водорода дымит и называется поэтому дымящей.
Многие металлы растворяются в соляной кислоте, при этом выделяется водород и образуются хлористые соли.
Для получения щелочных растворов применяются обыкновенная и каустическая сода.
Обыкновенная сода iNa2C03 получается из поваренной соли. Концентрированный раствор поваренной соли насыщается аммиаком, после чего через раствор пропускают под давлением углекислый газ, и образуется сода.
Каустическая сода КаОН, по внешнему виду представляет собой белое твердое вещество, обладающее сильными разъедающими свойствами при воздействии на органические вещества. Каустическая сода получается путем электролиза раствора поваренной соли.
Растворы обыкновенной и каустической соды обладают свойством нейтрализовать действие кислот и разрушать накипи.
Применение кислот и щелочных растворов имеет самый разнообразный характер. Серная кислота в смеси с водой применяется для очистки .металлических деталей путем их травления для снятия ржавчины. В большом количестве применяется очищенная серная кислота для приготовления электролита, заливаемого в аккумуляторные батареи автомобилей.
Соляная кислота в смеси с водой и другими материалами применяется для удаления накипи в системе охлаждения автомобильных двигателей, для травления поверхности металлических изделий перед лужением и пайкой и для приготовления травленой кислоты путем раствора в ней чистого цинка.
Растворы обыкновенной каустической соды применяются главным образом для удаления нагара, грязи, масла и накипи в радиаторах и рубашках блоков цилиндров.
Читать далее: Нефть и продукты ее переработки
Категория: - Автомобильные материалы и шины
Главная → Справочник → Статьи → Форум
stroy-technics.ru
Щелочной раствор - перекись - водород
Щелочной раствор - перекись - водород
Cтраница 1
Щелочные растворы перекиси водорода, вне зависимости от степени их чистоты, всегда менее стабильны, чем кислые растворы той же степени чистоты. Так, например, если к слабокислому раствору перекиси водорода добавить небольшое количество ионов тяжелых металлов, например меди, свинца, марганца или кобальта, то скорость разложения может возрасти с одного или двух процентов в год до нескольких процентов в неделю. Те же растворы при добавке щелочи полностью разлагаются в течение нескольких минут или часов. [1]
Щелочной раствор перекиси водорода, свежеприготовленный. [2]
Щелочные растворы перекиси водорода применяются для травления германия при изготовлении полупроводниковых приборрв. Однако механизм этой реакции почти не изучен. Некоторые авторы [1] связывают процесс травления германия с атомарным кислородом, выделяющимся при разложении перекиси водорода в щелочной среде. Другие [2] считают, что реакционными частицами в этой среде являются ионы НОГ-В этих работах изучалась лишь зависимость скорости растворения германия от концентрации щелочи и не учитывалось изменение концентрации перекиси водорода во время реакции за счет разложения. [3]
Щелочной раствор перекиси водорода также вызывает расщепление трополонового цикла. [4]
Щелочные растворы перекиси водорода снижают способность шерсти к свойлачиванию и сообщают ей сопротивляемость усадке. Поэтому обработку перекисью водорода используют иногда в сочетании с хлорированием шерсти для сообщения последней устойчивости против усадки. Вуд [34] опубликовал недавно статью, касающуюся вопроса снижения способности смеси волокон чистой шерсти или смесок к свойлачиванию и обеспечения их формостойкости путем обработки различными химическими веществами; в статье содержатся также многочисленные ссылки на литературу. [5]
При действии щелочных растворов перекиси водорода на растворы солей циркония или пере-киси водорода на пульпу ZrO2 х Н2О образуются перекисные со-единения. В системе ZrO2 х Н2О - Н2О2 - Н2О было установлено существование перекисных соединений, отвечающих эмпирическим формулам ZrOa 2Н2О, ZrOs Н2О и ZrOs. Области их существования определяются концентрацией перекиси водорода и температурой. При 0 существуют первые две фазы, при - 20 появляется третья фаза. [6]
Окисление 4-изопропилтрополона щелочным раствором перекиси водорода протекает довольно сложно [9, 349, 416], однако детальное исследование продуктов окисления позволило выяснить последовательность их образования [339, 340]; оказалось, что окисление протекает согласно приведенной ниже схеме. [7]
Метод с применением щелочного раствора перекиси водорода был использован только для определения немногих нитрилов, включая ацетонитрил, пропионитрил, бути-ронитрил и сукцинонитрил. Однако метод может быть применен к большинству простейших алифатических нитрилов. [8]
Прекрасным стабилизатором для щелочных растворов перекиси водорода является силикат натрия ( жидкое стекло), кото - i рый обычно добавляется в ванны для беления. Раньше при кис-1 лородном белении перекисью натрия производилась частичная или полная нейтрализация щелочи свободной кислотой или уда - Щ ление ее добавками солей, например, хлористым магнием или сульфатом кальция. Этот способ обладал рядом / недостатков: употребление кислоты удорожало [ процесс беления, нримшсндо же солей приводило к образованию шлама, состоящего па магниевых или кальциевых соединений. В настоящее время способ этот не применяется, так как было установлено, что силикат натрия, а также соединения магния, в особенности силикат его S8a даже в небольших количествах и при шагрепании, способны в значительной степени подавить разлагающее действие щелочи. Лучше всего стабилизирующее действие проявляется при наибольшей дисперсности стабилизатора, например, при применении стабилизатора в коллоидном состоянии. Это обстоятельство указывает на то, что антикаталитическое действие связано с адсорбционными явлениями. Соответствующие коллоиды ( силикаты натрия или магния) вводят в щелочные растворы перекиси водорода либо в готовом виде, либо в виде смеси из ж идкого стекла и хлористого магния. [9]
Окисление ненасыщенных кетонов щелочным раствором перекиси водорода вне зависимости от строения кетонов почти всегда приводит к образованию соответствующих окисей. [10]
Окисление пуберуловой кислоты щелочным раствором перекиси водорода является примером применения этого реактива. [11]
Органобораны легко окисляются щелочным раствором перекиси водорода. [12]
Германий растворяется в щелочном растворе перекиси водорода, в царской водке и при сплавлении со щелочами; с последними германий образует растворимые гер-манаты. [13]
Вследствие протекания этой реакции щелочные растворы перекиси водорода неустойчивы. [14]
Наилучшим растворителем для германия является щелочной раствор перекиси водорода. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
О реактивах
План
Растворы
Техника приготовления растворов
Растворы
Растворы весьма распространены в природе, технике, организмах человека и животных, с ними мы сталкиваемся повседневно и повсюду. Это и вода морей, океанов, рек, озер, воздух, которым мы дышим, металлические сплавы, используемые в авиации и космической технике, автомобилестроении, энергетике — чугун, сталь, бронзы, латунь, дюралюминий.
Химические процессы, известные с глубокой древности и изучаемые современными химиками и инженерами — технологами, в основном происходят в растворах. Растворы относятся к дисперсным системам.
Если в каком либо веществе (среде) распределено, в виде очень мелких частиц, другое вещество, то такая система называется дисперсной.
Примером сложной дисперсной системы может служить молоко, основными составными частями которого (не считая воду) являются жир, казеин и молочный сахар. Жир находится в виде эмульсии и при стоянии молока постепенно поднимается к верху (сливки). Казеин содержится в виде коллоидного раствора и самопроизвольно не выделяется, но легко может быть осажден (в виде творога) при подкислении молока, например, уксусом. В естественных условиях выделение казеина происходит при скисании молока. Наконец, молочный сахар находится в виде молекулярного раствора и выделяется лишь при испарении воды.
Свойства дисперсных систем, в первую очередь их устойчивость, зависят от размеров распределенных частиц. Если последние очень велики по сравнению с размерами молекул, дисперсные системы не прочны и распределенное вещество сравнительно быстро оседает вниз или, если оно легче вещества среды, поднимается вверх. Такие системы называются взвесями.
Если распределенное вещество находится в состоянии молекулярного раздробления, системы получаются устойчивые, не разделяющиеся при сколь долгом стоянии. Такие системы называются молекулярными растворами или просто растворами.
Промежуточную область занимают коллоидные растворы, в которых размеры частиц находятся между размерами частиц взвесей и молекулярных растворов.
Наибольшее значение для химии имеют дисперсные системы, в которых средой является жидкая фаза.
Вся наша жизнь связана с водой, точнее, с водными растворами самых различных веществ. Нет ни одного факта, который показал бы возможность возникновения жизни без участия воды или без ее присутствия. Человек не может жить без воды.
Мы говорим «вода», но в действительности — это водный раствор. Даже если вода находится в металлическом сосуде, она содержит ионы (или атомы) этого металла, а это — раствор!
Раствор — это однофазная термодинамически равновесная система, состоящая из смеси двух или более веществ (компонентов). Это научное определение понятия «раствор». Все слова этого определения вам известны, и смысл их понятен. Вам следует только объединить понятия в одно общее представление.
В растворе все компоненты его находятся в виде молекул, ионов или небольших ассоциатов (небольших групп, скоплений, ансамблей) частиц.
Иногда растворы рассматривают как фазы переменного состава, в которых соотношение веществ может быть изменено в определенных пределах без появления новых фаз.
Растворы могут быть жидкими, твердыми (кристаллическими) и газообразными.
То вещество (тот компонент), которое находится в большем количестве по сравнению с другими, принято называть растворителем, а другие вещества раствора называют растворенными веществами.
Важнейшей характеристикой раствора является его состав, который выражается концентрацией растворенных компонентов.
Пользуются различными способами выражения концентрации.
Отношение массы данного вещества (компонента) к массе всего раствора (всей системы) есть долевая концентрация по массе. Если долевую концентрацию умножить на 100, то это будет процентная концентрация ( по массе). Иногда ее называют массовым процентом или процентом по массе. Так, 35% раствор — это раствор, в 100 г которого содержится 35 г растворенного вещества.
Иногда говорят о растворении металлов, например натрия в воде или цинка в соляной кислоте. Это не правильно, в данном случае образуется химическое соединение. Растворением называется только такой процесс, при котором растворенное вещество можно выделить из раствора в его исходном состоянии такими простыми операциями, как выпаривание растворителя, перекристаллизация и так далее.
Итак, растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Состав раствора, в отличие от химического соединения, может изменяться в широких пределах. В свойствах раствора проявляются ряд свойств его компонентов, что также не присуще химическим соединениям. К механическим смесям близко подходит непостоянство состава растворов, но от них они отличаются гомогенностью.
Процесс растворения кристаллических твердых тел протекает под влиянием молекул растворителя и колебательного движения частиц тела. Выравнивание концентрации растворенного вещества происходит по диффузионному механизму. Растворение с течением времени выравнивается по скорости с образным ему процессом кристаллизации. Наступает в итоге состояние динамического равновесия между числом перешедших в раствор и выделившихся из него молекул. Такой раствор называется насыщенным раствором.
Растворение большинства кристаллических тел в воде идет с поглощением теплоты, обусловленным большим расходом энергии на разрушение кристаллической решетки твердого тела, которая часто не компенсируется при образовании гидратированных ионов. Между тем растворение в воде гидроксидов натрия, калия и др. сопровождается сильным разогревом раствора. Тепловой эффект реакции гидратации КОН составляет +54 кДж (ДН= —54 кДж).
Растворимостью вещества называется его способность образовывать однородную систему с другим веществом, являющимся растворителем.
Растворимость жидкостей в жидкости бывает неограниченной и ограниченной. Для первого вида это система «спирт—вода», для второго — «эфир—вода». После встряхивания эфира с водой происходит расслоение, что можно наблюдать на опыте по образованию границы раздела между двумя растворами: водный раствор эфира (внизу) и эфирный раствор воды (вверху).
Приведем некоторые виды растворов, определяемые качественными и количественными параметрами растворенного вещества и растворителя.
По массе растворенного вещества растворы подразделяют на разбавленные и концентрированные (условно). К разбавленным можно отнести растворы, содержащие один или менее моль растворенного вещества в 1 л раствора. При этом насыщенным называется раствор, концентрация которого при определенной температуре отвечает растворимости вещества. Если для растворения взято больше этого количества то избыток будет находиться в осадке. Между осадком и раствором устанавливается подвижное равновесие. В ненасыщенном растворе концентрация растворенного вещества ниже его растворимости.
Содержание вещества в насыщенном растворе при данной температуре является критерием его растворимости. Чаще всего эту величину выражают как массу в граммах безводного вещества, содержащегося в 100 г растворителя в насыщенном растворе. Ее называют коэффициентом растворимости.
В некоторых случаях возможно также образование пересыщенных растворов, которые содержат избыток растворенного вещества. Такие растворы образуются путем длительного охлаждения насыщенных растворов и представляют собой неустойчивые (лабильные) системы, при внесении в которые затравки в виде кристаллика соли или другого соединения, а также при встряхивании или сотрясении раствора происходит лавинная кристаллизация основной массы растворенного в избытке вещества. Этот опыт относится к очень наглядным и демонстрационным, в частности, его производят на примере раствора иодида свинца, образующего красивые тонкие чешуйки золотисто-желтого цвета.
По характеру взаимодействия растворенного вещества с растворителем различают ионные и молекулярные растворы. В первых растворяемое вещество представлено в виде молекул и продуктов их диссоциации на ионы. Во вторых — в виде молекул и их ассоциатов. Например, водные растворы соляной кислоты 10%, 12%, 14%, 20%, 33%, 4%, сульфата кальция, гидроксида калия 20%, 30%, 45%, 50% — ионные, растворы глюкозы, альбумина, кислорода в воде — молекулярные.
Ионные растворы, или растворы электролитов, относятся к проводникам электричества II рода, т. е. им присуща ионная проводимость. Это растворы солей, кислот, оснований, а также их расплавы и некоторые соединения в виде твердых тел.
По степени диссоциации электролиты относят к сильным (? > 30%), слабым (? < 3%) и средним (3% < ? < 30%). Сила электролитов и их растворимость не коррелируют друг с другом, так как малорастворимые соли, например РbSO4, относятся к сильным электролитам ввиду высокой степени ионизации молекул, находящихся в растворе. К сильным электролитам относятся кислоты НСlO4, НС1, Н2SO4, НNО3, щелочи КОН, NаОН, Са(ОН)2, большинство хорошо растворимых в воде солей — Са(НСO3)2, FеSO4, МgСl2 и др.
К средним электролитам принадлежат НF, Н2SО3, Н3РO4, НСООН, к слабым — Н2СО3, Н2S, СН3СООН, НCN, NН4ОН, Fе(СNS)3 и др. Это деление в некоторой мере зависит от природы растворителя, температуры и концентрации раствора. При разбавлении водой возрастает ?, к такому же результату приводит повышение температуры раствора, приводящее к усилению разрыва молекул на ионы.
Техника приготовления растворов
Независимо от того, какие готовят растворы, применять следует только чистые растворители. Если растворителем служит вода, то необходимо применять только дистиллированную или деминерализованную воду, а в отдельных случаях даже бидистиллят или специально очищенную дистиллированную воду.
Предварительно готовят соответствующие емкости (посуду), в которых будут готовить и хранить получаемый раствор. Посуда должна быть чистой.
Перед приготовлением растворов нужно подготовить по возможности два одинаковых сосуда: один — для растворения, а другой — для хранения раствора. Может случиться, что раствор нужно будет отфильтровывать от какого-либо осадка или примеси, не растворившейся в данных условиях.
Вымытый сосуд полезно предварительно проградуировать.
Для растворения следует применять по возможности чистые вещества. Готовые растворы обязательно проверяют на содержание нужного вещества и, если это будет необходимо, поправляют растворы, т. е. добавляют в них недостающее количество вещества или воды.
Нужно принимать меры для защиты приготовленных растворов от попадания в них пыли или газов, с которыми могут реагировать некоторые растворы. Так, щелочи следует защищать от двуокиси углерода, для этого бутыль со щелочью снабжают хлоркальциевой трубкой, заполненной натронной щелочью или аскаритом.
При хранении бутыли или другая посуда обязательно должны быть закрыты предварительно подобранными пробками.
При особо точных и ответственных анализах следует обязательно принимать во внимание возможность выщелачивания стекла и применять, если это допустимо, кварцевую посуду или такую, стекло которой не содержало бы искомый элемент. Так, неизбежна ошибка при определении бора, цинка, алюминия, свинца и некоторых других элементов в посуде из стекла, содержащего эти элементы.
В некоторых случаях растворы следует хранить в атмосфере инертного газа, как азот, или в атмосфере двуокиси углерода. Для этого существуют специальные устройства или особые бюретки, приспособленные для каждого случая титрования.
Щелочные растворы нельзя оставлять надолго в фарфоровой и особенно — в стеклянной посуде.
Растворы кислот
При разбавлении кислот следует помнить, что нужно приливать кислоту к воде, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Кислота — это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Рассмотрим растворы некоторых кислот.
Раствор соляной кислоты 10%, 12%, 14%, 20%, 33%, 4% — один из самых широко используемых растворов кислот. Его используют при очистке сплавов различных металлов, в гальванике, для очистки и дезинфекции, в пищевой промышленности и медицине.
Раствор серной кислоты — используется при изготовлении минеральных удобрений, электролита для свинцовых аккумуляторов, при создании искусственных волокон, в нефтехимической и нефтеперерабатывающей промышленности.
Раствор фосфорной кислоты — используется для производства удобрений, при очистке металлов, в текстильном производстве, при создании искусственных материалов, выплавке стекла, для производства медикаментов и в других отраслях промышленности.
Растворы щелочей
Если вещество содержит гидроксильную группу (ОН), которая может отщепляться (подобно отдельному «атому») в реакциях с другими веществами, то такое вещество является основанием. Существует много оснований, которые состоят из атома какого-либо металла и присоединенных к нему гидрокси-групы. Например:
Гидроксильные группы одновалентны, поэтому формулу основания легко составить по валентности металла. К химическому символу металла надо приписать столько гидрокси-групп, какова валентность металла. Большинство оснований — ионные соединения.
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Существует также основание, в котором гидроксильная группа присоединена не к металлу, а к иону Nh5+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу Nh5OH. Гидроксид аммония образуется в реакции присоединения воды к аммиаку, когда аммиак растворяют в воде:
Nh4 + h3O = Nh5OH (гидроксид аммония).
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей «мыльные» на ощупь и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками. При растворении щелочи происходит сильное разогревание, в особенности в тех местах, где лежат куски ее. Чтобы растворение шло быстрее, раствор следует все время перемешивать.
Концентрированные растворы щелочей сильно выщелачивают стекло, поэтому хранение осуществляется в полиэтиленовой таре
Если раствор щелочи все-таки попал в лицо, необходимо промыть глаза большим количеством воды, а затем разбавленным раствором слабой кислоты (например, борной).
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH — гидроксид калия (едкое кали), NaOH — гидроксид натрия (едкий натр), LiOH — гидроксид лития, Ca(OH)2 — гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 — гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Щелочами называются растворимые в воде сильные основания.
Раствор гидроокиси калия 20%, 30%, 45%, 50% — используется для производства метана, изготовления Калий — Литиевого электролита для щелочных аккумуляторов, в целлюлозном производстве и еще многих отраслях промышленности. Незаменимо это вещество в лабораторной практике: с его помощью выявляется уровень кислотности сред.
Раствор гидроокиси натрия (каустической соды, едкого натра) — один из наиболее широко используемых щелочных растворов. Использование его настолько широко что перечисление займет не одну страницу. Это и моющие средства используемые как в пищевой промышленности, так и дома, это и бумажное производство, и производство современного вида топлива, это химическая и нефтехимическая промышленность, и так далее.
Приготовление растворов у нас
baza1r.ru
Приготовление раствора щёлочи.

Обратная связь
ПОЗНАВАТЕЛЬНОЕ
Сила воли ведет к действию, а позитивные действия формируют позитивное отношение
Как определить диапазон голоса - ваш вокал
Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими
Целительная привычка
Как самому избавиться от обидчивости
Противоречивые взгляды на качества, присущие мужчинам
Тренинг уверенности в себе
Вкуснейший "Салат из свеклы с чесноком"
Натюрморт и его изобразительные возможности
Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д.
Как научиться брать на себя ответственность
Зачем нужны границы в отношениях с детьми?
Световозвращающие элементы на детской одежде
Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия
Как слышать голос Бога
Классификация ожирения по ИМТ (ВОЗ)
Глава 3. Завет мужчины с женщиной

Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
 Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
 Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Определение молярной концентрации эквивалента, титра стандартного раствора щелочи.
ЦЕЛЬ РАБОТЫ: приготовить стандартный раствор щелочи и определить его титр и молярную концентрацию эквивалента.
1 Приготовление стандартного раствора щёлочи.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: В качестве стандартного раствора обычно употребляют раствор гидроксида калия КОН или NaOH, С(1/1) = 0,1 моль/дм3. Для приготовления используют твёрдую щёлочь или её концентрированный раствор.
Исходные данные.
Приготовить раствор щёлочи NaОН, С(Naон) 0,1 моль/дм3, из твёрдого гидроксида натрия в объёме 500 см3.
1н 1000 см3 раствора NaОН - 40 г.
0,1н 500 см3 - х г.
х = = 2,0 г.
Щёлочь при хранении поглощает из воздуха СО2, поэтому всегда содержит примеси карбоната. Учитывая это свойство щёлочи и гигроскопичность твёрдой щёлочи, для приготовления раствора берут массу навески на 50% больше рассчитанной.
ПРИБОРЫ И РЕАКТИВЫ:
1. Раствор Н2С2O4 * 2Н2O 0,1н приготовленный из фиксанала.
2. Сухая щёлочь NaОН.
3. Дистиллированная вода.
4. Индикатор фенолфталеин.
5. Склянка на 500 см3.
6. Бюретка на 25 см3.
7. Пипетка на 10 см3.
8. Колбы для титрования.
ХОД РАБОТЫ:
На технических весах взвешивают стакан объёмом 100 - 200 см3 и пластмассовым шпателем помещают в него кусочки NaОН. Затем в стакан наливают 30-50 см3 дистиллированной воды и быстро сливают, и так ополаскивают кусочки 2-3 раза. При этом часть Na2СО3, покрывающей кусочки щёлочи, растворится. Если щелочь имеет чешуйчатый вид , то ее не обливают и навеску берут на 10 - 20 % больше рассчитанной. Промытые кусочки щёлочи растворяют в том же стакане охлаждённой прокипяченной водой и через воронку сливают в склянку объёмом 500 см3. В склянке раствор разбавляют прокипяченной дистиллированной водой до заданного объёма, закрывают и осторожно перемешивают. Приготовлен раствор щёлочи приблизительной концентрации.
2 Определение молярной концентрации эквивалента и титра стандартного раствора.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: Установление точной концентрации приготовленного раствора щёлочи можно проводить по щавелевой кислоте Н2С2О4 * 2Н2О, янтарной кислоте Н6С4О4 или по раствору соляной кислоты НСl. Наиболее часто используется щавелевая кислота.
Н2С2О4+ 2NaОН = Na2С2О4 + 2Н2O
В точке эквивалентности образуется соль слабой кислоты и сильного основания.
рН = 7 + (4,2-1,3)/ 2 = 8,45
Индикатор фенолфталеин имеет интервал перехода 8,0 - 10,0 и обеспечивает наименьшую ошибку титрования.
ХОД РАБОТЫ:
В подготовленную бюретку наливают раствор щёлочи, заполняют кончик бюретки и доводят раствор щёлочи до нулевой метки. В коническую колбу, в которой проводят титрование, пипеткой переносят точный объем исходного раствора щавелевой кислоты (10 см3) и добавляют 1-2 капли фенолфталеина. Титруют щавелевую кислоту щёлочью до появления от одной избыточной капли щёлочи бледно - розовой окраски, не исчезающий при перемешивание в течении 0,5 минуты.
Титрования повторяют до тех пор, пока три последних титрования не совпадут или не будут различаться не более, чем на 0,1 см3. Окончательным считают среднее значение из результатов трёх титрований.
ПРОТОКОЛ АНАЛИЗА:
V1( NaOH) =
V2( NaOH) =
V3( NaOH) =
Vcp( NAOH) = =
РАСЧЕТ РЕЗУЛЬТАТОВ АНАЛИЗА:
С(NAOH) *Vcp(NAOH) = С( 1/2Н2С2O4 · 2Н2O) * V (Н2С2O4 · 2Н2O) . Отсюда выражаем:
СNaOH= =
TNaOH = =
К NaOH= =
ЛАБОРАТОРНАЯ РАБОТА № 12
megapredmet.ru
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)