|
||||
|
|
звонок бесплатный
Наши сотрудники:
[email protected]
Екатерина - специалист по продаже а/м КАМАЗ
 [email protected]
[email protected]






Техника в наличии

Тягач КАМАЗ 44108-6030-24
2014г, 6х6, Евро3, дв.КАМАЗ 300 л.с., КПП ZF9, бак 210л+350л, МКБ,МОБ,рестайлинг.
цена 2 220 000 руб.,

КАМАЗ 4308-6063-28(R4)
4х2,дв. Cummins ISB6.7e4 245л.с. (Е-4),КПП ZF6S1000, V кузова=39,7куб.м., спальное место, бак 210л, шк-пет,МКБ, ТНВД BOSCH, система нейтрализ. ОГ(AdBlue), тент, каркас, рестайлинг, внутр. размеры платформы 6112х2470х730 мм
цена 1 950 000 руб.,

Самосвал КАМАЗ 6520-057
2014г, 6х4,Евро3, дв.КАМАЗ 320 л.с., КПП ZF16, ТНВД ЯЗДА, бак 350л, г/п 20 тонн, V кузова =20 куб.м.,МКБ,МОБ, со спальным местом.
цена 2 700 000 руб.,

Самосвал 6522-027
2014, 6х6, дв.КАМАЗ 740.51,320 л.с., КПП ZF16,бак 350л, г/п 19 тонн,V кузова 12куб.м.,МКБ,МОБ,задняя разгрузка,обогрев платформы.
цена 3 190 000 руб.,
СУПЕР ЦЕНА
на АВТОМОБИЛИ КАМАЗ
| 43118-010-10 (дв.740.30-260 л.с.) | 2 220 000 |
| 43118-6033-24 (дв.740.55-300 л.с.) | 2 300 000 |
| 65117-029 (дв.740.30-260 л.с.) | 2 200 000 |
| 65117-6010-62 (дв.740.62-280 л.с.) | 2 350 000 |
| 44108 (дв.740.30-260 л.с.) | 2 160 000 |
| 44108-6030-24 (дв.740.55,рест.) | 2 200 000 |
| 65116-010-62 (дв.740.62-280 л.с.) | 1 880 000 |
| 6460 (дв.740.50-360 л.с.) | 2 180 000 |
| 45143-011-15 (дв.740.13-260л.с) | 2 180 000 |
| 65115 (дв.740.62-280 л.с.,рест.) | 2 190 000 |
| 65115 (дв.740.62-280 л.с.,3-х стор) | 2 295 000 |
| 6520 (дв.740.51-320 л.с.) | 2 610 000 |
| 6520 (дв.740.51-320 л.с.,сп.место) | 2 700 000 |
| 6522-027 (дв.740.51-320 л.с.,6х6) | 3 190 000 |

подробнее про услугу перегона можно прочесть здесь.

|
Нужны самосвалы? Обратите внимание на Ford-65513-02. |
КАМАЗы в лизинг
ООО «Старт Импэкс» имеет возможность поставки грузовой автотехники КАМАЗ, а так же спецтехники на шасси КАМАЗ в лизинг. Продажа грузовой техники по лизинговым схемам имеет определенные выгоды для покупателя грузовика. Рассрочка платежа, а так же то обстоятельство, что грузовики до полной выплаты лизинговых платежей находятся на балансе лизингодателя, и соответственно покупатель автомобиля не платит налогов на имущество. Мы готовы предложить любые модели бортовых автомобилей, тягачей и самосвалов по самым выгодным лизинговым схемам.Контактная информация.
г. Набережные Челны, Промкомзона-2, Автодорога №3, база «Партнер плюс».
тел/факс (8552) 388373.
Схема проезда
Большая Энциклопедия Нефти и Газа. Аккумулятор щелочной
Работа - щелочной аккумулятор - Большая Энциклопедия Нефти и Газа, статья, страница 1
Работа - щелочной аккумулятор
Cтраница 1
Работа щелочных аккумуляторов контролируется по напряжению контрольного элемента при разряде на определенное сопротивление. [1]
В процессе работы щелочного аккумулятора электролит не расходуется, однако он требует периодического обновления из-за большой склонности к поглощению СО2 воздуха. [2]
При нормальных условиях работы щелочных аккумуляторов полезно производить смену электролита в сроки, установленные заводскими инструкциями. Смена электролита необходима главным образом для удаления карбонатов, которые постепенно накапливаются за счет углекислоты, поглощаемой из воздуха. Присутствие карбонатов вредно отражается на рабочих характеристиках аккумуляторов, вызывая повышение их внутреннего сопротивления. [3]
При нормальных условиях работы щелочных аккумуляторов полезно производить смену электролита в сроки, установленные заводскими инструкциями. Смена электролита необходима главным образом для удаления карбонатов, которые постепенно накапливаются за счет-углекислоты, поглощаемой из воздуха. Присутствие карбонатов вредно отражается на рабочих характеристиках аккумуляторов, вызывая повышение их внутреннего сопротивления. [4]
Большое влияние на работу щелочных аккумуляторов оказывают примеси. Емкость железного электрода уменьшается в присутствии даже небольших количеств А12О3, Мп2О3) Сг2О3, УгО3 и TiC2, образующих с закисью железа устойчивые соединения. Экранируя активные места поверхности, эти соединения затрудняют восстановление гидрата закиси железа при заряде. Отрицательное действие на работу железного электрода оказывают также примеси ВаО, СаО и MgO, образующие с закисью железа изоморфные смеси. [6]
Электролит в процессе электрохимических реакций не расходуется, поэтому плотность его при работе щелочного аккумулятора не изменяется. [8]
Защитные трубки предотвращают выползание и выбрызгивание электролита на поверхность щелочных аккумуляторов, улучшают техническое состояние батарей, так как применение трубок способствует поддержанию аккумуляторов в сухом и чистом виде и, следовательно, повышает изоляцию батарей, а также существенно упрощает уход за батареями, так как отпадает необходимость в частой чистке аккумуляторов и стеллажей. Применяя защитные трубки, можно значительно повысить уровень электролита, без риска увеличить загрязнение внешней поверхности аккумулятора. При этом продолжительность работы щелочных аккумуляторов между двумя очередными доливками воды увеличивается с 7 - 110 до 30 - 35 дней. [9]
Из соединений никеля важное практическое значение имеют водные закись и окись никеля. Гидрат закиси никеля Ni ( OH) 2 может быть переведен в гидрат окиси Ni ( OH) 3 электроосаждением в щелочной среде. На этом процессе основана работа щелочных аккумуляторов. [10]
Электропроводность растворов едкого кали значительно выше электропроводности растворов едкого натра, следовательно применение растворов едкого кали является предпочтительным по сравнению с применением растворов едкого натра. Раствор едкого кали удельного веса 1 19 - 1 21 является оптимальным, при котором обеспечиваются нормальная емкость аккумулятора, достаточно высокая электропроводность и почти отсутствует растворяющее действие электролита на железо. Добавка гидрата окиси лития к обычному раствору едкого кали оказывает благоприятное влияние на работу щелочных аккумуляторов, так как повышает емкость аккумуляторов и увеличивает срок их службы. [11]
Электродвижущая сила железо-никелевого аккумулятора составляет обычно 1 33 - 1 35 в. Эти аккумуляторы более удобны в обращении. Однако они обладают более низким коэффициентом отдачи - отдают в форме электрического тока приблизительно лишь 50 % энергии, поглощенной при зарядке. Найдено, что прибавка LiOH к электролиту улучшает работу щелочного аккумулятора. [12]
Электродвижущая сила железоникелевого аккумулятора составляет обычно 1 33 - 1 35 В. Эти аккумуляторы более удобны в обращении. Однако они обладают более низким коэффициентом отдачи - отдают в форме электрического тока приблизительно лишь 50 % энергии, поглощенной при зарядке. Найдено, что прибавка LiOH к электролиту улучшает работу щелочного аккумулятора. [13]
Страницы: 1
www.ngpedia.ru
Аккумуляторы щелочной - Справочник химика 21
Щелочные аккумуляторы. В условиях школы щелочные аккумуляторы портятся реже, чем свинцовые, поэтому для физического кабинета рекомендуется покупать именно щелочные аккумуляторы. Щелочные аккумуляторы могут испортиться по следующим причинам. [c.405]Щелочные аккумуляторы. Щелочные аккумуляторы в, некоторых случаях являются более удобными, чем свинцовые. Срок службы их больше, чем у свинцовых. Они более стойки к толчкам и тряске. От них можно разряжать токи большей силы и они не боятся кратковременного короткого замыкания. На продолжительное время их можно оставлять в разряженном состоянии. Однако щелочные аккумуляторы имеют меньшую э. д. с. и меньший к, п. д. В практике нашли применение два вида щелочных аккумуляторов кадмиево-никелевые и железно-никелевые. Обычно они укомплектованы из батарей, содержащих от трех до тридцати двух банок. [c.113]
Железо-никелевые щелочные аккумуляторы. Щелочные аккумуляторы имеют электроды, активная масса которых состоит из железа (или кадмия и железа) и гидроокиси никеля. Электроды опущены в раствор КОН. [c.369]Аккумуляторы щелочные (кадмиево-никелевые). ГОСТ 3895-47. [c.90]
Щелочной аккумулятор. Щелочной аккумулятор состоит из железного (отрицательного) и окисно-никелевого (положи- [c.406]
Аккумуляторы щелочные никель-кадмиевые (наливные) ГОСТ 9240—71 ИК-3 НК-14 НК-12Б 1.25 1.25 1.25 1,0 1,0 1,0 3 14 125 0,3 0,8 6,6 [c.126]
Аккумуляторы щелочные никель-железные (наливные) ГОСТ 9240—71 НЖ-22 НЖ-45 НЖ-60 нж-юг 1.25 1.25 1.25 1.25 1,0 1,0 1,0 1.0 22 45 60 100 — 1.7 2.8 4.5 6.6 [c.126]
Аккумуляторы щелочные (железо-никелевые). ГОСТ 5491-50. [c.90]
В другом распространенном типе аккумулятора — щелочном — используется окислительно-восстановительная реакция между железом (или кадмием) и окисью никеля [c.322]
Щелочные аккумуляторы. Щелочные аккумуляторы нечувствительны к сильным колебаниям тока и имеют ряд других преимуществ перед свинцовыми аккумуляторами. [c.444]
Аккумулятор щелочной КН-14 10 шт. на прибор Н-39 [c.221]
Число систем аккумуляторов еще меньще. Применяются свинцово-кислотные аккумуляторы, щелочные — железо-никелевые, кадмий-никелевые и серебряно-цинковые. Кроме требований, перечисленных выше для элементов, аккумуляторы должны еще принимать заряд без значительной потери энергии на побочные процессы и иметь длительный срок службы. [c.394]
Щелочные аккумуляторы. Щелочные аккумуляторы, часто встречающиеся в современных исследовательских лабораториях, имеют довольно много преимуществ перед свинцовыми кислотными. Пластины щелочных аккумуляторов сделаны из перфорированного железа, образующего ячейки, в которые запрессован гидрат окиси никеля (положительные пластины) и гидрат окиси [c.227]
В связи с широким применением механизмов (штабелеукладчиков, электрокар и т. п.) на современных холодильных предприятиях предусматриваются специальные помещения для их обслуживания. На рис. 11.11 показаны такие помещения, расположенные в пристройке к зданию холодильника генераторная 19, где находятся источники постоянного тока, помещение 20 для зарядки аккумуляторов, щелочное помещение 21 для приготов- [c.54]
Изделия электронной техники. Электролит для осаждения сплава олово-цинк. Методы химического анализа 16 0.686.545—77 ЕСТПП. Аккумуляторы щелочные ламельные. Анализ материалов и электролитов [c.392]
ОЕСТПП. Аккумуляторы щелочные и кислотные. Базовые показатели технологичности. — Взамен ОСТ 16 0.686.372—76 [c.150]
Е-3 — тазосепараторы Е-4 — аккумуляторы Т-1 — конденсаторы Е-1 — аккумулятор щелочной Е-2 — отстойник Р-1, Р-1а — реакторы полимеризации К-1а, К-1 — пентановые колонны К-2 — смолоотделитель К-3 — диизоамйле-новая колонна Р-2 —реакторы легкого крекинга К-4 — колонна разделения Сз, С4—Сб, Се К-5 — бутановая колонна К-6—изоамиленовая колонна Т-3 — кипятильники Т-2 — теплообмвниики П-1—нагревательная печь [c.45]
I — аккумулятор щелочной, напряжением в 2 — выключатель 3 — индукционная катушка 4 — прерыватель 5 — конденсатор 6 — реле 7 — -пружинный электрод 3 — детектор [c.467]
I — аккумулятор щелочной S — выключатель а — индукционная катушка 4 — прерыватель S — конденсатор в — реле 7 — пружинный искатель 8 — детектор 9 — заземление ю — провод л — кроиштейв с контактными роликами. [c.108]
chem21.info
Щелочной аккумулятор
Изобретение относится к электротехнике и касается производства химических источников тока. Цель изобретения - увеличение срока службы. Аккумулятор содержит корпус, отрицательный цинковый электрод и положительный электрод, разделенные сепаратором, помещенные в электролит, и дополнительный объем 1, отделенный от электродного отделения перегородкой с отверстием 4, диаметр которого выполнен из расчета 4 6 мм на 5 г веса цинкового электрода. Дополнительный объем снабжен вспомогательным никелевым электродом. Такая конструкция аккумулятора позволяет затормозить процесс старения цинкатного электролита и обеспечить стабильное циклирование. 1 ил.
Изобретение относится к химическим источникам тока и может найти применение в электромобилях, военной технике и т.д. Известные аккумуляторы с цинковым электродом имеют плотную сборку электродного блока, в результате которой электроды через сепаратор сильно прижаты друг к другу. Электролит находится в основном в порах электродов и в сепараторе, объем его около 1,5 мл/(А  ч). Используется пленочный сепаратор. Однако сроки службы этих аккумуляторов невелики и при средних режимах разряда составляют около 25 циклов. Аккумуляторы выходят из строя из-за пассивации, оползания активной массы цинкового электрода, дендритообразования, старения цинкатных электролитов. Аккумулятор требует сравнительно частых доливок электролита. Через каждые 4-5 циклов такие аккумуляторы требуют перезаряда из-за накопления заряженной фазы на цинковом электроде вследствие различия выхода по току на оксидно-никелевом и цинковом электродах. Наиболее близким по технической сущности является аккумулятор, содержащий дополнительную емкость с раствором для поглощения углекислого газа и кислорода атмосферы. Наличие дополнительного объема дает возможность предотвратить карбонизацию электролита электродного отделения и несколько уменьшить саморазряд аккумулятора за счет окисления цинка кислородной деполяризацией. В аккумуляторе появляется массоперенос электролита от дополнительного объема к электродному отделению. Здесь происходит обмен только газообразных продуктов. В аккумуляторе используется минимальное количество электролита. Однако указанный аккумулятор имеет малый срок службы, он требует сравнительно частых доливок электролита и периодических перезарядов аккумулятора. Целью изобретения является увеличение срока службы аккумулятора. Цель достигается тем, что отверстие выполнено диаметром 4-6 мм на 5 г веса цинкового электрода, а дополнительный объем снабжен вспомогательным никелевым электродом. На чертеже приведен предлагаемый аккумулятор. Дополнительная емкость 1 имеет такой объем, чтобы количество электролита, приходящееся на 1 А
ч). Используется пленочный сепаратор. Однако сроки службы этих аккумуляторов невелики и при средних режимах разряда составляют около 25 циклов. Аккумуляторы выходят из строя из-за пассивации, оползания активной массы цинкового электрода, дендритообразования, старения цинкатных электролитов. Аккумулятор требует сравнительно частых доливок электролита. Через каждые 4-5 циклов такие аккумуляторы требуют перезаряда из-за накопления заряженной фазы на цинковом электроде вследствие различия выхода по току на оксидно-никелевом и цинковом электродах. Наиболее близким по технической сущности является аккумулятор, содержащий дополнительную емкость с раствором для поглощения углекислого газа и кислорода атмосферы. Наличие дополнительного объема дает возможность предотвратить карбонизацию электролита электродного отделения и несколько уменьшить саморазряд аккумулятора за счет окисления цинка кислородной деполяризацией. В аккумуляторе появляется массоперенос электролита от дополнительного объема к электродному отделению. Здесь происходит обмен только газообразных продуктов. В аккумуляторе используется минимальное количество электролита. Однако указанный аккумулятор имеет малый срок службы, он требует сравнительно частых доливок электролита и периодических перезарядов аккумулятора. Целью изобретения является увеличение срока службы аккумулятора. Цель достигается тем, что отверстие выполнено диаметром 4-6 мм на 5 г веса цинкового электрода, а дополнительный объем снабжен вспомогательным никелевым электродом. На чертеже приведен предлагаемый аккумулятор. Дополнительная емкость 1 имеет такой объем, чтобы количество электролита, приходящееся на 1 А  ч емкости аккумулятора, примерно составляло 5-7 мл, то есть дополнительная емкость составляет примерно 1/10 часть общего объема аккумулятора. Дополнительный объем сообщается с электродным отделением 2 снизу аккумулятора, где в разделяющей стенке 3 имеется либо щель, либо отверстие 4, а в верхней части имеется окно 5 для выхода газов. Отверстие 4 выполняется с таким расчетом, чтобы его диаметр на каждые 5 г активной массы цинкового электрода составлял 4-6 мм. Толщина разделяющей стенки 3 должна быть минимальной и не должна превышать 1 мм. Наличие окна 5 обязательно по причине обеспечения свободного перехода жидкофазных продуктов через отверстие 4. При заряде аккумулятора вывод вспомогательного никелевого электрода 6 соединяется через резистор (на чертеже не показано) с отрицательным полюсом аккумулятора. Путем соответствующего подбора сопротивления резистора или поверхности вспомогательного электрода часть катодного тока расходуется на выделение водорода на вспомогательном электроде с таким расчетом, чтобы отрицательные и положительные электроды заряжались эквивалентно. При таком исполнении аккумулятора непроливаемая пробка 7 размещается поверх дополнительной емкости, тем самым значительно уменьшая количество электролита, уносимое газами. Кроме того, уменьшить высоту аккумулятора за счет уменьшения объема, находящегося между электродным блоком и крышкой аккумулятора. Дополнительный объем дает возможность в два-три раза сократить количество доливок электролита в аккумулятор. Такая конструкция аккумулятора обеспечивает стабильное циклирование цинкового раствора. Испытания, показали, что такая конструкция аккумулятора обеспечивает лучшие эксплуатационные характеристики по отношению к аккумуляторам промышленного изготовления. Не наблюдается явлений пассивации при средних режимах разряда до 350-40 циклов. Уменьшение концентрации электролита до 100 г/л КОН не отражается на характеристиках аккумулятора, что указывает на хорошую обратимость цинкового электрода в условиях аккумулятора с дополнительной емкостью. Не требуется периодических переразрядов аккумулятора. Применением микропористого сепаратора толщиной 0,5-1,0 мм удалось значительно снизить явление перераспределения активной массы цинкового электрода. Стабильность работы такого аккумулятора обусловлена торможением процесса старения цинкатного электролита. Система работает таким образом. При разряде аккумулятора пересыщенный цинкатный раствор, не успевая разложиться в электродном отделении, диффундирует в дополнительный объем, где его концентрация понижается ниже предельной, когда возможно разложение, т. е. старение электролита. При разряде происходит обратный переход цинкат-ионов через отверстие 4 из дополнительного объема к электродному и цикл повторяется. Уменьшение диаметра отверстия 4 ниже оптимального затрудняет диффузию цинкат-ионов, тем самым наблюдается некоторое увеличение старения электролита, а чрезмерное увеличение диаметра отверстия приводит к перерастворению цинка на электроде в электролит. Испытания показали, что наличие дополнительного объема не сказывается на процессе дендритообразования и саморазряда. Такая конструкция дает возможность также автоматически доливать аккумулятор электролитом введением в дополнительный объем поплавка, который при полной доливке закрывает окно, соединенное с основным резервуаром электролита.
ч емкости аккумулятора, примерно составляло 5-7 мл, то есть дополнительная емкость составляет примерно 1/10 часть общего объема аккумулятора. Дополнительный объем сообщается с электродным отделением 2 снизу аккумулятора, где в разделяющей стенке 3 имеется либо щель, либо отверстие 4, а в верхней части имеется окно 5 для выхода газов. Отверстие 4 выполняется с таким расчетом, чтобы его диаметр на каждые 5 г активной массы цинкового электрода составлял 4-6 мм. Толщина разделяющей стенки 3 должна быть минимальной и не должна превышать 1 мм. Наличие окна 5 обязательно по причине обеспечения свободного перехода жидкофазных продуктов через отверстие 4. При заряде аккумулятора вывод вспомогательного никелевого электрода 6 соединяется через резистор (на чертеже не показано) с отрицательным полюсом аккумулятора. Путем соответствующего подбора сопротивления резистора или поверхности вспомогательного электрода часть катодного тока расходуется на выделение водорода на вспомогательном электроде с таким расчетом, чтобы отрицательные и положительные электроды заряжались эквивалентно. При таком исполнении аккумулятора непроливаемая пробка 7 размещается поверх дополнительной емкости, тем самым значительно уменьшая количество электролита, уносимое газами. Кроме того, уменьшить высоту аккумулятора за счет уменьшения объема, находящегося между электродным блоком и крышкой аккумулятора. Дополнительный объем дает возможность в два-три раза сократить количество доливок электролита в аккумулятор. Такая конструкция аккумулятора обеспечивает стабильное циклирование цинкового раствора. Испытания, показали, что такая конструкция аккумулятора обеспечивает лучшие эксплуатационные характеристики по отношению к аккумуляторам промышленного изготовления. Не наблюдается явлений пассивации при средних режимах разряда до 350-40 циклов. Уменьшение концентрации электролита до 100 г/л КОН не отражается на характеристиках аккумулятора, что указывает на хорошую обратимость цинкового электрода в условиях аккумулятора с дополнительной емкостью. Не требуется периодических переразрядов аккумулятора. Применением микропористого сепаратора толщиной 0,5-1,0 мм удалось значительно снизить явление перераспределения активной массы цинкового электрода. Стабильность работы такого аккумулятора обусловлена торможением процесса старения цинкатного электролита. Система работает таким образом. При разряде аккумулятора пересыщенный цинкатный раствор, не успевая разложиться в электродном отделении, диффундирует в дополнительный объем, где его концентрация понижается ниже предельной, когда возможно разложение, т. е. старение электролита. При разряде происходит обратный переход цинкат-ионов через отверстие 4 из дополнительного объема к электродному и цикл повторяется. Уменьшение диаметра отверстия 4 ниже оптимального затрудняет диффузию цинкат-ионов, тем самым наблюдается некоторое увеличение старения электролита, а чрезмерное увеличение диаметра отверстия приводит к перерастворению цинка на электроде в электролит. Испытания показали, что наличие дополнительного объема не сказывается на процессе дендритообразования и саморазряда. Такая конструкция дает возможность также автоматически доливать аккумулятор электролитом введением в дополнительный объем поплавка, который при полной доливке закрывает окно, соединенное с основным резервуаром электролита.
Формула изобретения
ЩЕЛОЧНОЙ АККУМУЛЯТОР, содержащий корпус, отрицательный цинковый электрод и положительный оксидно-никелевый или серебряный электрод, разделенные сепаратором, помещенные в электролит, и дополнительный объем, отделенный от электродного отделения перегородкой с отверстием в нижней части, отличающийся тем, что, с целью увеличения срока службы, отверстие выполнено диаметром 4 6 мм на 5 г веса цинкового электрода, а дополнительный объем снабжен вспомогательным никелевым электродом.РИСУНКИ
Рисунок 1Похожие патенты:

Изобретение относится к электротехнике и касается производства кадмиевых электродов щелочных аккумуляторов

Изобретение относится к формированию герметичных щелочных аккумуляторов

Изобретение относится к электротехнической промышленности и может быть использовано в щелочных аккумуляторах с отрицательным цинковым электродом


Изобретение относится к электротехнической промышленности и может быть использовано при производстве кадмиевых электродов щелочных аккумуляторов





Изобретение относится к электротехнике и касается производства щелочных аккумуляторов
Изобретение относится к электротехнике и может быть использовано в производстве и эксплуатации аккумуляторов

Изобретение относится к электротехнике и может быть использовано в производстве и эксплуатации аккумуляторов
Изобретение относится к химическим источникам тока и может быть использовано в электротехнике при изготовлении никель-железных аккумуляторов

Изобретение относится к аккумуляторной батарее и оборудованию или устройству, содержащему аккумуляторную батарею
Изобретение относится к электротехнической промышленности и может быть использовано в производстве щелочных аккумуляторов с безламельными электродами
Изобретение относится к области получения композиционных материалов, в частности к получению пористых гибких диэлектрических материалов для сепараторов химических источников тока
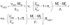
Изобретение относится к электротехнической промышленности и может быть использовано в производстве никель-кадмиевых герметичных аккумуляторов с безламельными электродами
Изобретение относится к электротехнической промышленности и может быть использовано в производстве щелочных аккумуляторов с безламельными электродами

Изобретение относится к электротехнике и может быть использовано в авиационных стартерных аккумуляторных батареях с щелочным электролитом, применяемых в качестве бортового резервного источника тока летательных аппаратов
Изобретение относится к электротехнике и касается производства химических источников тока
www.findpatent.ru
Щелочные аккумуляторы - Ремонт аккумуляторов
Щелочной аккумулятор состоит из бака 1, изготовленного из листовой стали толщиной 0,8 — 1 мм, и пластин 2, набранных в виде пакетов из тонких стальных лент, в которые запрессовано активное вещество.
В положительных пластинах активным веществом служит гидрат окиси никеля, в который для снижения внутреннего сопротивления аккумулятора добавлено 18 — 20% графита.
В отрицательных пластинах активной массой является кадмий с примесью железа (в кадмиево-никелевых аккумуляторах) или только железо (в железо-никелевых аккумуляторах).
Щелочной аккумулятор

Щелочной аккумулятор:
1 — бак, 2 — пластина, 3 — полюсные выводы, 4 — крышка, 5 — вентиляционная пробка, 6изоляционная пластина, 7 — обжимка, 8 — дистанционные палочки.
Пластины собраны в полублоки, каждый из которых состоит из пластин одной полярности, положительных или отрицательных. Бак заполнен составным электролитом из водного раствора едкого калия плотностью 1,19 — 1,21, в который добавлено на каждый литр раствора 10 г едкого лития, увеличивающего срок службы аккумулятора.
Для доступа электролита к активной массе в стальных лентах пакетов пластин имеются отверстия, которые служат также для выхода газов, образующихся при заряде и разряде аккумулятора.
Пакеты в торцахохвачены обжимками 7, которые на одной из сторон пакета несколько удлинены для присоединения к ним баретки. К баретке приварен стальной штырь с резьбой, который служит для крепления полублока пластин и подключения проводов к аккумулятору.
Пластины разной полярности изолированы друг от друга дистанционными эбонитовыми палочками 8. Блок пластин установлен в баке так, что исключается возможность их перемещения внутри бака при транспортировании и работе аккумулятора.
Пластины в баке установлены в строго определенном порядке. У кадмиево-никелевых аккумуляторов крайние пластины всегда положительные, они примыкают к широкой стенке бака и электрически соединены с ним; у железо-никелевых аккумуляторов крайние пластины всегда отрицательные, они соединены с баком.
Торцы пластин изолированы от узких стенок бака тонкой изоляционной эбонитовой пластиной 6 или воздушным промежутком. Бак закрыт крышкой 4 с отверстием для вентиляционной пробки 5, ввертываемой в крышку. Обеспечивая выход газов из бака, пробка в то же время препятствует выливанию электролита и проникновению в бак воздуха, вызывающего в электролите вредные химические реакции.
«Ремонт электрооборудования промышленных предприятий»,В.Б.Атабеков

Кислотные аккумуляторы могут быть стационарными или переносными. Стационарный кислотный аккумулятор состоит из бака 1 и свинцовых пластин 2 и 5. Бак изготовлен из дерева и покрыт внутри листовым свинцом. Большинство баков аккумуляторов, выпускаемых в настоящее время, изготовлены из стекла или пластмассы. Пластина представляет собой литую решетку из сплава свинца с сурьмой, заполненную активной массой, состоящей…

Неисправности возникают в аккумуляторах вследствие нарушения режимов работы и зарядки, при несоблюдении правил ухода за ними, а также в результате нарушения сроков ремонта. Неисправности в аккумуляторах приводят чаще всего к падению разрядного напряжения и снижению емкости. Падение напряжения объясняется изменением внутреннего сопротивления аккумулятора. Емкостью аккумулятора называют количество электричества, которое он может отдавать при разряде до…

В кислотных аккумуляторах неисправности проявляются в виде короткого замыкания между пластинами, разрушения сепараторов, сульфатации и разрушения пластин, образования шлама и коррозии решеток. Короткие замыкания между пластинами аккумулятора возникают в результате их коробления и разрушения сепараторов, а также из-за попадания в аккумулятор посторонних токопроводящих предметов и скопления на дне большого количества шлама. Характерными признаками короткого замыкания…

Разрушение пластин происходит при больших зарядных и разрядных токах и выражается в выпадении из них активной массы, которая оседает на дно бака в виде шлама. Электролит делается мутным и приобретаеткоричневую окраску. Признаками разрушения пластин являются низкая емкость и слишком быстрый разряд аккумулятора. Образование шлама происходит из-за содержания хлора в добавочной воде и сульфатации пластин. Неисправности…

Щелочные аккумуляторы повреждаются реже, чем кислотные. Возникшие в них неисправности зачастую устраняются после их промывки и смены электролита. Наиболее часто встречаются такие неисправности, как потеря емкости, вспучивание бака и чрезмерный нагрев электролита и зажимов, течь электролита. Потеря емкости в аккумуляторе может быть следствием длительной работы на старом электролите или попадания в него вредных примесей. Чтобы…
www.ktovdome.ru
Щелочные аккумуляторы электролит - Справочник химика 21
Щелочные аккумуляторы значительно легче свинцовых, но дают более низкие напряжения. Рабочее напряжение железо-никелевого аккумулятора составляет приблизительно 1,3—1,2 В для кадмиевого аккумулятора оно несколько меньше. Для щелочного аккумулятора выходы по току меньше, чем для свинцового, а вследствие значительно большей разности между зарядным и разрядным напряжениями выход по энергии составляет только 55—66%. Но зато щелочные аккумуляторы меньше боятся механической тряски, имеют большой срок службы, могут систематически работать с перегрузкой и не выходят из строя при хранении в разряженном состоянии. Электролит щелочного аккумулятора поглощает СО 2 из атмосферы, в результате чего уменьшается его проводимость, поэтому электролит приходится время от времени обновлять. [c.18] При приготовлении и хранении электролита его предохраняют от доступа воздуха, чтобы предотвратить поглощение углекислоты, так как она увеличивает саморазряд аккумуляторов и снижает емкость. При содержании в электролите до 50 г/л соды или поташа электролит заливать не рекомендуется. Все остальные неисправности, возникшие при эксплуатации (утечка тока, короткое замыкание, механические повреждения и т. п.), устраняют обычным способом. Для стабилизации емкости щелочные аккумуляторы подвергают двум-трем тренировочным циклам нормальных режимов. В отдельных случаях, когда батарея на третьем разряде отдает менее 80% номинальной емкости, следует провести дополнительно 1—2 цикла. В первые два цикла батарею заряжают током 150 А в течение [c.264]Процессы, протекающие в электролите. Процессы разряда и заряда щелочных аккумуляторов в суммарном виде можно представить реакциями [c.88]
Электролит за счет углекислоты воздуха постепенно обогащается углекислым калием, который снижает напряжение, увеличивает внутреннее сопротивление и уменьшает емкость аккумулятора. Для устранения действия углекислоты щелочные аккумуляторы при бездействии и разряде должны быть всегда закрыты. Электролит сменяется примерно один раз в год. [c.160]
Формирование щелочных аккумуляторов заключается в проведении одного или нескольких циклов заряд — разряд. При этом обычно применяют электролит (плотность 1,18—1,20 г/см )—раствор едкого кали и 4—15% гидроокиси лития. Иногда в электролит добавляют АзгОз или 5ЬгОз. Заряд ведут в течение 7—12 ч, а разряд— от 2 до 8 ч до напряжения 1,1 В. [c.98]
Электролит калиево-литиевый—раствор едкого кали и едкого лития. Применяют для щелочных аккумуляторов. [c.119]
Щелочные никель-кадмиевые (НК) аккумуляторы по сравнению с НЖ-аккумуляторами обладают лучшей работоспособностью при пониженной температуре и повышенной токовой нагрузке. Саморазряд НК-аккумуляторов значительно меньше. Все эти преимущества связаны прежде всего со своеобразием электрохимических свойств кадмиевого электрода. Так, различие в сохранности заряда щелочных аккумуляторов объясняется тем, что железо в щелочном электролите термодинамически неустойчиво, тогда как потенциал кадмия в тех же условиях положительнее равновесного потенциала водородного электрода, и самопроизвольное окисление чистого кадмия в обескисло- [c.226]
Пластины и электролит щелочных аккумуляторов помещ т в закрытый сосуд из стали. Преимущество этих аккумуляторов перед кислотными в простоте обслуживания и высокой механической прочности. Кроме того, они не требуют постоянного контроля за концентрацией электролита. Рабочее напряжение заряженных аккумуляторов 1,30 - 1,34 В (для никель-кадмиевых) и 1,37 - 1,41 В (для железо-никелевых). [c.58]
В некоторых случаях электроды получают два и более циклов формирования. Пластины считаются качественными, если в конце разряда потенциал по отношению к стандартному водородному электроду у положительных пластин будет не менее +0,28 в. а у отрицательных не менее —0,52 в. Потенциалы пластин в щелочных аккумуляторах обычно измеряют при помощи вспомогательного цинкового электрода, погруженного в электролит над пластинами. В этом случае потенциал положительных пластин в конце формировочного разряда должен быть не менее 1,5 б и отрицательных не более 0,7 в. Формированные пластины тщательно промывают и сушат. Отрицательные пластины для стабилизации кадмиевой активной массы пропитывают соляровым маслом. Для. этого их на сутки погружают в 10% раствор солярового масла в бензине (или бензоле), а затем 2 ч обдувают воздухом для удаления паров [c.535]
Электролит в этих аккумуляторах, в отличие от свинцовых и щелочных аккумуляторов, в реакциях заряда и разряда не участвует, поэтому его можно брать очень мало. Это обстоятельство позволило создать аккумуляторы, имеющие очень эффективную конструкцию электроды помещены вплотную друг к другу и разделены только тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно-цинковые аккумуляторы имеют больщую емкость, высокую энергию и высокую мощность на единицу массы и объема, поэтому они широко применяются там, где необходимы аккумуляторы небольшого размера. [c.602]
В качестве анода используют фольговые оксидно-никелевые электроды щелочных аккумуляторов либо аноды из устойчивых в щелочной среде материалов, например графита. Нели при электрохимическом синтезе карбоновых кислот в щелочной электролит ввести сульфат никеля, то в процессе электролиза на поверхности таких анодов осаждается слой гидроксидов никеля, которые окисляют спирт наряду с гидроксидами, находящимися в объеме раствора. [c.208]
Введение гидроокиси лития в электролит щелочного аккумулятора увеличивает емкость и срок службы аккумулятора при обычных температурах и удлиняет рабочий интервал в сторону высоких температур. Это полезное действие, однако, наблюдается лишь при умеренных концентрациях едкого лития в электролите, превышение которых, наоборот, приводит к ухудшению свойств аккумулятора. Установлено, что при большой концентрации едкого лития в электролите он может образовать с. массой положительного электрода электрохимически инертное соединение Ь ЫЮ2, от чего емкость электрода падает. [c.138]
Кадмиево-никелевые (КНА) и железо-никелевые (ЖНА) щелочные аккумуляторы имеют между собой много общего. В этих аккумуляторах положительным электродом служит Ы10(0Н), а отрицательным в ЖНА — железо, в КНА — кадмий электролит—раствор щелочи КОН. При разомкнутой цепи на электродах устанавливается электрохимическое равновесие [c.158]
Электролит, как кислотный, так и щелочной, при изготовлении сильно нагревается горячий раствор наливать в аккумуляторы нельзя, надо дать ему остыть до комнатной температуры. В аккумулятор наливается (через стеклянную воронку) такое количество раствора, чтобы уровень последнего был не менее как на 10— 12 мм выше пластин о высоте этого уровня можно судить, опуская в отверстие для пробки стеклянную палочку. После заполнения раствором отверстия в крышке плотно прикрываются ( ) металлическими пробками у щелочных аккумуляторов и резиновыми (но не корковыми) пробками у свинцовых. Так как раствор частично впитывается в пластины, через некоторое время нужно его долить и затем, не откладывая, поставить аккумулятор на первую зарядку. [c.405]
Гидроксид калия КОН (едкое кали) служит исходным веществом для получения солей калия и, кроме того, применяется в производстве жидких мыл, некоторых красителей и как электролит в щелочных аккумуляторах. [c.404]
Заслуживает упоминания применение ЬЮН в качестве добавки к щелочным аккумуляторам. Добавка ЫОН к КОН-Ь + МаОН повышает емкость аккумулятора на 12%, удельное сопротивление на 21%, срок службы железо-никелевого аккумулятора удлиняется в 2—3 раза (приведенные данные относятся к случаю добавки 21 г/л ЬЮН-НгО в электролит КОН с Р= 1,19—1,21 г см ). [c.13]
Электролит для щелочных аккумуляторов [c.133]
Электролиты для щелочных аккумуляторов в процессе работы поглощают углекислый газ из воздуха и переходят в карбонаты. Наличие в электролите карбонатов в больших количествах вызывает возрастание удельного сопротивления электролита и умень- [c.133]
Электролит калиево-литиевый — раствор едкого кали и едкого лития. Применяется для заполнения щелочных аккумуляторов. [c.92]
При длительном перерыве в эксплуатации аккумуляторов необходимо щелочные аккумуляторы зарядить и хранить заполненными (2—2,5 месяцев), а кислотные, после полного разряда, слив электролит, промыть дистиллированной водой и хранить с закрытыми пробками в сухом виде. [c.406]
Рассчитать падение напряжения в электролите межэлектродного пространства щелочного аккумулятора типа НЖ-22, имеющего две положительные пластины габаритами 140 Х 95 мм и три отрицательные пластины габаритами 145 X 99,5 мм при разрядном токе 22 А. Межэлектродное расстояние 1,2 мм. Электролит —раствор КОН плотностью 1,20 (21,15%-ный раствор КОН) с удельной электропроводностью =0,520 Ом- -см . [c.68]
При нормальных условиях работы щелочных аккумуляторов полезно производить смену электролита в сроки, установленные заводскими инструкциями. Смена электролита необходима главным образом для удаления карбонатов, которые постепенно накапливаются за счет углекислоты, поглощаемой из воздуха. Присутствие карбонатов вредно отражается на рабочих характеристиках аккумуляторов, вызывая повышение их внутреннего сопротивления. В литературных источниках нет единых норм максимально допустимого содержания углекислых солей в электролите. Указывают верхний предел от 30 до 90 г л. Известно, что при содержании карбонатов 100 г1л электрическая емкость уменьшается примерно на 25% [18]. [c.96]
Как приготовляют электролит для свинцового и щелочного аккумуляторов [c.139]
В СССР для кадмиево-никелевых щелочных аккумуляторов, работающих при температуре окружающей среды не ниже — 15°, в качестве электролита применяется водный раствор едкого кали с удельным весом 1,19 — 1,21 с добавкой 21 1 г л моногидрата лития. В железо-никелевых аккумуляторных батареях электролит для работы при температуре от + 20° до + 35° состоит из водного раствора едкого кали с удельным весом 1,19—1,21, добавляется 20 1 г/л моногидрата лития. Кондиции на литий едкий аккумуляторный установлены ГОСТом 8595-57 [c.44]
Цель работы. Ознакомление с установкой и методом определения электрохимического эквивалента. Принадлежности для работы. Свинцовый или щелочной аккумулятор амперметр реостат ключ медный кулонометр (ванна с электролитом и двумя медными электродами) секундомер, миллиметровая линейка аналитические весы 5-процентный раствор USO4 провода для монтажа прибора. Описание работы. При прохождении через электролит определенного количества электричества количество вещества т, выделяющегося на электроде, равно [c.74]
Многочисленными исследованиями установлено,, что реакции, происходящие в щелочном аккумуляторе, заключаются в переносе кислорода с одной пластины на другую. В течение разряда аккумулятора кислород отнимается у положительной пластины и присоединяется к отрицательной. При заряде происходит обратное. Электролит в целом не испытывает изменений ни в своем составе, ни в плотности. Но в электролите, находящемся в порах пластин, происхо-дят существенные изменения. [c.205]
Из гидроксидов щелочных металлов наиболее важное значение имеют NaOH и КОН. Гидроксид натрия — один из основных продуктов химической промышленности он совместно с КОН широко применяется как в самой химической промышленности, так и в других производствах. Наиболее крупный потребитель NaOH — быстро развивающееся производство искусственного волокна. Гидроксиды натрия и калия используются в Мыловарении, текстильной промышленности, при очистке нефтепродуктов, в щелочных аккумуляторах (электролит), как осушающее вещество и т. п. [c.219]
При разряде серебряно-цинковый аккумулятор можно представить как2п-12пО, 2п(ОН)г + КОН (40%)l+Ag. Электролит здесь в отличие от кислотных и других щелочных аккумуляторов в реакциях разряда и заряда не участвует. Поэтому электроды помещают вплотную один к другому (они разделены тонким слоем целлофана), электролит же находится в порах электродов. [c.488]
Напряжение щелочных аккумуляторов ниже, чем свинцовых. Во время разряда оно изменяется с 1,35 до 1,1 в, оставаясь в среднем равным 1,2 е, затем быстро падает до 1 е и ниже. Внутреннее сопротивление сильно возрастает по мере разряда у аккумуляторов ШН оно выше, чем у КН (той же емкости). Железный электрод растворяется в электролите, даже когда аккумулятор не замкнут,— выделяется водород. Кадмий устойчив в щелочных растворах, однако он значительно дороже железа, из-за чего кадмиевый электрод содержит иногда до 5% железа. Кроме того, присутствие железа в электроде благоприятно влияет на свойства его активной массы, повышая ее пористость. Свежезаряженный ЖН-аккумулятор имеет э.д.с. 1,48 е, КН—1,44. Однако через короткое время э.д.с. снижается у обоих аккумуляторов до 1,35 в. [c.403]
В 1883 г. был построен гальванический элемент, содержащий щелочной электролит (см, гл. I). Этот элемент можно рассматривать как прототип современного щелочного аккумулятора. В 1900 г. был построен первый щелочной аккумулятор, который нашел большое практическое применение. Аккумулятор со стоял из сосуда с раствором едкого кали и погруженных в него электродов. Положительным электродом заряженного аккумулятора служил гидрат окиси никеля с добавкой графита для придания электропроводности отрицательный электрод состоял из губчатого кадмия с добавкой губчатого железа. Годом позисе был разработан щелочной аккумулятор, отличающийся от описанного выше конструктивным, оформлением и применением для отрицательного электрода мелкораздробленного железа с добавкой небольшого количества окиси ртути. Положительный электрод был изготовлен из смеси гидрата окиси никеля и металлического (лепесткового) никеля. [c.140]
Гидроокись калия КОН (едкое кали), как и едкий натр,— очень сильное основание, еще больше растворимое в воде, чем NaOH. Применяется для получения жидких калийных мыл. Кроме того, раствор КОН используется как электролит в щелочных аккумуляторах (стр. 176), особенно в условиях низких температур. [c.217]
У кадмий-пикелевых аккумуляторов коэффициент использование активной массы пололнормальной эксплуатации щелочные аккумуляторы служат б—10 и более лет. Согласно ГОСТ 3895—47 срок службы щелочных аккумуляторов на составном (т. е. с добавкой гидрата окиси лития) электролите должен быть не менее 750 циклов. [c.520]
Щелочные аккумуляторы значительно отличаются от свинцовых. Применяемые в щелочных аккумуляторах активные массы для положительного и отрицательного электродов не обладают достаточной пластичностью и прочностью, поэтому они не могут, подобно массам свинцовых аккумуляторов, оставаться в пластинах в открытом виде. Для удержания активной массы при изготовлении Щелочных аккумуляторов применяют специальные коробочки, называемые ламелями они изготовлены из тонкоперфо-рированной жести. Электроды составляют из отдельных ламелей, соединенных специальной рамкой. К активной массе, находящейся внутри ламели, электролит проникает через отверстия на поверхности коробочки. Эти отверстия делают настолько мелкими, что частицы активной массы не могут выпасть из ламели. Электроды собирают в блоки и монтируют далее в металличе-СК1-Х, очень прочных сосудах. [c.151]
Электролит. В щелочных аккумуляторах в Качестве эле1раствор едкого кали. Раствор, содержащий 28% КОН, обладает максимальной электропроводностью, и с целях уменьшения внутреннего сопротивления его употребле-йие было бы желательно. Практически пользуются более слабыми растворами — содержащими от 20 до 22% КОН (уд. вес Ют 1,18 до 1,20), так как при применении концентрированных [c.160]
chem21.info
Щелочной аккумулятор - Большая Энциклопедия Нефти и Газа, статья, страница 2
Щелочной аккумулятор
Cтраница 2
Щелочные аккумуляторы применяются двух типов: железони-келевые и кадмиевоникелевые. [16]
Щелочные аккумуляторы не должны находиться в непосредственной близости от кислотных аккумуляторов. Помещение для зарядки щелочных и кислотных аккумуляторов должно быть изолированным. В каждом помещении следует иметь отдельную вытяжную систему вентиляции. Приточная система вентиляции может быть общей для помещений зарядки щелочных и кислотных аккумуляторов. [17]
Щелочные аккумуляторы в основном выпускаются с ламельными электродами. В них активные массы заключены в ламели - плоские коробочки с отверстиями. Кроме того, в ней содержится графит, добавляемый для увеличения электрической проводимости. Активная масса отрицательных пластин аккумуляторов КН состоит из смеси губчатого кадмия с порошком железа, а аккумуляторов ЖН - из порошка восстановленного железа. [18]
Щелочные аккумуляторы при сборке в батарею должны быть соединены в последовательную цепь посредством стальных никелированных межэлементных перемычек. [19]
Щелочные аккумуляторы в настоящее время выпускаются двух типов: железо-никелевые и кадмиево-никелевые. [20]
Щелочные аккумуляторы рекомендуется разрядить, электролит слить, банки промыть дистиллированной водой, залить свежим электролитом ( раствор едкого кали плотностью 1 25 - 1 27 г / см3) и снова зарядить батарею. Применение раствора натра в зимнее время не допускается. Повышение плотности электролита предотвращает возможность его замерзания, что могло бы привести к отказу батареи в работе, разрыву или выпучиванию стенок элементов, и препятствует резкому снижению ее емкости, наблюдаемому при низких температурах. [21]
Щелочные аккумуляторы делятся на железо-никелевые и кадмиево-нике-левые. Аккумуляторы этих типов различаются по конструкции положительных пластин, а именно: трубчатые пластины и пластины пакетного, или ламельного, типа. Отрицательные пластины всегда изготовляются пакетного типа. [22]
Щелочные аккумуляторы с трубчатыми положительными пластинами занимают меньший объем и имеют меньший вес, чем аккумуляторы такой же емкости с пластинами пакетного типа. Но, с другой стороны, аккумуляторы с трубчатыми пластинами имеют большее внутреннее сопротивление, чем аккумуляторы с пластинами пакетного типа, и, как следствие этого, большее падение напряжения на: жимах при большом разрядном токе. Аккумуляторы трубчатого типа целесообразно применять в тех случаях, когда в эксплуатации разрядный ток значительно не превышает номинального разрядного тока, а также когда при заданном ограниченном объеме требуется иметь наибольшую возможную емкость, например, для электромобилей, которые должны иметь максимальный пробег. [23]
Щелочные аккумуляторы обладают большой выносливостью и механической прочностью. Срок службы их при правильном уходе превышает 5 - 6 лет. Недостатки щелочных аккумуляторных батарей в том, что они дороже кислотных, вследствие увеличенного числа элементов на то же напряжение имеют больший габарит и более трудоемки, нуждаются в обязательной замене электролита через 1 - 2 года. [24]
Щелочные аккумуляторы имеют ряд преимуществ по сравнению с кислотными: обладают высокой механической прочностью и не боятся тряски и толчков; не выделяют вредных газов в процессе зарядки и работы; срок службы их больше, чем кислотных; отличаются от кислотных меньшим объемом и весом на единицу емкости, малой чувствительностью к колебаниям тока заряда и разряда и к перегрузке. Благодаря большему внутреннему сопротивлению они не боятся, как кислотные, кратковременных токов короткого замыкания. Наконец, наиболее важным преимуществом щелочного аккумулятора является химическая нейтральность его щелочи по отношению к активным массам пластин. Поэтому саморазряд их мал, и они длительное время могут находиться в разряженном состоянии без ухудшения своих свойств. Щелочные аккумуляторы отличаются от кислотных также простотой ухода за ними. [25]
Щелочные аккумуляторы широко применяются также в качестве источников питания в лабораторной практике. [26]
Щелочные аккумуляторы состоят из железо-никелевых решеток, заполненных для положительных пластин окисью никеля с графитом и для отрицательных - железным порошком с примесью кадмия. Электролит - 20 % - ный раствор КОН ( плотн. Каждый аккумулятор дает 1 25 в. Эти аккумуляторы имеют то преимущество перед свинцовыми, что не боятся сотрясений и могут разряжаться до конца. [27]
Щелочные аккумуляторы можно заряжать током одинаковой или убывающей силы, в то время как кислотные батареи требуют обязательного уменьшения силы тока на второй ступени зарядки. [29]
Щелочные аккумуляторы широко применяются в сейсмических и алектроразведочных станциях, смонтированных на автомобилях, а также в некоторых гравиметрических и магнитных установках. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Щелочной аккумулятор
298l47
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Союз Советских
Социалистических
Республик
Зависимый от патента №
МПК Н 01m 43/00
Заявлено 03.1Х.1966 (№ 1100332/24-7) Приоритет
Комитет по делам изобретений и открытий при Совете Министров
СССР
УДК 621.355.8.035.444 (088.8) Опубликовано 11 1!11971. Бюллетень № 10
Дата опубликования описания 21 V.1971
Автор изобретения
Иностранец
Карл Шельцер (Федеративная Республика Германии) Иностранец
Вернер Гройтерт (Швейцария) Заявитель
ЩЕЛОЧНОЙ АККУМУЛЯТОР
Известны щелочные аккумуляторы с отрицательным амальгамным электродом и положительным окисно-ртутным электродом.
При зарядке аккумулятора в результате растворения металлической фазы положительного электрода образуются частицы окиси ртути, плохо проводящие электрический ток.
Эти частицы должны быть механически впрессованы в остаточную фазу ртути, например, при помощи пористой упругой мембраны, с тем чтобы возможно большая часть окиси соприкасалась с металлической поверхностью электрода и могла превращаться в условиях разряда в ртуть. Это влияет на характеристики аккумулятора.
В предложенном аккумуляторе с целью улучшения электрических характеристик в электролит введен ион-комплексообразователь, дающий растворимые соединения с продуктами заряда положительного электрода, например цианид.
В качестве материала для отрицательного электрода можно употреблять, кроме ртути, и другие жидкие металлы, например галлий, или жидкости, обладающие такой же проводимостью, как металлы, например расплавы сплавов Вуда или Розе, в которых растворяются выделяющиеся при зарядке атомы щелочных или щелочноземельных металлов.
В качестве материала для положительного электрода могут быть использованы все металлы, которые образуют растворимые отрицательно заряженные комплексные ионы.
На фиг. 1 — 8 показан предложенный аккумулятор (варианты выполнения).
Аккумулятор (см. фиг. 1 — 4) содержит корпус 1, разделенный перегородкой 2 на емкости, в одну из которых помещен отрицатель10 ный электрод 8, а в другую — положительный электрод 4.
Обе электродные емкости заполнены одним и тем же раствором электролита, покрывающим перегородку 2. Выводные полюсные сое15 динения 5 и б состоят из нерастворимого в электролите и в электродном материале вещества, обладающего хорошей электропроводностью. Во время заряда или после окончания заряда жидкий материал отрицательного
20 электрода 8 превращается вследствие выделения из электролита щелочного или щелочноземельного металла в твердую амальгаму или сплав и застывает. Материал положительного электрода 4 частично или полностью рас25 ходуется при заряде и растворяется в электролите. При разряде аккумулятора материал положительного электрода выделяется из фазы электролита на положительном полюсном соединении 5 нли на оставшейся части поло298147 жительного электрода 4, в то время как из материала отрицательного электрода 3 в фазу электролита переходят в форме ионов атомы щелочного и/или щелочноземельного металла.
При приложении постоянного напряжения, превышающего напряжение на зажимах аккумулятора и равного приблизительно 2 а, ионы калия из электролита перемещаются к отрицательному электроду, разряжаются и образуют калиевую амальгаму.
Ионы гидроксила и цианида, перемещающиеся к положительному электроду, образуют при разряде окись и цианид ртути. Оба эти соединения образуют с избыточным цианистым калием электролита растворимые комплексные соли по схеме:
HgO+3KCN+Hg k(Hg (CN) з)+КОН
Hg(CN) q+KCNK(Hg(CNa) ).
Соединение К(Hg(CN) з) диссоциирует в водном растворе на положительно заряженные ионы калия и„отрицательно заряженные комплексные ионы (Hg (CN) з) —.
При разряде аккумулятора калий, имеющийся в амальгаме отрицательного электрода, растворяется с образованием ионов «алия в электролите, в то время как отрицательно заряженные ионы (Hg (CN)>) — отдают свой заряд на положительном электроде и распадаются при этом на металлическую ртуть и три иона цианида. Благодаря этому восстанавливается первоначальное незаряженное состояние. Вновь образовавшаяся ртуть объединяется с оставшимся в положительном электроде остатком ртути, в то время как свободные ионы цианида остаются растворенными в электролите.
Поскольку описанный процесс обратим, циклы зарядки и разряда могут повторяться столь часто, сколько это нужно.
Аккумулятор может быть выполнен в виде отдельной конструктивной единицы. Для этого положительный электрод из ртути и отрицательный электрод из амальгамы калия погружают в электролит, состоящий из щелочного раствора комплексного цианида калия — ртути.
Так как отрицательный электрод амальгамирует атомы калия, а в электролите присутствует комплексный цианид ртути, а«кумулятор может давать ток. После разряда и последующего приложения постоянного напряжения, превышающего напряжение на зажимах аккумулятора, аккумулятор может быть снова заряжен.
Аккумулятор является полностью заряженным, когда ртуть отрицательного электрода не может больше поглощать ионы калия. Разряженные ионы калия реагируют с водой электролита с образованием газообразного водорода, что является нежелательным, Однако выделение водорода может быть использовано для прекращения процесса зарядки либо автоматического прерывания его. Для этого образовавшийся водород направляют в электрический конденсатор. В результате создается регулирующая электрическая цепь, в состав которой входит конденсатор, и процесс зарядки прекращается.
Аккумулятор является полностью заряженным и в том случае, когда ртуть положительного электрода полностью растворяется в электролите, и электрод превращается в проводник, служащий для подачи электрического тока. Этот проводник рекомендуется изготавливать из нерастворимого или плохо растворимого в электролите материала. Можно также сделать емкость отрицательного электрода меньше емкости положительного электрода, благодаря чему положительный электрод даже после зарядки сохраняет еще некоторый резерв, в то время как отрицательный электрод не может воспринимать дальнейшей загс ряд,и.
В том случае когда положительный электрод содержит больше ртути, чем электролит может поглотить ее в форме растворимой комплексной соли, ртуть откладывается при пог5 следующей зарядке в виде серого осадка, состоящего из плохо растворимого цианида ртути. Эти соединения не препятствуют дальнейшему прохождению тока, и аккумулятор может продолжать заряжаться, причем активЗО ная масса положительного электрода и растворенные комплексные ионы цианида ртути переходят в нерастворимый цианид ртути.
Плохо растворимый цианид ртути может образоваться при зарядке и преждевременно, 35 если сила тока настолько большая, что количество образовавшегося цианида ртути превышает то количество, которое может раствориться в результате диффузии из электролита комплекса цианидных ионов.
40 Если обеспечить постоянное перемешивание электролита, то концентрация электролита будет везде одинаковой, и поверхность ртути останется чистой до тех пор, пока не будут связаны в комплексы почти все ионы циани45 да. Оба соединения — нерастворенный цианид ртути и растворенный комплекс цианида ртути — могут быть использованы для получения тока и образуют при разряде аккумулятора металлическую ртуть.
5п Перемешивать электролит можно либо при помощи мешалки, погруженной в жидкий электролит, либо путем встряхивания аккумуляторного бака. Оба способа могут быть использованы одновременно или попеременно.
55 Мешалка должна быть нейтральной хотя бы с поверхности и не подвергаться воздействию электролита; ее можно соединить с электродвигателем и подвесить в середине сосуда.
Мешалку можно изготовить магнитной, no6g крытой слоем синтетического материала. Магнитную мешалку помещают на дно сосуда и приводят в действие постоянно или периодически работающим магнитом, совершающим вращательное или колебательное движение.
65 Можно также сосуд с электролитом и электро298147 ды сделать подвижными один относительно другого или поместить аккумулятор в приспособление для встряхивания.
В качестве материала для отрицательного электрода, кроме бинарных амальгам, щелочных и щелочноземельных металлов, можно употреблять металлические многокомпонентные системы. В зависимости от выбора катионов, растворенных в электролите, или металлов, амальгированных в ртути отрицательного электрода, можно изменять свойства аккуму. ляторов: напряжение на зажимах, внутреннее сопротивление, емкость из расчета на объемную или весовую единицу, допустимую нагрузку, саморазряд и т. д. Так, например, рекомендуется, чтобы электролит содержал такое количество ионов щелочных или щелочноземельных металлов и гидроксильных ионов, чтобы внутреннее сопротивление аккумулятора было возможно меньшим и чтобы в процессе зарядки и разряда и между обоими этими процессами оно менялось в возможно меньшей степени.
Для создания аккумулятора с низким саморазрядом используется электролит из гидроокиси натрия с концентрацией 20 — 50 вес. /о.
Для создания высокого напряжения на зажимах аккумулятора применяется электролит, который содержит 20 — 50 вес. О о гидрата окиси калия.
Аккумулятор с высокой емкостью можно создать при использовании электролита, содержащего высококонцентрированный раствор гидрата окиси лития.
Можно также использовать электролит, насыщенный осадком и представляющий собой раствор гидрата окиси щелочного или щелочноземельного металла, в котором присутствуют многочисленные компоненты, такие как
NaOH, LiOH, Са(ОН) . При этом аккумулятор имеет низкий самораздряд.
В качестве материала для положительного электрода применяются такие металлы, которые образуют с ионами электролита растворимые отрицательно заряженные комплексные ионы. При этом желательно, чтобы комплексные ионы диссоциировали на свои компоненты в возможно меньшей степени.
Комплексный ион (ZLm) -" с центральным атомом Z, обладающим и зарядами и т связанными атомами Z, диссоциирует в водном растворе согласно схеме: (Я .щ) (т — и« вЂ” Z««+mL— на компоненты, входящие в его состав. По закону действующих масс (gп- )(/ — )m (zLm(m — n) ) и представляет собой константу диссоциации для данного процесса.
Чем меньше величина k>, тем более устойчивым является комплексный ион и тем меньшим саморазрядом характеризуется аккумулятор. Саморазряд может происходить в ре10
З0
65 зультате обмена между понами Z", раствореннымп в электролите, и между атомами щелочного или щелочноземельпого металла, присутствующими в амальгаме отрицагельного электрода, в соответствии со схемой: ««++пА — «-дА++ Я причем А обозначает атом щелочного металла, а А+ — катион щелочного металла.
Многие комплексные ионы имеют низкий k, например kz, иона (Cu(CN)4)> — составляет величину, меньшую 10 — . Процесс диссоциации протекает медленно. Это является существенным преимуществом аккумулятора, так как даже при большом сроке хранения он имеет незначительный саморазряд.
На фиг. 5 показан полностью или частично разряженный аккумулятор с вертикальным расположением электродов. Положительный электрод 4 выполнен из металлической пластины, а отрицательный электрод 8 — из жидкого металла, помещенного в плоский пористый мешок 7 из пластмассы, текстильных волокон или бумаги, устойчивой к щелочи. Ионы электролита могут проникать в поры мешка, а атомы металла отрицательного электрода 3 пройти сквозь эти поры не могут.
Положительный электрод 4 может быть выполнен аналогично.
Подобно ртути и меди, другие металлы образуют с ионами цианида, а также с другими связанными атомами устойчивые растворимые отрицательно заряженные комплексные ионы. К числу таких металлов относятся серебро, золото, металлы платиновой группы, железо, кобальт, никель, цинк и кадмий. Эти металлы могут быть использованы в качестве материала для положительного электрода.
Путем правильного выбора металла создают аккумулятор . с необходимыми свойствами.
Так, серебро, золото, платина обеспечивают высокое напряжение на зажимах.
Положительный электрод с целью расширения его применения изготавливают из многих компонентов, например из сплава двух металлов. При этом желательно, чтобы компоненты сплава имели близкие по величине потенциалы растворения и осаждения, например как никель и кобальт. При использовании положительного электрода из такого сплава во время зарядки аккумулятора кобальт и никель переходят одновременно в раствор под действием электролита, содержащего цианид, и вновь выделяются на положительном электроде при разряде аккумулятора. В качестве электродного материала можно упогреблять сплавы медь — цинк, медь — олово.
Для создания низкого напряжения на зажимах применяют положительный электрод, который частично состоит из железа или кобальта, никеля, цинка, кадмия.
Можно также изготавливать положительный электрод из двух или нескольких слоев металлов (фиг. 6). При зарядке аккумулятора слой 8 менее благородного металла раст298147
15 г0
З0
65 воряется в электролите в первую очередь, а слой 9 более благородного металла начинает растворяться при высоком зарядном напряжении, когда слой 8 уже полностью снят. )Келательно, чтобы положительное полюсное соединение б, состоящее из нерастворимого материала, у конца, погруженного в электролит, имело такое же поверхностное расширение, как и активная масса слоя 8 или 9 положительного электрода. Тогда при разрядке аккумулятора материал положительного электрода отложится почти в геометрическои форме, без ветвистых образований и комков. При этом зарядное напряжение должно быть больше напряжения на зажимах элемента.
При разряде аккумулятора процессы в электролите протекают в обратном порядке. Сначала, при более высоком напряжении на зажимах на положительной поддерживающей пластине 10 из комплексного иона откладывается серебро.
После этого напряжение на зажимах снижается скачкообразно до потенциала выделения никеля, а затем при дальнейшей разрядке на серебряном слое 9 начинает откладываться никель из комплексного иона. Этот процесс протекает до тех пор, пока в электролите не останется комплексных ионов или пока отрицательный электрод полностью не разрядится. Отложившийся никель образует положительный электродный слой 8.
Преимущество аккумулятора со слоистым положительным электродом заключается в том, что при измерении напряжения на зажимах аккумулятора можно определить его заряженность, так как скачок потенциала указывает, что непосредственно перед ним серебряный слой 9 еще сохраняет свою частичную емкость. Это помогает управлению отключающими органами, например реле, благодаря которым после определенного времени разрядки появляется сигнал, указывающий на необходимость повторной зарядки аккумулятора.
Компонентами многослойных электродов могут быть и другие металлы, потенциалы осаждения или растворения которых достаточно различаются.
К большинству аккумуляторов предъявляются следующие требования; высокий выход по току при зарядке и возможно меньший саморазряд в заряженном состоянии. Для достижения этого в водной фазе элекгролита, кроме комплексообразователя, растворяют гидрат окиси щелочного или щелочноземельного металла. Благодаря возникаю цей при этом большой величине рН выделение водорода на отрицательном электроде подавляется, что увеличивает выход по току при зарядке и снижает саморазряд. Кроме того, такой электролит желательно использовать хотя бы потому, что многочисленные комплексные ионы гяжелых металлов устойчивы лишь в щелочНоМ растворе. При рН(7 даже при использовании рекомендуемых цианидов в качестве комплексообразователей из раствора выделяется газообразная синильная кислота, чего при всех обстоятельствах следует избегать.
Для предотвращения возникновения ядовитых веществ можно использовать вместо ионов цианида ионы тиоцианата (образующие с многочисленными ионами тяжелых металлов растворимые отрицательно заряженные комплексные ионы) или органические анионы, например формиат, ацетат, пропионат, оксалат, тартрат, цитрат.
Для этой же цели пригодны анионы аминокислот, хлоруксусных кислот и т. д,, а также их замещенных производных. Существуют также другие органические соединения, образующие с тяжелыми металлами растворимые отрицательно заряженные комплексные ионы: комплексоны и клешневидные комплексы, например, нитрилоуксусных кислот, этилендиаминтетрауксусной кислоты, анилиндиуксусной кислоты.
Многочисленные связанные атомы можно сочетать друг с другом, благодаря чему образуются комплексы, состоящие из многих компонентов. К атомам тяжелых металлов могут присоединяться незаряженные связанные атомы вместе с заряженными связанными атомами. Так, например, вокруг центрального атома могут располагаться вместе с отрицательно заряженными группами акво- и аминокомплексные молекулы воды или аммиака.
Даже ион гидроксила может образовывать с амфотернореагирующими гидратами окисей металлов, например цинка, алюминия, титана и т. п. растворимые отрицательно заряженные гидроксо-комплексы, например:
Zn (ОН) +20 Н вЂ” -+ (Zn (ОН) «) >
Al (OH) з+ЗОН - (Al (ОН) e)
В этом случае электролит состоит из водного раствора гидрата окиси щелочного или щелочноземельного металла без других комплексообразующих ионов.
Из таких гидроксо-комплексов после отщепления воды образуются оксо-комплексы, которые могут служить компонентами электролита:
2А1 (ОН) g> (А1 0«) > — +4ОН +4Н О.
Из этой группы особое значение имеют комплексные анионы олова, мышьяка и сурьмы, например станниты и станнаты, так как эти вещества могут иметь различную валентность.
Центральный атом имеет в данном случае две валентности. При анодном окислении, например, мышьяка в присутствии гидроксильных ионов сначала образуется ион арсенита (Asm †)q â€, а затем, на второй ступени реакции, ион арсената (Аз+ — 04)3 —. Оба отрицательно заряженных иона легко растворимы в фазе электролита.
При зарядке аккумулятора на положительном электроде из мышьяка сначала образуется арсенит, и этот процесс идет до тех пор, пока электродный материал полностью не ра298147
65 створится. Затем потенциал изменяется скачком, причем у сердечниковой пластины положительного электрода, состоящей, например, из графита, магнетита или другого нерастворимого материала, в процессе дальнейшей зарядки растворяющийся в электролите арсенит окисляется до арсената.
При разряде аккумулятора в случае повышенного напряжения на зажимах на положительном электроде арсенат восстанавливается до арсенита. После этого напряжение на зажимах скачкообразно снижается, и в течение дальнейшего процесса разряда на положительном электроде выделяется металлический мышьяк.
Этот скачок потенциала путем измерения напряжения на зажимах может быть использован для контролирования заряженности аккумулятора с помощью указателей или регулято ров.
Следует учитывать, что кислород, присутствующий в комплексных соединениях олова, мышьяка и сурьмы, может быть заменен другими связанными атомами. Так, например, при замене кислорода серой образуются тиоарсениты и тио-арсенаты.
Другие тяжелые металлы, такие как хром, марганец, ванадий, молибден, могут образовывать, лишь находясь в состоянии высшей валентности, растворимые отрицательно заря>кенные комплексы с гидроксильными группами или оксо-группами. Так, например, хром может быть анодно окислен до нерастворимого гидрата окиси трехвалентного хрома
Сг (ОН) з. При дальнейшем анодном окислении можно получить легко растворимые отрицательно заряженные ионы хромата (Cr04), в которых хром находится в шестивалентном состоянии. Этот анион также может быть применен в описываемом аккумуляторе. Однако образование нерастворимого гидрата окиси трехвалентного хрома, выпадающего в виде губчатого осадка, приводит к некоторым затруднениям при использовании его в качестве электродной активной массы.
После нескольких циклов зарядки емкость аккумулятора снижается вследствие образования анодного шлама, не соприкасающегося с положительным электродом и вследствие этого не используемого в качестве электродной активной массы. Другие металлы также образуют нерастворимые гидраты окисей низших валентностей.
Чтобы устранить подобные явления в электролит, кроме гидроксильных ионов, вводят другие комплексообразователи, которые могут перевести гидраты окисей низших валентных состояний в растворимые соединения.
Точно так же могут быть использованы неорганические связанные атомы, объединяющиеся с многочисленными тяжелыми металлами и образующие растворимые отрицательно заряженные комплексные ионы, Для этой же цели можно употреблять, например, ионы нитрита, пирофосфата и гало5
З0
40 генида. Так, например, железо в присутствии избытка ионов фторида образует трехзарядный отрицательно заряженный растворимый комплексный ион (FeFs) з —.
Могут быть использованы и некоторые производные серной кислоты, например хлорсульфоновые кислоты и сульфаминовые кислоты, образующие с различными тяжелыми металлами растворимые отрицательно заряженные комплексные ионы, а также неорганические связанные атомы с органическими группами, с незаряженными связанными атомами, например с водой или аммиаком, служа цие для обогащения электролита отрицательно заряженными комплексными ионами.
Электролит должен иметь такой состав, чтобы после зарядки аккумулятора все комплексообразующие анионы были связаны, а поверхность положительного электрода покрылась слоем нерастворимых продуктов реакции, препятствующих дальнейшему прохождению зарядного тока. Тогда за процессом зарядки аккумулятора не нужно наблюдать, и подача зарядного тока автоматически прекращается.
Отрицательный электрод предложенного аккумулятора может состоять в заряженном состоянии из амальгамы щелочного или щелочноземельного металла, а в незаряженном состоянии — из ртути, положительный электрод — из ртути и амальгамы тяжелого металла, а электролит — из гидрата окиси щелочного или щелочноземельного металла и ионов йодида.
При зарядке такого аккумулятора на отрицательном электроде образуется амальгама щелочного или щелочноземельного металла, а на положительном электроде — первичный йодид ртути HgIq (а также йодиды амальгамированных компонентов), который немедленно растворяется под действием избытка ионов йодида:
H gI+ 2K I 2K++ (H gI4)После того как в электролите перед положительным электродом перестают присутствовать свободные ионы йодида, электрод покрывается слоем нерастворимого йодида ртути (а также нерастворимыми йодидами амальгимированных в нем компонентов), который плотно пристает к нему, предотвращая дальнейшее прохождение зарядного тока. После этого процесс зарядки аккумулятора практически заканчивается.
Чтобы прекратить подачу зарядного напряжения на зажимы аккумулятора, через который больше не проходит ток, можно включать в цепь зарядного тока автоматическое реле, которое при снижении силы тока автоматически выключается.
При разряде аккумулятора поверхностный слой положительного электрода растворяется, и находящиеся в электролите растворенные
298147
55 комплексные ионы достигают положительного электрода и реагируют с ним: (нд14) — Hgo+4I-.
При этом снова образуются металлическая ртуть и свободные ионы йодида.
В тех случаях когда требуется большая емкость, необходимо, чтобы количество электролита и концентрация ионов йодида в нем были возможно большими. При небольших количествах электролита можно использовать насыщенный раствор йодида, содержащий твердый осадок, например, йодистого калия.
В качестве растворителя для компонентов электролита могут вместо воды применяться спирты, кетоны, пиридин, диметилсульфоксид.
Однако внутреннее сопротивление такого аккумулятора, содержащего неводный растворитель, значительно больше, чем внутреннее сопротивление аккумулятора с водным электролитом.
Так же точно, как йодид, реагируют ионы хлорида и бромида, взаимодействующие с ртутью положительного электрода, однако комплексные ионы наиболее эффективно образуются йодидами. Если вместо йодистого калия в электролит добавить xJIopHcTbIH калий или бромистый калий, зарядка аккумулятора при прочих равных условиях прекратится значительно раньше в связи с образованием запорного слоя, состоящего из HgCI> или из HgBr>. Емкость такого аккумулятора будет меньше, чем у аккумулятора с йодидом.
Комплексные ионы, образующиеся при зарядке аккумулятора, распределяются в фазе электролита равномерно благодаря процессам конвекции и диффузии.
Потеря электроэнергии при повышении антропии может быть выравнена, если электролит разделить при помощи полупроницаемой мембраны на две реакционные емкости.
Мембрану выбирают таким образом, чтобы мелкие ионы, такие как катионы щелочных и щелочноземельных металлов, а также простые анионы комплексообразователя и гидроксильные ионы свободно могли проходить сквозь ее поры, которые задерживают более крупные комплексные ионы. Такие мембраны и фильтры могут быть выполнены из пластмасс, целлюлозы, спеченных металлических фольг и других материалов.
Растворимые отрицательно заряженные комплексные ионы, образующиеся при зарядке аккумулятора, не могут удаляться из ограниченной мембраной емкости электролита, расположенной у положительного электрода, в то время как все другие ионы могут свободно
45 диффундировать сквозь мембрану в обоих направлениях.
Благодаря этому реакционная емкость у отрицательного электрода остается свободной от комплексных ионов, что препятствует диссоциации комплексных ионов и предотвращает связанную с этим потерю заряда у центрального атома на отрицательном электроде. В результате саморазряд аккумулятора значительно снижается.
Если наложить полупроницаемую мембрану непосредственно на металл отрицательного электрода, то реакционная емкость, окружающая отрицательный электрод, станет очень небольшой, в то время как реакционная емкость у положительного электрода будет заполнена почти всем имеющимся количеством электролита. Этим достигают того, что почти все растворенные в электролите комплексообразующие ионы будут реагировать при зарядке аккумулятора с металлом, переходящим в раствор на положительном электроде, в то время как поступление комплексных ионов к отрицательному электроду будет в основном предотвращено. При уменьшении саморазряда аккумулятор приобретает в этом случае большую емкость, чем аккумулятор, у которого мембрана делит электролит на две реакционные емкости равной величины.
На фиг. 7 показан аккумулятор, в котором жидкий отрицательный электрод 8 расположен горизонтально над положительным электродом 4 и отделен от него электролитом.
Жидкий металл электрода 3 удерживается фильтром или полупроницаемой мембраной
11, которая может быть натянута между стенками корпуса.
На фиг. 8 изображен аккумулятор, в электролите которого расположена разделяющая мембрана 11, являющаяся проницаемой для небольших катионов и анионов и непроницаемой для более крупных комплексных ионов.
Аккумулятор может быть герметизирован с помощью уплотнительного кольца или путем привинчивания крышки или заваривания верхнего отверстия корпуса.
Предмет изобретения
Щелочной аккумулятор с отрицательным амальгамным электродом и положительным электродом, например, из окиси ртути, отличающийся тем, что, с целью улучшения электрических характеристик, в электролит введен ион-комплексообразователь, дающий растворимые соединения с продуктами заряда положительного электрода, например цианид.
298147 Риг 1
+ Фиг.5
2б
5 оиа 2
Уиг. 5
9 иг. Б
+ua.д
Составитель Ю. Драгомирова
Редактор Т. 3. Орловская Техред Е. Борисова Корректоры: А. Абрамова и М. Коробова
Заказ 1237/16 Изд. № 546 Тираж 473 Подписное
ЦНИИПИ Комитета по делам изобретений и открытий при Совете Министров СССР
Москва, Ж-35, Раушская наб., д. 4/5
Типография, пр. Сапунова, 2







www.findpatent.ru
423800, Набережные Челны , база Партнер Плюс, тел. 8 800 100-58-94 (звонок бесплатный)