Содержание
Принцип работы аккумулятора
Для обеспечения электрическим током схем мобильных устройств и машин, применяются специальные изделия, способные аккумулировать энергию. Для того чтобы правильно эксплуатировать такие устройства, желательно ознакомиться с принципом работы батарей.
История развития АКБ
Первые электрические батарейки на основе солевого электролита были известны ещё в Древнем Багдаде, но новый толчок к развитию этой технологии был получен в начале XIX века.
Итальянский учёный Алессандро Вольта более 200 лет назад создал первый химический источник электрического тока.
Батарейку такой конструкции нельзя было перезарядить, но начиная с этого момента был заложен основательный фундамент изготовления портативных АКБ. Спустя некоторое время, изобретение Вольта были усовершенствованы Иоганном Вильгельмом Риттером, который собрал из медных пластин аккумулятор, который можно было использовать многократно.
youtube.com/embed/bW_5q7saSR8″ frameborder=»0″ allowfullscreen=»allowfullscreen»>
После изобретения звукового сигнала, фар, стеклоочистителей возникла необходимость в источнике тока, который обеспечил бы автомобиль электричеством в необходимом объёме. Первое время машины не имели генератора, поэтому заряжать источники питания приходилось от сети, но уже в 20-е годы прошлого столетия машина стала оснащаться генератором электрического тока, что позволило осуществлять зарядку батарей во время работы двигателя внутреннего сгорания.
С момента первой установки на машину конструкция АКБ практически не изменялась, но существенной модернизации подверглись материалы, из которых изготавливались аккумуляторы. Пластины первых батарей делали из чистого свинца, который очень быстро покрывался оксидным слоем, что существенно снижало эффективность работы устройства. В дальнейшем, для уменьшения негативных последствий решётки обрабатывались суриком, но большую распространённость получила технология, при которой для производства пластин использовался сурьмяно-свинцовый сплав. В современных батареях проблема окисления решёток решается добавлением в свинец легирующих компонентов. Сплавы свинца и кальция позволяют снизить интенсивность испарения воды, поэтому корпус таких аккумуляторов изготавливается полностью герметичным.
В современных батареях проблема окисления решёток решается добавлением в свинец легирующих компонентов. Сплавы свинца и кальция позволяют снизить интенсивность испарения воды, поэтому корпус таких аккумуляторов изготавливается полностью герметичным.
Для чего нужна аккумуляторная батарея
Основное назначение автомобильного аккумулятора – обеспечение электрическим током стартер. Это электрическое устройство приводится в движение, только посредством постоянного тока высокой мощности.
Аккумуляторная батарея легко справляется с такой нагрузкой, кроме этого, изделие позволяет многократно осуществлять запуск двигателя.
Также автомобильный аккумулятор принимает непосредственное участие в обеспечении электрическим током таких потребителей, как:
- Осветительные приборы.
- Звуковой сигнал.
- Стеклоочистители.
- Сигнализацию.
- Дополнительное электрическое оборудование.
Наибольшая потребность в АКБ возникает во время стоянки, ведь в этот момент генератор не вырабатывает электрический ток, а вся нагрузка полностью ложится на плечи химического элемента питания. Также аккумулятор берёт на себя «обязанность» по обеспечению автомобиля электричеством в момент, когда обороты двигателя слишком малы, чтобы раскрутить якорь генератора до определённых значений.
Также аккумулятор берёт на себя «обязанность» по обеспечению автомобиля электричеством в момент, когда обороты двигателя слишком малы, чтобы раскрутить якорь генератора до определённых значений.
Если автомобиль с двигателем внутреннего сгорания нуждается в АКБ только в момент запуска, а также при отключённом генераторе, то такая разновидность машин, как электромобили использует электродвижущую силу батареи в качестве основного энергоносителя.
Свинцовые батареи практически не способны эффективно справиться с этой задачей, поэтому для питания мощных электромоторов применяются литий -ионные или кадмиевые батареи.
Принцип работы аккумуляторной батареи
Чтобы понять принцип работы аккумулятора автомобиля необходимо ознакомиться с устройством батареи. Автомобильный аккумулятор состоит из следующих элементов:
- Корпуса.
- Крышки.
- Отрицательных и положительных пластин.
- Сепараторов.
- Клемм.
- Электролита.
Если аккумулятор является обслуживаемым, то в крышке имеется 6 резьбовых пробок, которые открывают доступ к каждой банке батареи. Корпус современных изделий изготавливается из сверхпрочного пластика, крышка также делается из пластмассы, которая надёжно соединяется с основной коробкой методом пайки. Кроме корпуса, из кислотоустойчивой пластмассы изготавливаются сепараторы, которые устанавливаются между пластинами.
Корпус современных изделий изготавливается из сверхпрочного пластика, крышка также делается из пластмассы, которая надёжно соединяется с основной коробкой методом пайки. Кроме корпуса, из кислотоустойчивой пластмассы изготавливаются сепараторы, которые устанавливаются между пластинами.
Разобравшись, из чего состоит автомобильный аккумулятор можно приступать к изучению механизма накопления электрического тока. Работа АКБ зависит от возможности протекания химической реакции между свинцовыми пластинами и электролитом.
При подключении к АКБ потребителей электроэнергии происходит окисление свинца на положительной решётке, при этом на отрицательной пластине восстанавливается диоксид свинца.
Если аккумулятор заряжается от генератора или сетевого адаптера, то происходит обратный процесс. То есть, на отрицательных решётках уменьшается количество вещества, а на положительных – увеличивается.
Если известно из чего состоит АКБ, а также изучен принцип работы аккумулятора, то не составит большого труда разобраться в особенностях современных разновидностей таких изделий.
Типы современных АКБ
Устройство современного аккумулятора автомобиля отличается от источников тока, изготавливаемых в прошлом столетии, прежде всего, по наличию необслуживаемого корпуса. Практически все АКБ, предназначенные для легкового автотранспорта, выпускаются без пробок в верхней крышке. К такому технологическому решению удалось прийти только после того, как было снижено газообразование внутри корпуса батареи. Таким неоспоримым достоинством обладают АКБ следующих типов:
- Кальциевые (Ca/Ca).
- Гибридные.
- Гелевые.
- Литий-ионные.
- Щелочные.
Устройство АКБ без пробок позволяет уменьшить временные затраты на обслуживание аккумулятора, а также продлить срок годности изделия.
При производстве Ca/Ca аккумуляторов используется свинец легированный кальцием. Такое усовершенствование технологии позволяет изделию работать в течение многих лет, без образования сульфидной плёнки. Кроме этого, в таких батареях более высокий пусковой ток, что позволяет легко завести двигатель машины, даже при отрицательной температуре воздуха. Заряжать аккумуляторы этого типа желательно автоматическими пускозарядными устройствами, ведь при использовании обычных ЗУ потребуется постоянно контролировать уровень подачи тока и напряжения.
Заряжать аккумуляторы этого типа желательно автоматическими пускозарядными устройствами, ведь при использовании обычных ЗУ потребуется постоянно контролировать уровень подачи тока и напряжения.
Гибридные АКБ представляют собой средние по качеству батареи. Отрицательные пластины таких аккумуляторов также изготавливаются по кальциевой технологии, а положительные – из сурьмянистого сплава. Гибридные изделия существенно дешевле кальциевых АКБ, а зарядный ток на их контакты можно подавать с использованием даже старых моделей ЗУ.
В гелевой батареи аккумуляторный электролит представляет собой желеобразную массу.
Благодаря такой особенности батарея может прослужить более десяти лет, а при глубоком разряде рабочая поверхность пластин длительное время не будет покрываться оксидным слоем.
Несмотря на перечисленные преимущества, существенным недостатком таких изделий является высокая стоимость.
AGM- аккумуляторы представляют собой устройство, которое очень напоминает гелевую конструкцию АКБ. В корпусе из пластика находятся свинцовые пластины, которые погружены в ватоподобную стекловолоконную массу, которая пропитывается электропроводящим составом. Благодаря использованию такой технологии удаётся также добиться низких показателей испарения жидкости, а также устойчивости к механическому воздействию.
Литий-ионные аккумуляторы могут состоять только из ионов этого металла, поэтому при эксплуатации батарей значительно снижается вероятность их воспламенения даже под большой нагрузкой.
Благодаря этому преимуществу их можно использовать не только в качестве накопителя электроэнергии для машин с двигателем внутреннего сгорания, но и как основной источник энергии для электромобилей.
В современных щелочных аккумуляторах, также как и раньше, в качестве электролита используются едкий калий и едкий натрий. Достоинства таких батарей заключается в том, что в процессе эксплуатации не происходит снижения количества химических веществ внутри корпуса. Кроме этого, изделия имеют минимальный саморазряд и длительный срок эксплуатации. В различных самоходных установках такие модели АКБ применяются, в основном, в качестве тяговых аккумуляторов.
Кроме этого, изделия имеют минимальный саморазряд и длительный срок эксплуатации. В различных самоходных установках такие модели АКБ применяются, в основном, в качестве тяговых аккумуляторов.
Принцип работы аккумулятора несложен, но разобраться в нём всё-таки стоит. Несмотря на то, что в необслуживаемую АКБ невозможно даже долить воды, знание особенностей процесса зарядки и разрядки, позволит не допустить серьёзных ошибок во время эксплуатации батареи.
Что такое аккумуляторная батарея — устройство, состав и принцип работы АКБ
Содержание
- Определение АКБ и его функция в автомобиле
- Устройство аккумуляторной батареи и принцип ее работы
- По каким технологиям изготавливают
- Технология GEL
- Технология AGM
- Технология EFB
Основным источником электроэнергии в автомобиле является генератор – от него питаются все потребители при работающем двигателе. Но мотор сначала надо запустить. Для этого в машине установлена аккумуляторная батарея.
Определение АКБ и его функция в автомобиле
Аккумуляторная батарея (АКБ) – электрохимический возобновляемый источник электрической энергии. Он может снабжать потребителей до исчерпания заряда, после чего может быть перезаряжен. Количество циклов заряд-разряд ограничено, оно определяет жизненный ресурс батареи.
В автомобиле основное назначение АКБ — запуск двигателя. От аккумулятора запитывается стартерный двигатель, который приводит во вращение вал мотора, а также бензонасос (если он с электроприводом) и другие необходимые для старта узлы. После окончания последовательности пусковых операций на номинальный режим выйдет генератор, и вся нагрузка бортсети (включая возобновление потраченной на пуск энергии АКБ) перейдет на него.
Также аккумулятор может запитать потребителей, если двигатель не запущен. В штатном режиме это может быть аварийное светосигнальное оборудование, охранная сигнализация, в темное время суток – габаритные фонари и т.п. В нештатной ситуации могут быть обеспечены питанием и другие потребители — автозвук, световое оборудование при ремонте и диагностике и т. п. Надо лишь помнить, что время пользования до следующего заряда ограничено.
п. Надо лишь помнить, что время пользования до следующего заряда ограничено.
Устройство аккумуляторной батареи и принцип ее работы
Самый простой аккумулятор состоит из двух электродов – положительного из оксида свинца, отрицательного из свинца. Оба электрода помещены в раствор серной кислоты. При подключении потребителя начинают протекать химические реакции.
Устройство простого свинцово-кислотного аккумулятора.
Всего их при заряде-разряде несколько десятков, но для понимания работы АКБ наиболее важны следующие:
- при разряде на аноде (плюсовом электроде) диоксид свинца при взаимодействии с серной кислотой восстанавливается до сульфата свинца с образованием воды;
- при этом на катоде (минусовом электроде) свинец окисляется с образованием сульфата свинца (PbSO4).
В итоге происходит два важных для эксплуатации явления:
- Содержание серной кислоты в электролите падает (уменьшается плотность электролита).
- На пластинах выпадает плохо растворимый в кислоте осадок сульфата свинца.

При заряде реакции идут в обратном направлении:
- на катоде в результате реакции из сульфата свинца образуется свинец и кислотный остаток серной кислоты, катод заряжается отрицательным потенциалом;
- на аноде сульфат свинца с водой образуют серную кислоту и чистый свинец, заряжая электрод положительно.
Итогом реакций становится:
- Растворение сульфата свинца.
- Увеличение содержания серной кислоты и повышение плотности электролита.
- Появление электродвижущей силы (ЭДС), достигающей 2,1 вольта.
Если процессы протекают строго симметрично, то выпадающий осадок PbSO4 полностью растворяется. На практике такого не бывает, полное равновесие соблюсти сложно. Поэтому пластины постепенно покрываются слоем сульфата, маскирующим полезную площадь. В итоге емкость АКБ снижается. Этот процесс называется сульфатацией.
Пластины, покрытые слоем кристаллов сульфата свинца.Последствия «кипения» аккумулятора – выплескивание электролита и образование осадка при высыхании.
В практических конструкциях изначально свинцовые решетчатые пластины заполняют намазкой из смеси оксида свинца и свинцового сурика (с химической точки зрения — соединение свинца и кислорода). При первом заряде происходит формовка пластин. Во время реакции с серной кислотой на одном аноде образуется оксид свинца в губчатом виде, на другом – металлический свинец (также в пористой форме). Емкость аккумулятора зависит от площади пластин, поэтому практическое устройство элемента аккумуляторной батареи выглядит как пакет из анодных и катодных пластин, набранных поочередно и соедиенных параллельно.
Устройство элемента аккумуляторной батареи.
По каким технологиям изготавливают
Стремление улучшить работу свинцово-кислотных аккумуляторов привело к созданию новых технологий производства элементов. В первую очередь, это замена легирующей добавки. Вместо сурьмы сейчас широко применяется кальций. Его добавка придает свинцовым пластинам повышенную прочность, в результате появилась возможность сделать их более тонкими без потери жесткости конструкции. В электрохимических реакциях кальций не участвует. Кальциевые батареи имеют и другое достоинство – пониженная склонность к газообразованию при зарядке. Такой аккумулятор не склонен к «кипению». Это кардинально снижает расход воды во время эксплуатации. Также за последние годы популярность завоевали батареи в необслуживаемом исполнении.
В электрохимических реакциях кальций не участвует. Кальциевые батареи имеют и другое достоинство – пониженная склонность к газообразованию при зарядке. Такой аккумулятор не склонен к «кипению». Это кардинально снижает расход воды во время эксплуатации. Также за последние годы популярность завоевали батареи в необслуживаемом исполнении.
Тематическое видео: Революционная твердотельная батарея от Toyota
Технология GEL
В этих аккумуляторах электролит загущен до состояния геля специальными добавками. Главное достоинство батареи – необслуживаемое исполнение и практическая невозможность пролива электролита. Даже при небольших повреждениях корпуса гель не вытечет. Также созданы условия для рекомбинации газов в толще электролита. Водород и кислород, даже если они образуются при зарядке, не улетучиваются, а реагируют в толще геля с образованием воды. Малая часть газов, не поучаствовавшая в рекомбинации, улетучивается в пространство над электролитом. Когда давление достигает определенного предела, оно сбрасывается в атмосферу через специальный клапан. Другим плюсом является возможность эксплуатации почти в любом положении. Электрохимические реакции в таком элементе не отличаются от реакций в обычном аккумуляторе, принцип работы гелевой батареи абсолютно такой же, поэтому ЭДС одного элемента составляет те же 2,1 вольта.
Водород и кислород, даже если они образуются при зарядке, не улетучиваются, а реагируют в толще геля с образованием воды. Малая часть газов, не поучаствовавшая в рекомбинации, улетучивается в пространство над электролитом. Когда давление достигает определенного предела, оно сбрасывается в атмосферу через специальный клапан. Другим плюсом является возможность эксплуатации почти в любом положении. Электрохимические реакции в таком элементе не отличаются от реакций в обычном аккумуляторе, принцип работы гелевой батареи абсолютно такой же, поэтому ЭДС одного элемента составляет те же 2,1 вольта.
Читайте также
Типы автомобильных аккумуляторов и их обозначение
Главный минус АКБ с загущенным электролитом – пониженная динамика электрохимических реакций. Результатом этого становится пониженная токоотдача, которая не позволяет применять гелевые АКБ в качестве автомобильных стартерных. Зато такие батареи используют в качестве тяговых аккумуляторов, буферных элементов и в качестве источников питания, не требующих сервиса, на удаленных объектах (устройства телемеханики, ретрансляторы связи и т. п).
п).
Необслуживаемый гелевый аккумулятор.
Более подробно в статье: Гелевый аккумулятор для автомобиля — плюсы и минусы
Технология AGM
Эта технология позволяет в полной мере использовать преимущества пластин, легированных кальцием. Тонкие пластины собирают в компактный пакет, а чтобы избежать короткого замыкания, между ними прокладывают сепаратор-разделитель, как показано на рисунке в разрезе.
Устройство батареи АГМ.
Он изготовлен из волокнистого материала (обычно, стекловолокна). Пространство между волокнами заполнено электролитом, который удерживается внутри сепаратора капиллярными силами, поэтому свободной жидкости в такой батарее тоже нет. Часть межволоконного пространства оставлена незаполненным – небольшое количество газов, которое все же образуется во время эксплуатации, рекомбинирует в этих пустотах.
Технология EFB
Строение аккумуляторов, изготовленных по данной технологии, является промежуточным между традиционными батареями и AGM. Пластины (обычно, каждая положительная) такой АКБ помещены в сетчатый сепаратор, который позволяет расположить электроды более компактно без риска короткого замыкания. Внутри корпуса находится электролит в свободном виде, но часть его абсорбируется сеткой разделителя, которая позволяет держать пластины постоянно смоченными раствором серной кислоты.
Внутри корпуса находится электролит в свободном виде, но часть его абсорбируется сеткой разделителя, которая позволяет держать пластины постоянно смоченными раствором серной кислоты.
Кроме того, сепаратор снижает вымывание обмазки пластин и удерживает ее от осыпания, что положительно сказывается на сроке службы АКБ, увеличивая количество возможных циклов. Такие батареи обладают многими достоинствами аккумуляторов AGM, но их производство значительно дешевле.
Устройство аккумулятора EFB.
Несмотря на развитие литий-ионных технологий, кислотно-свинцовые батареи еще долго будут занимать свои ниши в сфере автономных источников питания. Предпосылками к этому служат их дешевизна, конструкция, отработанная десятилетиями, относительно долгий срок службы при эксплуатации в соответствующих условиях.
Как устроена батарея. Инженерное мышление
Батареи, мы используем их каждый день по всему миру, но как они работают? Об этом мы расскажем в этой статье, спонсируемой Squarespace. Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
Аккумуляторы
Прокрутите вниз, чтобы посмотреть видео на YouTube.
Что такое батарея?
Аккумулятор — это устройство, используемое для хранения энергии, когда она нам нужна. Мы используем их для питания небольших электрических устройств, таких как фонарики. Энергия хранится в виде химической энергии, и ее можно превратить в электрическую энергию, когда она нам понадобится. Мы увидим, как это работает чуть позже в статье.
Цепь батареи и лампы
Если мы посмотрим на простую цепь батареи и лампы. Чтобы зажечь лампу, нам нужно, чтобы через нее протекали электроны. Батарея будет обеспечивать толкающую силу, позволяющую электронам течь через лампу. Нам просто нужно подключить лампу к положительной и отрицательной клеммам батареи, чтобы замкнуть цепь. Батарея может выталкивать электроны только в течение определенного периода времени, это время зависит от того, сколько энергии хранится внутри батареи и сколько требуется нагрузке.
Примеры нагрузки
Когда мы говорим о нагрузке в электрической цепи, мы имеем в виду любые компоненты, для работы которых требуется электричество, например резисторы, светодиоды, двигатели постоянного тока или даже целые печатные платы. Некоторые батареи можно перезаряжать, и это будет четко указано сбоку, но типичная бытовая щелочная батарея не может, поэтому ее просто утилизируют, когда в ней заканчивается энергия. Они могут быть переработаны, поэтому убедитесь, что вы утилизируете их ответственно.
Между прочим, если вы хотите узнать, как работает двигатель постоянного тока, мы уже подробно рассказывали об этом ранее — посмотрите ЗДЕСЬ.
Что внутри батареи?
Типичная щелочная батарея на 1,5 В выглядит примерно так, но цвета зависят от производителя. Когда мы смотрим на батарею, у нас обычно плотно прилегает пластиковая обертка снаружи, она изолирует батарею, но также сообщает нам важную информацию, такую как емкость и напряжение, а также то, какой конец является положительным, а какой отрицательным.
Щелочная батарея
Положительный конец известен как катод и имеет расширенную поверхность, выступающую наружу.
Положительный конец
Отрицательный конец будет плоским, отрицательный конец известен как анод. Эти две клеммы электрически изолированы друг от друга.
Negative End
Под оберткой находится основной кожух, который обычно изготавливается из стали с никелированием. Это удерживает все внутренние компоненты на месте и предотвращает их взаимодействие с элементами атмосферы, такими как воздух и вода.
Under Wrapper
Внутри корпуса у нас есть несколько слоев различных материалов, эти материалы специально отобраны, потому что их химические реакции создают определенные уровни напряжения и тока. Первый слой — это катод, представляющий собой смесь оксида марганца (MnO2) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
Первый слой
Затем мы находим слой пористого материала, обычно волокнистой бумаги, который образует барьер. Барьер предотвращает прямой контакт материалов анода и катода друг с другом, что помогает батарее дольше работать, когда она не используется. Если бы барьера не было, то произошло бы короткое замыкание батареи. Микроскопические отверстия внутри материала позволяют атомам ионов проходить сквозь него. Мы рассмотрим это более подробно позже в этой статье.
Барьер предотвращает прямой контакт материалов анода и катода друг с другом, что помогает батарее дольше работать, когда она не используется. Если бы барьера не было, то произошло бы короткое замыкание батареи. Микроскопические отверстия внутри материала позволяют атомам ионов проходить сквозь него. Мы рассмотрим это более подробно позже в этой статье.
Барьер
Жидкий электролит из гидроксида калия затем распыляется на сепаратор во время производственного процесса, который пропитывает его и впитывается в материал анода. Используемый электролит является щелочным, поэтому мы называем этот тип батареи щелочной батареей.
Electrolyte Liquid Spray
На другой стороне барьера у нас есть анод, который представляет собой пасту, изготовленную из порошка цинка (Zn), а также гелеобразователя. Желирующий агент просто удерживает цинк во взвешенном состоянии, поэтому он не скапливается в одном месте. Цинк находится в форме порошка для увеличения площади поверхности материала, что снижает внутреннее сопротивление и, таким образом, улучшает перенос электронов.
Внутренняя батарея
Стальная капсула закрыта нейлоновой пластиковой крышкой. Затем в цинк вставляется латунный штифт, на который надевается стальной колпачок. Это дает нам отрицательную клемму. Обратите внимание, что положительные и отрицательные клеммы разделены пластиковой крышкой. Это гарантирует, что они электрически изолированы друг от друга, в противном случае электроны могут пройти через корпус и достичь положительной клеммы, что приведет к короткому замыканию батареи.
Разделение положительного и отрицательного
Основы электричества
Нам нужно понять некоторые основы того, как работает электричество, прежде чем мы сможем понять аккумулятор.
Во-первых, электричество — это поток электронов в цепи. Батареи могут обеспечить толкающую силу, которая перемещает электроны по цепи. Электроны хотят вернуться к своему источнику, и они немедленно пойдут по любому пути, чтобы достичь этого. Помещая такие вещи, как лампы, на пути электронов, мы можем заставить их выполнять работу за нас, например, освещать лампу.
Основы электричества
Батареи производят электричество постоянного или постоянного тока. Это означает, что электроны текут только в одном направлении от отрицательного к положительному. Осциллограф покажет постоянный ток в виде плоской линии в положительной области. Вы можете думать об электричестве постоянного тока как о реке, которая течет только в одном направлении.
Постоянный ток
В этих анимациях мы показываем поток электронов, который идет от отрицательного к положительному, но вы, возможно, привыкли видеть обычный ток, который идет от положительного к отрицательному. Электронный поток — это то, что происходит на самом деле, но обычный ток был исходной теорией, которая до сих пор широко используется и преподается по сей день. Просто знайте о двух и о том, какой из них мы используем.
Переменный ток
Электричество, которое вы получаете от электрических розеток в своих домах, представляет собой электричество переменного или переменного тока, это отличается от электричества, обеспечиваемого аккумулятором. При переменном токе электроны непрерывно текут вперед и назад, подобно морскому приливу, который течет между приливом и отливом. Осциллограф покажет переменный ток как волну, проходящую как через положительную, так и через отрицательную области, потому что она течет вперед, это положительно, и назад, это отрицательно.
При переменном токе электроны непрерывно текут вперед и назад, подобно морскому приливу, который течет между приливом и отливом. Осциллограф покажет переменный ток как волну, проходящую как через положительную, так и через отрицательную области, потому что она течет вперед, это положительно, и назад, это отрицательно.
Переменный ток
Если мы посмотрим на отрезок медного провода, внутри него мы обнаружим атомы меди. В центре атома у нас есть протоны и нейтроны, протоны заряжены положительно, а нейтроны считаются нейтральными, поэтому они не имеют заряда. Вокруг них вращаются электроны, электроны заряжены отрицательно.
Медная проволока
Некоторые из этих электронов могут свободно перемещаться к другим атомам. Они будут естественным образом перемещаться между другими атомами, но в случайных направлениях, что для нас бесполезно. Нам нужно, чтобы много электронов текло в одном направлении, и мы можем сделать это, обеспечив разность напряжений от источника питания, такого как батарея.
Когда мы говорим об атомах, вы часто будете слышать термин «ион». Ион — это просто атом, который имеет неравное количество электронов или протонов. Атом имеет нейтральный заряд, когда в нем одинаковое количество протонов и электронов, потому что протоны заряжены положительно, а электроны отрицательно заряжены, поэтому они уравновешиваются. Если в атоме больше электронов, чем протонов, то это отрицательный ион. Если в атоме больше протонов, чем электронов, то это положительный ион.
Ион
Напряжение похоже на давление в резервуаре с водой. Чтобы узнать, какое у нас давление, мы должны сравнить давление внутри трубы с давлением снаружи, и для этого мы используем манометр. Когда дело доходит до напряжения, мы используем вольтметр для измерения разницы напряжения между двумя разными точками. Если мы измерим разницу между батареями, мы получим 1,5 В, но если мы измерим тот же конец, мы получим 0 В, потому что это тот же конец, поэтому разницы нет.
Напряжение подобно давлению
Некоторые материалы позволяют электронам легко проходить через них, они известны как проводники.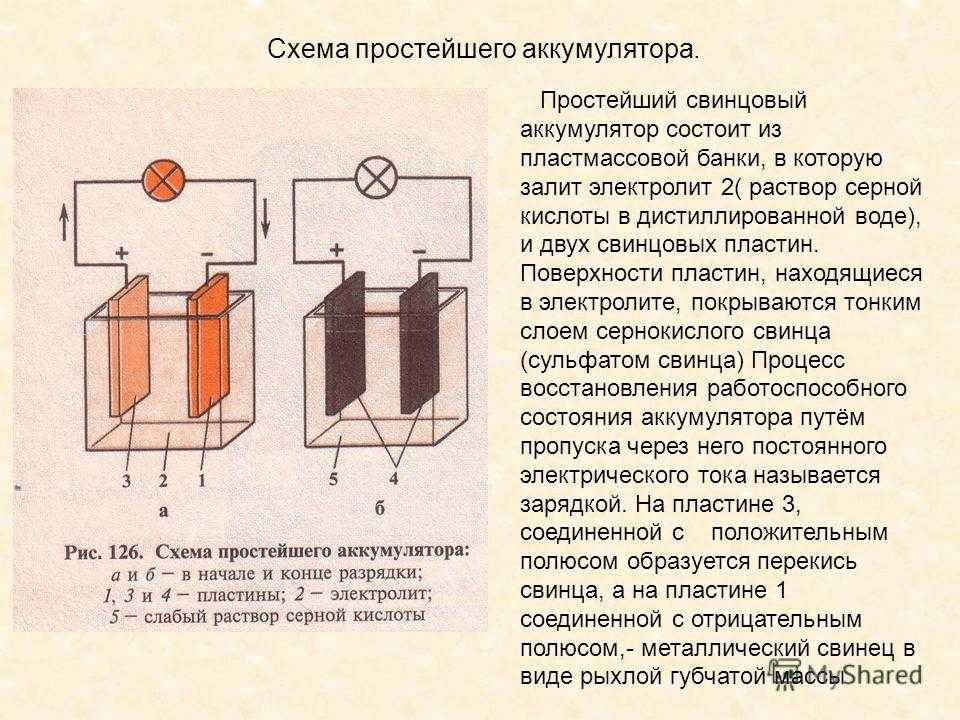 Примерами этого являются медь и большинство металлов. Другие материалы не пропускают электроны, они известны как изоляторы. Примерами этого являются резина и большинство пластмасс. Поэтому мы используем медные провода с резиновой изоляцией. Медь переносит электричество туда, где оно нам нужно, а резина защищает нас.
Примерами этого являются медь и большинство металлов. Другие материалы не пропускают электроны, они известны как изоляторы. Примерами этого являются резина и большинство пластмасс. Поэтому мы используем медные провода с резиновой изоляцией. Медь переносит электричество туда, где оно нам нужно, а резина защищает нас.
Смешивая определенные материалы, мы можем вызывать химические реакции. Это когда атомы одного материала взаимодействуют с атомами другого материала и во время этого взаимодействия атомы будут связываться или распадаться, электроны также могут быть захвачены или освобождены атомами в ходе химической реакции.
Хорошо, теперь, когда мы рассмотрели основы, давайте заглянем внутрь батареи и посмотрим, как она работает.
Как работает щелочная батарея?
Помните, мы кратко говорили об атомах. Ну, все эти материалы внутри батареи состоят из множества различных атомов, плотно упакованных вместе. Они представлены цветными шариками, каждый цвет которых соответствует разному материалу и, следовательно, разному атому для нашего очень упрощенного примера. Когда мы объединим все эти материалы вместе внутри капсулы, мы получим небольшую химическую реакцию, в которой атомы начнут взаимодействовать друг с другом.
Когда мы объединим все эти материалы вместе внутри капсулы, мы получим небольшую химическую реакцию, в которой атомы начнут взаимодействовать друг с другом.
Внутри батареи
Прежде всего, атом иона гидроксида в электролите соединяется с атомом цинка в анодной части. Эта химическая реакция известна как окисление и создаст гидроксид цинка, поскольку соединение цинка и гидроксида высвобождает электроны. Эти электроны теперь могут свободно двигаться и будут собираться на латунном штифте.
В то же время атом оксида марганца соединяется с молекулой воды из электролита, а также со свободным электроном в химической реакции, известной как восстановление. Во время химической реакции оксид марганца превращается в немного другую версию оксида марганца, этой версии больше не нужен атом иона гидроксида, поэтому он выбрасывает его в электролит. Атом воды замещается атомом, выброшенным из реакции окисления. Ион гидроксида теперь свободен и может пройти через сепаратор. Но пока не будет, потому что в анодной секции для него нет места.
Накопление электронов
Итак, как вы можете видеть, у нас есть накопление электронов на отрицательном выводе. Поскольку электроны заряжены отрицательно, и теперь у нас больше электронов на отрицательной клемме, чем на положительной, это означает, что у нас есть разница в напряжении между двумя концами, и мы можем измерить эту разницу с помощью мультиметра.
Помните, что мы можем измерить только разницу в напряжении между двумя разными точками. Если мы измерим одну и ту же точку, мы получим ноль вольт, потому что разницы нет.
Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. В положительной области меньше электронов, поэтому они попытаются добраться до этой клеммы. Сепаратор не позволяет им течь внутрь аккумулятора и достигать положительной клеммы.
Следовательно, электронам нужен другой путь. Если мы предоставим электронам внешний путь, такой как провод, электроны будут течь по нему, чтобы добраться до положительной клеммы. Помещая такие вещи, как лампа, на пути электронов, электроны должны будут пройти через нее, и поэтому мы заставляем их выполнять работу за нас, например, освещать лампу.
Помещая такие вещи, как лампа, на пути электронов, электроны должны будут пройти через нее, и поэтому мы заставляем их выполнять работу за нас, например, освещать лампу.
Зажигание лампы
Пока у нас есть замкнутая цепь между клеммами, химическая реакция будет продолжаться, и электроны текут от отрицательной клеммы. Если мы удалим провод или разомкнем цепь, то химическая реакция прекратится.
Итак, давайте вспомним происходящую химическую реакцию. Свободные электроны попадают в батарею через положительный полюс. Это объединяется с оксидом марганца и молекулой воды на катоде, который высвобождает ион гидроксида в электролит.
Ион гидроксида проходит через сепаратор и соединяется с атомом цинка, образуя гидроксид цинка, при этом высвобождаются электроны и молекула воды. Электроны хотят добраться до области с меньшим количеством электронов, положительный полюс имеет меньше электронов, поэтому они будут течь по проводу, чтобы достичь этого, и поэтому химическая реакция непрерывно повторяется снова и снова.
Однако внутри батареи содержится лишь определенное количество материала, поэтому со временем химическая реакция будет продолжаться все труднее и труднее, и в конечном итоге электроны перестанут течь. Аккумулятор больше не будет использоваться, и его необходимо утилизировать.
Соединение батарей вместе
Мы можем использовать батарею для питания некоторых компонентов, но обычно одной батареи недостаточно для питания наших устройств, для этого нам нужно объединить батареи.
Аккумуляторы можно подключать двумя способами. Серийно или параллельно. Ранее мы подробно рассмотрели эти типы схем, посмотрите серию ЗДЕСЬ, и параллельную ЗДЕСЬ.
Серия
Когда мы соединяем батареи последовательно, напряжение каждой батареи суммируется. Таким образом, две батареи по 1,5 В дают нам 3 В, а 3 батареи дают нам 4,5 В и т. д. Фактическое напряжение может немного отличаться в реальном мире. Напряжение увеличивается, потому что каждая батарея ускоряет входящие в нее электроны, поэтому мы получаем более высокое напряжение.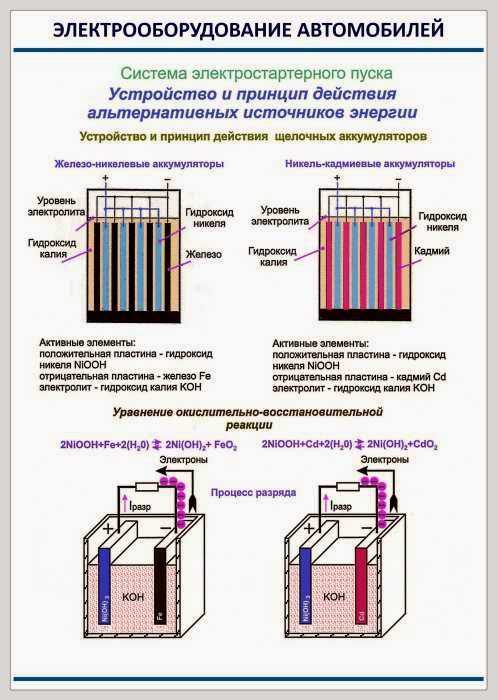
Параллельно
Если мы подключим батареи параллельно, то мы получим только 1,5 В, независимо от того, сколько мы подключим. Это потому, что путь сливается на подаче, но разделяется на обратном пути, поэтому электроны не будут ускоряться. Однако этот тип конфигурации сможет обеспечить больший ток, а также будет иметь большую емкость, поэтому мы сможем питать что-то дольше. Например, если батарея имела емкость 1200 мАч и мы поставили две параллельно, у нас будет емкость 2400 мАч, но напряжение 1,5 В. Если мы подключим их последовательно, у нас будет емкость 1200 мАч, но напряжение 3 В.
Серия и параллель
Емкость
Мы используем батареи для питания наших цепей. Но как долго батарея может питать нашу схему? Когда мы смотрим на упаковку или лист данных для батареи, мы видим значение с буквами m.A.h рядом с ним. Это рейтинг в миллиампер-часах.
Пример батареи
Например, этот имеет номинал 2500 мАч. Это означает, что теоретически он может обеспечить ток 2500 миллиампер в час, или 1250 мА в течение 2 часов, или 20 мА в течение 125 часов. Однако в реальной жизни это, вероятно, не продлится так долго, потому что химическая реакция замедляется, поэтому внутреннее сопротивление батареи меняется по мере ее разрядки. Есть много других вещей, которые влияют на это, например, возраст и температура.
Однако в реальной жизни это, вероятно, не продлится так долго, потому что химическая реакция замедляется, поэтому внутреннее сопротивление батареи меняется по мере ее разрядки. Есть много других вещей, которые влияют на это, например, возраст и температура.
Нет реального способа точно рассчитать продолжительность жизни, лучше всего просто проверить ее. Однако мы можем оценить срок службы по следующей формуле:
Срок службы батареи = Емкость (мАч) / ток цепи (мА).
На нашем веб-сайте мы создали простой бесплатный калькулятор, с помощью которого вы можете рассчитать время работы аккумулятора, а также необходимую емкость. Проверьте это ЗДЕСЬ .
Так, например, в этой схеме мы вычисляем спрос 19мА, а батарея имеет емкость 3000 мАч. Итак, 3000/19 дает нам 157,9 часа. Это действительно лучший сценарий, и на самом деле он почти наверняка не достигнет этого.
Срок службы батареи
Как измерить с помощью мультиметра
Чтобы измерить напряжение, мы просто выбираем функцию постоянного тока на нашем мультиметре, а затем подключаем красный провод к положительной клемме, а черный провод к отрицательной. Это даст нам показания напряжения.
Это даст нам показания напряжения.
Номинальное значение батареи
Вы можете видеть, что эта батарея рассчитана на 1,5 В, но когда мы протестировали ее, мы получили 1,593 В
Батарея разряжена
Когда батарея разряжена, мы получаем более низкое напряжение, это показывает 1,07 В, поэтому она полностью разряжена.
Однако иногда мы могли получить напряжение около 1,5 В, даже если батарея разряжена.
Чтобы полностью протестировать батарею, нам нужно протестировать ее под нагрузкой, чтобы проверить, может ли она еще быть полезной. Для этого нам понадобится резистор.
Test Battery
Итак, мы берем резистор около 100 Ом, хотя это не обязательно должно быть точно такое значение, но мы подключаем резистор между нашими двумя щупами. В этом случае мы просто использовали несколько зажимов типа «крокодил», чтобы соединить резистор между щупами, вот так.
Таким образом, ток будет протекать через резистор, и мы сможем снять показания напряжения, когда это произойдет. Если батарея еще в порядке, то уровень напряжения снизится лишь незначительно.
Если батарея еще в порядке, то уровень напряжения снизится лишь незначительно.
Пример батареи
Например, эта батарея имеет номинальное напряжение 1,5 В, без нагрузки 1,593 В, с подключенным резистором 1,547 В, так что это все еще хорошо.
Пример батареи
Эта батарея также рассчитана на 1,5 В, когда мы измеряем ее без нагрузки, она показывает точно 1,5 В, но когда мы подключаем резистор, она падает до 0,863 В, поэтому мы знаем, что она разрядилась.
Батарея разряжена
Но теперь, когда вы полностью заряжены, зайдите на сайт Squarespace.com и создайте свое собственное веб-присутствие в Интернете, которое содержит множество функций, позволяющих людям запускать, делиться и продвигать свои собственные проекты.
Мощные инструменты для ведения блога, чтобы демонстрировать фотографии, видео и обновления ваших проектов.
Вы можете легко планировать встречи для занятий и сессий с членами команды и клиентами с помощью встроенного инструмента. И вы даже можете собирать платежи или пожертвования, чтобы помочь поддержать ваше дело.
И вы даже можете собирать платежи или пожертвования, чтобы помочь поддержать ваше дело.
Посетите сайт Squarespace.com, чтобы получить бесплатную пробную версию, а когда будете готовы к запуску, перейдите по адресу Squarespace.com/engineeringmindset , чтобы получить скидку 10% на первую покупку веб-сайта или домена.
Как работает автомобильный аккумулятор
Свинцово-кислотный автомобильный аккумулятор 12 В. Эти большие и довольно тяжелые батареи используются в каждом автомобиле с двигателем внутреннего сгорания на планете. Они являются неотъемлемой частью автомобиля. Так что же он делает и как он работает? Об этом мы расскажем в этой статье, спонсируемой Squarespace. Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
Прокрутите вниз, чтобы посмотреть обучающее видео на YouTube.
Что такое автомобильный аккумулятор?
Свинцово-кислотный аккумулятор
Автомобильный аккумулятор на 12 В выглядит примерно так.
Это свинцово-кислотный аккумулятор. Мы называем это свинцово-кислотным аккумулятором, потому что внутри устройства находятся свинцовые пластины, погруженные в кислоту. Это создает химическую реакцию, которая высвобождает энергию и обеспечивает нас напряжением и током.
Химическая реакция
Таким образом, батарея накапливает энергию в виде химической энергии. Он не хранит электричество. Эта химическая энергия преобразуется в электрическую энергию всякий раз, когда она нам нужна. Эта батарея также является перезаряжаемой, если мы снабдим батарею электричеством, мы сможем обратить химическую реакцию вспять и перезарядить батарею.
Зарядка от генератора
Эти типы батарей могут обеспечивать большой ток, особенно по сравнению с типичными, меньшими по размеру, бытовыми щелочными батареями.
Мы рассмотрели, как работают щелочные батареи в нашей предыдущей статье, проверьте это ЗДЕСЬ.
Почему в автомобиле используется аккумулятор?
Типичный автомобильный аккумулятор находится в моторном отсеке автомобиля. Аккумулятор сначала используется для запуска двигателя, и он делает это, обеспечивая электричеством небольшой электрический двигатель, известный как стартер. Он также подает электричество в систему зажигания, чтобы начать сгорание топлива.
Стартер зацепляет небольшую шестерню на маховике двигателя. Это поворачивает коленчатый вал, который запускает двигатель внутреннего сгорания, затем маленькая шестерня отключается, и двигатель работает сам по себе. Стартер должен обеспечивать огромное усилие, чтобы иметь возможность вращать маховик, поэтому стартер потребляет чрезвычайно большой ток, возможно, сотни ампер, но только в течение нескольких секунд. Этот большой ток уменьшит энергию, хранящуюся в батарее. Так что нам нужно пополнить его обратно.
Этот большой ток уменьшит энергию, хранящуюся в батарее. Так что нам нужно пополнить его обратно.
Стартер
К двигателю подключен генератор переменного тока. Генератор вращается двигателем и при вращении вырабатывает электричество. Это подается обратно в аккумулятор для его перезарядки.
Генератор
Когда двигатель работает, генератор заряжает аккумулятор, а также обеспечивает электроэнергией такие вещи, как освещение и музыкальная система. Когда спрос на электроэнергию превышает то, что может обеспечить генератор переменного тока, батарея обеспечивает дополнительную мощность, что снова разряжает батарею.
Если двигатель выключен, генератор переменного тока перестает вращаться и заряжать аккумулятор, поэтому аккумулятор будет обеспечивать полную мощность, пока не разрядится. В этот момент батарея не может обеспечить достаточное количество электроэнергии для запуска двигателя, поэтому нам нужно запустить машину от внешнего источника.
Основные части
Давайте посмотрим на основные части автомобильного аккумулятора, а затем поймем, как он работает.
Во-первых, у нас есть пластиковый корпус, в котором все внутренние компоненты находятся на своих местах. Сверху у нас есть пластиковая крышка и две клеммы, положительная и отрицательная, которые называются клеммными колодками.
Сняв крышку, мы можем заглянуть внутрь. Обратите внимание, что корпус разделен на 6 отдельных камер, каждая из которых разделена пластиковой стенкой. Каждая камера известна как ячейка. Каждая ячейка генерирует около 2,1 вольт постоянного или постоянного тока. Каждая ячейка соединена последовательно, минус одной ячейки соединен с плюсом следующей ячейки, чтобы получить общее напряжение около 12,6 В.
6 отдельных отсеков
Это то же самое, как если бы вы соединили вместе бытовые щелочные батареи, их напряжения суммируются, чтобы обеспечить более высокое общее напряжение.
Каждая ячейка в батарее соединена с помощью пластины, сделанной из свинца. Они сварены вместе через пластиковую стенку, чтобы сформировать соединение.
Глядя на аккумулятор с этой точки зрения, мы видим, что ток течет через элементы аккумулятора от плюса к минусу, и это с использованием традиционной теории тока. На самом деле происходит то, что электроны текут в противоположном направлении от отрицательного к положительному. Но об этом чуть позже в статье.
На самом деле происходит то, что электроны текут в противоположном направлении от отрицательного к положительному. Но об этом чуть позже в статье.
Обратите внимание, что в каждой ячейке есть две пластины. Один положительный и один отрицательный. Их называют пластинчатыми ремнями, потому что каждый ремень соединен с рядом пластин, которые представляют собой листы свинца.
Пластины сформированы в виде решетчатых структур, которые максимально увеличивают площадь поверхности. Решетки покрыты пастой из оксида свинца. В пасте происходит химическая реакция, и мы увидим это чуть позже в статье. Паста действует как губка и впитывает часть жидкого электролита, что улучшает работу аккумулятора. Размер пластины определяет, какой ток может обеспечить батарея, но не меняет напряжение. Используемые материалы и количество пластин определяют напряжение, создаваемое каждой ячейкой. Сетка удерживает пасту на месте, обеспечивая равномерное распределение тока по пластине и помогает транспортировать электроны из батареи по электрической цепи.
Отрицательная пластина является анодом и представляет собой пластину из чистого свинца, хотя в нее добавляют небольшое количество добавок для упрочнения свинца и защиты от коррозии. Положительная пластина является катодом и сделана из оксида свинца. Пластины сделаны из разнородных материалов, чтобы образовалась химическая реакция и высвободились электроны. Мы не хотим, чтобы положительные и отрицательные пластины соприкасались друг с другом, это приведет к короткому замыканию батареи. Поэтому вместо этого мы помещаем каждую положительную пластину в разделитель конвертов. Это пористый материал, который позволяет ионам проходить без прямого контакта материалов друг с другом.
Положительная пластина
Положительная и отрицательная пластины расположены между собой с небольшим зазором между ними. Затем камера заполняется жидким электролитом из серной кислоты и воды. Поэтому батарея называется свинцово-кислотной.
Положительное и отрицательное
Основы электричества
Мы хотим быстро повторить основы электричества, чтобы вы поняли следующую часть того, как работает батарея.
Электроны
Электричество — это поток электронов в цепи. Нам нужно, чтобы много электронов текло в одном направлении по проводу, чтобы мы могли размещать предметы на пути электронов, например лампочки. Электроны должны будут пройти через него, и при этом они излучают свет. Когда много электронов течет в одном направлении, мы называем это током.
Атомы
Каждый материал состоит из атомов. Атомы имеют разное количество протонов, нейтронов и электронов, что и отличает материал. Некоторые материалы, такие как медь, имеют электрон, который может свободно перемещаться к другим атомам. Если мы подключим источник питания, такой как батарея, к медному проводу, напряжение будет толкать электроны, и они устремятся к положительной клемме батареи.
Мы сказали, что электроны текут от минуса к плюсу. Это известно как поток электронов, это теория того, как работает электричество, и это то, что происходит на самом деле. Но вы, возможно, привыкли видеть обычный ток, который идет от положительного к отрицательному, это исходная теория, известная как обычный ток. Это было доказано Джозефом Томпсоном, который открыл электрон и обнаружил, что они перетекают от отрицательного к положительному.
Это было доказано Джозефом Томпсоном, который открыл электрон и обнаружил, что они перетекают от отрицательного к положительному.
Джозеф Томпсон
Однако мы и по сей день используем обычную теорию тока при проектировании электрических цепей. Если мы посмотрим на эту простую схему, мы всегда должны предполагать, что ток течет от плюса к минусу, но инженеры и ученые знают, что электроны на самом деле текут в противоположном направлении. Электрические формулы, которые мы используем, по-прежнему будут давать одни и те же ответы независимо от того, в каком направлении течет электричество, поэтому это не имеет большого значения.
Постоянный ток
Существует два типа электричества: постоянный постоянный ток, который мы получаем от батарей. Электроны этого типа толкаются в одном направлении. Поэтому он называется постоянным током. Думайте об этом, как о воде, текущей по реке. Другой тип электричества — это переменный или переменный ток, который вы получаете от электрических розеток в своих домах. В этом типе электроны постоянно толкаются вперед и назад. Думайте об этом типе как о приливе и отливе моря.
В этом типе электроны постоянно толкаются вперед и назад. Думайте об этом типе как о приливе и отливе моря.
Переменный ток
Когда мы смешиваем определенные материалы вместе, мы можем вызывать химические реакции. Это когда атомы одного материала взаимодействуют с атомами другого материала. Во время этого взаимодействия атомы будут соединяться или распадаться. Электроны также могут быть высвобождены или захвачены атомами во время реакции.
Химическая реакция
Когда мы говорим об атомах, вы обычно слышите термин «ион». Ион – это атом, который имеет неравное количество протонов или электронов. Атом имеет нейтральное изменение, когда в нем одинаковое количество протонов и электронов, потому что протоны изменены положительно, а электроны заряжены отрицательно, поэтому они уравновешиваются. Если в атоме больше электронов, чем протонов, то это отрицательный ион. Если в атоме больше протонов, чем электронов, то это положительный ион.
Ион
Как это работает
Вместо того, чтобы пытаться понять эту сложную конструкцию, мы собираемся упростить ее до этой простой модели элемента с одним катодом и одним анодом.
В этой ячейке находится жидкий электролит, который на 1/3 состоит из серной кислоты и на 2/3 из воды.
У нас есть положительный электрод, который является катодом, он сделан из оксида свинца (PbO 2 )
У нас есть положительный электрод, который является анодом, он сделан из чистого свинца (Pb)
Катод и анод
Когда эти материалы объединяются, мы получаем небольшую химическую реакцию между атомами. Мы покажем атомы этих материалов с помощью этих цветных сфер.
Положительная катодная клемма оксида свинца (PbO 2 ) будет реагировать с сульфатом (SO 4 -2 ) в электролите, при этом на катоде образуется слой сульфата свинца (PbSO4) Терминал. В ходе этой реакции ион кислорода (O 2 -2 ) выбрасывается из катода в электролит. Оказавшись в электролите, эти ионы кислорода объединятся с ионами водорода (H+) с образованием воды (H 2 O).
В то же время атомы свинца на аноде будут реагировать с ионами сульфата (SO 4 -2 ) в электролите. Эта реакция создаст слой сульфата свинца (PbSO 4 ) вокруг электрода. В ходе этой реакции высвобождаются два электрона, которые собираются на отрицательном полюсе.
Эта реакция создаст слой сульфата свинца (PbSO 4 ) вокруг электрода. В ходе этой реакции высвобождаются два электрона, которые собираются на отрицательном полюсе.
Теперь у нас есть скопление электронов на отрицательной клемме. Поскольку электроны заряжены отрицательно, это означает, что у нас есть разница в заряде на двух клеммах, и мы можем измерить ее с помощью вольтметра или мультиметра.
Если вы думаете о магните, противоположные концы притягиваются, а одинаковые концы отталкиваются друг от друга. Электроны заряжены отрицательно, поэтому они отталкиваются друг от друга и притягиваются к положительной клемме, на которой меньше электронов. Но они не могут достичь этого. Если мы обеспечим путь для электронов, например провод, то электроны будут проходить через него, чтобы добраться до положительной клеммы. Затем мы можем поставить на пути этих электронов такие вещи, как лампа, и использовать их для выполнения работы, например, для освещения лампы.
Пока путь существует, химическая реакция продолжается, но это не будет длиться вечно. Химические вещества, необходимые для реакции, закончатся. Кислота разбавляется и слабеет, а сульфат свинца покрывает оба электрода. Это означает, что материалы становятся более похожими, и химическую реакцию становится труднее достичь.
Химические вещества, необходимые для реакции, закончатся. Кислота разбавляется и слабеет, а сульфат свинца покрывает оба электрода. Это означает, что материалы становятся более похожими, и химическую реакцию становится труднее достичь.
Но, к счастью, эту химическую реакцию можно обратить вспять, поэтому, если мы снабдим аккумулятор электричеством от генератора переменного тока, мы сможем начать обратную реакцию.
Возможна обратная реакция
Электроны входят в отрицательную клемму и воссоединяются с сульфатом свинца, высвобождая сульфат в электролит, оставляя только свинец на отрицательной пластине. Ионы сульфата входят в электролит и объединяются с ионом водорода, высвобождая ион кислорода, поэтому кислота электролита становится сильнее. Ион кислорода соединяется со свинцом, образуя оксид свинца, который высвобождает сульфат обратно в электролит, снова делая его прочнее.
Если бы мы оставляли аккумулятор полностью разряжаться слишком долго или слишком много раз, то было бы очень трудно обратить химическую реакцию вспять.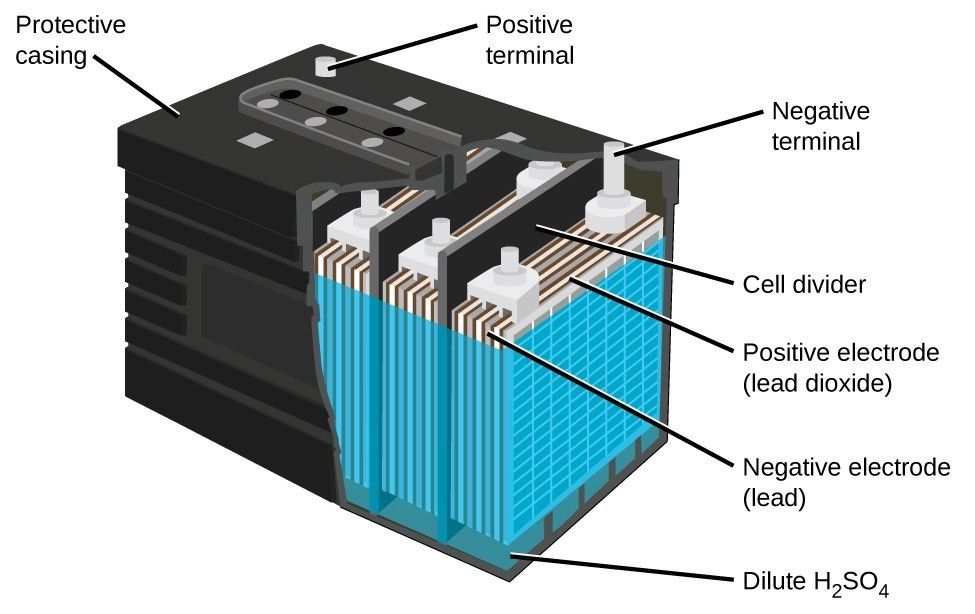 Кроме того, сульфатный слой может оторваться от электродов и акклиматизироваться на дне батареи, что означает, что он больше не участвует в химической реакции, поэтому батарею необходимо отремонтировать или заменить.
Кроме того, сульфатный слой может оторваться от электродов и акклиматизироваться на дне батареи, что означает, что он больше не участвует в химической реакции, поэтому батарею необходимо отремонтировать или заменить.
Итак, когда мы смотрим на аккумулятор, эта химическая реакция происходит между каждой пластиной в каждой ячейке, чтобы обеспечить ток в сотни ампер для запуска стартера, а также обеспечить напряжение для питания фар и т. д. Затем он перезаряжается генератор.
Проверка автомобильного аккумулятора с помощью мультиметра
Чтобы проверить напряжение автомобильного аккумулятора, мы просто переключаемся на настройку напряжения постоянного тока на нашем мультиметре, а затем подключаем красный провод к положительному, а черный провод к отрицательному. Мы должны увидеть напряжение около 12,6 В, если оно ниже 12, то батарея не работает должным образом.
Двигатель выключен
Когда мы заводим автомобиль, напряжение падает, потому что стартер потребляет огромное количество тока. Напряжение упадет примерно до 11 вольт, если оно упадет ниже 10 вольт, то батарея не работает должным образом.
Напряжение упадет примерно до 11 вольт, если оно упадет ниже 10 вольт, то батарея не работает должным образом.
Запуск двигателя
Когда двигатель работает, генератор переменного тока должен вырабатывать электричество, поэтому мы должны увидеть более высокое напряжение около 14 вольт, потому что генератор перезаряжает аккумулятор, и напряжение должно быть выше, чтобы помочь вернуть электроны обратно. и обратить вспять химическую реакцию.
Engine Running
Но теперь, когда вы полностью заряжены, зайдите на сайт Squarespace.com, чтобы создать свое собственное веб-присутствие в Интернете, которое содержит множество функций, позволяющих людям запускать, делиться и продвигать свои собственные проекты.
Мощные инструменты для ведения блога, чтобы демонстрировать фотографии, видео и обновления ваших проектов.
Вы можете легко планировать встречи для занятий и сессий с членами команды и клиентами с помощью встроенного инструмента. И вы даже можете собирать платежи или пожертвования, чтобы помочь поддержать ваше дело.



