Содержание
Углеводороды — Что такое Углеводороды?
Соединения углеводородов отличаются друг от друга количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Углеводороды (hydrocarbon) – это органические соединения, состоящие из углерода и водорода.
Углеводороды служат фундаментальной основой органической химии: молекулы любых других органических соединений рассматривают как их производные.
Соотношения между углеродом и водородом в углеводородах колеблются в широких пределах (10-90 %).
Соединения углеводородов отличаются друг от друга количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе встречаются в сырой нефти.
Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация углеводородов
Алканы (парафины) – углеводороды общей формулы CnH2n+2, в молекулах которых атомы углерода связаны между собой σ-связью, а остальные их валентности предельно насыщены атомами водорода.
Отсюда другое название алканов – предельные углеводороды.
Первым представителем данного гомологического ряда является метан СН4.
Алкены (олефины) относятся к непредельным углеводородам общей формулы CnH2n.
В молекуле алкена кроме σ-связей содержится одна π-связь.
Первый представитель гомологического ряда – этилен С2Н4, поэтому алкены называют также «этиленовыми углеводородами».
Диеновые углеводороды содержат в молекуле 2 двойные связи.
Общая формула СnН2n-2.
Первым представителем ряда является бутадиен СН2=СН–СН=СН2.
Алкинами называются углеводороды общей формулы CnH2n-2, молекулы которых содержат тройную связь.
Первый представитель гомологического ряда – ацетилен С2Н2, поэтому алкины называют также «ацетиленовыми углеводородами».
Молекулы циклоалканов содержат циклы разной величины, атомы углерода в которых связаны между собой только σ-связью.
Общая формула СnH2n.
Циклоалкены содержат одну двойную связь и имеют общую формулу СnН2n-2.
Углеводороды, имеющие кратные связи, легко вступают в реакции присоединения по месту разрыва π-связей.
Ароматические углеводороды (арены) – углеводороды общей формулы CnH2n-6.
Первые представители ароматических углеводородов были выделены из природных источников и обладали своеобразным запахом, поэтому и получили название «ароматические».
Важнейшим представителем ароматических углеводородов является бензол С6Н6.
В молекуле бензола 6 атомов углерода, соединяясь σ-связями, образуют правильный шестиугольник.
В результате сопряжения 6 свободных р-электронов образуется единое π-электронное облако над и под плоскостью кольца.
Природные источники углеводородов
Каменный уголь – плотная осадочная порода черного, иногда сepo-черного цвета, дающая на фарфоровой пластинке черную черту.
Каменный уголь представляет собой продукт глубокого разложения остатков растений, погибших миллионы лет назад (древовидных папоротников, хвощей и плаунов, а также первых голосеменных растений).
В органическом веществе угля содержится 75-92 % углерода, 2,5-5,7 % водорода, 1,5-15 % кислорода.
Международное название элемента углерода происходит от лат. carbō («уголь»).
Природный газ – полезное ископаемое, основным компонентом которого является метан СН4 (75-98 %).
В природном газе содержатся также его ближайшие гомологи: этан С2Н6, пропан С3Н8, бутан С4Н10 и следовые количества более тяжелых легкокипящих углеводородов.
Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его количество в природном газе.
Содержание сероводорода и его органических производных (тиолов) в природном газе в сумме может достигать 5-25 %.
Попутные нефтяные газы – газы, которые находятся в природе над нефтью или растворены в ней под давлением.
Их состав может быть выражен примерным соотношением компонентов: метан – 31 %, этан – 7,5 %, пропан – 21,5 %,
бутан – 20 %, пентан и гексан (легкокипящие жидкости) – 20 %.
С каждой тонной добытой нефти выделяется около 50 м3 газов, которые вплоть до середины 20го в. сжигали в факелах, причиняя двойной ущерб – теряли ценное сырье и загрязняли атмосферу.
Первым предприятием в России, на котором стали использовать попутные нефтяные газы, стала Сургутская ГРЭС.
6 основных энергоблоков, работающих на попутном газе, были введены в строй в 1985-1988 гг.
В настоящее время попутные нефтяные газы улавливают и используют как топливо (в том числе и автомобильное) и ценное химическое сырье.
Нефть – смесь углеводородов от светло-бурого до черного цвета с характерным запахом.
Нефть намного легче воды и в ней не растворяется.
В зависимости от происхождения нефть может содержать большое количество алифатических, циклических или ароматических углеводородов.
Так, например, бакинская нефть богата циклоалканами и содержит сравнительно небольшое количество алифатических предельных углеводородов.
Значительно больше алканов в грозненской, ферганской, а также нефти штата Пенсильвания (США).
Пермская нефть содержит ароматические углеводороды.
В небольших количествах в состав нефти могут входить также кислородсодержащие соединения, как, например, альдегиды, кетоны, эфиры и карбоновые кислоты.
Углеводороды С2-С5. Определение содержания оксигенатов методом газовой хроматографии с использованием пламенно-ионизационного детектора – РТС-тендер
Обозначение: ГОСТ Р 56867-2016
Статус: действующий
Название русское: Углеводороды С2-С5.
 Определение содержания оксигенатов методом газовой хроматографии с использованием пламенно-ионизационного детектора
Определение содержания оксигенатов методом газовой хроматографии с использованием пламенно-ионизационного детектораНазвание английское: Hydrocarbons C2-C5. Determination of oxygenates by gas chromatography using a flame ionization detector
Дата актуализации текста: 01.01.2021
Дата актуализации описания: 01.01.2021
Дата издания: 30.10.2019
Дата введения в действие: 01.01.2017
Область и условия применения: Настоящий стандарт устанавливает метод определения содержания органических оксигенатов в углеводородах С2-С5 методом многомерной газовой хроматографии с пламенно-ионизационным детектором. Настоящий метод используют для углеводородов с температурой конца кипения не выше 200 °С.
 В таблице 1 приведены основные определяемые оксигенаты. Линейный рабочий диапазон определения концентраций оксигенатов составляет от 0,50 до 100 мг/кг
В таблице 1 приведены основные определяемые оксигенаты. Линейный рабочий диапазон определения концентраций оксигенатов составляет от 0,50 до 100 мг/кгОпубликован: Официальное издание. М.: Стандартинформ, 2019
Утверждён в: Росстандарт
ГОСТ Р 56867-2016
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Определение содержания оксигенатов методом газовой хроматографии с использованием пламенно-ионизационного детектора
ОКС 75.160.20
Дата введения 2017-01-01
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт сырья, материалов и технологий» (ФГУП «ВНИИ СМТ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 52 «Природный и сжиженные газы»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 25 февраля 2016 г. N 70-ст
N 70-ст
4 Настоящий стандарт идентичен стандарту АСТМ Д 7423-09 (2014)* «Стандартный метод определения содержания оксигенатов в матрицах углеводородных соединений , , и методом газовой хроматографии с использованием пламенно-ионизационного детектора» (ASTM D 7423-09 (2014) «Standard test method for determination of oxygenates in , , and hydrocarbon matrices by gas chromatography and flame ionization detection», IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. — Примечание изготовителя базы данных.
Наименование настоящего стандарта изменено относительно наименования указанного стандарта АСТМ для приведения в соответствие с ГОСТ Р 1.5-2012 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Сентябрь 2019 г.
Сентябрь 2019 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
1.1 Настоящий стандарт устанавливает метод определения содержания органических оксигенатов в углеводородах методом многомерной газовой хроматографии с пламенно-ионизационным детектором. Настоящий метод используют для углеводородов с температурой конца кипения не выше 200°С. В таблице 1 приведены основные определяемые оксигенаты. Линейный рабочий диапазон определения концентраций оксигенатов составляет от 0,50 до 100 мг/кг.
Настоящий метод используют для углеводородов с температурой конца кипения не выше 200°С. В таблице 1 приведены основные определяемые оксигенаты. Линейный рабочий диапазон определения концентраций оксигенатов составляет от 0,50 до 100 мг/кг.
1.2 Настоящий метод испытаний используют для определения массовой доли каждого оксигената в углеводородных соединениях. Для идентификации оксигената используют эталонные стандарты и порядок элюирования из колонки.
1.3 Значения, указанные в единицах СИ, считаются стандартными.
1.4 В настоящем стандарте не предусмотрено рассмотрение всех вопросов обеспечения безопасности, связанных с его применением. Пользователь настоящего стандарта несет ответственность за установление соответствующих правил по технике безопасности и охране здоровья, а также определяет целесообразность применения законодательных ограничений перед его использованием.
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
2. 1 Стандарты АСТМ
1 Стандарты АСТМ
_______________
Уточнить ссылки на стандарты ACTM можно на сайте AСTM: www.astm.org или в службе поддержки клиентов AСTM: [email protected]. В информационном томе ежегодного сборника стандартов (Annual Book of ASTM Standards) следует обращаться к сводке стандартов ежегодного сборника стандартов на странице сайта.
ASTM D 1265, Standard practice for sampling liquefied petroleum (LP) gases, manual method [АСТМ Д 1265 Стандартная практика отбора проб сжиженных углеводородных (LP) газов, ручной метод]
ASTM D 1835, Standard specification for liquefied petroleum (LP) gases [АСТМ Д 1835 Стандартная спецификация на сжиженные углеводородные (LP) газы]
ASTM D 4175, Standard terminology relating to petroleum, petroleum products and lubricants (АСТМ Д 4 1 7 5 Стандартная терминология, относящаяся к нефти, нефтепродуктам и смазочным материалам)
ASTM D 6299, Standard practice for applying statistical quality assurance and control charting techniques to evaluate analytical measurement system performance (АСТМ Д 6299 Стандартная практика применения статистических методов для обеспечения качества и графиков для оценки работы измерительных систем)
ASTM D 6849, Standard practice for storage and use of liquefied petroleum gases (LPG) in sample cylinders for LPG test methods [АСТМ Д 6849 Стандартная практика хранения и использования образцов сжиженных углеводородных газов (LPG) в пробоотборниках для методов испытаний LPG]
ASTM E 355, Standard practice for gas chromatography terms and relationships (АСТМ Е 355 Стандартная практика по терминам и определениям в газовой хроматографии)
3. 1 В настоящем стандарте применены термины по АСТМ Е 355, а также следующие термины с соответствующими определениями.
1 В настоящем стандарте применены термины по АСТМ Е 355, а также следующие термины с соответствующими определениями.
3.2 Определения
3.2.1 сжиженные углеводородные газы; LPG [liquefied petroleum gases (LPG)]: Смесь газообразных углеводородов, преимущественно пропана и бутана, сжиженная при высоком давлении и/или охлаждении для облегчения хранения, транспортирования, погрузки и разгрузки (см. АСТМ Д 4175).
3.2.2 оксигенаты (oxygenates): Беззольные органические соединения, содержащие кислород, такие, как спирт или простой эфир, которые можно использовать в качестве топлива или добавки к топливу (см. АСТМ Д 4175).
3.3 Термины, характерные для настоящего стандарта
3.3.1 метод переключения Дина (Dean’s switching method): Метод, в котором аликвота пробы вводится в колонку с использованием крана-дозатора или через делитель потока газового хроматографа. Проба подается в неполярную колонку, из которой в аналитическую колонку элюируются более легкие углеводороды в порядке возрастания температур кипения, а более тяжелые углеводороды удаляются обратным потоком в вентиляционную систему. Оксигенаты элюируют из аналитической колонки и обнаруживаются пламенно-ионизационным детектором.
Проба подается в неполярную колонку, из которой в аналитическую колонку элюируются более легкие углеводороды в порядке возрастания температур кипения, а более тяжелые углеводороды удаляются обратным потоком в вентиляционную систему. Оксигенаты элюируют из аналитической колонки и обнаруживаются пламенно-ионизационным детектором.
3.3.2 метод переключения Дина с прямым вводом (Dean’s switching method with direct inject): Используют кран-дозатор, который напрямую подключается к предколонке. Метод обычно используют для определения оксигенатов в этиленовых и пропиленовых концентратах. Метод обеспечивает самые низкие пределы обнаружения, которые обычно требуются для испытания этиленовых и пропиленовых концентратов.
3.3.3 метод переключения Дина с делением потока (Dean’s switching method equipped with a split inlet): Используют кран-дозатор с делением потока для введения пробы в предколонку. Метод используют для определения оксигенатов в смесях углеводоров .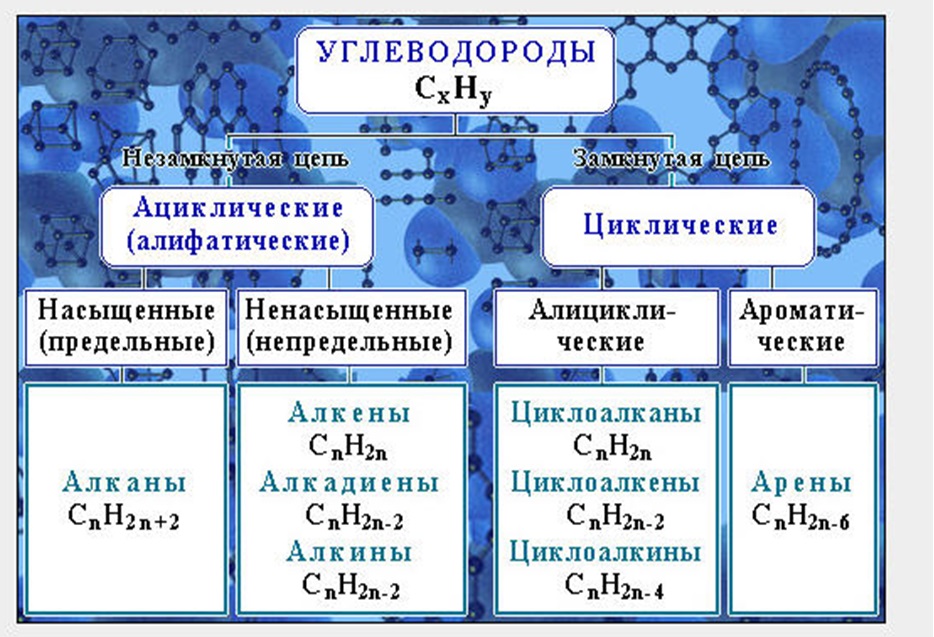 Метод не обеспечивает достижения нижнего предела обнаружения по настоящему методу испытаний. Для этого используют кран-дозатор с прямым вводом.
Метод не обеспечивает достижения нижнего предела обнаружения по настоящему методу испытаний. Для этого используют кран-дозатор с прямым вводом.
3.3.4 метод отсечного клапана (valve cut method): Обычно используется для определения оксигенатов в смесях углеводородов . Метод при использовании деления потока не обеспечивает достижения нижнего предела обнаружения по настоящему методу испытаний. Для этого используют кран-дозатор с прямым вводом.
3.3.5 метод отсечного клапана с делением потока (valve cut method equipped with a split inlet): Аликвоту пробы вводят в предколонку, используя кран-дозатор с делением потока. Пробу подают в неполярную колонку, из которой в аналитическую колонку элюируются более легкие углеводороды в порядке возрастания температур кипения, а более тяжелые углеводороды удаляются в атмосферу. Кислородсодержащие соединения элюируют из аналитической колонки и обнаруживаются пламенно-ионизационным детектором.
3. 4 Сокращения
4 Сокращения
3.4.1 DIPE — диизопропиловый эфир.
3.4.2 ЕТВЕ — этил-трет-бутиловый эфир.
3.4.3 МЕК — бутанон-2.
3.4.4 МТВЕ — метил-трет-бутиловый эфир.
3.4.5 TAME — метил-трет-амиловыйэфир.
3.4.6 PLOT — открытая капиллярная колонка с пористым слоем на стенках.
3.4.7 WCOT — открытая капиллярная колонка с неподвижной фазой, нанесенной на внутреннюю поверхность.
4.1 При испытании используют метод переключения Дина или метод отсечного клапана. Для введения пробы в предколонку используют кран-дозатор с делением потока или с прямым вводом. Кран-дозатор при прямом вводе пробы в колонку должен быть присоединен непосредственно к предколонке.
4.2 Измеряют отклик детектора и время удерживания пика каждого оксигената в калибровочном стандарте и используют для внешней калибровки отклика пламенно-ионизационного детектора. Содержание каждого оксигената вычисляют методом внешнего стандарта. Калибровочные вещества приведены в таблице 1.
Содержание каждого оксигената вычисляют методом внешнего стандарта. Калибровочные вещества приведены в таблице 1.
Таблица 1 — Оксигенаты и типичные времена удерживания
Углеводород | Определение, типы и факты
структуры обычных углеводородных соединений
Смотреть все СМИ
- Ключевые люди:
- Пьер-Эжен-Марселлен Бертло
Джордж А. Ола
Шарль-Адольф Вюрц
- Похожие темы:
- стирол
бензол
олефин
ксилол
нафталин
Просмотреть весь связанный контент →
Самые популярные вопросы
Что такое углеводород?
Углеводород – это любой класс органических химических веществ, состоящий только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
химическое соединение
Узнайте больше о химических соединениях.
Какие углеводороды наиболее широко используются в современной жизни?
Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
нефть
Узнайте больше о нефти.
ископаемое топливо
Узнайте больше об ископаемом топливе.
Существуют ли различные виды углеводородов?
- Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств.
- Алифатические (от греческого aleiphar , «жир») углеводороды получают в результате химического распада жиров или масел. Они делятся на алканы, алкены и алкины.
- Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь.

- Ароматические углеводороды составляют группу родственных веществ, получаемых путем химического разложения экстрактов некоторых приятно пахнущих растений. Их относят либо к аренам, содержащим в качестве структурной единицы бензольное кольцо, либо к небензольным ароматическим углеводородам, обладающим особой стабильностью, но не содержащим бензольного кольца.
ароматическое соединение
Узнайте больше об ароматических соединениях.
Как использование углеводородов влияет на глобальное потепление и изменение климата?
Углеводороды составляют ископаемое топливо. Одним из основных побочных продуктов сжигания ископаемого топлива является двуокись углерода (CO 2 ). Постоянно растущее использование ископаемого топлива в промышленности, на транспорте и в строительстве добавило в атмосферу Земли большое количество CO 2 . Атмосферный CO 2 концентрации колебались между 275 и 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но к 1959 г. оно увеличилось до 316 ppmv, а в 2018 г. — до 412 ppmv. CO 2 ведет себя как парниковый газ, т. е. поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
н.э. и концом 18 века, но к 1959 г. оно увеличилось до 316 ppmv, а в 2018 г. — до 412 ppmv. CO 2 ведет себя как парниковый газ, т. е. поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
глобальное потепление
Узнайте больше о глобальном потеплении.
изменение климата
Узнайте больше об изменении климата.
Сводка
Прочтите краткий обзор этой темы
углеводород , любое из класса органических химических соединений, состоящих только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Многие углеводороды встречаются в природе. Помимо того, что они составляют ископаемое топливо, они присутствуют в деревьях и растениях, как, например, в виде пигментов, называемых каротинами, которые встречаются в моркови и зеленых листьях. Более 98 процентов натурального сырого каучука представляет собой углеводородный полимер, цепочечную молекулу, состоящую из множества связанных друг с другом звеньев. Структура и химический состав отдельных углеводородов в значительной степени зависят от типов химических связей, связывающих вместе атомы составляющих их молекул.
Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств. Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические углеводороды делятся на три основные группы в зависимости от типа содержащихся в них связей: алканы, алкены и алкины. Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь. Ароматические углеводороды — это те, которые значительно более стабильны, чем можно было бы предположить по их структуре Льюиса; обладают «особой устойчивостью». Они классифицируются либо как арены, содержащие в качестве структурной единицы бензольное кольцо, либо как небензоидные ароматические углеводороды, обладающие особой стабильностью, но не имеющие в качестве структурной единицы бензольного кольца.
Эта классификация углеводородов помогает связать структурные признаки со свойствами, но не требует отнесения конкретного вещества к одному классу. Действительно, молекула обычно включает структурные единицы, характерные для двух или более семейств углеводородов. Молекула, которая содержит как тройную углерод-углеродную связь, так и бензольное кольцо, например, будет проявлять некоторые свойства, характерные для алкинов, и другие, характерные для аренов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Алканы описываются как насыщенные углеводороды, а алкены, алкины и ароматические углеводороды считаются ненасыщенными.
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, удовлетворяющие общему выражению C n H 2 n + 2 (где n — целое число). Углерод с p 3 гибридизированы (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь С—С и С—Н является сигма (σ) связью ( см. химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые своей молекулярной формулой. Для С 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — означает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Изомеры, различающиеся порядком соединения атомов, имеют разное строение и называются конституциональными изомерами. (Старое название — структурные изомеры.) Соединения n -бутан и изобутан являются конституциональными изомерами и являются единственными возможными для формулы C 4 H 10 . Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Не существует простой арифметической зависимости между количеством атомов углерода в формуле и количеством изомеров. Теория графов использовалась для расчета количества конституционно-изомерных алканов, возможных для значений 9.0048 n в C n H 2 n + 2 от 1 до 400. Число конституциональных изомеров резко возрастает с увеличением числа атомов углерода. Верхнего предела возможного числа атомов углерода в углеводородах, вероятно, не существует. В качестве примера так называемого сверхдлинного алкана синтезирован алкан СН 3 (СН 2 ) 388 СН 3 , в котором 390 атомов углерода связаны в непрерывную цепь. Несколько тысяч атомов углерода соединены вместе в молекулах углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.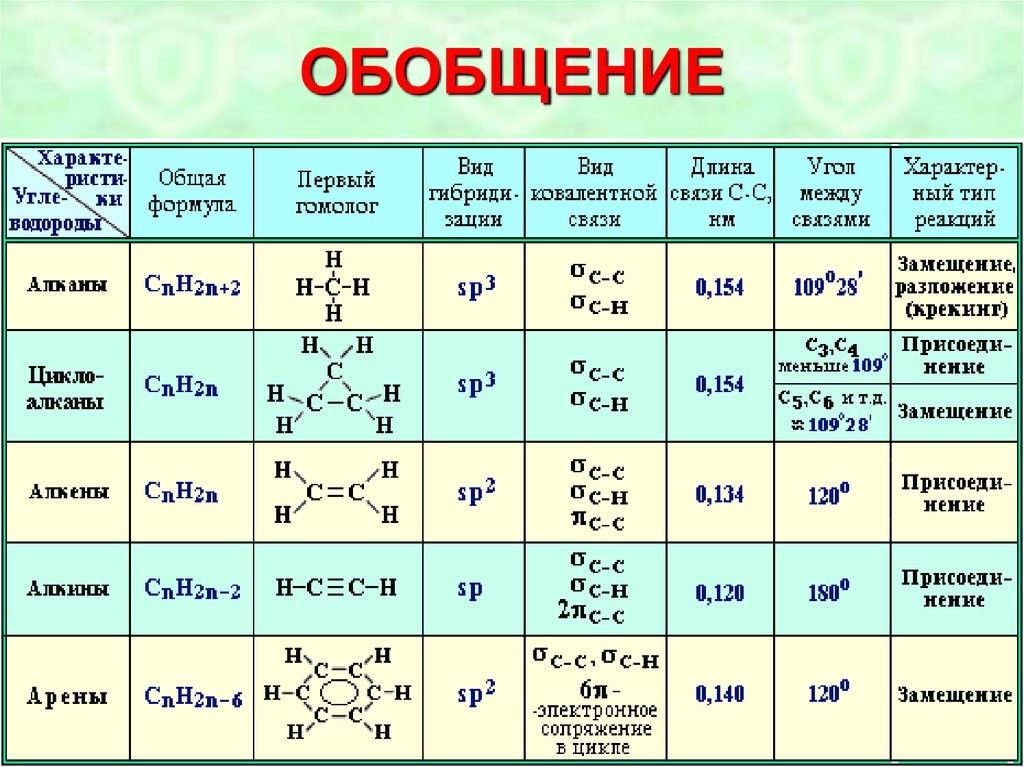
| молекулярная формула | количество конституциональных изомеров |
|---|---|
| С 3 Н 8 | 1 |
| С 4 Н 10 | 2 |
| С 5 Н 12 | 3 |
| С 6 Н 14 | 5 |
| С 7 Н 16 | 9 |
| С 8 Н 18 | 18 |
| С 9 Н 20 | 35 |
| С 10 Н 22 | 75 |
| С 15 Н 32 | 4347 |
| С 20 Н 42 | 366 319 |
| С 30 Н 62 | 4 111 846 763 |
Необходимость дать каждому соединению уникальное имя требует большего разнообразия терминов, чем доступно с описательными префиксами, такими как n — и iso-. Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Правила IUPAC присваивают названия неразветвленным алканам в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , CH 3 CH 3 и CH 3 CH 2 CH 3 соответственно Префикс n — не используется для неразветвленных алканов в систематической номенклатуре IUPAC; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан. Названия неразветвленных алканов, начиная с пятиуглеродных цепей, состоят из латинской или греческой основы, соответствующей количеству атомов углерода в цепи, за которой следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением CH 2 группы составляют гомологический ряд.
| формула алкана | имя | формула алкана | имя |
|---|---|---|---|
| СН 4 | метан | СН 3 (СН 2 ) 6 Ч 3 | октановое число |
| CH 3 CH 3 | этан | CH 3 (CH 2 ) 7 CH 3 | нонан |
| СН 3 СН 2 СН 3 | пропан | СН 3 (CH 2 ) 8 CH 3 | деканировать |
| СН 3 СН 2 СН 2 СН 3 | бутан | CH 3 (CH 2 ) 13 CH 3 | пентадекан |
| СН 3 (СН 2 ) 3 СН 3 | пентан | CH 3 (CH 2 ) 18 CH 3 | икозан |
| CH 3 (CH 2 ) 4 CH 3 | гексан | CH 3 (CH 2 ) 28 CH 3 | триаконтан |
| CH 3 (CH 2 ) 5 CH 3 | гептан | CH 3 (CH 2 ) 98 CH 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепочки атомов углерода в молекуле, называемой материнской. Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным последовательной нумерацией атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным последовательной нумерацией атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
При наличии двух или более идентичных заместителей используются повторяющиеся префиксы (ди-, три-, тетра- и т. д.) вместе с отдельным локантом для каждого заместителя. Различные заместители, такие как этил (―CH 2 CH 3 ) и метильную (―CH 3 ) группы приведены в алфавитном порядке. Реплицирующиеся префиксы игнорируются при упорядочении по алфавиту. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.
Метил и этил являются примерами алкильных групп. Алкильная группа получается из алкана путем удаления одного из его атомов водорода, в результате чего остается потенциальная точка присоединения. Метил — единственная алкильная группа, полученная из метана, а этил — единственная из этана. Есть два С 3 H 7 и четыре C 4 H 9 алкильные группы. Правила IUPAC для обозначения алканов и алкильных групп охватывают даже очень сложные структуры и регулярно обновляются. Они однозначны в том смысле, что, хотя одно соединение может иметь более одного правильного названия IUPAC, нет никакой возможности, чтобы два разных соединения имели одно и то же название.
Углеводород | Определение, типы и факты
структуры обычных углеводородных соединений
Посмотреть все СМИ
- Ключевые люди:
- Пьер-Эжен-Марселлен Бертло
Джордж А. Ола
Шарль-Адольф Вюрц
- Похожие темы:
- стирол
бензол
олефин
ксилол
нафталин
Просмотреть весь связанный контент →
Популярные вопросы
Что такое углеводород?
Углеводород – это любой класс органических химических веществ, состоящий только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
химическое соединение
Узнайте больше о химических соединениях.
Какие углеводороды наиболее широко используются в современной жизни?
Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
нефть
Узнайте больше о нефти.
ископаемое топливо
Узнайте больше об ископаемом топливе.
Существуют ли различные виды углеводородов?
- Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств.
- Алифатические (от греческого aleiphar , «жир») углеводороды получают в результате химического распада жиров или масел.
 Они делятся на алканы, алкены и алкины.
Они делятся на алканы, алкены и алкины. - Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь.
- Ароматические углеводороды составляют группу родственных веществ, получаемых путем химического разложения экстрактов некоторых приятно пахнущих растений. Их относят либо к аренам, содержащим в качестве структурной единицы бензольное кольцо, либо к небензольным ароматическим углеводородам, обладающим особой стабильностью, но не содержащим бензольного кольца.
ароматическое соединение
Узнайте больше об ароматических соединениях.
Как использование углеводородов влияет на глобальное потепление и изменение климата?
Углеводороды составляют ископаемое топливо. Одним из основных побочных продуктов сжигания ископаемого топлива является двуокись углерода (CO 2 ). Постоянно растущее использование ископаемого топлива в промышленности, на транспорте и в строительстве добавило в атмосферу Земли большое количество CO 2 . Атмосферные концентрации CO 2 колебались от 275 до 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но к 1959 г. они увеличились до 316 ppmv.и вырос до 412 частей на миллион по объему в 2018 году. CO 2 ведет себя как парниковый газ, то есть он поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
Атмосферные концентрации CO 2 колебались от 275 до 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но к 1959 г. они увеличились до 316 ppmv.и вырос до 412 частей на миллион по объему в 2018 году. CO 2 ведет себя как парниковый газ, то есть он поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
глобальное потепление
Узнайте больше о глобальном потеплении.
изменение климата
Узнайте больше об изменении климата.
Сводка
Прочтите краткий обзор этой темы
углеводород , любое из класса органических химических соединений, состоящих только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Многие углеводороды встречаются в природе. Помимо того, что они составляют ископаемое топливо, они присутствуют в деревьях и растениях, как, например, в виде пигментов, называемых каротинами, которые встречаются в моркови и зеленых листьях. Более 98 процентов натурального сырого каучука представляет собой углеводородный полимер, цепочечную молекулу, состоящую из множества связанных друг с другом звеньев. Структура и химический состав отдельных углеводородов в значительной степени зависят от типов химических связей, связывающих вместе атомы составляющих их молекул.
Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств. Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические углеводороды делятся на три основные группы в зависимости от типа содержащихся в них связей: алканы, алкены и алкины. Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь. Ароматические углеводороды — это те, которые значительно более стабильны, чем можно было бы предположить по их структуре Льюиса; обладают «особой устойчивостью». Они классифицируются либо как арены, содержащие в качестве структурной единицы бензольное кольцо, либо как небензоидные ароматические углеводороды, обладающие особой стабильностью, но не имеющие в качестве структурной единицы бензольного кольца.
Эта классификация углеводородов помогает связать структурные признаки со свойствами, но не требует отнесения конкретного вещества к одному классу. Действительно, молекула обычно включает структурные единицы, характерные для двух или более семейств углеводородов. Молекула, которая содержит как тройную углерод-углеродную связь, так и бензольное кольцо, например, будет проявлять некоторые свойства, характерные для алкинов, и другие, характерные для аренов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Алканы описываются как насыщенные углеводороды, а алкены, алкины и ароматические углеводороды считаются ненасыщенными.
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, удовлетворяющие общему выражению C n H 2 n + 2 (где n — целое число). Углерод с p 3 гибридизированы (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь С—С и С—Н является сигма (σ) связью ( см. химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые своей молекулярной формулой. Для С 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — означает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Изомеры, различающиеся порядком соединения атомов, имеют разное строение и называются конституциональными изомерами. (Старое название — структурные изомеры.) Соединения n -бутан и изобутан являются конституциональными изомерами и являются единственными возможными для формулы C 4 H 10 . Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Не существует простой арифметической зависимости между количеством атомов углерода в формуле и количеством изомеров. Теория графов использовалась для расчета количества конституционно-изомерных алканов, возможных для значений 9.0048 n в C n H 2 n + 2 от 1 до 400. Число конституциональных изомеров резко возрастает с увеличением числа атомов углерода. Верхнего предела возможного числа атомов углерода в углеводородах, вероятно, не существует. В качестве примера так называемого сверхдлинного алкана синтезирован алкан СН 3 (СН 2 ) 388 СН 3 , в котором 390 атомов углерода связаны в непрерывную цепь. Несколько тысяч атомов углерода соединены вместе в молекулах углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
| молекулярная формула | количество конституциональных изомеров |
|---|---|
| С 3 Н 8 | 1 |
| С 4 Н 10 | 2 |
| С 5 Н 12 | 3 |
| С 6 Н 14 | 5 |
| С 7 Н 16 | 9 |
| С 8 Н 18 | 18 |
| С 9 Н 20 | 35 |
| С 10 Н 22 | 75 |
| С 15 Н 32 | 4347 |
| С 20 Н 42 | 366 319 |
| С 30 Н 62 | 4 111 846 763 |
Необходимость дать каждому соединению уникальное имя требует большего разнообразия терминов, чем доступно с описательными префиксами, такими как n — и iso-. Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Правила IUPAC присваивают названия неразветвленным алканам в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , CH 3 CH 3 и CH 3 CH 2 CH 3 соответственно Префикс n — не используется для неразветвленных алканов в систематической номенклатуре IUPAC; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан. Названия неразветвленных алканов, начиная с пятиуглеродных цепей, состоят из латинской или греческой основы, соответствующей количеству атомов углерода в цепи, за которой следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением CH 2 группы составляют гомологический ряд.
| формула алкана | имя | формула алкана | имя |
|---|---|---|---|
| СН 4 | метан | СН 3 (СН 2 ) 6 Ч 3 | октановое число |
| CH 3 CH 3 | этан | CH 3 (CH 2 ) 7 CH 3 | нонан |
| СН 3 СН 2 СН 3 | пропан | СН 3 (CH 2 ) 8 CH 3 | деканировать |
| СН 3 СН 2 СН 2 СН 3 | бутан | CH 3 (CH 2 ) 13 CH 3 | пентадекан |
| СН 3 (СН 2 ) 3 СН 3 | пентан | CH 3 (CH 2 ) 18 CH 3 | икозан |
| CH 3 (CH 2 ) 4 CH 3 | гексан | CH 3 (CH 2 ) 28 CH 3 | триаконтан |
| CH 3 (CH 2 ) 5 CH 3 | гептан | CH 3 (CH 2 ) 98 CH 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепочки атомов углерода в молекуле, называемой материнской. Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным последовательной нумерацией атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным последовательной нумерацией атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
При наличии двух или более идентичных заместителей используются повторяющиеся префиксы (ди-, три-, тетра- и т. д.) вместе с отдельным локантом для каждого заместителя. Различные заместители, такие как этил (―CH 2 CH 3 ) и метильную (―CH 3 ) группы приведены в алфавитном порядке. Реплицирующиеся префиксы игнорируются при упорядочении по алфавиту. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.


 Определение содержания оксигенатов методом газовой хроматографии с использованием пламенно-ионизационного детектора
Определение содержания оксигенатов методом газовой хроматографии с использованием пламенно-ионизационного детектора В таблице 1 приведены основные определяемые оксигенаты. Линейный рабочий диапазон определения концентраций оксигенатов составляет от 0,50 до 100 мг/кг
В таблице 1 приведены основные определяемые оксигенаты. Линейный рабочий диапазон определения концентраций оксигенатов составляет от 0,50 до 100 мг/кг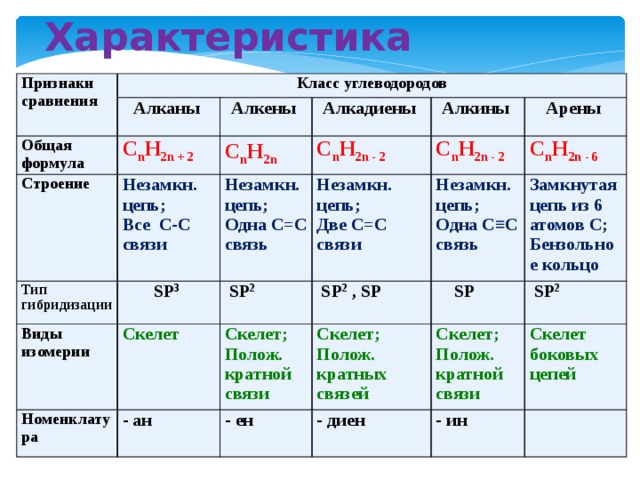
 Они делятся на алканы, алкены и алкины.
Они делятся на алканы, алкены и алкины.