Содержание
2.Основные требования, предъявляемые к деталям и узлам машин
Общие
сведения о деталях и узлах.
Машины,
механизмы, приборы, аппараты, приспособления,
инструменты и другие изделия основного
и вспомогательного производств
машиностроительных предприятий
изготовляют из деталей.
Деталью
принято называть элемент конструкции,
изготовленный из материала одной марки
без применения сборочных операций
(например, болт, гайка, вал и т. д.).
Совокупность
деталей, соединенных на предприятии
изготовителе сборочными операциями
(завинчиванием, сваркой и т. д.) и
предназначенных для совместной работы,
называют сборочной единицей (узлом).
Простейший
узел является составной частью более
сложного, который, в свою очередь,
оказывается узлом изделия, комплекса
и т. п.
Характерными
примерами узлов являются, по мере
нарастания сложности, подшипник, узел
опоры, редуктор и т. П
Понятие
машины, детали и узла (сборочной единицы)
Машина
— это устройство, которое выполняет
определенные действия с целью облегчения
физического и умственного труда человека.
Например, автомобиль является транспортной
машиной, станок для обработки каких-либо
заготовок — технологической машиной.
Дета́ль
— изготовленное, изготавливаемое, или
же подлежащее изготовлению изделие,
являющееся частью машины, или же какой
либо технической конструкции,
изготавливаемое из однородного по
структуре и свойствам материала без
применения при этом каких-либо сборочных
операций.
Узел
(сборочная единица)
— изделие, составные части которого
(детали) подверглись соединению между
собой сборочными операциями на
предприятии-изготовителе.
Требования,
которым должны отвечать отдельные
элементы конструкции машины, определяются
в первую очередь условиями ее работы
(температура, давление, действующие
нагрузки, агрессивность среды, точность
изготовления и др.) в режиме эксплуатации.
К
большинству проектируемых машин
предъявляются следующие требования:
– надежность,
Работоспособностью,
Надежностью, Технологичность,
Экономичность, Прочность,
Жесткость, Устойчивость
Понятия
работоспособности, надежности,
технологичности и экономичности.
Работоспособностью
называют состояние машин и механизмов,
при котором они способны нормально
выполнять заданные функции с параметрами,
установленными нормативно-технической
документацией (технические условия,
стандарты и т. п.)..
Надежностью
называют свойство изделия выполнять
без внеплановых ремонтов определенные
функции, сохраняя во времени значения
установленных эксплуатационных
показателей в заданных пределах.
Технологичность
– основа экономичности конструкции.
Технологичными называют изделия,
обеспечивающие заданные эксплуатационные
показатели при наименьших затратах
времени, труда, материалов и средств на
их создание в конкретных условиях
производства.
Экономичность
характеризуется
совокупностью затрат на проектирование,
изготовление и эксплуатацию изделия.
Экономическая целесообразность обычно
определяется существенным повышением
производительности либо экономией
энергоресурсов, либо увеличением
универсальности (возможностью
использования проектируемого механизма
в машинах нового поколения).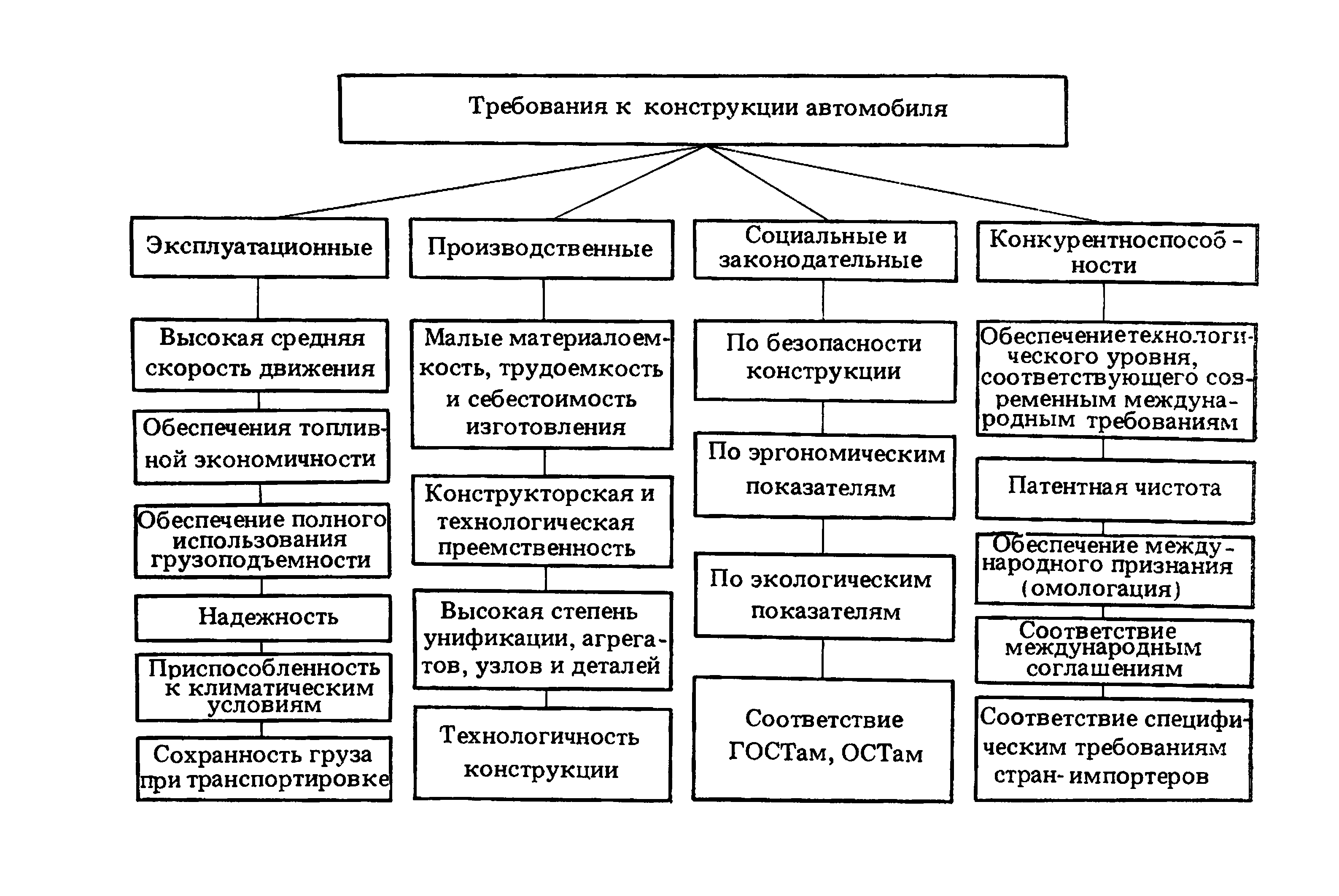
Постепенный
отказ. Отказ,
характеризующийся постепенным изменением
одного или нескольких параметров
состояния машины, называется постепенным.
Причиной могут быть различные процессы,
протекающие в ее деталях (изнашивание,
коррозия, накопление усталостных
повреждений и т. д.). Вероятность возникнове
ния постепенного отказа повышается о
увеличением длительности предыдущей
работы машины.
Внезапный
отказ. Отказ,
характеризующийся скачкообразным
изменением одного или нескольких
параметров состояния машины, называется
внезапным. Он вызывается обычно
неожиданным изменением внешних условий
или воздействий. Чаще всего это перегрузки
вследствие попадания посторонних
предметов в рабочие органы машины,
наезды, рывки при неправильном управлении
и т. д. Внезапный отказ может возникнуть
с одинаковой вероятностью независимо
от длительности предыдущей работы
машины, т. е. ее срока службы.
Основные
критерии работоспособности и расчета
деталей машин.
Работоспособность
– состояние изделия, при котором оно
способно выполнять заданные функции.
Критерии
работоспособности: прочность, жесткость,
износостойкость, виброустойчивость,
теплостойкость, коррозионная стойкость,
надежность.
Прочность
– способность детали выдерживать
приложенную нагрузку без разрушения
или возникновения пластических
деформаций. Нагрузка бывает – статическая,
усталостная, ударная => разный расчет
критериев. Т.к. нагрузка различна, при
переменной нагрузке учитывается вид
нагружения путем введения эмпирических
коэффициентов.
Жесткость
— способность деталей, сборочных единиц
сопротивляться изменению формы
под действием нагрузок.
Жесткость
вызвана собственными упругими деформациями
деталей, приближенно вычисляемыми по
формулам сопротивления материалов
и контактными деформациями (перемещениями),
определяемыми при начальном контакте
деталей по линии или в точке по формулам
Герца, а при начальном контакте по
площади — с помощью экспериментальных
зависимостей. Методы повышения
жесткости: 1) введение дополнительных
конструктивных элементов 2) оптимальная
форма сечения образца 3) применение
материалов с высокими модулями упругости.
Износостойкость
— способность материала рабочих
поверхностей деталей сопротивляться
изнашиванию.
Она
определяется видом трения (скольжения
или качения), наличием смазочного
материала, режимом трения (жидкостным,
полужидкостным, граничным и сухим),
уровнем защиты от загрязнений,
материалом и твердостью трущихся
поверхностей. Износостойкость —
важный критерий работоспособности, так
как около 90% деталей, имеющих подвижные
сопряжения, выходят из строя именно
из-за износа.
Виброустойчивость
— способность машины сопротивляться
появлению вредных вынужденных колебаний
и автоколебаний, т. е. колебаний,
вызываемых ими самими. Колебания вызывают
дополнительные деформации деталей,
снижая их циклическую прочность,
Теплостойкость
— способность машины работать при
повышенных температурах — особо
актуальна в машинах с большим
тепловыделением в рабочем процессе
(тепловые и электрические машины,
машины для горячей обработки металлов).
Теплостойкость ограничивает
работоспособность машин, поскольку
снижаются несущая способность масляного
слоя в трущихся парах и точность деталей
из-за температурных деформаций. Так,
Так,
температурные деформации лопаток турбин
могут вызвать выборку зазоров и аварию
машины.
Коррозионная
стойкость — сопротивление металлов
химическому или электрохимическому
разрушению поверхностных слоев и
коррозионной усталости. Средства борьбы
— специальное легирование или
покрытия.
Надежность
– способность сохранять свои
эксплуатационные свойства в течение
заданного срока службы. Срок службы
определяет продолжительность эксплуатации
от начала до разрушения. Ресурс –
количество циклов работы в часах или
циклах нагружения за время срока службы.
5.4. Технологические требования, предъявляемые к конструкциям деталей из порошковых материалов
Технология машиностроения / Проектирование и производство заготовок / 5.4. Технологические требования, предъявляемые к конструкциям деталей из порошковых материалов
При проектировании заготовок, учитывая особенности технологического процесса изготовления деталей из порошковых материалов, необходимо:
· максимально упрощать форму детали;
· не допускать боковых впадин, круговых канавок, обратной конусности и отверстий, не параллельных оси прессования;
· избегать тонких стенок, узких пазов, острых углов и т. п.;
п.;
· обеспечивать минимальное изменение размеров по толщине и диаметру должно быть минимальным;
· стремиться использовать круглые сечения взамен квадратных и прямоугольных;
· радиусы закругления у наружных углов выбирать не менее 2,5 мм, а у внутренних – 0,25 мм;
· при однократном холодном прессовании с последующим спеканием может быть достигнута следующая точность: 0,03…005 мм для радиальных размеров и до 0,12 мм для высотных;
· шероховатость поверхности спеченных деталей определяется шероховатостью поверхности пресс-форм, однако наличие пористости в деталях не позволяет получать полированные поверхности;
· изделия высотой (длиной) более пяти диаметров могут обладать неоднородностью; для получения высокой однородности металла отношение длины к максимальному размеру поперечного сечения не должно превышать трех;
· для получения высоких прочностных характеристик обрабатываемых деталей необходимо использовать более сложные технологические процессы, включающие двойное или тройное прессование, калибровку, горячее прессование, горячую объемную штамповку и т. д.
д.
При проектировании деталей, к точности исполнительных размеров которых предъявляют высокие требования, необходимо предусматривать припуск на их дальнейшую механическую обработку.
Наружные и внутренние резьбы следует изготавливать обработкой резанием. В конструкциях деталей необходимо избегать выступов, пазов и отверстий, расположенных перпендикулярно оси прессования. Их следует заменять соответствующими элементами, расположенными в направлении прессования, или изготавливать обработкой резанием. Узкие и длинные пазы или выступы следует заменять аналогичными элементами, повышающими жесткость и прочность конструкции. Прессование деталей сопровождается значительной усадкой, поэтому при проектировании заготовок следует избегать значительной разностенности, которая вызывает коробление и образование трещин.
При незначительной разностенности, уменьшающейся в направлении усилия прессования, в процессе прессования получают более равномерную плотность по высо
те детали. Длинные тонкостенные конструкции необходимо заменять равнозначными по эксплуатационным показателям с учетом получения равномерной плотности прессуемой детали. Толщина стенок должна быть не менее 1,0 мм. Для свободного удаления заготовки пресс-форма должна иметь незначительную конусность. При проектировании конструкций заготовок с коническими поверхностями для удобства извлечения из пресс-формы недопустима обратная конусность. Радиусы перехода сопрягающихся поверхностей должны быть не менее 0,2 мм.
Длинные тонкостенные конструкции необходимо заменять равнозначными по эксплуатационным показателям с учетом получения равномерной плотности прессуемой детали. Толщина стенок должна быть не менее 1,0 мм. Для свободного удаления заготовки пресс-форма должна иметь незначительную конусность. При проектировании конструкций заготовок с коническими поверхностями для удобства извлечения из пресс-формы недопустима обратная конусность. Радиусы перехода сопрягающихся поверхностей должны быть не менее 0,2 мм.
Общие требования к сертификации | Федеральное авиационное управление
Если это не требуется в связи с конкретной областью запрашиваемого сертификата по Части 135, для сертификации требуются следующие элементы:
Право собственности на компанию
Заявитель должен быть гражданином Соединенных Штатов Америки. Если предполагаемый держатель сертификата будет принадлежать товариществу, каждый член товарищества должен быть гражданином США, если он принадлежит корпорации или ассоциации, созданной или организованной в соответствии с законодательством Соединенных Штатов или любого штата, территории или владения Соединенные Штаты, президент и две трети или более членов совета директоров и других управляющих должны быть гражданами Соединенных Штатов, и не менее 75 процентов голосующих акций должны принадлежать или контролироваться лицами, которые являются гражданами. Соединенных Штатов или одного из их владений.
Соединенных Штатов или одного из их владений.
Основная операционная база
Во время подачи заявки заявитель должен продемонстрировать посредством документов о праве собственности, договора аренды или письма о намерениях, что он установил физическое местонахождение своей основной производственной базы.
Воздушное судно
Заявитель/эксплуатант должен иметь исключительное право пользования как минимум одним воздушным судном, отвечающим требованиям хотя бы для одного вида операций. Заявитель должен либо владеть, либо иметь договор аренды на период 6 непрерывных месяцев с момента сертификации, чтобы удовлетворить требование об исключительном использовании. Заявитель может начать процесс сертификации с письма о намерениях, показывающего, что воздушное судно будет приобретено или арендовано, но ни при каких обстоятельствах процесс сертификации не будет завершен до тех пор, пока заявитель не предоставит подходящее воздушное судно.
После определения объема эксплуатации требуется письменное заявление, подтверждающее, что воздушное судно и его оборудование соответствуют требованиям 14 CFR 135. 25, включая регистрацию, текущую сертификацию летной годности, идентификацию и текущее состояние летной годности. Владелец сертификата также должен показать, что воздушное судно соответствует требованиям для всех предполагаемых операций.
25, включая регистрацию, текущую сертификацию летной годности, идентификацию и текущее состояние летной годности. Владелец сертификата также должен показать, что воздушное судно соответствует требованиям для всех предполагаемых операций.
Требования к техническому обслуживанию для операций по части 135
В зависимости от сложности воздушного судна и объема операций техническое обслуживание для операций по части 135 является более строгим, чем для операций по части 91 операции.
Воздушные суда, сертифицированные по типу пассажирских сидений, исключая любое кресло пилота, из девяти мест или менее, должны обслуживаться в соответствии с частями 91 и 43 настоящей главы, а также §135.415, §135.417, §135.421 и §135.422. Утвержденная программа проверки воздушных судов может использоваться в соответствии с §135.419. Это может включать ежегодные проверки, 100-часовые проверки и утвержденные программы проверки воздушных судов ( AAIP ).
Воздушные суда, сертифицированные по типу конфигурации пассажирских сидений, исключая место пилота, состоящее из десяти и более мест, должны обслуживаться в соответствии с программой технического обслуживания, описанной в §135.415, §135.417, §135.423–§135.443. Сюда входит программа непрерывного поддержания летной годности ( ЛАГЕРЬ ). Дополнительную информацию см. в § 135.425 и AC 120-16G.
Кроме того, самолет и все его компоненты с рекомендованным производителем временем между капитальными ремонтами (TBO) должны соблюдаться для самолета, эксплуатируемого по сертификату Части 135. Записи о техническом обслуживании должны быть полными, без пробелов в документации, особенно для компонентов с ограниченным временем или циклом. Любые компоненты с ограниченным временем или циклом, которые имеют неполную запись о техническом обслуживании, должны быть возвращены в статус нулевого времени.
Чтобы убедиться, что самолет и записи о техническом обслуживании соответствуют требованиям Части 135, AC проведет проверку соответствия самолета.
Экономический орган
Кандидаты, подающие заявку на выполнение пригородных перевозок между штатами, должны получить Экономический орган от Департамента транспорта ( DOT ). Департамент транспорта выдает экономические полномочия, когда определяет, что заявитель «пригоден, готов и способен» осуществлять операции, и заявитель представил доказательства страхового покрытия, как описано ниже. Поскольку это является обязательным требованием для завершения сертификации, заявитель должен как можно раньше подать заявку на определение экономического органа, чтобы избежать возможных задержек.
Дополнительную информацию и формы можно найти на веб-сайте авиационной политики Министерства транспорта США.
Кандидаты, подающие заявку на выполнение межгосударственных рейсов по запросу, должны зарегистрироваться в качестве оператора воздушного такси, заполнив форму OST 4507 – Регистрация оператора воздушного такси и поправки – вместе с документом о страховом покрытии, описанным ниже, в Отдел воздушных перевозок FAA, Отдел технических программ. Претенденты должны зарегистрироваться не позднее, чем за 30 дней до начала работы
Претенденты должны зарегистрироваться не позднее, чем за 30 дней до начала работы
Формы и дополнительную информацию, в том числе руководство «Как стать авиаперевозчиком по требованию» ( PDF ) , можно найти на веб-сайте Отдела технических программ FAA.
Страхование
Все прямые авиаперевозчики США, выполняющие межштатные или зарубежные авиаперевозки, должны подать в FAA подтверждение страхового покрытия ответственности за авиакатастрофы, которое соответствует требованиям 14 CFR Part 205, с использованием формы OST 6410 — Страховой сертификат авиаперевозчиков США — Отдел воздушных перевозок, Отдел технических программ.
Копию формы и информацию для подачи можно найти на веб-сайте Отдела технических программ FAA.
Руководящий персонал
Для того, чтобы получить сертификат держателя сертификата Части 135 «Стандарт», заявитель должен указать поименно лиц, которые будут выполнять функции Директора по эксплуатации, Старшего пилота и Директора по техническому обслуживанию. Конкретные требования к опыту, необходимые для работы на этих должностях, см. в 14 AC , часть 119.71. При подаче заявки на сертификацию в качестве держателя сертификата «Базовый» или «Единый PIC» заявитель может запросить отклонение для определенных руководящих должностей. Дополнительную информацию об отклонениях руководства см. в разделе 9.0065 FSIMS AC Приказ 8900.1, том 2, глава 4, раздел 6, параграф (B) 2-463 и 8900.1, том 2, глава 2, раздел 3. должны быть представлены в AC .
Конкретные требования к опыту, необходимые для работы на этих должностях, см. в 14 AC , часть 119.71. При подаче заявки на сертификацию в качестве держателя сертификата «Базовый» или «Единый PIC» заявитель может запросить отклонение для определенных руководящих должностей. Дополнительную информацию об отклонениях руководства см. в разделе 9.0065 FSIMS AC Приказ 8900.1, том 2, глава 4, раздел 6, параграф (B) 2-463 и 8900.1, том 2, глава 2, раздел 3. должны быть представлены в AC .
Общее руководство по эксплуатации (
GOM )
Руководство держателя сертификата (см. AC Приказ 8900.1, том 3, глава 32, раздел 1 ) должно содержать операционные политики, методы и процедуры держателя сертификата. Члены экипажа обязаны соблюдать правила эксплуатации, методы и процедуры, содержащиеся в руководстве. §135.23 содержит список элементов, которые должны быть включены в ГОМ . Владельцы сертификатов, которые эксплуатируют самолеты с 9 или менее пассажирскими местами, обычно включают свои процедуры технического обслуживания в GOM . Для получения дополнительной информации о требованиях к руководству по техническому обслуживанию см. AC Приказ 8900.1, том 3, глава 32, раздел 10.
§135.23 содержит список элементов, которые должны быть включены в ГОМ . Владельцы сертификатов, которые эксплуатируют самолеты с 9 или менее пассажирскими местами, обычно включают свои процедуры технического обслуживания в GOM . Для получения дополнительной информации о требованиях к руководству по техническому обслуживанию см. AC Приказ 8900.1, том 3, глава 32, раздел 10.
Общее руководство по техническому обслуживанию (
GMM ) с 10 и более пассажирскими местами и должен включать следующие три секции:
- Административные правила и процедуры;
- Подробные инструкции по администрированию, управлению и выполнению элементов программы обслуживания держателя сертификата;
- Технические данные, описывающие стандарты, методы, приемы и процедуры технического обслуживания.
Дополнительные указания, касающиеся требований руководства по техническому обслуживанию, см. в 14 AC (§§135.21 и 135.427), если применимо, и AC , приказ 89.00.1, том 3, глава 32, раздел 11.
в 14 AC (§§135.21 и 135.427), если применимо, и AC , приказ 89.00.1, том 3, глава 32, раздел 11.
Руководство по летной эксплуатации самолета
Часть 135, § 135.81(c) требует, чтобы операторы в соответствии с Частью 135 имели актуальное руководство по летной эксплуатации (или эквивалентную информацию для некоторых самолетов, сертифицированных без руководства по летной эксплуатации). за каждое воздушное судно, используемое в их авиаперевозках. Для выполнения требований Части 135 эксплуатанты могут использовать утвержденное Руководство по летной эксплуатации самолета ( AFM ) или утвержденное Руководство по летной эксплуатации вертолета ( RFM ), в зависимости от обстоятельств, или они могут разработать, получить одобрение и использовать Руководство по летной эксплуатации компании. ( CFM ).
Дополнительные указания относительно требований руководства по летной эксплуатации см. в AC Приказ 8900.1, том 3, глава 32, раздел 5. программу обучения обращению с опасными материалами для утверждения, даже если они не собираются перевозить опасные материалы. Требования к обучению опасным веществам содержатся в Разделе 49 Кодекса США (49 USC) и Разделе 14 Свода федеральных правил (14 CFR).
Определение «работодатель, работающий с опасными веществами» и «работник, работающий с опасными веществами» можно найти в 49 USC Part 171, §171.8. Требования к обучению работе с опасными веществами изложены в 49 USC, часть 172, подраздел H, и 14 CFR, часть 135, подраздел K.
. Дополнительные указания, касающиеся требований к опасным веществам, см. в следующих источниках:
- Консультативный циркуляр 121-40: 14 CFR Часть 121 и Часть 135 Операции по перевозке опасных грузов
- Приказ 8900.1 Том 2, Глава 2, Раздел 6: Опасные материалы или опасные грузы
Программы обучения
Заявитель, за исключением того, кто использует в своей работе только одного пилота, должен представить программу обучения для членов пилотского экипажа и, если применимо, бортпроводников.
Начальный учебный план компании
Учебный план (завершенный, насколько это возможно) должен быть приложен к официальному письму-заявке. Учебные программы должны включать как минимум следующие разделы учебной программы, если это применимо, для каждой должности члена экипажа:
- Базовое обучение идеологической обработке
- Аварийное обучение
- Управление ресурсами экипажа ( CRM ) Обучение
- Начальная наземная и летная подготовка
- Обновление наземной и летной подготовки
- Периодическая наземная и летная подготовка
- Обучение переквалификации
- Отличия наземной и летной подготовки
- Переходная наземная и летная подготовка
- Опасные материалы (хазмат)
Дополнительные указания относительно требований к учебным программам см. в §135, подраздел H и FSIMS AC , Приказ 8900. 1, том 3, глава 19. Для получения дополнительной информации, связанной с использованием услуг обучения, утвержденного AC , часть 142 центре см. AC Заказ 8900.1, Vol. 3, глава 54, раздел 6.
1, том 3, глава 19. Для получения дополнительной информации, связанной с использованием услуг обучения, утвержденного AC , часть 142 центре см. AC Заказ 8900.1, Vol. 3, глава 54, раздел 6.
Требования программы борьбы с наркотиками и алкоголем
Правила Министерства транспорта ( DOT ), 49 AC , часть 40, описывает необходимые процедуры для проведения тестирования на наркотики и алкоголь на рабочем месте для транспортной отрасли, регулируемой на федеральном уровне. Все авиаперевозчики и операторы, которым требуется сертификация в соответствии с 14 AC , часть 119, и которым разрешено выполнять операции в соответствии с частью 135, должны иметь программу борьбы с наркотиками и алкоголем. См. 14 AC , часть 120. Эта программа находится в ведении Управления аэрокосмической медицины, Отдел по борьбе с наркотиками AAM-820.
Управление транспортной безопасности (
TSA ) требования к программе безопасности для держателей сертификатов Части 135
Кандидатам, которые намерены осуществлять операции в соответствии с 14 AC Часть 135, может потребоваться принять и внедрить программу безопасности, утвержденную Администрацией транспортной безопасности ( TSA ). Размер и объем требуемой программы безопасности будут основываться на нескольких факторах, включая, помимо прочего, вид выполняемых операций, максимальный сертифицированный взлетный вес воздушного судна, вместимость воздушного судна, а также то, будут ли они подниматься в воздух или покидать его. пассажиров в стерильной зоне аэропорта.
Информацию о применимости и требованиях к конкретным программам безопасности см. в 49 CFR, разделы 1544.101 (a)–(i).
Чтобы получить дополнительные указания относительно требований программы безопасности TSA и узнать, как подать заявку на утверждение вашей программы, обратитесь в TSA по номеру по адресу: charters-aircargo-s@tsa. dhs.gov.
dhs.gov.
Перечень минимального оборудования (
MEL )
При отсутствии утвержденного MEL и соответствующего разрешения на Эксплуатационную спецификацию любое воздушное судно, указанное в Эксплуатационной спецификации Части 135, имеющее неработающие приборы или оборудование, не может эксплуатироваться. Хотя это и не является абсолютным требованием, настоятельно рекомендуется, чтобы все держатели сертификатов представили MEL для каждого типа самолетов, которые они будут эксплуатировать.
Для получения дополнительной информации о MEL см. AC Приказ 8900.1, том 4, глава 4, раздел 3 и том 4, глава 4, раздел 4. турбореактивный самолет или самолет, для полетов которого в соответствии с VFR требуется два пилота, если он ранее не эксплуатировал такой самолет в полетах по Части 135 в течение как минимум 25 часов проверочных испытаний, приемлемых для Администратора. Проверочные испытания самолета, по сути, представляют собой полномасштабную симуляцию коммерческих операций, чтобы продемонстрировать способность работать независимо, безопасно и в соответствии с применимыми CFR.
Проверочные испытания самолета, по сути, представляют собой полномасштабную симуляцию коммерческих операций, чтобы продемонстрировать способность работать независимо, безопасно и в соответствии с применимыми CFR.
Закон об улучшении документации пилотов (
PRIA ) от 1996 г.
PRIA был принят для обеспечения того, чтобы авиаперевозчики надлежащим образом изучали биографию пилота, прежде чем разрешить этому пилоту выполнять полеты коммерческого авиаперевозчика. Согласно PRIA , авиаперевозчик не может принять пилота на работу до тех пор, пока он не получит и не проверит записи пилота за последние 5 лет, как указано в PRIA . Для получения дополнительной информации о PRIA см. текущий информационный циркуляр 120-68.
Часть 11, Электронные записи; Электронные подписи — объем и применение
Руководство для промышленности
1
Часть 11, Электронные записи; Электронные подписи —
Сфера применения и применение
Содержит необязательные рекомендации
В этом руководстве представлены текущие взгляды Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по этому вопросу. Он не создает и не предоставляет никаких прав для какого-либо лица и не связывает FDA или общественность. Вы можете использовать альтернативный подход, если он удовлетворяет требованиям применимых законодательных и нормативных актов. Если вы хотите обсудить альтернативный подход, свяжитесь с персоналом FDA, ответственным за внедрение этого руководства. Если вы не можете найти подходящего сотрудника FDA, позвоните по соответствующему номеру, указанному на титульном листе данного руководства.
I.
 ВВЕДЕНИЕ
ВВЕДЕНИЕ
Это руководство предназначено для описания текущего мнения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в отношении объема и применения части 11 раздела 21 Свода федеральных правил; электронные записи; Электронные подписи (21 CFR, часть 11). 2
Этот документ содержит руководство для лиц, которые в соответствии с требованием закона или другой части правил FDA ведут учет или представляют информацию в FDA 3 , выбрали ведение записей или представление указанной информации в электронном виде и в результате стали подпадать под действие части 11. Часть 11 применяется к записям в электронной форме, которые создаются, модифицируются, поддерживаются, архивируются, извлекаются или передаются. в соответствии с любыми требованиями к документации, изложенными в правилах Агентства. Часть 11 также применяется к электронным записям, представляемым в Агентство в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах (Закон) и Законом об общественном здравоохранении (Закон о PHS), даже если такие записи не указаны конкретно в правилах Агентства (§ 11. 1). Основополагающие требования, изложенные в Законе, Законе о PHS и правилах FDA (кроме части 11), упоминаются в этом руководящем документе как 9.0272 правила предикатов .
1). Основополагающие требования, изложенные в Законе, Законе о PHS и правилах FDA (кроме части 11), упоминаются в этом руководящем документе как 9.0272 правила предикатов .
В результате своей текущей инициативы по надлежащей производственной практике (CGMP) для лекарств и биологических препаратов для человека и животных, 4 FDA пересматривает часть 11, поскольку она применяется ко всем продуктам, регулируемым FDA. Мы ожидаем инициирования нормотворчества для изменения части 11 в результате повторной проверки. В этом руководстве поясняется, что мы будем узко интерпретировать объем части 11. Пока идет пересмотр части 11, мы намерены проявлять правоприменение по своему усмотрению в отношении определенных требований части 11. То есть мы не намерены предпринимать принудительные меры для обеспечения соблюдения требований части 11 в отношении проверки, контрольного журнала, хранения и копирования записей, как объясняется в этом руководстве. Тем не менее, записи должны храниться или представляться в соответствии с базовыми предикатными правилами, и Агентство может принять регулирующие меры в случае несоблюдения таких предикатных правил.
Кроме того, мы намерены действовать по своему усмотрению и не намерены предпринимать (или рекомендовать) действия для обеспечения соблюдения каких-либо требований части 11 в отношении систем, которые работали до 20 августа 1997 г., даты вступления в силу части 11 (обычно известной как устаревшие системы) при обстоятельствах, описанных в разделе III.C.3 настоящего руководства.
Обратите внимание, что часть 11 остается в силе и что это правоприменительное право применяется только так, как указано в данном руководстве.
Руководящие документы
FDA, включая это руководство, не устанавливают юридически обязательных обязанностей. Вместо этого в руководствах описывается текущее мнение Агентства по теме, и их следует рассматривать только как рекомендации, если только не указаны конкретные нормативные или законодательные требования. Использование слова вместо в руководствах Агентства означает, что что-то предлагается или рекомендуется, но не требуется.
Содержание
II. ФОН
В марте 1997 г. FDA выпустило заключительную часть 11 правил, в которых изложены критерии для принятия FDA при определенных обстоятельствах электронных записей, электронных подписей и собственноручных подписей, выполненных на электронных записях, как эквивалентных бумажным записям и собственноручным подписям, выполненным на бумаге. Эти правила, применимые ко всем программным областям FDA, были предназначены для максимально широкого использования электронных технологий, совместимых с ответственностью FDA по защите здоровья населения.
После того, как часть 11 вступила в силу в августе 1997 года, между промышленностью, подрядчиками и Агентством последовали серьезные дискуссии относительно толкования и выполнения правил. FDA (1) говорило о части 11 на многих конференциях и неоднократно встречалось с отраслевой коалицией и другими заинтересованными сторонами, чтобы узнать больше о потенциальных проблемах, связанных с частью 11; (2) опубликовал руководство по политике соответствия, CPG 7153. 17: Политика обеспечения соблюдения: 21 CFR, часть 11; электронные записи; электронные подписи; и (3) опубликовали многочисленные проекты руководящих документов, включая следующие:
17: Политика обеспечения соблюдения: 21 CFR, часть 11; электронные записи; электронные подписи; и (3) опубликовали многочисленные проекты руководящих документов, включая следующие:
- 21 CFR часть 11; электронные записи; Электронные подписи, проверка
- 21 CFR часть 11; электронные записи; Электронные подписи, глоссарий терминов
- 21 CFR часть 11; электронные записи; Электронные подписи, штампы времени
- 21 CFR часть 11; электронные записи; Электронные подписи, ведение электронных записей
- 21 CFR часть 11; электронные записи; Электронные подписи, электронные копии электронных записей
Во всех этих сообщениях высказывались опасения, что некоторые толкования требований части 11 могут (1) неоправданно ограничивать использование электронных технологий таким образом, который несовместим с заявленным намерением FDA при выпуске правила, (2) значительно увеличить затраты на соблюдение требований до такой степени, которая не предполагалась во время разработки правила, и (3) препятствовать инновациям и технологическим достижениям, не принося значительной пользы для общественного здравоохранения. Эти проблемы были подняты, в частности, в областях требований части 11 для проверки, журналов аудита, хранения записей, копирования записей и устаревших систем.
Эти проблемы были подняты, в частности, в областях требований части 11 для проверки, журналов аудита, хранения записей, копирования записей и устаревших систем.
В результате этих опасений мы решили пересмотреть документы части 11 и связанные с ними вопросы, особенно в свете инициативы Агентства по программе CGMP. В Федеральном реестре от 4 февраля 2003 г. (68 FR 5645) мы объявили об отзыве проекта руководства для промышленности, 21 CFR Part 11; электронные записи; Электронные подписи, электронные копии электронных записей . Мы решили, что хотим свести к минимуму время, затрачиваемое отраслью на рассмотрение и комментирование проекта руководства, поскольку этот проект руководства может больше не отражать наш подход в рамках инициативы CGMP. Затем в Федерального реестра от 25 февраля 2003 г. (68 FR 8775), мы объявили об отзыве части 11 проекта руководящих документов по проверке, словарю терминов, отметкам времени, 5 ведению электронных записей и CPG 7153. 17. Мы получили ценные комментарии общественности по этим проектам руководств и планируем использовать эту информацию для помощи в принятии будущих решений в отношении части 11. Мы не собираемся переиздавать эти проекты руководств или CPG.
17. Мы получили ценные комментарии общественности по этим проектам руководств и планируем использовать эту информацию для помощи в принятии будущих решений в отношении части 11. Мы не собираемся переиздавать эти проекты руководств или CPG.
В настоящее время мы пересматриваем часть 11 и ожидаем начала нормотворчества для пересмотра положений этого правила. Чтобы избежать ненужных затрат ресурсов на соблюдение требований части 11, мы выпускаем это руководство, чтобы описать, как мы намерены осуществлять правоприменение в отношении определенных требований части 11 во время повторной проверки части 11. Как упоминалось ранее, часть 11 остается в силе. эффект в течение этого периода повторной экспертизы.
Содержание
III. ОБСУЖДЕНИЕ
Общий подход к требованиям части 11
Как более подробно описано ниже, подход, изложенный в этом руководстве, основан на трех основных элементах:
- Часть 11 будет толковаться узко; сейчас мы уточняем, что меньшее количество записей будет считаться подпадающим под действие части 11.

- В отношении тех записей, которые по-прежнему подпадают под действие части 11, мы намерены осуществлять правоприменение по своему усмотрению в отношении требований части 11 в отношении проверки, журналов аудита, хранения записей и копирования записей в порядке, описанном в этом руководстве, и в отношении всех требований части 11. для систем, которые работали до даты вступления в силу части 11 (также известные как устаревшие системы).
- Мы будем применять все требования к правилам предикатов, включая требования к записи правил предикатов и ведению записей.
Важно отметить, что правоприменительные полномочия FDA, описанные в данном руководстве, ограничены конкретными требованиями части 11 (за исключением устаревших систем, в отношении которых степень правоприменительных полномочий при определенных обстоятельствах будет более широкой). Мы намерены обеспечить соблюдение всех остальных положений части 11, включая, помимо прочего, определенные элементы управления для закрытых систем в § 11.
 10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований:
10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований:- ограничение доступа к системе для уполномоченных лиц
- использование проверок операционной системы
- использование авторитетных проверок
- использование проверок устройств
- определение того, что лица, которые разрабатывают, обслуживают или используют электронные системы, имеют образование, подготовку и опыт для выполнения возложенных на них задач
- установление и соблюдение письменных политик, предусматривающих ответственность отдельных лиц за действия, инициированные с использованием их электронных подписей
- надлежащий контроль системной документации
- средства управления для открытых систем, соответствующие средствам управления для закрытых систем, отмеченным выше (§ 11.30)
- требования, относящиеся к электронным подписям (например, §§ 11.50, 11.70, 11.100, 11.200 и 11.300)
Мы ожидаем постоянного соблюдения этих положений и будем продолжать обеспечивать их соблюдение.
 Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами.
Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами.- Часть 11 будет толковаться узко; сейчас мы уточняем, что меньшее количество записей будет считаться подпадающим под действие части 11.
Детали подхода – Объем части 11
Узкое толкование области применения
Мы понимаем, что существует некоторая путаница в отношении сферы действия части 11. Некоторые понимают, что сфера действия части 11 очень широка. Мы считаем, что некоторые из этих широких толкований могут привести к ненужному контролю и затратам и могут препятствовать инновациям и технологическим достижениям, не принося дополнительной пользы для общественного здравоохранения. В результате мы хотим уточнить, что Агентство намерено узко интерпретировать объем части 11.
При узком толковании области применения части 11 в отношении записей, которые должны храниться в соответствии с предикатными правилами или представляться в FDA, когда лица предпочитают использовать записи в электронном формате вместо бумажного, будет применяться часть 11.
 С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0003
С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0003Определение записей части 11
В соответствии с этой узкой интерпретацией FDA считает, что часть 11 применима к следующим записям или подписям в электронном формате (записи или подписи части 11):
Записи, которые необходимо вести в соответствии с требованиями правила предикатов и которые ведутся в электронном формате вместо бумажного формата . С другой стороны, записи (и любые связанные с ними подписи), которые не требуется хранить в соответствии с предикатными правилами, но которые, тем не менее, хранятся в электронном формате, не являются записями части 11.

На основе правил предикатов рекомендуется определить, являются ли определенные записи записями части 11. Мы рекомендуем документировать такие решения.
Записи, которые необходимо вести в соответствии с предикатными правилами, которые хранятся в электронном формате в дополнение к бумажному формату и на которые полагаются для выполнения регулируемых действий .
В некоторых случаях фактическая деловая практика может определять, 9 ли вам 9 лет.0272 с использованием электронных записей вместо бумажных записей в соответствии с § 11.2(a). Например, если запись требуется вести в соответствии с предикатным правилом, и вы используете компьютер для создания бумажной распечатки электронных записей, но, тем не менее, вы полагаетесь на электронную запись для выполнения регулируемых действий, Агентство может считать вас с использованием электронной записи вместо бумажной. То есть Агентство может принять во внимание вашу деловую практику при определении применимости части 11.

Соответственно, мы рекомендуем, чтобы для каждой записи, которую необходимо вести в соответствии с предикатными правилами, вы заранее определили, планируете ли вы полагаться на электронную запись или бумажную запись для выполнения регулируемых действий. Мы рекомендуем вам задокументировать это решение (например, в стандартной рабочей процедуре (СОП) или спецификации).
- Записи, представленные в FDA в соответствии с предикатными правилами (даже если такие записи не указаны конкретно в правилах Агентства) в электронном формате (при условии, что записи были идентифицированы в списке № 9).2S-0251 в качестве типов документов, которые Агентство принимает в электронном формате). Однако запись, которая сама по себе не представлена, но используется при создании представления, не является записью части 11, если иное не требуется в соответствии с правилом предиката, и она ведется в электронном формате.
- Электронные подписи, предназначенные для эквивалента собственноручных подписей, инициалов и других общих подписей, требуемых правилами предикатов.
 Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ).
Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ).
- Подход к конкретным требованиям части 11
- Валидация
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении конкретных требований части 11 для проверки компьютеризированных систем (§ 11.10(a) и соответствующие требования в § 11.30). Хотя лица по-прежнему должны соблюдать все применимые требования правила предиката для проверки (например, 21 CFR 820.70(i)), это руководство не следует рассматривать как налагающее какие-либо дополнительные требования для проверки.
Мы предлагаем, чтобы ваше решение о проверке компьютеризированных систем и степень проверки учитывали влияние систем на вашу способность выполнять требования предикатных правил.
 Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему.
Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему.Мы рекомендуем вам основывать свой подход на обоснованной и задокументированной оценке рисков и определении потенциального влияния системы на качество и безопасность продукции, а также целостность записей. Например, проверка не будет важна для текстового процессора, используемого только для создания SOP.
Дополнительные рекомендации по валидации компьютеризированных систем см. в руководстве FDA для промышленности и персонала FDA Общие принципы валидации программного обеспечения , а также в отраслевых руководствах, таких как Руководство по GAMP 4 (см. ссылки).
Контрольный журнал
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении конкретных требований части 11, касающихся компьютерных контрольных журналов с отметками времени (§ 11.
 10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи.
10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи.Даже если нет требований предикатного правила для документирования, например, даты, времени или последовательности событий в конкретном случае, тем не менее может быть важно иметь контрольные журналы или другие физические, логические или процедурные меры безопасности для обеспечить достоверность и достоверность записей. 6 Мы рекомендуем основывать свое решение о применении журналов аудита или других соответствующих мер на необходимости соблюдения требований предикатных правил, обоснованной и задокументированной оценке рисков, а также на определении потенциального влияния на качество продукта и безопасность и целостность записи.
 Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.
Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.Устаревшие системы 7
Агентство намерено осуществлять правоприменение по своему усмотрению в отношении всех требований части 11 для систем, которые в противном случае находились в рабочем состоянии до 20 августа 1997 г., даты вступления в силу части 11, при обстоятельствах, указанных ниже.
Это означает, что Агентство не намерено предпринимать принудительные действия для обеспечения соблюдения каких-либо требований части 11, если для конкретной системы выполняются все следующие критерии:
- Система работала до даты вступления в силу.
- Система выполнила все применимые требования правила предиката до даты вступления в силу.
- В настоящее время система соответствует всем применимым требованиям к правилам предикатов.

- У вас есть документальное подтверждение и обоснование того, что система пригодна для использования по назначению (включая наличие приемлемого уровня безопасности и целостности записей, если применимо).
Если система была изменена с 20.08.1997, и если изменения будут препятствовать выполнению системой требований предикатного правила, элементы управления Части 11 должны применяться к записям и подписям Части 11 в соответствии с политикой принудительного применения, изложенной в этом руководстве.
Копии записей
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении конкретных требований части 11 для создания копий записей (§ 11.10 (b) и любых соответствующих требований в § 11.30). Вы должны предоставить следователю разумный и полезный доступ к записям во время проверки. Все хранящиеся у вас записи подлежат проверке в соответствии с предикатными правилами (например, §§ 211.180(c), (d) и 108.35(c)(3)(ii)).

Мы рекомендуем вам предоставлять копии электронных записей по:
- Изготовление копий записей, хранящихся в обычных переносимых форматах, когда записи ведутся в этих форматах
Использование установленных методов автоматического преобразования или экспорта, если они доступны, для создания копий в более распространенном формате (примеры таких форматов включают, помимо прочего, PDF, XML или SGML)
В каждом случае мы рекомендуем, чтобы используемый процесс копирования производил копии, сохраняющие содержание и значение записи. Если у вас есть возможность искать, сортировать или отслеживать записи части 11, копии, предоставленные Агентству, должны обеспечивать такую же возможность, если это разумно и технически осуществимо. Вы должны разрешить проверку, просмотр и копирование записей в удобочитаемой форме на вашем сайте с использованием вашего оборудования и в соответствии с установленными вами процедурами и методами доступа к записям.

Сохранение записи
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении требований части 11 по защите записей, чтобы обеспечить их точный и быстрый поиск в течение всего периода хранения записей (§ 11.10 (c) и любое соответствующее требование в § 11.30). Лица по-прежнему должны соблюдать все применимые требования предикатного правила для хранения и доступности записей (например, §§ 211.180(c),(d), 108.25(g) и 108.35(h)).
Мы предлагаем, чтобы ваше решение о том, как вести записи, основывалось на требованиях предикатного правила, и чтобы вы основывали свое решение на обоснованной и задокументированной оценке рисков и определении ценности записей с течением времени.
FDA не возражает, если вы решите архивировать требуемые записи в электронном формате на неэлектронных носителях, таких как микрофильмы, микрофиши и бумага, или в стандартном электронном формате файлов (примеры таких форматов включают, но не ограничиваются, PDF , XML или SGML).
 Лица по-прежнему должны соблюдать все требования правила предиката, а сами записи и любые копии требуемых записей должны сохранять свое содержание и значение. Пока требования правила предиката полностью удовлетворены, а содержание и значение записей сохранены и заархивированы, вы можете удалить электронную версию записей. Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0248 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей.
Лица по-прежнему должны соблюдать все требования правила предиката, а сами записи и любые копии требуемых записей должны сохранять свое содержание и значение. Пока требования правила предиката полностью удовлетворены, а содержание и значение записей сохранены и заархивированы, вы можете удалить электронную версию записей. Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0248 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей.
- Валидация
Содержание
IV. ССЫЛКИ
Справочные материалы Управления по санитарному надзору за качеством пищевых продуктов и медикаментов
- Глоссарий терминологии компьютеризированных систем и разработки программного обеспечения (Отдел полевых исследований, Управление региональных операций, Управление по вопросам регулирования, FDA 1995)
- Общие принципы проверки программного обеспечения; Окончательное руководство для промышленности и персонала FDA (FDA, Центр устройств и радиологического здоровья, Центр оценки и исследований биологических препаратов, 2002 г.
 )
) - Руководство для промышленности, рецензенты FDA и соответствие требованиям по использованию готового программного обеспечения в медицинских устройствах (FDA, Центр устройств и радиологического здоровья, 1999 г.)
- Фармацевтические CGMP для 21 века: подход, основанный на оценке риска; Научный подход и подход к регулированию качества продукции, основанный на оценке рисков, включающий комплексный подход к системам качества (FDA 2002)
Отраслевые ссылки
- Руководство по надлежащей практике автоматизированного производства (GAMP) для валидации автоматизированных систем, GAMP 4 (форум ISPE/GAMP, 2001 г.) (http://www.ispe.org/gamp/)
- ISO/IEC 17799:2000 (BS 7799:2000) Информационные технологии. Свод правил по управлению информационной безопасностью (ISO/IEC, 2000)
- ISO 14971:2002 Медицинские устройства. Применение управления рисками к медицинским устройствам (ISO, 2001)
Содержание
1 Это руководство было подготовлено Управлением по контролю за соблюдением нормативных требований Центра оценки и исследований лекарственных средств (CDER) в консультации с другими центрами Агентства и Управлением по регулированию Управления по санитарному надзору за качеством пищевых продуктов и медикаментов.
2 62 передняя 13430
3 Эти требования включают, например, определенные положения правил надлежащей производственной практики (21 CFR, часть 211), правил системы качества (21 CFR, часть 820) и правил надлежащей лабораторной практики для неклинических лабораторных исследований (21). Свод федеральных правил, часть 58).
4 См. Фармацевтические CGMP для 21 века: подход, основанный на оценке рисков; Подход к регулированию качества продукции, основанный на науке и оценке рисков, включающий комплексный подход к системам качества .
5 Несмотря на то, что мы отозвали проект руководства по отметкам времени, наше текущее мнение не изменилось в том смысле, что при использовании отметок времени для систем, охватывающих разные часовые пояса, мы не ожидаем, что вы будете записывать местное время подписывающей стороны. При использовании меток времени их следует реализовывать с четким пониманием используемой ссылки на часовой пояс.



 10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований:
10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований: Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами.
Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами. С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0003
С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0003

 Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ).
Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ).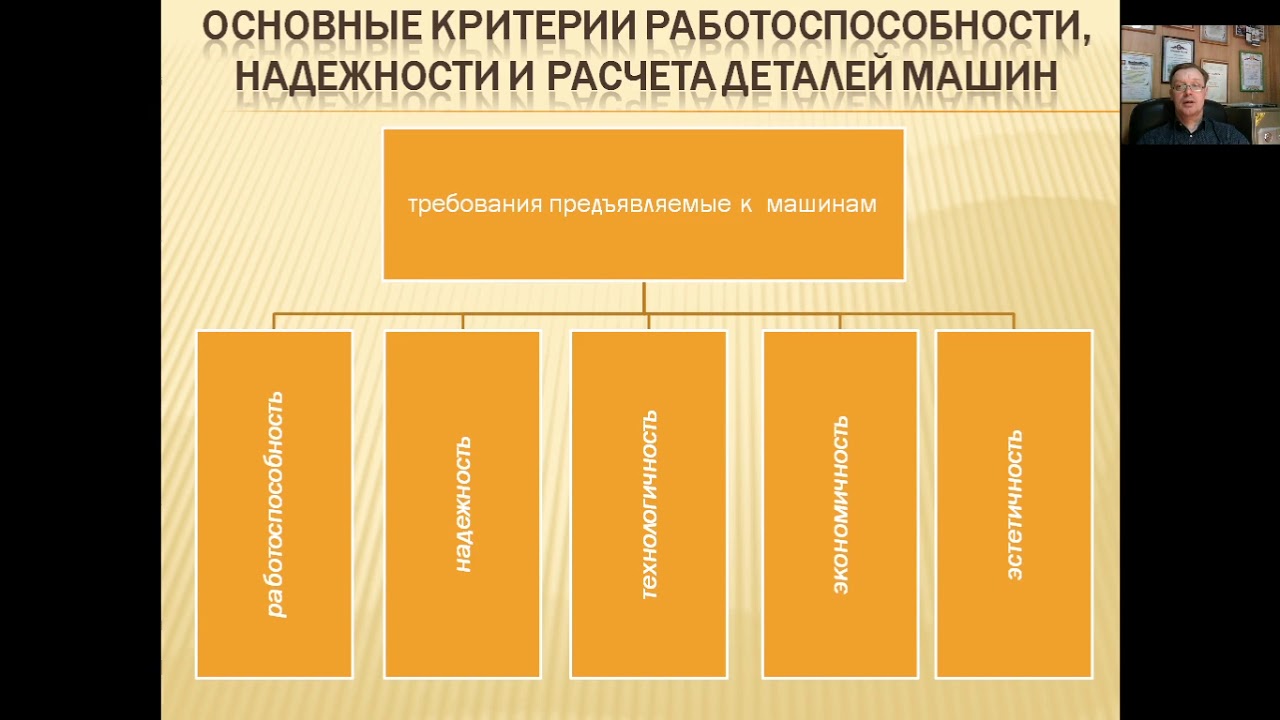 Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему.
Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему. 10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи.
10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи. Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.
Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.


 Лица по-прежнему должны соблюдать все требования правила предиката, а сами записи и любые копии требуемых записей должны сохранять свое содержание и значение. Пока требования правила предиката полностью удовлетворены, а содержание и значение записей сохранены и заархивированы, вы можете удалить электронную версию записей. Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0248 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей.
Лица по-прежнему должны соблюдать все требования правила предиката, а сами записи и любые копии требуемых записей должны сохранять свое содержание и значение. Пока требования правила предиката полностью удовлетворены, а содержание и значение записей сохранены и заархивированы, вы можете удалить электронную версию записей. Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0248 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей. )
)