Содержание
Температура горения, вспышки и кипения бензина АИ-92 1, поставка нефтепродуктов по России от компании ООО «Поставком»
Просмотров: 14 413
14.10.2021 14:20
Бензин не является однокомпонентным продуктом, поэтому единой формулы, как и фиксированных значений характеристик для него не существует. Кроме непосредственно производных нефтепродуктов в бензине присутствует большое количество присадок, которые сильно влияют на свойства итогового продукта. Поэтому для простоты исследования вопроса далее мы будем говорить о бензине самой распространенной марки – АИ-92.
Для начала давайте разберемся, что означают цифры и буквы в марке бензина. Число указывает на степень устойчивости топлива к возгоранию. И чем оно больше, тем устойчивее продукт к самовоспламенению, т. е. к способности загореться без наличия открытого огня. Чем опасна детонация, поговорим ниже, а сейчас вернемся к марке. Буквы «А» и «И» говорят о том, что бензин автомобильный, а значение октанового числа получено путем исследования.
Чем опасно самовоспламенение?
Наличие детонации – очень неприятный, а иногда и фатальный момент для двигателя. И возникновение посторонних шумов из-за столкновения волн высокого давления в цилиндрах – это только вершина айсберга. Самовоспламенение бензина АИ-92 часто приводит к куда более разрушительным последствиям. Ударная волна от детонации буквально сдирает масляную пленку, защищающую поршневые кольца и цилиндры от износа, а двигатель от перегрева. Также она приводит к тому, что в камере сгорания образуется нагар, который также нарушает работу и приводит к поломке элементов мотора.
Последствия детонации топлива в двигателе
От чего зависит и как определяется октановое число?
Октановое число бензина, полученного из сырой нефти, колеблется в пределах 40–60 единиц. Из-за чрезвычайно низкой устойчивости к детонации в него добавляют определенный набор присадок. Кроме этого, есть методы переработки нефти, которые позволяют увеличить октановое число сырого бензина путем повышения доли разветвленных и циклических углеводородов в его составе.
На сегодня существует 2 способа определения октанового числа, которые дают разные данные для одной и той же пробы: исследовательский (ГОСТ 8226) и моторный (ГОСТ 511/82). В первом случает в лабораторных условиях сравниваются 2 образца – опытный и эталонный. При проведении моторного исследования используется одноцилиндровый двигатель, который позволяет измерить степень сжатия в режиме реального времени.
Важный факт. В каждой стране принята своя система определения октанового числа. Для России эталонным считается исследовательский метод определения. А, например, США используют среднее арифметическое значений двух методов.
Температура кипения бензина
Так как АИ-92, как и другие бензины, состоит из различных фракций, то не существует единого значения для точки кипения. Так, легкие фракции начинают кипеть уже при 33°.
Производители различают несколько стадий кипения бензина в зависимости от перегоняемого объема. Первая стадия – это начало закипания, далее отслеживают, когда сгорают 10, 50 и 90 % и точку полного испарения топлива.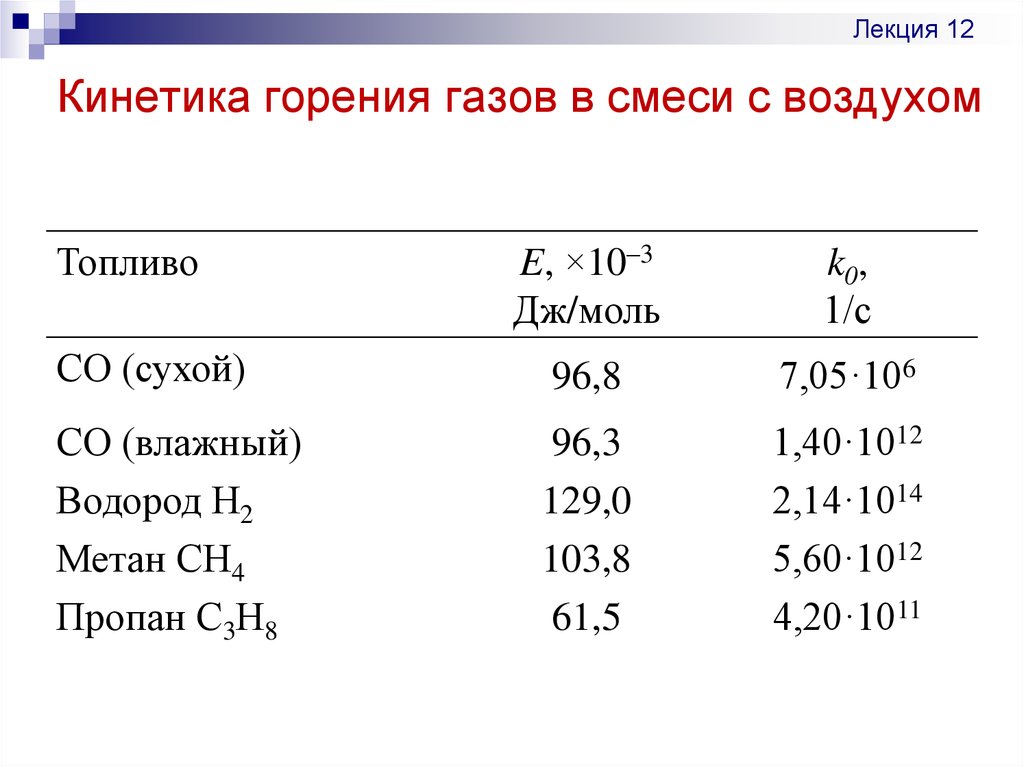 Эти значения напрямую влияют на работу двигателя.
Эти значения напрямую влияют на работу двигателя.
За температуру, при которой начинают кипеть и сгорают первые 10 % бензина, отвечают легкие фракции. Она влияет на пусковые характеристики двигателя. Чем ниже этот порог, тем проще запустить мотор при низких температурах. Поэтому зимние сорта содержат большее количество легких фракций.
Интересный факт. Еще пару десятков лет назад закипевшее при жаре топливо было достаточно распространенным явлением. Образовывающиеся при этом паровые пробки стопорили работу мотора, и приходилось ждать, пока техника остынет.
Около 50 % объема топлива называют рабочей фракцией. Она влияет на время прогрева и переход двигателя в разные режимы работы.
За температуру кипения 50–90 % бензина отвечают тяжелые фракции. Чем ниже эта температура, тем более равномерно и полнее прогорает топливо в цилиндрах. Если порог слишком высок, то часть бензина может оседать на стенках камеры в виде конденсата, впоследствии образуя нагар и смывая масляную пленку. Это снижает срок эксплуатации элементов двигателя. Кроме того, расход такого топлива сильно возрастает, что бьет по экономической составляющей. Согласно ГОСТу, оптимальной температурой кипения для тяжелых фракций считается 180 °С.
Это снижает срок эксплуатации элементов двигателя. Кроме того, расход такого топлива сильно возрастает, что бьет по экономической составляющей. Согласно ГОСТу, оптимальной температурой кипения для тяжелых фракций считается 180 °С.
В чем отличия температуры горения и вспышки АИ-92?
Вспышка происходит от открытого огня, когда концентрация паров бензина достигает интервала 0,8–8 % по объему. Важно помнить, что горит именно паровоздушная смесь. Поэтому если концентрация бензина в воздухе меньше, то возгорания не произойдет по причине недостатка горючего вещества. Если же концентрация выше порогового значения, то для возгорания уже не будет достаточно кислорода.
Не стоит путать вспышку с самовоспламенением, при котором для детонации не нужен огонь.
Обычно температуру вспышки определяют лабораторным методом, при котором в емкость, расположенную над тиглем, наливают бензин. И начинают его нагревать. При каждом повышении температуры на 1 градус над емкостью зажигается источник пламени.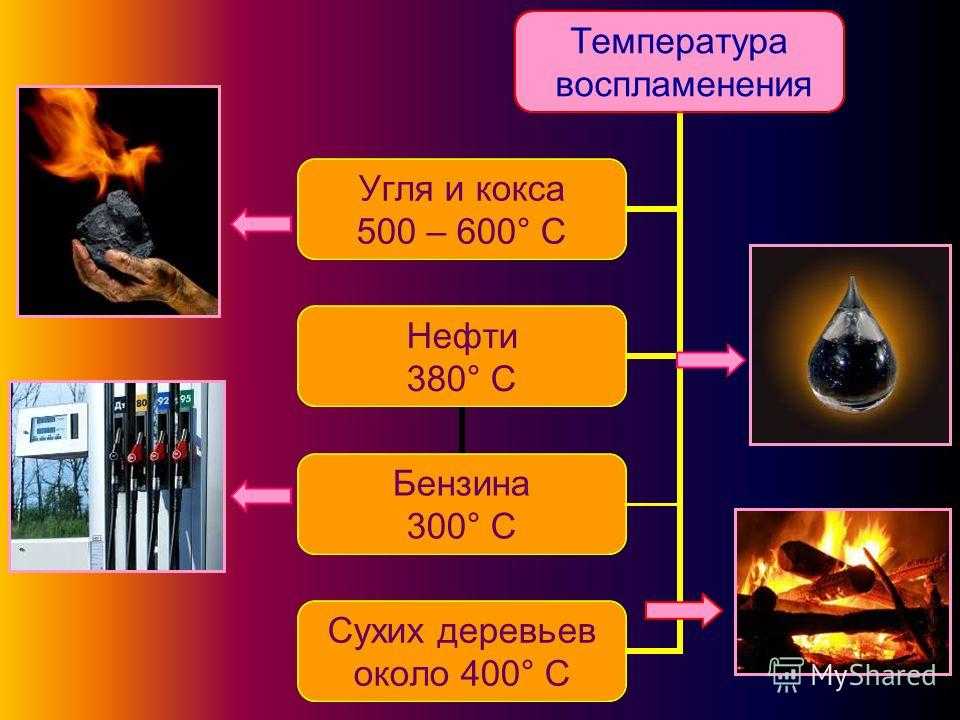 Температуру вспышки фиксируют в момент, когда появляется огонь.
Температуру вспышки фиксируют в момент, когда появляется огонь.
Вопреки расхожему мнению, температура горения бензина – это температура, которую создает топливо при сгорании. Она сильно зависит от того, в каких условиях горит бензин. Так, в двигателе температура достигает 900–1100 °С. В то время как при горении топлива на открытом воздухе она не превышает 900 °С.
Скорость горения
Октановое число влияет не только на способность бензина к самовоспламенению. Что более важно, от него зависит скорость горения топлива. Ведь чем меньше скорость сгорания, тем дольше он толкает поршень. А значит, и КПД в этом случае выше.
Меры предосторожности при хранении бензина
Что происходит при длительном хранении?
Несмотря на то что бензин – это легкогорючее вещество, при его хранении с большей вероятностью он потеряет в качестве, чем воспламенится. Дело в том, что с учетом всей опасности, бензин не так просто детонирует. Конечно, если вы не забавляетесь со спичками рядом с разлитым топливом.
Что более важно, при длительном хранении из бензина испаряются вещества, которыми доводилось октановое число. Конечно, это не приведет к тому, что он потеряет свои основные свойства. Но вот на качестве сгорания и на работе двигателя это может сказаться.
При взаимодействии с воздухом бензин склонен к окислению. В результате после сгорания на стенках камеры и в топливных каналах образуется смолянистый осадок. Что также не приносит пользу двигателю.
Во время длительного хранения часть фракций может выпадать в осадок, что приводит к засорению фильтров топливной системы.
В чем хранить?
Лучше всего хранить бензин в металлических (алюминиевых, стальных) канистрах. Пластик менее предпочтителен из-за низкой прочности и герметичности таких тар. Кроме того, он не отводит статическое электричество, что может привести к появлению искры и возгоранию. Вообще герметичность – один из наиболее важных моментов при хранении. Во-первых, неплотно закрытые тары способствуют испарению компонентов.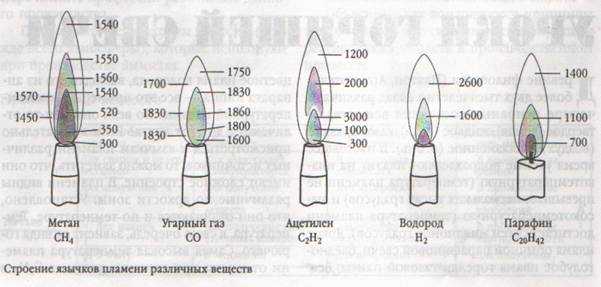 Конечно, через микрощели не может испариться сколь-нибудь большое количество самого топлива, но вот летучие фракции вполне могут. Кроме того, бензин обладает высокой текучестью и буквально просачивается даже в малейшие щели. Думаю, нет нужды говорить, чем может быть опасно разлитие бензина.
Конечно, через микрощели не может испариться сколь-нибудь большое количество самого топлива, но вот летучие фракции вполне могут. Кроме того, бензин обладает высокой текучестью и буквально просачивается даже в малейшие щели. Думаю, нет нужды говорить, чем может быть опасно разлитие бензина.
Из-за склонности к окислению необходимо следить, чтобы воздуха в таре было как можно меньше. Поэтому рекомендуется заполнять канистру на 95 %. Это также препятствует образованию конденсата на стенках. Его появление провоцирует коррозию и в итоге разрушает емкость.
Условия хранения
Высокие температуры – это то, что противопоказано бензину. Во-первых, они являются причиной усиления испарения топлива. Во-вторых, окисление бензина при высоких температурах происходит более интенсивно. Поэтому тары лучше хранить в прохладных помещениях с температурой не выше 15 °С.
Освещенность, вопреки расхожему мнению, не оказывает непосредственного влияния на хранение бензина. Запрет на нахождения емкостей под прямыми солнечными лучами связан исключительно с тем, что это приводит к перегреву и испарению топлива.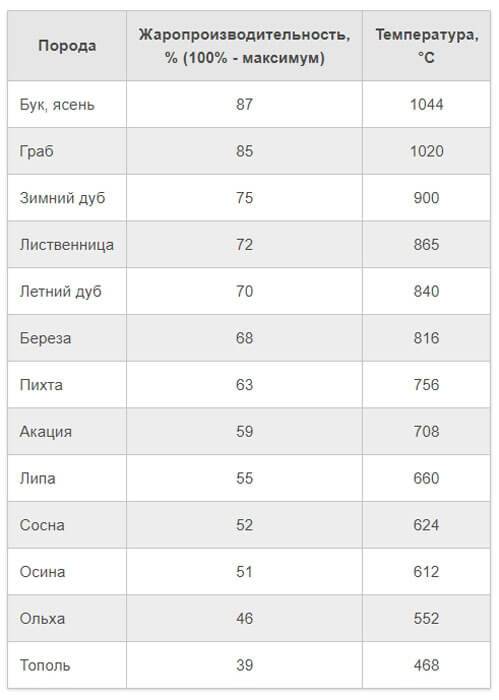
Пожарная опасность
Так как самовоспламенение бензина при нормальном давлении происходит при температурах свыше 255 °С, то при хранении топлива следует опасаться контакта с открытым огнем, а не внезапной детонации. Чтобы предотвратить возгорание, не следует использовать для хранения тары, способствующие накоплению статического электричества. Также следует внимательно относиться к герметичности емкостей. Конечно, в нормальных условиях сложно добиться нужной для вспышки концентрации паров, но это не значит, что не может загореться сам бензин.
Список литературы:
- Григорьева Л. В., Кацуба Ю. Н., Производство бензинов [Электронный ресурс] – URL: https://cyberleninka.ru/article/n/proizvodstvo-benzinov/viewer
- Ланин С. Н., Палюлин В. А., Баскин И. И., Расчет адиабатических температур горения алканов с2-с11 — компонентов нефтепродуктов методом искусственных нейронных сетей [Электронный ресурс] – URL: https://cyberleninka.ru/article/n/raschet-adiabaticheskih-temperatur-goreniya-alkanov-s2-s11-komponentov-nefteproduktov-metodom-iskusstvennyh-neyronnyh-setey/viewer
- Шишков В.
 А., Определение угла опережения зажигания при переключении с бензина на газ в зависимости от скорости горения топливной смеси [Электронный ресурс] – URL: https://cyberleninka.ru/article/n/opredelenie-ugla-operezheniya-zazhiganiya-pri-pereklyuchenii-s-benzina-na-gaz-v-zavisimosti-ot-skorosti-goreniya-toplivnoy-smesi/viewer
А., Определение угла опережения зажигания при переключении с бензина на газ в зависимости от скорости горения топливной смеси [Электронный ресурс] – URL: https://cyberleninka.ru/article/n/opredelenie-ugla-operezheniya-zazhiganiya-pri-pereklyuchenii-s-benzina-na-gaz-v-zavisimosti-ot-skorosti-goreniya-toplivnoy-smesi/viewer
8.3. Температура горения
В теплотехнике различаются следующие температуры горения газов: жаропроизводительность, калориметрическую, теоретическую и действительную (расчетную).
Жаропроизводительность tж — максимальная температура продуктов полного сгорания газа в адиабатических условиях с коэффициентом избытка воздуха α = 1,0 и при температуре газа и воздуха, равной 0°C:
tж = Qн /(ΣVcp) (8.11)
где Qн — низшая теплота сгорания газа, кДж/м3;
ΣVcp — сумма произведений объемов диоксида углерода, водяного пара и азота, образовавшихся при сгорании 1 м3 газа (м3/м3), и их средних объемных теплоемкостей при постоянном давлении в пределах температур от 0°С до tж (кДж/(м3•°С).
В силу непостоянства теплоемкости газов жаропроизводительность определяется методом последовательных приближений. В качестве начального параметра берется ее значение для природного газа (≈2000°С), при α= 1,0 определяются объемы компонентов продуктов сгорания, по табл. 8.3 находится их средняя теплоемкость и затем по формуле (8.11) считается жаропроизводительность газа. Если в результате подсчета она окажется ниже или выше принятой, то задается другая температура и расчет повторяется.
Жаропроизводительность распространенных простых и сложных газов при их горении в сухом воздухе приведена в табл. 8.5. При сжигании газов атмосферном воздухе, содержащем около 1 вес. % влаги, жаропроизводительность снижается на 25–30°С.
Калориметрическая температура горения tK — температура, определяемая без учета диссоциации водяных паров и диоксида углерода, но с учетом фактической начальной температуры газа и воздуха. Она отличается от жаропроизводительности tж тем, что температура газа и воздуха, а также коэффициент избытка воздуха α принимаются по их действительным значениям. Определить tK можно по формуле:
Определить tK можно по формуле:
tк = (Qн + qфиз)/(ΣVcp) (8.12)
где qфиз — теплосодержание (физическая теплота) газа и воздуха, отсчитываемое от 0°С, кДж/м3.
Природные и сжиженные углеводородные газы перед сжиганием обычно не нагревают, и их объем по сравнению с объемом воздуха, идущего на горение, невелик. Поэтому при определении калориметрической температуры теплосодержание газов можно не учитывать. При сжигании газов с низкой теплотой сгорания (генераторные, доменные и др.) их теплосодержание (в особенности нагретых до сжигания) оказывает весьма существенное влияние на калориметрическую температуру.
Зависимость калориметрической температуры природного газа среднего состава в воздухе с температурой 0°С и влажностью 1% от коэффициента избытка воздуха а приведена в табл. 8.5, для сжиженного углеводородного газа при его сжигании в сухом воздухе — в табл. 8.7. Данными табл. 8.5–8.7 можно с достаточной точностью руководствоваться при установлении калориметрической температуры горения других природных газов, сравнительно близких по составу, и углеводородных газов практически любого состава. При необходимости получить высокую температуру при сжигании газов с малыми коэффициентами избытка воздуха, а также для повышения КПД печей, на практике подогревают воздух, что приводит к росту калориметрической температуры (см. табл. 8.6).
При необходимости получить высокую температуру при сжигании газов с малыми коэффициентами избытка воздуха, а также для повышения КПД печей, на практике подогревают воздух, что приводит к росту калориметрической температуры (см. табл. 8.6).
Теоретическая температура горения tT — максимальная температура, определяемая аналогично калориметрической tK, но с поправкой на эндотермические (требующие теплоты) реакции диссоциации диоксида углерода и водяного пара, идущие с увеличением объема:
СО2 ‹–› СО + 0,5О2 — 283 мДж/моль (8.13)
Н2О ‹–› Н2 + 0,5О2 — 242 мДж/моль (8.14)
При высоких температурах диссоциация может привести к образованию атомарного водорода, кислорода и гидроксильных групп ОН. Кроме того, при сжигании газа всегда образуется некоторое количество оксида азота. Все эти реакции эндотермичны и приводят к снижению температуры горения.
Теоретическая температура горения может быть определена по следующей формуле:
tT = (Qн + qфиз – qдис)/(ΣVcp) (8. 15)
15)
где qдис —суммарные затраты теплоты на диссоциацию СО2 и Н2О в продуктах сгорания, кДж/м3; ΣVcp —сумма произведения объема и средней теплоемкости продуктов сгорания с учетом диссоциации на 1 м3 газа.
Как видно из табл. 8.8, при температуре до 1600°С степень диссоциации может не учитываться, и теоретическую температуру горения может принять равной калориметрической. При более высокой температуре степень диссоциации может существенно снижать температуру в рабочем пространстве. На практике особой необходимости в этом нет, теоретическую температуру горения необходимо определять только для высокотемпературных печей, работающих на предварительно нагретом воздухе (например, мартеновских). Для котельных установок в этом нужды нет.
Действительная (расчетная) температура продуктов сгорания tд — температура, которая достигается в реальных условиях в самой горячей точке факела. Она ниже теоретической и зависит от потерь теплоты в окружающую среду, степени отдачи теплоты из зоны горения излучением, растянутости процесса горения во времени и др. Действительные усредненные температуры в топках печей и котлов определяются по тепловому балансу или приближенно по теоретической или калориметрической температуре горения в зависимости от температуры в топках с введением в них экспериментально установленных поправочных коэффициентов:
Действительные усредненные температуры в топках печей и котлов определяются по тепловому балансу или приближенно по теоретической или калориметрической температуре горения в зависимости от температуры в топках с введением в них экспериментально установленных поправочных коэффициентов:
tд = tтη (8.16)
где η— т. н. пирометрический коэффициент, укладывающийся в пределах:
• для качественно выполненных термических и нагревательных печей с теплоизоляцией — 0,75–0,85;
• для герметичных печей без теплоизоляции — 0,70–0,75;
• для экранированных топок котлов — 0,60–0,75.
В практике надо знать не только приведенные выше адиабатные температуры горения, но и максимальные температуры, возникающие в пламени. Их приближенные значения обычно останавливают экспериментально методами спектрографии. Максимальные температуры, возникающие в свободном пламени на расстоянии 5–10 мм от вершины конусного фронта горения, приведены в табл. 8.9.
Анализ приведенных данных показывает, что максимальные температуры в пламени меньше жаропроизводительности (за счет затрат тепла на диссоциацию Н2О и СО2 и отвода теплоты из пламенной зоны).
Топливо > Температура вспышки
Топливо > Температура вспышки
Температура вспышки и температура самовоспламенения обычных автомобильных жидкостей
Лабораторные измерения
Лабораторные измерения температуры вспышки дают полезную информацию о температуре, при которой жидкость может выделять достаточно паров, чтобы поддерживать пламя в идеальных условиях. Измерения температуры самовоспламенения требуют дополнительной интерпретации. В лаборатории самовоспламенение измеряется путем помещения образцов в почти закрытые камеры без доступа воздуха и с помощью приборов для выявления даже хрупких и мимолетных воспламенений. Значения, показанные в следующей таблице, указывают на самые низкие возможные температуры воспламенения для перечисленных жидкостей в идеальных условиях.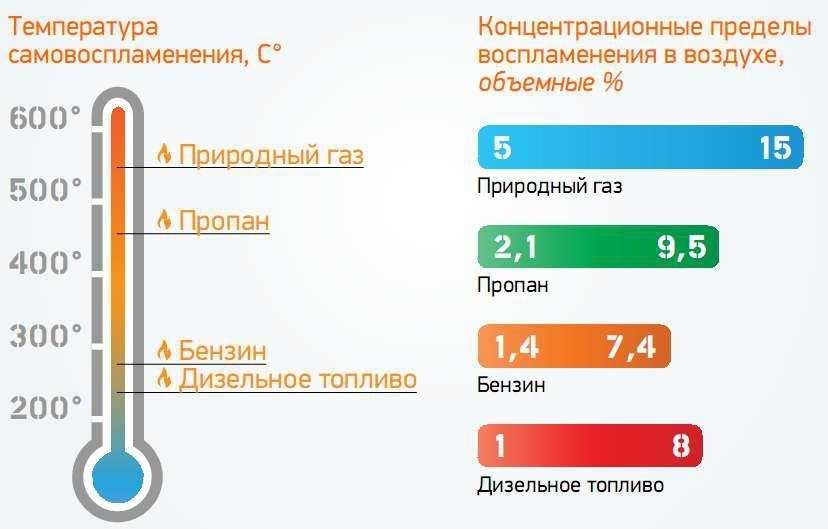
Значения в таблице представлены для общего ознакомления и не требуют запоминания. Табличные значения позволяют сравнивать относительную воспламеняемость различных жидкостей и могут использоваться в качестве источника для практических исследований пожаров.
| Жидкости | Точка возгорания [12] или F | Температура самовоспламенения [13] o F |
| Автоматическая коробка передач. Жидкость [ 2, 4] | 302-383 | 410-417 |
| Тормозная жидкость [2, 4, 10, 11] | 210-375 | 540-675 |
| Компрессорное масло (ПАГ и сложный эфир) [4, 8] | 392-500 | 410-714 |
| Охлаждающая жидкость | ||
| Этиленгликоль (100%) [ 1, 2, 4] | 232-260 | 725-775 |
| Этиленгликоль (90%) [ 2] | 270 | Н/Д |
| Пропиленгликоль (100%) [ 1, 4] | 210-230 | 700 |
| Дизельное топливо [1, 2, 3, 4] | 100-204 | 350-625 |
| Этанол (в газоголе) [ 1, 3, 5] | 55 | 685 |
| Бензин (октановое число 50-100) [1, 2] | от -36 до -45 | 536-853 |
| Бензин (неэтилированный) [ 4] | -45 | 495-833 |
| Моторное масло (обычное и синтетическое) [ 1, 2, 4] | 300-495 | 500-700 |
| Метанол (в жидкости для ветрового стекла) [ 1, 2, 3, 4, 5,14] | 52-108 | 725-878 |
| Жидкость гидроусилителя руля [ 2, 4] | 300-500 | 500-700 |
| Хладагенты | ||
R134a 140 кПа (5,5 фунтов на кв. дюйм изб.) [ 7] дюйм изб.) [ 7] | 350 | |
| R134a[ 7,15,16] | Не воспламеняется при температуре окружающей среды. и атмосферное давление | 1370-1418 |
| Фреон 12 [17] | >1382 | |
| ГХФУ-22 [ 9] | Воспламеняется при манометрическом давлении 60 фунтов на кв. дюйм | |
| Углеводородные хладагенты | Легковоспламеняющийся | Легковоспламеняющийся |
| Стартерная жидкость (этиловый эфир) [ 5,18] | -49 | 320 |
Примечание к таблице: когда разные источники имели разные значения температуры воспламенения или температуры самовоспламенения для одного и того же материала, диапазон в таблице был увеличен, чтобы включить все найденные значения.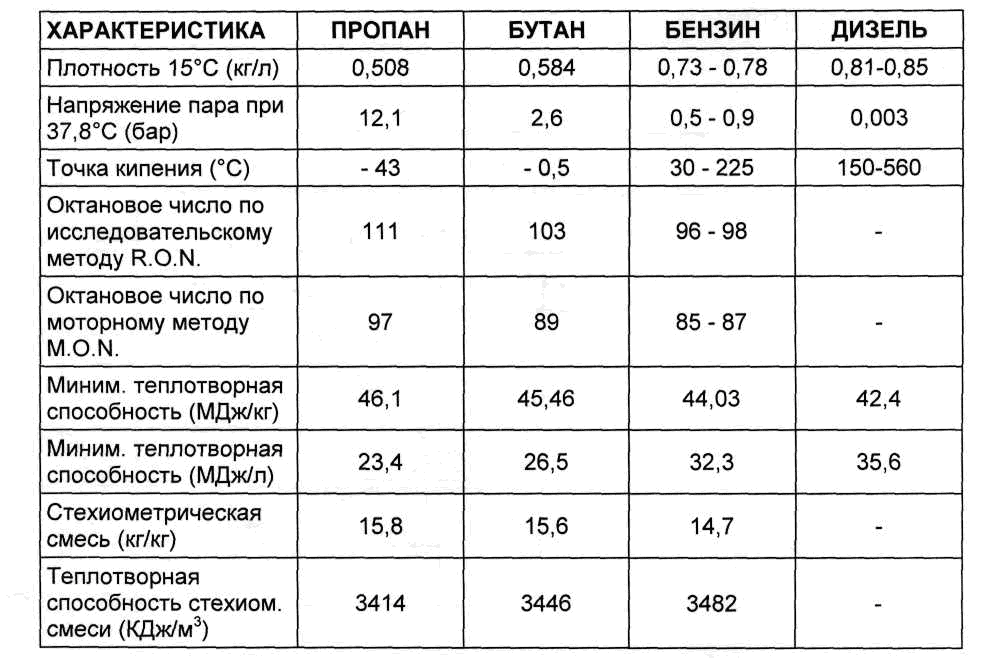
Чтобы использовать характеристики воспламеняемости в исследованиях, необходимо также провести измерения в среде транспортного средства.
Чтобы просмотреть ссылок для этой страницы, прежде чем продолжить
нажмите здесь,
Теплота сгорания
Перейти к табличным значениям
Стандартная теплота сгорания : Энергия, выделяющаяся при полном сгорании вещества X с избытком кислорода при стандартных условиях (25°C и 1 бар). С термодинамической точки зрения это отрицательное значение изменения энтальпии реакции горения.
N x + M O 2 → x CO 2 (G) + Y H 2 O (L) + Z H 2 O (L) + Z 424111111111111111111111111111111111111111111111111111111111111111111. где Z — любые другие продукты, образующиеся в ходе реакции, а n, m, x, y и z — число молей каждой молекулы в уравновешенном уравнении.
где Z — любые другие продукты, образующиеся в ходе реакции, а n, m, x, y и z — число молей каждой молекулы в уравновешенном уравнении.
Теплота сгорания используется для количественной оценки характеристик топлива в системе сгорания, такой как печи, двигатели и турбины для выработки электроэнергии. Это то же самое, что валовая теплотворная способность или энергоемкость .
В общем случае теплота сгорания может быть выражена следующим образом:
ΔH c ° = — x ΔH f °(CO 2 ,g) — 90 ° 90 4H 4 y 902 (H 2 O,l) — z ΔH f °(Z) + n ΔH f °(X) + м ΔH f °(O 2 ,g)
где ΔH c ° : теплота сгорания при стандартных условиях (25°C и 1 бар)
ΔH f : 902 стандартные условия (25°C, 1 бар)
Тогда теплота сгорания может быть рассчитана из стандартной энтальпии образования (ΔH f °) веществ, участвующих в реакции, приведенных в виде табличных значений.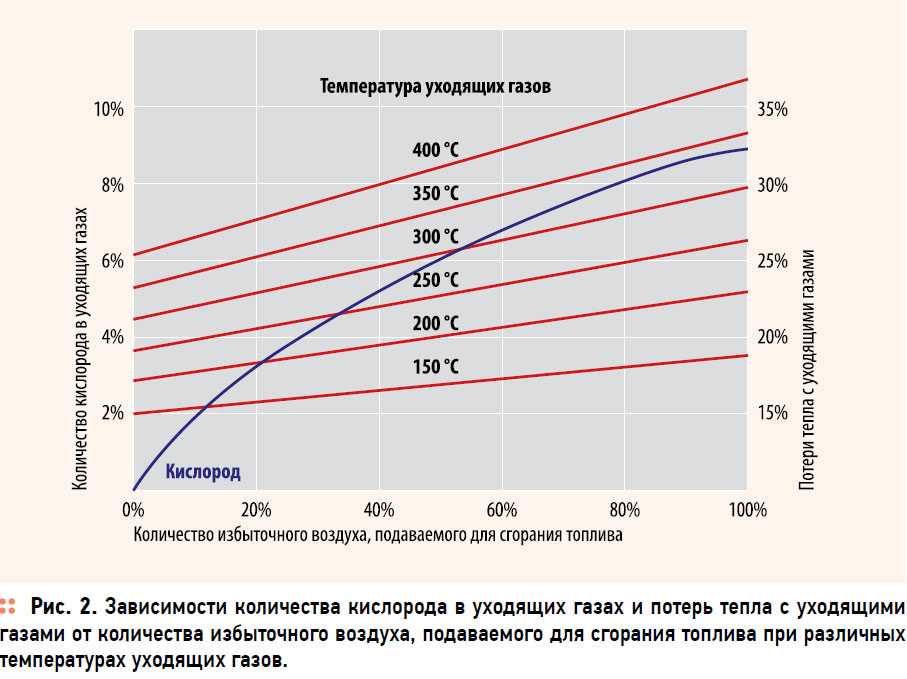
См. Ключевые значения термодинамики, согласованные на международном уровне, Стандартное состояние и энтальпия образования, Свободная энергия Гиббса образования, энтропия и теплоемкость и Стандартная энтальпия образования, Энергия Гиббса образования, энтропия и молярная теплоемкость органических веществ
Для соединений, содержащих углерод, водород и кислород (как и многие органические соединения), общее уравнение реакции горения будет иметь вид: 2 → aCO 2 (г) + ½bH 2 O (ж) + теплота сгорания
и теплота сгорания может быть рассчитана из стандартной теплоты образования всех соединений, участвующих в реакции:
ΔH с ° = -aΔH f °(CO 2 ,g) — ½b ΔH f °(H 2 O,l) + ΔH f °(C a H
= A (393. 51) + B (142,915) + ΔH F ° (C A H B O C )
51) + B (142,915) + ΔH F ° (C A H B O C )
9
Пример Пример Пример : : .
Что такое теплота сгорания жидкого этанола с формулой C 2 H 5 OH (=C 2 H 6 O)?
Для этанола константы a, b и c равны 2, 6 и 1 соответственно, а химическое уравнение сгорания этанола:
C 2 H 6 O(l) + 3O 2 (г) → 2CO 2 (г)+ 3H 2 O(ж)
Стандартная теплота образования жидкого этанола, ΔH f °(C 2 O 6 H , л), составляет -277,6 кДж/моль.
Теплота сгорания этанола, ΔH c °(C 2 H 6 O, л) = 2*393,51 + 6*142,915 + (-277,6) = 1366,91 кДж/моль Это можно перевести в кДж на единицу массы:
Молекулярная масса этанола равна (2*12,01 + 6*1,01 + 1*16,00) = 46,08 г/моль
Теплота сгорания этанола, ΔH c °(C 2 H 6 O, l) = 1366,91 [кДж/моль] * 1000 [г/кг] / 48,08 [г/моль] = 29664 кДж/кг этанола = 290,7 МДж/кг = 12754 БТЕ/фунт = 7086 ккал/кг
В таблице ниже приведены значения теплоты сгорания, рассчитанные по вышеописанному методу. Для веществ, содержащих азот, предполагается, что атомы азота превращаются в газ N 2 с ΔH f °(N 2 ) = 0 кДж/моль. В таких случаях общее уравнение применимо и к этим веществам. Если известно, что в реакциях горения образуются другие вещества, необходимо знать точные продукты, чтобы иметь возможность рассчитать теплоту сгорания.
Для веществ, содержащих азот, предполагается, что атомы азота превращаются в газ N 2 с ΔH f °(N 2 ) = 0 кДж/моль. В таких случаях общее уравнение применимо и к этим веществам. Если известно, что в реакциях горения образуются другие вещества, необходимо знать точные продукты, чтобы иметь возможность рассчитать теплоту сгорания.
Преобразование в другие единицы.
См. также Теплотворная способность топливных газов и Ископаемые виды топлива — Содержание энергии.
Для полной таблицы — повернуть экран!
| Name | Formula | State* | ΔH c ° kJ/mol | ΔH c ° kJ/g or МДж/кг | ΔH c ° kJ/kg | ΔH c ° BTU/lb | ΔH c ° kcal/kg | ||||||||||||||||||
| Acetaldehyde | C 2 H 4 O | liq | 1167 | 26. 49 49 | 26487 | 11387 | 6326 | ||||||||||||||||||
| Acetamide | C 2 H 5 NO | cry | 1185 | 20.06 | 20058 | 8623 | 4791 | ||||||||||||||||||
| Acetic acid | C 2 H 4 O 2 | liq | 874 | 14.55 | 14552 | 6256 | 3476 | ||||||||||||||||||
| Acetone | C 3 H 6 O | liq | 1790 | 30.81 | 30814 | 13248 | 7360 | ||||||||||||||||||
| Acetonitrile | C 2 H 3 N | liq | 1256 | 30.59 | 30589 | 13151 | 7306 | ||||||||||||||||||
| Acetylene (Ethyne) | C 2 H 2 | GAS | 1300 | 49,92 | 49923 | 21463 | 11924 | 21463 | 11924 | 11924 | 11924 | 11924 | 21463 | 11924 | 21463 | 0004 | l-Alanine | C 3 H 7 NO 2 | cry | 1577 | 17. 70 70 | 17697 | 7608 | 4227 | |
| Ammonia | NH 3 | Газ | 383 | 22,48 | 22477 | 9663 | 5369 | ||||||||||||||||||
| ANILINE | C 6 H 6 | 996899689968996899689968996899688 | 89968996899689 | 99688 | 8 | 999689 | 99689968996899688 | 8 | 99689968996883 | 36.43 | 36429 | 15662 | 8701 | ||||||||||||
| Anthracene | C 14 H 10 | cry | 7068 | 39.65 | 39654 | 17048 | 9471 | ||||||||||||||||||
| Benzene | C 6 H 6 | liq | 3268 | 41.83 | 41833 | 17985 | 9992 | ||||||||||||||||||
| Benzoic acid | C 7 H 6 O 2 | cry | 3228. 2 2 | 26.43 | 26432 | 11364 | 6313 | ||||||||||||||||||
| 1,3-Butadiene | C 4 H 6 | gas | 2542 | 46.99 | 46987 | 20201 | 11223 | ||||||||||||||||||
| Butane | C 4 H 10 | gas | 2878 | 49.50 | 49501 | 21282 | 11823 | ||||||||||||||||||
| 1-Butanol | C 4 H 10 | liq | 2676 | 36.09 | 36092 | 15517 | 8621 | ||||||||||||||||||
| 2-Butanone | C 4 H 8 O | liq | 2444 | 33.89 | 33888 | 14569 | 8094 | ||||||||||||||||||
| 1-Butene | C 4 H 8 | gas | 2718 | 48.43 | 48432 | 20822 | 11568 | ||||||||||||||||||
| cis-2 Butene | C 4 H 8 | GAS | 2710 | 48,29 | 48289 | 20761 | 11534 | ||||||||||||||||||
| Trans-Butene | C | ||||||||||||||||||||||||
| 0028 gas | 2706 | 48.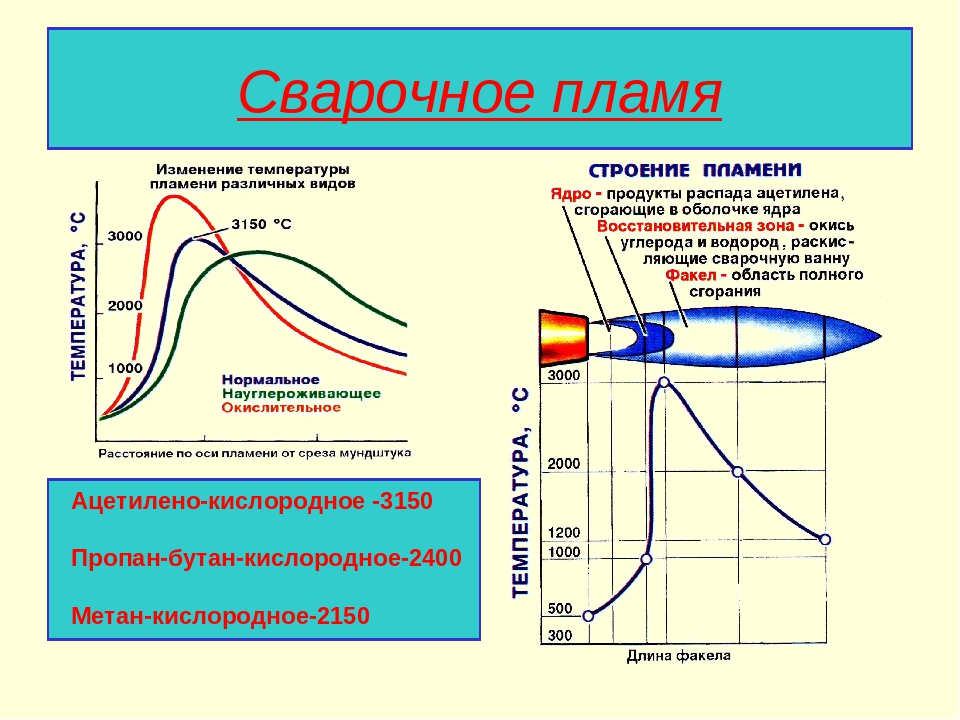 22 22 | 48218 | 20730 | 11517 | ||||||||||||||||||||
| Butanoic acid | C 4 H 8 O 2 | liq | 2183.6 | 38.91 | 38909 | 16728 | 9293 | ||||||||||||||||||
| Butylbenzene | C 10 H 14 | liq | 5872.7 | 104.65 | 104646 | 44990 | 24994 | ||||||||||||||||||
| Carbon (graphite) | C | cry | 394 | 32.81 | 32806 | 14104 | 7836 | ||||||||||||||||||
| Carbon monoxide | CO | gas | 283 | 10.10 | 10104 | 4344 | 2413 | ||||||||||||||||||
| Циклобутан | C 4 H 8 | GAS | GAS | GAS | GAS 0 H 8 | . 0028 2745.1 0028 2745.1 | 48.91 | 48914 | 21029 | 11683 | |||||||||||||||
| Cyclobutene | C 4 H 6 | gas | 2588 | 47.84 | 47837 | 20566 | 11426 | ||||||||||||||||||
| Циклогексан | C 6 H 12 | LIQ | 3920 | 46.57 | 46567 | 20020 | 111128 | 7 | 20020 | 1111229 | 7 | 20020 | 111122 | ||||||||||||
| Cyclopentane | C 5 H 10 | liq | 3291.6 | 46.92 | 46922 | 20173 | 11207 | ||||||||||||||||||
| Cyclopropane | C 3 H 6 | Газ | 2091 | 49,68 | 49679 | 21358 | 11866 | ||||||||||||||||||
| декан | C 10 H 22 | C 10 H 22 6 | 10 H 22 6 | C 10 H 22 9 | C 10 H 22 9 | C 10 H 22 9 | 9. 0028 liq 0028 liq | 6778 | 47.63 | 47625 | 20475 | 11375 | |||||||||||||
| Diethyl ether (ethoxyethane) | C 4 H 10 O | liq | 2724 | 36.74 | 36741 | 15796 | 8775 | ||||||||||||||||||
| Dimethyl ether (methoxymethane) | C 2 H 6 O | gas | 1460 | 31.68 | 31684 | 13622 | 7568 | ||||||||||||||||||
| Ethane | C 2 H 6 | gas | 1561 | 51.89 | 51895 | 22311 | 12395 | ||||||||||||||||||
| 1,2-Ethanediol | C 2 H 6 O 2 | liq | 1185 | 19.09 | 19088 | 8206 | 4559 | ||||||||||||||||||
| Ethanol | C 2 H 6 O | liq | 1367 | 29. 67 67 | 29666 | 12754 | 7086 | ||||||||||||||||||
| Ethyl acetate | C 4 H 8 O 2 | liq | 2238 | 25.40 | 25397 | 10919 | 6066 | ||||||||||||||||||
| Ethylene (ethene) | C 2 H 4 | gas | 1411 | 50.29 | 50285 | 21619 | 12010 | ||||||||||||||||||
| Formaldehyde | CH 2 O | gas | 571 | 19.01 | 19014 | 8175 | 4541 | ||||||||||||||||||
| Formic acid | CH 2 O 2 | LIQ | 254 | 5,52 | 5518 | 2372 | 1318 | ||||||||||||||||||
| 0028 Glycerol | C 3 H 8 O 3 | liq | 1654 | 17.96 | 17957 | 7720 | 4289 | ||||||||||||||||||
| Heptane | C 7 H 16 | liq | 4817 | 48. 06 06 | 48059 | 20662 | 11479 | ||||||||||||||||||
| Heptanoic acid | C 7 H 14 O 2 | liq | 4145.2 | 31.83 | 31835 | 13687 | 7604 | ||||||||||||||||||
| Hexane | C 6 H 14 | liq | 4163 | 48.31 | 48307 | 20767 | 11538 | ||||||||||||||||||
| Гексадекановая кислота | C 16 H 32 O 2 | LIQ | 10031,3 | 39,11 9006 | 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39 39.112 | 16815 | 9342 | ||||||||||||||||||
| Hexanoic acid | C 6 H 12 O 2 | liq | 3492.2 | 30. 06 06 | 30059 | 12923 | 7179 | ||||||||||||||||||
| Hydrazine | N 2 H 4 | liq | 622 | 19.40 | 19401 | 8341 | 4634 | ||||||||||||||||||
| Hydrogen | H 2 | gas | 286 | 141.58 | 141584 | 60870 | 33817 | ||||||||||||||||||
| Hydrogen cyanide | CHN | gas | 672 | 24.86 | 24861 | 10688 | 5938 | ||||||||||||||||||
| Ketene | C 2 H 2 O | GAS | 1025 | 24.38 | 24382 | 10482 | 24382 | 10482 | 24382 | 10482 | 24382 | 10482 | 0006 | 5824 | |||||||||||
| Methane | CH 4 | gas | 891 | 55. 51 51 | 55514 | 23867 | 13259 | ||||||||||||||||||
| Methanol | CH 4 O | liq | 726 | 22,65 | 22652 | 9739 | 5410 | ||||||||||||||||||
| Метилацетат | C 3 H 6 O 2 | 1592 | 21.49 | 21487 | 9238 | 5132 | |||||||||||||||||||
| Methylamine | CH 5 N | gas | 1086 | 34.95 | 34953 | 15027 | 8348 | ||||||||||||||||||
| Метилциклогексан | C 7 H 14 | LIQ | 4565.3 | 46,48 | 46485 | 19985 | 96485 | 19985 | |||||||||||||||||
| 19985 | |||||||||||||||||||||||||
| 19985 | 19985 | 0006 | |||||||||||||||||||||||
| Methylcyclopentane | C 6 H 12 | liq | 3938. 1 1 | 46.78 | 46782 | 20113 | 11174 | ||||||||||||||||||
| Methyl formate | C 2 H 4 O 2 | LIQ | 973 | 16.20 | 16200 | 6965 | 3869 | ||||||||||||||||||
| Метила-терт-бутиловый эфир | C | ||||||||||||||||||||||||
| .0249 5 H 12 O | liq | 3369 | 38.21 | 38209 | 16427 | 9126 | |||||||||||||||||||
| Naphthalene | C 10 H 8 | cry | 5157 | 40.23 | 40232 | 17294 | 9609 | ||||||||||||||||||
| Оксид азота | NO | GAS | 91 | 3,03 | 3032 9006 | 1304 | 3,03 | 3032 9006 | 1304 1304 9004 | 9003 | 3032 9006 | 1304 1304 1304 9004 | 3,03 | 3032 | 13028 13028 9006 | 3,03 | 3032 | 13028 1304 9006 | 3,03 | 3032 | 3,03 | 3032 | 724 | ||
| Nitrobenzene | C 6 H 5 NO 2 | liq | 3088 | 25. 08 08 | 25081 | 10783 | 5990 | ||||||||||||||||||
| Nitromethane | CH 3 NO 2 | LIQ | 710 | 11,63 | 11630 | 50009 | 2778 | ||||||||||||||||||
| Атлеус оксид | N | ||||||||||||||||||||||||
| .0249 2 O | gas | 82 | 1.86 | 1863 | 801 | 445 | |||||||||||||||||||
| Nonane | C 9 H 20 | liq | 6125 | 47.74 | 47743 | 20526 | 11403 | ||||||||||||||||||
| Octane | C 8 H 18 | liq | 5470 | 47.87 | 47873 | 20582 | 11434 | ||||||||||||||||||
| 1-Octanol | C 8 H 18 O | liq | 5294 | 40.64 | 40642 | 17473 | 9707 | ||||||||||||||||||
| Pentane | C 5 H 12 | LIQ | 3509 | 48. 62 62 | 48621 | 20903 | 11613 | ||||||||||||||||||
| Pentanoic Aud | |||||||||||||||||||||||||
| .10 O 2 | liq | 2837.3 | 27.78 | 27776 | 11942 | 6634 | |||||||||||||||||||
| 1-Pentanol | C 5 H 12 O | liq | 3331 | 37.78 | 37779 | 16242 | 9023 | ||||||||||||||||||
| Phenanthrene | C 14 H 10 | cry | 7055 | 39.58 | 39581 | 17017 | 9454 | ||||||||||||||||||
| Phenol | C 6 H 6 O | cry | 3054 | 32.45 | 32448 | 13950 | 7750 | ||||||||||||||||||
| Propanal | C 3 H 6 O | LIQ | 1522 | 26. 20 20 | 26201 | 11264 | 6258 | ||||||||||||||||||
| Propane | C 8 C 8 C9008 C 8 C | ||||||||||||||||||||||||
| .0249 3 H 8 | gas | 2220 | 50.33 | 50329 | 21638 | 12021 | |||||||||||||||||||
| Propanenitrile | C 3 H 5 N | liq | 1911 | 34.69 | 34689 | 14914 | 8285 | ||||||||||||||||||
| Propanoic acid | C 3 H 6 O 2 | liq | 1527.3 | 20.61 | 20614 | 8862 | 4924 | ||||||||||||||||||
| 1-Propanol | C 3 H 8 O | liq | 2021 | 33.62 | 33622 | 14455 | 8030 | ||||||||||||||||||
| 2-Propanol | C 3 H 8 O | liq | 2006 | 33.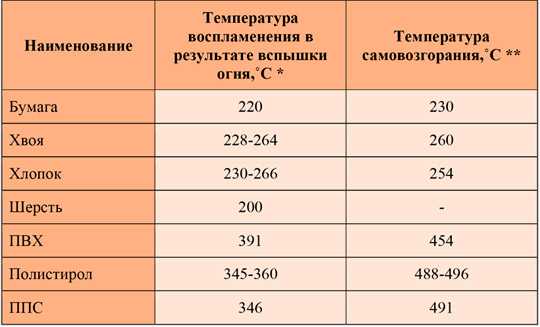 37 37 | 33372 | 14347 | 7971 | ||||||||||||||||||
| Propene | C 3 H 6 | gas | 2058 | 48.90 | 48895 | 21021 | 11678 | ||||||||||||||||||
| Propyne | C 3 H 4 | gas | 185.0 | 4.62 | 4617 | 1985 | 1103 | ||||||||||||||||||
| Pyridine | C 5 H 5 N | liq | 2782 | 35.17 | 35166 | 15119 | 8399 | ||||||||||||||||||
| Toluene (methylbenzene) | C 7 H 8 | liq | 3910 | 42.43 | 42431 | 18242 | 10134 | ||||||||||||||||||
| Trimethylamine | C 3 H 9 N | gas | 2443 | 41.32 | 41316 | 17763 | 9868 | ||||||||||||||||||
| 2,4,6-Trinitrotoluene | C 7 H 5 N 3 O 6 | cry | 3406 | 14.  |


 А., Определение угла опережения зажигания при переключении с бензина на газ в зависимости от скорости горения топливной смеси [Электронный ресурс] – URL: https://cyberleninka.ru/article/n/opredelenie-ugla-operezheniya-zazhiganiya-pri-pereklyuchenii-s-benzina-na-gaz-v-zavisimosti-ot-skorosti-goreniya-toplivnoy-smesi/viewer
А., Определение угла опережения зажигания при переключении с бензина на газ в зависимости от скорости горения топливной смеси [Электронный ресурс] – URL: https://cyberleninka.ru/article/n/opredelenie-ugla-operezheniya-zazhiganiya-pri-pereklyuchenii-s-benzina-na-gaz-v-zavisimosti-ot-skorosti-goreniya-toplivnoy-smesi/viewer