Содержание
Химические свойства металлов — с чем реагируют? Свойства и таблица
Поможем понять и полюбить химию
Начать учиться
137.2K
Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
| Li, K, Na, Ca, Ba | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
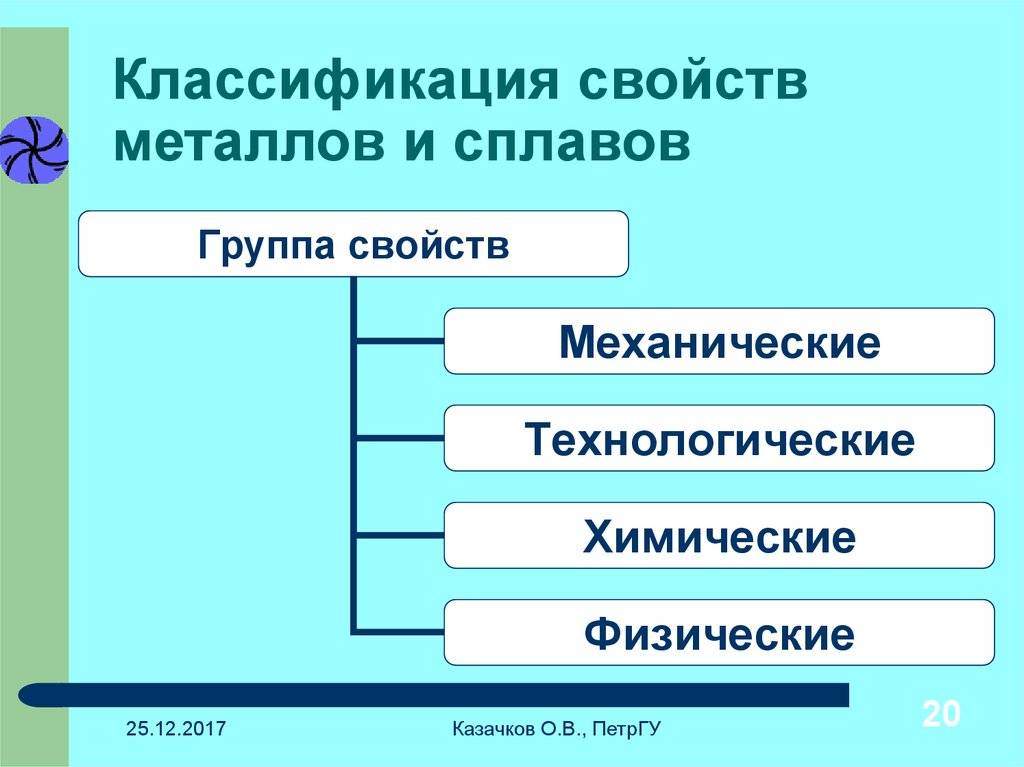
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Li, K,Ca, Na, | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au | |
|---|---|---|---|---|
Восстановительная способность металлов в свободном состоянии | ||||
Взаимодействие металлов с кислородом | Быстро окисляются при обычной температуре | Медленно окисляются при обычной температуре или при нагревании | Не окисляются | |
Взаимодействие с водой | Выделяется водород и образуется гидроксид | При нагревании выделяется водород и образуются оксиды | Водород из воды не вытесняют | |
Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот (кроме HNO3) | Не вытесняют водород из разбавленных кислот | ||
Реагируют с концентрированными азотной и серной кислотами | С кислотами не реагируют, растворяются в царской водке | |||
Взаимодействие с солями | Не могут вытеснять металлы из солей | Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей | ||
Взаимодействие с оксидами | Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов | |||
Татьяна Сосновцева
К предыдущей статье
140. 4K
4K
Оксиды
К следующей статье
Химические свойства кислот
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Свойства металлов и все основные физические особенности видов сплавов
05Дек
Содержание статьи
- Что это такое – металл
- Физические свойства
- Основные химические свойства металлов
- Признаки
- Классификация и виды металлов
- Сплавы
- Сравнение свойств
Обнаружение общих физических и химических свойств металлов и сплавов привело к повсеместному использованию материала. Со временем ученые начали подробно изучать его характеристики, а также создавать различные методы металлообработки, которые увеличивают прочность, улучшают кристаллическую решетку. На настоящий момент есть такие составы, которые используются при кораблестроении. Все больше сфер жизни не может обойтись без металлических элементов – от бытовой ложки или авторучки до сложных механических узлов и микросхем. Но обыватели часто не понимают, что за вещество мы используем, и какие особенности дают ему такую распространенность. В статье мы подробно поговорим про это.
На настоящий момент есть такие составы, которые используются при кораблестроении. Все больше сфер жизни не может обойтись без металлических элементов – от бытовой ложки или авторучки до сложных механических узлов и микросхем. Но обыватели часто не понимают, что за вещество мы используем, и какие особенности дают ему такую распространенность. В статье мы подробно поговорим про это.
Что это такое – металл
Древнегреческое слово metallion как раз обозначает «выкапывать из земли» – добытое из горной руды. На настоящий момент известно 96 значений в чистом виде и неограниченное количество сплавов. Все они отличаются от неметаллов повышенными прочностными качествами и проводимостью, поэтому из них делают провода. На первый взгляд отличить металлический образец от каменного или иного можно по специфическому блеску.
Физические свойства
В условиях комнатной температуры и без применения давления все вещества обладают твердым состоянием. Но есть галлий, он уже при 30 градусах тепла начинает деформироваться, тает в руках. Можно отметить характеристики:
Можно отметить характеристики:
- Высокая пластичность. Хрупкие только марганец, олово и цинк.
- Могут быть легкие и тяжелые. Сравни алюминий с осмием.
- Температура плавления очень большая. Есть и исключения, например, ртуть, именно по этой причине ее используют в классических термометрах.
- Цвет – серый, серебристый, голубоватый. Редкими являются цветные изделия, например, желтые или красные.
- Увеличенная проводимость тепла и электричества, особенно у меди, поэтому имеют популярность медные провода.
Основные химические свойства металлов
В данной категории нет общих правил, так как все они разделяются на множество подгрупп по уровню активности – щелочные, актиноиды, полуметаллы и другие. Многие взаимодействуют с водой, почти все – с кислородом (кроме золота и платины),происходит окисление. Процесс проходит в нормальных условиях, если в составе много щелчки, только при нагреве – если нет. Также почти все элементы вступают в реакцию с серой и хлором.
Признаки
Перечислим черты, по которым обыватель может отличить вещества этой категории от неметаллов:
- Блеск.
- Хорошая проводимость тепла и электричества.
- Прочность.
- Подвергаются ковке и свариванию.
- Кристаллическое строение тела.
- Высокая температура плавления и кристаллизации.
Классификация и виды металлов
Есть чистые, однокомпонентные структуры и сплавы. Самым классическим примером можно назвать различные виды стали. Они различаются по ГОСТу в соответствии с добавлением легирующих добавок. Чем больше содержание углерода, тем крепче материал. Также есть общепринятое разграничение, ниже представим подтипы.
Черные
Их добывают из металлической руды. В производстве они занимают 90% от всего сырья. Обычно это чугуны и стали. Для изменения характеристик добавляют большее или меньшее количество углерода и легирующие добавки: медь, кремний, хром, никель. Одним из очень популярных подвидов является нержавейка, которая отличается своим блеском поверхности и уникальными свойствами – легкостью, высокой прочностью и устойчивостью к влажности, температурным перепадам.
Что относится к цветным металлам
Второе название – нежелезные, то есть сплавы не содержат в себе железа, а состоят из более дорогостоящих материалов. Вещества имеют различный цвет, отличаются уникальными качествами:
- долговечность;
- длительное сохранение свойств;
- образование оксидной пленки, которая препятствует коррозии.
Благодаря этому, определенные разновидности можно использовать в медицине, ювелирном деле, химической промышленности, при изготовлении электрических проводов. К цветмету относится алюминий, цинк, олово, свинец, никель, хром, серебро, золото и другие.
Медь и ее сплавы являются популярными металлами
Медная руда была обработана человеком одна из первой, потому что она подвергается холодному методу ковки и штамповки. Податливость привела к востребованности повсеместно. Кислород в составе приводит к красному отливу. Но уменьшение валентности в различных соединениях приведет к желтому, зеленому, синему цвету. Привлекательным качеством считается отличная теплопроводность – на втором месте после серебра, поэтому она применяется для проводов. Соединения могут быть:
Привлекательным качеством считается отличная теплопроводность – на втором месте после серебра, поэтому она применяется для проводов. Соединения могут быть:
- твердыми – в сочетании с железом, мышьяком, цинком, фосфором;
- с плохой растворимостью с висмутом, свинцом;
- хрупкими – с серой или кислородом.
К металлам относятся алюминий и сплавы
Al открыт в 1825 году и отличается легкостью и простотой в металлообработке. Производится из бокситов, при этом запасы этой горной породы практически неиссякаемы. Далее элемент соединяют в различных пропорциях с медью, марганцем, магнием, цинком, кремнием. Реже с титаном, литием, бериллием. Особенности в зависимости от добавок:
- хорошая свариваемость;
- устойчивость к коррозии;
- высокая усталостная прочность;
- пластичность.
Его применяют для изготовления ювелирных изделий, столовых приборов, а также для стекловарения, в пищевой и военной промышленности, для создания ракет и для производства водорода и тепла в алюмоэнергетике.
Все о металлах магний, титан и их сплавах
Mg – самое легкое вещество из этой группы. Не обладает прочностью, но есть достоинства, например, пластичность, химическая активность. Благодаря высокой конструкционной способности его добавляют в составы, чтобы увеличивать свариваемость, простоту металлообработки режущим ножом. Необходимо учитывать, что магний очень восприимчив к ржавлению. Титан имеет похожие качества – легкость, пластичность, серебристый цвет. Но антикоррозийная пленка появляется при первом соприкосновении с кислородом. Отличительные особенности – низкая теплопроводность, электропроводность, отсутствие магнитизма. Металл, содержащий титан, – это вещество, используемое для авиационной, химической, судостроительной промышленности.
Антифрикционные сплавы
Характерная особенность этой группы – удобство применения при механических воздействиях. Они практически не создают трения, а также снижают его у других композитов. Очень часто они выступают в качестве твердой смазки для узлов, например, для подшипников. В составе обычно бывает фторопласт, латунь, бронза, железографит и баббит.
В составе обычно бывает фторопласт, латунь, бронза, железографит и баббит.
Мягкие
Это те, у которых ослаблены металлические связи. По этой причине они имеют более низкую температуру плавления и кипения, просто деформируются. Иногда можно одним нажатием пальца сделать вмятину, ногтем оставить царапину К ним относятся: медь, серебро, золото, бронза, свинец, алюминий, цезий, натрий, калий, рубидий и другие. Одним из наиболее мягких является ртуть, она находится в природе в жидком состоянии.
Что значит твердый металл
В природе такая руда встречается крайне редко. Порода находится у упавших метеоритов. Один из наиболее популярных – хром. Он тугоплавкий и легко поддается металлообработке. Еще один элемент – вольфрам. Он очень плохо плавится, но при правильной обработке используется в осветительных приборах благодаря устойчивости к теплу и гибкости.
Металлические материалы в энергетике
Мы бы не имели такую развитую электросеть и массу приборов, потребляющих электричество, если бы ряд веществ не отличались наличием свободных электронов, положительных ионов и высокой проводимостью. Провода делают из свинца, меди и алюминия. Отлично бы подошло серебро, но его редкость влияет на стоимость, поэтому редко используется.
Провода делают из свинца, меди и алюминия. Отлично бы подошло серебро, но его редкость влияет на стоимость, поэтому редко используется.
Особенности черных вторичных металлов
Это отходы, которые образуются в результате одного из этапа металлообработки – ковки, резки. Это могут быть обрезки или стружки. Они отправляются в сталеплавильные печи, но перед этим должны пройти проверки по ГОСТу. Лом называют чермет, его различают на стальной и чугунный по цене. Его использование очень востребовано вместо обработки руды.
Щелочноземельные сплавы
Это твердые вещества, которые имеют высокую химическую активность. В чистом виде встречаются очень редко, зато применяются в соединениях. Их значение нельзя переоценить с точки зрения анатомии человека и животного. Магний и кальций – необходимые микроэлементы.
Понятие щелочной металл
Они способны растворяться в воде, образуя щелочь. Из-за своей повышенной химической активности (вступление в реакцию происходит с бурным действием, воспламенением, выделением газа, дыма) в природе почти не встречается. Ведь на внешнем уровне всего один электрон, который легко отдается любому веществу. Гидроксиды очень важны в промышленности.
Ведь на внешнем уровне всего один электрон, который легко отдается любому веществу. Гидроксиды очень важны в промышленности.
Общая характеристика материалов из d- и f-семейств
Это переходные элементы, которые могут являться как окислителями, так и восстановителями. Свойства зависят от среды, в которой они находятся. Но есть и общие:
- на внешнем уровне много электронов;
- несколько степеней окисления;
- увеличенная валентность;
- прочность;
- тягучесть;
- ковкость.
Из чего состоят побочные подгруппы металлов системы Менделеева
По сути это разновидности предыдущей категории – переходные элементы. Это линейка от скандия до цинка. Они часто выплавляются и обладают фактически такими же характеристиками, как и вышеперечисленные материалы из d- и f-семейств.
Сплавы
Чистые слитки, добываемые из руды, используются максимально редко. Это обусловлено как дороговизной, так и недостаточно хорошими качествами (чтобы исправить, добавляют углерод, легирующие добавки). Иногда в природе встречаются соединения, и нужно только подкорректировать состав. Самые известные:
Иногда в природе встречаются соединения, и нужно только подкорректировать состав. Самые известные:
- латунь;
- бронза;
- сталь;
- чугун.
Сравнение свойств
Вторая часть элементов в периодической системой отличается многообразием характеристик, поэтому почти невозможно привести полную сводную таблицу. Мы предлагаем таблицу, на которой представлено 4 отличительные черты:
| Признаки | Металлы | Неметаллы |
| Положение в П. С. | Под диагональю бор-астат | Над ней |
| Строение атома | Большой атомный радиус, чисто электронов на последнем слое — от 1 до 3 | Маленький, от 4 до 7 — соответственно |
| Физические св-ва | Электропроводность, теплопроводность, блеск, ковкость, пластичность, по агрегатному состоянию, в основном, твёрдые | Диэлектрики, неблестящие, хрупкие, газы, жидкости и летучие твёрдые вещества |
| Кристаллические решетки | Металлическая | Молекулярная, атомная |
| Химические св-ва | Восстановители | Окислительные (иногда восстанов-ли) |
Мы рассказали про металл, что это за материал, как он используется. Если вам нужны станки по металлообработке, закажите их в компании «Роста». У нас в наличии и на заказ имеются ручные и полуавтоматические ленточнопильные станки, а также маятниковые, вертикальные и двухстоечные агрегаты. Цена на товары снижена в 1.5 — 2 раза по сравнению с зарубежными аналогами. Чтобы уточнить интересующую вас информацию, свяжитесь с менеджерами, мы с радостью поможем в выборе оборудования.
Если вам нужны станки по металлообработке, закажите их в компании «Роста». У нас в наличии и на заказ имеются ручные и полуавтоматические ленточнопильные станки, а также маятниковые, вертикальные и двухстоечные агрегаты. Цена на товары снижена в 1.5 — 2 раза по сравнению с зарубежными аналогами. Чтобы уточнить интересующую вас информацию, свяжитесь с менеджерами, мы с радостью поможем в выборе оборудования.
Металлы: химические и физические свойства
Физические свойства
1) Физическое состояние – Металлы являются твердыми при комнатной температуре, т.е. натрий, алюминий, калий, магний. Есть исключения. Ртуть и галлий — это металлы, но они находятся в жидком состоянии при комнатной температуре.
2) Блеск – Свежеприготовленные металлы имеют блестящую поверхность, называемую глянцем. Они обладают свойством отражать свет от своей поверхности, и их можно полировать, например. такие металлы, как золото, серебро, медь, демонстрируют это свойство.
такие металлы, как золото, серебро, медь, демонстрируют это свойство.
3) Ковкость – Металлы можно выковывать в тонкие листы. Это свойство называется пластичностью. Благодаря этому свойству металлы можно прокатывать в листы, например, в листы. алюминий, медь, цинк можно бить в листы.
4) Пластичность – Металлы можно вытягивать в тонкую проволоку. Это свойство называется пластичностью. Например, из 100 граммов серебра можно вытянуть тонкую проволоку длиной около 200 метров.
5) Твердость – Металлы обычно твердые, т.е. железо, кобальт, никель. Есть несколько исключений. Натрий и калий мягкие и их можно резать ножом.
6) Проводимость – Как правило, металлы являются хорошими проводниками тепла и электричества, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника. Относительно свинец и висмут являются плохими проводниками тепла и электричества.
7) Плотность – Металлы обычно имеют высокую плотность и они тяжелые.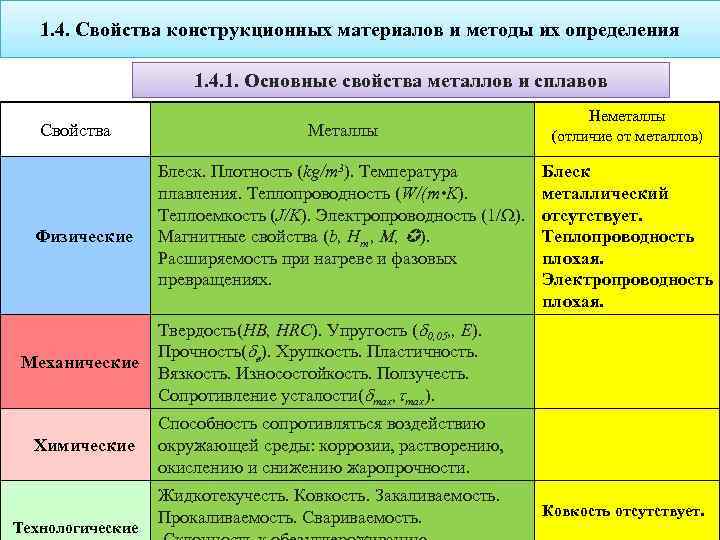 Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
8) Температура плавления и кипения – Металлы обычно имеют высокие температуры плавления и кипения. Например, железо, кобальт и никель имеют высокие температуры плавления и кипения. Вольфрам имеет самую высокую температуру плавления. Есть некоторые исключения из этого. Например, большинство щелочных металлов имеют низкую температуру плавления и кипения.
9) Прочность на растяжение – Большинство металлов обладают высокой прочностью на растяжение, т.е. прочностью. Например, железо, титан, некоторые сплавы обладают высокой прочностью на растяжение. Однако такие элементы, как натрий, калий и ртуть, не обладают прочностью.
Химические свойства металлов
1) Электронная конфигурация – Металлы обычно имеют от 1 до 3 электронов на внешней оболочке своего атома. Например, натрий, магний и алюминий имеют 1, 2 и 3
электронов соответственно на самой внешней оболочке своего атома.
2) Валентность – Атомы металлов могут терять от 1 до 3 электронов на своей внешней оболочке и проявлять валентности от 1 до 3.
3) Электрохимическая природа – Атомы металлов склонны терять электроны и образовывать катионы.
4) Электроотрицательность – Металлы обычно имеют низкую электроотрицательность, т.е. тенденцию притягивать электроны в состоянии молекулы.
5) Образование оксидов – Металлы образуют оксиды, обычно ионные и основные по своей природе. Если этот основной оксид растворяется в воде, он образует щелочь. Например, оксиды Na, K и Ca, т.е. Na2O, K2O и CaO являются сильнощелочными по своей природе и при растворении в воде образуют щелочи NaOH, KOH и Ca(OH)2.
6) Восстановитель – Все металлы действуют как восстановители.
Обзор физических свойств металлов
Физические свойства являются важным способом отличить один материал от другого. При изучении и применении металлургии физические свойства часто считаются более широкой категорией, чем механические свойства, но не все свойства пересекаются. Физические свойства легче всего отличить от механических методом испытаний. В то время как для измерения механических свойств требуется приложение усилий, физические свойства можно измерить без изменения материала.
При изучении и применении металлургии физические свойства часто считаются более широкой категорией, чем механические свойства, но не все свойства пересекаются. Физические свойства легче всего отличить от механических методом испытаний. В то время как для измерения механических свойств требуется приложение усилий, физические свойства можно измерить без изменения материала.
Тем не менее, физические свойства меняются в разных средах. Например, большинство металлов имеют более высокую плотность при более низких температурах из-за принципов теплового расширения и сжатия . Цвет и внешний вид, которые также являются физическими свойствами, изменяются в зависимости от ряда факторов окружающей среды.
Подробнее о механических свойствах металлов читайте в нашем блоге.
Физические свойства металлов включают:
- Коррозионная стойкость
- Плотность
- Температура плавления
- Термические свойства
- Теплоемкость
- Теплопроводность
- Тепловое расширение
- Электропроводность
- Магнитные свойства
Что такое сплав?
Слово сплав появляется в блоге Eagle Group, особенно в этой серии. Сплав представляет собой однородную смесь, состоящую из комбинации отдельных элементов, когда хотя бы один из элементов является металлом. Обычные сплавы включают бронзу, которая представляет собой смесь меди (Cu) и олова (Se). Сталь представляет собой смесь железа (Fe) и углерода (C), а нержавеющая сталь включает другие легирующие добавки, такие как хром (Cr), никель (Ni) и марганец (Mn).
Сплав представляет собой однородную смесь, состоящую из комбинации отдельных элементов, когда хотя бы один из элементов является металлом. Обычные сплавы включают бронзу, которая представляет собой смесь меди (Cu) и олова (Se). Сталь представляет собой смесь железа (Fe) и углерода (C), а нержавеющая сталь включает другие легирующие добавки, такие как хром (Cr), никель (Ni) и марганец (Mn).
Коррозионная стойкость
Могут возникать многие виды коррозии. Коррозия — это процесс, при котором материал восстанавливается до более стабильного состояния посредством химической реакции, часто связанной с атмосферой или условиями эксплуатации. Ржавчина, часто встречающаяся на незащищенных изделиях из черных металлов, является одной из наиболее распространенных форм коррозии.
Коррозионная стойкость , с другой стороны, это способность материала сопротивляться реакции перехода к более стабильному состоянию в окружающей среде.
Необработанный алюминий, кремний, титан и их сплавы обладают естественной коррозионной стойкостью благодаря быстро образующемуся на их поверхности нереакционноспособному слою. Распространенным сплавом для многих применений, требующих коррозионной стойкости, является нержавеющая сталь. В отличие от углеродистой стали, сплавы нержавеющей стали способны противостоять поверхностной коррозии при воздействии сред, которые обычно вызывают коррозию, включая влажную, кислотную или высокую температуру.
Распространенным сплавом для многих применений, требующих коррозионной стойкости, является нержавеющая сталь. В отличие от углеродистой стали, сплавы нержавеющей стали способны противостоять поверхностной коррозии при воздействии сред, которые обычно вызывают коррозию, включая влажную, кислотную или высокую температуру.
Нажмите здесь, чтобы прочитать нашу запись в блоге «Коррозионная стойкость»
Плотность
Плотность объекта определяется по простой формуле: масса объекта (M) делится на его объем (V). Сначала практическое применение плотности заключалось в определении подлинности золота, как в истории с золотой короной. Золото — отличный кандидат для проверки плотности, потому что это гораздо более плотный материал, чем другие металлы, со средней плотностью 1206 фунтов. за кубический фут.
Сплавы, чаще используемые в производстве, имеют меньшую плотность. Сталь в среднем около 494 фунта на кубический фут, в то время как из нержавеющей стали немного меньше. Плотность титана составляет примерно половину плотности стали, а алюминия — около одной трети. На практике это означает, что деталь из стали будет весить примерно в три раза больше, чем точно такая же деталь из алюминия. Однако у стали есть и другие преимущества, такие как твердость и прочность, поэтому меньшие объемы или толщина материала могут обеспечить такие же или лучшие характеристики в сравнении.
Плотность титана составляет примерно половину плотности стали, а алюминия — около одной трети. На практике это означает, что деталь из стали будет весить примерно в три раза больше, чем точно такая же деталь из алюминия. Однако у стали есть и другие преимущества, такие как твердость и прочность, поэтому меньшие объемы или толщина материала могут обеспечить такие же или лучшие характеристики в сравнении.
Eagle Alloy и Eagle Precision часто производят сложные тонкостенные отливки из различных сплавов углеродистой и нержавеющей стали. Сплав влияет на конструкцию, производственный процесс и методы отделки, используемые для изготовления каждой литой детали.
Точка плавления
Точка плавления материала определяется как температура, при которой он переходит из твердого состояния в жидкое при атмосферном давлении . Температура плавления может быть основным фактором при принятии решения о возможности использования сплава для конкретного продукта. Различные сплавы имеют разные диапазоны температур плавления, что определяется элементами их химического состава. Например, сплав с высоким процентным содержанием олова или алюминия будет плавиться при гораздо более низкой температуре, чем сплав, состоящий в основном из железа и никеля.
Например, сплав с высоким процентным содержанием олова или алюминия будет плавиться при гораздо более низкой температуре, чем сплав, состоящий в основном из железа и никеля.
Температура плавления является важным фактором для производителей металлов. На многих литейных предприятиях используются методы литья в песчаные формы, такие как воздушная установка или литье в оболочковые формы, поскольку неметаллические формы могут выдерживать более высокие температуры, необходимые для плавления стали. Алюминий, с другой стороны, можно отливать в многоразовых стальных формах, так как он имеет гораздо более низкую температуру плавления, чем сталь.
Тепловые свойства
Тепловые свойства включают теплоемкость, теплопроводность и тепловое расширение. В производстве все три свойства являются важными факторами при выборе правильного сплава.
- Теплоемкость , также известная как удельная теплоемкость , представляет собой количество энергии, необходимое для изменения температуры материала, и является ключевым компонентом прогнозирования затвердевания отливки.

- Теплопроводность определяется как скорость, с которой тепло может передаваться через материал, и у металлов есть одна общая черта — высокая теплопроводность. Электропроводность — это другое свойство, но оно пропорционально коррелирует с теплопроводностью. Такие металлы, как медь и золото, известные как хорошие электрические проводники, также являются хорошими теплопроводниками.
- Тепловое расширение относится к тому, как металлы расширяются при нагревании и сжимаются при охлаждении. Это свойство особенно важно при проектировании оснастки для литья металлов. Выкройки и формы должны быть больше конечной детали, чтобы учесть усадку при охлаждении.
Нажмите здесь, чтобы прочитать наш пост «Электропроводность» для получения дополнительной информации о тепло- и электропроводности
Магнитные свойства
Магнитные свойства см. способ, которым материал реагирует на приложенное внешнее магнитное поле . Этот магнитный отклик можно классифицировать как диамагнитный, парамагнитный, ферромагнитный, антиферромагнитный или ферримагнитный.
Этот магнитный отклик можно классифицировать как диамагнитный, парамагнитный, ферромагнитный, антиферромагнитный или ферримагнитный.
- Диамагнетики — отталкиваются магнитными полями
- Парамагнетик — не показывает магнитный порядок
- Ферромагнетик — самый сильный тип магнетизма
- Антиферромагнитный — может существовать при достаточно низких температурах, но исчезает при температуре Нееля 9 или выше0088
- Ферримагнетик — слабая форма ферромагнетизма
Железо является одним из наиболее магнитных металлов, поэтому черные металлы (металлы, содержащие железо), такие как сталь, также проявляют различные степени магнетизма, в частности ферромагнетизм.
Хотя приведенные выше свойства ни в коем случае не являются исчерпывающими, они представляют собой многие из наиболее важных свойств, связанных с выбором материала для литья металлов или обработки на станках с ЧПУ. В Eagle Group наши эксперты по металлургии имеют опыт оценки потребностей продукта и, основываясь на отзывах клиентов, в конечном итоге предлагают оптимальный сплав для работы.