Содержание
Внутреннее строение и свойства металлов и сплавов
К машиностроительным материалам относятся металлы и их сплавы, древесина, пластмассы, резина, картон, бумага, стекло и др. Наибольшее применение при изготовлении машин получили металлы и их сплавы.
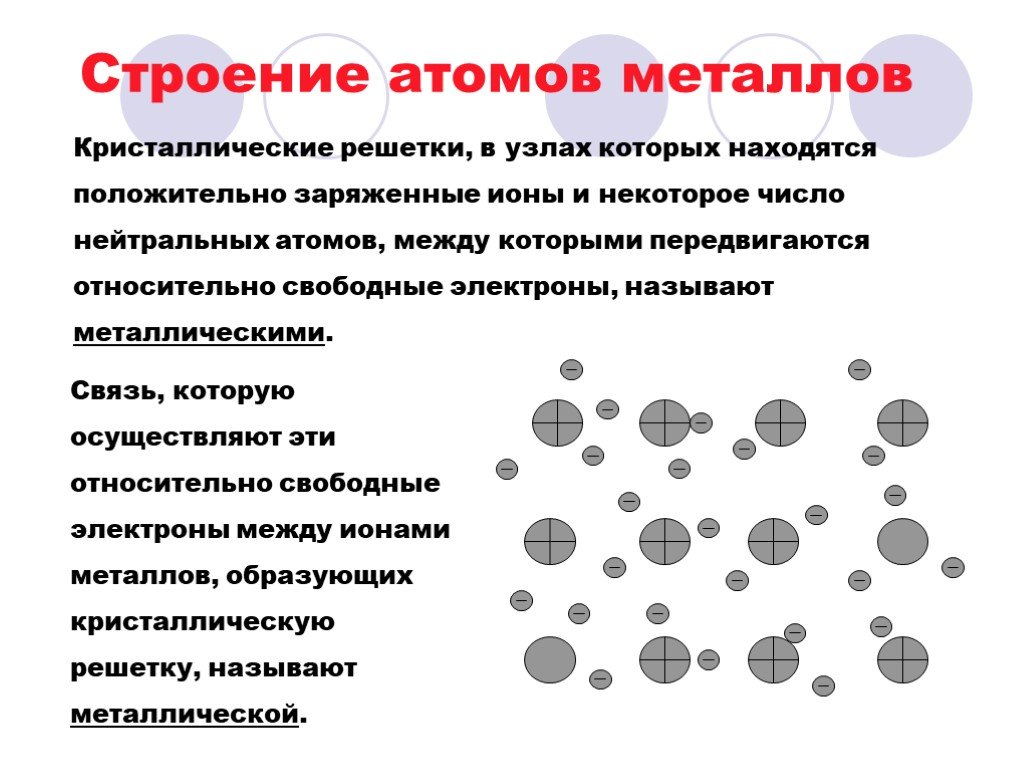
Металлами называются вещества, обладающие высокой теплопроводностью и электрической проводимостью; ковкостью, блеском и другими характерными свойствами, которые легко и не очень поддаются металлообработке.
В технике все металлы и сплавы принято делить на черные и цветные. К черным металлам относятся железо и сплавы на его основе. К цветным — все остальные металлы и сплавы. Для того чтобы правильно выбрать материал для изготовления деталей машин с учетом условий их эксплуатации, механических нагрузок и других факторов, влияющих на работоспособность и надежность машин, необходимо знать внутреннее строение, физико-химические, механические и технологические свойства металлов.
Металлы и их сплавы в твердом состоянии имеют кристаллическое строение. Их атомы располагаются в пространстве в строго определенном порядке и образуют пространственную кристаллическую решетку. Наименьший комплекс атомов, который при многократном повторении в пространстве воспроизводит решетку, называется элементарной кристаллической ячейкой. Форма элементарной кристаллической ячейки определяет совокупность свойств металлов: блеск, плавкость, теплопроводность, электропроводность, обрабатываемость и анизотропность (различие свойств в различных плоскостях кристаллической решетки) . Пространственные кристаллические решетки образуются при переходе металла из жидкого состояния в твердое. Этот процесс называется кристаллизацией.
Процесс кристализации. Кристаллизация состоит из двух стадий. В жидком состоянии металла его атомы находятся в непрерывном движении. При понижении температуры движение атомов замедляется, они сближаются и группируются в кристаллы. Образуются так называемые центры кристаллизации (первая стадия). Затем идет рост кристаллов вокруг этих центров (вторая стадия). Вначале кристаллы растут свободно. При дальнейшем росте кристаллы отталкиваются, рост одних кристаллов мешает росту соседних, в результате чего образуются неправильной формы группы кристаллов, которые называют зернами. Размер зерен существенно влияет на эксплуатационные и технологические, свойства металлов. Крупнозернистый металл имеет низкую сопротивляемость удару, при его обработке резанием возникает трудность в получении малой шероховатости поверхности деталей. Размеры зерен зависят от природы самого металла и условий кристаллизации.
Образуются так называемые центры кристаллизации (первая стадия). Затем идет рост кристаллов вокруг этих центров (вторая стадия). Вначале кристаллы растут свободно. При дальнейшем росте кристаллы отталкиваются, рост одних кристаллов мешает росту соседних, в результате чего образуются неправильной формы группы кристаллов, которые называют зернами. Размер зерен существенно влияет на эксплуатационные и технологические, свойства металлов. Крупнозернистый металл имеет низкую сопротивляемость удару, при его обработке резанием возникает трудность в получении малой шероховатости поверхности деталей. Размеры зерен зависят от природы самого металла и условий кристаллизации.
Методы изучения структуры металла. Исследование структур металлов и сплавов производится с помощью макро- и микроанализа, а также другими способами.
Методом макроанализа изучается макроструктура, т. е. строение металла, видимое невооруженным глазом или с помощью лупы. Макроструктуру определяют по изломам металла или по макрошлифам.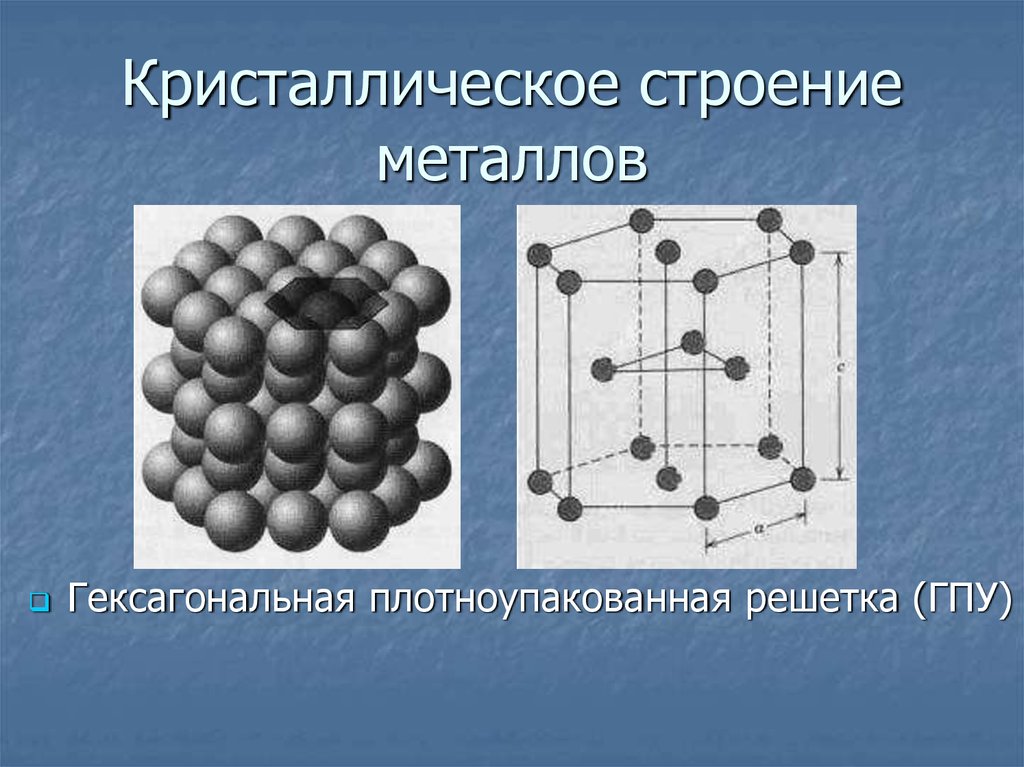
Макрошлиф представляет собой образец металла или сплава, одна из сторон которого отшлифована и протравлена кислотой или другим реактивом. Этим методом выявляются крупные дефекты: трещины, усадочные раковины, газовые пузыри, неравномерность распределения примесей в металле и т. д.
Микроанализ позволяет определить размеры и форму зерен, структурные составляющие, качество термической обработки, выявить микродефекты. Микроанализ проводится по микрошлифам с помощью микроскопа (современные металлографические микроскопы дают увеличение до 2000, а электронные — до 25 000). Микрошлиф— это образец металла, имеющий плоскую полированную поверхность, подвергнутую травлению слабым раствором кислоты или щелочи для выявления микроструктуры.
Свойства металлов. Свойства металлов обычно подразделяют на физико-химические, механические и технологические. Физико-химические и механические свойства твёрдых тел, в том числе и металлов, вам знакомы из курсов физики и химии.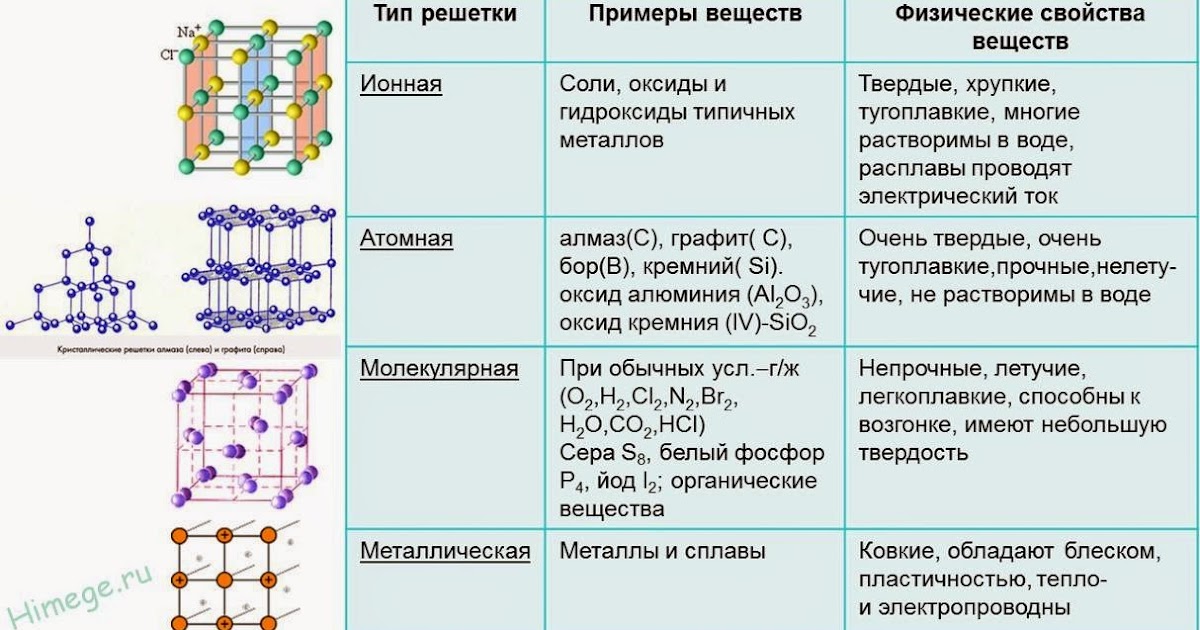 Остановимся на рассмотрении некоторых механических и технологических свойств, важных с точки зрения обработки металлов. Под механическими свойствами, как известно, понимают способность металла или сплава сопротивляться воздействию внешних сил.
Остановимся на рассмотрении некоторых механических и технологических свойств, важных с точки зрения обработки металлов. Под механическими свойствами, как известно, понимают способность металла или сплава сопротивляться воздействию внешних сил.
К механическим свойствам относят прочность, вязкость, твердость и др.
Прочность характеризует свойство металла или сплава в определенных условиях и пределах, не разрушаясь, воспринимать те или иные воздействия внешних сил.
Важным свойством металла является ударная вязкость — сопротивление материала разрушению при ударной нагрузке.
Под твердостью понимают свойство материала сопротивляться внедрению в него другого, более твердого тела.
К основным технологическим свойствам металлов и сплавов относятся следующие:
ковкость — свойство металла подвергаться ковке и другим видам обработки давлением;
жидкотекучесть — свойство расплавленного металла заполнять литейную форму во всех ее частях и давать плотные отливки точной конфигурации;
свариваемость — свойство металла давать прочные сварные соединения;
обрабатываемость резанием — свойство металлов подвергаться обработке режущими инструментами для придания деталям определенной формы, размеров и шероховатости поверхности.
Строение и свойства металлов — презентация онлайн
1. Строение и свойства металлов
СТРОЕНИЕ И СВОЙСТВА МЕТАЛЛОВ
материаловедение
2. Общая характеристика металлов и сплавов
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И СПЛАВОВ
В чистом виде в природе встречаются химически
устойчивые элементы (Pt, Au, Ag, Hg, Cu).
Из 119 открытых элементов 22 являются неметаллами.
Характерными свойствами металлов являются:
1. высокая пластичность
2. высокая теплопроводность
3. высокая электропроводность
4. положительный температурный коэффициент
электрического сопротивления
5. хорошая отражательная способность
6. термоэлектронная эмиссия
7. кристаллическое строение в твердом состоянии
В отличие от аморфных тел атомы металлов в кристалле
занимают строго определенные пространственные
положения, характеризуемые периодической
повторяемостью в трех измерениях.
Расстояния между отдельными плоскостями ячейки
являются параметрами элементарной кристаллической
решетки.
Элементарные ячейки у различных металлов
существенно отличаются величиной параметров, которые
соразмерны нескольким ангстремам (Å=10⁻⁸ см), а
также характером упаковки атома.
Форма кристаллической решетки соответствует
определенному уровню свободной энергии атомов.
4. Кристаллическое строение металлов
КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
Аллотропия металлов (или полиморфизм) — их
свойство перестраивать решетку при определенных
температурах в процессе нагревания или охлаждения.
Аллотропию обнаруживают все элементы, меняющие
валентность при изменении температуры, например
железо, марганец, никель, олово и др. Каждое
аллотропическое превращение происходит при
определенной температуре. Например, одно из
превращений железа происходит при температуре
911°С, ниже которой атомы составляют решетку
центрированного куба, а выше — решетку
гранецентрированного куба.
Структура, имеющая ту или иную решетку, называется
аллотропической формой или модификацией.
Принято обозначать полиморфную модификацию,
устойчивую при более низкой температуре, индексом α ,
при более высокой температуре β, затем γ и т.д.
Температура превращения одной кристаллической
модификации в другую называется температурой
полиморфного превращения. При этом меняются
свойства, в частности плотность, объем вещества.
На явлении полиморфизма основана термическая
обработка.
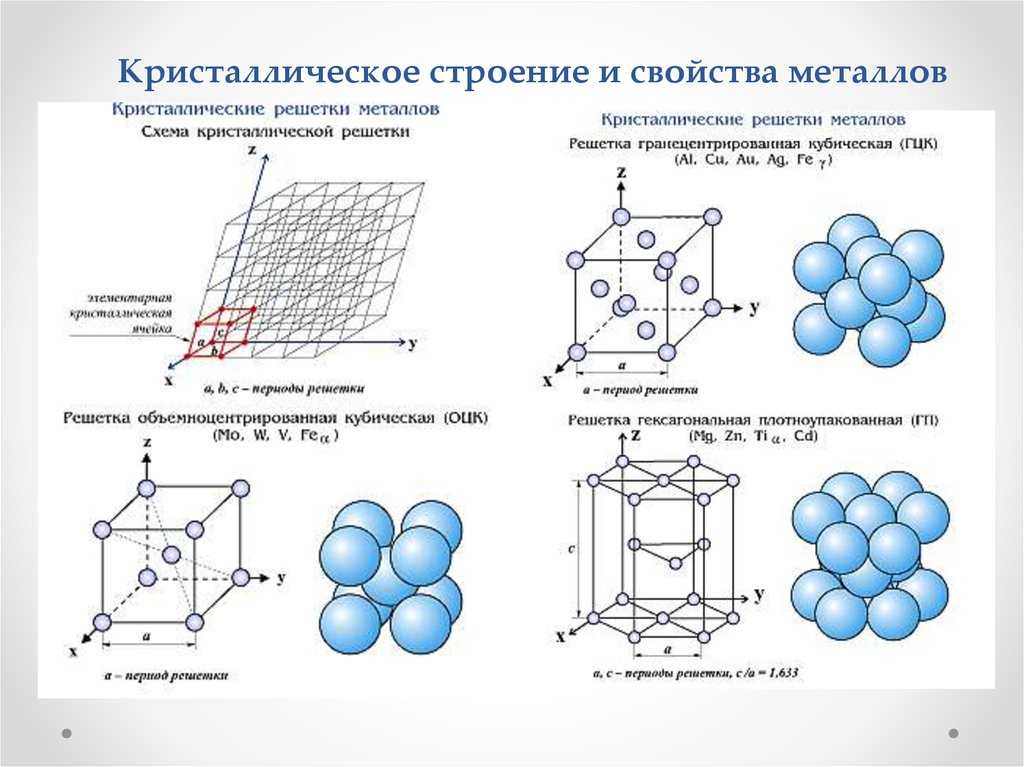
11. Кристаллические решетки металлов Таблица 1
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ МЕТАЛЛОВ
ТАБЛИЦА 1
Тип решетки
Металлы, имеющие такое
кристаллическое строение
Кубическая
объемноцентрированная
Хром, вольфрам, молибден,
железо (до 910° И от 1400 до
1539°С), титан (при
температурах свыше 882°С)
Кубическая
гранецентрированная
Алюминий, медь, никель,
свинец, золото, серебро, железо
(при 910—1400°С)
Гексагональная
Цинк, магний, бериллий, титан
(до 882°С)
Полиморфные превращения наблюдаются у
многих металлов и могут быть обратимыми в
зависимости от изменения температуры и
давления в пределах твердого состояния.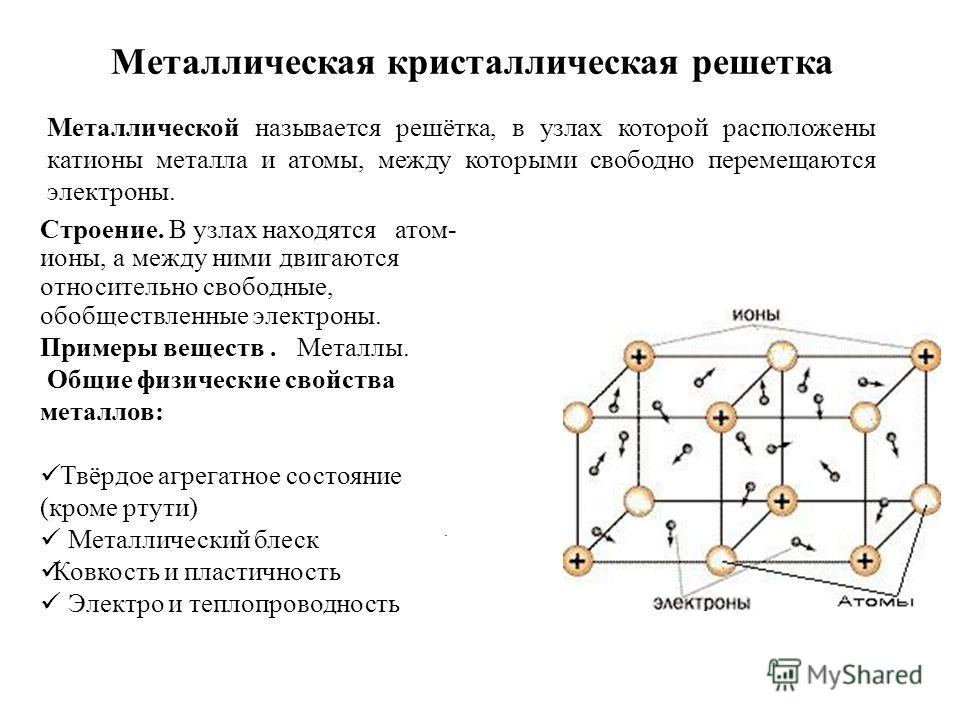
Например, известны полиморфные
превращения у
железа
марганца;
олова
и т. д.
Полиморфные превращения сопровождаются
изменением в твердом состоянии структуры
металлов и сплавов, при этом изменяются их
механические, физические и химические
свойства. Такое явление широко используется
в технике, например при термической
обработке металлов и сплавов.
Аморфные материалы изотропны – их свойства в разных
направлениях одинаковы.
Из-за неодинаковой плотности атомов в разных
направлениях кристалла наблюдаются разные свойства –
анизотропия (характерна для одиночных кристаллов).
Поликристаллическое тело характерно
квазиизотропностью.
16. Дефекты кристаллической решетки
ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
Реальный кристалл отличается от идеального.
Он имеет структурные несовершенства
(дефекты): точечные, линейные и
поверхностные.
Точечными дефектами являются пустые
узлы или вакансии и межузельные атомы;
количество этих дефектов возрастает с
повышением температуры.
19. Точечные дефекты
ТОЧЕЧНЫЕ ДЕФЕКТЫ
Вокруг узлов решетки (точек равновесия) атомы совершают
колебательные движения. Чем выше температура тела, тем
больше энергия атомов и больше амплитуда их колебаний.
Отдельные атомы реального тела всегда имеют энергию, а
следовательно, и амплитуду колебаний выше средней. Эти
атомы могут перемещаться между узлами решетки. Допустим,
это атом 1 (рис. 1, а). Вышедший из узла атом называется
дислоцированным. Место, где находился атом 1 (вакансия), не
остается свободным, его занимает атом из более глубоких
слоев — тела их можно зафиксировать (так называемые
закалочные вакансии). Вакансии могут образовываться в
результате пластической деформации, рекристаллизации и т.д.
Важнейшими линейными дефектами
являются дислокации (краевые и
винтовые), представляющие как бы сдвиг
части кристаллической решетки.
Дислокации характеризуются большой
протяженностью в одном направлении и
малой в другом.
25. Линейные дефекты
ЛИНЕЙНЫЕ
ДЕФЕКТЫ
Сдвинем часть идеального кристалла на одно межатомное расстояние, например влево (рис.
1, б). В верхних рядах кристалла оказалось на один атом больше, чем в нижних. Появилась
лишняя плоскость 4— 5 (экстраплоскость) в верхней части кристалла. Линия,
перпендикулярная направлению сдвига кристалла, является краем экстраплоскости. Она
называется линейной дислокацией и может достигать многих тысяч межатомных расстояний.
Происхождение винтовой дислокации сложнее. Разрежем кристалл плоскостью G (рис. 1, в) и
часть его сдвинем вверх на одно межатомное расстояние. Горизонтальные атомные
плоскости изогнутся, и край каждой плоскости сомкнётся с краем ближайшей соседней
плоскости. Расположение атомов в сдвинутой (АВ) и в несдвинутой части (CD) даст винтовую
линию.
На рис. 1, г белыми кружками обозначены атомы сдвинутой части, черными — несдвинутой.
Линия ЕFпредставляет собой так называемую винтовую дислокацию, при наличии которой
кристалл как бы состоит из закрученных по винту кристаллографических плоскостей.
Дислокации легко подвижны, так как в зоне дислокаций решетка упруго искажена, атомы
смещены относительно равновесного положения и стремятся вернуться в него.
28. Поверхностные дефекты
ПОВЕРХНОСТНЫЕ ДЕФЕКТЫ
Реальное тело имеет поликристаллическое строение (состоит из
множества кристаллов, соприкасающихся между собой). Отдельные
кристаллы получили название «зерно». Поверхностные дефекты
образуются на границах зерен (рис. 2, а), которые обычно
представляют собой переходную область шириной 3 — 4 межатомных
расстояний.
В этой области решетка одного кристалла переходит в решетку
другого, имеющего иную кристаллографическую ориентацию. Зерна
повернуты друг относительно друга на небольшие углы, и по
границам скапливаются дислокации (рис. 2, б), примеси и
различные посторонние включения. Поэтому на границах зерен
атомы расположены несколько иначе, чем в объеме зерна. В
результате реальный металл имеет сложную дислокационную
структуру, называемую мозаичной, или блочной (рис. 2, в), которая
2, в), которая
определяет его свойства. Под влиянием внешних факторов
(например, механические нагрузки, тепловое воздействие) меняется
количество и плотность дефектов, меняются и свойства металла.
29. Рис. 1.3. Схемы строения границ и блочной (мозаичной) структуры кристаллов: а — схема размещения атомов в области границ зерен
РИС. 1.3. СХЕМЫ СТРОЕНИЯ ГРАНИЦ И БЛОЧНОЙ (МОЗАИЧНОЙ) СТРУКТУРЫ КРИСТАЛЛОВ:
А — СХЕМА РАЗМЕЩЕНИЯ АТОМОВ В ОБЛАСТИ ГРАНИЦ ЗЕРЕН МЕТАЛЛА: 1 — ЗЕРНО 1; 2—
ГРАНИЦА; 3 — ЗЕРНО 2; Б — МАЛОУГЛОВАЯ ГРАНИЦА; В — БЛОЧНАЯ СТРУКТУРА
КРИСТАЛЛА
30. Диффузия
ДИФФУЗИЯ
Наличие вакансий определяет возможность
перемещения атомов в кристаллическом
теле на расстояния, превышающие
межатомные для данного металла
(диффузия). Перемещение атомов, не
связанных с изменением концентрации в
отдельных объемах, называется
самодиффузией. Диффузия, связанная с
изменением концентрации, называется
гетеродиффузией.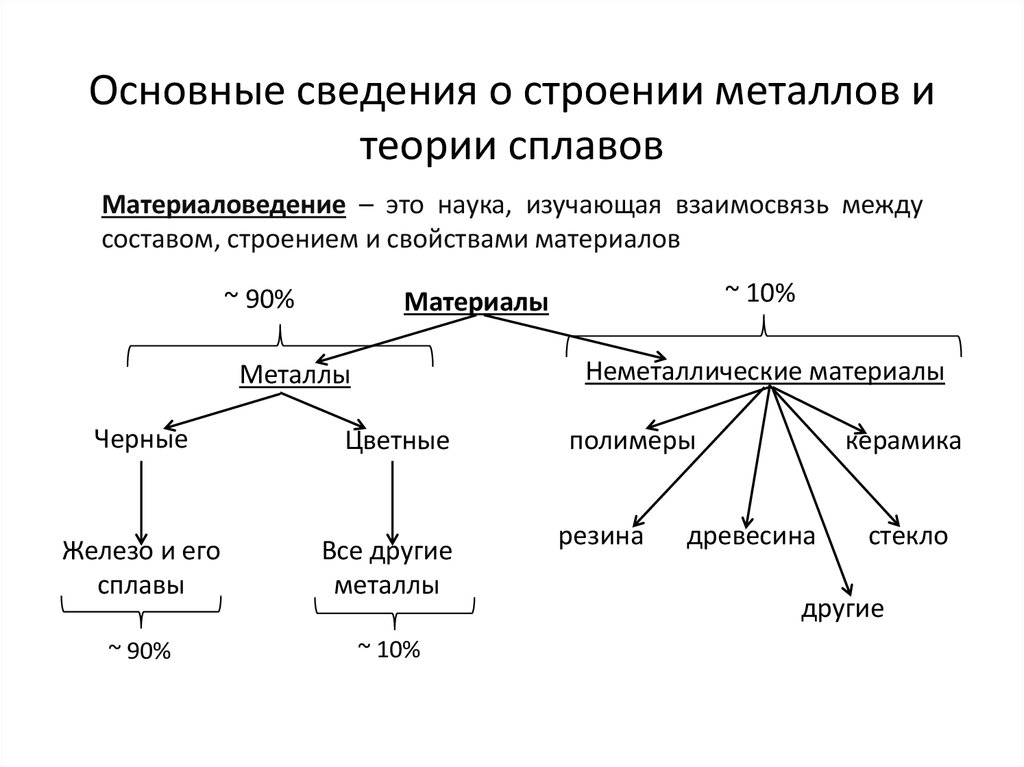 Она происходит в
Она происходит в
сплавах с повышенным содержанием
примесей.
При циклической диффузии (рис. 3, а)
совместно перемещаются группы атомов
(атомы 1— 4). Такая диффузия не требует
больших затрат энергии, но маловероятна.
При обменном механизме диффузии (рис. 3, б)
атомы меняются местами (атомы 1 и 2). При
вакансионной диффузии (рис. 3, в) происходит
замещение вакансий. Этот механизм приводит
к перемещению точечных дефектов в глубь
поликристалла. При межузельной диффузии
(рис. 3, г) атомы примесей, имеющие малый
атомный радиус (черный квадрат),
перемещаются в межузельном пространстве.
Скорость диффузии зависит от энергии
атомов, т. е. от степени нагрева тела. Наиболее
Рис. 3. Перемещение атомов в кристаллической решетке металлов:
а — циклическая диффузия; б — обменный механизм
диффузии; в — вакансионная диффузия; г — межузельная диффузия; 1, 2,
3, 4 — перемещающиеся атомы
Дефекты кристаллов оказывают
существенное влияние на механические,
физические, химические и
технологические свойства металлов.
В отдельных кристаллах свойства различны в разных
направлениях. Если взять большой кристалл, вырезать
из него несколько одинаковых по размеру, но различно
ориентированных образцов, и испытать их свойства, то
иногда наблюдается значительная разница в свойствах
отдельных образцов. Это свойство кристаллов называют
анизотропностью. Анизотропность кристаллов
объясняется особенностями расположения атомов в
пространстве.
Аморфные тела изотропны, т. е. все эти свойства
одинаковы во всех направлениях. Излом аморфного
тела всегда имеет неправильную, искривленную, так
называемую раковистую, поверхность.
Металлы, затвердевшие в обычных
условиях, состоят не из одного кристалла,
а из множества отдельных кристаллитов,
различно ориентированных друг к другу,
поэтому свойства литого металла
приблизительно одинаковы во всех
направлениях; это явление называют
квазиизотропностью (кажущейся
изотропностью).
37. Процесс кристаллизации
Любое вещество может находиться в трех агрегатных
состояниях: твердом, жидком, газообразном. Возможен
Возможен
переход из одного состояния в другое, если новое
состояние в новых условиях является более
устойчивым, обладает меньшим запасом энергии.
Кристаллизацией металлов называется образование
кристаллов в металлах (и сплавах) при переходе из
жидкого состояния в твердое (первичная
кристаллизация).
К вторичной кристаллизации относят превращения в
затвердевшем металле при его остывании. Сюда
относятся перекристаллизация из одной модификации в
другую (полиморфные превращения), распад твердых
растворов, распад (а также образование) химических
соединении.
Температура, соответствующая какомулибо превращению в металле, называется
критической точкой.
Переход из жидкого состояния в твердое
при охлаждении сопровождается
образованием кристаллической решетки,
т. е. кристаллизацией. Чтобы вызвать
кристаллизацию, жидкий металл нужно
переохладить несколько ниже
температуры плавления.
Охлаждение жидкости ниже равновесной температуры
кристаллизации называется переохлаждением, которое
характеризуется степенью переохлаждения ():
Степень переохлаждения зависит от природы
металла, от степени его загрязненности (чем чище
металл, тем больше степень переохлаждения), от
скорости охлаждения (чем выше скорость
охлаждения, тем больше степень переохлаждени).
При нагреве всех кристаллических тел наблюдается
четкая граница перехода из твердого состояния в
жидкое. Такая же граница существует при переходе из
жидкого состояния в твердое.
– теоретическая температура кристаллизации;
.
– фактическая температура кристаллизации.
Кривая охлаждения чистого металла
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии,
процесс сопровождается плавным понижением
температуры. На участке 1 – 2 идет процесс
кристаллизации, сопровождающийся выделением тепла,
которое называется скрытой теплотой кристаллизации.
Оно компенсирует рассеивание теплоты в пространство, и
поэтому температура остается постоянной. После
окончания кристаллизации в точке 2 температура снова
начинает снижаться, металл охлаждается в твердом
состоянии.
Модель
процесса кристаллизации
При затвердевании и при аллотропическом превращении и металле вначале
возникают зародыши кристалла (центры кристаллизации), вокруг которых
группируются атомы, образуя соответствующую кристаллическую решетку.
Центрами кристаллизации могут служить неметаллические включения.
Таким образом, процесс кристаллизации складывается из двух этапов:
образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости
ориентированы случайно, кроме того, при первичной кристаллизации
кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные
кристаллы растут навстречу друг другу и точки их соприкосновения
определяют границы зерен.
Центры кристаллизации образуются в исходной фазе независимо друг от друга
в случайных местах. Сначала кристаллы имеют правильную форму, но по
мере столкновения и срастания с другими кристаллами форма нарушается.
Рост продолжается в направлениях, где есть свободный доступ питающей
среды. После окончания кристаллизации имеем поликристаллическое тело.
43. Условия получения мелкозернистой структуры.
Размеры образовавшихся кристаллов зависят от соотношения
числа образовавшихся центров кристаллизации и скорости роста
кристаллов при температуре кристаллизации.
Стремятся к получению мелкозернистой структуры. Оптимальными
условиями для этого являются: максимальное число центров
кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек
нерастворимых примесей, которые играют роль готовых центров
кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося
металла.
Стенки изложниц имеют неровности, шероховатости, которые
увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате
модифицирования, когда в жидкие металлы добавляются
посторонние вещества – модификаторы.
По механизму воздействия различают:
Вещества не растворяющиеся в жидком
металле – выступают в качестве
дополнительных центров кристаллизации.
Поверхностно — активные вещества,
которые растворяются в металле, и,
осаждаясь на поверхности растущих
кристаллов, препятствуют их росту.
46. Схема образования дендритной структуры
СХЕМА ОБРАЗОВАНИЯ ДЕНДРИТНОЙ СТРУКТУРЫ
49. Контрольный тест
КОНТРОЛЬНЫЙ ТЕСТ
1.Какие свойства не являются характерными
для металлов?
1) высокая пластичность
2) высокая теплопроводность
3) высокая электропроводность
4) отрицательный температурный коэффициент
электрического сопротивления
5) хорошая отражательная способность
2. В какой кристаллической ячейке 14 атомов?
1) Кубической объемноцентрированной,
2) Кубической гранецентрированной,
3) Гексагональной.
3. Свойство металлов перестраивать решетку
при определенных температурах в процессе
нагревания или охлаждения называется
1) Аллотропия
2) полиморфизм
4. Полиморфные превращения сопровождаются
изменением в твердом состоянии структуры
металлов и сплавов, какие их свойства при этом
изменяются
1) механические
2) физические
3) химические свойства.
5. Пустые узлы или вакансии и межузельные атомы
являются
1) линейными дефектами
2) поверхностными дефектами
3) точечными дефектами
6. Перемещение атомов, не связанных с
Перемещение атомов, не связанных с
изменением концентрации в отдельных
объемах, называется
1) гетеродиффузией
2) самодиффузией
3) диффузией.
7. Аморфные тела
1) анизотропны
2) изотропны
Металлические конструкции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3629
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице описывается структура металлов и связывается эта структура с физическими свойствами металла.
Структура металлов
Металлы представляют собой гигантские структуры атомов, удерживаемых вместе металлическими связями. «Гигантский» подразумевает, что задействовано большое, но различное количество атомов — в зависимости от размера куска металла.
«Гигантский» подразумевает, что задействовано большое, но различное количество атомов — в зависимости от размера куска металла.
12-координация
Большинство металлов плотно упакованы, то есть в доступный объем помещается как можно больше атомов. Каждый атом в структуре имеет 12 соприкасающихся соседей. Такой металл описывается как 12-координированный.
Каждый атом соприкасается с 6 другими атомами в каждом слое.
Также есть 3 атома, соприкасающиеся с любым конкретным атомом в верхнем слое, и еще 3 в нижнем слое.
На этой второй диаграмме показан слой непосредственно над первым слоем. Под ним будет соответствующий слой (на самом деле есть два разных способа размещения третьего слоя в плотно упакованной структуре, но это выходит за рамки этой темы).
8-координация
Некоторые металлы (в частности, в группе 1 периодической таблицы) упакованы менее эффективно, имея только 8 соприкасающихся соседей. Это 8-координатные.
Это 8-координатные.
Левая диаграмма показывает, что атомы не соприкасаются друг с другом в определенном слое. Их касаются только атомы в слоях выше и ниже. На правой диаграмме показаны 8 атомов (4 сверху и 4 снизу), соприкасающихся с атомом более темного цвета.
Кристаллические зерна
Было бы заблуждением полагать, что все атомы в куске металла расположены упорядоченным образом. Любой кусок металла состоит из большого количества «кристаллических зерен», представляющих собой области правильной формы. На границах зерен атомы сместились.
Физические свойства металлов
Температуры плавления и кипения
Металлы обычно имеют высокие температуры плавления и кипения из-за прочности металлической связи. Прочность связи варьируется от металла к металлу и зависит от количества электронов, которые каждый атом делокализует в море электронов, а также от упаковки. Металлы группы 1, такие как натрий и калий, имеют относительно низкие температуры плавления и кипения, главным образом потому, что каждый атом имеет только один электрон, который вносит свой вклад в связь, но есть и другие проблемы:
- Элементы группы 1 также неэффективно упакованы (8-координированы), так что они не образуют столько связей, как большинство металлов.

- У них относительно большие атомы (это означает, что ядра находятся на некотором расстоянии от делокализованных электронов), что также ослабляет связь.
Электропроводность
Металлы проводят электричество. Делокализованные электроны могут свободно перемещаться по структуре в трех измерениях. Они могут пересекать границы зерен. Несмотря на то, что рисунок может быть нарушен на границе, пока атомы соприкасаются друг с другом, металлическая связь все еще присутствует. Жидкие металлы также проводят электричество, показывая, что, хотя атомы металла могут свободно двигаться, делокализация остается в силе до тех пор, пока металл не закипит.
Теплопроводность
Металлы хорошо проводят тепло. Тепловая энергия воспринимается электронами как дополнительная кинетическая энергия (заставляет их двигаться быстрее). Энергия передается по остальной части металла движущимися электронами.
Пластичность и пластичность
Металлы подразделяются на ковкие (можно раскатывать в листы) и пластичные (можно вытягивать в проволоку). Это происходит из-за способности атомов перемещаться друг по другу в новые положения без разрыва металлической связи. Если к металлу приложить небольшое усилие, слои атомов начнут катиться друг по другу. Если напряжение снова снять, они вернутся в исходное положение. В этих условиях говорят, что металл эластичен.
Это происходит из-за способности атомов перемещаться друг по другу в новые положения без разрыва металлической связи. Если к металлу приложить небольшое усилие, слои атомов начнут катиться друг по другу. Если напряжение снова снять, они вернутся в исходное положение. В этих условиях говорят, что металл эластичен.
Если приложить большее усилие, атомы перекатываются друг через друга в новое положение, и металл необратимо изменяется.
Твердость металлов
Перекатыванию слоев атомов друг по другу препятствуют границы зерен, потому что ряды атомов не выстраиваются должным образом. Отсюда следует, что чем больше границ зерен (чем мельче отдельные кристаллические зерна), тем тверже становится металл.
Несмотря на это, поскольку границы зерен — это области, где атомы не находятся в таком хорошем контакте друг с другом, металлы имеют тенденцию к разрушению на границах зерен. Увеличение количества границ зерен не только делает металл более твердым, но и делает его более хрупким.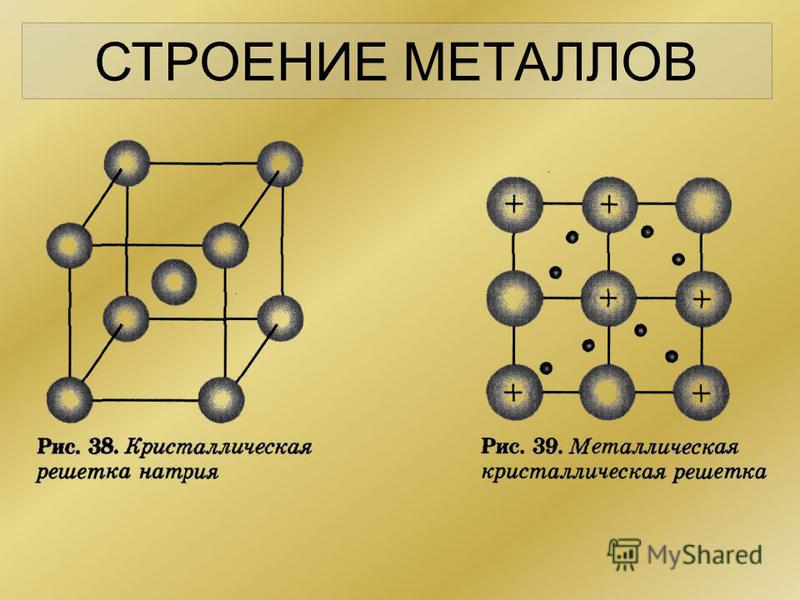
Контроль размера кристаллических зерен
Если у вас есть кусок чистого металла, вы можете контролировать размер зерен с помощью термической обработки или обработки металла. Нагрев металла приводит к более равномерному расположению атомов, уменьшая количество границ зерен и, таким образом, делая металл более мягким. При ударах по металлу, когда он холодный, образуется много мелких зерен. Таким образом, холодная обработка делает металл тверже. Чтобы восстановить его работоспособность, вам нужно будет его снова нагреть.
Вы также можете нарушить правильное расположение атомов, вставив в структуру атомы немного другого размера. Сплавы , такие как латунь (смесь меди и цинка), тверже исходных металлов, потому что неравномерность структуры помогает предотвратить скольжение рядов атомов друг относительно друга.
Участник
Джим Кларк (Chemguide.co.uk)
Эта страница под названием «Металлические конструкции» используется в соответствии с лицензией CC BY-NC 4. 0, ее автором, ремиксом и/или куратором является Джим Кларк.
0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги

Структура металлов | Инженерная библиотека
На этой странице представлены главы о структуре металлов из «Справочника по основам DOE: материаловедение», DOE-HDBK-1017/1-9.3, Министерство энергетики США, январь 1993 г.
Другие связанные главы из «Справочника по основам Министерства энергетики: материаловедение» можно увидеть справа.
Склеивание
Расположение атомов в материале определяет поведение и свойства этого материала. Большинство материалов, используемых при строительстве ядерных реакторов, представляют собой металлы. В этой главе мы обсудим различные типы соединений, возникающих в материалах, выбранных для использования в реакторной установке. В Справочнике по химии типы склеивания обсуждаются более подробно.
Атомная связь
Материя, как мы ее знаем, существует в трех обычных состояниях. Эти три состояния – твердое, жидкое и газообразное. Атомные или молекулярные взаимодействия, происходящие внутри вещества, определяют его состояние. В этой главе мы будем иметь дело главным образом с твердыми телами, потому что твердые тела представляют наибольшую проблему в технических приложениях материалов. Жидкости и газы будут упомянуты только в сравнительных целях.
В этой главе мы будем иметь дело главным образом с твердыми телами, потому что твердые тела представляют наибольшую проблему в технических приложениях материалов. Жидкости и газы будут упомянуты только в сравнительных целях.
Твердое вещество удерживается вместе силами, возникающими между соседними атомами или молекулами. Эти силы возникают из-за различий в электронных облаках атомов. Другими словами, валентные электроны или электроны внешней оболочки атомов определяют их притяжение к своим соседям. Когда физическое притяжение между молекулами или атомами материала велико, материал плотно удерживается вместе. Молекулы в твердых телах тесно связаны друг с другом. Когда притяжение слабее, вещество может быть в жидкой форме и свободно течь. Газы практически не проявляют сил притяжения между атомами или молекулами, и их частицы могут свободно двигаться независимо друг от друга.
Типы связей в материале определяются тем, как силы удерживают материю вместе. Рисунок 1 иллюстрирует несколько типов облигаций, а их характеристики перечислены ниже.
- Ионная связь. В этом типе связи один или несколько электронов полностью передаются от атома одного элемента к атому другого, и элементы удерживаются вместе силой притяжения из-за противоположной полярности заряда.
- Ковалентная связь – связь, образованная общими электронами. Электроны являются общими, когда атому нужны электроны для завершения его внешней оболочки, и он может поделиться этими электронами со своим соседом. Тогда электроны входят в состав обоих атомов, и обе оболочки заполнены.
- Металлическая связь. В этом типе связи атомы не обмениваются электронами и не обмениваются электронами для связи друг с другом. Вместо этого многие электроны (примерно по одному на каждый атом) могут более или менее свободно перемещаться по металлу, так что каждый электрон может взаимодействовать со многими неподвижными атомами.
- Молекулярная связь. Когда электроны нейтральных атомов проводят больше времени в одной области своей орбиты, будет существовать временный слабый заряд.
 Молекула будет слабо притягивать другие молекулы. Это иногда называют ван-дер-ваальсовыми или молекулярными связями.
Молекула будет слабо притягивать другие молекулы. Это иногда называют ван-дер-ваальсовыми или молекулярными связями. - Водородная связь. Эта связь похожа на молекулярную связь и возникает из-за легкости, с которой атомы водорода готовы отдать электрон атомам кислорода, фтора или азота.
Некоторые примеры материалов и их связей указаны в таблице 1.
| Материал | Бонд |
|---|---|
| Хлорид натрия | Ионный |
| Алмаз | Ковалентный |
| Натрий | Металлик |
| Сплошной H 2 | Молекулярный |
| Лед | Водород |
Тип связи определяет не только то, насколько хорошо материал удерживается вместе, но и то, какими микроскопическими свойствами обладает материал. Такие свойства, как способность проводить тепло или электрический ток, определяются свободой движения электронов.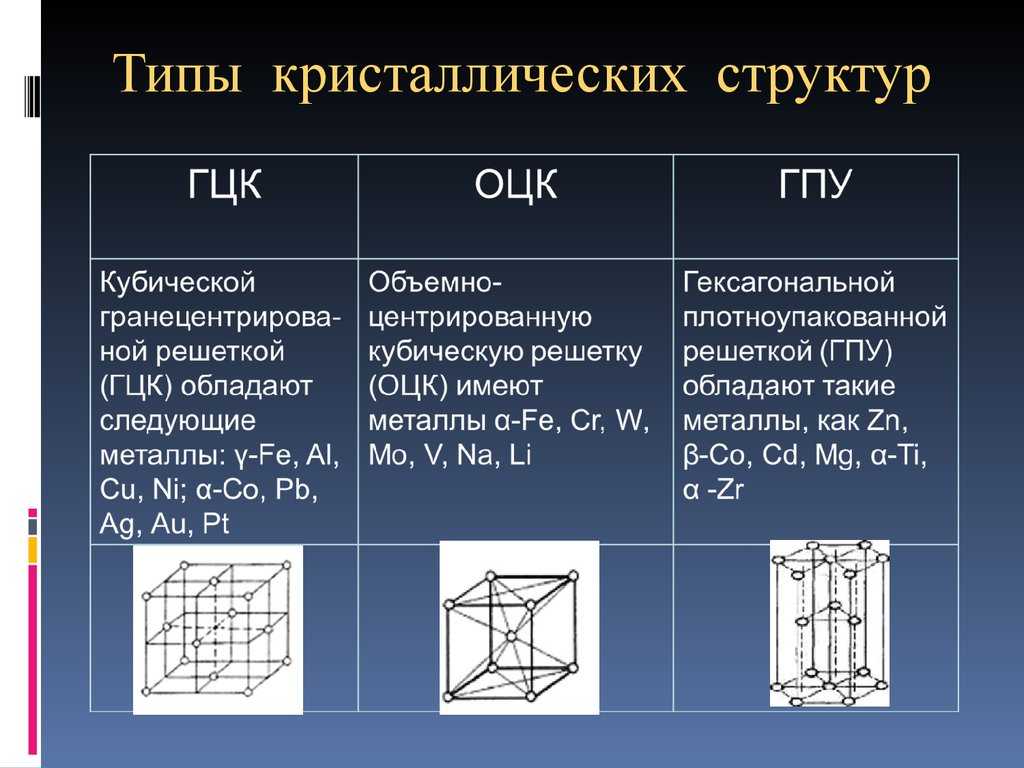 Это зависит от типа существующей связи. Знание микроскопической структуры материала позволяет нам предсказать, как этот материал будет вести себя в определенных условиях. И наоборот, материал может быть синтетически изготовлен с заданной микроскопической структурой, чтобы получить свойства, желательные для определенных технических приложений.
Это зависит от типа существующей связи. Знание микроскопической структуры материала позволяет нам предсказать, как этот материал будет вести себя в определенных условиях. И наоборот, материал может быть синтетически изготовлен с заданной микроскопической структурой, чтобы получить свойства, желательные для определенных технических приложений.
Рисунок 1: Типы склеивания
Порядок в микроструктурах
Твердые тела имеют большее межатомное притяжение, чем жидкости и газы. Однако существуют большие различия в свойствах твердых материалов, используемых в технических целях. Свойства материалов зависят от их межатомных связей. Эти же связи также определяют пространство между конфигурацией атомов в твердых телах. Все твердые тела можно разделить на аморфные и кристаллические.
Аморфный
Аморфные материалы не имеют регулярного расположения своих молекул. Такие материалы, как стекло и парафин, считаются аморфными. Аморфные материалы обладают свойствами твердых тел. Они имеют определенную форму и объем и медленно диффундируют. У этих материалов также отсутствуют четко определенные температуры плавления. Во многом они напоминают жидкости, которые очень медленно текут при комнатной температуре.
Они имеют определенную форму и объем и медленно диффундируют. У этих материалов также отсутствуют четко определенные температуры плавления. Во многом они напоминают жидкости, которые очень медленно текут при комнатной температуре.
Кристаллический
В кристаллической структуре атомы расположены в трехмерном массиве, называемом решеткой. Решетка имеет правильную повторяющуюся конфигурацию во всех направлениях. Группа частиц из одной части кристалла находится в точно таком же геометрическом отношении, что и группа из любой другой части того же кристалла.
У нас есть несколько структурных калькуляторов на выбор. Здесь только несколько:
- Калькулятор луча
- Калькулятор болтовых соединений
- Распределение силы болтового соединения
- Калькулятор зажимов
- Калькулятор потери устойчивости колонны
- Калькулятор роста усталостной трещины
Распространенные типы решеток
Все металлы, используемые в реакторе, имеют кристаллическую структуру. Кристаллические микроструктуры организованы в виде трехмерных массивов, называемых решетками. В этой главе будут обсуждаться три наиболее распространенные решетчатые структуры и их характеристики.
Кристаллические микроструктуры организованы в виде трехмерных массивов, называемых решетками. В этой главе будут обсуждаться три наиболее распространенные решетчатые структуры и их характеристики.
Общие кристаллические структуры
В металлах и во многих других твердых телах атомы расположены в виде правильных рядов, называемых кристаллами. Кристаллическая структура состоит из атомов, расположенных по образцу, который периодически повторяется в трехмерной геометрической решетке. Силы химической связи вызывают это повторение. Именно этот повторяющийся шаблон определяет такие свойства, как прочность, пластичность, плотность (описанную в Модуле 2 «Свойства металлов»), проводимость (свойство проводить или передавать тепло, электричество и т. д.) и форму.
В целом, тремя наиболее распространенными основными структурами кристаллов, связанными с металлами, являются: (а) объемно-центрированная кубическая, (б) гранецентрированная кубическая и (в) гексагональная плотноупакованная. На рис. 2 показаны эти три шаблона.
На рис. 2 показаны эти три шаблона.
Рис. 2. Распространенные типы решеток
Объемно-центрированная кубическая
В объемно-центрированном кубическом (ОЦК) расположении атомов элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре тела куба.
Гранецентрированный куб
В гранецентрированном кубическом расположении атомов (FCC) элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре каждой из граней куба.
Шестигранник В закрытой упаковке
В гексагональной плотноупакованной схеме (HCP) атомов элементарная ячейка состоит из трех слоев атомов. Верхний и нижний слои содержат по шесть атомов в углах шестиугольника и по одному атому в центре каждого шестиугольника. Средний слой содержит три атома, расположенные между атомами верхнего и нижнего слоев, отсюда и название плотная упаковка.
Большинство диаграмм структурных ячеек для ОЦК и ГЦК форм железа нарисованы так, как если бы они были одного размера, как показано на рисунке 2, но это не так. В схеме ОЦК структурная ячейка, в которой используются всего девять атомов, намного меньше.
В схеме ОЦК структурная ячейка, в которой используются всего девять атомов, намного меньше.
Такие металлы, как α-железо (Fe) (феррит), хром (Cr), ванадий (V), молибден (Mo) и вольфрам (W), обладают структурой ОЦК. Эти металлы ОЦК обладают двумя общими свойствами: высокой прочностью и низкой пластичностью (что допускает остаточную деформацию). Металлы FCC, такие как γ-железо (Fe) (аустенит), алюминий (Al), медь (Cu), свинец (Pb), серебро (Ag), золото (Au), никель (Ni), платина (Pt) и торий (Th), как правило, имеют более низкую прочность и более высокую пластичность, чем металлы ОЦК. ГПУ-структуры обнаружены в бериллии (Be), магнии (Mg), цинке (Zn), кадмии (Cd), кобальте (Co), таллии (Tl) и цирконии (Zr).
Зернистая структура и границы
Металлы содержат зерна и кристаллические структуры. Человеку нужен микроскоп, чтобы увидеть зерна и кристаллические структуры. Зерна и границы зерен помогают определить свойства материала.
Зернистая структура и границы
Если бы вы взяли небольшой срез обычного металла и исследовали его под микроскопом, вы бы увидели структуру, подобную той, что показана на рис. 3(а). Каждая из светлых областей называется зерном, или кристаллом, то есть областью пространства, занятой сплошной кристаллической решеткой. Темные линии, окружающие зерна, являются границами зерен. Структура зерна относится к расположению зерен в металле, при этом зерно имеет определенную кристаллическую структуру.
3(а). Каждая из светлых областей называется зерном, или кристаллом, то есть областью пространства, занятой сплошной кристаллической решеткой. Темные линии, окружающие зерна, являются границами зерен. Структура зерна относится к расположению зерен в металле, при этом зерно имеет определенную кристаллическую структуру.
Граница зерна относится к внешней области зерна, которая отделяет его от других зерен. Граница зерна представляет собой область несоответствия между зернами и обычно имеет ширину от одного до трех атомов. Границы зерен разделяют разноориентированные области кристаллов (поликристаллические), в которых кристаллическая структура идентична. На рис. 3(б) представлены четыре зерна разной ориентации и границы зерен, возникающие на границах раздела между зернами.
Очень важной характеристикой металла является средний размер зерна. Размер зерна определяет свойства металла. Например, меньший размер зерна увеличивает прочность на растяжение и имеет тенденцию к увеличению пластичности. Более крупный размер зерна предпочтителен для улучшения характеристик ползучести при высоких температурах. Ползучесть – это постоянная деформация, увеличивающаяся со временем при постоянной нагрузке или напряжении. Ползучесть становится все легче с повышением температуры. Напряжение и деформация рассматриваются в Модуле 2, Свойства металлов, а ползучесть рассматривается в Модуле 5, Растительные материалы.
Более крупный размер зерна предпочтителен для улучшения характеристик ползучести при высоких температурах. Ползучесть – это постоянная деформация, увеличивающаяся со временем при постоянной нагрузке или напряжении. Ползучесть становится все легче с повышением температуры. Напряжение и деформация рассматриваются в Модуле 2, Свойства металлов, а ползучесть рассматривается в Модуле 5, Растительные материалы.
Рисунок 3: Зерна и границы
(а) микроскопический (б) атомный
Еще одним важным свойством зерен является их ориентация. На рис. 4(а) представлено случайное расположение зерен, при котором ни одно направление внутри зерен не совпадает с внешними границами металлического образца. Эта случайная ориентация может быть получена путем поперечной прокатки материала. Если такой образец достаточно прокатать в одном направлении, в нем может образоваться ориентированная по зерну структура в направлении прокатки, как показано на рис. 4(b). Это называется предпочтительной ориентацией. Во многих случаях предпочтительная ориентация очень желательна, но в других случаях она может быть очень вредной. Например, предпочтительная ориентация урановых топливных элементов может привести к катастрофическим изменениям размеров при использовании в ядерном реакторе.
Во многих случаях предпочтительная ориентация очень желательна, но в других случаях она может быть очень вредной. Например, предпочтительная ориентация урановых топливных элементов может привести к катастрофическим изменениям размеров при использовании в ядерном реакторе.
Рисунок 4: Ориентация зерен
(a) Случайная (b) Предпочтительная
У нас есть несколько структурных калькуляторов на выбор. Здесь только несколько:
- Калькулятор луча
- Калькулятор болтовых соединений
- Распределение силы болтового соединения
- Калькулятор зажимов
- Калькулятор потери устойчивости колонны
- Калькулятор роста усталостной трещины
Полиморфизм
Металлы могут существовать более чем в одной форме одновременно. В этой главе мы обсудим это свойство металлов.
Фазы полиморфизма
Полиморфизм — это свойство или способность металла существовать в двух или более кристаллических формах в зависимости от температуры и состава. Этим свойством обладают большинство металлов и металлических сплавов. Уран — хороший пример металла, проявляющего полиморфизм. Металлический уран может существовать в трех различных кристаллических структурах. Каждая структура существует на определенной фазе, как показано на рисунке 5.
Этим свойством обладают большинство металлов и металлических сплавов. Уран — хороший пример металла, проявляющего полиморфизм. Металлический уран может существовать в трех различных кристаллических структурах. Каждая структура существует на определенной фазе, как показано на рисунке 5.
- Альфа-фаза, от комнатной температуры до 663°C
- Бета-фаза, от 663°C до 764°C
- Гамма-фаза, от 764°С до точки плавления 1133°С.
Рисунок 5: Кривая охлаждения для нелегированного урана
Альфа-фаза
Альфа-фаза (α) стабильна при комнатной температуре и имеет кристаллическую систему, характеризующуюся тремя неравными осями, расположенными под прямым углом.
В альфа-фазе свойства решетки различны по осям X, Y и Z. Это связано с тем, что регулярно повторяющееся состояние атомов отличается. Из-за этого условия при нагревании фаза расширяется в направлениях X и Z и сжимается в направлении Y. На рис. 6 показано, что происходит с размерами (Å = ангстрем, одна стомиллионная сантиметра) элементарной ячейки альфа-урана при нагревании.
Как показано, нагревание и охлаждение альфа-фазы урана может привести к резкому изменению размеров и грубым искажениям металла. Таким образом, чистый уран не используется в качестве топлива, а только в сплавах или соединениях.
Рисунок 6: Изменение содержания альфа-урана при нагревании от 0 до 300 °C
Бета-фаза
Бета (β) фаза урана возникает при повышенных температурах. Эта фаза имеет тетрагональную (четыре угла и четыре стороны) структуру решетки и является достаточно сложной.
Гамма Фаза
Гамма (γ) фаза урана образуется при температурах выше тех, которые необходимы для стабильности бета фазы. В гамма-фазе структура решетки ОЦК и при нагревании расширяется одинаково во все стороны.
Дополнительные примеры
Два дополнительных примера полиморфизма перечислены ниже.
- Нагрев железа до 907°C вызывает переход железа из ОЦК (альфа, феррит) в форму ГЦК (гамма, аустенит).
- Цирконий находится в ГПУ (альфа) до 863°С, где он переходит в ОЦК (бета, цирконий) форму.

Свойства одной полиморфной формы одного и того же металла будут отличаться от свойств другой полиморфной формы. Например, гамма-железо может растворять до 1,7% углерода, тогда как альфа-железо может растворять только 0,03%.
Сплавы
Большинство материалов, используемых в проектировании конструкций или производстве компонентов, представляют собой металлы. Легирование является обычной практикой, поскольку металлические связи позволяют соединять различные типы металлов.
Сплавы
Сплав представляет собой смесь двух или более материалов, по крайней мере один из которых является металлом. Сплавы могут иметь микроструктуру, состоящую из твердых растворов, где вторичные атомы вводятся в кристаллическую решетку в качестве замещающих или внедренных атомов (более подробно обсуждаются в следующей главе и Модуле 5, Растительные материалы). Сплав также может быть кристаллом с металлическим соединением в каждой точке решетки. Кроме того, сплавы могут состоять из вторичных кристаллов, внедренных в первичную поликристаллическую матрицу. Этот тип сплава называется композитным (хотя термин «композитный» не обязательно означает, что составные материалы представляют собой металлы). Модуль 2, Свойства металлов, обсуждает, как различные элементы изменяют физические свойства металла.
Этот тип сплава называется композитным (хотя термин «композитный» не обязательно означает, что составные материалы представляют собой металлы). Модуль 2, Свойства металлов, обсуждает, как различные элементы изменяют физические свойства металла.
Общие характеристики сплавов
Сплавы обычно прочнее чистых металлов, хотя обычно обладают меньшей электропроводностью и теплопроводностью. Прочность – важнейший критерий, по которому оценивают многие конструкционные материалы. Поэтому сплавы используются для машиностроения. Сталь, вероятно, самый распространенный конструкционный металл, является хорошим примером сплава. Это сплав железа и углерода с другими элементами, придающими ему определенные желаемые свойства.
Как упоминалось в предыдущей главе, иногда материал может состоять из нескольких твердых фаз. Прочность этих материалов повышается за счет того, что твердая структура становится формой, состоящей из двух перемежающихся фаз. Когда рассматриваемый материал представляет собой сплав, можно закалить (более подробно обсуждается в Модуле 2, Свойства металлов) металл из расплавленного состояния с образованием вкрапленных фаз. Вид и скорость закалки определяют конечную структуру твердого тела и, следовательно, его свойства.
Вид и скорость закалки определяют конечную структуру твердого тела и, следовательно, его свойства.
Нержавеющая сталь типа 304
Нержавеющая сталь типа 304 (содержащая 18-20% хрома и 8-10,5% никеля) используется в резервуарах реакторов для производства трития, трубопроводах технологической воды и оригинальных технологических теплообменниках. Этот сплав устойчив к большинству видов коррозии.
Состав обычных технических материалов
Большое разнообразие конструкций, систем и компонентов, используемых на ядерных объектах Министерства энергетики США, изготовлено из самых разных материалов. Многие материалы представляют собой сплавы с основным металлом из железа, никеля или циркония. Выбор материала для конкретного применения основан на многих факторах, включая температуру и давление, которым будет подвергаться материал, устойчивость материала к определенным типам коррозии, ударную вязкость и твердость материала, а также другие свойства материала.
Одним из материалов, который имеет широкое применение в системах объектов Министерства энергетики, является нержавеющая сталь. Существует около 40 стандартных типов нержавеющей стали и множество других специализированных типов под различными торговыми названиями. Благодаря модификации видов и количеств легирующих элементов сталь можно адаптировать для конкретных применений. Нержавеющие стали классифицируются как аустенитные или ферритные в зависимости от их структуры решетки. Аустенитные нержавеющие стали, в том числе 304 и 316, имеют гранецентрированную кубическую структуру атомов железа с углеродом в твердом растворе внедрения. Ферритные нержавеющие стали, включая тип 405, имеют объемно-центрированную кубическую железную решетку и не содержат никеля. Ферритные стали легче сваривать и изготавливать, они менее подвержены коррозионному растрескиванию под напряжением, чем аустенитные нержавеющие стали. Они обладают лишь умеренной устойчивостью к другим типам химического воздействия.
Существует около 40 стандартных типов нержавеющей стали и множество других специализированных типов под различными торговыми названиями. Благодаря модификации видов и количеств легирующих элементов сталь можно адаптировать для конкретных применений. Нержавеющие стали классифицируются как аустенитные или ферритные в зависимости от их структуры решетки. Аустенитные нержавеющие стали, в том числе 304 и 316, имеют гранецентрированную кубическую структуру атомов железа с углеродом в твердом растворе внедрения. Ферритные нержавеющие стали, включая тип 405, имеют объемно-центрированную кубическую железную решетку и не содержат никеля. Ферритные стали легче сваривать и изготавливать, они менее подвержены коррозионному растрескиванию под напряжением, чем аустенитные нержавеющие стали. Они обладают лишь умеренной устойчивостью к другим типам химического воздействия.
Другими металлами, которые имеют особое применение на некоторых ядерных объектах Министерства энергетики, являются инконель и циркалой. Состав этих металлов и различных типов нержавеющей стали указан в Таблице 2 ниже.
Состав этих металлов и различных типов нержавеющей стали указан в Таблице 2 ниже.
| %Fe | %С Макс. | %Cr | %Ni | % Мо | %Mn Макс. | %Si Макс. | %Zr | |
|---|---|---|---|---|---|---|---|---|
| Нержавеющая сталь 304 | Бал. | 0,08 | 19 | 10 | 2 | 1 | ||
| Нержавеющая сталь 304L | Бал. | 0,03 | 18 | 8 | 2 | 1 | ||
| Нержавеющая сталь 316 | Бал. | 0,08 | 17 | 12 | 2,5 | 2 | 1 | |
| Нержавеющая сталь 316L | Бал. | 0,03 | 17 | 12 | 2,5 | 2 | ||
| 405 Нержавеющая сталь | Бал. | 0,08 | 13 | 1 | 1 | |||
| Инконель | 8 | 0,15 | 15 | Бал.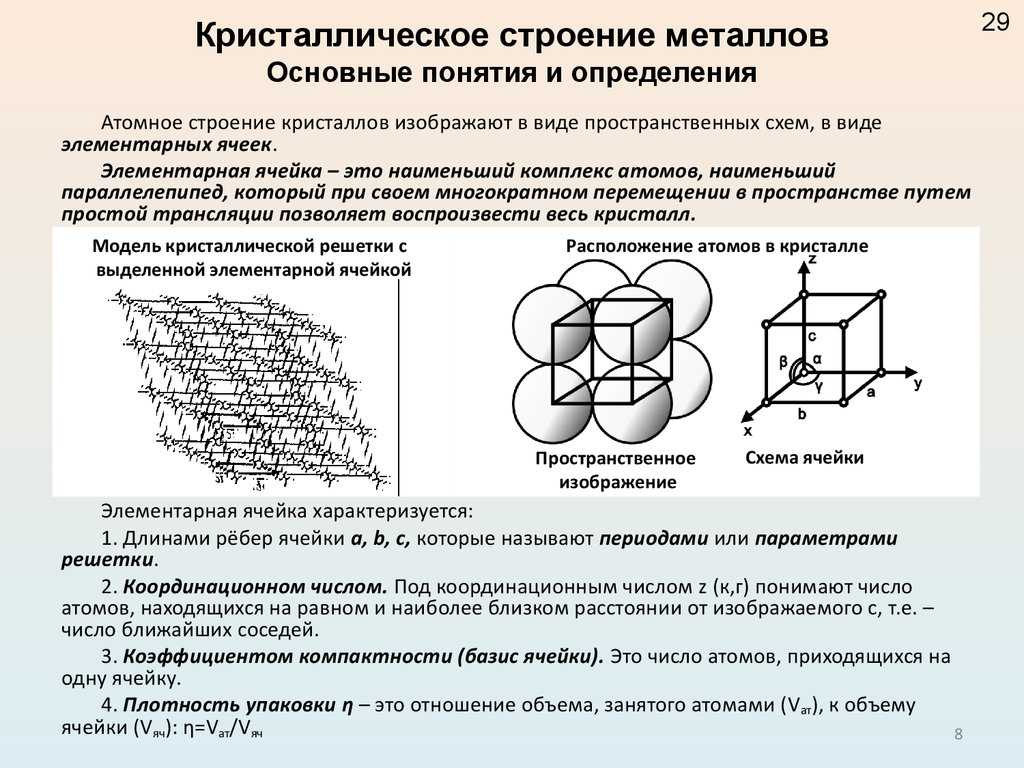 | 1 | 0,5 | ||
| Циркалой-4 | 0,21 | 0,1 | Бал. |
У нас есть несколько структурных калькуляторов на выбор. Здесь только несколько:
- Калькулятор луча
- Калькулятор болтовых соединений
- Распределение силы болтового соединения
- Калькулятор зажимов
- Калькулятор потери устойчивости колонны
- Калькулятор роста усталостной трещины
Дефекты металлов
Обсуждение порядка в микроструктурах в предыдущих главах предполагало идеализированные микроструктуры. В действительности материалы не состоят из идеальных кристаллов и не свободны от примесей, изменяющих их свойства. Даже аморфные твердые тела имеют несовершенства и примеси, которые изменяют их структуру.
Микроскопические дефекты
Микроскопические дефекты обычно классифицируются как точечные, линейные или межфазные дефекты.
- Точечные несовершенства имеют атомарные размеры.
- Линейные несовершенства или дислокации обычно имеют длину в несколько атомов.
- Межфазные дефекты больше, чем линейные дефекты, и возникают в двумерной области.
Точечные дефекты
Точечные дефекты в кристаллах можно разделить на три основные категории дефектов. Они показаны на рисунке 7.
- Вакансионные дефекты возникают из-за отсутствия атома в позиции решетки. Дефект вакансионного типа может возникать из-за несовершенной упаковки в процессе кристаллизации или из-за повышенных тепловых колебаний атомов, вызванных повышенной температурой.
- Дефекты замещения возникают из-за примеси, присутствующей в положении решетки.
Междоузельные дефекты возникают из-за того, что примесь находится в междоузлии или один из атомов решетки находится в междоузлии, а не в своем положении в решетке. Междоузлие относится к местам между атомами в структуре решетки.

Примеси внедрения, называемые модификаторами сетки, действуют как точечные дефекты в аморфных твердых телах. Наличие точечных дефектов может увеличить или уменьшить ценность материала для инженерного строительства в зависимости от предполагаемого использования.
Рисунок 7: Точечные дефекты
Линейные дефекты
Линейные дефекты называются дислокациями и встречаются только в кристаллических материалах. Дислокации могут быть краевого, винтового или смешанного типа, в зависимости от того, как они искажают решетку, как показано на рис. 8. Важно отметить, что дислокации не могут заканчиваться внутри кристалла. Они должны заканчиваться на краю кристалла или другом дислокации, или же они должны замкнуться сами на себя.
Краевые дислокации состоят из дополнительного ряда или плоскости атомов в кристаллической структуре. Несовершенство может проходить по прямой линии через весь кристалл или идти по неправильной траектории. Он также может быть коротким, простираясь лишь на небольшое расстояние вглубь кристалла, вызывая скольжение на одно атомное расстояние вдоль плоскости скольжения (направление движения краевого дефекта).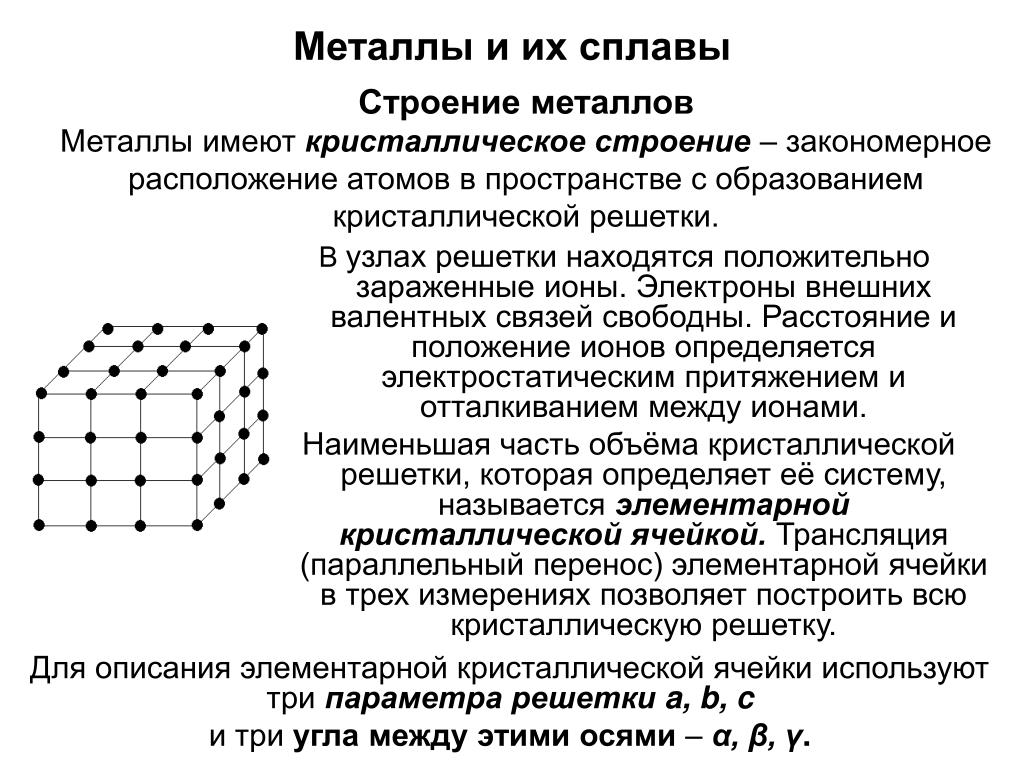
Рисунок 8: Линейные дефекты (дислокации)
Скольжение происходит, когда кристалл подвергается напряжению, и дислокация движется через кристалл, пока не достигнет края или не будет остановлена другой дислокацией, как показано на рисунке 9.. Позиция 1 показывает нормальную кристаллическую структуру. Позиция 2 показывает силу, приложенную с левой стороны, и противодействующую силу, приложенную с правой стороны. Позиции с 3 по 5 показывают, как конструкция проскальзывает. Позиция 6 показывает окончательную деформированную кристаллическую структуру. Скольжение одной активной плоскости обычно составляет порядка 1000 атомных расстояний, и для получения текучести требуется скольжение по многим плоскостям.
Рисунок 9: Накладки
Винтовые дислокации могут быть вызваны разрывом кристалла параллельно направлению скольжения. Если проследить за винтовой дислокацией по всей цепи, она покажет схему скольжения, подобную той, что имеет винтовая резьба. Рисунок может быть как левым, так и правым. Это требует, чтобы некоторые из атомных связей непрерывно переформировывались, так что кристалл после разрушения имеет почти ту же форму, что и раньше.
Это требует, чтобы некоторые из атомных связей непрерывно переформировывались, так что кристалл после разрушения имеет почти ту же форму, что и раньше.
Ориентация дислокаций может варьироваться от чисто краевой до чисто винтовой. В какой-то промежуточной точке они могут обладать как краевыми, так и винтовыми характеристиками. Важность дислокаций основана на легкости, с которой они могут перемещаться по кристаллам.
Межфазные дефекты
Межфазные дефекты существуют под углом между любыми двумя гранями кристалла или кристаллической формы. Эти дефекты обнаруживаются на свободных поверхностях, границах доменов, границах зерен или межфазных границах. Свободные поверхности являются границами между газами и твердыми телами. Границы доменов относятся к интерфейсам, где электронные структуры различны с обеих сторон, что приводит к тому, что каждая сторона действует по-разному, хотя с обеих сторон существует одно и то же атомное расположение. Границы зерен существуют между кристаллами с одинаковой структурой решетки, которые обладают различной пространственной ориентацией. Поликристаллические материалы состоят из множества зерен, разделенных расстоянием, обычно составляющим несколько атомных диаметров. Наконец, межфазные границы существуют между областями, где материалы находятся в разных фазах (т. е. ОЦК рядом с ГЦК-структурами).
Поликристаллические материалы состоят из множества зерен, разделенных расстоянием, обычно составляющим несколько атомных диаметров. Наконец, межфазные границы существуют между областями, где материалы находятся в разных фазах (т. е. ОЦК рядом с ГЦК-структурами).
Макроскопические дефекты
Трехмерные макроскопические дефекты называются объемными дефектами. Обычно они встречаются в гораздо большем масштабе, чем микроскопические дефекты. Эти макроскопические дефекты обычно вносятся в материал во время очистки от его исходного состояния или в процессе изготовления.
Наиболее распространенный объемный дефект возникает из-за включения посторонних частиц в основной материал. Эти частицы второй фазы, называемые включениями, редко нужны, потому что они значительно изменяют структурные свойства. Примером включения могут быть частицы оксида в чистом металле или немного глины в структуре стекла.
Другие объемные дефекты включают газовые карманы или усадочные полости, которые обычно встречаются в отливках.



 Молекула будет слабо притягивать другие молекулы. Это иногда называют ван-дер-ваальсовыми или молекулярными связями.
Молекула будет слабо притягивать другие молекулы. Это иногда называют ван-дер-ваальсовыми или молекулярными связями.