Содержание
Углеводородное топливо — назначение и его виды
- Что такое углеводородное топливо?
- Углеводородное топливо: основные разновидности
- Углеводородное топливо жидкое
- Углеводородное топливо в сжиженном виде
- Углеводородные топлива, получаемые из пара и солнца
- Свойства углеводородного топлива
- Применение углеводородных топлив
- Плюсы и минусы углеводородных сжиженных и жидких топлив
- Углеводородное топливо: основные разновидности
Углеводородное топливо — полезное вещество с высоким содержанием в составе углеводорода без определенной температуры кипения. Оно может из воздуха поглощать и растворять воду. В качестве источников для его получения используют природный газ и сырую нефть.
Углеводородное топливо — это нефтяное жидкое и сжиженное топливо, горючие газы. Углеводородов в его составе от 96 до 99%. Тепловая способность вещества прямо пропорционально зависит от содержания водорода. Самая большая тепловая способность у метана, поскольку в его составе 25% водорода.
Самая большая тепловая способность у метана, поскольку в его составе 25% водорода.
Где применяется углеводородное топливо? Какими свойствами оно обладает? Какие его виды существуют? В чем заключаются преимущества и недостатки углеводородных топлив? Почему очень важно правильно подбирать его для двигателя? Как оно влияет на рабочие параметры мотора? Давайте разбираться.
Углеводородное топливо: основные разновидности
Различают три ключевых вида углеводородного топлива — сжиженное, жидкое, от пара и солнечного света. О каждом расскажем более подробно.
Углеводородное топливо жидкое
Продукт переработки нефти. Изготавливается таким способом: когда сырая нефть нагревается, ее переводят в газ, после чего из нее отбирают тяжелые, вязкие и трудносгораемые углеводороды, так до того момента, пока не получится готовый продукт — бензин. Остатки перегонки — мазут — разделяют на фракции: смазочные технические масла, дизельное топливо, вазелин. В результате переработки некоторых сортов нефти получают парафин и гудрон. Их активно используют в дорожном строительстве.
В результате переработки некоторых сортов нефти получают парафин и гудрон. Их активно используют в дорожном строительстве.
Самые популярные виды топлива:
-
Бензин. Состав топлива этого вида сложный, включает огромное количество отдельных углеводородов. Его производят из 50% сырой нефти. Состоит из продуктов полимеризации, природного и обычного бензина, полученного в ходе крекинг-процесса, сжиженных газов, моторного топлива. -
Керосин. Один из самых легких и летучих видов топлива. Входит в состав моторного технического топлива. У него большая вязкость, горит ясным и высоким пламенем, не образует копоть и углистый осадок. Медленно нагревается, используется при производстве реактивного топлива, отличается фракционным составом, применяется в разных сферах и отраслях. -
Дизельное топливо. Этот вид топлива применяют в моторах, в которых горючее воспламеняется при температуре не более 7 тыс. градусов. -
Каменный уголь. Перерабатывают по технологии гидрирования, коксования или неполного сгорания. Под воздействием высоких температур меняет состав, распадается на кокс и летучие составляющие, при охлаждении из летучих составляющих испаряются аммиачные воды, смолы, остаются этилен, метан, азот, бензол, аммиак, т. д. Если пропустить через серную кислоту перечисленные вещества, то выделится сульфат аммония — одно из самых востребованных удобрений. Поглощение бензола осуществляют с помощью растворителя.
Перерабатывают по технологии гидрирования, коксования или неполного сгорания. Под воздействием высоких температур меняет состав, распадается на кокс и летучие составляющие, при охлаждении из летучих составляющих испаряются аммиачные воды, смолы, остаются этилен, метан, азот, бензол, аммиак, т. д. Если пропустить через серную кислоту перечисленные вещества, то выделится сульфат аммония — одно из самых востребованных удобрений. Поглощение бензола осуществляют с помощью растворителя.
Из всех видов топлива, получаемых из нефти, бензин считается самым востребованным. Именно поэтому его производство занимает львиную долю.
Углеводородное топливо в сжиженном виде
Не используют в виде газа. Служит источником тепла в районах и местах без централизованного отопления. Яркий представитель рассматриваемого вида топлива — это метан. Если охладить его до температуры –160 градусов, происходит его сжатие и переход в бесцветную жидкость без запаха. Показатель плотности метана 0,5 кг/л. Разновидность углеводородного топлива весит в два раза меньше, чем вода. Он взрывобезопасный и невоспламеняемый, поэтому его безопасно перевозить. Если нормализовать температуру, метан снова станет газом.
Разновидность углеводородного топлива весит в два раза меньше, чем вода. Он взрывобезопасный и невоспламеняемый, поэтому его безопасно перевозить. Если нормализовать температуру, метан снова станет газом.
Среди других видов сжиженных углеводородных полезных ископаемых топлив особое место отводят попутным газам, которые растворяются под давлением нефти: азоту, аргону, углекислому газу. Их перерабатывают на бутан, этан, пропан. Чтобы получить так называемые непредельные углеводороды, этан и пропан дегидрируют.
Углеводородные топлива, получаемые из пара и солнца
Эта разновидность топлива появилась относительно недавно. Ее впервые в 2016 году получили в американской лаборатории, используя в атмосфере CO₂, пар и солнечный свет. В специальном проточном реакторе пар под высоким давлением смешивали с углекислым газом, в качестве катализатора выступал солнечный свет. Разработчики утверждают, что в скором времени их способ получения углеводородного синтетического моторного топлива станет популярным даже при условии дешевой нефти.
Свойства углеводородного топлива
Углеводородные топлива имеют следующие свойства:
-
Коррозионные. Вызывают окислительные реакции сплавов и металлов, поскольку содержат в своем составе серу, органические кислоты, воду, азотистые соединения (чем их больше в составе, тем агрессивнее углеводородные топлива), могут быть разной стабильности в зависимости от содержания. -
Высокая скорость горения, воспламеняемость. Зависит во многом от значения цетанового числа. Чем больше углеводов в топливе, тем выше цетановое число. -
Высокая температура кипения. У каждой разновидности углеродного топлива она своя или не ограничивается какими-либо конкретными показателями. -
Устойчивость к накоплению статического электричества. Топлива с высоким содержанием углеродов и водорода не вызывают и не сохраняют свободный электрический заряд на поверхностях и в объеме диэлектриков. -
Улучшенная электропроводимость. Топлива с большим количеством углеводородов в составе хорошо проводят электрический ток и имеют низкую величину электрического сопротивления.
Топлива с большим количеством углеводородов в составе хорошо проводят электрический ток и имеют низкую величину электрического сопротивления. -
Летучесть. Хорошо испаряются, легко переходят из жидкого в газо- и парообразное состояние. -
Взрывоопасность. Углеродистые топлива имеют низкую температуру вспышки, поэтому легко воспламеняются, горят и взрываются в определенных производственных условиях. -
Дымность и токсичность. При сгорании выделяют вещества, имеющие достаточно ядовитый состав. -
Плотность и вязкость. Гарантируют стабильную подачу топлива, его равномерное распыление в камере сгорания. -
Устойчивость к низким температурам. Топлива с высоким содержанием углеводородов в составе не замерзают в сильные морозы, благодаря этому их сфера использования существенно расширяется. -
Повышенная температура вспышки. Пары, которые выделяются из топлива, могут вспыхивать в воздушной среде под воздействием источника зажигания, но устойчивого горения не возникает, если сразу удалить источник зажигания.
Свойства топлива с высоким содержанием углерода во многом зависят от количества вспомогательных присадок в составе.
Применение углеводородных топлив
Ключевое назначение жидких углеводородных топлив — использование как горючего в авиационных и ракетных моторных системах, а также в ДВС. Кроме того, их используют в металлургии, химической энергетике, для обогрева помещений в местах, где отсутствует централизованное газоснабжение.
Углеводородные сжиженные и жидкие топлива незаменимы в газо- и нефтехимии, электрогенерации, коммунальном хозяйстве. Они гарантируют стабильную и бесперебойную работу НПЗ. Их применяют как сырье для газохимического производства. Из них производят удобрения, пластмассу, цифровые устройства, шины, моющие средства, медицинское оборудование, упаковки.
Огромная доля углеводородных жидких топлив приходится на производство авиакеросина, необходимого для обеспечения бесперебойных пассажирских и грузовых авиаперевозок.
Углеводородные жидкие топлива, такие как этан, пропан, бутан, используют для отопления жилых помещений и в коммерческом секторе. Их подают в газовые плиты, используют при производстве красок и смол.
Нефтяному дистиллятному топливу находят активное применение в дизельных генераторах. Мазут выступает в качестве топлива для отопительных систем. Он незаменим при выработке электроэнергии на ТЭС.
Бензин — это одна из самых востребованных разновидностей углеводородных топлив. Ежегодно его потребление стремительно возрастает. Именно сжигание бензина дает более 81% всех выбросов углекислого газа в атмосферу.
Плюсы и минусы углеводородных сжиженных и жидких топлив
У рассматриваемых топлив много достоинств, основные из них:
-
большая теплоотдача; -
повышенная температура сгорания; -
экономичность, минимальный расход применения; -
огромная прибыль от добычи; -
комплексность переработки, широкая область применения.
От углеводородных топлив напрямую зависят уровень жизни людей и экономическая мощность государств.
Основные недостатки энергетических ресурсов:
Огромное токсическое воздействие — один из самых существенных минусов углеводородных жидких и сжиженных топлив. Несмотря на это, мы активно используем их в хозяйственной деятельности, ежегодно наращиваем добычу и производство.
Влияние нефтевытесняющих композиций на распределение углеводородов в системе нефть-водная фаза в лабораторных испытаниях
%PDF-1.3
%
1 0 obj
>
endobj
4 0 obj
/Title
>>
endobj
2 0 obj
>
endobj
3 0 obj
>
stream
Чуйкмна Дарья Ивановна; Серебренникова Ольга Викторовна; Русских Ирина Владимировна; Гулая Елена Владимировна; Стахина Лариса Дмитриевна; Кадычагов Петр Борисович
endstream
endobj
5 0 obj
>
>>
/Contents [12 0 R 13 0 R 14 0 R]
/CropBox [0 0 595. 0 842.0]
0 842.0]
/Annots [15 0 R]
>>
endobj
6 0 obj
>
/Contents 18 0 R
/CropBox [0 0 595.0 842.0]
>>
endobj
7 0 obj
>
/Contents 21 0 R
/CropBox [0 0 595.0 842.0]
>>
endobj
8 0 obj
>
/Contents 24 0 R
/CropBox [0 0 595.0 842.0]
>>
endobj
9 0 obj
>
endobj
10 0 obj
>
endobj
11 0 obj
>
stream
x
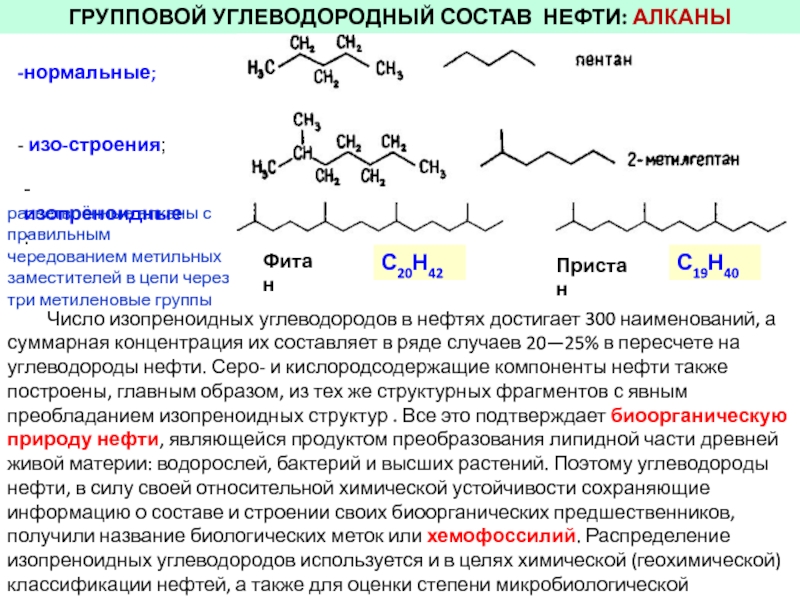
Углеводороды
Углеводороды
Углеводороды
Органические молекулы:
Органическая химия изучает свойства соединений углерода. Все соединения углерода, за исключением нескольких неорганических соединений углерода, являются органическими. Неорганические соединения углерода включают оксиды углерода, бикарбонаты и карбонаты ионов металлов, цианиды металлов и некоторые другие.
Углеводороды
Простейшие органические соединения состоят только из атомов углерода и водорода. Соединения только углерода и водорода называются Углеводороды .
Алканы
Простейший углеводород – метан, CH 4 . Это простейший член ряда углеводородов. Каждый последующий член ряда имеет на один атом углерода больше, чем предыдущий член. Этот ряд соединений называется алканов ( С n H 2n+2 ) . Более легкие газы и используются в качестве топлива. Средние (от 7 углеродов до 12 углеродов) — это жидкости, используемые в бензине (бензине). Высшие представляют собой воскообразные твердые вещества. Свечной воск представляет собой смесь алканов. Алканы являются насыщенными, что означает, что они содержат максимальное количество атомов водорода на углерод и не содержат двойных или тройных связей.
Это простейший член ряда углеводородов. Каждый последующий член ряда имеет на один атом углерода больше, чем предыдущий член. Этот ряд соединений называется алканов ( С n H 2n+2 ) . Более легкие газы и используются в качестве топлива. Средние (от 7 углеродов до 12 углеродов) — это жидкости, используемые в бензине (бензине). Высшие представляют собой воскообразные твердые вещества. Свечной воск представляет собой смесь алканов. Алканы являются насыщенными, что означает, что они содержат максимальное количество атомов водорода на углерод и не содержат двойных или тройных связей.
Наименование органических соединений относится к органической номенклатуре . Существует множество правил именования органических соединений, систематизированных Международным союзом теоретической и прикладной химии 9.0003
Правила ИЮПАК для номенклатуры алканов
1. Найдите и назовите самую длинную непрерывную углеродную цепь.
Найдите и назовите самую длинную непрерывную углеродную цепь.
2. Определите и назовите группы, присоединенные к этой цепочке.
3. Последовательно пронумеруйте цепь, начиная с конца, ближайшего к группе заместителей.
4. Обозначьте расположение каждой группы заместителей соответствующим номером и названием.
5. Соберите название, перечислив группы в алфавитном порядке.
Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Количество атомов углерода | Префикс | Структура |
1 | Мет ан | CH 4 |
2 | Эт ан | CH 3 CH 3 |
3 | Опора ан | CH 3 CH 2 CH 3 |
4 | Бут ане | CH 3 (CH 2 ) 2 CH 3 |
5 | Пент ан | CH 3 (CH 2 ) 3 CH 3 |
6 | Шестигранник Ан | Ч 3 (CH 2 ) 4 CH 3 |
7 | Гепт ане | CH 3 (CH 2 ) 5 CH 3 |
8 | октябрь ан | CH 3 (CH 2 ) 6 CH 3 |
9 | Не ан | CH 3 (CH 2 ) 7 CH 3 |
10 | декабрь ан | CH 3 (CH 2 ) 8 CH 3 |
11 | Ундек ан | CH 3 (CH 2 ) 9 CH 3 |
12 | Додек ане | CH 3 (CH 2 ) 10 CH 3 |
Изомерия
Все алканы с 4 и более атомами углерода проявляют структурную изомерию . Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Например, C 4 H 10 может быть любой из этих двух разных молекул:
Они называются соответственно бутан и 2-метилпропан .
Наименование структурных изомеров алканов
Номенклатура усложняется, если алкан разветвляется. В таком случае есть несколько правил, которым вы должны следовать, чтобы дать алкану правильное название.
- Найдите самую длинную углеродную цепь в молекуле. Количество атомов углерода в самой длинной цепи становится родительским именем (см. таблицу выше)
- Найдя исходную цепь, вы нумеруете исходную цепь, начиная с конца, ближайшего к первому заместителю (заместителем является любой фрагмент, выступающий за пределы основной цепи).

- Далее определите названия всех заместителей . Заместители называются так, как если бы часть была отдельной молекулой, за исключением того, что используется суффикс yl, а не ane. Таким образом, двухуглеродный заместитель будет этильным заместителем (а не этановым заместителем).
- Поместите заместители в алфавитном порядке (т.е. этил перед метилом) перед названием родителя.
- Затем определите положение всех заместителей в названии, поместив перед ним число атомов углерода, в котором заместитель присоединяется к исходной цепи. Например, 2-метилгептан указывает на то, что метильный заместитель присоединен к углероду номер 2.
Применение правил
Теперь попробуйте применить эти правила, чтобы назвать следующую молекулу (это не так сложно, как может показаться).
Действуйте шаг за шагом, как описано выше.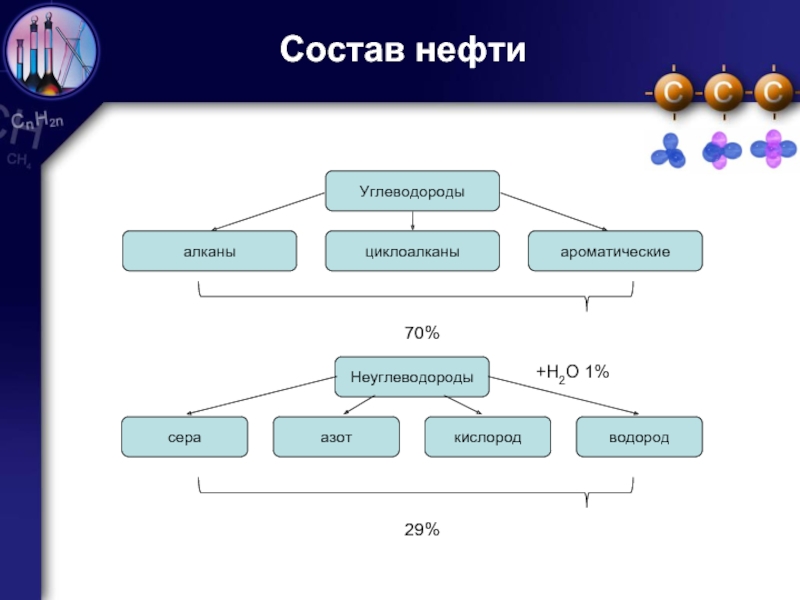
1) Найдите самую длинную углеродную цепь в молекуле. Во-первых, найдите исходную цепь в молекуле, то есть максимально длинную цепочку соединяющих атомов углерода. Обратите внимание, что родительская цепочка не обязательно является цепочкой, которая просто следует слева направо. Например, если бы вы посчитали количество атомов углерода в этой молекуле слева направо, вы бы получили 7 атомов углерода. Однако это не родительская цепочка! Если вы начнете слева, а затем подсчитаете, где молекула разветвляется, вы обнаружите, что в ней 8 атомов углерода. Это самая длинная цепь (не дайте себя обмануть профессорам, прячущим атомы углерода в ответвлениях), и, таким образом, исходной цепью является октан (см. таблицу выше).
2) Номер родительской цепочки. Второй шаг — пронумеровать атомы углерода в исходной цепи, начиная с конца, ближайшего к первому заместителю. Важно нумеровать молекулу с правильного конца (другими словами, в этом примере вы нумеруете алкан справа налево или слева направо). Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
| | |
| Правильная нумерация | Неправильная нумерация |
3. Назовите все заместители. Затем вы определяете названия заместителей. В этом случае единственным заместителем является 2-углеродная группа у 4-го атома углерода. Это этильная группа.
4. Расположите заместители в алфавитном порядке. Следующим шагом является расположение заместителей в алфавитном порядке (т.е. этил перед метилом), но так как есть только один заместитель, в этом нет необходимости.
5. Найдите заместитель в родительском изменении, присвоив ему номер . Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Циклоалканы снова содержат только углерод-водородные связи и углерод-углеродные одинарные связи, но на этот раз атомы углерода соединены в кольцо. Наименьшим циклоалканом является циклопропан.
Если вы посчитаете атомы углерода и водорода, вы увидите, что они больше не соответствуют общей формуле C n H 2n+2 . Соединяя атомы углерода в кольцо, вы должны были потерять два атома водорода.
Вряд ли он вам когда-нибудь понадобится, но общая формула циклоалкана C н Н 2 н .
Не думайте, что это все плоские молекулы. Все циклоалканы от циклопентана и выше существуют в виде «сморщенных колец».
Циклогексан
, например, имеет кольцевую структуру, которая выглядит следующим образом:
Эта форма циклогексана известна как «кресло» из-за его формы, отдаленно напоминающей стул.
Правила ИЮПАК для номенклатуры циклоалканов
1. Для монозамещенного циклоалкана кольцо дает название корня, а замещающая группа называется как обычно. Номер места необязателен.
2. Если алкильный заместитель большой и/или сложный, кольцо может быть названо замещающей группой алкана.
3. Если в кольце присутствуют два разных заместителя, они перечислены в алфавитном порядке, и первый указанный заместитель соответствует углероду №1. Затем нумерация атомов углерода в кольце продолжается в направлении (по часовой стрелке или против часовой стрелки), которое дает второму заместителю меньший возможный номер положения.
4. Если в кольце присутствует несколько заместителей, они перечислены в алфавитном порядке. Номера положений присваиваются заместителям таким образом, что один из них находится у углерода № 1, а другие положения имеют наименьшие возможные номера, считая либо по часовой стрелке, либо против часовой стрелки.
5. Название собирается, перечисляя группы в алфавитном порядке и присваивая каждой группе (если их две или более) номер местоположения. Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Алкены
Другая серия соединений называется алкенов . Они имеют общую формулу: C n H 2n . Алкены содержат меньше атомов водорода, чем алканы. Оставшиеся дополнительные валентности возникают в виде двойных связей между парой атомов углерода. Двойные связи более реакционноспособны, чем одинарные связи, что делает алкены химически более реакционноспособными.
Правила ИЮПАК для номенклатуры алкенов и циклоалкенов
1. Суффикс ен (окончание) указывает на алкен или циклоалкен.
2. Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода двойной связи 90 552 .
Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода двойной связи 90 552 .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода двойной связи . Если двойная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода двойной связи, используется в качестве локатора двойной связи. Если присутствует более одной двойной связи, соединение называется диеновым, триеновым или эквивалентным префиксом, указывающим количество двойных связей, и каждой двойной связи присваивается локаторный номер.
5. В циклоалкенах атомам углерода двойной связи отведены кольцевые позиции №1 и №2. Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
6. Группы заместителей, содержащие двойные связи:
H 2 C=CH– Винильная группа
H 2 C=CH–CH 2 – Аллильная группа
Алкины
Третьей серией являются алкины . Они имеют следующую формулу: C n H 2n-2 .
Они имеют следующую формулу: C n H 2n-2 .
Алкины имеют два атома углерода, соединенных тройной связью. Это очень реакционноспособно, что делает эти соединения нестабильными.
Правила ИЮПАК для номенклатуры алкинов
1. Суффикс yne (окончание) указывает на алкин или циклоалкин.
2. Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода тройной связи 90 552 .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода тройной связи . Если тройная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода тройной связи, используется в качестве локатора тройной связи.
5. Если присутствует несколько множественных связей, каждой из них должен быть присвоен номер локатора. Двойные связи предшествуют тройным связям в названии IUPAC, но цепочка нумеруется с конца, ближайшего к кратной связи, независимо от ее природы.
Двойные связи предшествуют тройным связям в названии IUPAC, но цепочка нумеруется с конца, ближайшего к кратной связи, независимо от ее природы.
6. Поскольку тройная связь является линейной, она может быть размещена только в кольцах размером более десяти атомов углерода. В простых циклоалкинах атомам углерода тройной связи назначаются кольцевые положения № 1 и № 2. Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
7. Группы заместителей, содержащие тройные связи:
HC≡C– Этинильная группа
HC≡CH–CH 2 – Пропаргильная группа
Проблемы:
Нарисуйте структурную формулу 2-бром-4,4-дихлор-5,5-диметилгептана
Нарисуйте структурную формулу 4-бром-1-этилциклопентена
Нарисуйте структурную формулу 7-метил-6-октен-1,3-диина
2.8: Углеводороды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 136814
Цель обучения
- классифицировать углеводороды как насыщенные или ненасыщенные
- классифицируют углеводороды как алканы, алкены, алкины, циклоалканы или ароматические соединения (арены)
- применить гомологический ряд к органическим молекулам с 1-10 атомами углерода
Классификация углеводородов
Углеводороды представляют собой органические соединения, которые содержат только углерод и водород. Присущая углеводородам способность связываться друг с другом известна как катенация и позволяет углеводородам образовывать более сложные молекулы, такие как циклогексан и бензол. Катетенация возникает из-за того, что характер связи между атомами углерода совершенно неполярен.
Присущая углеводородам способность связываться друг с другом известна как катенация и позволяет углеводородам образовывать более сложные молекулы, такие как циклогексан и бензол. Катетенация возникает из-за того, что характер связи между атомами углерода совершенно неполярен.
Четыре основных класса углеводородов: алканы, алкены, алкины и арены. Ароматические соединения получили свои названия от того факта, что многие из этих соединений в первые дни открытия были сгруппированы, потому что они были маслами с ароматными запахами. Классификации углеводородов приведены ниже.
Насыщенные углеводороды (алканы) являются простейшими видами углеводородов. Они полностью состоят из одинарных связей и насыщены водородом. Общая формула насыщенных углеводородов C9.0025 n H 2n +2 (при условии нециклической структуры). Насыщенные углеводороды являются основой нефтяного топлива и встречаются в виде линейных или разветвленных соединений. У простейших алканов атомы C связаны в прямую цепь; они называются нормальными алканами.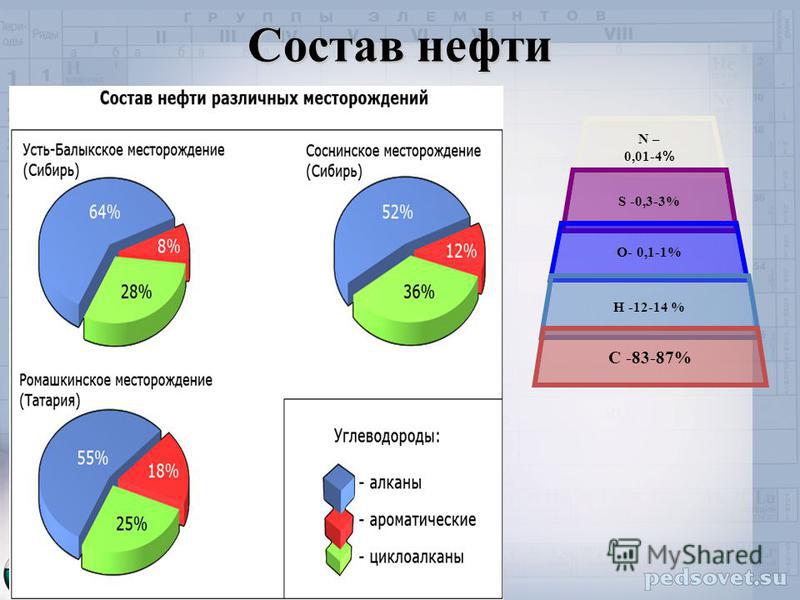 Они названы по количеству атомов углерода в цепи. Наименьшим алканом является метан:
Они названы по количеству атомов углерода в цепи. Наименьшим алканом является метан:
Ненасыщенные углеводороды имеют двойные и/или тройные связи между атомами углерода. Алкены с двойной связью называются алкенами и имеют общую формулу C n H 2n (при условии нециклической структуры). Те, которые содержат тройные связи, называются алкинами и имеют общую формулу C n H 2n-2 . Наименьший алкен — этен — имеет два атома углерода и также известен под своим общим названием этилен, а наименьший алкин — это этин, также известный как ацетилен.
Циклоалканы представляют собой углеводороды, содержащие одно или несколько углеродных колец, к которым присоединены атомы водорода. Префикс «цикло» добавляется к имени для обозначения кольцевой структуры. Общая формула насыщенного углеводорода, содержащего одно кольцо, C н Н 2 н .
Ароматические углеводороды, также известные как арены, представляют собой углеводороды, которые имеют по крайней мере одно ароматическое кольцо. Ароматические соединения содержат бензольное звено. Сам бензол состоит из шести атомов C в кольце с чередующимися одинарными и двойными связями C-C:
Ароматические соединения содержат бензольное звено. Сам бензол состоит из шести атомов C в кольце с чередующимися одинарными и двойными связями C-C:
Для большинства соединений для выяснения их структуры потребуется информация, выходящая за рамки химической формулы. Однако соотношение C:H в химической формуле может дать представление о химической структуре.
Например, давайте рассмотрим некоторые возможные структуры и химические формулы углеводородов, содержащих шесть атомов углерода.
Насыщенный алкан имеет самое высокое отношение водорода к углероду. Ненасыщенный алкен и шестичленное алкановое кольцо имеют одинаковую химическую формулу. Важно помнить об этой связи. Ненасыщенный алкин имеет более низкое отношение водорода к углероду, чем алкены со второй пи-связью. Бензольные кольца имеют самое низкое отношение водорода к углероду — 1:1.
Упражнение
1. Классифицируйте следующие соединения как насыщенные или ненасыщенные. Для ненасыщенных углеводородов уточните классификацию, указав, является ли соединение алкеном, алкином или ареном.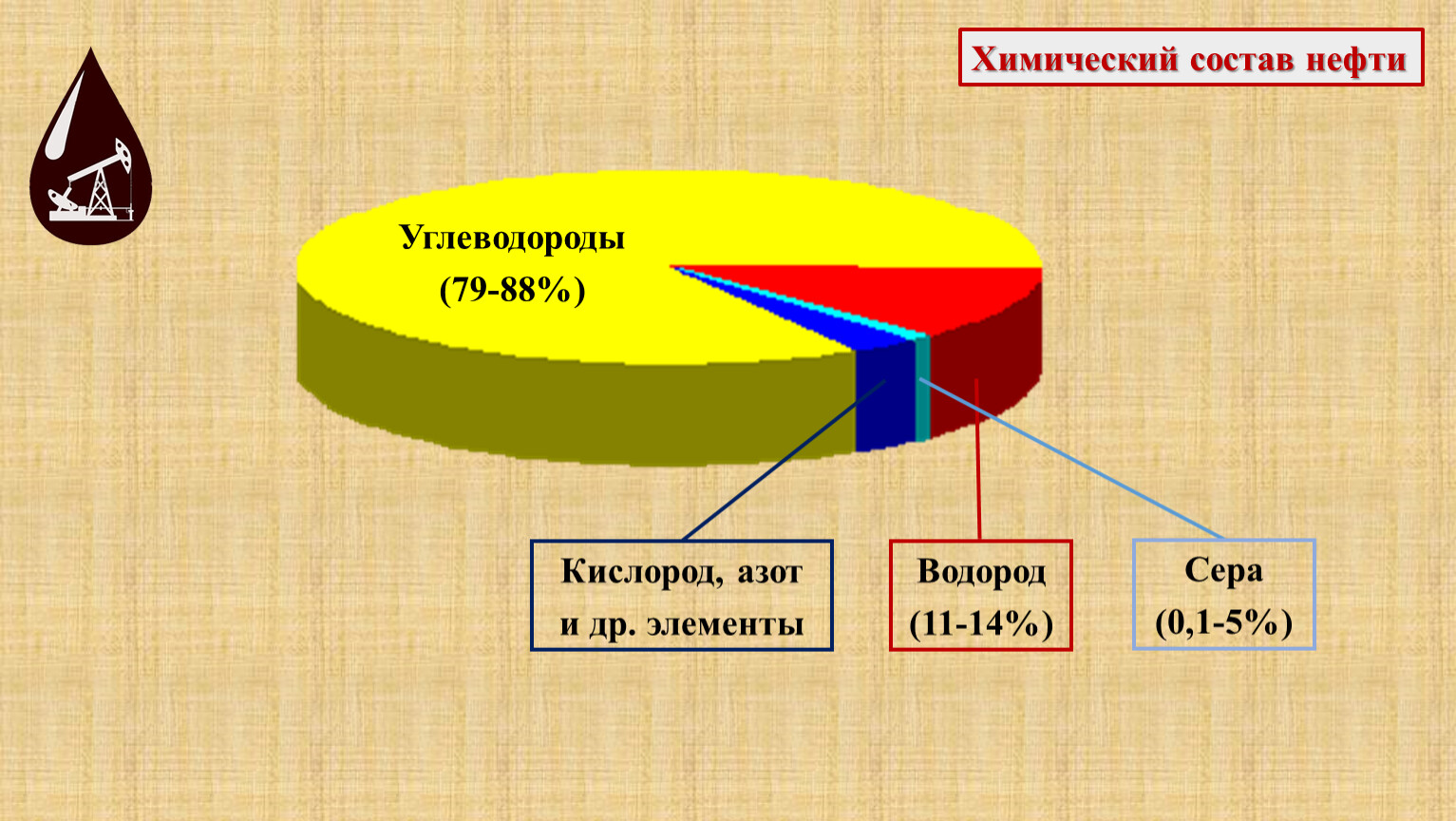
- Ответить
1.
Количество атомов углерода, непрерывно связанных друг с другом, является важным структурным признаком и описывается с использованием гомологического ряда. На первом курсе органической химии обычно достаточно запомнить первые десять названий гомологического ряда. Конечно, ваш профессор установит стандарт. Большинство префиксов знакомы по греческим префиксам для бинарных ковалентных соединений. Это префиксы для первых четырех длин углеродной цепи, которые могут быть незнакомы. Интересно, что три из этих углеводородов часто встречаются в повседневной жизни. Газ метан является основным компонентом метеоризма и ингредиентом, который воспламеняется, когда зажигаются газы — не пытайтесь повторить это дома. Пропан и бутан являются газами при комнатной температуре. Их хранят под давлением для создания жидкого состояния. Пропан используется в качестве топлива для барбекю, а бутан используется в зажигалках. Суффикс «ан» используется для различения самой длинной непрерывной углеродной цепи, в то время как более короткие углеродные ветви (заместители) обозначаются суффиксом «ил».
Суффикс «ан» используется для различения самой длинной непрерывной углеродной цепи, в то время как более короткие углеродные ветви (заместители) обозначаются суффиксом «ил».
Упражнение
2. Заполните приведенную ниже таблицу.
| Краткая структурная формула | Химическое название |
| пропан | |
| С 6 Н 6 | |
| CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 |
- Ответить
2.
Краткая структурная формула Химическое название CH 3 CH 2 CH 3 пропан С 6 Н 6 бензол Ч. 


 Перерабатывают по технологии гидрирования, коксования или неполного сгорания. Под воздействием высоких температур меняет состав, распадается на кокс и летучие составляющие, при охлаждении из летучих составляющих испаряются аммиачные воды, смолы, остаются этилен, метан, азот, бензол, аммиак, т. д. Если пропустить через серную кислоту перечисленные вещества, то выделится сульфат аммония — одно из самых востребованных удобрений. Поглощение бензола осуществляют с помощью растворителя.
Перерабатывают по технологии гидрирования, коксования или неполного сгорания. Под воздействием высоких температур меняет состав, распадается на кокс и летучие составляющие, при охлаждении из летучих составляющих испаряются аммиачные воды, смолы, остаются этилен, метан, азот, бензол, аммиак, т. д. Если пропустить через серную кислоту перечисленные вещества, то выделится сульфат аммония — одно из самых востребованных удобрений. Поглощение бензола осуществляют с помощью растворителя. Топлива с большим количеством углеводородов в составе хорошо проводят электрический ток и имеют низкую величину электрического сопротивления.
Топлива с большим количеством углеводородов в составе хорошо проводят электрический ток и имеют низкую величину электрического сопротивления.