Содержание
Азотная кислота
Физические и химические свойства
Плотность безводной азотной кислоты ρ = 1522 кг/м3, температура плавления tпл— 41,15°С, температура кипения tкип 84° С.
С водой смешивается в любых отношениях с образованием азеотропной смеси с tкип = 121,8°C, содержащей 69,2% кислоты. Также существуют кристаллогидраты HNO3∙H2O с tпл -37,85°С и HNO3∙3H2O c tпл-18,5°С. В отсутствии воды азотная кислота неустойчива, разлагается на свету с выделением кислорода уже при обычных температурах (4HNO3 → 4NO2 + 2H2O + O2), причём выделяющейся двуокисью азота окрашивается в жёлтый цвет, а при высоких концентрациях NO2 — в красный.
Азотная кислота является сильным окислителем, окисляет серу до серной кислоты, фосфор — до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с азотной кислотой. С большинством металлов азотная кислота взаимодействует преимущественно с выделением окислов азота: ЗСu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O.
Некоторые металлы, например железо, хром, алюминий, легко растворяющиеся в разбавленной азотной кислоте, но устойчивы к воздействию концентрированной, что объясняется образованием на поверхности металла защитного слоя окисла. Такая особенность позволяет хранить и перевозить концентрированную азотную кислоту в стальных ёмкостях.
Смесь концентрированной азотной и соляной кислоты в отношении 1:3, называемая царской водкой, растворяет даже золото и платину. Органические соединения под действием азотной кислоты окисляются или нитруются, причём в последнем случае остаток (нитрогруппа NO2+) замещает в органических соединениях водород (происходит нитрование).
Соли азотной кислоты называютя нитратами, а соли с Na,K, Са, NO4+ — селитрами.
Получение
В 13 в. было описано получение азотной кислоты нагреванием калиевой селитры с квасцами, железным купоросом и глиной.
В середине 17 в. И. Р. Глаубер предложил получать азотную кислоту при умеренном (до 150°C) нагревании калиевой селитры с концентрированной серной кислотой: KNO3 + H2SO4 → HNO3 + KHSO4 До начала 20 в. этот способ применяли в промышленности, заменяя калиевую селитру более дешёвой природной чилийской селитрой NaNO3.
Современный способ производства азотной кислоты основан на каталитическом окислении аммиака кислородом воздуха. Основные стадии процесса:
- контактное окисление аммиака до окиси азота: 4NH3 + 5O2 → 4NO + 6H2O;
- окисление окиси азота до двуокиси и поглощение смеси «нитрозных газов» водой:
2NO + O2 → 2NO2
3NO2 + H2O → 2HNO3 + NO - смесь аммиака (10 — 12% ) с воздухом пропускают через нагретую до 750 — 900°С сетку катализатора, которым служат сплавы
платины — тройной (93% Pt, 3% Rh, 4% Pd) или двойной (90 — 95% Pt, 10 — 5% Rh) - окисление NO до NO2 и растворение NO2 в воде — может быть проведенj при атмосферном давлении, под давлением до 1 Мн/м2 или комбинированным способом, при котором под давлением происходит только поглощение нитрозных газов водой
Получают азотную кислоту с концентрациями 45 — 49% или (при использовании давления) 55 — 58% . Дистилляцией таких растворов
Дистилляцией таких растворов
может быть получена азотная кислота азеотропного состава. Более концентрированную кислоту (до 100% ) получают перегонкой растворов азотной кислоты с
концентрированной H2SO4 или прямым синтезом — взаимодействием N2O4 с водой
(или разбавленной азотной кислотой) и кислородом: 2N2O4 + 2H2O + O2 → 4HNO3.
Применение азотной кислоты
Важнейшие области применения азотной кислоты — производство азотных и комбинированных удобрений, взрывчатых веществ (тринитротолуола и др.), органических красителей.
В органическом синтезе широко применяют смесь концентрированной азотной и серной кислоты — «нитрующую смесь».
Азотную кислоту используют в камерном способе производства серной кислоты, для получения фосфорной кислоты из фосфора, как окислитель ракетного топлива.
В металлургии азотую кислоту применяют для травления и растворения металлов, а также для разделения золота и серебра.
Токсичность
Вдыхание паров азотной кислоты приводит к отравлению, попадание кислоты (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание азотной кислоты в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5.
Концентрированная азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы.
Вернуться в каталог
Заказ продукции
Как к Вам обращаться:
Телефон:
Email для связи:
Интересующая продукция:
Ваше сообщение:
Почему замерзают аккумуляторы?
–Автостарт. Аккумуляторы в Уфе–Полезные статьи–
Почему замерзают аккумуляторы?
Превратить автомобилиста в пешехода в считанные минуты могут, пожалуй, три явления: внезапная поломка машины, ДТП и сильный мороз. Тема морозов, «умерших» аккумуляторов и утренних «упражнений» на стоянке жителям Тюмени близка, как никому.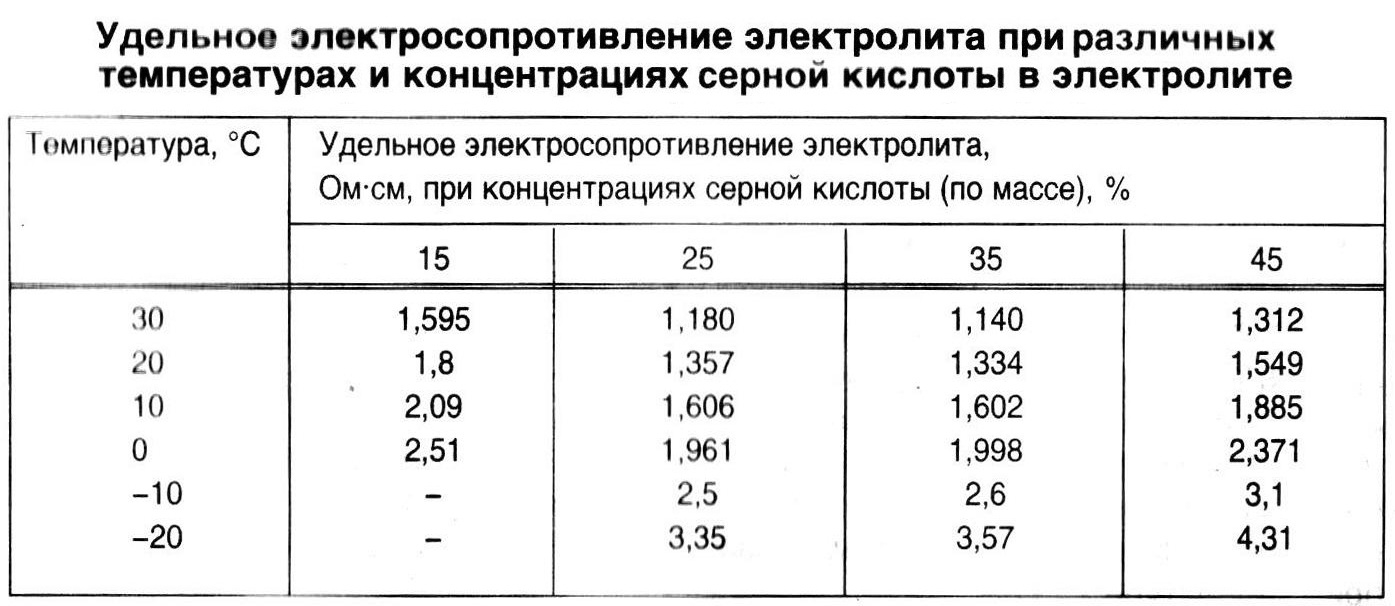
Наверняка вы можете припомнить случай, когда морозным утром в понедельник спеша на работу, вы падали на сиденье любимого автомобиля, вставляли ключ в замок зажигания и вместо довольного урчания двигателя слышали слабое «барахтанье» стартера. Безнадёжно «севший» аккумулятор — проблема близкая всем автовладельцам, и особенно хозяевам старых автомобилей.
При эксплуатации автомобиля в жестких условиях сибирской зимы одной емкости маловато, нужны еще и увеличенные стартерные токи холодной прокрутки. Дело в том, что чем больше емкость и пусковые токи холодной прокрутки, тем при более высоком напряжении происходит запуск двигателя, падение напряжения при пуске минимально ( на шоферском сленге – просадка напряжения). Это хороший надежный запуск. И съем емкости (количества электричества) с батареи при запуске меньше, значит и заряжаться такая батарея будет лучше и быстрее. Разряд батареи при таком пуске не глубокий, расход активных материалов и электролита в аккумуляторе минимален, что повышает коэффициент отдачи по току и по энергии, т. е. необходимо гораздо меньше энергии затрачивать и на заряд по отношению к разрядной энергии аккумулятора, так как все процессы заряда –разряда протекают при более высоком значении напряжения. Аккумулятор с меньшей емкостью и низким током холодной прокрутки при пуске просаживается по напряжению в большей степени , на морозе напряжение может упасть и до 6 вольт. При этом прокрутка двигателя присутствует (есть), а пуск двигателя осложняется — нет достаточной степени сжатия топливно – воздушной смеси , а также из-за отсутствия образования более мощной искры или вообще отказа работы электронного блока зажигания из-за низкого остаточного напряжения на клеммах аккумулятора. И при всем при этом аккумулятор тратит очень много энергии. Автовладельцы с большим практическим опытом вождения выбирают, как правило, аккумуляторы большей емкости и с более высоким током холодной прокрутки , зная что несколько пусков холодного двигателя не доведут разряд батареи до недопустимой просадки напряжения .
е. необходимо гораздо меньше энергии затрачивать и на заряд по отношению к разрядной энергии аккумулятора, так как все процессы заряда –разряда протекают при более высоком значении напряжения. Аккумулятор с меньшей емкостью и низким током холодной прокрутки при пуске просаживается по напряжению в большей степени , на морозе напряжение может упасть и до 6 вольт. При этом прокрутка двигателя присутствует (есть), а пуск двигателя осложняется — нет достаточной степени сжатия топливно – воздушной смеси , а также из-за отсутствия образования более мощной искры или вообще отказа работы электронного блока зажигания из-за низкого остаточного напряжения на клеммах аккумулятора. И при всем при этом аккумулятор тратит очень много энергии. Автовладельцы с большим практическим опытом вождения выбирают, как правило, аккумуляторы большей емкости и с более высоким током холодной прокрутки , зная что несколько пусков холодного двигателя не доведут разряд батареи до недопустимой просадки напряжения . А чем выше напряжение, тем быстрее аккумулятор зарядится от генератора при движении автомобиля и восстановит свою затраченную на пуск энергию. Аккумулятор- это сосуд с энергией, если израсходовали допустим 10 ампер часов, то возместить нужно больше, на коэффициент 1,3 , т.е 13 ампер часов при заряде. Таковы особенности эксплуатации аккумуляторов — этих простых и одновременно сложных устройств. И если обратимость этой энергии не поддерживать , аккумулятор долго работать не будет. Разряд –заряд должен быть сбалансированным , тогда аккумулятор будет иметь всегда достаточную мощность для пуска холодного двигателя, так как мощность зависит от величины среднего разрядного напряжения и емкости батареи .
А чем выше напряжение, тем быстрее аккумулятор зарядится от генератора при движении автомобиля и восстановит свою затраченную на пуск энергию. Аккумулятор- это сосуд с энергией, если израсходовали допустим 10 ампер часов, то возместить нужно больше, на коэффициент 1,3 , т.е 13 ампер часов при заряде. Таковы особенности эксплуатации аккумуляторов — этих простых и одновременно сложных устройств. И если обратимость этой энергии не поддерживать , аккумулятор долго работать не будет. Разряд –заряд должен быть сбалансированным , тогда аккумулятор будет иметь всегда достаточную мощность для пуска холодного двигателя, так как мощность зависит от величины среднего разрядного напряжения и емкости батареи .
Что касается температур замерзания электролита, то температура замерзания электролита заряженного аккумулятора минус 70°С , такой аккумулятор не разморозится.
Иногда такие простые, казалось бы, причины, как ослабление или окисление контактов соединения с электропроводкой приводят к снижению эффективности зарядки от генератора из-за падения напряжения на клеммах аккумулятора, при этом сам аккумулятор абсолютно исправен, но систематически недозаряжается. Прибавьте к этому низкую температуру за бортом автомобиля, и получите результат — аккумулятор не принимает заряд.
Прибавьте к этому низкую температуру за бортом автомобиля, и получите результат — аккумулятор не принимает заряд.
Этому явлению есть довольно простое объяснение. При низких температурах в аккумуляторах повышается вязкость электролита, скорость протекания электрохимических реакций замедляется, и в итоге снижается способность аккумулятора быстро заряжаться.
В таких случаях автомобилисты вынуждены эксплуатировать свои аккумуляторы в состоянии неполного заряда и, естественно, с более низкой емкостью. При каждом последующем пуске аккумулятор, как правило, недопустимо глубоко разряжается, а зарядиться быстро и до требуемой емкости и напряжения уже не может.
Конечно, электролит замерзнуть не может, а вот когда весь ресурс аккумулятора исчерпан и вся серная кислота израсходована на процессы разрядки, то в электролите остается практически одна вода, температура замерзания которой составляет 0°С.
Ниже приведены температуры замерзания электролита в аккумуляторе при разряде :
|
Плотность электролита ,приведенная к температуре 25ºC, г/см³
|
Температура замерзания, минус ºC
|
|
1,090
|
7
|
|
1,120
|
10
|
|
1,140
|
14
|
|
1,160
|
18
|
|
1,180
|
22
|
|
1,200
|
28 батарея , разряженная на 50 %
|
|
1,210
|
34
|
|
1,240
|
50 батарея , разряженная на 25 %
|
|
1,300
|
70
|
Вода при замерзании увеличивается в объеме и выдавливает активную массу из ячеек решетки, из-за чего ослабляется контакт между активной массой и токоведущей основой, увеличивается сопротивление, в результате мы имеем снижение по токоотдаче, пусковой мощности аккумулятора и сроку службы. Такой аккумулятор теряет свой ресурс и, как правило, преждевременно выходит из строя.
Такой аккумулятор теряет свой ресурс и, как правило, преждевременно выходит из строя.
Именно поэтому величина и запас емкости в аккумуляторе в холодное время года имеет очень большое значение для условий беспроблемной эксплуатации.
Чтобы решить вышеперечисленные проблемы, на Тюменском заводе по производству стартерных аккумуляторных батарей «АЛЬКОР» налажен серийный выпуск аккумуляторных батарей торговых марок ARCTIC BATBEAR, TYUMEN BATBEAR, ТЮМЕНСКИЙ МЕДВЕДЬ, ЯМАЛ.
Эти аккумуляторы разработаны специально для эксплуатации в регионах с холодным климатом. В производстве используется новейшее импортное оборудование, особо чистые материалы, электролиты и вода, которая по содержанию примесей соответствует дистиллированной. Очистка воды производится на итальянской установке обратного осмоса с использованием мембраны.
В числе преимуществ батарей — высокий ток приема заряда и способность быстро восстанавливать энергию разряда при эксплуатации в холодное время года. Высокие токи холодного пуска при минус 18 °C – токи холодной прокрутки, обеспечивают аккумуляторам более высокую мощность и надежность запуска холодного двигателя .
Высокие токи холодного пуска при минус 18 °C – токи холодной прокрутки, обеспечивают аккумуляторам более высокую мощность и надежность запуска холодного двигателя .
← Назад к списку статей
17.05.2023
Учет в магазине Б. Хмельницкого 134 (май)
22.02.2023
График работы магазинов в День Защитника Отечества
06.02.2023
Учет
Сеть магазинов Автостарт приветствует вас на нашем сайте!
Сеть магазинов Автостарт c 1992 года работает на рынке аккумуляторных батарей в Уфе. Мы предлагаем в широком ассортименте аккумуляторы всех типов: стартерные аккумуляторы, мото-аккумуляторы, тяговые аккумуляторы (кислотные, щелочные), а также сцепления, зарядные и пуско-зарядные устройства, моторные масла, смазки, автохимию.
Ответы: Постоянная депрессии точки замерзания…
Принципы современной химии 8-е издание
ISBN: 9781305079113
Автор: Дэвид В. Окстоби, Х. Пэт Гиллис, Лори Дж. Батлер 900 03
Окстоби, Х. Пэт Гиллис, Лори Дж. Батлер 900 03
Издатель: Cengage Learning
1 Атом в современной химии2 Химические формулы, уравнения и результаты реакций3 Атомные оболочки и классические модели химической связи4 Введение в квантовую механику5 Квантовая механика и структура атома6 Квантовая механика и молекулярная структура7 Связь в органических молекулах8 Связь в соединениях переходных металлов и координационных комплексах9Газообразное состояние10 Твердые тела, жидкости и фазовые переходы11 Растворы12 Термодинамические процессы и термохимия13 Самопроизвольные процессы и термодинамическое равновесие14 Химическое равновесие15 Кислотно-основные равновесия16 Растворимость и равновесие осаждения17 Электрохимия18 Химическая кинетика19 Ядерная химия20 Молекулярная спектроскопия и фотохимия21 Структура и связь в твердых телах22 Неорганические материалы23 Полимерные материалы и мягкие Конденсированные веществаA Научные обозначения и экспериментальные ошибкиB Единицы Si, преобразования единиц измерения и физика для общей химииC Математика для общей химии expand_more
Вопросы главы expand_more
Задача 1P: У пациента «количество холестерина» равно 214. лем 8PПроблема 9PПроблема 10PПроблема 11PПроблема 12PПроблема 13PПроблема 14PПроблема 15PПроблема 16PПроблема 17PПроблема 18PПроблема 19PПроблема 20PПроблема 21PПроблема 22PПроблема 23PПроблема 24PПроблема 25PПроблема 26PПроблема 27PПроблема 28PПроблема 29Проблема 30Р Проблема 31Р Проблема 32Р Проблема 33Р Проблема 34Р Проблема 35Р Проблема 36Р Проблема 37Р Проблема 38Р Проблема 39Р Проблема 40Р Проблема 41Р: Давление паров чистого ацетона, Ch4C(O)Ch4 при 30°C составляет 0,3270 атм. Предположим, 15,0 г бензофенона,… Задача 42P Проблема 43 P Проблема 44 P Проблема 45 P Проблема 46 P Проблема 47 P Проблема 48 P Проблема 49 P Проблема 50 P Проблема 51 P Проблема 52 P Проблема 53 P Проблема 54 P Проблема 55 P Проблема 56 P Проблема 57 P Проблема 58 P Проблема 5 9PЗадача 60PЗадача 61PЗадача 62PЗадача 63PЗадача 64PЗадача 65APЗадача 66AP: Относительная растворимость солей в жидком аммиаке может существенно отличаться от растворимости в воде. Итак,… Задача 67APЗадача 68APЗадача 69APPЗадача 70APЗадача 71APЗадача 72APЗадача 73AP: Давление паров чистой жидкости CS2 равно 0,3914 атм при 20°C.
лем 8PПроблема 9PПроблема 10PПроблема 11PПроблема 12PПроблема 13PПроблема 14PПроблема 15PПроблема 16PПроблема 17PПроблема 18PПроблема 19PПроблема 20PПроблема 21PПроблема 22PПроблема 23PПроблема 24PПроблема 25PПроблема 26PПроблема 27PПроблема 28PПроблема 29Проблема 30Р Проблема 31Р Проблема 32Р Проблема 33Р Проблема 34Р Проблема 35Р Проблема 36Р Проблема 37Р Проблема 38Р Проблема 39Р Проблема 40Р Проблема 41Р: Давление паров чистого ацетона, Ch4C(O)Ch4 при 30°C составляет 0,3270 атм. Предположим, 15,0 г бензофенона,… Задача 42P Проблема 43 P Проблема 44 P Проблема 45 P Проблема 46 P Проблема 47 P Проблема 48 P Проблема 49 P Проблема 50 P Проблема 51 P Проблема 52 P Проблема 53 P Проблема 54 P Проблема 55 P Проблема 56 P Проблема 57 P Проблема 58 P Проблема 5 9PЗадача 60PЗадача 61PЗадача 62PЗадача 63PЗадача 64PЗадача 65APЗадача 66AP: Относительная растворимость солей в жидком аммиаке может существенно отличаться от растворимости в воде. Итак,… Задача 67APЗадача 68APЗадача 69APPЗадача 70APЗадача 71APЗадача 72APЗадача 73AP: Давление паров чистой жидкости CS2 равно 0,3914 атм при 20°C. Когда 40,0 г ромбической серы… Задача 74APЗадача 75APЗадача 76APЗадача 77APЗадача 78APЗадача 79APЗадача 80APЗадача 81APЗадача 82APЗадача 83APЗадача 84APЗадача 85APЗадача 86CPЗадача 87CPЗадача 88CP 9 0013 format_list_bulleted
Когда 40,0 г ромбической серы… Задача 74APЗадача 75APЗадача 76APЗадача 77APЗадача 78APЗадача 79APЗадача 80APЗадача 81APЗадача 82APЗадача 83APЗадача 84APЗадача 85APЗадача 86CPЗадача 87CPЗадача 88CP 9 0013 format_list_bulleted
См. аналогичные учебники
Объяснение концепции
Константа понижения температуры замерзания чистого H 2 СО 4 равно
6,12 К кг моль -1 . При растворении 2,3 г этанола (С 2 Н 5 ОН) в 1,00 кг чистой серной кислоты температура замерзания раствора оказывается на 0,92 К ниже температуры замерзания чистой серной кислоты. Определите, сколько частиц образуется
при растворении 1 молекулы этанола в серной кислоте
ChemTeam: Депрессия точки замерзания
ChemTeam: Депрессия точки замерзания
Депрессия точки замерзания
Проблемы 1-10
Пробы 11-25
Вернуться в меню решений
Учебное пособие по повышению температуры кипения
Раствор затвердевает (замерзает) при более низкой температуре, чем чистый растворитель. Это коллигативное свойство называется депрессией точки замерзания.
Это коллигативное свойство называется депрессией точки замерзания.
Чем больше растворенного вещества растворено, тем сильнее эффект. Для этого поведения было разработано уравнение. Это:
Δt = i K f м
Δt — изменение температуры от точки замерзания чистого растворителя до точки замерзания раствора. Он равен двум константам, умноженным на моляльность раствора. Постоянная К f на самом деле получено из нескольких других констант, и его вывод описан в учебниках по вводной термодинамике. Его техническое название — криоскопическая постоянная. Греческая приставка крио- означает «холодный» или «замораживающий». В более общем смысле это называется «моляльной константой понижения температуры замерзания».
Постоянная, называемая фактором Ван ‘т Хоффа, обозначается буквой ‘i’ и обсуждается ниже примеров задач.
Вот некоторые примеры криоскопических констант:
Вещество K f бензол 5. 12
камфора 40. четыреххлористый углерод 30. этиловый эфир 1,79 вода 1,86
Единицами константы являются градусы Цельсия на моляль (°C м¯ 1 ). Есть два варианта единиц измерения константы, которые вы также должны знать:
1) K m¯ 1 : используется кельвин, а не градус Цельсия. Однако «расстояние» между одним градусом Цельсия и кельвином одинаково, числовое значение не изменяется. Его редко можно увидеть, и я буду игнорировать его.
2) °C кг моль¯ 1 : берется моляль (моль/кг) и подносится кг (который находится в знаменателе знаменателя) и подводится к числителю.
Последнее очень полезно, потому что оно разделяет молярную единицу. Мы будем использовать приведенное выше уравнение для расчета молекулярной массы. Имейте в виду, что единицей молекулярной массы является грамм/моль.
Еще одно напоминание: моляль – это количество молей растворенного вещества на кг растворителя.
Перейдите к примерам задач, чтобы обсудить фактор Ван ‘т Хоффа.
Пример №1: Чистый бензол замерзает при 5,50 °C. Раствор, приготовленный путем растворения 0,450 г неизвестного вещества в 27,3 г бензола, замерзает при 4,18 °С. Определите молекулярную массу неизвестного вещества. Константа точки замерзания бензола составляет 5,12 °С/м.
Решение:
Δt = i K f м
1,32 °C = (1) (5,12 °C кг моль¯ 1 ) (x / 0,0273 кг)
1,32 °C = (187,5458 °C моль¯ 1 ) (x)
х = 0,007038 моль
0,450 г / 0,007038 моль = 63,9 г/моль
Обратите внимание на предположение, что вещество не ионизируется. Это довольно безопасное предположение, когда растворителем является бензол. Также обратите внимание на предположение, что растворенное вещество нелетуче.
Пример #2: Сколько граммов этиленгликоля, C 2 H 4 (OH) 2 , необходимо добавить к 400,0 г воды для получения раствора, который замерзнет при -8,35 °C?
Решение:
Δt = i K f м
8,35 °C = (1) (1,86 °C кг моль¯ 1 ) (x / 0,4000 кг)
8,35 °C = (4,65 °C моль¯ 1 ) (x)
х = 1,7957 моль
1,7957 моль умножить на 62,07 г/моль = 111 г (до трех знаков инжира)
Раствор замерзает при -1,37 °C.
Обратите внимание на коэффициент Ван-т-Гоффа, равный 1. Это значение используется для веществ, которые не ионизируются в растворе. Практически все, если не все, органические вещества в растворе не ионизируются. каждый из них имеет фактор Ван ‘т-Гоффа, равный 1, и они называются неэлектролитами.
Пример #3: 33,7 г образца неэлектролита растворяли в 750 г воды. Температура замерзания раствора составляла -2,86 °С. Какова молярная масса соединения? K f = 1,86 °С/м.
Решение:
Δt = i K f м
2,86 °C = (1) (1,86 °C кг моль¯ 1 ) (x / 0,750 кг)
2,86 °C = (2,48 °C моль¯ 1 ) (x)
х = 1,1532 моль
33,7 г / 1,1532 моль = 29.2 г/моль
Пример #4: Образец нафталина массой 1,60 г (неэлектролит с формулой C 10 H 8 ) растворяют в 20,0 г бензола. Температура замерзания бензола составляет 5,5 °С, а К f = 5,12 кг/моль. Какова температура замерзания раствора?
Какова температура замерзания раствора?
Решение:
1) Определите моляльность нафталина:
(1,60 г / 128,1732 г/моль) / 0,0200 кг = 0,624155 м
2) Определите депрессию точки замерзания:
Δt = i K f м
x = (1) (5,12 °C кг моль¯ 1 ) (0,624155 моль/кг)
х = 3,2 °С
3) Определить точку замерзания:
5,5 − 3,2 = 2,3 °С
Пример № 5: Камфора (C 6 H 16 O) плавится при 179,8 °C и имеет особенно большую константу депрессии температуры замерзания, K f = 40,0 °C/м. При растворении 0,186 г органического вещества с неизвестной молярной массой в 22,01 г жидкой камфоры температура замерзания смеси оказывается равной 176,7 °С. Какова молярная масса растворенного вещества?
Решение:
179,8 — 176,7 = 3,1 °С
Δt = i К f м
3,1 °C = (1) (40,0 °C кг моль¯ 1 ) (x / 0,02201 кг)
3,1 °C = (1) (1817,356 °C моль¯ 1 ) (x)
х = 0,001705775 моль
0,186 г / 0,001705775 моль = 109 г/моль
Пример №6: Температура замерзания раствора, приготовленного путем растворения 150,0 мг кофеина в 10,0 г камфоры, на 3,07 градуса Цельсия ниже, чем у чистой камфоры (К f = 40,0 °С/м). Какова молярная масса кофеина?
Какова молярная масса кофеина?
Решение:
1) Используйте изменение точки замерзания для расчета моляльности раствора:
Изменение FP = K f (м) 3,07 °C = (40,0 °C/м) (м)
м = 0,07675 моляля
Помните: моляльность – количество молей растворенного вещества на килограмм растворителя
2) Переведите концентрацию раствора в граммы растворенного вещества на 1000 г растворителя:
150 мг 1 г 1000 г ––––––– х ––––––– х ––––––– = 15,0 г растворенного вещества / 1 кг растворителя 10,0 г 1000 мг 1 кг
3) Разделив эту концентрацию на моляльность раствора, вы получите молярную массу:
15,0 г/кг –––––––––––––– = 195 г/моль 0,07675 моль/кг
Пример №7: Какова температура замерзания водного раствора, полученного путем растворения 10,90 г MgCl 2 в 88,41 г H 2 O?
Решение:
10,90 г / 95,211 г/моль = 0,1144826 моль
0,1144826 моль/0,08841 кг = 1,2949 м
Δt = i K f м
Δt = (3) (1,86 °C/м) (1,2949 м)
Δt = 7,226 °C (до 4 цифр)
Температура замерзания раствора –7,226 °С.
В действительности точка замерзания может быть ближе к −6,5 °C из-за ионного спаривания между Mg 2+ и ионами Cl¯. Коэффициент Ван-т-Гоффа ближе к 2,7 для концентрированного раствора MgCl 2 (у меня нет источника по этому вопросу, я просто видел упоминание об этом несколько раз за эти годы). Ионные пары на короткое время образуются, поскольку противоположно заряженные частицы притягиваются и уменьшают видимое количество частиц. Помните, коллигативные свойства зависят от общего количества частиц, уменьшите их, и вы уменьшите эффект.
Пример #8: При какой температуре замерзнет раствор фторида стронция с концентрацией 29,3% (по весу)?
Решение:
1) Нам нужна моляльность раствора SrF 2 . Для этого сначала предположим, что имеется 100 г раствора. Поэтому:
29,3%(вес/вес) означает 29,3 г SrF 2 в 100 г раствора, а также 70,7 г воды.
2) Поскольку моляльность включает моли растворенного вещества, мы вычисляем моли SrF 2 :
29,3 г / 125,62 г/моль = 0,233243 моль
3) Теперь моляльность:
0,233243 моль/0,0707 кг = 3,29905 м
4) Теперь мы готовы к расчету точки замерзания:
Δt = i K f м
Δt = (3) (1,86) (3,29905) Δt = 18,4087 °С
Раствор замерзает при −18,4 °C
Фактор Ван-т-Гоффа
Фактор Ван ‘т Гоффа обозначается строчной буквой i. Это безразмерная константа, непосредственно связанная со степенью диссоциации растворенного вещества в растворителе.
Это безразмерная константа, непосредственно связанная со степенью диссоциации растворенного вещества в растворителе.
Вещества, которые не ионизируются в растворе, например сахар, имеют i = 1.
Вещества, которые ионизируются до двух ионов, например NaCl, имеют i = 2.
Вещества, которые ионизируются до трех ионов, например MgCl 2 , имеют i = 3.
И так далее. . . .
Это современное объяснение. В 1880-х годах, когда ван ‘т Хофф собирал и изучал данные о температурах кипения и замерзания, он не понял, что я имел в виду. Он использовал i только для того, чтобы попытаться совместить данные. Собственно, вот что у него было:
Возьмите 1,0 молярный раствор сахара и измерьте его повышение АД. Теперь исследуйте 1,0-молярный раствор NaCl. Его повышение б.п. в два раза превышает значение сахара. Когда он сделал MgCl 2 , он получил значение в три раза больше, чем у сахара.
Все его значения начинают группироваться вместе, одна группа с сахароподобными значениями, другая с NaCl-подобными значениями и третья с MgCl 2 -подобными значениями.
Вот как каждая группа получила свое значение i, и он понятия не имел, почему. То есть, пока он не узнал о теории электролитической диссоциации Сванте Аррениуса. Затем современное объяснение, приведенное выше, стало очень ясным.
Вещества, которые частично ионизируют раствор, обычно имеют значение i от 1 до 2. Я решу пример задачи по осмосу, где i = 1,17. Кроме того, значения i могут быть снижены с помощью концепции, называемой «спаривание ионов». Например, NaCl имеет фактическое i = 1,8 из-за спаривания ионов. Я оставлю это вам, чтобы узнать, что такое ионное спаривание.
Пример №9: Температура замерзания 0,0925 мл водного раствора хлорида аммония оказалась равной –0,325 °C. Каков фактический фактор Ван’т-Гоффа для этой соли при данной концентрации по сравнению с идеальным значением, равным 2? К f = 1,86 °С/м
Решение:
Δt = i K f м
0,325 °C = (x) (1,86 °C/м) (0,0925 м)
х = 1,89
Пример №10: Раствор 5,00 г хлорида натрия в 1,00 кг воды имеет температуру замерзания –0,299 °C. Каков фактический фактор Вант-Гоффа для этой соли при данной концентрации по сравнению с идеальным значением 2? K f (вода) = 1,86 °C/м
Каков фактический фактор Вант-Гоффа для этой соли при данной концентрации по сравнению с идеальным значением 2? K f (вода) = 1,86 °C/м
Решение:
1) Определите моляльность раствора NaCl:
(5,00 г / 58,443 г/моль) / 1,00 кг = 0,085553 м
2) Определить фактор Вант-Гоффа:
Δt = i K f м
0,299 °C = (x) (1,86 °C/м) (0,085553 м)
х = 1,89
Пример #11: Раствор готовят путем растворения 1,53 г ацетона (СН 3 СОСН 3 ) в 50,00 г воды. Его температура замерзания составляет -0,980 ° C. Диссоциирует ли ацетон в растворе?
Решение:
1) Определить количество молей ацетона:
1,53 г / 58,0794 г/моль = 0,02634325 моль
2) Путь решения №1: предположить отсутствие диссоциации и вычислить ожидаемую точку замерзания:
Δt = i K f м
x = (1) (1,86 °C кг моль¯ 1 ) (0,02634325 моль / 0,0500 кг)
x = 0,9799689 °C = 0,980 °C (с точностью до трех цифр)
Ацетон не диссоциирует в растворе.
3) Путь решения №2: рассчитать значение фактора Ван ‘т Хоффа:
Δt = i K f м
0,980 °C = (y) (1,86 °C кг моль¯ 1 ) (0,02634325 моль / 0,0500 кг)
г = 1,00
Ацетон не диссоциирует в растворе.
Пример #12: Водный раствор содержит 0,8402 моляль Na 2 SO 4 . Его температура замерзания составляет -4,218 °C. (a) Определите эффективное число частиц, возникающих из каждой формульной единицы Na 2 SO 4 в этом растворе. (b) Какое поведение сульфата натрия в растворе объясняет различие по сравнению с теоретическим фактором Ван ‘т Гоффа, равным 3?
Δt = i K f м
4,218 = (х) (1,86) (0,8402)
х = 2,699 = 2,7
Na 2 SO 4 демонстрирует «спаривание ионов». В каждый данный момент в растворе находится не 100% ионов натрия, а сульфат-ионы. Некоторые NaSO 4 2 ¯ (и даже некоторые NaSO 2 SO 4 ) существуют, формируясь и распадаясь от мгновения к мгновению.
Это ионное спаривание уменьшает количество частиц в растворе, тем самым снижая фактор Вант-Гоффа.
Пример #13: Температура замерзания 5,00% раствора CH 3 COOH(водн.) составляет -1,576 °C. (а) Определите экспериментальный фактор Вант-Гоффа для этого раствора. б) Основываясь на своем понимании межмолекулярных сил, объясните их значение.
Решение:
1) Предположим, что процентное соотношение равно массе (и что это водный раствор), и рассчитаем моляльность:
5,00% означает 5,00 г уксусной кислоты и 95,0 г воды.
5,00 г / 60,054 г/моль = 0,0832584 моль
0,0832584 моль/0,0950 кг = 0,8764 м
2) Рассчитайте фактор Ван-т-Гоффа:
Δt = i K f м
1,576 °C = (x) (1,86 °C кг моль -1 ) (0,8764 моль/кг)
х = 0,9668
Для (b) обратите внимание, что фактор Ван ‘т Гоффа на меньше , чем на единицу. Если бы растворенный СН 3 СООН ионизировался, то фактор Ван ‘т Гоффа был бы в больше , чем единица.
Объяснение состоит в том, что CH 3 COOH образует димеры (две молекулы CH 3 COOH объединяются в одну «молекулу»). Это уменьшает количество частиц в растворе, тем самым уменьшая фактор Ван-т-Гоффа.
В Интернете можно найти множество изображений димеров уксусной кислоты. Вот некоторые.
Пример №14: Расположите следующие водные растворы в порядке убывания температуры замерзания:
0,10 м КНО 3
0,10 м BaCl 2
0,10 м C 2 H 4 (OH) 2
0,10 м Na 3 PO 4
Решение:
1) Определить коэффициент Вант-Гоффа для каждого вещества:
0,10 м KNO 3 —> один ион K + и один нитрат-ион на формульную единицу, фактор Ван-т-Гоффа = 2
0,10 м BaCl 2 —-> один ион Ba 2+ и два иона хлорида на формульную единицу, фактор Ван ‘т Гоффа = 3
0,10 м C 2 H 4 (OH) 2 —> этиленгликоль не ионизируется в растворе, фактор Ван-Т-Гоффа = 1
0,10 м Na 3 PO 4 —> три иона Na + и один ион фосфата на формульную единицу, фактор Вант-Гоффа = 4
2) Определите эффективную моляльность каждого раствора:
KNO 3 —> 0,10 м x 2 = 0,20 м
BaCl 2 —> 0,10 м x 3 = 0,30 м
C 2 H 4 (OH) 2 —> 0,10 м x 1 = 0,10 м
Na 3 Заказ на покупку 4 —> 0,10 м x 4 = 0,40 м
3) Я понял, что этот вопрос означает порядок, в котором первое вещество имеет точку замерзания, ближайшую к чистой воде, а последнее имеет самую низкую точку замерзания, значение которого наиболее далеко от 0 °C.
C 2 H 4 (OH) 2 KNO 3
BaCl 2
Na 3 PO 4Пример №15: Определенный растворитель имеет температуру замерзания −22,465 °C. В этом растворителе готовят разбавленные (0,050 мл) растворы четырех распространенных кислот и измеряют их точки замерзания, получая следующие результаты:
Кислота: HCl H 2 SO 4 HClO 3 HNO 3 Температура замерзания: −22,795 °C –22,788 °C –22,791 °C –22,796 °C (а) Определите K f для этого растворителя и (б) укажите причину, по которой одна из кислот так сильно отличается от других своей способностью понижать температуру замерзания.
Решение:
1) Определите K f для каждой кислоты, используя:
Δt = i K f м
2) HCl (фон-т-Гофф = 2)
0,333 °С = (2) (К ф ) (0,050 м)
K f = 3,3 (до двух знаков фиг)
3) H 2 SO 4 (фон-т-Гофф = 3) 0,323 °C = (3) (K f ) (0,050 м)
K f = 2,2 (до двух знаков фиг)
4) HClO 3 (фон-т-Гофф = 2)
0,326 °C = (2) (K f ) (0,050 м)
K f = 3,3 (до двух знаков фиг)
5) HNO 3 (фон ‘т Гофф = 2)
0,331 °С = (2) (К ф ) (0,050 м)
K f = 3,3 (до двух знаков фиг)
6) Ответ на (б) заключается в том, что H 2 SO 4 не ионизируется на 100% в обоих атомах водорода. Серная кислота сильна только своим первым водородом:
Ионизация второго водорода слабая, в результате чего серная кислота имеет коэффициент Ван ‘т-Гоффа чуть больше 2, а не 3, как на шаге №3, чуть выше.
Некоторые дополнительные комментарии о температуре кипения и замерзания раствора
Чистые вещества имеют истинные температуры кипения и замерзания, а растворы — нет. Например, чистая вода имеет температуру кипения 100°С и температуру замерзания 0°С. Например, при кипении, когда чистый водяной пар покидает жидкость, остается только чистая вода. С раствором не так.
При кипении раствора, если растворенное вещество нелетучее, то в паровую фазу переходит только чистый растворитель. Растворенное остается (в этом смысл нелетучести). Однако следствием этого является то, что раствор становится более концентрированным, следовательно, повышается его температура кипения. Если бы вы построили график изменения температуры кипения чистого вещества в зависимости от времени, линия осталась бы плоской. В случае раствора линия будет иметь тенденцию к смещению вверх по мере того, как раствор станет более концентрированным.
Нелетучее растворенное вещество — это вещество, которое остается в растворе. Испаряющийся пар является только чистым растворителем. С другой стороны, летучее растворенное вещество выкипает вместе с растворителем.
Испаряющийся пар является только чистым растворителем. С другой стороны, летучее растворенное вещество выкипает вместе с растворителем.
Соль в воде является примером нелетучего растворенного вещества. Выкипает только вода, а при высыхании остается белое твердое вещество (NaCl). Гексан, растворенный в пентане, является примером летучего растворенного вещества. Пар будет представлять собой смесь гексана и пентана. Однако здесь есть кое-что очень интересное. Процентное содержание гексана и пентана в парах будет РАЗЛИЧНЫМ, чем процентное содержание каждого из них в растворе. Мы рассмотрим это в другом уроке.
И последнее, что заслуживает небольшого упоминания, это концепция азеотропа. Это постоянно кипящая смесь. Это означает, что смесь паров, выходящих из кипящего раствора, такая же, как смесь раствора. О первом появлении сообщил Дальтон в 1802 году, но это слово не было придумано до 1911 года.
Одним из примеров бинарного азеотропа является 4% (по весу) воды и 96% этилового спирта. Кстати, это означает, что вы не можете получить чистый 100% спирт (так называемый абсолютный спирт) путем кипячения. Вы должны использовать другие средства, чтобы получить последние 4%. Это также означает, что абсолютный спирт гигроскопичен, что он поглощает воду из атмосферы.
Кстати, это означает, что вы не можете получить чистый 100% спирт (так называемый абсолютный спирт) путем кипячения. Вы должны использовать другие средства, чтобы получить последние 4%. Это также означает, что абсолютный спирт гигроскопичен, что он поглощает воду из атмосферы.
Справочник по химии и физике за 1992 г. перечисляет следующее:
Азеотроп Номер Двоичный 1743 Тернарный 177 Четвертичный период 21 Квинарий 2
Вот состав одной пятерной системы. Он кипит при 76,5°С.
Вещество Проценты
по весуВода 9,45 Нитрометан 37,30 Тетрахлорэтилен 21.


 12
12

 Это ионное спаривание уменьшает количество частиц в растворе, тем самым снижая фактор Вант-Гоффа.
Это ионное спаривание уменьшает количество частиц в растворе, тем самым снижая фактор Вант-Гоффа.