Содержание
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде~, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор h3SO4. Это значит, что в I л раствора должно содержаться:
Кислота с плотностью 1,84 г\смг содержит 95,6% h3SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):
Соответствующий объем кислоты составит:
Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора h3SO4 содержит не 0,0049 г h3SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора h3SO4 содержит не 0,0049 г h3SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
* Для отмеривания кислоты пользуются тщательно высушенной бюреткой с притертым краном. .
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
К оглавлению
см. также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
Химические свойства кислот, химия 8 класс
Общие свойства кислот.
 Классификация
Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
- бескислородные
- кислородсодержащие.

Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
- сильные
- слабые электролиты.
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
HNO3 → H+ + NO—3
HCl → H+ + Cl—
Многоосновные кислоты диссоциируют ступенчато.
Н3РО4 ↔ Н+ + Н2РО—4 (первая ступень)
Н2РО—4 ↔ Н+ + НРO2-4 (вторая ступень)
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
H2CO3 → H2O + CO2↑
Бескислородные на простые вещества
|
t | ||
|
2HCl |
→ |
Cl2 + H2. |
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Mg + 2HCl → MgCl2 + H2↑
Найти ряд активности можно на последней странице электронного учебника
«Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
Au + HNO3 + 4HCl → HAuCl4 + NO + 2H2O.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Na2CO3 + 2CH3 — COOH → 2CH3 — COONa + H2O + CO2↑.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
Те же условия сохраняются и для реакций кислот с солями.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
K2O + 2HNO3 → 2KNO3 + H2O
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
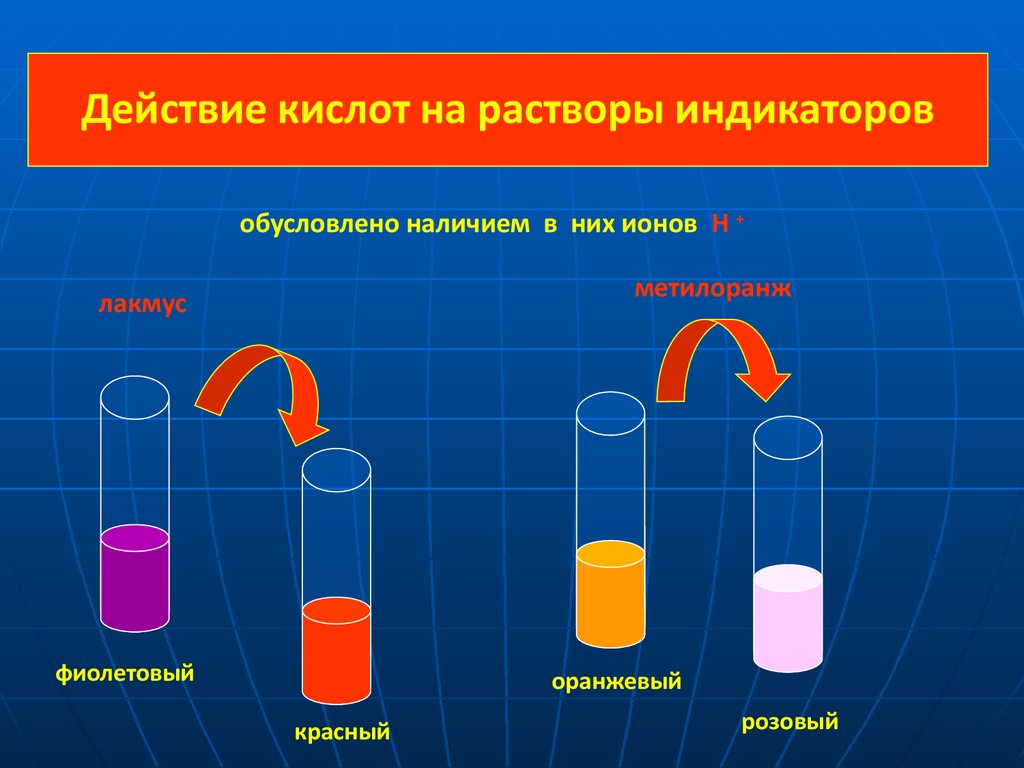
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Что ещё почитать?
Неметаллы
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
18HBr + 2KMnO4 →2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 →3I2↓ + 2Crl3 + 2KI + 7H2O
#ADVERTISING_INSERT#
7.9: Кислотные растворы, влияющие на рН воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15162
В отличие от сильных кислот/оснований, слабые кислоты и слабые основания не полностью диссоциируют (разделяются на ионы) при равновесии в воде, поэтому при расчете pH этих растворов необходимо учитывать уникальную константу ионизации и равновесные концентрации. Хотя это сложнее, чем вычисление pH раствора сильной кислоты или основания, большинство биохимически важных кислот и оснований считаются слабыми, и поэтому очень полезно понимать, как рассчитать pH этих веществ. Тот же основной метод можно использовать для определения рН водных растворов многих различных слабых кислот и оснований.
Хотя это сложнее, чем вычисление pH раствора сильной кислоты или основания, большинство биохимически важных кислот и оснований считаются слабыми, и поэтому очень полезно понимать, как рассчитать pH этих веществ. Тот же основной метод можно использовать для определения рН водных растворов многих различных слабых кислот и оснований.
Введение
Водный раствор слабой кислоты или основания содержит как протонированную, так и непротонированную формы соединения, поэтому можно составить таблицу ICE и использовать ее для подстановки концентраций в выражение константы равновесия. Константа ионизации кислоты (K a ) или основания (K b ) является мерой того, насколько легко кислота отдает протоны или насколько легко основание принимает протоны. Поскольку вы рассчитываете pH, вы должны найти неизвестную концентрацию ионов гидроксония в растворе при равновесии.
Первый шаг при расчете рН водного раствора любой слабой кислоты или основания состоит в том, чтобы определить, является ли исходная концентрация высокой или низкой по сравнению с 10 -7 М (концентрация ионов гидроксония и гидроксида в воде из-за автоионизация воды). Если концентрация кислоты или основания очень близка или меньше 10 -7 М, то раствор считается разбавленным и необходимо предпринять дополнительные шаги для расчета рН.
Если концентрация кислоты или основания очень близка или меньше 10 -7 М, то раствор считается разбавленным и необходимо предпринять дополнительные шаги для расчета рН.
Слабые кислоты и основания
Сначала вы должны ознакомиться с выражениями констант равновесия и их написанием для химической реакции. Затем, составив таблицу ICE, вы сможете найти неизвестные значения концентрации, которые можно подставить в это выражение равновесия.
Пример \(\PageIndex{1}\): Уксус как слабая кислота
Каков pH 1,5 л уксуса, содержащего 3% уксусной кислоты по массе? (K a = 1,8 x 10 -5 )
Раствор
Для начала необходимо найти начальную концентрацию уксусной кислоты в уксусе. Предположим, что уксус — это просто раствор уксусной кислоты в воде, плотность которого равна 1 г/мл.
Итак, если уксус представляет собой 3% уксусной кислоты по массе и молярная масса HC 2 H 3 O 2 = 60,05 г/моль, то
\[\dfrac{1,5 л,уксус}{ } \times \dfrac{1000 мл}{1 л} \times \dfrac{1g}{1mL} \times \dfrac{3g,уксусная кислота}{100g,уксус} \times \dfrac{1mol,уксусная кислота}{60,05 г, уксусная кислота} = 0,75 \;моль\; HC_2H_3O_2 \nonumber \]
Разделите 0,75 моль на 1,5 л, чтобы получить начальную концентрацию 0,50 М.
Теперь составьте таблицу ДВС, учитывая ионизацию уксусной кислоты в воде в ион ацетата и ион гидроксония. Поскольку в выражение равновесия включены только растворенные вещества и газы, в наших расчетах можно не учитывать концентрацию воды (чистой жидкости). 9+_{(водн.)} \номер\]
| HC 2 H 3 O 2 | Н 2 О | С 2 Н 3 О 2 — | Н 3 О + | |
|---|---|---|---|---|
| Начальный | 0,5 | — | 0 | 0 |
| Изменить | -х | — | +х | +х |
| Равновесие | 0,5 — х | — | х | х |
На каждую диссоциирующую молекулу уксусной кислоты образуется один ион ацетата и один ион гидроксония. Это может быть представлено вычитанием «x» из исходной концентрации уксусной кислоты и добавлением «x» к исходным концентрациям диссоциированных ионов. 9-_{(водн.)} \номер\]
Это может быть представлено вычитанием «x» из исходной концентрации уксусной кислоты и добавлением «x» к исходным концентрациям диссоциированных ионов. 9-_{(водн.)} \номер\]
| НХ 3 | Н 2 О | НХ 4 + | ОХ — | |
|---|---|---|---|---|
| я | 7,0 x 10 -3 | — | 0 | 0 |
| С | -х | — | +х | +х |
| Е | 7,0×10 -3 — х | — | х | х |
Вместо К б вам дали рК б . Итак, чтобы получить K b
Итак, чтобы получить K b
pK b = -log(K b ) = 4,74
K b = 10 -4,74 9{-4}) = 3,46 \номер \]
и в воде при 25 градусах
\[pH + pOH = 14 \номер\]
Отсюда:
\[14 — 3,46 = pH = 10,54 \номер\ ]
Слабые полипротоновые кислоты и основания
Полипротонные кислоты имеют более одного протона, отдающего воде, поэтому они имеют более одной константы ионизации (K a1 , K a2 и т. д.), которые можно учитывать. Полипротонные основания отбирают у воды более одного протона, а также имеют более одной константы ионизации (K b1 , K b2 и т. д.).
Чаще всего первый протонный обмен является единственным, который существенно влияет на рН. Это обсуждается более подробно в конце первого примера.
Пример \(\PageIndex{3}\): Лимонная кислота как полипротоновая кислота
Каков рН грейпфрута, содержащего 0,007 М раствора лимонной кислоты (C 6 H 8 O 7 )?
(К а1 = 7,5 х 10 -4 , К а2 = 1,7 х 10 9+_{(водн. )} \номер\]
)} \номер\]
| С 6 Н 8 О 7 | Н 2 О | С 6 Н 7 О 7 — | Н 3 О + | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| я | 0,007 | — | 0 | 0 |
| С 6 Н 7 О 7 — | Н 2 О | C 6 H 6 O 7 2 — | Н 3 О + | |
|---|---|---|---|---|
| я | 0,00195 | — | 0 | 0,00195 |
| С | -х | — | +х | +х |
| Е | 0,00195 — х | — | х | 0,00195 + х |
Помните, что для первой диссоциации x = [H 3 O + ] = [C 6 {-5} = 0,00197 \;M \номер \]
\[-\log(0,00197) = pH = 2,71 \неномер \]
Обратите внимание, что если вы проигнорировали добавление гидроксония из второй диссоциации, то [H 3 O + ] = 0,00195 M, и использование этого значения для расчета pH по-прежнему дает ответ 2,71.
Таким образом, хотя вы составили две таблицы ICE (вы могли бы даже составить третью таблицу для K a3 ), количество протонов, пожертвованных при второй диссоциации, было ничтожно мало по сравнению с первой диссоциацией. Таким образом, вы можете видеть, что на самом деле только первая диссоциация влияет на рН. Чаще всего это так, и необходима только одна таблица ICE. Вам решать, насколько вы хотите быть уверенными и сколько таблиц ICE вы хотите создать при расчете этих проблем.
Пример \(\PageIndex{4}\): кальцинированная сода как полипротонное основание
Каков рН насыщенного раствора карбоната натрия (Na 2 CO 3 )?
(растворимость в воде 21,6 г/100 мл при комнатной температуре и для угольной кислоты, H 2 CO 3 , K a1 = 4,5 x 10 -7 , K a2 900 x 3 1 090 4,7 4,7 11
Раствор
Сначала нужно найти начальную концентрацию CO 3 9-_{(водн.)} \номер\]
| СО 3 2 — | Н 2 О | ОХС 3 — | ОХ — | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| я | 2,04 | — | 0 | 0 | ||||||||||||||||||||||||
| С | -х | — | +х | +х | ||||||||||||||||||||||||
| Е | 2. {-7} \номер\] 9-] \nonumber \] {-7} \номер\] 9-] \nonumber \]Вы можете игнорировать константу ионизации второго основания, потому что она удаляет незначительное количество протонов из воды. Если вы хотите проверить это, составив таблицу ICE, вы должны получить, что общая концентрация гидроксида составляет 0,0207000222 M \ приблизительно 0,0207 M , поэтому pOH = -log(0,0207) = 1,68 pH + pOH = 14 Разбавленные слабые кислоты и основания«Разбавленные» относятся к концентрации кислоты или основания в воде. Если концентрация близка или ниже 10 -7 M, тогда вы должны рассмотреть вопрос о пожертвовании ионов гидроксония из воды, а также из вашей кислоты или основания. Это делается путем создания таблицы ICE для определения протонирования кислоты или основания, а также включения ионного продукта воды. Пример \(\PageIndex{5}\): Разбавленная слабая кислота Средний пчелиный яд содержит 5 микрограммов муравьиной кислоты (\(HCO_2H\)). Раствор9-_{(водн.)} \номер\]
|



 Чему равен pH 500 мл раствора муравьиной кислоты? (pK a = 3,75)
Чему равен pH 500 мл раствора муравьиной кислоты? (pK a = 3,75)

 ). Однако для слабой кислоты концентрация ионов гидроксония будет намного меньше, чем молярная концентрация кислоты, и [H 3 O + ] необходимо рассчитывать, используя значение K a . Мы можем подойти к этому, используя таблицу ICE , как мы делали это для предыдущих задач равновесия. Если бы мы приготовили раствор уксусной кислоты точно 0,50 М, то изначально [СН 3 СООН] равно 0,50 М и оба [СН 3 COO – ] и [H 3 O + ] равны нулю. Небольшое количество CH 3 COOH будет ионизировать; давайте назовем это x , сделав изменение для [CH 3 COOH] «- x », увеличив оба [CH 3 COO – ] и [H 3 O 9] на сумму «+ х ». Наконец, равновесная концентрация [CH 3 COOH] будет (0,50 M – x) и оба [CH 3 COO – ] и [H 3 O + ] будут x .
). Однако для слабой кислоты концентрация ионов гидроксония будет намного меньше, чем молярная концентрация кислоты, и [H 3 O + ] необходимо рассчитывать, используя значение K a . Мы можем подойти к этому, используя таблицу ICE , как мы делали это для предыдущих задач равновесия. Если бы мы приготовили раствор уксусной кислоты точно 0,50 М, то изначально [СН 3 СООН] равно 0,50 М и оба [СН 3 COO – ] и [H 3 O + ] равны нулю. Небольшое количество CH 3 COOH будет ионизировать; давайте назовем это x , сделав изменение для [CH 3 COOH] «- x », увеличив оба [CH 3 COO – ] и [H 3 O 9] на сумму «+ х ». Наконец, равновесная концентрация [CH 3 COOH] будет (0,50 M – x) и оба [CH 3 COO – ] и [H 3 O + ] будут x . Заполненная таблица представлена ниже.
Заполненная таблица представлена ниже. Однако в этом нет необходимости, поскольку уксусная кислота является слабой кислотой и по определению в растворе будет существовать очень мало диссоциированной формы, что делает количество x очень и очень маленьким. Если x намного меньше 0,50 М (наша начальная концентрация уксусной кислоты), то (0,50 М – x) 0,50 М, и уравнение упрощается до: 9{+}]=\sqrt{(K_{a}\times C_{0}} \номер\]
Однако в этом нет необходимости, поскольку уксусная кислота является слабой кислотой и по определению в растворе будет существовать очень мало диссоциированной формы, что делает количество x очень и очень маленьким. Если x намного меньше 0,50 М (наша начальная концентрация уксусной кислоты), то (0,50 М – x) 0,50 М, и уравнение упрощается до: 9{+}]=\sqrt{(K_{a}\times C_{0}} \номер\] Как показано выше, K a уксусной кислоты 1,8 х 10 -5 ; каким будет p H этого решения?
Как показано выше, K a уксусной кислоты 1,8 х 10 -5 ; каким будет p H этого решения?