Содержание
Влияние коррозии на прочность оборудования
Авторы:
Каландаров Наврузбек Олимбаевич,
Гойибова Дилфуза Фарходовна
Рубрика: Технические науки
Опубликовано
в
Молодой учёный
№9 (113) май-1 2016 г.
Дата публикации: 03.05.2016
2016-05-03
Статья просмотрена:
2496 раз
Скачать электронную версию
Скачать Часть 2 (pdf)
Библиографическое описание:
Каландаров, Н. О. Влияние коррозии на прочность оборудования / Н. О. Каландаров, Д. Ф. Гойибова. — Текст : непосредственный // Молодой ученый. — 2016. — № 9 (113). — С. 171-173. — URL: https://moluch.ru/archive/113/28512/ (дата обращения: 05.07.2023).
О. Влияние коррозии на прочность оборудования / Н. О. Каландаров, Д. Ф. Гойибова. — Текст : непосредственный // Молодой ученый. — 2016. — № 9 (113). — С. 171-173. — URL: https://moluch.ru/archive/113/28512/ (дата обращения: 05.07.2023).
Коррозией металлов называют самопроизвольное разрушение металлических материалов вследствие химического или электрохимического взаимодействия их с окружающей средой. Коррозионный процесс протекает на границе раздела двух сред металла и окружающей среды, т. е. является гетерогенным процессом взаимодействия жидкой или газообразной среды с металлом (рис. 1).
Рис. 1. Некоторые типы гетерогенности поверхности корродирующего металла: а –контакт разнородных металлов; б –дифференциальная аэрация; в –образование щелей и питтингов; г –межкристаллитная коррозия; д –структурно-избирательное разрушение; е –коррозионное растрескивание, или коррозионная усталость, при приложении нагрузки.
Способность металлов сопротивляться воздействию среды называется коррозионной стойкостью, или химическим сопротивлением материала. Металл, подвергающийся коррозии, называют корродирующим металлом, а среда, в которой протекает коррозионный процесс, — коррозионной средой. В результате коррозии изменяются свойства металла и зачастую происходит ухудшение его функциональных характеристик.
Металл, подвергающийся коррозии, называют корродирующим металлом, а среда, в которой протекает коррозионный процесс, — коррозионной средой. В результате коррозии изменяются свойства металла и зачастую происходит ухудшение его функциональных характеристик.
Металл при коррозии может частично или полностью разрушаться. Химические соединения, образующиеся в результате взаимодействия металла и коррозионной среды, называют продуктами коррозии. Продукты коррозии могут оставаться на поверхности металла в виде оксидных пленок, окалины или ржавчины. В зависимости от степени адгезии их к поверхности металла наблюдаются различные случаи. Например, ржавчина на поверхности железных сплавов образует рыхлый слой, процесс коррозии распространяется далеко в металлы может привести к образованию сквозных язв и свищей. Напротив, при окислении алюминия на поверхности образуется плотная сплошная пленка оксидов, которая предохраняет металл от дальнейшего разрушения [1–5, 9, 15, 24].
Первопричиной коррозии металлов является их термодинамическая неустойчивость в различных средах при данных внешних условиях, т. е. самопроизвольный переход металла в более устойчивое окисленное состояние за счет уменьшения термодинамического потенциала системы, которое достигается в результате реакции:
е. самопроизвольный переход металла в более устойчивое окисленное состояние за счет уменьшения термодинамического потенциала системы, которое достигается в результате реакции:
металл + окислительный компонент среды = продукт коррозии
Термодинамика дает исчерпывающие сведения о возможности или невозможности самопроизвольного протекания коррозионного процесса при определенных условиях. Термодинамические потенциалы могут быть использованы для количественной оценки движущих сил химических или электрохимических коррозионных процессов, а также для расчета скоростей этих процессов и практических методов защиты от коррозии, т. е. создания условий, уменьшающих или полностью исключающих возможность протекания коррозионного процесса.
Однако термодинамика не дает ответа на вопрос, с какой скоростью будет протекать термодинамический возможный коррозионный процесс. Рассмотрением этого вопроса, а также установлением влияния различных факторов на скорость коррозии и характер коррозионного разрушения металлов занимается кинетика (учение о скоростях) коррозионных процессов. Отличительной особенностью коррозионных процессов является их сложность и много стадийность. Обычно коррозионный процесс состоит из трех основных стадий:
Отличительной особенностью коррозионных процессов является их сложность и много стадийность. Обычно коррозионный процесс состоит из трех основных стадий:
1) перенос реагирующих веществ к поверхности раздела фаз;
2) собственно гетерогенная реакция;
3) отвод продуктов реакции из реакционной зоны.
Каждая из этих стадий может протекать последовательно или параллельно с образованием на поверхности металла продуктов коррозии. Реакция окисления происходит, когда металл соединяется с атомом или группой молекул, теряя при этом электроны, либо когда он переходит из одной степени окисления в другую, более высокую. Суммарная реакция окисления этого типа может быть представлена как две реакции, протекающие одновременно [1]:
окисление электронов;
восстановление электронов ;
суммарная реакция .
Одновалентный металл будет образовывать один оксид, многовалентный может формировать, как правило, несколько различных оксидов, число которых определяется валентностью металла. Оксиды электрически нейтральны, имеют определенную кристаллическую структуру, состоят из зерен (кристаллов), свойства которых подобны свойствам металлов. Оксид способен к рекристаллизации, росту зе-рен и может подвергаться пластической деформации, особенно при высоких температурах. Для всех металлических изделий, испытывающих механическую нагрузку, наиболее опасными являются локальные виды коррозии. Это демонстрирует график зависимости потерь прочности дюралюминия от коррозионных потерь веса при различных видах коррозионного разрушения (рис. 2).
Оксиды электрически нейтральны, имеют определенную кристаллическую структуру, состоят из зерен (кристаллов), свойства которых подобны свойствам металлов. Оксид способен к рекристаллизации, росту зе-рен и может подвергаться пластической деформации, особенно при высоких температурах. Для всех металлических изделий, испытывающих механическую нагрузку, наиболее опасными являются локальные виды коррозии. Это демонстрирует график зависимости потерь прочности дюралюминия от коррозионных потерь веса при различных видах коррозионного разрушения (рис. 2).
Рис. 2. График зависимости изменения прочности от коррозионных потерь
В зависимости от того, как распространяются коррозионные трещины, коррозионные разрушения принято делить на транскристаллитные, когда разрушение протекает по телу зерен и интеркристаллитные или межкристаллитные, когда разрушение происходит по границам зерен. В межремонтный период происходят утечки нефти, газа и воды вследствие коррозионных повреждений, из-за отложения продуктов коррозии ухудшается теплопроводность поверхностей теплообмена, уменьшение проходных сечений трубопроводов из-за отложения ржавчины требует повышения мощности насосов — все это обходится в миллионы долларов в год. Загрязнение продукции также оценивается в миллиарды долларов, например, небольшое количество меди, поступившее в систему в результате коррозии медного трубопровода или латунного оборудования, может испортить целую партию продукта. Следы металлов могут изменять цвет красителей. Свинцовое оборудование не может быть использовано для приготовления и хранения пищевых продуктов из-за токсичности солей свинца. Мягкая вода, проходящая по свинцовым трубопроводам, небезопасна для питья. По заключению Бюро продуктов питания и лекарственных препаратов, допустимая концентрация свинца в пище не должна превышать 1 мг/л.
Загрязнение продукции также оценивается в миллиарды долларов, например, небольшое количество меди, поступившее в систему в результате коррозии медного трубопровода или латунного оборудования, может испортить целую партию продукта. Следы металлов могут изменять цвет красителей. Свинцовое оборудование не может быть использовано для приготовления и хранения пищевых продуктов из-за токсичности солей свинца. Мягкая вода, проходящая по свинцовым трубопроводам, небезопасна для питья. По заключению Бюро продуктов питания и лекарственных препаратов, допустимая концентрация свинца в пище не должна превышать 1 мг/л.
К этой же группе потерь относится порча продуктов питания из-за ржавления металлических емкостей. Один из заводов, консервирующих фрукты и овощи, терпел убытки около миллиона долларов в год до тех пор, пока не были выявлены и устранены металлургические факторы, приводившие к локальной коррозии. Другая компания, использующая металлические крышки на стеклянных консервных банках, теряла 0,5 млн долларов в год из-за точечной коррозии крышек, что приводило к бактериальному заражению продукции. При расчете толщины стенки аппаратов и его проектировании используются допуски на коррозию. В тех случаях, когда скорости коррозии неизвестны, а методы борьбы с коррозией неясны, задача оптимального проектирования значительно усложняется. Надежные данные о скорости коррозии позволяют более точно оценить срок эксплуатации оборудования и упрощают его проектирование. Например, расчетная толщина стенки трубопровода диаметром 200 мм и длиной 362 км с учетом коррозии составляет 8,18 мм. А применение соответствующей защиты от коррозии позволяет снизить эту величину до 6,35 мм, что приводит к экономии 3700 т стали и увеличению полезного объема трубопровода на 5 %. Отсюда видно, что косвенные потери составляют существенную часть общих коррозионных потерь, однако их подсчет представляет собой трудную задачу даже в рамках одной отрасли промышленности. В ряде случаев потери вообще не могут быть выражены в денежных единицах. К ним относятся аварии, связанные с взрывами, разрушением нефтехимического оборудования, или вызванные коррозией катастрофы самолетов, поездов, автомобилей, приводящие к потере здоровья или гибели людей.
При расчете толщины стенки аппаратов и его проектировании используются допуски на коррозию. В тех случаях, когда скорости коррозии неизвестны, а методы борьбы с коррозией неясны, задача оптимального проектирования значительно усложняется. Надежные данные о скорости коррозии позволяют более точно оценить срок эксплуатации оборудования и упрощают его проектирование. Например, расчетная толщина стенки трубопровода диаметром 200 мм и длиной 362 км с учетом коррозии составляет 8,18 мм. А применение соответствующей защиты от коррозии позволяет снизить эту величину до 6,35 мм, что приводит к экономии 3700 т стали и увеличению полезного объема трубопровода на 5 %. Отсюда видно, что косвенные потери составляют существенную часть общих коррозионных потерь, однако их подсчет представляет собой трудную задачу даже в рамках одной отрасли промышленности. В ряде случаев потери вообще не могут быть выражены в денежных единицах. К ним относятся аварии, связанные с взрывами, разрушением нефтехимического оборудования, или вызванные коррозией катастрофы самолетов, поездов, автомобилей, приводящие к потере здоровья или гибели людей.
Литература:
- Кац Н. Г., Стариков В. П., Парфенов С. Н. Химическое сопротивление Материалов и защита оборудования нефтегазопереработки от коррозии. М.: Машиностроение. -2011 г.
- Жук Н. П. Курс теории коррозии и защита металлов: учеб. Пособие/ Жук Н. П. -2-е изд., стереотипное. Перепечатка издания 1976.-М:. ООО ТИД «Альянс», 2006.-472.
- Сухотина А. М., Шрейдера А. В., Арчакова Ю. И.-Коррозия и защита химической аппаратуры. Нефтеперерабатывающая и нефтехимическая промышленность. Под.ред-М.: Химия, 1974г-576 с.
- Клинов И. Я. Коррозия химической аппаратуры. Коррозионностойкие материалы. Учеб.пособие/ -М.: Машинастроение, 1976.-462 с.
Основные термины (генерируются автоматически): коррозионный процесс, металл, продукт коррозии, скорость коррозии, корродирующий металл, коррозионная среда, коррозия, окружающая среда, поверхность металла, результат коррозии.
Похожие статьи
Коррозия металлов | Статья в журнале «Молодой ученый»
Виды коррозионных разрушений разнообразны — равномерная коррозия, неравномерная, коррозия пятнами, коррозия язвами, подповерхностная
При этом скорость протекания процессов электрохимической коррозии на порядок больше чем при химической коррозии.
Методы защиты
коррозии | Статья в журнале «Молодой ученый»
Коррозия – это самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды. Коррозия металлов – разрушение металлов вследствие физико-химического воздействия внешней среды…
Методы борьбы с
коррозией. Плазменное электролитическое…
осадком, газовая коррозия, коррозионная эрозия, щелевая коррозия и т.д. [4]. Все это приводит к необходимости защиты оборудования от воздействия агрессивных сред, созданию новых и
Органические ингибиторы коррозии адсорбируются только на поверхности металла.
Ингибирование
коррозии стали 20Л в хлоридсодержащих средах
Ключевые слова: коррозионная стойкость, ингибиторы коррозии, скорость коррозии, ингибирующий эффект.
Об эффективной защите сталей в различных агрессивных средах ингибированием коррозионного процесса органическими гетероциклическими соединениями…
Коррозионное поведение сплава ЛС59–1 в растворе карбоната…
латунь, скорость коррозии, коррозионная стойкость, цистеин, селективное растворение, продукты коррозии. Похожие статьи. Использование растворов силиката натрия в производстве бетонов.
Оценка загрязнения
окружающей среды токсичными металлами
металл, коррозионная среда, слой, материал, коррозия, окружающая среда, схема строения, газовая коррозия, жидкая фаза, контактная коррозия.
Лабораторные методы измерения и приборы контроля
коррозии
При переходе металла в продукты коррозии и кислых средах выделяется эквивалентное количество водорода. В нейтральных кислородсодержащих средах при образовании продуктов коррозии поглощенного эквивалентное количество кислорода.
Изучение влияния некоторых аминов на
коррозионное поведение…
1. 2. Коррозионной средой служил 3% раствор NaCl и 3% раствор NaCl, насыщенный h3S (0,8 г/л). Это модельная среда (NACE) содержит сильные активаторы коррозионного процесса.
Такой подход, основанный на двух независимых методах оценки скорости коррозии…
Коррозия в судовых парогенераторах | Статья в журнале. ..
..
Электрохимическая коррозия. Коррозионный процесс, разрушающий металл, в следствие
Электрохимическая коррозия наблюдается при протекании следующих процессов: − анодного, образование ионов металла в электролите и некомпенсированных электронов
Похожие статьи
Коррозия металлов | Статья в журнале «Молодой ученый»
Виды коррозионных разрушений разнообразны — равномерная коррозия, неравномерная, коррозия пятнами, коррозия язвами, подповерхностная
При этом скорость протекания процессов электрохимической коррозии на порядок больше чем при химической коррозии.
Методы защиты
коррозии | Статья в журнале «Молодой ученый»
Коррозия – это самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды. Коррозия металлов – разрушение металлов вследствие физико-химического воздействия внешней среды…
Коррозия металлов – разрушение металлов вследствие физико-химического воздействия внешней среды…
Методы борьбы с
коррозией. Плазменное электролитическое…
осадком, газовая коррозия, коррозионная эрозия, щелевая коррозия и т.д. [4]. Все это приводит к необходимости защиты оборудования от воздействия агрессивных сред, созданию новых и
Органические ингибиторы коррозии адсорбируются только на поверхности металла.
Ингибирование
коррозии стали 20Л в хлоридсодержащих средах
Ключевые слова: коррозионная стойкость, ингибиторы коррозии, скорость коррозии, ингибирующий эффект.
Об эффективной защите сталей в различных агрессивных средах ингибированием коррозионного процесса органическими гетероциклическими соединениями. ..
..
Коррозионное поведение сплава ЛС59–1 в растворе карбоната…
латунь, скорость коррозии, коррозионная стойкость, цистеин, селективное растворение, продукты коррозии. Похожие статьи. Использование растворов силиката натрия в производстве бетонов.
Оценка загрязнения
окружающей среды токсичными металлами
металл, коррозионная среда, слой, материал, коррозия, окружающая среда, схема строения, газовая коррозия, жидкая фаза, контактная коррозия.
Лабораторные методы измерения и приборы контроля
коррозии
При переходе металла в продукты коррозии и кислых средах выделяется эквивалентное количество водорода. В нейтральных кислородсодержащих средах при образовании продуктов коррозии поглощенного эквивалентное количество кислорода.
В нейтральных кислородсодержащих средах при образовании продуктов коррозии поглощенного эквивалентное количество кислорода.
Изучение влияния некоторых аминов на
коррозионное поведение…
1. 2. Коррозионной средой служил 3% раствор NaCl и 3% раствор NaCl, насыщенный h3S (0,8 г/л). Это модельная среда (NACE) содержит сильные активаторы коррозионного процесса.
Такой подход, основанный на двух независимых методах оценки скорости коррозии…
Коррозия в судовых парогенераторах | Статья в журнале…
Электрохимическая коррозия. Коррозионный процесс, разрушающий металл, в следствие
Электрохимическая коррозия наблюдается при протекании следующих процессов: − анодного, образование ионов металла в электролите и некомпенсированных электронов
Коррозия металлов.
 Основные виды коррозии. Электрохимическая коррозия металлов
Основные виды коррозии. Электрохимическая коррозия металлов
Коррозия металлов. Основные виды коррозии. Электрохимическая коррозия металлов. Скорость коррозии. Методы защиты металлов от коррозии.
Коррозией называется разрушение металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
Коррозия приводит к большим потерям металлов в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и пр. Безвозвратные потери металлов от коррозии составляют 10% от ежегодного их выпуска. По ориентировочным подсчетам, мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Однако, затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов во много раз превышают стоимость металла, из которого они изготовлены. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему.
Различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах; б) коррозию в неэлектролитах – агрессивных органических жидкостях, таких как, например, сернистая нефть и др.
Газовая коррозия протекает по схеме: n Me + m/2O2 = MenOm;
Коррозию в серусодержащих неэлектролитах можно выразить схемой: Me + S = MeS.
Электрохимическая коррозия может протекать: а) в водных растворах электролитов, то есть солей, кислот и щелочей; б) в атмосфере любого влажного газа; в) в почве.
В воде обычно содержится растворенный кислород, способный к восстановлению по схеме: О2 + 4Н+ + 4е = 2 Н2О, или в нейтральной среде: 2Н2О +О2 + 4е = 4ОН— (1);
Кроме того, в воде присутствуют ионы водорода, также способные к восстановлению: 2Н+ + 2е = Н2 или (в нейтральной среде) Н2О + 2е = Н2 + ОН—(2).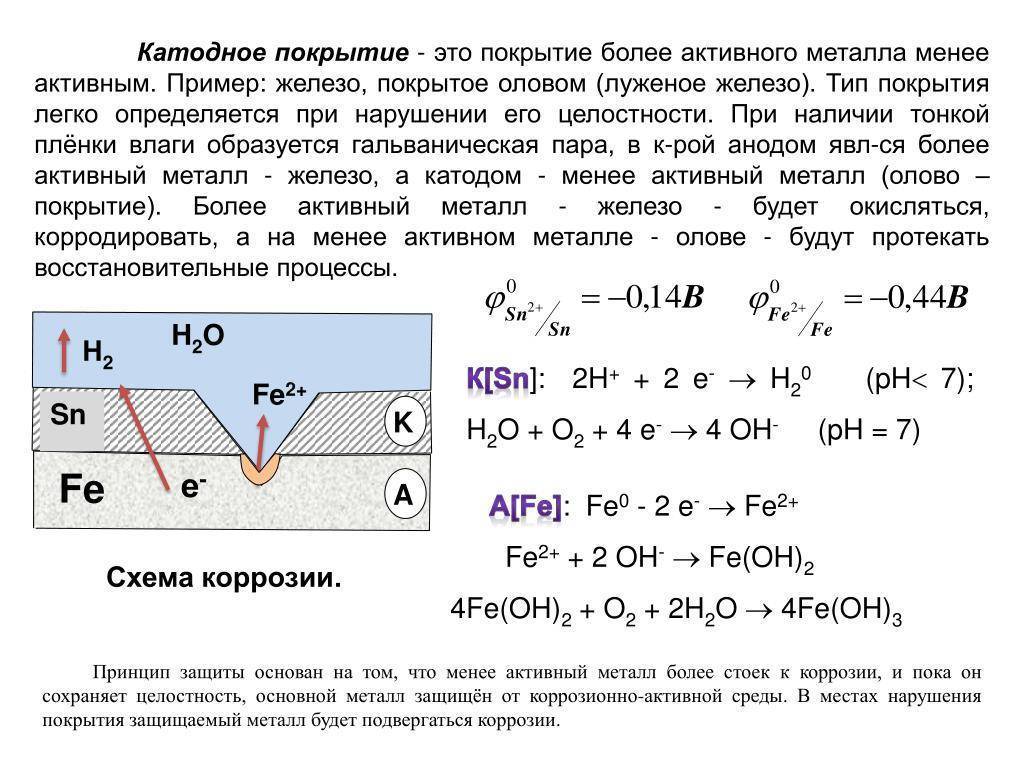 Коррозия с участием кислорода называется коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Коррозия с участием кислорода называется коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Потенциал, отвечающий электродному процессу (1), равен 1,229в – 0,059рН. В нейтрально среде он равен около 0,8в. Следовательно, растворенный в воде или нейтральных растворах кислород будет окислять те металлы, потенциал которых меньше, чем 0,8в. Эти металлы расположены в ряду напряжений, начиная от его начала, до серебра.
Потенциал электродного процесса (2) в нейтральной среде равен приблизительно –0,41в. Следовательно, ионы водорода в нейтральных водных растворах могут окислить только те металлы, потенциал которых меньше, чем 0,41в. Это металлы от начала ряда напряжений до кадмия.
Пример 1. Рассмотрим электрохимическую коррозию железа в кислой среде.
На анодных участках происходит окисление железа: (а) Fe – 2e = Fe+2;
На катодных участках происходит восстановление водорода: 2Н+ + 2е = Н2.
Пример 2. Если гвоздь вбить во влажное дерево, то коррозии подвергается (покрывается ржавчиной) та его часть, которая находится внутри дерева. Это объясняется тем, что влага древесины содержит растворенный кислород, то есть, происходит коррозия железа по схеме:
(а) Fe –2e = Fe2+; (к) О2 + 2Н+ + 4е = 2Н2О;
Продуктами коррозии являются вода и оксид железа (II), который в присутствии кислорода окисляется до оксида трехвалентного железа Fe2O3.
Кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную оксидную пленку, которая препятствует взаимодействию этих металлов с водой. Поэтому количество металлов, которые может окислить водород в нейтральной среде, еще меньше.
Таким образом, вода, содержащая растворенный кислород (в воде его обычно содержится от 0 до 14 мг/л), значительно опаснее в коррозионном отношении, чем вода, способная окислять металлы только за счет ионов водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла и окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде: атмосфере или растворе. Могут иметь место различные случаи электрохимической коррозии.
Атмосферная коррозия – это коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы и, в первую очередь, кислород. Скорость атмосферной коррозии зависит от многих факторов. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты (например, СО2 или SО2). Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию в них влаги.
Коррозия в грунте (почвенная коррозия) приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный кислород. В зависимости от состава грунтовых вод, а также минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Контактная коррозия протекает, когда два металла в различными потенциалами соприкасаются друг с другом либо в влажной среде, либо при наличии влаги, конденсирующейся из воздуха. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Пример 3. Хром находится в контакте с медью. Какой из металлов будет окисляться, если эта пара металлов попадет в кислую среду? Составьте схему образующегося при этом гальванического элемента.
Хром более активный металл, чем медь (потенциал хрома равен –0,744в, а меди +0,337в), поэтому в образующейся гальванической паре он будет анодом, а медь – катодом. Хромовый анод растворяется: (а) 2Cr – 6e = 2Cr3+;
на медном катоде выделяется водород: (к) 6Н+ + 6е = 3Н2.
Схема образующегося гальванического элемента:
(-) 2Cr/Cr3+//HCl/(Cu)3H2/6H+ (+)
Основным отличием процессов контактной электрохимической коррозии от процессов, происходящих в гальваническом элементе, является отсутствие внешней электрической цепи. Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
На поверхности металла могут быть участки, на которых катодные процессы протекают быстрее (катализируются). Такие участки называют катодными. На других участках будет происходить анодное растворение металла, поэтому они называются анодными участками. Катодные и анодные участки имеют очень малые размеры, однако, они чередуются и образуют коррозионные микроэлементы. Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Пример 4. Атмосферная коррозия алюминия в нейтральной среде протекает по схеме:
(а) 2Al – 6e = 2Al 3+; (к) 3Н2О + 3е = 3Н2 + 3ОН—. Продуктами коррозии являются в данном случае водород и гидроксид алюминия.
Пример 5. Медь не вытесняет водород из разбавленных кислот вследствие того, что ее потенциал более положительный, чем потенциал водорода. Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на меди начинается бурное выделение водорода. Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но и от природы растворенных в воде веществ и температуры. Так, в случае контакта железо-цинк, последний интенсивно коррозирует при комнатной температуре, но в горячей воде полярность металлов изменяется, и коррозировать начинает железо.
Для защиты от коррозии и предупреждения ее применяются различные методы. К важнейшим из них относятся следующие методы:
1) Легирование металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию основного металла и повышение его устойчивости к коррозии. В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
2) Защитные покрытия. Слои различных материалов, создаваемые на поверхности металлических изделий и сооружений для защиты от коррозии называются защитными покрытиями. Материалами для защитных покрытий могут быть как чистые металлы цинк, кадмий, алюминий, никель, медь, хром, серебро, так и их сплавы (бронза, латунь и др.).
Защитные покрытия делятся на катодные и анодные покрытия. К катодным покрытиям относятся такие металлические покрытия, потенциалы которых имеют более положительное значение, чем потенциал основного металла. Примерами катодного покрытия на стальных изделиях являются медь, серебро, никель. При повреждении покрытия или при наличии в нем пор возникает коррозионный элемент, в котором основной материал служит анодом и растворяется (коррозирует), а материал – катодом, на котором выделяется водород или поглощается кислород. Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинковое покрытие на стальных изделиях. При повреждении покрытия анодом будет служить металл покрытия, а основной металл, в качестве катода, разрушению подвергаться не будет. Потенциалы металлов зависят от состава растворов, поэтому, например, покрытие стали оловом (лужение) в растворе серной кислоты является катодным, а в растворе органических кислот – анодным.
Пример 6. Железное изделие покрыли кадмием. Какое это покрытие – катодное или анодное? Составьте уравнения анодного и катодного процессов коррозии этого изделия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случае?
Кадмий (потенциал –0,403в) менее активный металл, чем железо, (потенциал –0,440в) и в случае образование коррозионного элемента будет служить катодом поэтому данное покрытие является катодным. При коррозии происходит анодное растворение железа:
При коррозии происходит анодное растворение железа:
(а) Fe – 2e = Fe2+;
Катодным процессом в случае атмосферной коррозии во влажном воздухе будет восстановление кислорода:
(к) H2O +O2 + 4e = 4OH—;
Продуктами коррозии в данном случае являются гидроксид железа.
В кислой среде происходит катодное восстановление ионов водорода:
(к) 2Н+ +2е = Н2.
Продуктами коррозии в этом случае являются хлорид железа (II) и водород.
Пример 7. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Составьте уравнения анодного и катодного процессов коррозии и укажите, какие продукты коррозии образуются.
Ржавчиной быстрее покроется железная пластинка, покрытая медью, так как в паре железо (потенциал –0,440в) – медь (потенциал +0,337в) железо является анодом и разрушается по схеме:
(а) Fe – 2e = Fe2+;
На катоде происходит восстановление растворенного в воде кислорода по схеме:
(к) H2O + O2 + 4e = 4OH—;
Продуктами коррозии является гидроксид железа.
В паре железо-олово (потенциал +0,150в) железо также является более активным металлом, а, следовательно, анодом. Анодный процесс состоит в окислении железа по схеме:
(а) Fe –2e = Fe2+;
Вместе с этой лекцией читают «5 Сетевые модели».
Катодный процесс протекает аналогично предыдущему. Продуктами коррозии является гидроксид железа.
ЭДС первого коррозионного элемента равен +0,337 – (-0,440) = +0,777 в. ЭДС второго коррозионного элемента равен +0,150 – (-0,440) = +0,590 в. Следовательно, в первом случае коррозия железа будет протекать быстрее.
3) Электрохимическая защита. Этот метод защиты от коррозии основан на торможении анодных или катодных реакций коррозионных процессов. К защищаемой конструкции присоединяют металл с более отрицательным электродным потенциалом, чем потенциал металла конструкции. Этот металл называется протектором, а защита от коррозии – протекторной защитой. При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
Используется также катодная или анодная поляризация за счет приложенного извне тока. Сущность катодной защиты заключается в том, что защищаемое изделие присоединяется к отрицательному полюсу внешнего источника постоянного тока и становится вследствие этого катодом. Анодом обычно служит стальной вспомогательный электрод, который растворяется. Анодную защиту применяют к металлам, способным легко пассивироваться (образовывать оксидную пленку) при смещении их потенциала в положительную сторону. Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
4) Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию в ней компонентов, опасных в коррозионном отношении. В нейтральных средах, например, коррозия протекает обычно с поглощением кислорода. Кислород удаляют кипячением или вытеснением его из раствора при помощи инертного газа (барботаж инертным газом) или восстанавливают соответствующими реагентами (сульфиты, гидразин). Агрессивность кислых сред можно снизить подщелачиванием (нейтрализацией).
Для защиты от коррозии широко применяют вещества, при добавлении которых в соответствующую среду значительно уменьшается скорость коррозии. Такие вещества называются ингибиторами коррозии. По составу ингибиторы делятся на органические и неорганические. Так как активность ингибиторов зависит от рН среды, их также делят на кислотные, щелочные и нейтральные. По механизму действия ингибиторы можно разделить на анодные, катодные и экранирующие. Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
Piping Products — Corrosion Products & Equipment, Inc.
Перейти к содержимому
Комплексные решения от бака к баку для химических, полупроводниковых, микрофильтрационных, полигонных и общепромышленных применений. Неметаллические, устойчивые к коррозии системы трубопроводов, аксессуары и клапаны от проверенных производителей, включая главного партнера CPE NOV Fiber Glass Systems.
Полиэтилен высокой плотности
- Трубы и фитинги
- Изготовление и проектирование
- Формованные фитинги
- Электромуфтовые фитинги
- Трубопроводные системы с двойной защитной оболочкой
- Труба с прорезями и перфорацией
- Замена и установка водопропускных труб
- Люки и резервуары
- Приводные и ручные клапаны
- Установка и ремонт на месте
Полипропилен и ПВДФ
- Системы кислотных отходов
- Системы трубопроводов высокой чистоты
- Трубопровод двойной защитной оболочки
- Удаление дыма и запаха
- Резервуары и лабораторное оборудование
- Клапан и защитные коробки
- Приводные и ручные клапаны
- Регуляторы и предохранительные клапаны
- Установка и ремонт
ПВХ и ХПВХ
- Трубы и фитинги
- Изготовления
- Прозрачные трубы и фитинги
- Трубопровод с двойной защитной оболочкой
- Приводные и ручные клапаны
- Регуляторы и предохранительные клапаны
- Системы воздуховодов
- Клапан и защитные коробки
Стекловолокно
- Трубы и фитинги
- Изделия
- Двустенные трубопроводные системы
- Трубы с прорезями и перфорацией
- Приводные и ручные клапаны
- Изготовление резервуаров
- Решетки, лестницы и стремянки
- Монтаж и ремонт на месте
Тефлон
- Трубы, трубки и фитинги
- Лента и смазка
- Компрессионные и сварные фитинги
- Клапаны
- Изготовления
- Резервуары и вкладыши для резервуаров
- Компенсаторы
Футерованная сталь и футерованный стеклопластик
- Трубы и фитинги
- Изготовления
- Приводные и ручные клапаны
- Компенсаторы
- Гибкие соединители и шланги
- Резервуары
Специальные продукты
- Оборудование для обеспечения безопасности
- Быстросъемные фитинги
- Блокировочное кольцо
- Пластиковый лист, стержень и трубка
- Магнитная локаторная лента
- Защитные фланцевые экраны
Аренда оборудования
- Fusion Machines
- Аппараты для сварки горячим воздухом
- Экструзионные сварочные аппараты
- Режущие инструменты
- Оборудование для установки стеклопластика
- Электромуфта
Системы
- Трубы, трубки и фитинги
- Лента и смазка
- Компрессионные и сварные фитинги
- Клапаны
- Изготовления
- Резервуары и вкладыши для резервуаров
- Компенсаторы
Другие промышленные системы
Резервуары
- Хранение сыпучих материалов из стеклопластика
- Хранение сыпучих материалов из полиэтилена высокой плотности
- Двойной контейнер
- Ротоформованный или изготовленный на заказ
- Аксессуары для резервуаров
Клапаны
- Неметаллические клапаны
- Металлические клапаны
Поговорите с экспертом
Мы здесь для вас. Свяжитесь с нами для консультации, поиска информации и технического обслуживания.
Свяжитесь с нами для консультации, поиска информации и технического обслуживания.
|


 Наши услуги предоставляются по всей стране.
Наши услуги предоставляются по всей стране. Простой метод защиты заключается в соединении защищенного металла с более легко подверженным коррозии «жертвенным металлом», который действует как анод. Тогда жертвенный металл подвергается коррозии вместо защищенного металла. Для таких конструкций, как длинные трубопроводы, где пассивная гальваническая катодная защита недостаточна, для обеспечения достаточного тока используется внешний источник питания постоянного тока.
Простой метод защиты заключается в соединении защищенного металла с более легко подверженным коррозии «жертвенным металлом», который действует как анод. Тогда жертвенный металл подвергается коррозии вместо защищенного металла. Для таких конструкций, как длинные трубопроводы, где пассивная гальваническая катодная защита недостаточна, для обеспечения достаточного тока используется внешний источник питания постоянного тока. Мы также предлагаем следующие позиции:
Мы также предлагаем следующие позиции:
