Содержание
Восстановление деталей осталиванием. Свойства покрытий, электролиты, оборудование, преимущества способа. — Студопедия
Поделись с друзьями:
Гальванические ремонтные покрытия — осталивание
По сравнению с хромированием процесс остали-вания имеет ряд преимуществ: большую скорость нанесения покрытия, высокий выход металла по току, возможность получения более толстых покрытий, использование более простых и дешевых электролитов. Осталиванием восстанавливают изношенные стержни клапанов, цилиндрические поверхности толкателей, валики масляных и водяных насосов, другие детали.
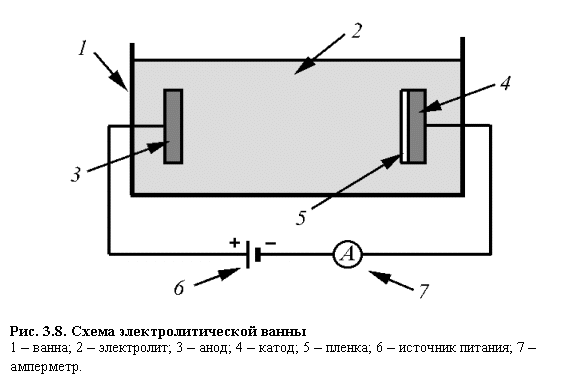
Технологический процесс восстановления деталей осталиванием состоит из подготовки восстанавливаемой поверхности к осталнванию, анодного травления, собственно осталивания, промывки и механической обработки.
Очищенную от загрязнений деталь сначала шлифуют до устранения следов износа, затем отправляют в гальванический цех для дальнейшей обработки. Здесь детали обезжиривают, для чего их монтируют на подвески и опускают в ванну с раствором следующего состава: 20 г/л едкого натра; 25 г/л соды углекислой или кальцинированной; 25 г/л тринатрийфосфата; 5 г/л растворимого (жидкого) стекла. Обезжиривание проводят в течение 5-6 мин при плотности тока 2-3 кА/м2. Температура раствора должна быть 70-80°С.
Обезжиривание проводят в течение 5-6 мин при плотности тока 2-3 кА/м2. Температура раствора должна быть 70-80°С.
Обезжиренные детали промывают в горячей воде, поверхности, не подлежащие покрытию, изолируют полихлорвиниловой лентой или другим кислотостойким материалом. После такой обработки деталь еще раз обезжиривают венской известью с добавкой 5% кальцинированной соды и промывают проточной холодной водой.
Электролитическое анодное травление выполняют в ванне такого состава: 360-400 г/л серной кислоты; 10-20 г/л сернокислого железа. Плотность тока 2,5-3,0 кА/м2, температура 15-20°С, продолжительность 1-2 мин. Детали, прошедшие анодное травление, промывают в горячей воде. Затем подвески с деталями за гружают в ванну для осталивания.
Осталивание рекомендуется проводить в ванне следующего состава: 250—300 г/л хлористого железа; 1,0-1,5 г/л соляной кислоты; 10 г/л хлористого марганца. Возможно применение и других составов.
Процесс осталивания рекомендуется начинать с малой плотности тока — 0,5 кА/м2, а через каждые 5 мин добавлять 0,5 кА/м2, пока его плотность не достигнет 3-4 кА/м2.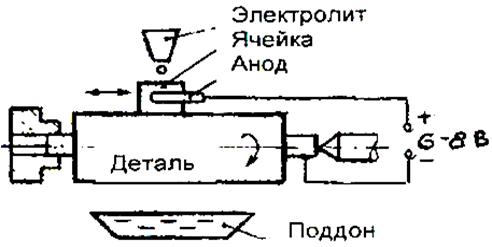 Температуру электролита надо выдерживать в пределах 60-90°С.
Температуру электролита надо выдерживать в пределах 60-90°С.
После осталивания и промывки детали вместе с подвесками погружают в ванну обезжиривания и нейтрализации кислоты. Состав электролита: 20-30 г/л едкого натра; 10-20 г/л жидкого стекла; 25-30 г/л кальцинированной соды. Время обработки 3-4 мин, температура 60-70°С.
Завершается восстановление детали механической обработкой.
Гальванические ремонтные покрытия
Гальванические покрытия получают из электролитов при прохождении через них постоянного тока. Катодом при гальваническом осаждении металлов из электролитов является восстанавливаемая деталь, анодом — металлическая пластина. Применяют два вида анодов: растворимые и нерастворимые. Растворимые аноды изготавливают из металла, который осаждается на детали, а нерастворимые — из свинца.
При прохождении постоянного тока через электролит на катоде разряжаются положительно заряженные ионы, а на аноде — отрицательно заряженные. Металл анода растворяется и переходит в раствор в виде ионов металла взамен выделившихся на катоде.
Для восстановления автомобильных деталей осталиванием, хромированием и цинкованием ГОСНИТИ разработан комплект гальванического оборудования ОРГ-10578. В него входят ванны осталивания, травления, обезжиривания и хромирования (все по одной), три ванны горячей промывки, ванна нейтрализации, две ванны холодной промывки, тележка для фильтрации электролита, три источника постоянного тока, три пульта управления и электротельфер.
Процессы хромирования, осталивания и электронатирания применяются для компенсации износа рабочих поверхностей деталей. Для восстановления защитно-декоративных покрытий применяется в основном только хромирование. Цинкование используется главным образом для защиты деталей от коррозии.
Примеры восстановления деталей гальваническими ремонтными покрытиями
Ось коромысел клапанов двигателя ЗМЗ-24
износ наружной поверхности до диаметра менее 21,96 мм.
Технические требования: деталь должна быть восстановлена способом, обеспечивающим твердость поверхности после обработки не менее HRC 50 и исключающим сильный нагрев металла во избежание искривления оси (материал детали — сталь 45).
Учитывая эти требования, а также небольшой износ, который обычно не превышает 0,15 мм, и наличие сквозных отверстий, лучше всего деталь восстановить хромированием.
На гальванический участок оси коромысел, подлежащие восстановлению, должны поступать промытыми и очищенными от всех загрязнений и прошедшие механическую обработку. Чтобы толщина наносимого слоя покрытия была по всей поверхности одинаковой, диаметр оси уменьшают шлифованием против номинального на 0,15 мм.
Перед нанесением покрытия деталь протирают ацетоном и заглушают все отверстия. При этом применяют заглушки из винипласта. После этого детали на подвеске опускают в ванну для хромирования, имеющую следующий состав электролита: хромовый ангидрид — 250 г/л, серная кислота — 2,5 г/л.
Первоначально производят анодную обработку поверхностей деталей, для чего их подключают к минусовому полюсу источника тока. Анодную обработку осей коромысел производят при силе тока 500-600 А в течение 1-2 мин. После этого переключают питание на прямую полярность и постепенно доводят ток до расчетной величины, т. е. до 1000 А. При данном режиме и нормальном составе электролита слой хрома толщиной 0,3 мм наращивается за 15-20 ч.
е. до 1000 А. При данном режиме и нормальном составе электролита слой хрома толщиной 0,3 мм наращивается за 15-20 ч.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Железнение (осталивание) деталей из ЦАМ и не только
Cronex
После повреждения краски на деталях из ЦАМ встает вопрос о восстановлении покрытия и эстетического вида деталей.
Если краска вас не устраивает (или эта краска жуть как дорогая 😊), можно применить способ покрытия этих деталей обычным средством для холодного воронения Клевер.
Да, вы правы, Клевер вообще никак не реагирует с ЦАМ, силумином и остальными сплавами, не содержащими железа.
Но есть способ это железо нанести на сплавы. Давным давно в СССР этим пользовались для восстановления деталей машин.
Далее попытаюсь описать практический способ.
Cronex
Ну начнем.
Что будем покрывать железом:
Что использовалось:
-Средство для прочистки стоков для предварительной протравки детали. Почему Chirton — из всего что было в магазине в нем было наибольшее содержание едкого натра в составе около 40% (едкий натр хрен в городе найдешь)
Электролит:
-Удобрение железный купорос, есть в любом садовом магазине, у меня упаковка 200 гр цвет должен быть салатовый, если коричневый то это выделение FeIII при контакте с водой.
-Удобрение борная кислота, есть в любом садовом магазине,у меня упаковка 10 гр.
-Лекарство аспирин — в аптеке, на электролит потребовалось 4 таблэтки т.е. 2 гр.
-Поваренная соль — 1 чайная ложка
-*Средство для преобразования ржавчины производства Вика 1 чайная ложка (можно просто заменить о.фосфорной кислотой — бывает в паяльных магазинах как флюс)
-*Нашатырный спирт — 1 чайная ложка, в аптеке
* — не обязательно, только для увеличения Ph более 6
Комплекс для протравы детали.
Сначала тщательно отмываем деталь в Фэри с примесью пищевой соды, раза три с промывкой в проточной воде.
Разбавляем Chirton, либо едкий натр, в кипяченой воде при 60-70 град. Все в перчатках и крайне ОСТОРОЖНО — дрянь очень едкая !!!!
Опускаем деталь в ацкую смесь и наблюдаем — реакция на ЦАМ почти такая же как на хлорное железо, ждем появления интенсивного темного налета — это займет 1-2 минуты.
Промываем деталь в проточной воде и оттираем этот темный налет Фэри с примесью пищевой соды щеткой.
Повторяем процесс протравки и промывки еще раз.
Готовим электролит:
на 1 литр кипяченой воды при 60-70 град. забрасываем все что удалось собрать из реактивов перечисленных выше. Самое главное что бы был железный купорос, борная кислота и аспирин.
С учетом что концентрация достаточно сильная без всяких опасений добавляем воды необходимой для полного закрытия детали.
Я использовал для электролиза самое простое зарядное устройство 12/24 В, но с контролем по току.
В качестве анода в электролит запущен старый гаечный ключ, рекомендуют использовать низкоуглеродистую сталь 2 или 3
Включаем ток, процесс в 3 этапа.
1- примерно 15-20 мин на 1А, наблюдаем на реакцию на поверхности до появления легкого налета. Вынимаем и промываем в проточной воде стирая налет.
2- примерно 15-20 мин на 5А, наблюдаем на реакцию на поверхности. Вынимаем и промываем в проточной воде стирая налет.
3- примерно 15-20 мин на 10А,наблюдаем на реакцию на поверхности. Вынимаем и промываем в проточной воде стирая налет.
Почему 3 этапа?
1 для формирования поверхностной адгезии с протравленной поверхностью детали.
2 формирование укрепляющего слоя
3 формирование основного слоя поверхности
Впрочем токи и время этапов можно варьировать на свое усмотрение.
После окончания электролиза деталь тщательно отмываем в Фэри с примесью пищевой соды, раза три с промывкой в проточной воде для удаления налета. Можно попробовать карцевание, но я не стал — не было стальной терки из проволоки, а из стружки сильно абразивна.
После этого деталь сушим , вот тут начинается истерика — эта дрянь на глазах покрывается ржавчиной!!!
Не пугаться — это показывает что процесс удался.
После сушки деталь обрабатываем Клевером как обычную железяку.
После обработки деталь сушим и натираем маслом.
Вроде все.
Что получилось:
-покрытие 0,2 мм химическим железом сплава ЦАМ
-укрепление конструкционной поверхностной прочности (попробовал согнуть осталленную алюминиевую проволоку — по сравнению с непокрытыми участками увеличение прочности очень заметно)
-применение классической холодной воронилки Клевер и достаточно неплохой результат по качеству и равномерности цвета из-за применения его по чистому железу.
-возможность неограниченного количества раз применения данного способа восстановления покрытия без изменения геометрии детали
Непушист
Мне вот любопытно — заворонить нормально, в селитре, возможно потом? Ведь если попадется не осталенный участок, его прожрет расплав. РЛ видимо безопаснее.
РЛ видимо безопаснее.
Cronex
Я боюсь что не стоит проверять и вот почему — данный метод в силу своего кустарного состояния и отдаленно напоминающий реальный технологический процесс (импирический подбор химикатов и пропорций — что было под рукой) не дает гарантии качественного и сплошного сцепления с поверхностью сплава.
От это к сожалению никуда не уйдешь, путь только в гальвано-цех к профи в этом деле 🙂 Я тут почитал старую книжку что то типа «Технологу промышленного производства» — там столько тонкостей!!!!
Тем более что по технологии после железнения необходимо проводить закаливание нанесенного покрытия для получения необходимой твердости (чуть ли не до твердости нержавейки), а этого к сожалению сам сплав не позволит.
RW
Cronex, молодца, результат как говорится на лицо и говорит сам за себя.
Cronex
Спасибо за приятный отзыв 🙂
В следующий раз попытаюсь найти дополнительные соли для повышения прочности покрытия, собрать более приличную ванну для электролиза и провести процесс железнения максимально приближенный к оригинальному технологическому процессу.
SHTIRLITZ
Интересная тема, послежу.
-=SoViN=-
Интересная тема, послежу.
+1
Cronex
Тут на днях заказал Cybergun Tanfoglio Colt 1911 и кучу дополнительной химии в Чип и Дип (не реклама)
На этой машинке планирую провести дополнительные исследования с качеством покрытия и эффектом хим. полировки.
Правда в силу отдаленности проживания и сроках доставки, результаты получится представить только после НГ.
Кстати для данного процесса можно применить обычную старую зарядку для телефона. Там около 300-500 мА на 6 В, будет вполне достаточно для электролиза только время будет побольше затрачено. Зато снижение скорости осаждения положительно скажется на качестве и прочности покрытия.
Там около 300-500 мА на 6 В, будет вполне достаточно для электролиза только время будет побольше затрачено. Зато снижение скорости осаждения положительно скажется на качестве и прочности покрытия.
Strelok-mod79
Отличный способ. Если пожелезнить направляющие, то наверное и износ меньше будет.
Вот только с закалкой железа ничего не выйдет. Углерода то нет, соответственно и закалить не выйдет. На сколько знаю — твердость покрытий имеет нескллько другую природу нежели закаленная сталь.
Cronex
Тем более что по технологии после железнения необходимо проводить закаливание нанесенного покрытия для получения необходимой твердости (чуть ли не до твердости нержавейки)
Вот очень сильно сомневаюсь, что в технологии указана нержавейка, как критерий оценки твердости. Это все равно что например оценивать смазочные материалы в сравнении с пластилином.
Cronex
Ну с закалкой и упоминание нержавейки не сам придумал — только продал за что купил 🙂
«Прогревание полученных покрытий в течение 1 ч при 400? С повышает микротвердость слоя до 1400 кгс/мм2.»
«После термообработки в вакууме или в безокислительной среде при 1100-1150? С в течение 1 ч покрытие имеет однородную структуту и микротвердость от 1200 до 1600 кгс/мм2. Износостойкость его повышается в 10-12 раз по сравнению с покрытием чистым железом.»
Это выдержки из текста по методологии для хлористых и сернокислых электролитов.
Про закалку наверное имелось ввиду все таки легирование добавлением в электролит солей хрома, марганца, бора и т.д.
Zveri4
Раз тема о покрытии алюминия,спрошу здесь:
Кто пользовался таким составом и если пользовался,что получилось?
http://modelsworld.ru/shop/product24974.php
Cronex
Сам такую прикупил, но пока не использовал.
Похоже что это средство на основе селена, а следственно особо прочного покрытия ожидать не приходится.
ИМХО для быстрых косметических целей, но вполне имеет право на использование.
Deni-kin
Cronex
После термообработки в вакууме или в безокислительной среде при 1100-1150? С в течение 1 ч покрытие имеет однородную структуту и микротвердость от 1200 до 1600 кгс/мм2.
Так то оно может и так, но не для покрытия на алюминии и его сплавах, при такой t он может не испарится конечно, но кипеть точно будет, бомба получится, да не — порвёт самое тонкое место и вытечет. http://aluminium-guide.ru/temp…nievyx-splavov/
John JACK
Cronex
Износостойкость его повышается в 10-12 раз по сравнению с покрытием чистым железом.
Это никак не закалка, а скорее спекание довольно рыхлого электролитического слоя в более плотную корку. Химически будет всё то же практически чистое железо (Fe), никакая не сталь.
Воронение в селитре тут не пройдёт. Электрохимия такая электро, работает только по пути наименьшего сопротивления от анода к детали. В внутренние полости о особенно углы ионы железа не пролезут. Щёлочь же доберётся везде и радостно сожрёт люминь. Это если не рассматривать возможности того, что покрытие само окислится насквозь.
Нержавейка же бывает очень разная. У «обычной» нержавейки с пластилином можно спокойно сравнивать и твёрдость.
Непушист
Zveri4
Раз тема о покрытии алюминия,спрошу здесь:
В теме про 1911-й Кольт кто-то пользовался ею и выкладывал фотки. Вопрос как обычно в том, в т. ч., что все-таки жидкость позиционируется как состав именно для алюминия. Возможно что по нему она работает хорошо, но в наших-то делах чистый алюминий редкость. Народ радостно бежит тереть ею цамовое литье, как-то словно бы забывая про медь и цинк в его составе…
Народ радостно бежит тереть ею цамовое литье, как-то словно бы забывая про медь и цинк в его составе…
Zveri4
Народ радостно бежит тереть ею цамовое литье, как-то словно бы забывая про медь и цинк в его составе..
Ну в инструкции,что-то про примеси есть,видимо надо пробовать.Лично мне надо зачернить резервуар,краской могу но не хочу,вот и интересуюсь.
Непушист
Zveri4
Лично мне надо зачернить резервуар,краской могу но не хочу,вот и интересуюсь.
А если в термоусадку 😊
Zveri4
А если в термоусадку
Это самое простое,только увеличивать диаметр нельзя,восьмерка подогнана.Да и не по Феншую это.
Непушист
Zveri4
Это самое простое,только увеличивать диаметр нельзя,восьмерка подогнана.Да и не по Феншую это.
Короче применительно к холодным красилкам (воронилками их язык называть не поворачивается) можно сказать одно — не стоит питать насчет них иллюзий. Все они работают примерно одинаково. Т. е. чернить конечно чернят, но держатся ерундово. На стенку вещь повесить — нормально, юзать — неизбежно протираются в местах контакта с руками, притом некрасиво, совсем не так как настоящее воронение. Косметика, словом.
Tranklykator
Может оффтоп, но едкий натр можно купить в магазине радиодеталей, используется для проявления фоторезиста. Цена правда негуманная
Cronex
едкий натр можно купить в магазине радиодеталей
Ага…. Приглашаю в реальность славного г.Находка Приморского края где есть целых 2 магазина этой тематики 🙂 оба размером с сигаретный ларек 🙂 и ассортиментом … блин это даже ассортиментом назвать нельзя.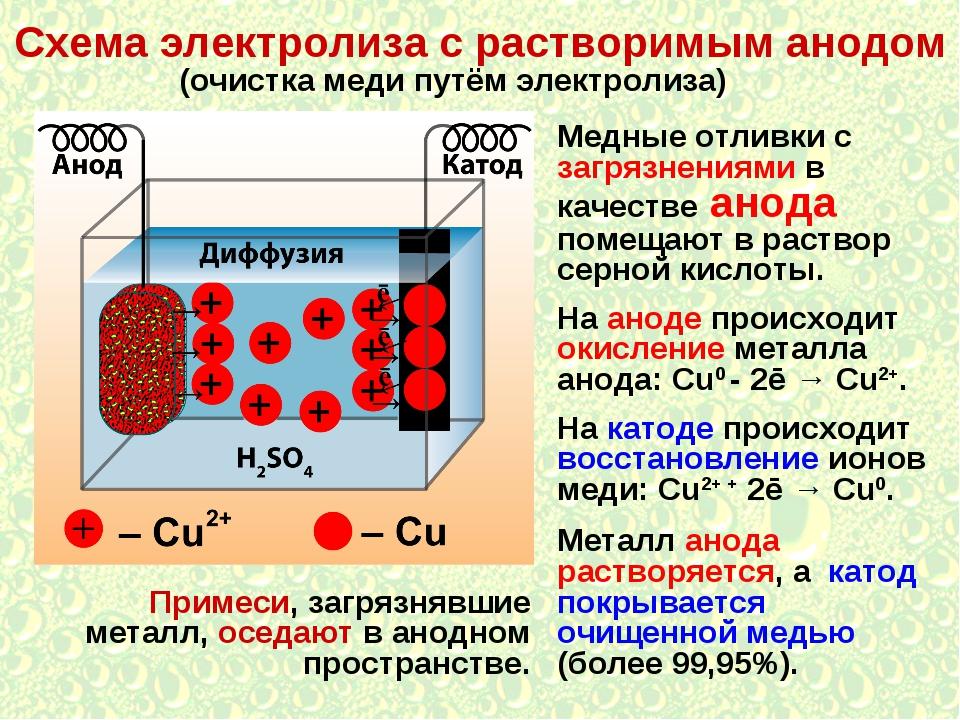
Я лет 35 занимаюсь радиоэлектроникой и все что смог купить в городе это цапон лак и то в строительном магазине 🙂
Вот когда жил и работал в Москве 2002-10 тогда, да — проблем не было 🙂
Да и на сколько я помню едкий натр вообще объявлен перкурсором.
John JACK
Едкий натр продаётся в любом хозяйственном в составе «средства для прочистки засоров канализации». Это натриевую селитру вы в обычном садовоческом магазине купите только очень случайно.
Непушист
John JACK
в любом хозяйственном
Мож не надо писдеть о том, чего не знаешь? Во-первых далеко не в любом, во-вторых то, что там изредка продается, как правило содержит большой процент добавок типа мела, сводящих результат к нулю.
John JACK
Непушист
Мож не надо писдеть о том, чего не знаешь?
А, прости что покусился на твою монополию.
«То, что там изредка продаётся», успешно используется разными людьми. Хотя у меня есть несколько килограммов реактивов из специально обученного магазина, и когда они кончатся, я просто пойду и куплю там же ещё.
Cronex
как правило содержит большой процент добавок типа мела, сводящих результат к нулю
Ну в случае с Чиртон это алюминиевые шарики 🙂
Strelok-mod79
John JACK
Это натриевую селитру вы в обычном садовоческом магазине купите только очень случайно.
Вообще-то я калийную там и брал, в садоводческом. Да и отсутствие калийной селитры (а именно она считается самой ужасной среди слуг, про нее же в школе говорили что порох делают!!!) при наличии аммиачной 😛 (тут слуги спокойны, никто в эту химию из них на столько не углублялся, ещё мосх напрягать) — это бред чистой воды.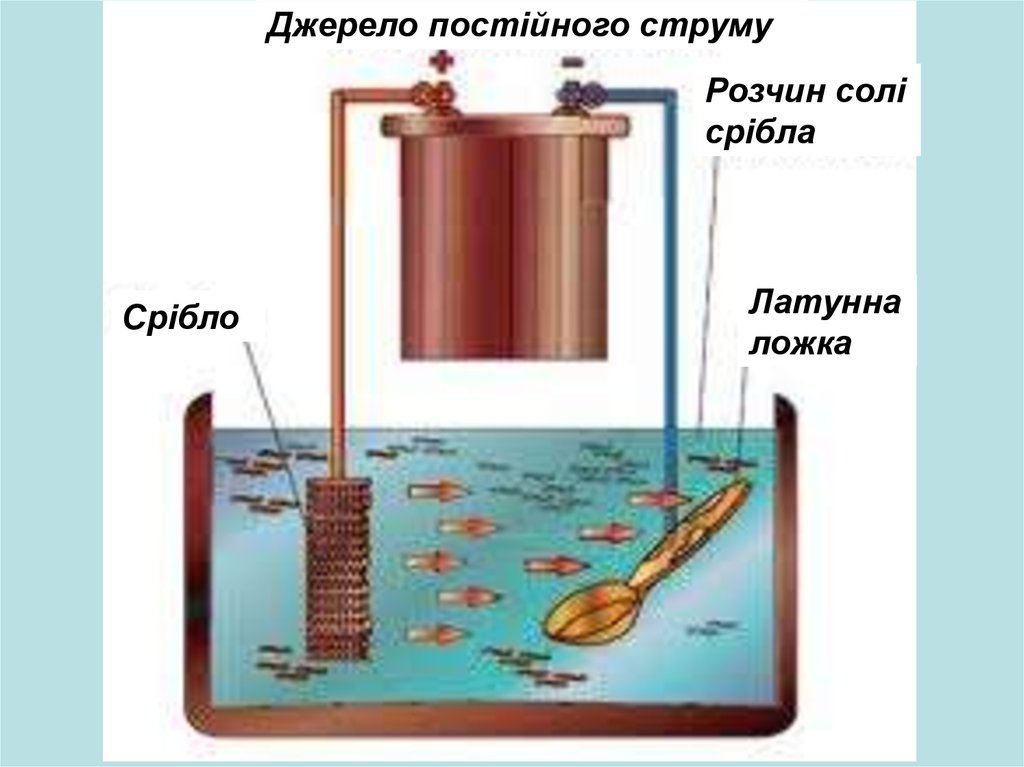
Kinnn
Калийная точно есть, а когда я спросил натриевую, меня не поняли…
Вообще-то я калийную там и брал
Strelok-mod79
А зачем натриевая? Калийная лучше, она и как удобрение лучше, и как источник кислорода.
krysoboj
испытывал я подобную технологию в студенчестве. покрытия не получилось. отложения были в виде коричневых хлопьев. почему? кстати в первоисточнике предлагалось ещё различное скульптурное творчество из пластилина или парафина с последующим покрытием графитом. или железнение насекомых, членистоногих и пр.
Strelok-mod79
Плотность тока очень важна.
Cronex
Плотность тока очень важна.
Согласен — ток был очень сильным и плотный электролит
Keltec
Up
Непушист
Осталивание Кольта-1911
http://s12.postimg.org/9sbbqrbjx/IMG_9910.jpg
http://s24.postimg.org/tym6bwdj9/IMG_9911.jpg
http://s7.postimg.org/6y5acgg0b/IMG_9918.jpg
😊
Cronex
Какой электролит использовали?
Результат — просто восхищает!! 🙂
Кстати звук затворной рамы изменился?
Непушист
Cronex
Какой электролит использовали?
Результат — просто восхищает!! 🙂
Кстати звук затворной рамы изменился?
Должен перед Вами покаяться, коллега. Я запостил эти ссылки просто в виде шутки. Это мой Кольт-1911 от Инокацу, который я недавно приобрел, он целиком из каленой сталюки. Извините за легкий «оживляж» темы.
Извините за легкий «оживляж» темы.
Cronex
Ок, понял 🙂
А то я уж весь обзавидовался и начал смотреть на свои кривые руки 🙂
Непушист
John JACK
А, прости что покусился на твою монополию.
Ты не в состоянии «покуситься на мою монополию» по двум причинам — 1. я не держу монополий, и 2. со «средствами из хозяйственных» у тебя это едва ли вышло бы, если б и держал…
Avizenna
Алюминий любит железо, а железо любит алюминий. Сплав получается альфер, а смесь алюминия и железа термит. 😊Железо очень хорошо садится на алюминий с последующей полной диффузией алюминия в железо(со временем). Гы 😊
Tranklykator
попробовал технологию, ничего не вышло. Детальки из дюрали лишь приобретали неравномерный черный трудносмываемый налет. Помучился, в итоге забил и покрасил баллоном 😞
Детальки из дюрали лишь приобретали неравномерный черный трудносмываемый налет. Помучился, в итоге забил и покрасил баллоном 😞
Cronex
Детальки большие были?
Если маленькие то явно была большая плотность тока на площадь поверхности покрываемых деталей. И электролит большой концентрации тоже вредит.
Неравномерное покрытие говорит о плохом обезжиривании.
Если налет стирался без применения какой либо химии (типа очиститель для снятия загрязнения и воронения) значит адгезия слабая получилась.Либо протравка не удалась, либо опять обезжиривание.
Можно после протравки попробовать анодное травление — переброс полярности на пару минут.
Во кстати, а полярность не перепутали?
Tranklykator
Детальки были мелкие, спусковая скоба и восьмерка. Неравномерное не в смысле пятнами, а с одного края толще налет, а с другого тоньше. Налет удалялся химией, пробовал и щелочью, и ортофосфорной кислотой, смывало на раз. А металлической губкой отдиралось с трудом, именно сдирать приходилось, до царапин в алюминии.
Налет удалялся химией, пробовал и щелочью, и ортофосфорной кислотой, смывало на раз. А металлической губкой отдиралось с трудом, именно сдирать приходилось, до царапин в алюминии.
Токи пробовал разные от 5 А, до 300 мА на детальку, вся разница в скорости образования налета, ну и при больших токах деталь приобретала налет бархатистого вида. На железку кидал +, на деталь — Менять полярность не пробовал, может и перепутал 😊 Пробовал и углеродистую и малоуглеродистую сталь. Электролит был по рецепту с первого поста, просто первый раз я соль забыл положить, а потом и с солью намешал, разницы не увидел. Единственный раз на внутренней поверхности восьмерки появился ржавый налет, но снаружи он был все равно черным.
Даже думал так и оставить, но этот налет сильно мазучий
Единственное сильное отступление от сабжевой технологии — бодяжил в воде комнатной температуры, была баклага дистиллированной. Может, это и есть основная ошибка. В горячей не пробовал
Cronex
С одного края больше с другого меньше это от большой плотности электролита мне кажется — слишком короткий путь для ионов и они скопом оседают на ближайшей поверхности. В этом случае на углах должно быть наибольшее оседание. Было такое проявление?
При больших токах бархатистость тоже признак плотного электролита, покрытие вообще могло принять слоисто лохматый или игольчатый характер.
А площадь анода была больше или сравнима с площадью деталей? По всем руководствам должна быть равна или больше.
То что сдирать приходилось это хорошо 🙂 — значит оно самое получилось.
Ор.фосфорной кислотой по железу должно было получиться фосфатирование с блекло серым налетом и плотнее чем сам о покрытие, а вот то что оно ею смылось это уже вопрос. Может просто цвет сменился в тон деталей?
Мазучий налет получается при протравке в щелечи и при анодном травлении, это когда + на деталь … странно.
Tranklykator
Ну на моих деталях сложно было сказать, они больше из углов, чем из поверхностей состояли, но на внешних сторонах, обращенных к аноду, налет был толще. Думал даже крутить деталь в электролите. При больших токах и выдержке действительно игольчатый налет получался, и на углах «пушистей», чем на поверхностях. Насчет площади анода не заморачивался, скорее она была равна, или ненамного больше. Хотел было 2 анода по краям ванны сделать, но не стал.
В щелочи налет отходил как бы пластинками, а от ортофоски просто деталь белела. Но показалось, что просто налет смывался до алюминия.
А температура сильно важна? Что то подумалось повторить процесс более вдумчиво
Cronex
Температура для сернокислых электролитов рекомендуется в районе 40-60 градусов, на сколько влияет на сам процесс точно не скажу, врать не буду, не экспериментировал.
А вот для приготовления электролита действительно лучше нагреть до 70-80 градусов.
И вот еще уточнение — какой объем электролита у вас получился? Если остался 1 литр плюс химикаты, то это большая концентрация. В начале топика написано про это и про то что я доливал воду. Фактически у меня получилось около 2 литров электролита. Наверное надо уточнение дописать.
Новый электролит может помочь батареям электромобилей противостоять холоду
Увеличивающаяся с годами плотность энергии литий-ионных батарей привела к появлению электромобилей с увеличенным запасом хода. Но этот запас хода резко падает вместе с температурой зимой. Это падение производительности батареи является одной из причин, по которой клиенты часто не хотят покупать электромобиль.
Изменив электролит батареи, исследователи создали батарею, которая работает при температурах до -20 °C. По сравнению с другими батареями для холодной погоды, о которых до сих пор сообщали исследователи, у этой батареи рекордный срок службы — более года.
Современные батареи хорошо работают при температуре от 0 °C до 40 °C. Для более широкого распространения разработчики стремятся создавать аккумуляторы, работающие в более широком диапазоне температур, от -40 °C до 60 °C. «Высокая плотность энергии и долгий срок службы литий-ионных аккумуляторов при низких температурах являются ключом к разработке всепогодных электромобилей», — говорит Чонг Ян из Пекинского технологического института.
Для более широкого распространения разработчики стремятся создавать аккумуляторы, работающие в более широком диапазоне температур, от -40 °C до 60 °C. «Высокая плотность энергии и долгий срок службы литий-ионных аккумуляторов при низких температурах являются ключом к разработке всепогодных электромобилей», — говорит Чонг Ян из Пекинского технологического института.
Увеличенные аккумуляторы снижают запас хода электромобиля на холоде
Сегодня, чтобы аккумуляторы работали на холоде, производители добавляют внешнюю изоляцию и обогрев. Но это также увеличивает габариты, а перенос этого дополнительного веса снижает дальность пробега. Кроме того, он не идеален для аккумуляторов для работы в холодную погоду в приложениях, чувствительных к весу, таких как высотные дроны и спутники.
Многие исследователи пытаются улучшить работу аккумуляторов при низких температурах, сосредоточив внимание на электролитах, которые перемещают ионы лития между электродами аккумулятора. Низкие температуры загущают эти электролиты, поэтому ионы движутся медленнее, что приводит к потере емкости и медленной зарядке. Некоторые команды недавно использовали низкотемпературные растворители для изготовления электролитов или тестировали химические добавки в электролитах, которые помогают улучшить их устойчивость к холоду. Другие разработали совершенно новые электролиты, способные выдерживать широкий диапазон температур.
Некоторые команды недавно использовали низкотемпературные растворители для изготовления электролитов или тестировали химические добавки в электролитах, которые помогают улучшить их устойчивость к холоду. Другие разработали совершенно новые электролиты, способные выдерживать широкий диапазон температур.
Ян вместе с Цян Чжаном из Университета Цинхуа и их коллегами сосредоточились на низкотемпературном растворителе. Хотя такие растворители помогают работать в холодную погоду, известно, что при высоких температурах они выделяют газы, которые сокращают срок службы батареи. «Тем не менее, механизм газообразования и соответствующая стратегия ингибирования остаются неизвестными», — говорит Ян.
В своей статье, опубликованной в журнале Matter , исследователи раскрывают механизм образования газа и предлагают новый высококонцентрированный электролит, разработанный ими в качестве решения проблемы.
Они обнаружили, что литиевое покрытие — накопление металлического лития на поверхности графитового анода батареи — является причиной газообразования.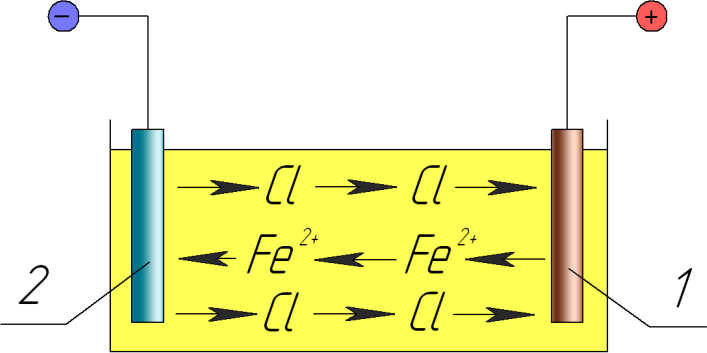 При зимних температурах из-за того, что ионы лития движутся медленно, они, как правило, скапливаются при входе из электролита в графит, поэтому некоторое количество металлического лития в конечном итоге накапливается на поверхности. Исследователи обнаружили, что обычно используемый низкотемпературный растворитель этилацетат бурно реагирует с этим гальваническим литием, что приводит к образованию газообразных водорода и этана. Давление скопившегося газа в конечном итоге приводит к растрескиванию электродов и выходу батареи из строя.
При зимних температурах из-за того, что ионы лития движутся медленно, они, как правило, скапливаются при входе из электролита в графит, поэтому некоторое количество металлического лития в конечном итоге накапливается на поверхности. Исследователи обнаружили, что обычно используемый низкотемпературный растворитель этилацетат бурно реагирует с этим гальваническим литием, что приводит к образованию газообразных водорода и этана. Давление скопившегося газа в конечном итоге приводит к растрескиванию электродов и выходу батареи из строя.
Подход к холодной погоде использует новый электролит
Для борьбы с образованием газа исследователи изготовили электролит, растворив большее, чем обычно, количество солей лития в растворителе, состоящем из 90 процентов этилацетата и 10 процентов фторэтиленкарбоната.
Затем исследователи изготовили элемент батареи с этим электролитом, графитовым анодом и катодом NMC811, состоящим из 80 процентов никеля, 10 процентов кобальта и 10 процентов марганца. Катоды NMC811 используются в современных высокоэффективных литий-ионных батареях из-за их высокой плотности энергии и минимального использования дорогого кобальта.
Катоды NMC811 используются в современных высокоэффективных литий-ионных батареях из-за их высокой плотности энергии и минимального использования дорогого кобальта.
«Все материалы, которые мы используем, коммерчески доступны, и предлагаемый электролит разумно производить в больших масштабах», — говорит Ян, что делает новый подход легко применимым к современным распространенным химическим веществам аккумуляторов и производственным процессам.
Исследователи показали, что использование этилацетата в качестве основного растворителя обеспечивает работоспособность элемента батареи при температурах до -40 °C. Между тем литиевая соль реагирует с фторэтиленкарбонатом, образуя твердый слой на аноде, который проводит ионы лития, но также защищает любой металлический литий, который неизбежно покрывает поверхность. Защитный слой предохраняет литий от реакции с этилацетатом и образования газов.
В ходе испытаний элементы сохранили более трех четвертей своей емкости при комнатной температуре при -40 °C. И их можно заряжать в течение более 1400 циклов, что является средним числом циклов зарядки, которое батарея проходит в течение года.
И их можно заряжать в течение более 1400 циклов, что является средним числом циклов зарядки, которое батарея проходит в течение года.
Однако, по словам Яна, еще есть узкие места, которые нужно преодолеть. Электролит имеет относительно высокую стоимость по сравнению с обычными, и аккумулятор неэффективно работает при температуре ниже -50°С. Поэтому теперь команда планирует «дальнейшую оптимизацию концентрации литиевой соли и типа растворителя, стремясь снизить стоимость электролита», а также улучшить характеристики при более низких температурах.
Новая конструкция электролита может привести к созданию более качественных аккумуляторов для электромобилей
Новый электролит на основе лития, изобретенный учеными Стэнфордского университета, может проложить путь к следующему поколению электромобилей с батарейным питанием.
Обычный (прозрачный) электролит слева и новый Стэнфордский электролит справа. (Изображение предоставлено Zhiao Yu)
В исследовании, опубликованном 22 июня в журнале Nature Energy , исследователи из Стэнфорда демонстрируют, как их новая конструкция электролита повышает производительность литий-металлических батарей, многообещающей технологии для питания электромобилей, ноутбуков и других устройств.
«Большинство электромобилей работают на литий-ионных батареях, которые быстро приближаются к своему теоретическому пределу плотности энергии», — сказал соавтор исследования И Цуй, профессор материаловедения и инженерии, а также фотонной науки в Национальной ускорительной лаборатории SLAC. «Наше исследование было сосредоточено на литий-металлических батареях, которые легче литий-ионных батарей и потенциально могут обеспечивать больше энергии на единицу веса и объема».
Литий-ионный против металлического лития
Литий-ионные аккумуляторы, используемые во всем, от смартфонов до электромобилей, имеют два электрода — положительно заряженный катод, содержащий литий, и отрицательно заряженный анод, обычно сделанный из графита. Раствор электролита позволяет ионам лития перемещаться туда и обратно между анодом и катодом, когда батарея используется и когда она перезаряжается.
Кандидаты в доктора наук и ведущие авторы Хансен Ван (слева) и Чжао Ю (справа) тестируют экспериментальную клетку в своей лаборатории. (Изображение предоставлено Hongxia Wang.)
(Изображение предоставлено Hongxia Wang.)
Литий-металлическая батарея может удерживать в два раза больше электроэнергии на килограмм, чем современная обычная литий-ионная батарея. Литий-металлические батареи делают это, заменяя графитовый анод металлическим литием, который может хранить значительно больше энергии.
«Литий-металлические аккумуляторы очень перспективны для электромобилей, где вес и объем имеют большое значение», — сказал соавтор исследования Женан Бао, представитель K.K. Ли, профессор Инженерной школы. «Но во время работы литий-металлический анод реагирует с жидким электролитом. Это вызывает рост литиевых микроструктур, называемых дендритами, на поверхности анода, что может привести к возгоранию и выходу батареи из строя».
Исследователи десятилетиями пытались решить проблему дендритов.
«Электролит был ахиллесовой пятой литий-металлических аккумуляторов», — сказал соавтор Чжао Юй, аспирант по химии. «В нашем исследовании мы используем органическую химию для рационального проектирования и создания новых стабильных электролитов для этих батарей».
Новый электролит
Для исследования Ю и его коллеги изучили, могут ли они решить проблемы со стабильностью с помощью обычного имеющегося в продаже жидкого электролита.
«Мы предположили, что добавление атомов фтора в молекулу электролита сделает жидкость более стабильной, — сказал Юй. «Фтор — широко используемый элемент в электролитах для литиевых аккумуляторов. Мы использовали его способность притягивать электроны для создания новой молекулы, которая позволяет металлическому литиевому аноду хорошо функционировать в электролите».
Результатом стало новое синтетическое соединение, сокращенно FDMB, которое можно легко производить в больших количествах.
«Конструкции электролитов становятся очень экзотичными, — сказал Бао. «Некоторые из них подали хорошие надежды, но их производство очень дорого. Молекулу FDMB, которую придумал Чжао, легко производить в больших количествах, и она довольно дешевая».
«Невероятная производительность»
Команда из Стэнфорда протестировала новый электролит в литий-металлическом аккумуляторе.
Результаты были потрясающими. Экспериментальная батарея сохранила 90 процентов своего первоначального заряда после 420 циклов зарядки и разрядки. В лабораториях типичные литий-металлические батареи перестают работать примерно через 30 циклов.
Исследователи также измерили, насколько эффективно ионы лития переносятся между анодом и катодом во время зарядки и разрядки, свойство, известное как «кулоновская эффективность».
«Если вы зарядите 1000 ионов лития, сколько вы получите обратно после разрядки?» — сказал Цуй. «В идеале вам нужно 1000 из 1000 для кулоновской эффективности 100 процентов. Чтобы быть коммерчески жизнеспособным, элемент батареи должен иметь кулоновский КПД не менее 99,9%. В нашем исследовании мы получили 99,52% в полуячейках и 99,98% в полных ячейках; невероятное выступление».
Аккумулятор без анода
Для потенциального использования в бытовой электронике команда из Стэнфорда также протестировала электролит FDMB в безанодных литий-металлических мешочных элементах — имеющихся в продаже батареях с катодами, которые подают литий к аноду.
«Идея состоит в том, чтобы использовать литий только на стороне катода для снижения веса», — сказал соавтор Хансен Ван, аспирант в области материаловедения и инженерии. «Безанодная батарея проработала 100 циклов, прежде чем ее емкость упала до 80 процентов — не так хорошо, как эквивалентная литий-ионная батарея, которая может работать от 500 до 1000 циклов, но все же одна из самых эффективных безанодных элементов».
«Эти результаты обнадеживают для широкого спектра устройств», — добавил Бао. «Легкие безанодные аккумуляторы станут привлекательной чертой для дронов и многих других потребительских электронных устройств».
Battery500
Министерство энергетики США (DOE) финансирует большой исследовательский консорциум под названием Battery500, чтобы сделать литий-металлические батареи жизнеспособными, что позволит производителям автомобилей создавать более легкие электромобили, которые могут преодолевать гораздо большие расстояния между зарядками. Это исследование было частично поддержано грантом консорциума, в который входят Стэнфорд и SLAC.
Улучшая аноды, электролиты и другие компоненты, Battery500 стремится почти втрое увеличить количество электроэнергии, которую может обеспечить литий-металлическая батарея, со 180 ватт-часов на килограмм, когда программа была запущена в 2016 году, до 500 ватт-часов на килограмм. Более высокое отношение энергии к весу, или «удельная энергия», является ключом к решению проблем с запасом хода, которые часто возникают у потенциальных покупателей электромобилей.
Перейдите на веб-сайт для просмотра видео.
Zhiao Yu
Испытание на воспламеняемость обычного карбонатного электролита (слева) и нового электролита FDMB (справа), разработанного в Стэнфорде. Обычный карбонатный электролит воспламеняется сразу после контакта с пламенем, но электролит FDMB может выдерживать прямое пламя в течение не менее трех секунд.
«Безанодная батарея в нашей лаборатории достигла удельной энергии около 325 ватт-часов на килограмм, приличное число», — сказал Цуй. «Нашим следующим шагом может быть совместная работа с другими исследователями из Battery500 для создания элементов, которые приближаются к цели консорциума в 500 ватт-часов на килограмм».
В дополнение к более длительному сроку службы и лучшей стабильности, электролит FDMB также гораздо менее воспламеняем, чем обычные электролиты, как продемонстрировали исследователи в этом встроенном видео.
«Наше исследование, по сути, представляет собой принцип проектирования, который люди могут применять для создания лучших электролитов», — добавил Бао. «Мы только что показали один пример, но есть много других возможностей».
Среди других соавторов Стэнфорда – Цзянь Цинь, доцент кафедры химического машиностроения; ученые с докторской степенью Сянь Конг, Кеченг Ван, Вэньсяо Хуан, Снехашис Чоудхури и Чибуезе Аманчукву; аспиранты Уильям Хуан, Ючи Цао, Дэвид Макканик, Ю Чжэн и Саманта Хунг; и студенты Ютинг Ма и Эдер Ломели.


 Да и не по Феншую это.
Да и не по Феншую это.
