Содержание
Регулировка колес трактора: описание и инструкции
Главная » Трактора
Трактора
Опубликовано
Устойчивость движения трактора зависит от правильной регулировки передних колес машины, положение которых в плоскостях относительно оси связано с углом наклона поворотных шкворней. Важным считается показатель схождения переднего края управляемой пары, для которого необходимо, чтобы совпали вертикальная и горизонтальная плоскости, а также наклон шкворней в продольной и поперечной оси. Кроме обеспечения общей устойчивости, проведение действий по настройке обеспечивает равномерный износ шин.
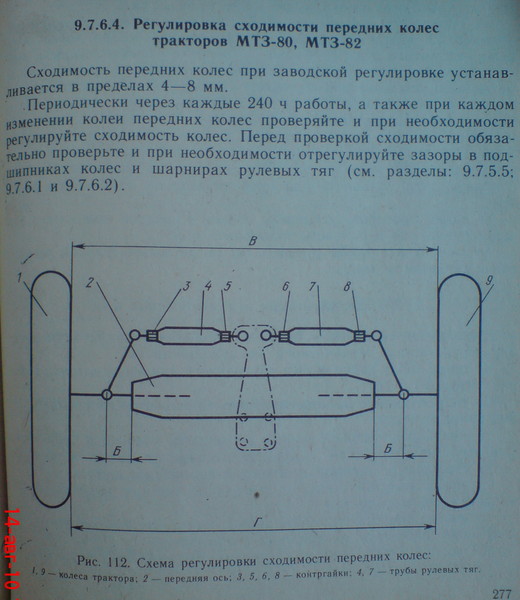
Регулировать схождение управляемых колес трактора МТЗ 82 необходимо через каждые 240 рабочих часов. Если же во время осмотра машины выявляют износ шин, к проверке настроек приступают немедленно, так как неравномерность стирания протектора может косвенно свидетельствовать о дисбалансе осей.
Содержание
- Обслуживание тракторов
- Работа с развалом-схождением
- Регулировка колес трактора ЮМЗ
Обслуживание тракторов
Сельхозтехника требует своевременного осмотра и эксплуатации исключительно исправных машин, ведь разница в установочных положениях даже в 15 мм недопустима. Полная процедура включает подготовительный и основной этапы. Чтобы отрегулировать схождение передних колес трактора, у машины проверяют:
Полная процедура включает подготовительный и основной этапы. Чтобы отрегулировать схождение передних колес трактора, у машины проверяют:
- силу фиксации затяжек гаек, труб, соединений рулевых тяг;
- прочность затяжки гаек сошки вала гидроусилителя;
- прочность крепления элементов поворотных рычагов;
- размер зазора подшипников ступиц;
- давление в шинах;
- зазор между поворотными кулаками и трубой передней оси для МТЗ 80;
- расстояние между редукторами и корпусом переднего моста для МТЗ 82.
Работа с развалом-схождением
Чтобы снять замеры, трактор устанавливают на ровную площадку. Положение машины при этом должно совпасть с прямолинейным движением. Телескопической штангой с мерной линейкой на уровне центра ободов колес между их задними внутренними закраинами делают замеры. Инструмент держат в горизонтальном положении. После диагностики в нужных точках делают отметки.
Трактор перекатывают по этой же площадке на 1,5 метра, чтобы предыдущие замеры стали впереди оси вращения и совпали с ее центром. Еще раз штангой меряют расстояние, как и до поворота колес. Без перекатывания настройки не проводят, так как можно получить некорректные данные.
Еще раз штангой меряют расстояние, как и до поворота колес. Без перекатывания настройки не проводят, так как можно получить некорректные данные.
В результате заднее расстояние, или развал, должно быть больше переднего, или схождения, на 4-8 мм. Если сходимость больше, то укорачивают рулевые тяги, если меньше нормы, то удлиняют их с обеих сторон. Для этого проворачивают трубчатую центральную часть тяги при ослабленных контргайках.
Если рулевое управление трактора с ГРУ, то настройки требуют левая и правая поперечные тяги. При комплектации ГОРУ – только общая поперечная тяга. Чтобы было более удобно работать, края деталей делают с разным направлением витков резьбы: один — с левым, другой – с правым.
Регулировка колес трактора ЮМЗ
При выставлении направляющих неведущего моста для изменения колеи допустимый интервал – 100 мм. Регулировка предполагает:
- одно колесо поднимают над землей и ослабляют гайки болтов 1, которые фиксируют резной конец трубы, а также выбивают фиксатор 2;
- начинают двигать кулак 3, добиваясь этим изменения расстояния от колеса до продольной оси машины до половины необходимой колеи;
- отверстия в трубке совмещают под фиксатор, после чего закручивают болты;
- вымеряют длину поперечной тяги при поднятом левом колесе или толкающей тяги при правом.
 Для этого ослабляют контргайки 5, проворачивают трубу 6 при фиксированных наконечниках 4 и выставляют необходимый параметр;
Для этого ослабляют контргайки 5, проворачивают трубу 6 при фиксированных наконечниках 4 и выставляют необходимый параметр; - затягивают контргайки и опускают трактор.
Сходимость направляющих колес ЮМЗ выставляется в пределах 10±6 мм. Регулировка предполагает:
- установку направляющих колес в положение движения по прямой;
- определение числа оборотов руля между крайними точками, а затем при возврате его на половину этого расстояния;
- посредством вращения поперечной и толкающей тяги установка направляющей параллельно оси трактора;
- простановка меток с внутренней стороны боковой поверхности передней части ведущего колеса на уровне оси вращения;
- снятие замеров между полученными точками, а затем после вращения рулевых тяг сведение колеса на 2,5 мм внутрь;
- перекатывание трактора, чтобы метки переместились на 180 градусов;
- снятие новых замеров и сравнение их с первично полученными данными. Разница между результатами должна быть 10 мм.

Изменение колеи задних колес проводят по схеме:
- демонтажные болты переводят во вкладыши;
- болты крепления выставляют на 3-4 оборота;
- отвинчивают крепления и сдвигают ступицу до головок болтов;
- ступицу сдвигают вместе со вкладышами до тех пор, пока расстояние колеса от продольной оси не будет равняться 50% от нужной колеи;
- демонтажные болты переводят из вкладышей и закрепляют ступицу.
Даже миллиметровые погрешности в схождении ведущих колес приводят к износу шин на 5-10%. Необходимость настройки сельскохозяйственных машин обусловлена также сохранением геометрии обработки грунта и снижением расхода топлива.
Как отрегулировать развал МТЗ 82 схождение передних колес своими руками
Содержание
Обслуживание и уход за передней осью заключаются в следующем:
- в регулярной проверке надежности и подтяжке резьбовых соединений;
- в периодической смазке шкворневого соединения и шарниров рулевых тяг;
- в проверке люфтов в шкворневом соединении и шарнирах рулевых тяг;
- в регулировке зазоров в шарнирах продольной рулевой тяги и регулировке угла схождения и поворота колес.

Особенно тщательно необходимо осматривать и своевременно подтягивать гайки крепления рычагов тяг и клинового штифта, являющегося стопором шкворня.
При ослаблении крепления клинового штифта появляется люфт и последующая быстрая выработка отверстия под шкворень в балке передней оси, а при износе этого отверстия потребуется либо замена дорогостоящей балки, либо сложный ремонт балки с расточкой отверстия, изготовлением втулки с запрессовкой и последующей точной обработкой отверстия под шкворень.
Люфт шкворня во втулках проверяют покачиванием колеса руками в вертикальной плоскости. Колесо при этом не должно касаться земли. При обнаружении значительного люфта во втулках шкворня разобрать шкворневое соединение и повернуть шкворень вокруг оси на угол 90° до второй лыски под стопорный штифт.
Развал — Схождение. Дедовским способом своими руками. Сход Развал без СТО
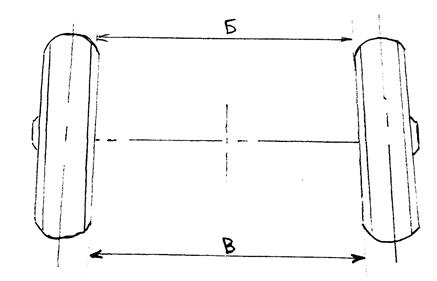
Рис . 84. Углы установки передних колёс автомобиля ГАЗ-53А
84. Углы установки передних колёс автомобиля ГАЗ-53А
В процессе эксплуатации схождение колес рекомендуется проверять следующим образом.
Поставить автомобиль на горизонтальную ровную поверхность и проверить давление в шинах. Передние колеса поставить в положение, соответствующее движению по прямой. Затем, чтобы выбрать зазоры в соединениях деталей передней оси, автомобиль продвинуть несколько вперед и остановить. После этого замерить угол схождения колёс. Проверять желательно при двух положениях колёс, для чего продвинуть автомобиль на 1 м и повторить замер.
Угол схождения колёс определяют разностью размеров (А — Б) (см. рис. 84) между внутренними краями шин или между ободами колёс, которая должна быть в пределах 1,5 — 3 мм. Измерения производят в горизонтальной плоскости на уровне оси передних колес.
Схождение колес регулируют следующим образом.
- Расшплинтовывают гайки стяжных наконечников поперечной рулевой тяги.
- Отвертывают гайки болтов наконечников.

- Вращением поперечной тяги вокруг своей оси устанавливают нормальную величину (1,5 — 3 мм) схождения колёс.
Величину угла развала колёс проверяют приборами. Если нужных приборов нет, то, пользуясь угольником, замеряют расстояние В (см. рис. 84) от верхней и Г от нижней точек обода колеса до вертикальной плоскости. Разность этих размеров при правильном угле развала должна быть в пределах 6 — 10 мм. При всех замерах и регулировках автомобиль должен стоять на горизонтальной площадке, а давление в шинах колёс соответствовать норме.
#МТЗ1221#РАЗВАЛ СХОЖДЕНИЯ# СЬЕЛО ВСЮ РЕЗИНУ НА АСФАЛЬТЕ #ЧТО ДЕЛАТЬ КУДА КРУТИТЬ РУЛЕВУЮ ТЯГУ #
Люфты в шарнирах рулевых тяг проверяют покачиванием обоих колес одновременно внутрь или наружу. При обнаружении большого люфта в шарнирах продольной тяги устраняют его.
Шаровые пальцы шарниров продольной рулевой тяги должны зажиматься пружинами между сухарями тяги с суммарным осевым зазором от 0,125 до 0,375 мм. Чтобы обеспечить такой зазор в шарнире, необходимо распшлинтовать пробку продольной рулевой тяги, затянуть пробку до отказа, а затем отвернуть её от 1⁄12 до 1⁄4; оборота в в этом положении запшлинтовать. При этом шарнир должен обеспечивать возможность покачивания без заеданий противоположного конца тяги во все стороны от среднего положения на 95 мм.
Пригодность шарнира поперечной рулевой тяги к дальнейшей эксплуатации проверяют покачиванием шарового пальца в шарнире. Для этого снять шарнир с автомобиля и, покачивая шаровой палец рукой, ощутить усилие действия пружины на палец. Малоощутимое усилие на пальце или его отсутствие, а также заедание пальца свидетельствуют о непригодности шарнира к дальнейшей эксплуатации.
При смазке шкворневого соединения и шарниров рулевых тяг через пресс-масленки смазка должна выходить в зазоры соединений.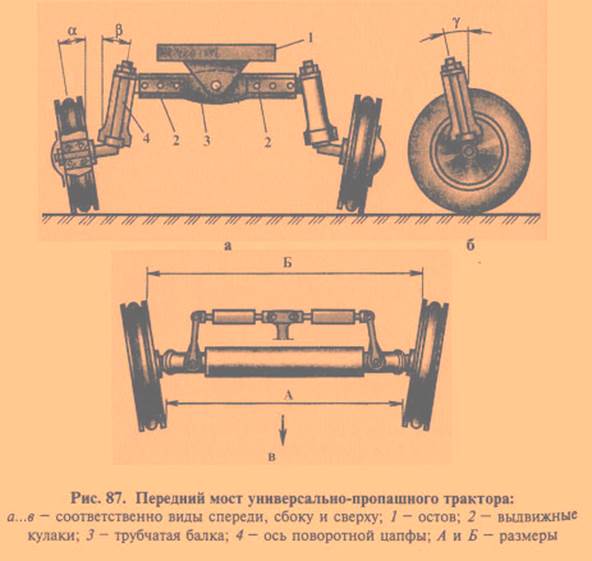
Если при полном повороте колес не обеспечивается нормальный радиус поворота автомобиля или шины задевают за что-либо, то проверяют максимальный угол поворота колёс передней оси, который должен быть равен 34° для внутреннего колеса.
Наибольший угол поворота колёс регулируют путем изменения длины болтов, ввертываемых в резьбовые отверстия рычагов поперечной рулевой тяги.
Проверить, не погнуты ли поперечные рулевые тяги или поворотные рычаги, а также нет ли люфтов в шарнирах поперечной тяги. Выправить погнутую тягу или заменить изношенные детали, после чего отрегулировать схождение передних колёс.
Источник: vajnovsem.ru
СХОД РАЗВАЛ САНГ ЕНГ АКТИОН СПОРТ
При эксплуатации автомобиля SsangYong Actyon Sports важно следить за состоянием подвески и особенно за сходом-развалом колес. В случае неправильной настройки геометрии колес автомобиль может быстро изнашивать шины и потерять управляемость.
Для правильной настройки схода-развала необходимо использовать специальное оборудование. Это позволит добиться правильной геометрии колес и увеличить срок службы шин и подвески.
Это позволит добиться правильной геометрии колес и увеличить срок службы шин и подвески.
Более того, рекомендуется выполнять профилактические работы по проверке схода-развала не реже, чем раз в 10 000 километров.
Определить, что автомобиль нуждается в настройке схода-развала можно по таким признакам, как неоднородный износ шин или неправильная реакция рулевого управления.
Важно понимать, что правильный сход-развал это не что иное, как залог комфортной и безопасной езды на вашем SsangYong Actyon Sports.
Стук в рулевой. Причины и возможный развод в сервисе
НЕ ВЫХОДИТ РАЗВАЛ-СХОЖДЕНИЕ КОЛЕС НА КАЙРОНЕ ИЛИ АКТИОНЕ?
Как отрегулировать развал если это не предусмотрено конструкцией автомобиля ,на примере фиат добло.
Как сделать развал схождение колес своими руками
отрегулировали сход — развал
Кривые руки мастера сход/развала
СХОД — развал самостоятельно в домашних условиях.
Регулируемые тяги Санг енг нью Актион, установка
Замена Рулевых Наконечников без Развала Схождения,без сход развала Своими руками
Сход-развал сход-развалу рознь
Источник: ssangyong-rs. ru
ru
Сервисное обслуживание
Ваша заявка принята! В ближайшее время с Вами свяжется сотрудник и согласует детали записи. Спасибо за обращение!
Ошибка при отправке заявки.
С-концевая область фетуина-В плазмы человека не требуется для механизма ингибирования астацин-металлопептидаз с помощью поднятого хобота слона
1. Blobel CP. Замечательная роль протеолиза на поверхности клетки и за ее пределами. Курс. мнение Клеточная биол. 2000; 12: 606–612. doi: 10.1016/S0955-0674(00)00139-3. [PubMed] [CrossRef] [Google Scholar]
2. Klein T, Eckhard U, Dufour A, Solis N, Total CM. Механизмы протеолитического расщепления, функция и «омические» подходы для почти повсеместной посттрансляционной модификации. хим. 2018; 118:1137–1168. doi: 10.1021/acs.chemrev.7b00120. [PubMed] [CrossRef] [Академия Google]
3. Аролас Дж.Л., Гулас Т., Куппари А., Гомис-Рют Ф.Х. Множественные архитектуры и механизмы латентности зимогенов металлопептидаз. хим. 2018; 118:5581–5597. doi: 10.1021/acs.chemrev.8b00030. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1021/acs.chemrev.8b00030. [PubMed] [CrossRef] [Google Scholar]
4. Yan C, Boyd DD. Регуляция экспрессии гена матриксной металлопротеиназы. J. Cell Physiol. 2007; 211:19–26. doi: 10.1002/jcp.20948. [PubMed] [CrossRef] [Google Scholar]
5. Hadler-Olsen E, Fadnes B, Sylte I, Uhlin-Hansen L, Winberg J-O. Регуляция активности матриксных металлопротеиназ в норме и при патологии. FEBS J. 2011; 278: 28–45. doi: 10.1111/j.1742-4658.2010.07920.х. [PubMed] [CrossRef] [Google Scholar]
6. Хан А.Р., Джеймс М.Н. Молекулярные механизмы превращения зимогенов в активные протеолитические ферменты. прот. науч. 1998; 7: 815–836. doi: 10.1002/pro.5560070401. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Rawlings ND, et al. База данных протеолитических ферментов, их субстратов и ингибиторов MEROPS в 2017 г. и сравнение с пептидазами в базе данных PANTHER. Нуклеиновые Кислоты Res. 2018;46:D624–D632. doi: 10.1093/nar/gkx1134. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Серда-Коста Н., Гомис-Рют FX. Архитектура и функция каталитических доменов металлопептидазы. прот. науч. 2014; 23:123–144. doi: 10.1002/pro.2400. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Серда-Коста Н., Гомис-Рют FX. Архитектура и функция каталитических доменов металлопептидазы. прот. науч. 2014; 23:123–144. doi: 10.1002/pro.2400. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Bode W, Gomis-Rüth FX, Huber R, Zwilling R, Stöcker W. Структура астацина и последствия для активации астацинов и лигирования цинка коллагеназы. Природа. 1992; 358: 164–167. doi: 10.1038/358164a0. [PubMed] [CrossRef] [Google Scholar]
10. Gomis-Rüth FX, Stöcker W, Huber R, Zwilling R, Bode W. Уточненная 1,8 Å рентгеновская кристаллическая структура астацина, цинк-эндопептидазы раков Astacus astacus L. Определение структуры, уточнение, молекулярная структура и сравнение с термолизином. Дж. Мол. биол. 1993; 229:945–968. doi: 10.1006/jmbi.1993.1098. [PubMed] [CrossRef] [Google Scholar]
11. Gomis-Rüth FX, Trillo-Muyo S, Stöcker W. Функциональное и структурное понимание астациновых металлопептидаз. биол. хим. 2012; 393:1027–1041. doi: 10.1515/hsz-2012-0149. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
12. Brix Klaudia, Stöcker Walter., редакторы. Протеазы: структура и функция. Вена: Springer Вена; 2013. [Google Академия]
13. Бонд Дж.С. Протеазы: история, открытие и роль в здоровье и болезнях. Дж. Биол. хим. 2019; 294:1643–1651. doi: 10.1074/jbc.TM118.004156. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
14. Bode W, Gomis-Rüth FX, Stöcker W. очередь) и топологии и должны быть сгруппированы в общее семейство «metzincins» FEBS Lett. 1993; 331: 134–140. дои: 10.1016/0014-5793(93)80312-и. [PubMed] [CrossRef] [Google Scholar]
15. Stöcker W, et al. Метцинцины. Топологические и последовательные отношения между астацинами, адамализинами, серрализинами и матриксинами (коллагеназами) определяют надсемейство цинк-пептидаз. прот. науч. 1995; 4: 823–840. doi: 10.1002/pro.5560040502. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Gomis-Rüth FX. Структурные аспекты клана металлоэндопептидаз метцинцина . Мол. Биотех. 2003; 24: 157–202. дои: 10.1385/МБ:24:2:157. [PubMed] [CrossRef] [Академия Google]
Мол. Биотех. 2003; 24: 157–202. дои: 10.1385/МБ:24:2:157. [PubMed] [CrossRef] [Академия Google]
17. Гомис-Рют FX. Архитектура каталитического домена металлопротеаз метцинцина. Дж. Биол. хим. 2009; 284:15353–15357. doi: 10.1074/jbc.R800069200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Pérez-Silva JG, Español Y, Velasco G, Quesada V. База данных Degradome: расширение роли протеаз млекопитающих в жизни и болезнях. Нуклеиновые Кислоты Res. 2016;44:D351–D355. doi: 10.1093/nar/gkv1201. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Кесслер Э., Такахара К., Биниаминов Л., Брюсель М., Гринспен Д.С. Костный морфогенетический белок-1: проколлаген С-протеиназа I типа. Наука. 1996;271:360–362. doi: 10.1126/science.271.5247.360. [PubMed] [CrossRef] [Google Scholar]
20. Shimell MJ, Ferguson EL, Childs SR, O’Connor MB. Ген tolloid дрозофилы , формирующий дорсально-вентральный паттерн, связан с морфогенетическим белком 1 кости человека.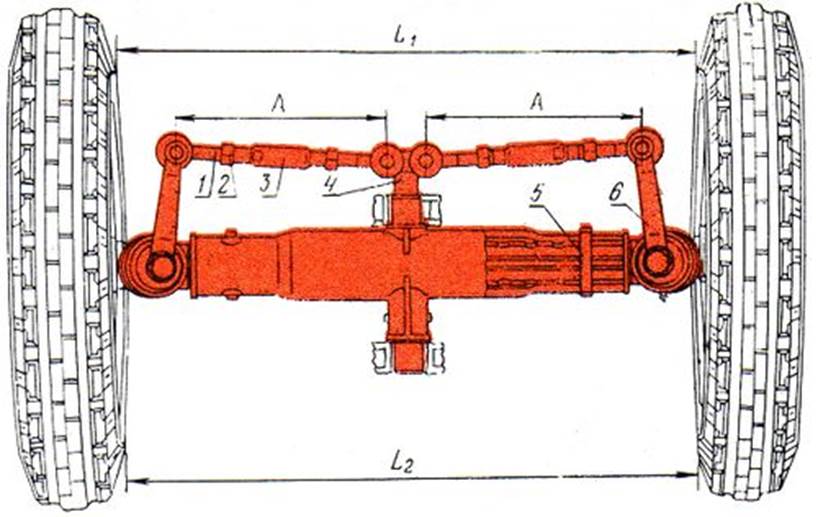 Клетка. 1991; 67: 469–481. doi: 10.1016/0092-8674(91)90522-Z. [PubMed] [CrossRef] [Google Scholar]
Клетка. 1991; 67: 469–481. doi: 10.1016/0092-8674(91)90522-Z. [PubMed] [CrossRef] [Google Scholar]
21. Sterchi EE, Stöcker W, Bond JS. Меприны, мембраносвязанные и секретируемые астациновые металлопротеиназы. Мол. Аспекты Мед. 2008;29: 309–328. doi: 10.1016/j.mam.2008.08.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Becker-Pauly C, et al. Протеомный анализ выявляет кислотную первичную специфичность семейства астациновых металлопротеаз, отражаемую физиологическими субстратами. Мол. Клетка. Протеомика. 2011;10:М111.009233. doi: 10.1074/mcp.M111.009233. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Ambort D, et al. Специфическая обработка тенасцина-С металлопротеазой меприном b нейтрализует его ингибирование распластывания клеток. Матрица биол. 2010;29: 31–42. doi: 10.1016/j.matbio.2009.08.007. [PubMed] [CrossRef] [Google Scholar]
24. Vazeille E, et al. Роль мепринов в защите слизистой оболочки подвздошной кишки у пациентов с болезнью Крона от колонизации адгезивно-инвазивными E . кишечная палочка . ПлоС один. 2011;6:e21199. doi: 10.1371/journal.pone.0021199. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
кишечная палочка . ПлоС один. 2011;6:e21199. doi: 10.1371/journal.pone.0021199. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Burkart AD, Xiong B, Baibakov B, Jiménez-Movilla M, Dean J. Овастацин, протеаза кортикальных гранул, расщепляет ZP2 в блестящей зоне до предотвратить полиспермию. Дж. Клеточная биология. 2012;197:37–44. doi: 10.1083/jcb.201112094. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Körschgen H, et al. Внутриклеточная активация овастацина опосредует отвердение блестящей оболочки перед оплодотворением. Мол. Гум. Воспр. 2017; 23:607–616. doi: 10.1093/molhr/gax040. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Floehr J, Dietzel E, Schmitz C, Chappell A, Jahnen-Dechent W. Понижающая регуляция белков плазмы, полученных из печени, опосредует фетуин-B. обратимое женское бесплодие. Мол. Гум. Воспр. 2017;23:34–44. дои: 10.1093/моль час/gaw068. [PubMed] [CrossRef] [Google Scholar]
28. Stöcker W, Breit S, Sottrup-Jensen L, Zwilling R. α 2 -Макроглобулин из гемолимфы пресноводных раков Astacus astacus . Комп. Биохим. Физиол. Б. 1991; 98: 501–509. doi: 10.1016/0305-0491(91)90244-8. [PubMed] [CrossRef] [Google Scholar]
Stöcker W, Breit S, Sottrup-Jensen L, Zwilling R. α 2 -Макроглобулин из гемолимфы пресноводных раков Astacus astacus . Комп. Биохим. Физиол. Б. 1991; 98: 501–509. doi: 10.1016/0305-0491(91)90244-8. [PubMed] [CrossRef] [Google Scholar]
29. Kruse MN, et al. Гомоолигомеры меприна α и β человека: расщепление белков базальной мембраны и чувствительность к ингибиторам металлопротеаз. Биохим. Дж. 2004; 378: 383–389.. doi: 10.1042/BJ20031163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Zhang Y, Ge G, Greenspan DS. Ингибирование костного морфогенетического белка 1 нативной и измененной формами α 2 -макроглобулина. Дж. Биол. хим. 2006; 281:39096–39104. doi: 10.1074/jbc.M601362200. [PubMed] [CrossRef] [Google Scholar]
31. Lee HX, Ambrosio AL, Reversade B, de Robertis EM. Эмбриональная дорсально-вентральная передача сигналов: секретируемые белки, родственные frizzled, как ингибиторы толлоидных протеиназ. Клетка. 2006; 124: 147–159. . doi: 10.1016/j.cell.2005.12.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
. doi: 10.1016/j.cell.2005.12.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Bijakowski C, et al. Sizzled уникален среди секретируемых родственных frizzled белков своей способностью специфически ингибировать костный морфогенетический белок-1 (BMP-1)/толлоидоподобные протеиназы. Дж. Биол. хим. 2012; 287:33581–33593. doi: 10.1074/jbc.M112.380816. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Dietzel E, et al. Фетуин-В, белок плазмы печени, необходим для оплодотворения. Дев. Клетка. 2013; 25:106–112. doi: 10.1016/j.devcel.2013.03.001. [PubMed] [CrossRef] [Академия Google]
34. Stöcker W, et al. Слияние гамет млекопитающих зависит от ингибирования овастацина фетуином-В. биол. хим. 2014; 395:1195–1199. doi: 10.1515/hsz-2014-0189. [PubMed] [CrossRef] [Google Scholar]
35. Кармилин К. и соавт. Фетуин-В плазмы млекопитающих является селективным ингибитором металлопротеиназ овастацина и меприна. науч. Отчет 2019; 9: 546. doi: 10.1038/s41598-018-37024-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1038/s41598-018-37024-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Cuppari A, et al. Структура фетуина-В плазмы млекопитающих и его механизм селективного ингибирования металлопептидазы. IUCrJ. 2019;6:317–330. doi: 10.1107/S205225251
68. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Tsai PL, Chen CH, Huang CJ, Chou CM, Chang GD. Очистка и клонирование эндогенного белкового ингибитора нефрозина карпа – астациновой металлопротеиназы. Дж. Биол. хим. 2004; 279:11146–11155. doi: 10.1074/jbc.M310423200. [PubMed] [CrossRef] [Google Scholar]
38. Bode W, et al. Рентгеновская кристаллическая структура цистатина куриного яйца размером 2,0 Å и его возможный способ взаимодействия с цистеинпротеиназами. EMBO J. 1988;7:2593–2599. doi: 10.1002/j.1460-2075.1988.tb03109.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Stubbs MT, et al. Уточненная рентгеновская кристаллическая структура 2,4 Å рекомбинантного человеческого стефина B в комплексе с цистеиновой протеиназой папаином: новый тип взаимодействия ингибитора протеиназы. EMBO J. 1990; 9: 1939–1947. doi: 10.1002/j.1460-2075.1990.tb08321.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
EMBO J. 1990; 9: 1939–1947. doi: 10.1002/j.1460-2075.1990.tb08321.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Rawlings ND, Barrett AJ. Эволюция белков суперсемейства цистатина. Дж. Мол. Эвол. 1990;30:60–71. doi: 10.1007/BF02102453. [PubMed] [CrossRef] [Google Scholar]
41. Lee C, Bongcam-Rudloff E, Sollner C, Jahnen-Dechent W, Claesson-Welsh L. Цистатины типа 3; фетуины, кининоген и богатый гистидином гликопротеин. Передний. Бионауч. 2009;14:2911–2922. дои: 10.2741/3422. [PubMed] [CrossRef] [Google Scholar]
42. Floehr J, et al. Связь высоких концентраций фетуина-В в сыворотке с частотой оплодотворения при ЭКО: перекрестное пилотное исследование. Гум. Воспр. 2016; 31: 630–637. дои: 10.1093/хумреп/dev340. [PubMed] [CrossRef] [Google Scholar]
43. Dall E, Fegg JC, Briza P, Brandstetter H. Структура и механизм аспартимид-зависимой пептидной лигазы в легумаине человека. Ангью. хим. Междунар. Эд. англ. 2015;54:2917–2921. doi: 10.1002/anie. 201409135. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
201409135. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Guevara T, et al. Структура профермента и активация астацин-металлопептидазы. Дж. Биол. хим. 2010; 285:13958–13965. doi: 10.1074/jbc.M109.097436. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Аролас Й.Л., Ботельо Т.О., Вилчинскас А., Гомис-Рют Ф.Х. Структурные доказательства ингибирования металлопептидаз по стандартному механизму из комплекса, готового ресинтезировать пептидную связь. Ангью. хим. Междунар. Эд. англ. 2011;50:10357–10360. doi: 10.1002/anie.201103262. [PubMed] [CrossRef] [Google Scholar]
46. Krissinel E, Henrick K. Вывод макромолекулярных ансамблей из кристаллического состояния. Дж. Мол. биол. 2007; 372: 774–797. doi: 10.1016/j.jmb.2007.05.022. [PubMed] [CrossRef] [Академия Google]
47. Laskowski M, Jr., Kato I. Белковые ингибиторы протеиназ. Анну. Преподобный Биохим. 1980; 49: 593–626. doi: 10.1146/annurev.bi.49.070180.003113. [PubMed] [CrossRef] [Google Scholar]
48. Шехтер И., Бергер А. О размере активного сайта протеаз. И. Папаин. Биохим. Биофиз. Рез. коммун. 1967; 27: 157–162. doi: 10.1016/j.bbrc.2012.08.015. [PubMed] [CrossRef] [Google Scholar]
Шехтер И., Бергер А. О размере активного сайта протеаз. И. Папаин. Биохим. Биофиз. Рез. коммун. 1967; 27: 157–162. doi: 10.1016/j.bbrc.2012.08.015. [PubMed] [CrossRef] [Google Scholar]
49. Gomis-Rüth FX, Botelho TO, Bode W. Стандартная ориентация металлопептидаз. Биохим. Биофиз. Акта. 2012; 1824: 157–163. doi: 10.1016/j.bbapap.2011.04.014. [PubMed] [CrossRef] [Академия Google]
50. Denecke B, et al. Распределение в тканях и тестирование активности предполагают сходную, но не идентичную функцию фетуина-В и фетуина-А. Биохим. Дж. 2003; 376: 135–145. doi: 10.1042/BJ20030676. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Becker C, et al. Различия в механизме активации между альфа- и бета-субъединицами меприна человека. биол. хим. 2003; 384: 825–831. doi: 10.1515/BC.2003.092. [PubMed] [CrossRef] [Google Scholar]
52. Фридрих С., Кармилин К., Штёкер В. Работа с металлопротеиназами. Курс. протокол Белковая наука. 2016;83:21.16.21–21.16.20. doi: 10.1002/0471140864.ps2116s83. [Перекрестная ссылка] [Академия Google]
doi: 10.1002/0471140864.ps2116s83. [Перекрестная ссылка] [Академия Google]
53. Becker-Pauly C, et al. Субъединицы α и β металлопротеазы меприна экспрессируются в отдельных слоях эпидермиса человека, обнаруживая различные функции в пролиферации и дифференцировке кератиноцитов. Дж. Инвест. Дерматол. 2007; 127:1115–1125. doi: 10.1038/sj.jid.5700675. [PubMed] [CrossRef] [Google Scholar]
54. Juanhuix J, et al. Разработки в области оптики и производительности на BL13-XALOC, линии пучка макромолекулярной кристаллографии на синхротроне ALBA. Дж. Синхротронное излучение. 2014;21:679–689. doi: 10.1107/S160057751400825X. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Kabsch W. XDS. Акта Кристаллогр. секта Д. 2010; 66: 125–132. doi: 10.1107/S0907444909047337. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Кабш В. Интеграция, масштабирование, присвоение пространственных групп и пост-уточнение. Acta Crystallogr . раздел . Д. 2010; 66: 133–144. doi: 10.1107/S0907444909047374. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Д. 2010; 66: 133–144. doi: 10.1107/S0907444909047374. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Winn MD, et al. Обзор пакета CCP4 и текущих разработок. Акта Кристаллогр. секта Д. 2011; 67: 235–242. doi: 10.1107/S0907444910045749. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. McCoy AJ, et al. Кристаллографическая программа Phaser. Дж. Заявл. Кристаллогр. 2007; 40: 658–674. doi: 10.1107/S0021889807021206. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Terwilliger TC, et al. Итеративное построение модели, уточнение структуры и изменение плотности с помощью мастера PHENIX AutoBuild. Акта Кристаллогр. секта Д. 2008; 64: 61–69.. doi: 10.1107/S090744490705024X. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Emsley P, Lohkamp B, Scott WG, Cowtan K. Возможности и разработка Coot. Акта Кристаллогр. секта Д. 2010; 66: 486–501. doi: 10.1107/S0907444910007493. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Afonine PV, et al. На пути к автоматизированному уточнению кристаллографической структуры с помощью phenix.refine. Акта Кристаллогр. секта Д. 2012; 68: 352–367. doi: 10.1107/S0907444912001308. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Afonine PV, et al. На пути к автоматизированному уточнению кристаллографической структуры с помощью phenix.refine. Акта Кристаллогр. секта Д. 2012; 68: 352–367. doi: 10.1107/S0907444912001308. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Смарт ОС и др. Использование схожести структур при уточнении: автоматизированная NCS и ограничения целевой структуры в BUSTER. Акта Кристаллогр. секта Д. 2012; 68: 368–380. doi: 10.1107/S0907444911056058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Берман Х., Хенрик К., Накамура Х. Объявление о всемирном банке данных о белках. Нац. Структура биол. 2003; 10: 980–980. doi: 10.1038/nsb1203-980. [PubMed] [CrossRef] [Google Scholar]
64. Моррисон Дж. Ф. Кинетика обратимого ингибирования ферментативных реакций прочносвязывающими ингибиторами. Биохим. Биофиз. Акта. 1969;185:269–286. doi: 10.1016/0005-2744(69)90420-3. [PubMed] [CrossRef] [Google Scholar]
65. Pettersen EF, et al. UCSF Chimera — система визуализации для поисковых исследований и анализа.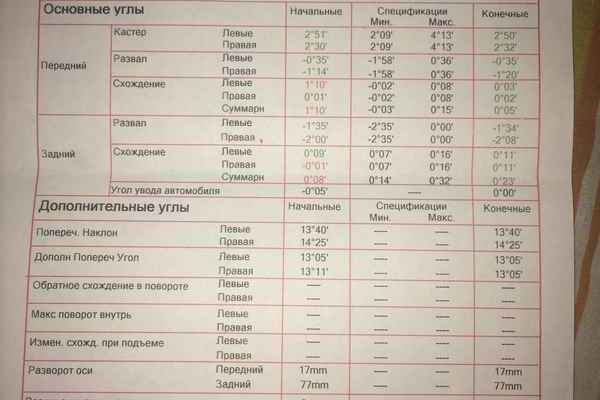


 Для этого ослабляют контргайки 5, проворачивают трубу 6 при фиксированных наконечниках 4 и выставляют необходимый параметр;
Для этого ослабляют контргайки 5, проворачивают трубу 6 при фиксированных наконечниках 4 и выставляют необходимый параметр;