Содержание
Воздействие коррозии металла на детали трубопровода
18 мая 2021, 15:30
Коррозия металлов
Коррозия металлов — это самопроизвольное нежелательное разрушение сплавов вследствие их химического или электрохимического взаимодействия с окружающей средой. Негативные последствия может выражаться различными дефектами, например: трещины, утолщение стенок, изменение химического состава сплава, возникновение каверн (полостей), точечное образование ям и язв (питтинговая коррозия) и др. Коррозия может привести к возникновению аварийных ситуаций, например, способствовать разгерметизации трубопровода. Какие существуют виды коррозии? Как защитить трубопровод от разрушения?
Классификация коррозионных процессов:
Снижается работоспособность конструкции. Существует широкое разнообразие коррозионных процессов. Важно отметить, что каждая из разновидностей имеет свои особенности протекания процесса. Происходящее окисление металла напрямую воздействуют на используемую конструкцию. Скорость коррозии зависит от концентрации реагентов и может возникать по химическому и электрохимическому механизму. Наиболее распространенный механизм коррозии — электрохимический. Коррозионной средой может служить как жидкость, так и газ.
Происходящее окисление металла напрямую воздействуют на используемую конструкцию. Скорость коррозии зависит от концентрации реагентов и может возникать по химическому и электрохимическому механизму. Наиболее распространенный механизм коррозии — электрохимический. Коррозионной средой может служить как жидкость, так и газ.
Какая коррозия может возникнуть в газовых средах:
-
образование окисной пленке на металле в сухом воздухе -
коррозия металла в газовых средах при высоких температурах (выше 200 °С), включая среды, содержащие водяной газ -
образование окалины на трубчатых электронагревателях (ТЭНы)
Какая коррозия встречается в жидких средах:
-
коррозия металлов в неэлектролитах -
коррозия внутренней поверхности нефтепроводов при контакте с нефтепродуктами -
коррозия стали под действием жидкого брома -
коррозия элементов теплообменников при контакте с жидкометаллическими теплоносителями
Иногда, атмосферную коррозию выделяют в отдельный вид. Атмосферная коррозия металлоконструкций и трубопроводов возникает во влажном климате и влажных грунтах. Например, такая ситуация может возникнуть при подземной, полуподземной или наземной (в насыпи) схемах прокладки трубопровода. Болотистые, вечномерзлые и скальные грунты, районы горных выработок, оползней и прочих неустойчивых грунтах. Однако, при установке трубопроводов на опорах (надземный способ) вырастает значительная подверженность трубопровода суточным и сезонным колебаниям температуры.
Атмосферная коррозия металлоконструкций и трубопроводов возникает во влажном климате и влажных грунтах. Например, такая ситуация может возникнуть при подземной, полуподземной или наземной (в насыпи) схемах прокладки трубопровода. Болотистые, вечномерзлые и скальные грунты, районы горных выработок, оползней и прочих неустойчивых грунтах. Однако, при установке трубопроводов на опорах (надземный способ) вырастает значительная подверженность трубопровода суточным и сезонным колебаниям температуры.
Виды атмосферной коррозии:
-
подземная или почвенная коррозия на влажных грунтах. Дополнительная агрессивность почвы зависит от ее пористости и кислотности. -
при взаимодействии с природными водными средами. Они содержат растворенные соли, продукты жизнедеятельности живых организмов, растворенные газы и т.д. -
коррозия по ватерлинии — линия соприкосновения поверхности с водой. В такой ситуации на конструкцию действует водная коррозия и высокая концентрация атмосферного кислорода
В такой ситуации на конструкцию действует водная коррозия и высокая концентрация атмосферного кислорода
Дополнительными факторами, влияющими на возникновение коррозии может быть механическое воздействие, не рациональное конструирование, наличие внешней поляризации — такой вид разрушения принято называть контактной коррозией. Вид коррозионного поражения, главным образом, зависит от свойств сплава и особенностей коррозионной среды.
Меры защиты металла от коррозии
Коррозия наблюдается во всех областях народного хозяйства и имеет множество разновидностей. Коррозия — сложное явление, которое протекает за счет множества сопряженных процессов и возникает из-за особенностей сплава и условий его эксплуатации. Компания «ОНИКС» предлагает произвести оцинкование деталей трубопровода, чтобы защитить конструкцию от вредоносного воздействия.
Помимо выбора коррозионностойких сплавов, вы можете нанести защитное покрытие. В «ОНИКС» вы можете заказать два вида защитных покрытий: гальваническим или термодиффузионным методом воздействия на металл.
В «ОНИКС» вы можете заказать два вида защитных покрытий: гальваническим или термодиффузионным методом воздействия на металл.
Таблица — Методы оцинкования для деталей трубопровода
|
Гальванический метод |
Термодиффузионный метод | |
|---|---|---|
|
Преимущества |
Внешний вид (блестящая, гладкая поверхность) |
Высокие защитные свойства |
|
Толщина покрытия от 4 мкм до 20 мкм |
Проникновение в структуру металла, что влияет на долговечность использования | |
|
Равномерное покрытие |
Ровное и однородное покрытие | |
|
Возможность приваривать без зачистки поверхности | ||
|
Большой срок годности | ||
|
Недостатки |
Хрупкость покрытия |
Грязно-серый цвет поверхности |
|
Срок годности 1,5-2 года |
Габариты изделий, которые могут быть подвергнуты термодиффузионному цинкованию ограничены | |
|
При сварке необходимо зачищать от цинка свариваемую поверхность |
Продукция для заказа:
- Гальваническим методом: фланцы типа 01 и 11, фланцевые и эллиптические заглушки, крутоизогнутые отводы, переходы и тройники.

- Термодиффузионным методом: болты, шпильки, шайбы, гайки, крутоизогнутые отводы, переходы и тройники диаметром до 400-500 мм.
Широкое распространение защитных покрытий обусловлено высокой эффективностью их применений. Чтобы заказать нанесение защитного покрытия на детали трубопровода, отправьте заявку по почте [email protected] или свяжитесь с менеджерами отдела продаж.
— Осколкова Анастасия, контент-менеджер «ОНИКС»
ЧИТАЙТЕ ТАКЖЕ
Воротниковые фланцы на высокое давление. Стандарты ГОСТ, ASME, DIN, EN
12.09.2022
Фланцевые заглушки по ГОСТ 34785-21. Технические характеристики и особенности
20.07.2022
Замена группы ГОСТ 28759 для фланцев сосудов и аппаратов в 2022 году
28. 06.2022
06.2022
Гайки и шайбы — важный элемент фланцевого крепежа
17.06.2022
Способы защиты металлов от коррозии
Железо и сплавы на его основе подвержены коррозии – разрушению, которое происходит вследствие химического или электрохимического взаимодействия компонентов металлов и сплавов с различными веществами окружающей среды. В результате этих окислительно-восстановительных реакций металлы связываются в оксиды, что приводит к потере их эксплуатационных свойств. Первые проявления разрушительного процесса – образование на поверхности пятен рыжего цвета. Своевременные меры по предотвращению коррозии обеспечивают значительное продление срока службы металлических изделий и конструкций.
Виды коррозии металлов
Коррозионные процессы различаются по характеру разрушения, механизму протекания процесса, типу агрессивной среды, вызывающей коррозию.
Характер разрушения
По этому признаку выделяют следующие типы коррозии:
- Сплошная – равномерная или неравномерная.
 Затрагивает равномерно всю поверхность металлоизделия или конструкции.
Затрагивает равномерно всю поверхность металлоизделия или конструкции. - Местная. Поражаются отельные участки поверхности.
- Питтинг-коррозия (точечная). Поражения – отдельные, глубокие или сквозные.
- Межкристаллитная. Разрушающиеся области располагаются вдоль границ зерен.
Механизм протекания коррозии
Основные типы коррозии – химическая и электрохимическая. Химические коррозионные процессы протекают в результате химреакций, при которых разрушаются металлические связи, а образуются новые – между атомами металла и окислителя. Химическая коррозия возникает при контакте металлов и сплавов со средами, не проводящими электрический ток. Она может быть жидкостной и газовой.
- Газовая коррозия протекает в агрессивных газовых и паровых средах при отсутствии сконденсированной влаги на поверхности металлоизделия или металлоконструкции. Она может стать причиной полного разрушения железа и сплавов на его основе.
 На поверхности алюминия и алюминиевых сплавов в газовых средах образуется защитная пленка, защищающая их от коррозии. Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород.
На поверхности алюминия и алюминиевых сплавов в газовых средах образуется защитная пленка, защищающая их от коррозии. Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород. - Жидкостная коррозия протекает при контакте металлической поверхности с жидкими неэлектролитами – нефтью и нефтепродуктами. При наличии даже небольшого количества воды этот химический процесс легко превращается в электрохимический.
Электрохимическая коррозия возникает при контакте металлов и сплавов с жидкостями-электролитами вследствие протекания двух взаимосвязанных процессов:
- анодный – ионы металла переходят в раствор электролита;
- катодный – электроны, которые образовались на стадии анодного этапа, связываются частицами окислителя.
В зависимости от среды, в которой протекают электрохимические коррозионные процессы, различают следующие типы коррозии:
- Атмосферная.
 Самая распространенная. Протекает в условиях атмосферы или другого влажного газа.
Самая распространенная. Протекает в условиях атмосферы или другого влажного газа. - В растворах электролитов – кислотах, щелочах, солях, обычной воде.
- Почвенная. Скорость процесса зависит от состава грунта. Наименее агрессивны песчаные почвы, наиболее – кислые почвы.
- Аэрационная. Ее вызывает неравномерный доступ воздушной среды к разным частям изделий и конструкций.
- Биологическая. Ее провоцируют микроорганизмы, которые в результате жизнедеятельности вырабатывают углекислый газ, сероводород и другие газы, вызывающие коррозионные процессы.
- Электрическая. Возникает из-за блуждающих токов, которые появляются при эксплуатации электротранспорта.
Общий вывод! Коррозионные процессы активнее всего развиваются на поверхностях, удобных для отложения пыли, осадков, плохо обдуваемых воздушными струями. Поэтому они подвержены застою воздуха, накоплению и длительному сохранению на поверхности влаги.
Способы защиты металла от коррозии
На стадии производства стали в ее состав могут вводиться легирующие добавки, которые предотвращают появление очагов всех (или некоторых) видов коррозии. Таким элементом является, хром, которого должно быть не менее 13 % от общего количества всех компонентов. Для предотвращения возникновения и развития коррозии в сталях без легирующих добавок используют следующие методы антикоррозионной защиты – конструктивные, пассивные, активные.
Конструктивные
Заключаются в защите поверхности металла с помощью нетонкослойных покрытий – панелей, резиновых прокладок, заслонов. Эти способы имеют мало преимуществ: их сложно, а иногда невозможно реализовать, материалы для конструктивной защиты стоят дорого и после монтажа занимают много места. Их применяют нечасто и только в местах, где они скрыты от глаз.
Пассивные
На металлическое изделие наносится тонкослойное покрытие, которое выполняет чисто барьерные характеристики, то есть процесс защиты заключается в предотвращении контакта металла с наружной средой. Для пассивного способа защиты используют неметаллические покрытия – грунтовки, лаки, краски, эмали. После высыхания они образуют прочную и твердую пленку, имеющую хорошее сцепление с основанием.
Для пассивного способа защиты используют неметаллические покрытия – грунтовки, лаки, краски, эмали. После высыхания они образуют прочную и твердую пленку, имеющую хорошее сцепление с основанием.
Преимущества пассивного способа: невысокая цена и удобное нанесение покрытий, большой ассортимент составов разных цветов и характеристик, создание надежного барьера между металлом и окружающей средой. Недостатки: невысокая устойчивость к механическим повреждениям, необходимость периодически обновлять барьерный слой.
Активные (электрохимические)
Самый распространенный способ создания активной защиты для стальной поверхности – цинкование (горячее, термодиффузионное, гальваническое, холодное). Первые три технологии осуществимы только в производственных условиях. Чаще всего используется горячее цинкование. Стальной листовой прокат цинкуют на непрерывных линиях. Преимущества такого процесса: возможность получать цинковый слой достаточной толщины, высокие автоматизация и производительность процесса. В бытовых условиях применяют только холодное цинкование – нанесение на стальную поверхность цинкнаполненного материала. Обычно холодное цинкование применяют для локального восстановления цинкового покрытия.
В бытовых условиях применяют только холодное цинкование – нанесение на стальную поверхность цинкнаполненного материала. Обычно холодное цинкование применяют для локального восстановления цинкового покрытия.
Принцип активного защитного действия цинка заключается в том, что он обладает меньшей скоростью коррозии в данной среде, что позволяет ему обеспечить электрохимическую катодную защиту стальной основы. При нанесении на сталь цинкового покрытия цинк с железом образуют гальваническую пару, в которой цинк является более активным металлом. При контакте с влагой и другими коррозионноопасными средами цинк-анод отдает электроны, которые принимает железо-катод, что позволяет ему сохранять свои технические характеристики. Защитный процесс длится до полного исчезновения цинкового слоя.
Плюсы цинкования – долговечность и возможность добавлять цинковый слой в процессе эксплуатации изделий и конструкций. Минусы – необходимость в тщательной подготовке поверхности, обязательное соблюдении технологических правил, сложность утилизации токсичных отходов.
Механизм электрохимической коррозии металлов — УТТП
Глава 1. Химический и электрохимический механизмы растворения металлов в электролитах
1.1. Термодинамическая возможность электрохимической коррозии металлов
1.2. Катодные процессы при электрохимической коррозии металлов
1.3. Гомогенный и гетерогенный пути протекания электрохимической коррозии металлов
1.4. Коррозионные гальванические элементы и причины их возникновения
1.5. Схема и особенности электрохимического коррозионного процесса
1.6. Поляризация электродов и ее причины
Глава 2. Электрохимическая кинетика анодных и катодных процессов
Глава 3. Уравнения поляризационных кривых
Глава 4. Диффузионная кинетика и концентрационная поляризация
4.1 Диффузионная кинетика в приэлектродном неподвижном слое
4.2 Концентрационная поляризация
4.3 Смешанная поляризация
Глава 5. Вторичные процессы и продукты электрохимической коррозии металлов и их влияние на поляризацию
Глава 6. Анодный процесс электрохимической коррозии металла
Анодный процесс электрохимической коррозии металла
Глава 7. Анодная реакция ионизации металла
Глава 8. Анодные реакции, протекающие с участием металла и водного расствора
Глава 9. Участие анионов в анодном процессе
Глава 10. Стадийность реакций растворения металлов
Первопричиной коррозии металлов, в том числе и электрохимической коррозии, является их термодинамическая неустойчивость. При взаимодействии с электролитами металлы самопроизвольно растворяются, переходя в более устойчивое окисленное (ионное) состояние. Большой теоретический и практический интерес представляет механизм этого саморастворения металлов, т.е. механизм коррозионного процесса, его основные закономерности, скорость протекания процесса и характер коррозионного разрушения.
Глава 1. Химический и электрохимический механизмы растворения металлов в электролитах
Самопроизвольный переход металлов в окисленное (ионное) состояние при взаимодействии с другими веществами может протекать по двум различным механизмам: 1) химическому; 2) электрохимическому.
Химический механизм в виде проходящей на одном и том же участке поверхности в одну стадию и независящей от потенциала металла химической реакции без участия свободных электронов, когда металл, отдавая окислителю валентные электроны, вступает с ним в химическое соединение или образует ионы, может иметь место и в электролитах:
разложение амальгам щелочных металлов растворами с высоким pH (В.Н. Коршунов и 3.А. Иофа)
Me(Hg) + H20 = Me+ + ½ H2 + OH— + Hg (327)
травление кремния в концентрированной щелочи (С.У. Изидинов, Т.И. Борисова, В.И. Веселовский)
Si + 2Н2О = SiO2 + 2H2 (328)
растворение железа, хрома и их сплавов в 0,1-н. H2SO4 (Я.М. Колотыркин и Г.М. Флорианович)
Me + 2Н2О = Ме п+ +n⋅OН — + n / 2⋅Н2 (329)
растворение алюминия в 50%-ной СН3СООН (Н. А. Михайлова, Н.П. Жук, И.А. Бартеньева и А.В. Турковская)
А. Михайлова, Н.П. Жук, И.А. Бартеньева и А.В. Турковская)
4А1 + 3O2 + 12Н + = 4А1 3+ + 6Н20
и др.
Электрохимический механизм в виде протекающей с участием свободных электронов электрохимической реакции, при которой ионизация атомов металла [см. уравнение (271)] и восстановление окислительного компонента коррозионной среды [см. уравнение (326)] проходят не в одном акте и их скорости зависят от величины электродного потенциала металла, имеет место в подавляющем большинстве случаев коррозии металлов в электролитах и является, таким образом, преобладающим.
Возможность подразделения процесса растворения металлов в электролитах на два сопряженных процесса — анодный и катодный — облегчает в большинстве случаев его протекание по сравнению с химическим взаимодействием. При электрохимическом взаимодействии окислитель играет лишь роль деполяризатора, отнимающего валентные электроны металла и обеспечивающего переход металла в ионное состояние, но не вступает с ним при этом в химическое соединение [вторичные процессы и продукты коррозии при электрохимическом механизме коррозии металлов могут иметь место (см. с. 212), но они не обязательны].
с. 212), но они не обязательны].
1.1. Термодинамическая возможность электрохимической коррозии металлов
Принципиальная возможность или невозможность самопроизвольного протекания процесса электрохимической коррозии металла, так же как и химической коррозии, определяется знаком изменения свободной энергии процесса. Возможно самопроизвольное протекание только коррозионных процессов, которое сопровождается убылью изобарно-изотермического потенциала, т.е. ΔGТ < 0. При электрохимической коррозии металлов для расчетов более удобно пользоваться электрохимическими данными – электродными потенциалами. Термодинамически возможен процесс электрохимической коррозии, для которого соблюдается условие
ΔGТ = -nEТF < 0 (330)
где ΔGТ — изменение изобарно-изотермического потенциала данного коррозионного процесса, кал/г-атом Me;
n — число грамм-эквивалентов;
ЕТ = (Vк) oбр — (Vа) обр — э. д.с. гальванического элемента, в котором обратимо осуществляется данный коррозионный процесс, В;
д.с. гальванического элемента, в котором обратимо осуществляется данный коррозионный процесс, В;
(Vк) oбр — обратимый потенциал катодной реакции в данных условиях, В; (Vа) обр = (VMe) обр — обратимый потенциал металла в данных условиях(для сплавов — обратимый потенциал анодной составляющей сплава в данных условиях, В;
F = 23062 кал/г-экв – число Фарадея.
Принципиальная возможность протекания процесса электрохимической коррозии металла определяется, таким образом, соотношением обратимого потенциала металла в данных условиях и обратимого потенциала катодного процесса в данных условиях.
Самопроизвольное протекание электрохимического коррозионного процесса возможно, если
(Vа) обр = (VMe) обр < (Vк) oбр (331)
т.е. для электрохимического растворения металла необходимо присутствие в электролите окислителя — деполяризатора, обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях. При соблюдении этого условия ЕТ > 0, a ΔGТ < 0.
При соблюдении этого условия ЕТ > 0, a ΔGТ < 0.
1.2. Катодные процессы при электрохимической коррозии металлов
Процесс катодной деполяризации электрохимической коррозии металлов может осуществляться:
1) ионами:
| H +H2О + e = H + H2О = ½ H2 + H2О | (332) |
| Ag +mH2О + e = Ag + mH2О | (333) |
| Cu 2+mH2О + e = Cu +mH2O | (334) |
| Cu +mH2O + e = Сu + mН2О | (335) |
| Fe 3+mH2O + е = Fe 2+mH2O | (336) |
| S2O82- + 2e = S2O84- = 2SO82- | (337) |
| 2HSO3— + 2Н + + 2е = S2O42- + 2H2O | (338) |
| NO3— + 3H + + 2e = HNO2 + H2O | (339) |
| 2HNO2 + 4H + + 4e = H2N2O2 + 2H2O | (340) |
| Cr2O72- + 14Н + + 6e = 2Cr 3+ + 7H2O | (341) |
2) нейтральными молекулами:
| O2 + 4e + 2H2O = 4OH — | (342) |
| H2O2 + 2e = 2OH — | (343) |
| Cl2 + 2e = 2Сl — | (344) |
| I2 + 2e = 2I — | (345) |
| Br2 + 2e = 2Вr — | (346) |
Таблица 28 — Стандартные окислительно-восстановительные потенциалы катодных деполяризующих реакций в водных растворах при 25 °С (по Н. Д. Томашову и Н.Е. Хомутову)
Д. Томашову и Н.Е. Хомутову)
| Электродная реакция | (VОК — В)°обр |
| Нейтральные среды (pH = 7) | |
| Аl(ОН)3 + 3е = Аl + 3ОН — | -1,94 |
| ТiO2 + 2Н2O + 4е = Ti + 4OН — | -1,27 |
| FeS + 2е = Fe + S 2- | -1,00 |
| Сr(ОН)3 + 3е = Сr + 3ОН — | -0,886 |
| Zn(OH)2 + 2е = Zn + 2OН — | -0,83 |
| Fe(OH)2 + 2е = Fe + 2OН — | -0,463 |
| Н + + Н2O + 2е = Н2 + ОН — | -0,414 |
| Cd(OH)2 + 2е = Cd + 2OН — | -0,395 |
| Со(OH)2 + 2е = Со + 2OН — | -0,316 |
| Fe3O4 + Н2О + 2е = 3FeO + 2OН — | -0,315 |
| Ni(OH)2 + 2е = Ni + 2OН — | -0,306 |
| Fe(OH)3 + е = Fe(OH)2 + ОН — | -0,146 |
| PbO + Н2O + 2е = Pb + 2OН — | -0,136 |
| Cu2O + Н2O + 2е = 2Cu + 2OН — | +0,056 |
| CuO + Н2O + 2е = Cu + 2OН — | +0,156 |
| Cu(ОН)2 + 2е = Cu + 2OН — | +0,19 |
| AgCl + е = Ag + С1 — | +0,222 |
| O2 + 2Н2O + 2е = Н2O2 + 2OН — | +0,268 |
| Hg2(Cl2) + 2е = 2Hg + 2C1 — | +0,268 |
| Fe(CN)63- + е = Fe(CN)64- | +0,40 |
| Mn(OH)3 + е = Mn(OH)2 + OН — | +0,514 |
| I2 + 2e = 2I — | +0,536 |
| CrO42- + 4H2O + 3e = Cr(OH)3 + 5OH — | +0,560 |
| O2 + 2H + + 4e = 2OH — | +0,815 |
Br2(водн. ) + 2e = 2Br — ) + 2e = 2Br — | +1,087 |
| MnO4— + 2H2O + 3e = MnO2 + 4OH — | +1,140 |
| Н2О2 + 2e = 2OH — | +1,356 |
| Сl2 + 2e = 2C1 — | +1,360 |
| O3 + H + + 2e = O2 + OH — | +1,654 |
| S2O82- + 2e = 2SO42- | +2,01 |
| F2 + 2e = 2F — | +2,87 |
| Кислые среды (pH = 0) | |
| 2HSO3— + 2H + + 2e = S2O42- + 2H2O | -0,103 |
| H + + e =½H2 | 0,000 |
| Cu 2+ + e = Cu + | +0,153 |
| Fe 3+ + e = Fe 2+ | -0,771 |
| 2HNO3— + 4H + + 4e = 2H2N2O2 + H2O | -0,86 |
| NO3— + 3H + + 2e = HNO2 + H2O | +0,94 |
| NO3— + 4H + + 3e = NO + 2H2O | +0,96 |
| ClO3 + 3H + + 2e = НСlO2 + H2O | +1,21 |
| O2 + 4H + + 4e = 2H2O | +1,229 |
| Cr2O72- + 14H + + 6e = 2Cr3+ + 7H2O | +1,33 |
| PbO2 + 4H + + 2e = Pb2+ + 2H2O | +1,455 |
| Mn 3+ + e = Mn 2+ | +1,51 |
| H2O2 + 2H + + 2e = 2H2O | +1,776 |
| Щелочные среды (pH = 14) | |
| Mg(OH)2 + 2e = Mg + 2OH — | -2,69 |
| Н2AlO3— + H2O + 3e = Al + 4OH — | -2,33 |
| Mn(OH)2+ 2e = Mn + 2OH — | -1,55 |
| 2H2O + 2e = H2 + 2OH — | -0,828 |
| FeCO3+ 2e = Fe + CO32- | -0,756 |
| СlO3— + Н2 + 2e = СlO2— + 2OH — | +0,33 |
| СlO4— + Н2O + 2e = СlO3— + 2OH — | +0,36 |
| O2 + 2Н2O + 4e = 4OH — | +0,401 |
| СlO2— + Н2O + 2e = СlO — + 2OH — | +0,66 |
| O3 + Н2O + 2e = O2 + 2OH — | +1,24 |
3)нерастворимыми пленками:
| CuО + 2е + Н2O = Сu + 2OН — | (347) |
| Fe3O4 + 2е + Н2O = 3FeO + 2OH — | (348) |
| Fe(ОН)3 + е = Fe(OH)2 + ОН — | (349) |
4)органическими соединениями:
| RO + 2е + 4Н + = RН2 + Н2O | (350) |
| R + 2е + 2Н + = RН2 | (351) |
где R — радикал или органическая молекула.
Обратимые окислительно-восстановительные потенциалы катодных реакций (Vк) oбр = (Vо-в)oбр характеризующие возможность протекания последних, выражаются уравнением
(352)
где (Vк) oбр = (Vок-в) oбр — стандартный окислительно-восстановительный (обратимый окислительно-восстановительный потенциал при ), см. таблицу 28;
aок и aв — активность окислителя и восстановителя соответственно;
р и q — стехиометрические коэффициенты окислителя и восстановителя соответственно в окислительно-восстановительной реакции.
Наибольшее значение в большинстве конкретных случаев электрохимической коррозии металлов имеют катодные реакции: (342) — кислородная деполяризация и (332) — водородная деполяризация (деполяризация водородными ионами).
1.3. Гомогенный и гетерогенный пути протекания электрохимической коррозии металлов
Современная теория электрохимической коррозии металлов [1] сноска исходит из возможности протекания процесса как гомогенно-электрохимическим, так и гетерогенно-электрохимическим путем (локальные элементы), из которых второй (гетерогенно-электрохимический) в практических случаях коррозии преобладает.
В теории необратимых электродных потенциалов металлов А.Н. Фрумкина (см. с. 176), в которой сформулирован электрохимический механизм саморастворения (коррозии) металлов в электролитах, рассматривалось растворение металла с однородной (гомогенной) поверхностью, т. е. предполагалось, что скорость протекающих на поверхности электрохимических реакций одинакова на всех участках и что все точки поверхности обладают одним и тем же значением потенциала[2] сноска (т.е. что поверхность является строго эквипотенциальной). Автор этой теории считает, что такое допущение вполне законно для жидкого металла, например для поверхности ртути или амальгамного электрода, которая может служить образцом однородной поверхности. Относительно твердого металла это допущение может служить лишь известным приближением. Даже если твердый металл химически вполне однороден, разные участки его поверхности не являются вполне однородными физически. Разные точки поверхности, различающиеся своим положением в решетке отдельных кристаллитов, обладают различной энергией и различными свойствами, что отражается на кинетике электрохимических реакций, протекающих в этих точках. Особенно резкое отклонение от принятой упрощенной картины получается в том случае, когда металл содержит в себе инородные включения и когда вследствие этого на его поверхности имеются разделенные участки с различными физическими и химическими свойствами[2] сноска.
Особенно резкое отклонение от принятой упрощенной картины получается в том случае, когда металл содержит в себе инородные включения и когда вследствие этого на его поверхности имеются разделенные участки с различными физическими и химическими свойствами[2] сноска.
А. Н. Фрумкиным и В. Г. Левичем[3] сноска было теоретически доказано, что поверхность корродирующего металла остается приблизительно эквипотенциальной и при наличии неоднородностей, если только размеры включений малы, а электропроводность электролита достаточно велика, что подтверждено измерениями Г. В. Акимова и А. И. Голубева (рис. 129).
Как видно из рисунка 129, наблюдаются заметные изменения потенциала при переходе от одной составляющей сплава (анод-цинк, катод-FeZn7) к другой, но абсолютная величина их невелика. В тех случаях, когда нас интересует только общая величина коррозии, а не распределение ее по поверхности (например, при определении величины саморазряда электрода источника тока), это позволяет трактовать заведомо неоднородную поверхность как однородную. Необходимо иметь, однако, в виду, что в случае металла с неоднородной поверхностью значение общей, скорости коррозионного процесса, как правило, еще совершенно не определяет величины и степени опасности коррозионных разрушений. Как видно из рисунка 129, скорость анодного процесса резко возрастает с приближением к краю катодного включения. Разрушение металла происходит, следовательно, неравномерно; в данном случае оно концентрируется главным образом вблизи включения[2] сноска.
Необходимо иметь, однако, в виду, что в случае металла с неоднородной поверхностью значение общей, скорости коррозионного процесса, как правило, еще совершенно не определяет величины и степени опасности коррозионных разрушений. Как видно из рисунка 129, скорость анодного процесса резко возрастает с приближением к краю катодного включения. Разрушение металла происходит, следовательно, неравномерно; в данном случае оно концентрируется главным образом вблизи включения[2] сноска.
Таким образом, гомогенная трактовка протекания электрохимического коррозионного процесса, являющаяся вполне законной для жидкого металла, при переходе к твердому металлу может служить только известным приближением являющимся упрощенной картиной при наличии в металле инородных включений и пригодным только для металлов повышенной частоты или для количественной оценки случаев более или менее равномерного характера разрушения поверхности корродирующего металла, т.е. когда общая величина коррозии представляет интерес.
По этой теории, в стационарных условиях суммарные скорости анодного iа и катодного iк процессов саморастворения (коррозии) металла равны, т.е.
(353)
что значительно упрощает расчеты, но дает очень грубое приближение или вовсе не пригодно для оценки и расчета неравномерных и местных коррозионных разрушений металлов.
Согласно более ранней, имеющей почти полуторавековую историю, гетерогенной трактовке процессов электрохимической коррозии металлов (теории локальных элементов), участки анодной и катодной реакций пространственно разделены и для протекания коррозии необходим переток электронов в металле и ионов в электролите. Такое пространственное разделение анодной и катодной реакций энергетически более выгодно, так как они локализуются на тех участках, где их прохождение облегчено (энергия активации реакции меньше).
В большинстве практических случаев протекание электрохимической коррозии обычно характеризуется локализацией анодного и катодного процессов на различных (более или менее постоянных) участках корродирующей поверхности металла, что приводит к неравномерному или местному характеру (см. с. 15) коррозионного разрушения. Эти отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходят анодный или катодный процессы, являются в зависимости от их размеров короткозамкнутыми макрогальваническими (имеющими размеры, хорошо различимые невооруженным глазом) или микрогальваническими (обнаруживаемыми лишь при помощи микроскопа) элементами (рис. 130).
с. 15) коррозионного разрушения. Эти отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходят анодный или катодный процессы, являются в зависимости от их размеров короткозамкнутыми макрогальваническими (имеющими размеры, хорошо различимые невооруженным глазом) или микрогальваническими (обнаруживаемыми лишь при помощи микроскопа) элементами (рис. 130).
Таким образом, электрохимическая коррозия металлов напоминает работу гальванического элемента, в котором отрицательный электрод (например, цинк) растворяется, когда он соединен проводником со вторым электродом, на котором восстанавливаются ионы водорода или другие вещества[4] сноска и поэтому ее можно рассматривать как результат работы большого числа коррозионных гальванических элементов на корродирующей поверхности металла, соприкасающейся с электролитом.
Основателем теории микрогальванических (локальных) элементов принято считать де для Рива (1830 г. ), хотя еще в 1813 г. аналогичная теория была сформулирована Ф.И. Гизе. Теория микрогальванических элементов получила признание и свое дальнейшее развитие в XX в. благодаря трудам многих ученых и прежде всего Н.А. Изгарышева, Г. В. Акимова и его школы. А.И. Голубевым и Г.В.Акимовым были исследованы реальные микроэлементы.
), хотя еще в 1813 г. аналогичная теория была сформулирована Ф.И. Гизе. Теория микрогальванических элементов получила признание и свое дальнейшее развитие в XX в. благодаря трудам многих ученых и прежде всего Н.А. Изгарышева, Г. В. Акимова и его школы. А.И. Голубевым и Г.В.Акимовым были исследованы реальные микроэлементы.
Эта теория в ее современном виде объясняет не только общую величину коррозии, но и влияние гетерогенности поверхности корродирующих металлов (включая и структурную гетерогенность) на характер и скорость (увеличение и уменьшение ее, равно как и отсутствие влияния в ряде случаев) коррозионного разрушения. Она была широко использована для объяснения коррозионного поведения конструкционных металлов и сплавов в различных условиях[5] сноска.
По этой теории, в стационарных условиях суммарные скорости анодного iа и катодного iк процессов при саморастворении (коррозии) металлов не равны, так как площади анодных и катодных участков, как правило, не равны, т. е. Sа ≠ Sк, поэтому
е. Sа ≠ Sк, поэтому
При этом скоростью собственно коррозии является только первая величина, т.е. анодная плотность тока iа.
Современная теория электрохимической коррозии металлов не противопоставляет два пути (гомогенный и гетерогенный) протекания процесса, полагая, что соответствующие теоретические положения, основанные в обоих случаях на использовании электрохимической термодинамики и кинетики, дополняют друг друга, так как каждое из них имеет свои границы применения. В связи с этим попытки необъективной критики одной из этих теорий[6] сноска являются ненужными.
1.4. Коррозионные гальванические элементы и причины их возникновения
Поверхность корродирующего металла представляет собой обычно многоэлектродный, т.е. состоящий из нескольких (более двух) отличающихся друг от друга электродов, гальванический элемент (рис. 131). В первом приближении эту поверхность можно рассматривать как двухэлектродную систему, т. е. состоящую из участков двух видов — анодных (одного сорта) и катодных (тоже одного сорта).
е. состоящую из участков двух видов — анодных (одного сорта) и катодных (тоже одного сорта).
Причины возникновения электрохимической гетерогенности (неоднородности) поверхности раздела металл — электролит при электрохимической коррозии металлов приведены в таблице 29.
Таким образом, электрохимическая гетерогенность поверхности корродирующего металла приводит к дифференциации последней на анодные (с более отрицательным электродным потенциалом Va) и катодные (с более положительным электродным потенциалом Vк) участки. Степень гетерогенности этой поверхности характеризуется разностью электродных потенциалов анодных и катодных участков, т.е. (Vк) oбр — (Vа) обр (см. рис. 129).
1.5. Схема и особенности электрохимического коррозионного процесса
Электрохимическое растворение металла — сложный процесс, состоящий из трех основных процессов (рис. 133):
1) анодного процесса — образования гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции
2) процесса перетекания электронов по металлу от анодных участков к катодным и соответствующего перемещения катионов и анионов в растворе;
Таблица 29 — Причины возникновения электрохимической гетерогенности поверхности металл-электролит (типы коррозионных гальванических элементов) по Н. Д. Ромашову
Д. Ромашову
| Общая причина возникновения гетерогенности | Конкретная причина возникновения гетерогенности | Обычная полярность участков |
| Неоднородность металлической фазы | Макро- и микровключения Неоднородность сплава | Включения с более положительным электродным потенциалом являются катодами (рис. 132, а) Участки сплава, обогащенные компонентом с более положительным электродным потенциалом, являются, как правило, катодами |
| Неоднородность поверхности металла | Наличие границ блоков и зерен кристаллитов Выход дислокаций на поверхность металла Анизотропность металлического кристалла | Границы блоков и зерен могут быть и катодами, и анодами (рис. 132, б) Область выхода дислокации на поверхность обычно является анодом Различные грани монокристаллов могут быть анодами или катодами |
| Субмикроскопическая (атомарная) неоднородность поверхности металла | Наличие разнородных атомов в твердом растворе | Атомы или группы атомов металла с более отрицательным электродным потенциалом являются в ряде случаев анодами |
| Неоднородность защитных пленок на поверхности металла | Макро- и микропоры в окисной пленке Неравномерное распределение на поверхности металла вторичных продуктов коррозии | Металл в порах является анодом (рис. 132, в) 132, в)Участки металла под продуктами коррозии, как правило, являются анодами (рис. 132, г) |
| Неоднородность внутренних напряжений в металле | Неравномерная деформация Неравномерность приложенных внешних нагрузок | Более деформированные участки металла являются анодами (рис. 132, д) Более напряженные участки металла являются анодами (рис. 130, е) |
| Неоднородность жидкой фазы | Различие в концентрации собственных ионов данного металла в электролите Различи в концентрации нейтральных солей в растворе | Участки металла, соприкасающиеся с более разбавленным раствором, при установлении искаженного обратимого электродного потенциала являются анодами Участки металла, соприкасающиеся с более концентрированными растворами солей с активным анионом, являются анодами (рис. 132, ж), а с растворами пассивирующих солей, наоборот — катодами |
| Неоднородность жидкой фазы | Различие в pH Различие в концентрации кислорода или других окислителей | Участки металла, соприкасающиеся с раствором с более низким значением рН, являются катодами Участки металла, соприкасающиеся с раствором с большей концентрацией кислорода или другого окислителя, являются катодами (рис.  132, з) 132, з) |
| Неоднородность физических условий | Различие температуры Неравномерное распределение лучистой энергии Неравномерное наложение внешнего электрического поля | Более нагретые участки металла являются анодами (рис. 132, и) Более интенсивно облучаемые участки металла являются анодами Участки металла, где положительные заряды (катионы) выходят в электролит, являются анодами (рис. 132, к) |
3) катодного процесса — ассимиляции электронов какими-либо ионами или молекулами раствора (деполяризаторами), способными к восстановлению на катодных участках по реакции
D + nе = [Dne]
Таким образом, электрохимическая коррозия на неоднородной (гетерогенной) поверхности металла аналогична работе короткозамкнутого гальванического элемента.
При замыкании в электролите двух обратимых электродов с разными потенциалами [(Vа) обр и (Vк) oбр] происходит перетекание электронов от более отрицательного электрода (анода) к менее отрицательному (или более положительному) электроду (катоду). Это перетекание электронов выравнивает значения потенциалов замкнутых электродов. Если бы при этом электродные процессы (анодный на аноде и катодный на катоде) не протекали, потенциалы электродов сравнялись бы, и наступила бы полная поляризация. В действительности анодный и катодный электродные процессы продолжаются, препятствуя наступлению полной поляризации вследствие перетекания электронов с анода к катоду, т.е. действуют деполяризующие. Отсюда, в частности, происходит и название ионов и молекул раствора, обеспечивающих протекание катодного процесса — деполяризаторы. Однако из-за отставания электродных процессов от перетока электронов в гальваническом элементе (см. с. 192) потенциалы электродов изменяются (сближаются) и короткозамкнутая система, в конечном итоге, полностью заполяризовывается (см. с. 271, 282 и 287).
Это перетекание электронов выравнивает значения потенциалов замкнутых электродов. Если бы при этом электродные процессы (анодный на аноде и катодный на катоде) не протекали, потенциалы электродов сравнялись бы, и наступила бы полная поляризация. В действительности анодный и катодный электродные процессы продолжаются, препятствуя наступлению полной поляризации вследствие перетекания электронов с анода к катоду, т.е. действуют деполяризующие. Отсюда, в частности, происходит и название ионов и молекул раствора, обеспечивающих протекание катодного процесса — деполяризаторы. Однако из-за отставания электродных процессов от перетока электронов в гальваническом элементе (см. с. 192) потенциалы электродов изменяются (сближаются) и короткозамкнутая система, в конечном итоге, полностью заполяризовывается (см. с. 271, 282 и 287).
Особенности электрохимического коррозионного процесса:
1) подразделение его на два одновременно протекающих, но в значительной степени независимых электродных процесса: анодный и катодный;
2) зависимость кинетики этих двух электрохимических процессов, а следовательно, и скорости коррозии в соответствии с за¬конами электрохимической кинетики от величины электродного потенциала металла: смещение потенциала металла в положительную сторону (например, в результате поляризации от внешнего источника тока) обычно облегчает анодный процесс и затрудняет катодный; смещение потенциала в отрицательную сторону, на¬оборот, ускоряет катодный процесс и тормозит анодный;
3) возможность локализации электродных процессов на различных участках поверхности корродирующего металла, где их протекание облегчено;
4) при локализации электродных процессов реализация материального эффекта коррозии (растворения металла) преимущественно на анодных участках поверхности корродирующего металла.
Общие принципы протекания коррозионных процессов
В большинстве случаев электрохимической коррозии металлов основными тормозящими явлениями, устанавливающими определенную конечную скорость ее, служат явления поляризации.
1.6. Поляризация электродов и ее причины
Если элементы обратимого гальванического элемента с потенциалами в разомкнутом состоянии (Vа) обр и (Vк) oбр и сопротивлением электролита между ними в цепи R замкнуть и измерить установившееся значение силы генерируемого тока I’, то оказывается, что эта сила тока значительно меньше рассчитанной по закону Ома, т.е.
(355)
Так как практически R — const (строго говоря, величина R зависит от I’, так как прохождение тока вызывает изменение концентрации, а следовательно, и электропроводности раствора, но этот эффект при небольших длительностях опыта незначителен), причину неравенства (355) следует искать в числителе дроби. И действительно, измерения показывают (рис. 134), что потенциалы электродов, через которые проходит при их работе (замыкании) электрический ток, отличаются от потенциалов, не нагруженных током: потенциал анода при прохождений через него тока становится положительнее, а потенциал катода — отрицательнее:
И действительно, измерения показывают (рис. 134), что потенциалы электродов, через которые проходит при их работе (замыкании) электрический ток, отличаются от потенциалов, не нагруженных током: потенциал анода при прохождений через него тока становится положительнее, а потенциал катода — отрицательнее:
(356)
(357)
где Vа и Vк — устанавливающиеся при данном значении тока электродные потенциалы, называемые эффективными;
ΔVа и ΔVк — смещение потенциалов анода и катода.
Это изменение (сближение) потенциалов, а следовательно, и их разности, приводящее к уменьшению силы тока, называют поляризацией.
Таким образом, в уравнении (355) должны фигурировать не начальные (Vа) обр и (Vк) oбр, а эффективные значения потенциалов электродов, т.е.
(358)
Явления поляризации электродов наблюдаются как в гальванических элементах, так и в электролизерах, т. е. при прохождении через электроды постоянного электрического тока независимо от его происхождения (генерации тока в результате работы гальванического элемента или его подвода от внешнего источника к электролизеру).
е. при прохождении через электроды постоянного электрического тока независимо от его происхождения (генерации тока в результате работы гальванического элемента или его подвода от внешнего источника к электролизеру).
Понятие электрохимической поляризации было введено Э.X. Ленцем (1839 г.). Работы Э.X. Ленца и А.С. Савельева, а затем Н.П. Слугинова (1877-1881 гг.), Р.А. Колли (1878 г.) и других заложили основы теории поляризации электродных процессов.
Поляризация является следствием отставания электродных процессов от перетока электронов в гальваническом элементе. Анодный процесс выхода ионов металла в электролит (Ме n+ → Ме n+ × mН2О) отстает от перетока электронов от анода к катоду, что приводит к уменьшению отрицательного заряда на поверхности электрода и делает потенциал анода положительнее; катодный процесс ассимиляции электронов (D + nе → [Dne]) отстает от поступления на катод электронов, что приводит к увеличению отрицательного заряда на поверхности электрода и делает потенциал катода отрицательнее (рис. 135).
135).
Все это справедливо и для электрохимического коррозионного процесса, протекание которого аналогично работе короткозамкнутого гальванического элемента: возникающий из-за наличия начальной разности потенциалов катодной и анодной реакций Еобр = (Vк) oбр — (Vа) обр процесс электрохимической коррозии сопровождается перетеканием электрического тока от анодных участков к катодным в металле и от катодных участков к анодным в электролите, которое вызывает поляризацию на обоих участках. Эти явления дополнительно тормозят протекание коррозионного процесса.
1) для скорости электрохимического коррозионного процесса можно в общем виде записать следующим образом:
(359)
где R — омическое сопротивление корродирующей системы;
Р — поляризационное сопротивление (сопротивление протеканию элек¬тродных процессов) системы.
Как будет показано в дальнейшем (см.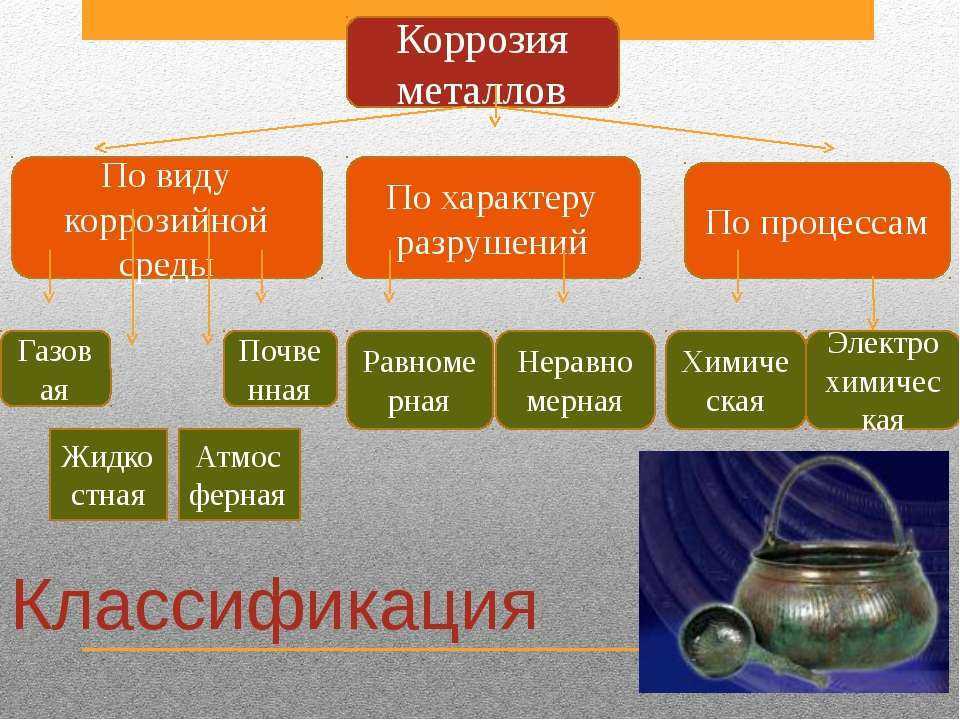 с. 269), уравнение такого вида может быть получено для линейной зависимости электродных поляризаций от плотности коррозионного тока, а для более сложной зависимости уравнения имеют более сложный вид. Кинетику электродных процессов, в том числе и электродных процессов электрохимической коррозии металлов, принято изображать в виде поляризационных кривых, представляющих собой графическое изображение измеренной с помощью описанной в ч.III методики зависимости потенциалов электродов V от плотности тока i = I / S, т.е. V= f(i). На рис. 136 приведены кривые анодной и катодной поляризации металла, характеризующие его поведение в качестве анода и катода коррозионного элемента. Степень наклона кривых характеризует большую (крутой ход) или малую (пологий ход) затрудненность протекания электродного процесса. Количественно это может быть выражено истинной поляризуемостью процесса при данной плотности тока i (в данной точке поляризационной кривой):
с. 269), уравнение такого вида может быть получено для линейной зависимости электродных поляризаций от плотности коррозионного тока, а для более сложной зависимости уравнения имеют более сложный вид. Кинетику электродных процессов, в том числе и электродных процессов электрохимической коррозии металлов, принято изображать в виде поляризационных кривых, представляющих собой графическое изображение измеренной с помощью описанной в ч.III методики зависимости потенциалов электродов V от плотности тока i = I / S, т.е. V= f(i). На рис. 136 приведены кривые анодной и катодной поляризации металла, характеризующие его поведение в качестве анода и катода коррозионного элемента. Степень наклона кривых характеризует большую (крутой ход) или малую (пологий ход) затрудненность протекания электродного процесса. Количественно это может быть выражено истинной поляризуемостью процесса при данной плотности тока i (в данной точке поляризационной кривой):
(360)
(361)
или средней поляризуемостью процесса для данного интервала плотности тока (на данном участке поляризационной кривой):
(362)
(363)
Рис. 136. Кривые анодной и катодной поляризации металла
136. Кривые анодной и катодной поляризации металла
Причины анодной поляризации, т.е. отставания процесса выхода ионов металла в электролит от перетока электронов с анодных участков на катодные, следующие:
1)Замедленность анодной реакции коррозии металла
которая определяется соответствующим значением энергии активации этой реакции Qa, приводит к возникновению электрохимической поляризации (ΔVa)э = x, называемой перенапряжением ионизации металла.
При очень малых значениях анодной плотности тока (ориентировочно при ia < 10-2 А/м2 зависимость перенапряжения ионизации металла от анодной плотности тока может быть выражена линейным уравнением (участок (VMe)обр A на рис. 137):
(ΔVa)э = x = k1ia (364)
где k1 – постоянная, зависящая от материала и состояния поверхности анода, температуры и пр.
Линейная зависимость электрохимической поляризации от плотности от плотности тока при малых значениях последней была впервые установлена А.С. Савельевым (1845 г.).
При плотностях тока, больших, чем примерно 10-2 А/м2, анодная поляризация может быть представлена логарифмическим уравнением (участок АВС на рис. 137):
(ΔVa)э = x = a1lg ia (365)
;где a1 – постоянная, зависящая от материала и состояния поверхности анода, температуры и пр.;
Логарифмическая зависимость электрохимической поляризации от плотности тока при достаточно больших значениях последней была впервые установлена Тафелем для катодного процесса разряда водородных ионов (1900 г.), и уравнение подобного типа называют уравнением Тафеля или тафелевским.
Поляризация, вызываемая перенапряжением ионизации металлов, достигает небольших величин [пологая кривая (VMe)обр ABC на рис. 137], которые максимальны у пассивирующихся металлов группы железа.
137], которые максимальны у пассивирующихся металлов группы железа.
Рис. 137. Анодные поляризационные кривые:
а – в координатах ia – Va; б – в координатах lg ia – Va [(VMe)обр; ABC – перенапряжение ионизации металла;
ВЕ – пассивирование металла; ДEF – перенапряжение анодного выделения кислорода]
Ниже приведены значения перенапряжения ионизации металлов (ΔVa)э = x, В, в растворах соответствующих сернокислых солей при ia = 0,002 А/см2 (по Ньюбери)
| Cd | ………… | 0,00 | Со | ………… | 0,02 | |
| Zn | ………… | 0,01 | Ni | ………… | 1,60 | |
| Сu | . ……….. ……….. | 0,02 | Fe | ………… | 1,66 | |
| Tl | ………… | 0,30 |
А.Н. Фрумкин показал, что чем выше отношение тока обмена I0 к налагаемому току, тем труднее сдвинуть равновесие (275) пропусканием через систему тока и тем ниже поляризация, вызываемая замедленностью электрохимической реакции.
2) Замедленность диффузии ионов металла от поверхности в объем раствора приводит к возникновению концентрационной поляризации анода (ΔVa)конц, которая сравнительно невелика [пологая кривая, аналогичная кривой (VMe)обр ABC на рис. 137], кроме случаев большой активности ионов металла у поверхности.
3) Очень большая замедленность анодной реакции ионизации металла имеет место при возникновении анодной пассивности (см. с. 305). Анодная поляризация металлов в определенных условиях может облегчать переход металлов в пассивное состояние (образование на металле первичных фазовых или адсорбционных защитных пленок), что сопровождается резким торможением анодного процесса с соответствующим самопроизвольным падением плотности тока и значительным смещением потенциала электрода в положительную сторону (участок BE на рис. 137) до значений, достаточных для протекания нового анодного процесса, обычно выделения кислорода [участок EF кривой (Vo2)обр DEF на рис. 137]. Значение этого вида анодной поляризации рассчитать нельзя и его берут обычно из опытных данных.
137) до значений, достаточных для протекания нового анодного процесса, обычно выделения кислорода [участок EF кривой (Vo2)обр DEF на рис. 137]. Значение этого вида анодной поляризации рассчитать нельзя и его берут обычно из опытных данных.
Процессы, уменьшающие анодную поляризацию, называются деполяризационными процессами (например, перемешивание, снижающее концентрационную поляризацию), а вещества, их осуществляющие, — анодными деполяризаторами (например, комплексообразователи NH3CN — и др., сильно понижающие активность простых ионов металлов в растворе вследствие их связывания в труднодиссоциирующие комплексы, или ионы Cl —, затрудняющие наступление анодной пассивности металлов).
Причинами катодной поляризации, т.е. отставания процесса ассимиляции электронов от поступления на катодные участки электронов, являются:
1.Замедленность катодной деполяризационной реакции
D + nе [Dne]
которая определяется соответствующим значением энергии активации этой реакции Qк, приводит к возникновению электрохимической поляризации (ΔVк)э = x называемой перенапряжением реакции катодной деполяризации.
2. Замедленность диффузии деполяризатора из объема электролита к катодной поверхности или продукта катодной деполяризационной реакции в обратном направлении, которая приводит к концентрационной поляризации катода (ΔVк)конц. Более подробно явления катодной поляризации будут рассмотрены ниже для наиболее часто встречающихся катодных процессов кислородной и водородной деполяризации (см. с. 223 и 251).
Глава 2. Электрохимическая кинетика анодных и катодных процессов
Скорость гетерогенной химической реакции на металле в жидкости может быть представлена уравнением общего типа:
v = Skc’ exp(-Q/RT) (369)
где v — скорость реакции;
S — поверхность, на которой протекает реакция;
k — константа скорости реакции;
с’ — поверхностная активность или концентрация реагирующего вещества, т.е. его актив-ность или концентрация в слое жидкости, расположенном на поверхности металла;
Q — энергия (теплота) активации реакции;
R — газовая постоянная;
Т — абсолютная температура.
Если металл погрузить в раствор его соли, то для удельных скоростей (v/S), выражен-ных в единицах соответствующих плотностей тока i, его частных анодной (271) и катодной (272) реакций можно написать следующие уравнения:
(370)
так как aMe или cMe = Const = 1;
(371)
где , как это следует из теории растворов;
с — концентрация ионов металла в объеме раствора;
Ψ1 — потенциал, приходящийся на диффузионную часть двойного электрического слоя;
n — число электронов, принимающих участие в данном элементарном процессе (в нашем случае — валентность ионов металла).
Особенностью электрохимических гетерогенных реакций является зависимость их энергий активации Q, а следовательно, и скорости от потенциала электрода V или его поляризации ΔV, т.е.
Q1 = f(ΔV) и Q2 = f(ΔV) (372)
Нашей задачей является нахождение этих зависимостей.
На рис. 138 приведено изменение потенциальной энергии ионов металла, склонного к самопроизвольному окислению (растворению). На этом рисунке кривые 1 и 2 воспроизводят рис. 107, иллюстрирующий механизм возникновения скачка потенциала на границе металл-электролит за счет окисления и восстановления самого металла. Кривая 1 соответствует моменту погружения металла в раствор его соли, а кривая 2 — моменту установления равновесия. Часть устанавливающегося при этом потенциала металла (Vа)обр относительно раствора, приходящаяся на плотную часть двойного электрического слоя Ψобр, может служить мерой максимальной работы А, совершаемой при переходе 1 г-иона катионов металла в раствор, т.е.
A Ψобр nF (373)
Рис. 138. Схема изменения энергии U катионов металла, склонного к самопроизвольному растворению, при анодной поляризации:
1 — в момент погружения металла в раствор его соли;
2 — в момент установления равновесия;
3 — при анодной поляризации
Анодная поляризация металла, т. е. сдвиг потенциала металла в положительную сторону, когда VMe > (VMe)обр и ΔV > 0, повышает энергетический уровень катионов на поверхности металла и понижает его у катионов, находящихся в растворе на расстоянии δ0 от поверхности металла, как это представлено кривой 3 на рис. 138. Устанавливающийся при этом скачок потенциала, поляризуемого внешним током металла относительно раствора Vа, дает в плотной части двойного слоя скачок Ψ ≠ Ψобр, а совершаемая работа А’ при переходе 1 г-иона катионов металла в раствор будет равна
е. сдвиг потенциала металла в положительную сторону, когда VMe > (VMe)обр и ΔV > 0, повышает энергетический уровень катионов на поверхности металла и понижает его у катионов, находящихся в растворе на расстоянии δ0 от поверхности металла, как это представлено кривой 3 на рис. 138. Устанавливающийся при этом скачок потенциала, поляризуемого внешним током металла относительно раствора Vа, дает в плотной части двойного слоя скачок Ψ ≠ Ψобр, а совершаемая работа А’ при переходе 1 г-иона катионов металла в раствор будет равна
A’ = Ψ nF (374)
где Ψ = Vа — Ψi
При анодной поляризации ΔVа энергетический барьер анодной частной реакции Qа = Q0 уменьшается на величину αA’, а энергетический барьер катодной частной реакции QК = Q0 увеличивается на величину βA’, причем α + β = 1. Множители α и β принято называть коэффициентами переноса (или перехода). Таким образом, можно написать следующие уравнения:
Множители α и β принято называть коэффициентами переноса (или перехода). Таким образом, можно написать следующие уравнения:
Q1 = Q0 — αA’ (375)
Q2 = Q0 — βA’ (376)
или с учетом уравнения (374):
Q1 = Q0 — α⋅Ψ⋅nF (377)
Q2 = Q0 — β⋅Ψ⋅nF (378)
или с учетом уравнения (283):
Q1 = Q0 — α⋅(Vа — Ψ1)⋅nF (379)
Q2 = Q0 — β⋅(Vа — Ψ1)⋅nF (380)
Чтобы перейти от потенциала поляризуемого металла Vа относительно раствора (потенциал которого в середине условно принимается равным нулю)
Vа = (Vа)обр + ΔV (381)
к электродному потенциалу металла VMe, т. е. измеренному относительно стандартного водородного электрода
е. измеренному относительно стандартного водородного электрода
VMe = (VMe)обр + ΔV (382)
можно написать следующее уравнение:
Vа = (Vа)обр + ΔV + Const (383)
где Const = -V(0) — потенциал нулевого заряда металла, измеренный относительно того же электрода сравнения [см. уравнение (293)].
При подстановке уравнения (383) в уравнения (379) и (380) получим
Q1 = Q0 — α⋅{(VMe)обр + ΔV — Ψ1}⋅nF + β⋅nF⋅Const (384)
Q2 = Q0 — β⋅{(VMe)обр + ΔV — Ψ1}⋅nF + β⋅nF⋅Const (385)
Таким образом, величины Q1 и Q2 зависят от потенциала металла VMe = (VMe)обр + ΔV и строения двойного электрического слоя на границе металл-раствор, так как Q1 и Q2 = f(Ψ1), а Ψ1 определяется строением двойного электрического слоя.
Подставляя уравнения (384) и (385) соответственно в уравнения (370) и (371), получаем
(386)
(387)
где Q0 и члены, содержащие const, вошли в новые постоянные K1 и K2.
Для катодной поляризации металла, т.е. при сдвиге потенциала металла в отрицательную сторону, когда VMe < (VMe)обр и ΔV < 0, могут быть получены аналогичным образом следующие уравнения с учетом, что работа восстановления А’ отрицательна:
Q1 = Q0 + (-αA’) = Q0 — αA’ = Q0 — α⋅Ψ⋅nF = Q0 — α(Va — Ψ1)⋅nF (388)
Q2 = Q0 — (-βA’) = Q0 + βA’ = Q0 — β⋅Ψ⋅nF = Q0 — β(Va — Ψ1)⋅nF (389)
что снова приведет нас к уравнениям (386) и (387).
Уравнения (386) и (387) справедливы для любого окислительно-восстановительного электрода и показывают зависимость скоростей электродных процессов от потенциала и строения двойного электрического слоя. При этом видно, что на скорость электродного процесса оказывает влияние только часть общего скачка потенциала, приходящаяся на плотную часть двойного электрического слоя (т.е. на зону, где протекает электрохимическая реакция), Ψ = (VMe)обр + ΔV — Ψ1.
Величины коэффициентов переноса α и β < 1, а их сумма α + β = 1. Во многих случаях α = β = 0,5. Если концентрация раствора достаточно велика, то Ψ1 ≈ 0, a Va ≈ Ψ, и уравнения (386) и (387) упрощаются. При любом значении потенциала металла VMe и имеют определенную величину:
1) если VMe = (VMe)обр, т.е. ΔV = 0, то и коррозии нет;
2) если VMe ≠ (VMe)обр, если VMe > (VMe)обр, т. е. ΔV > 0, то и идет окисление (растворение) металла; если VMe < (VMe)обр, т.е. ΔV < 0, то и идет восстановление (осаждение) ионов металла;
е. ΔV > 0, то и идет окисление (растворение) металла; если VMe < (VMe)обр, т.е. ΔV < 0, то и идет восстановление (осаждение) ионов металла;
3)при достаточно больших ΔV или
Глава 3. Уравнения поляризационных кривых
На рис. 139 сплошными линиями нанесены зависимости (386) и (387), т.е. частные анодная и катодная поляризационные кривые, а пунктирной линией — суммарная поляризационная кривая, которая пересекает ординату в точке VMe = (VMe)обр, когда . Правая ветвь этой кривой, т.е. ia = f(V), соответствует разности , а левая, т.е. iК = f(V), — разности .
Для упрощения уравнений примем Ψ1 ≈ 0.
Для достаточно больших значений поляризаций ΔV (когда , и ) можно написать следующие уравнения суммарной поляризационной кривой:
(390)
(391)
где члены, содержащие (VMe)обр, введены в новые постоянные K1 и K20.
Рис. 139. Поляризационные кривые
Рис. 140. Поляризационная кривая в координатах lg i – ΔV
Если уравнение (390) прологарифмировать:
и решить относительно поляризации, т.е. ΔV, получим
или, принимая
получим уравнение, совпадающее с эмпирическим уравнением (365):
ΔVa = a1 + b1log ia (391 а)
Так же может быть получено уравнение для катодной ветви суммарной поляризационной кривой:
или, принимая
получим уравнение, аналогичное уравнению (365):
ΔVK = a2 + b2log ik (391 б)
Уравнения (391 а) и (391 б) в координатах ΔV = f(log i) дают прямую линию (рис. 140), у которой tg α = β. Численное значение коэффициента b при α = β = 0,5 и 25 °С получаем из уравнения
140), у которой tg α = β. Численное значение коэффициента b при α = β = 0,5 и 25 °С получаем из уравнения
(392)
По опытному значению коэффициента b уравнений (391 а) и (391 б) можно, пользуясь уравнением (392), составить суждение о величине n, т.е. числе электронов, принимающих участие в элементарном процессе, ответственном за перенапряжение данного электрохимического процесса.
Для малых значений поляризаций ΔV, когда величиной обратной частной реакции пренебрегать нельзя, можно написать следующие уравнения суммарной поляризационной кривой:
(393)
(394)
Учитывая, что в условиях равновесия (когда ΔV = 0) ia = ik = i0, можно написать
(395)
(396)
Заменяя соответствующие уравнениям (395) и (396) части уравнений (393) и (394) на i0, получаем
(397)
(398)
Разлагаем экспоненты уравнений (397) и (398) в ряд, ограничиваясь двумя первыми членами ряда (что вследствие малости величины ΔV не вносит большой погрешности):
(399)
(400)
где α + β = 1
Решая уравнения (399) и (400) относительно ΔV, находим
(401)
(402)
т. е. теоретические уравнения совпадают с эмпирическим уравнением (364) для малых поляризаций (низких ia или ik).
е. теоретические уравнения совпадают с эмпирическим уравнением (364) для малых поляризаций (низких ia или ik).
Из уравнений (401) и (402) следует, что чем меньше ток обмена i0 данной электрохимической реакции, тем больше электрохимическая поляризация ΔV.
Глава 4. Диффузионная кинетика и концентрационная поляризация
Электродные процессы электрохимической коррозии металлов обязательно включают в себя, как всякий гетерогенный процесс, помимо электрохимической реакции, стадии массопереноса, осуществляемые диффузией или конвекцией: отвод продукта анодного процесса (ионов металла) от места реакции — поверхности металла, перенос частиц деполяризатора катодного процесса к поверхности металла и отвод продуктов катодной деполяризационной реакции от места реакции — поверхности металла в глубь раствора и т.п. Суммарная скорость гетерогенного процесса определяется торможениями его отдельных стадий. Если, однако, торможение одной из последовательных его стадий значительно больше других, то суммарная скорость процесса определяется в основном скоростью этой наиболее заторможенной стадии. В коррозионных процессах довольно часты случаи диффузионного или диффузионно-кинетического контроля, т.е. значительной заторможенности стадий массопереноса. В связи с этим диффузионная кинетика представляет теоретический и практический интерес.
В коррозионных процессах довольно часты случаи диффузионного или диффузионно-кинетического контроля, т.е. значительной заторможенности стадий массопереноса. В связи с этим диффузионная кинетика представляет теоретический и практический интерес.
4.1 Диффузионная кинетика в приэлектродном неподвижном слое
А.Н. Щукарев (1896 г.) на примере простейшей диффузионной кинетики растворения твердых тел в жидкостях сформулировал закон:
m = k(cн — c0)S (403)
где m — количество вещества, растворяющееся в единицу времени;
сн — концентрация насыщенного раствора;
с0 — фактическая концентрация раствора в данный момент времени;
S — величина поверхности растворяющегося тела;
k — коэффициент пропорциональности.
В дальнейшем было показано, что коэффициент k пропорционален коэффициенту диффузии вещества в жидкости kД, так что уравнение (403) для m может быть записано, по Нернсту (1904 — 1905 гг. ), в виде
), в виде
(404)
где δ — постоянная.
Согласно теории Нернста, к поверхности твердого тела прилегает тонкий слой неподвижной жидкости толщиной , в котором происходит диффузия растворяющегося вещества. За пределами этого слоя движение жидкости, увлекающей растворенное вещество, приводит к поддержанию постоянства концентрации во всем остальном объеме раствора. Толщина δ получила название толщины диффузионного слоя Нернста. Она зависит только от скорости перемещения диффундирующего вещества
δ = 1 / v n (405)
где v — скорость движения жидкости; n = 1/2 ÷ 1.
Распределение концентраций в диффузионном слое имеет линейный характер (рис. 141).
Рис. 141. Зависимость скорости движения жидкости v и концентрации раствора с от расстояния (по Нернсту)
В обычных условиях перемешивания δ = 10-2 — 10-3 см, что соответствует десяткам тысяч молекулярных слоев. Такой слой не может удерживаться молекулярными силами. Кроме того, прямые опыты показали, что на расстояниях порядка 10-5 см от твердой стенки наблюдается движение жидкости, а следовательно, линейный закон распределения концентрации теряет свое обоснование. Теория Нернста не позволяет оценить значение потока m теоретически, так как толщина δ в ней не вычисляется, поэтому теория является только качественной, а не количественной. Уравнение (404) позволяет найти значение δ, исходя из известных величин m, концентраций cн и c0 и известного коэффициента диффузии kД, а затем производить количественные расчеты.
Такой слой не может удерживаться молекулярными силами. Кроме того, прямые опыты показали, что на расстояниях порядка 10-5 см от твердой стенки наблюдается движение жидкости, а следовательно, линейный закон распределения концентрации теряет свое обоснование. Теория Нернста не позволяет оценить значение потока m теоретически, так как толщина δ в ней не вычисляется, поэтому теория является только качественной, а не количественной. Уравнение (404) позволяет найти значение δ, исходя из известных величин m, концентраций cн и c0 и известного коэффициента диффузии kД, а затем производить количественные расчеты.
Скорость диффузии в приэлектродном слое в направлении х, нормальном к поверхности электрода, дается первым законом Фика:
(406)
где — градиент концентрации;
S = SMe — сечение потока диффузии, равное площади электрода.
Учитывая, что , и полагая S = 1 см2, можно получить удельную скорость диффузии:
(407)
Если принять, по Нернсту, линейное изменение концентрации, можно уравнение (407) записать следующим образом:
(408)
Рис. 142. Распределение эквивалентной концентрации катионов (ck), анионов (ca) и электролита в целом с вблизи поверхности электрода
142. Распределение эквивалентной концентрации катионов (ck), анионов (ca) и электролита в целом с вблизи поверхности электрода
При толщине диффузионного слоя δ (расстояние, на котором с претерпевает линейное изменение от c0 до с — рис. 142) и разности концентраций c0 — c, предполагая молекулярную диффузию в слое толщиной δ и конвективный перенос в остальном объеме электролита, получим следующее уравнение:
(409)
Если m — число грамм-ионов, перенесенных диффузией к (или от) 1 см2 поверхности электрода, то для плотности тока, которая может поддерживаться диффузией, можно написать следующее уравнение:
(410)
где n — число электронов на одну частицу, молекулу или ион реагирующего вещества, исчезающих (или освобождающихся) при электродном процессе.
Если в это уравнение подставить значение dm/dx из уравнения (409), получим
(411)
При выводе уравнения (411) предполагали, что вещество, в том числе и ионы, подводится к электроду только диффузией; однако часть ионов может доставляться к электроду нормальным процессом переноса в электрическом поле — миграцией. Если, например, n+ — число переноса разряжающегося катиона в пределах диффузионного слоя, то удельная скорость, с которой ионы подводятся миграцией к электроду, равна n+i/nF. В стационарном состоянии скорость переноса ионов равна сумме скоростей диффузии и миграции, так что
Если, например, n+ — число переноса разряжающегося катиона в пределах диффузионного слоя, то удельная скорость, с которой ионы подводятся миграцией к электроду, равна n+i/nF. В стационарном состоянии скорость переноса ионов равна сумме скоростей диффузии и миграции, так что
откуда
(411 а)
Заменив множитель в уравнении (411 а) на k, получим i = k(c0 — с).
Наибольший (предельный) диффузионный ток наблюдается, когда с ≈ 0 (например, когда каждый приближающийся к электроду ион немедленно вступает в электрохимическую реакцию):
(412)
или для ионов (например, катионов), переносимых, помимо диффузии, частично и миграцией:
(412 а)
где iД — предельная диффузионная плотность тока.
При проведении расчетов по диффузионной кинетике особое внимание следует обратить на соответствие размерности всех входящих в уравнение величин, в частности, на размерность концентрации, которая при размерности kД см2/с, δ см должна быть выражена в г-моль или г⋅ион/см3.
Конвективная диффузия (диффузия в движущейся жидкости)
Движение жидкости относительно электрода стабилизирует толщину диффузионного слоя δ и делает ее меньше, что соответствует конвективной диффузии, т.е. диффузии в движущейся жидкости. Увеличение скорости перемещения жидкости приводит к ускорению диффузии. Теория диффузии в движущейся жидкости разрабатывалась в работах ряда исследователей (Д.А. Франк-Каменецкого, Эйкена, В.Г. Левича) и была сформулирована В.Г. Левичем[7 сноска.
Из гидродинамики известно, что скорость жидкости, обтекающей твердую поверхность, только в непосредственной близости от нее равна нулю, а далее постепенно возрастает и достигает величины, свойственной потоку жидкости (рис. 143). Этот слой жидкости с постепенно нарастающей от нуля до v0 скоростью движения, толщиной П, называют граничным слоем Прандтля.
Из гидродинамической теории следует, что толщина граничного слоя Прандтля зависит от скорости движения жидкости относительно твердого тела v0 и кинематической вязкости жидкости v . Кроме того, эта толщина зависит от расстояния рассматриваемой точки х от точки набегания струи на плоский электрод (рис. 144). По мере увеличения этого расстояния х толщина П возрастает, согласно уравнению
Кроме того, эта толщина зависит от расстояния рассматриваемой точки х от точки набегания струи на плоский электрод (рис. 144). По мере увеличения этого расстояния х толщина П возрастает, согласно уравнению
(413)
до какого-то расстояния х, после чего она стабилизируется т.е. П = Const.
Рис. 143. Распределение скорости движения жидкости вблизи поверхности твердого тела
Рис. 144. Изменение толщины граничного слоя Прандтля вдоль поверхности пластинки, обтекаемой жидкостью
Перенос вещества в движущейся жидкости обусловлен двумя разными механизмами:
1) при наличии разности концентраций в жидкости возникает молекулярная диффузия, т.е. самопроизвольное выравнивание концентрации;
2) частицы растворенного в жидкости вещества увлекаются последней в процессе ее движения (конвекции) и переносятся вместе с ней.
Совокупность обоих этих процессов называют конвективной диффузией вещества в жидкости.
На рис. 145 показаны конвекционные потоки, возникающие в называемой обычно неподвижной (неперемешиваемой) теплой воде вследствие охлаждения последней возле стенок сосуда, что делает ее более тяжелой и заставляет опускаться вниз, а на ее место поступает более теплая вода из центральной части сосуда. Это самоперемешивание неподвижной жидкости можно наблюдать, если в ней имеются пылинки или другие мелкие частицы (например, волоски ваты) при пропускании через сосуд яркого света, например солнечного. При приближении температуры общей массы воды к комнатной эти конвекционные потоки ослабевают, но поддерживаются за счет охлаждения воды ее испарением с поверхности (скрытая теплота испарения воды Qисп = 539 кал/г). Если в сосуде не вода, а раствор, то вследствие испарения воды с поверхности происходит дополнительное (помимо охлаждения) утяжеление его поверхностного слоя в результате изменения концентрации, сопровождающееся опусканием вниз. Все это снижает воспроизводимость результатов опытов по диффузии в неподвижных растворах из-за непостоянства толщины граничного слоя Прандтля жидкости у поверхности твердого тела (электрода) и толщины части ее, называемой диффузионным слоем.
Все это снижает воспроизводимость результатов опытов по диффузии в неподвижных растворах из-за непостоянства толщины граничного слоя Прандтля жидкости у поверхности твердого тела (электрода) и толщины части ее, называемой диффузионным слоем.
Более воспроизводимые результаты получаются для перемешиваемой с определенной контролируемой скоростью жидкости и, в частности, для вращающегося дискового электрода, для которого и была в первую очередь сформулирована теория конвективной диффузии.
Рис. 145. Конвекционные потоки в неподвижной теплой воде
Рис. 146. Распределение концентрации и касательная слагающая скорости движения жидкости у поверхности твердого тела
В объеме жидкого электролита с постоянной концентрацией перенос вещества осуществляется конвекцией, т.е. движением жидкости. При наличии градиента концентрации в слое жидкости становится возможным перенос молекулярной диффузией.
Таким образом, в граничном слое Прандтля при наличии в нем градиента концентрации массоперенос осуществляется двумя разными параллельно протекающими путями. Суммарная скорость процесса массопереноса определяется скоростью протекания каждого элементарного процесса переноса. Если, однако, торможение одного из этих параллельных процессов значительно меньше торможения другого, то суммарная скорость массопереноса определяется в основном скоростью этого наименее заторможенного, т.е, быстрого, процесса переноса. Скорость конвективного массопереноса в граничном слое Прандтля снижается по мере уменьшения скорости движения v в нем жидкости (см. рис. 143) и его роль в определении суммарной скорости массопереноса тоже уменьшается, а роль молекулярной диффузии возрастает. Начиная с какого-то расстояния от твердой поверхности δ молекулярный перенос вещества становится преобладающим по сравнению с конвективным переносом, который преобладает в части слоя Прандтля (П — δ).
Таким образом, диффузионный слой, являющийся частью слоя Прандтля, не неподвижный, а движущийся с уменьшающейся до нуля скоростью, но массоперенос в нем осуществляется в основном за счет молекулярной диффузии, которая значительно превосходит массоперенос за счет конвекции (движения) жидкости, т. е. это область наиболее резкого изменения концентрации вещества (рис. 146).
е. это область наиболее резкого изменения концентрации вещества (рис. 146).
Теория конвективной диффузии учитывает молекулярную диффузию, идущую как поперек слоя, так и в тангенциальном направлении, вдоль него, и дает для толщины диффузионного слоя следующее уравнение:
(414)
где Рr = v/kД — безразмерное число Прандтля, которое у воды и сходных с ней жидкостей равно примерно 103, а в вязких жидкостях достигает значения порядка 106 и более.
Таким образом, при Рr ≈ 103 толщина диффузионного пограничного слоя составляет примерно десятую часть слоя Прандтля. Поэтому, как следует из теории, касательная, слагающая скорости движения жидкости на границе диффузионного пограничного слоя составляет около 10 % значения скорости движения жидкости вдали от твердой поверхности.
Комбинируя уравнения (413) и (414), получаем
(415)
Расчеты показывают, что в пределах диффузионного пограничного слоя концентрация раствора быстро изменяется (см. рис. 146). В первом приближении закон изменения концентрации можно считать линейным (т.е. ~ dc/dx = Δс/δ). Поэтому уравнение для диффузионного потока m на единицу поверхности электрода можно приближенно представить в следующем виде:
рис. 146). В первом приближении закон изменения концентрации можно считать линейным (т.е. ~ dc/dx = Δс/δ). Поэтому уравнение для диффузионного потока m на единицу поверхности электрода можно приближенно представить в следующем виде:
(416)
т.е. в таком же виде, как и в теории Нернста [уравнение (404)], но δ в нем является вполне определенной функцией свойств жидкости и скорости ее движения, а также коэффициента диффузии, т.е. зависит от природы диффундирующего вещества. В случае, когда диффундирует одновременно несколько веществ, при данных условиях перемешивания одновременно существует несколько пограничных слоев. Кроме того, по зависимости δ от kД (414) диффузионный поток пропорционален не kД, а kД2/3.
При зависимости коэффициента диффузии от кинематической вязкости
(416)
диффузионный поток данного сорта частиц в растворах с различной вязкостью изменяется как l/v5/6. Зависимость диффузионного потока m от температуры дается уравнением
Зависимость диффузионного потока m от температуры дается уравнением
(417)
где Qv — энергия активации для вязкости жидкости.
Соответственно температурная зависимость δ дается уравнением
(418)
а зависимость толщины слоя Прандтля П от угловой скорости вращения ω дискового электрода — уравнением
(419)
Уравнения для смешанной кинетики (диффузионно-кинетического контроля процесса) имеют более сложный вид.
Так как толщина диффузионного слоя δ зависит от расстояния х до переднего края обтекаемой потоком жидкости пластинки [см. рис. 146 и уравнение (415)], различные точки этой пластинки не равнодоступны в диффузионном отношении (рис. 147): тангенциальный перенос вещества движущейся жидкостью весьма существенно увеличивает эффективность диффузионного потока, который у переднего края пластинки больше, чем у заднего.
Рис. 147. Диффузионный поток m на различных расстояниях х от края пластинки
При постоянном режиме перемешивания, диффузии определенных частиц и постоянной температуре толщина диффузионного слоя δ = Const; при этом изменение концентрации в диффузионном слое, как указывалось выше, почти линейно, что делает приемлемым уравнение (404).
4.2 Концентрационная поляризация
Замедленность диффузионной стадии электрохимического процесса приводит, как это отмечалось выше (см. с. 196), к возникновению концентрационной поляризации, значение которой для неконцентрированных растворов можно представить уравнением, соответствующим э.д.с. концентрационного элемента:
(420)
где с — концентрация диффундирующего вещества вблизи поверхности корродирующего металла;
c0 — то же, в объеме раствора.
Согласно уравнению (411), можно написать для смешанного диффузионно-кинетического и чисто диффузионного (с ≈ 0) контролей следующие уравнения:
(421)
(422)
где iД — предельная диффузионная плотность тока.
Находим из этих уравнений значения c0 и c:
и, подставляя их в уравнение (420), получаем для неконцентрированных растворов уравнение
(423)
График этой зависимости приведен на рис. 148.
148.
Рис. 148. Зависимость концентрационной поляризации от плотности тока
Концентрационная поляризация всегда имеет место при электрохимических электродных процессах, увеличивая значение поляризации данного процесса на меньшую или большую величину (ΔV > ΔVэ = х), а часто (при высоких, близких к iД плотностях тока) определяет суммарную скорость процесса (диффузионный контроль процесса).
4.3 Смешанная поляризация
Если заторможенности электродной реакции и диффузии соизмеримы, то суммарная скорость электрохимического процесса будет зависеть от обеих этих стадий (смешанный диффузионно-кинетический контроль), т. е. поляризация процесса будет смешанной. Этот случай поляризации будет рассмотрен в дальнейшем на широко распространенном примере кислородной деполяризации (см. с. 240).
Глава 5. Вторичные процессы и продукты электрохимической коррозии металлов и их влияние на поляризацию
Анодная реакция ионизации металла (271)
Me + mH2О = Меn + mН2О + nе
и катодная реакция ассимиляции электронов, например реакция кислородной деполяризации (342)
О2 + 4е + 2Н2О = 4ОН —
являются первичными процессами электрохимической коррозии металлов, а их продукты (Меn + mН2О и ОН —) — первичными продуктами коррозии.
При электрохимической коррозии металлов наряду с первичными процессами возможно протекание вторичных процессов — взаимодействие первичных продуктов коррозии друг с другом или с электролитом и растворенными в нем газами с образованием пленок вторичных трудно растворимых продуктов коррозии.
Рис. 149. Образование вторичного продукта коррозии цинка в водном растворе NaCl:
а – осадка Zn(OH)2 при работе гальванической пары Zn-Cu;
б – пленки Zn(OH)2 в месте контакта Zn-Cu и осадка;
в – пленки Zn(OH)2 при работе микропар Zn-Cu
Так, ионы многих металлов (Al, Fe, Mg, Ni и др.) при определенных значениях рН среды образуют труднорастворимые гидраты окислов (рис. 149):
Меn + mН2О + nОН — = mH2О + Me(OH)n ↓ (424)
В табл. 30 приведены значения рН начала осаждения гидроокисей металлов.
Таблица 30 — рН начала осаждения гидроокисей металлов (по Бриттону)
| Me(OH)n | pH | Me(OH)n | pH | Me(OH)n | pH | Me(OH)n | pH |
| Fe(OH)3 | 2 | Pb(OH)2 | 5.0 | Fe(OH)2 | 5.5 | Ni(OH)2 | 8.0 |
| Zr(OH)2 | 2 | Zn(OH)2 | 5. 2 2 | Be(OH)2 | 5.7 | Mn(OH)2 | 8.5 — 8.7 |
| Sn(OH)2 | 3 | Cr(OH)3 | 5.3 | Cd(OH)2 | 6.7 | AgOH | 9.0 |
| Al(OH)3 | 4.1 | Cu(OH)2 | 5.3 | Co(OH)2 | 7.5 — 8.0 | Mg(OH)2 | 10.5 |
Железо в фосфорнокислых средах образует труднорастворимый фосфат:
3Fe 2+ + 2РО43- = Fe3(PO4)2 ↓ (425)
Свинец в растворах H2SО4 и ее солей образует нерастворимый сульфат:
Pb 2+ + SO42- = PbSO4 ↓ (426)
Железо с крепкой (70 %-ной) H2SО4 образует нерастворимый в ней сульфат:
Fe 2+ + SO42- = Fe2SO4 ↓ (427)
Железо и магний в крепких растворах HF образуют нерастворимые в HF фториды:
Fe 2+ + 2F — = FeF2 ↓ (428)
Mg 2+ + 2F — = MgF2 ↓ (429)
Вторичные продукты коррозии металлов могут претерпевать дальнейшие изменения.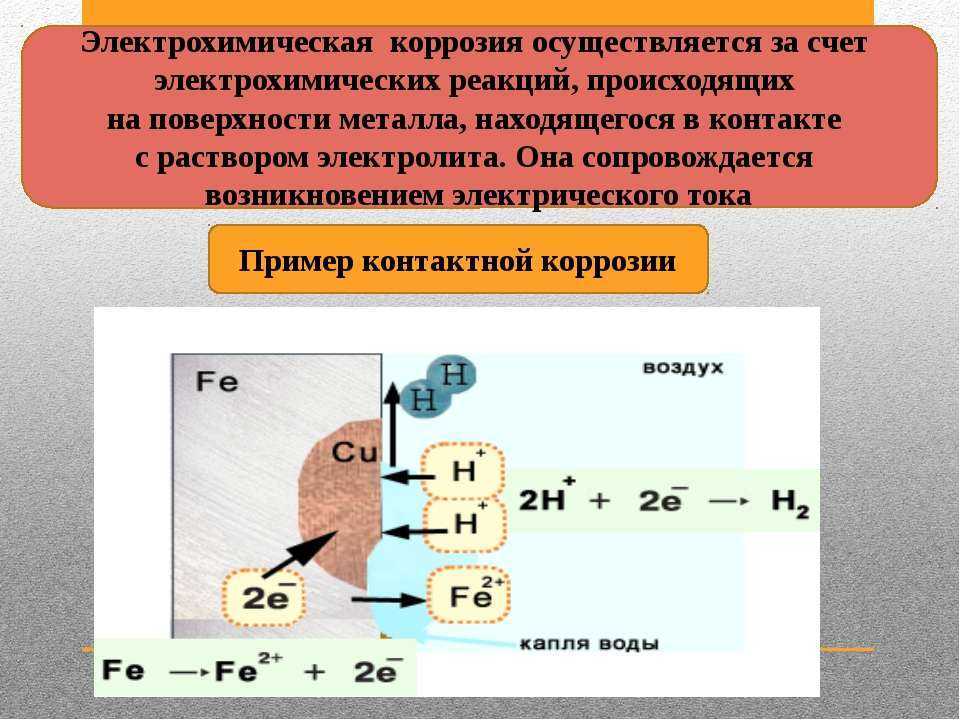 Так, железо при коррозии в средах с рН > 5,5 образует труднорастворимый в воде вторичный продукт коррозии — гидрат закиси железа белого цвета:
Так, железо при коррозии в средах с рН > 5,5 образует труднорастворимый в воде вторичный продукт коррозии — гидрат закиси железа белого цвета:
Fe 2+ + mН2О + 2ОН — = mH2О + Fe(OH)2 ↓ (430)
который, взаимодействуя с растворенным в электролите кислородом, образует еще более труднорастворимый гидрат окиси железа бурого цвета:
2Fe(OH)2 + ½ О2 + H2О = 2Fe(OH)3 ↓ (431)
Эти вторичные продукты коррозии железа [Fe(OH)2 и Fe(OH)3] могут претерпевать дальнейшие превращения с образованием сложных гидратированных окислов FeO ⋅ Fe2O3 ⋅ nН2O — ржавчины.
При коррозии алюминия имеет место вторичный процесс:
Al 3+ + mН2О + 3ОН — = mH2О + Al(OH)3 ↓ (при рН ≥ 4) (432)
а в некоторых случаях — дальнейшее изменение гидрата окиси алюминия:
2Al(OH)3 = 3H2О + Al2O3 (433)
Пленки вторичных труднорастворимых продуктов коррозии металлов обладают большими или меньшими защитными свойствами и часто придают металлу повышенную коррозионную стойкость (Аl и Zn в нейтральных растворах, Рb в H2SО4, Fe и Mg в крепкой HF и пр. ). Ржавчина на стали также обладает некоторыми защитными свойствами (рис. 150).
). Ржавчина на стали также обладает некоторыми защитными свойствами (рис. 150).
Рис. 150. Влияние частоты n удаления продуктов коррозии на среднюю скорость коррозии низкоуглеродистой стали Km— за 200 ч в неперемешиваемом нейтральном 1 %-ном растворе NaCl при 23 °C
Пленки вторичных труднорастворимых продуктов коррозии заметно затрудняют диффузионные процессы (толщина таких пленок является часто дополнительной толщиной диффузионного слоя), увеличивая их роль в общем торможении процесса и способствуя часто наступлению диффузионного контроля процесса.
Глава 6. Анодный процесс электрохимической коррозии металла
Как уже говорилось, электрохимическое саморастворение (коррозия) металла является сложным процессом, но собственно коррозия (растворение) реализуется в анодном процессе ионизации металла.
Глава 7. Анодная реакция ионизации металла
По Нернсту (1890 г.), реакция ионизации металла в электролитах выглядит следующим образом:
Me = Ме n+ + nе (434)
Нернст полагал, что электродный потенциал металла возникает в результате обмена ионами между металлом и раствором, но в качестве движущих сил этого обмена ионами Нернстом были приняты электролитическая упругость растворения металла P и осмотическое давление растворенного вещества π. На этой основе им была создана качественная картина возникновения скачка потенциала на границе металл-раствор и количественная зависимость величины скачка этого потенциала для металлических электродов первого рода от концентрации раствора. Из теории Нернста, в частности, следовал вывод о независимости стандартных («нормальных») потенциалов электродов от природы растворителя, поскольку величина электролитической упругости растворения P, определяющая нормальный (или стандартный) потенциал металла, не являлась функцией свойств растворителя, а зависела только от свойств металла.
На этой основе им была создана качественная картина возникновения скачка потенциала на границе металл-раствор и количественная зависимость величины скачка этого потенциала для металлических электродов первого рода от концентрации раствора. Из теории Нернста, в частности, следовал вывод о независимости стандартных («нормальных») потенциалов электродов от природы растворителя, поскольку величина электролитической упругости растворения P, определяющая нормальный (или стандартный) потенциал металла, не являлась функцией свойств растворителя, а зависела только от свойств металла.
В 1914 г. Л.В. Писаржевским было дано новое толкование электродных процессов, позволившее заменить формальную схему осмотической теории Нернста реальной физической картиной. Несколько позже (1926 г.) аналогичные идеи высказаны Н.А. Изгарышевым и А.И. Бродским. По Л.В. Писаржевскому, причинами перехода ионов металла в раствор являются диссоциация атомов металла на ионы и электроны и стремление образовавшихся ионов сольватироваться, т. е. вступать в соединение с растворителем. Необходимо, следовательно, учитывать два равновесия: одно — между атомами металла и продуктами его распада (ионы и электроны) и другое — при сольватации (в водных растворах — гидратации). Таким образом, потенциал металла, погруженного в раствор, зависит от обоих процессов и состоит из двух слагаемых, одно из которых зависит от свойств металла, а второе — от свойств как металла, так и растворителя. Эти новые взгляды, основанные на электронных представлениях, качественно совпадают с современными представлениями, которые, таким образом, были предвосхищены Л.В. Писаржевским задолго до квантовой механики, статистики, Ферми и других современных теоретических методов.
е. вступать в соединение с растворителем. Необходимо, следовательно, учитывать два равновесия: одно — между атомами металла и продуктами его распада (ионы и электроны) и другое — при сольватации (в водных растворах — гидратации). Таким образом, потенциал металла, погруженного в раствор, зависит от обоих процессов и состоит из двух слагаемых, одно из которых зависит от свойств металла, а второе — от свойств как металла, так и растворителя. Эти новые взгляды, основанные на электронных представлениях, качественно совпадают с современными представлениями, которые, таким образом, были предвосхищены Л.В. Писаржевским задолго до квантовой механики, статистики, Ферми и других современных теоретических методов.
С учетом идей Л.В. Писаржевского, П.А. Изгарышева и других реакция ионизации металла в электролитах в общем ее виде стала выглядеть применительно к водным растворам следующим образом (271):
Me + mH2О = Ме n + mH2О [или Ме n+ (водн)] + nе
По теории необратимых (стационарных) электродных потенциалов металлов А. Н. Фрумкина (см. с. 176), электрохимическое саморастворение (коррозия) металла является результатом нарушения равновесного обмена катионами между металлом и раствором:
Н. Фрумкина (см. с. 176), электрохимическое саморастворение (коррозия) металла является результатом нарушения равновесного обмена катионами между металлом и раствором:
и протекает со скоростью , которая в случаях, когда , становится приближенно равной скорости частной анодной реакции, т.е. .
Глава 8. Анодные реакции, протекающие с участием металла и водного расствора
Все анодные реакции, протекающие с участием металла и водного раствора, не содержащего комплексообразующих или осаждающих анионов (за исключением иона гидроксила), можно представить в виде одного из следующих общих уравнений:
Me = Ме n+ (водн) + nе (435)
Me + nH2O = Me(ОН)n(т) ↓ + nН + + nе (436 а)
Me + nOH — = Me(ОН)n(т) ↓ + nе (436 б)
Me + nH2O = MeOnn-(водн) + 2nН + + nе (437 а)
Me + nOH — = MeOnn-(водн) + nН + + nе (437 б)
где Ме n+ (водн. ) и МеOnn- (водн.) — растворимые в воде катионы и соответственно оксианионы, ассоциированные с соответствующим числом молекул воды;
) и МеOnn- (водн.) — растворимые в воде катионы и соответственно оксианионы, ассоциированные с соответствующим числом молекул воды;
Me(OH)n (т) — слаборастворимая твердая гидроокись, способная гидратироваться или терять молекулы воды с образованием мономерных или полимерных окислов или гидроокислов.
Аналогичный вид имеют уравнения для гидроксиокислов и оксианионов металла, содержащих гидроксильные группы. Каждые два процесса, представленные уравнениями (436 а) и (436 б), а также (437 а) и (437 б), с термодинамической точки зрения идентичны, за исключением выбора стандартных состояний, хотя они предполагают различные пути протекания реакций. Во всех случаях уравнения описывают процессы в общем виде без детального рассмотрения промежуточных механизмов.
Для многих металлов электродные потенциалы полуэлементов в которых осуществляются обратимые реакции, соответствующие процессам (435)-(437 б), измерены или вычислены из других термодинамических величин.
Данные об этих реакциях, а также растворимости анионов и гидроокисей были представлены в виде равновесных диаграмм зависимости изменения потенциала электродов и растворимости твердых фаз от рН раствора: для железа — Пурбе (1938 г.), а для меди — А.И. Шултиным (1941 г.). Пурбе и его школа собрали, оценили и сопоставили такие данные для многих металлов и составили соответствующие диаграммы — диаграммы Пурбе 1.
Глава 9. Участие анионов в анодном процессе
Зависимость скорости коррозии металлов в растворах кислот не только от рН, но и от природы кислоты (рис. 156) наталкивала исследователей на мысль о том, что анионы кислот принимают непосредственное участие в этом процессе, влияя на его скорость.
Рис. 156. Зависимость скорости растворения цинка от концентрации различных кислот
Впервые эта мысль была сформулирована Центнершвером (в 1928 г.) для объяснения зависимости скорости растворения v кадмия от концентрации соляной кислоты:
v = kc 4 HCl (440)
как взаимодействие поверхностных атомов металла и хлор-ионов с образованием комплексного аниона:
Cd + 4Сl — = (CdCl4 ) 2- + 2e (441)
скорость которого определяет скорость процесса растворения кадмия. Аналогичные представления были развиты Питчем и сотрудниками (1931 г.), согласно которым коррозионный процесс начинается с адсорбции ионов или молекул среды на наиболее энергетически выгодных местах поверхности металла
Аналогичные представления были развиты Питчем и сотрудниками (1931 г.), согласно которым коррозионный процесс начинается с адсорбции ионов или молекул среды на наиболее энергетически выгодных местах поверхности металла
Zn + SO42- = ZnSO42- (адc)
Zn + H3O + = ZnH3O + (адc) (442)
с образованием комплексных соединений, которые затем претерпевают дальнейшие превращения:
ZnSO42- (адc) = ZnSO4 + 2e
2Zn⋅H3O+ (адc) + 2e = 2Zn + H2↑ + 2H2O (443)
Б.В. Эршлер (1940-1944 гг.) также пришел к выводу об участии хлор-ионов в процессе анодного растворения платины в водных растворах хлоридов, а Б.Н. Кабанов и Д.И. Лейкис (1946 г.) установили, что при анодном растворении железа в щелочах происходит адсорбция ионов ОН — по реакции
Fe + ОН — ↔ Fe(OН)адс + е (444)
которая, по Б. Н. Кабанову, Р.X. Бурштейн и А.Н. Фрумкину (1947 г.), идет быстро и сопровождается последующими стадиями:
Н. Кабанову, Р.X. Бурштейн и А.Н. Фрумкину (1947 г.), идет быстро и сопровождается последующими стадиями:
Fe(OН)адс + ОН — → FeOадс + H2O + е (445)
FeO (адс) + ОН — ↔ HFeO2— (446)
из которых замедленной (→) является стадия (445), а стадия (446) проходит, как и стадия (444), быстро (↔).
З.А. Иофа и Л.А. Медведева (1949 г.) установили, что адсорбция ионов иода на поверхности железа замедляла реакции ионизации атомов металла и разряда водородных ионов при растворении железа в растворах НС1, а Я.М. Колотыркин и Л.А. Медведева (1955 г.) отметили непосредственное участие иод-иона в процессе растворения кадмия в растворах иодидов Геришером было доказано (1953 г.), что в большинстве случаев анодное растворение амальгам, а также твердых металлов протекает через образование комплексов металла с анионами и другими компонентами раствора непосредственно в электрохимической стадии. Последующие работы в этой области Бонгоффера, Хойслера, В.В. Лосева, Бокриса, Кристиансена, Я.М. Колотыркина с сотрудниками, Я.Д. Зытнера и А.Л. Ротиняна, Л.И. Антропова и других развили представление о растворении металлов по механизму комплексообразования, причем эти комплексы анионов с металлом могут быть промежуточными, которые затем распадаются на простые ионы или продукты гидролиза, т.е. часто имеет место каталитический механизм.
Последующие работы в этой области Бонгоффера, Хойслера, В.В. Лосева, Бокриса, Кристиансена, Я.М. Колотыркина с сотрудниками, Я.Д. Зытнера и А.Л. Ротиняна, Л.И. Антропова и других развили представление о растворении металлов по механизму комплексообразования, причем эти комплексы анионов с металлом могут быть промежуточными, которые затем распадаются на простые ионы или продукты гидролиза, т.е. часто имеет место каталитический механизм.
Согласно современным воззрениям, обобщенным Я.М. Колотыркиным (1962 г.), анодное растворение металлов идет через образование комплекса металла с ионами (или другими компонентами раствора) в несколько последовательных стадий, из которых одна (или иногда две) определяет скорость всего процесса (→), в то время как остальные протекают быстро(↔):
1) специфическая адсорбция анионов на поверхности металла
Ме + mА — = (МеАm) m- (адс) (447)
2) электрохимическая стадия, определяющая скорость всего процесса — переход комплекса в раствор:
(МеАm) m- (адс) → (МеАm) (m-n) (водн) + nе (448)
3) распад комплекса на простые ионы (или продукты гидролиза):
(МеАm) (m-n) = Ме n+ (водн) + mA — (водн) (449)
Ускоряющее действие аниона имеет место по достижении определенной концентрации cкр, которая зависит от природы металла и аниона.
Глава 10. Стадийность реакций растворения металлов
Образование многозарядного иона Ме n+ из металла Me при его растворении может происходить не в одну стадию
Me = Ме n+ (водн) + nе
а путем последовательного отщепления электронов, т.е. в несколько последовательных стадий:
Me = Ме + (водн) + е (477)
Me + (водн) = Ме 2+ (водн) + е (478)
Me (n-1)+ (водн) = Ме n+ (водн) + е (479)
При этом не исключена возможность вступления части ионов промежуточной валентности в химические реакции с компонентами раствора, например:
Me m+ (водн) + (n — m)⋅Н + (водн) = Me n+ (водн) + (n — m) / 2 ⋅ Н2 (480)
без затраты электрического тока, с чем может быть связан повышенный выход процесса по току и отклонение эффективной валентности от величины n.
Рис. 157. Зависимость эффективной валентности nи от потенциала при различных концентрациях HClO4:
1 — 3⋅10 -3 м.;
2- 1⋅10 -2 м.;
3 — 5⋅10 -2 м.;
4 — 0,2 м.;
5 — 1 м.;
6 — 0,05 м. HClO4 + NaCl
[1] Томашов Н. Д. Теория коррозии и защиты металлов. М., Изд-во АН СССР, 1959. 591 с. с ил.; Батраков В.П. — В кн.: Коррозия и защита металлов. М., Оборонгиз, 1962, с. 33-81.
[2] Кинетика электродных процессов. М., Изд-во МГУ, 1952, с. 303 Авт.: А.Н. Фрумкин, В.С. Багоцкий, 3.А. Иофа, Б.Н. Кабанов.
[3] Там же, с. 307.
[4] Кинетика электродных процессов. М., Изд-во МГУ, 1952. с. 279 Авт.: А.Н. Фрумкин, В.С. Багоцкий, 3.А. Иофа, Б.Н. Кабанов.
[5] Колотыркин Я.М. — «Защита металлов», 1967, т. 3, № 6, с. 667—678.
[6] Скорчеллетти В.В. Теоретические основы коррозии металлов, Л., «Химия», 1973. 263 с. с ил.
[7] Левич В.Г. Физико-химическая гидродинамика. М., Изд-во АН СССР, 1952, 537 с. с ил.
М., Изд-во АН СССР, 1952, 537 с. с ил.
Страница не найдена — Инженерная практика
Свежий выпуск: №
04/2022
Популярное в этом месяце
Публикации автора на сайте журнала «Инженерная практика»
БЕЛОВ Петр Васильевич, ООО «Лайтор»
Внутритрубная диагностика трубопроводов с внутренним покрытием и втулками защиты сварного шва
ГУБАЙДУЛЛИН Марат Наилевич, ООО «ИНТРОН ВТД»АЙДУГАНОВ Дмитрий Николаевич, ООО «Инженерно-производственный центр»
Применение трубопроводов из альтернативных материалов на месторождениях ООО «ИНК». Результаты применения. Анализ, перспективы развития
Результаты применения. Анализ, перспективы развития
МАКСИМОВ Геннадий Львович, ООО «Иркутская нефтяная компания»ПРОМАХОВ Василий Александрович, ООО «Иркутская нефтяная компания»ФЕДОТОВА Анна Владимировна, АО «Трубодеталь»ПЕРОВ Кирилл Алексеевич, ООО «Иркутская нефтяная компания»
Оценка необходимости актуализации и разработки нормативной базы в части применения защитных покрытий
ПОЛЯКОВА Елена Ивановна, ФГБУ Научно-исследовательский институт проблем хранения РосрезерваКУГАЙ Мария Александровна, ФГБУ Научно-исследовательский институт проблем хранения РосрезерваШЕВЧУК Тамара Петровна, ФГБУ Научно-исследовательский институт проблем хранения Росрезерва
Автономный актив. Отдельные элементы и перспективы развития
Отдельные элементы и перспективы развития
КУЗЬМИН Максим Игоревич, ООО «Газпромнефть НТЦ»ГРЕХОВ Иван Викторович, ООО «Газпромнефть НТЦ»ГЕРАСИМОВ Ростислав Владимирович, ООО «Газпромнефть НТЦ»
Ближайшие совещания
Отраслевая техническая Конференция
СЕРВИС-2022. Эффективный нефтесервис Российских нефтегазодобывающих компаний. Развитие отечественного технологического потенциала. Новые отраслевые вызовы
4-6 октября 2022 г. , г. Когалым
, г. Когалым
Ближайшие тренинги
Семинар-практикум
Защитные антикоррозионные покрытия 2022. Эффективные методы применения защитных покрытий в нефтедобыче
25-27 октября 2022 г., г. Самара
Тренинг-курс
Ловильный сервис на нефтяных и газовых скважинах
14-18 ноября 2022 г. , г. Пермь
, г. Пермь
электрохимическая коррозия, химическая коррозия, катодная коррозия, атмосферная коррозия, газовая коррозия и др.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму процесса различают химическую и электрохимическую коррозию металлов.
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
По виду коррозионной среды и условиям протекания различают несколько видов коррозии.
Газовая коррозия — это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1%) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д.
Атмосферная коррозия — это коррозия металлов в атмосфере воздуха или любого влажного газа.
Подземная коррозия — это коррозия металлов в почвах и грунтах.
Биокоррозия — это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов.
Контактная коррозия — это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите.
Радиационная коррозия — это коррозия, обусловленная действием радиоактивного излучения.
Коррозия внешним током и коррозия блуждающим током. В первом случае — это коррозия металла, возникающая под воздействием тока от внешнего источника. Во втором случае — под воздействием блуждающего тока.
Коррозия под напряжением — коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Это очень опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки (оси, рессоры, автоклавы, паровые котлы, турбины и т.д.). Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов.
Коррозионная кавитация — разрушение металла, обусловленное одновременным коррозионным и ударным воздействием внешней среды.
Фреттинг-коррозия — это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает с одинаковой скоростью по всей поверхности металла, и неравномерной когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
При избирательной коррозии разрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней.
Местная (локальная) коррозия охватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв — разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек (питтингов), глубоко проникающих в металл.
Первый вид наблюдается, например, при коррозии латуни в морской воде. Язвенная коррозия отмечена у сталей в грунте, а питтинговая — у аустенитной хромоникелевой стали в морской воде.
Подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий.
Межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия вызывает разрушение металла под прокладками, в зазорах, резьбовых креплениях и т.д.
Коррозия металлов и способы защиты от неё
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях.Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.
Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.

Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.
Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.
К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.
Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т. д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Механизм коррозии – обзор
ScienceDirect
РегистрацияВход
Механизмами коррозии, имеющими особое значение для механической стабильности, являются науглероживание (осаждение углерода на поверхности и в сплаве) и обезуглероживание (потеря углерода из сплава).
Источник: Конструкционные материалы для ядерных реакторов поколения IV, 2017 г.
PlusAdd to Mendeley
Заки Ахмад, Принципы коррозионной инженерии и борьбы с коррозией, 2006 г.
4.2.8 МЕХАНИЗМ РАВНОМЕРНОЙ КОРРОЗИИ
Механизм коррозии в водном растворе достаточно хорошо продемонстрирован. При атмосферной коррозии, которая также является примером равномерной коррозии, присутствует очень тонкий слой электролита. Вероятно, лучше всего это продемонстрировать, поместив небольшую каплю морской воды на кусок стали. При сравнении атмосферной коррозии с водной коррозией наблюдаются следующие отличия:
На поверхности металла, подвергающегося воздействию атмосферы, присутствует лишь ограниченное количество воды и растворенных ионов, тогда как доступ кислорода, присутствующего в воздухе, неограничен [1]. ]. Продукты коррозии образуются близко к поверхности металла, в отличие от водной коррозии, и они могут предотвратить дальнейшую коррозию, действуя как физический барьер между поверхностью металла и окружающей средой, особенно если они нерастворимы, как в случае с медью или свинцом. Ниже представлен упрощенный механизм водной коррозии железа (рис. 4.2):
Ниже представлен упрощенный механизм водной коррозии железа (рис. 4.2):
Рисунок 4.2. Водная коррозия железа
На анодных участках протекает анодная реакция:
(4.4)Fe→Fe+++2e
На катодных участках происходит восстановление кислорода:
(4.5)O2+2h3O+ 4e→4OH−
Ионы OH реагируют с ионами Fe ++ , образующимися на аноде:
(4.6)Fe2++2OH−→Fe(OH)2
При большем доступе к кислороду воздуха, Fe(OH) 2 окисляется до Fe(OH) 3 и позже теряет воду:
(4.7)4Fe(OH)2+O2+2h3O→4Fe(OH)3
Гидроксид железа превращается в гидратированный оксид железа или ржавчину кислородом:
(4.8)4Fe(OH)2+O2→2Fe2O3⋅ h3O+2h3O
Ржавчина (Fe 2 O 3 ·H 2 O) образуется на полпути между центром капли и периферией, которая является щелочной. Электроны текут от анода (центр капли) к катоду (периферия) в металлической цепи. Текущий поток показан на рис. 4.2. Ионы двухвалентного железа на поверхности железа растворимы, тогда как ионы в растворе окисляются кислородом до нерастворимых гидратированных оксидов трехвалентного железа, называемых 9. 0055 ржавчина. Ржавчина образуется вдали от места коррозии. Скорость коррозии очень высока, если ион двухвалентного железа быстро окисляется до оксида трехвалентного железа. Fe(OH) 3 нерастворим, и если он образуется вдали от поверхности металла, коррозионная реакция ускоряется, поскольку равновесие необходимо поддерживать за счет подачи большего количества ионов двухвалентного железа (Fe ++ ) с поверхности. Если же Fe(OH) 3 образуется на поверхности металла очень быстро, коррозия предотвращается (пассивная пленка).
0055 ржавчина. Ржавчина образуется вдали от места коррозии. Скорость коррозии очень высока, если ион двухвалентного железа быстро окисляется до оксида трехвалентного железа. Fe(OH) 3 нерастворим, и если он образуется вдали от поверхности металла, коррозионная реакция ускоряется, поскольку равновесие необходимо поддерживать за счет подачи большего количества ионов двухвалентного железа (Fe ++ ) с поверхности. Если же Fe(OH) 3 образуется на поверхности металла очень быстро, коррозия предотвращается (пассивная пленка).
Если SO 2 присутствует в качестве загрязняющего вещества, в воздухе образуется FeSO 4 (уравнения (4.1–4.3)). На коррозию железа существенно влияет присутствие растворимого сульфат-иона в растворе. Ион сульфата продолжает атаковать железо, и поверхность становится неровной и даже ямчатой. При этом образуются слои пористой ржавчины. Поскольку пористая ржавчина не обеспечивает защиты металла, коррозия продолжается. Эффект SO 2 , SO 3 и Cl − показано на рис. 4.3.
Эффект SO 2 , SO 3 и Cl − показано на рис. 4.3.
Рисунок 4.3. Влияние SO 2 и влажности на коррозию металлов. Реакция происходит в очень тонком (невидимом) водном слое. , в Тенденции исследований и технологий в области нефтегазовой коррозии, 2017
32.2.3 Внешние угрозы коррозии
Механизмы внешней коррозии во многом определяются средой, в которой установлено оборудование или трубопровод. Как правило, эти среды можно разделить на подземные, морское дно, свободное воздействие морской воды, приповерхностные подводные среды, зоны заплеска, атмосферные условия (на суше и в море) и коррозию под изоляцией. Каждая из этих широких групп может быть дополнительно разделена на подгруппы, например, для атмосферных береговых, береговых морских, береговых сельских, береговых промышленных, и даже они различаются в зависимости от климатических регионов. Восприимчивость к внешней коррозии также зависит от температуры. Срок службы покрытия может снижаться из-за условий окружающей среды, условий эксплуатации и механических повреждений. В зависимости от условий эксплуатации, внешняя защита от коррозии в основном основывается на защитных покрытиях и катодной защите (CP), где это применимо, в дополнение к поддержанию этих методов контроля коррозии. В некоторых случаях могут быть протестированы и проверены системы контроля покрытия и CP; однако для подземных трубопроводов наружная коррозия в местах дефектов или повреждений покрытия обычно обнаруживается только во время внутритрубной инспекции (ВИТ) или иногда в ходе обследований CP с короткими интервалами.
Срок службы покрытия может снижаться из-за условий окружающей среды, условий эксплуатации и механических повреждений. В зависимости от условий эксплуатации, внешняя защита от коррозии в основном основывается на защитных покрытиях и катодной защите (CP), где это применимо, в дополнение к поддержанию этих методов контроля коррозии. В некоторых случаях могут быть протестированы и проверены системы контроля покрытия и CP; однако для подземных трубопроводов наружная коррозия в местах дефектов или повреждений покрытия обычно обнаруживается только во время внутритрубной инспекции (ВИТ) или иногда в ходе обследований CP с короткими интервалами.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL-адрес: https://www.sciencedirect.com/science/article/pii/B9780081011058000322
Dr. 2018
Модель коррозии
Механизм коррозии в бетонных коллекторах обсуждался в разделе 1. 6.1, а модели скорости коррозии и уменьшения толщины стенок были представлены в виде уравнений 1.19.и 1,20 соответственно.
6.1, а модели скорости коррозии и уменьшения толщины стенок были представлены в виде уравнений 1.19.и 1,20 соответственно.
Ссылаясь на уравнение 1.20, уменьшение толщины стенки за истекшее время t , составляет:
где k — коэффициент, представляющий долю кислотной реакции, s — уклон трубы, u — скорость потока (м/с), j — коэффициент, зависящий от pH, для доли H 2 S, [ DS ] – концентрация растворенных сульфидов (мг/л), A – кислотоемкость или щелочность, b – ширина поверхности потока, Ṕ – периметр обнаженной стенки, t – время.
Для учета неопределенностей в отношении уменьшения толщины стенки из-за коррозии представлена стохастическая модель. С учетом уравнения 1.20 основные случайные величины, влияющие на уменьшение толщины, включают: k , u , j , [ DS ], b / P ’ и A .
Уменьшение толщины стенки из-за коррозии зависит как от основных случайных величин, так и от времени. Его можно выразить следующим образом:
Его можно выразить следующим образом:
(5.29)d(t)=f(k,u,j,[DS],b/P′,A,t)
где k,u,j,[DS],b/P′ и A — основные случайные величины, вероятностная информация о которых предполагается доступной.
Значения основных случайных величин в текущем тематическом исследовании представлены в таблице 5.8.
Таблица 5.8. Статистические данные для основных случайных переменных
| Основные переменные | 0.8 | 0.1 | |
|---|---|---|---|
| j | – | 0.2 | 0.04 |
| [ DS ] | mg/L | 1 | 0.5 |
| u | m/s | 0.6 | 0.1 |
| b / P ‘ | – | h / D =0.2 ( b / P ‘=0.36) | 0,11 |
| H / D = 0,4 ( B / P ‘= 0,55) | 0,18 | ||
. 0,18 0,18 | 0.23 | ||
| A | – | 0.2 | 0.06 |
View chapterPurchase book
Read full chapter
URL: https://www.sciencedirect.com/ наука/статья/pii/B97801281357855000056
Zaki Ahmad, в принципах коррозионной инженерии и контроля коррозии, 2006
12.11 Средство принципов, вовлеченных в коррозионное усилительство
. Корроционическая механизм изыскания в случае, из -за непредубийного фона, потому что непреднамеренный феном — это очень комплексный феном, потому что наоборот. Потому что наоборот, потому что непреднамеренный феном. Потому что наоборот. Потому что наоборот. Потому что наоборот. Потому что наоборот. к коррозии. Эти факторы описаны в разделе 12.9.
В основном коррозия арматуры происходит из-за разрушения ее пассивного слоя, состоящего из нерастворимой тонкой оксидной пленки. Эта пленка изолирует арматуру от агрессивной среды. Пленки, которые растут на арматуре, представляют собой либо Fe 2+ (железо) или Fe 3+ (железо), оба стабильны в отсутствие карбоната. Пленка Fe 3+ (железо) обычно более стабильна, чем пленка железа (Fe 2+ ). Эти пленки образуются по следующей реакции:
Эта пленка изолирует арматуру от агрессивной среды. Пленки, которые растут на арматуре, представляют собой либо Fe 2+ (железо) или Fe 3+ (железо), оба стабильны в отсутствие карбоната. Пленка Fe 3+ (железо) обычно более стабильна, чем пленка железа (Fe 2+ ). Эти пленки образуются по следующей реакции:
Fe→Fe2++2e−(анодное растворение)Fe2++2OH−→Fe(OH)2(железное окись)2Fe(OH)2+O2→2FeOOH+h3(железное оксид)
Подробности вышеуказанных реакций приведены в главе 2. Пленки больше не сохраняют защитную функцию, если рН падает из-за карбонизации. Они больше не остаются прикрепленными к армированию и теряют свою пассивность, в результате чего поверхность армирования подвергается воздействию коррозионно-активных веществ. Попадание СО 2 является основным фактором, разрушающим пассивность и растворяющим защитный оксидный слой на поверхности армирования.
Еще одним важным фактором является попадание ионов хлора в арматуру. Пленка оксида железа (Fe 2 O 3 ) или γ-FeOOH устойчива к проникновению хлорида, однако оксид железа (FeO⋅nH 2 O) чувствителен к проникновению иона хлорида и реагирует с ним с образованием растворимого комплекса. , что приводит к нарушению пассивации и растворению пленки оксида железа. Оксид железа имеет красно-коричневый цвет и составляет большую часть ржавчины.
Пленка оксида железа (Fe 2 O 3 ) или γ-FeOOH устойчива к проникновению хлорида, однако оксид железа (FeO⋅nH 2 O) чувствителен к проникновению иона хлорида и реагирует с ним с образованием растворимого комплекса. , что приводит к нарушению пассивации и растворению пленки оксида железа. Оксид железа имеет красно-коричневый цвет и составляет большую часть ржавчины.
Начавшийся процесс питтинга становится автокаталитическим. Электрон, выделяющийся при окислении, Fe+3Cl − → FeCl 3 + 3 e , течет через сталь к катоду, FeCl 3 + 3OH − → Fe(OH) 3 +1Cl 9003 − , что приводит к увеличению концентрации хлорид-иона и снижению рН. Вышеупомянутый процесс будет продолжаться только в том случае, если концентрация хлорида выше, чем концентрация гидроксильного иона (ОН —). Если ОН — концентрация ионов выше, пленка оксида железа преобразуется в оксид железа (γ-FeOOH) и сохраняется пассивность. Более высокая концентрация кислорода также будет способствовать превращению гидроксида железа в оксид железа и пассивации арматуры. Углекислый газ и ионы хлора в основном являются двумя ингредиентами, ответственными за коррозию арматуры. Механизм коррозии арматуры этими двумя компонентами показан на рис. 12.13. Другие факторы, такие как содержание влаги, температура кислорода, разность потенциалов, защитный слой бетона, действуют либо уменьшая, либо увеличивая легкость проникновения веществ, вызывающих коррозию, в бетон. Ключевым фактором является поддержание щелочности, так как в щелочных условиях коррозия не может происходить из-за пассивного состояния арматуры в этих условиях.
Более высокая концентрация кислорода также будет способствовать превращению гидроксида железа в оксид железа и пассивации арматуры. Углекислый газ и ионы хлора в основном являются двумя ингредиентами, ответственными за коррозию арматуры. Механизм коррозии арматуры этими двумя компонентами показан на рис. 12.13. Другие факторы, такие как содержание влаги, температура кислорода, разность потенциалов, защитный слой бетона, действуют либо уменьшая, либо увеличивая легкость проникновения веществ, вызывающих коррозию, в бетон. Ключевым фактором является поддержание щелочности, так как в щелочных условиях коррозия не может происходить из-за пассивного состояния арматуры в этих условиях.
Рисунок 12.13. Коррозия арматурной стали, вызванная ионами хлорида и углекислым газом Эксплуатация, техническое обслуживание и ремонт наземных газовых турбин, 2021
Горячая коррозия
Горячая коррозия обычно наблюдается в газовых турбинах, работающих на некачественном топливе или работающих в натрийсодержащих средах.
Во-первых, в процессе сжигания некоторых видов топлива, таких как сырая нефть и высокосернистый газ, выделяются серьезные загрязняющие вещества, такие как ванадий и сера соответственно. Эти соединения проходят через газовый поток, разрушают защитные оксиды материала и инициируют химическую атаку. В результате происходит более быстрая реакция, чем простое окисление, что приводит к быстрому расходу материала.
Во-вторых, наличие хлорида натрия или морской соли в воздушном потоке является еще одной известной причиной горячей коррозии, как непосредственно, так и через «сульфат натрия». Этот побочный продукт образуется в результате реакции между серой из топлива и натрием из воздуха (Kurz & Brun, 2008).
Механизм горячей коррозии протекает аналогично окислению в три этапа, как показано на рис. 5.14.
Рис. 5.14. Ступени механизма горячей коррозии.
- 1.
Инкубация: скорость химической реакции аналогична скорости окисления. Типичные оксиды образуются аналогично оксидам без воздействия солей Cr 2 O 3 и Al 2 O 3 .
 Увеличение массы происходит за счет реакции с кислородом и образования накипи.
Увеличение массы происходит за счет реакции с кислородом и образования накипи.- 2.
Начало: коррозия ускоряется из-за образования трещин или скалывания окалины. Это связано с тем, что деформации от роста оксида достигают критического уровня.
- 3.
Размножение: характеристики реакции отличаются от характеристик окисления. Более быстрое разрушение материала происходит в результате флюсования оксидов и продолжается до тех пор, пока не произойдет полное разделение или разрушение.
В зависимости от температуры активации горячую коррозию можно разделить на две категории, включая высокотемпературную и низкотемпературную горячую коррозию, как показано на рис. 5.15.
Рис. 5.15. Скорость коррозии в зависимости от температуры.
Источник: Роланд Штрайфф. Защита материалов современными высокотемпературными покрытиями. Journal de Physique IV Colloque, 1993, 03 (C9), pp. C9–17-C9–41.https://doi.org/10.1051/jp4:1993902jpa-00252332
Горячая коррозия типа I или высокотемпературная коррозия
Горячая коррозия типа I или высокотемпературная коррозия начинается при температуре около 850°C (Roland, 1993). Это связано с тем, что диффузия кислорода, ванадия, серы и других реактивных элементов в основной металл намного быстрее при высоких температурах. Поскольку это высокотемпературная активируемая реакция, она обычно больше касается авиационных газовых турбин по сравнению с их наземными аналогами.
Это связано с тем, что диффузия кислорода, ванадия, серы и других реактивных элементов в основной металл намного быстрее при высоких температурах. Поскольку это высокотемпературная активируемая реакция, она обычно больше касается авиационных газовых турбин по сравнению с их наземными аналогами.
Эксперимент был проведен на жаропрочных сплавах на основе никеля без покрытия и с покрытием Ni-20%Cr. Образцы подвергались воздействию температуры 900°C и солевой среды Na2SO4–60%V2O5 (Muthu, Arivarasu, Arivazhagan, & Nageswara Rao, 2019). Результаты образцов с покрытием показаны на рис. 5.16.
Рис. 5.16. Микроскопическое изображение образцов с покрытием после воздействия Na2SO4–60%V2O5 при 900 °C.
Источник: From Muthu, M., Arivarasu, M., Arivazhagan, N., & Нагешвара рао, М. (ок. 2019 г.). Исследование стойкости к горячей коррозии жаропрочного сплава 825 без покрытия и покрытия Ni-20%Cr в среде Na2SO4–60%V2O5 при 900 °C Procedia .
В образцах с покрытием отмечены следующие особенности:
- 1.

Верхний слой (внешняя граница покрытия) содержит высокий процент кислорода и хрома с ограниченным количеством никеля. Дополнительная сера и натрий находятся в количестве 3,19% и 0,81% соответственно.
- 2.
Слой покрытия содержит высокое содержание никеля и хрома на уровне или выше 75% и 20% соответственно.
- 3.
Подложка из основного металла вблизи границы его покрытия обнаруживается с небольшим процентным содержанием кислорода.
- 4.
Поверхность раздела на покрытии очищена от коррозионных соединений. Однако отмечено, что он содержит большое количество хрома (38%) из-за внешней диффузии Cr.
Как часть горячей коррозии типа I, ожидается, что проглатывание серы произойдет в результате модификации отложений сульфата натрия. В случае обсуждавшегося ранее эксперимента в слое покрытия (внешняя граница) была обнаружена сера, что указывает на начало реакции и, кроме того, на успех покрытия в защите нижележащего материала. Полностью истощенное покрытие подвергает материал истощению его защитных элементов, открывая пути для развития внутренних сульфидов металлов.
Полностью истощенное покрытие подвергает материал истощению его защитных элементов, открывая пути для развития внутренних сульфидов металлов.
Подобным образом результаты непокрытых образцов показаны на рис. 5.17.
Рис. 5.17. Микроскопическое изображение непокрытых образцов после воздействия Na2SO4–60%V2O5 при 900 °C.
Источник: From Muthu, M., Arivarasu, M., Arivazhagan, N., & Нагешвара рао, М. (ок. 2019 г.). Исследование стойкости к горячей коррозии жаропрочного сплава 825 без покрытия и покрытия Ni-20%Cr в среде Na2SO4–60%V2O5 при 900 °C Procedia .
Следующие наблюдения отмечены в непокрытых образцах:
- 1.
Верхний слой (внешняя граница подложки) содержит повышенное количество никеля, железа, ванадия и кислорода и небольшое количество хрома (5,76%), что указывает на присутствие оксидов никеля и железа, NiO и Fe2O3 соответственно.
- 2.
Верхний слой содержит большое количество ванадия (15,46%), что указывает на диффузию этого элемента внутрь в оксидную окалину.
 Это является причиной агрессивной коррозионной реакции непокрытого материала.
Это является причиной агрессивной коррозионной реакции непокрытого материала.- 3.
Подложка (чуть ниже ее внешней границы) богата никелем, железом и хромом. Кислород также присутствует во все возрастающих количествах, перемещаясь внутрь субстрата.
- 4.
Подложка (примерно 60 мкм границы раздела окалина-подложка) содержит высокие уровни ванадия (13,27%), что указывает на диффузию ванадия внутрь из расплавленной соли в жаропрочный сплав.
Горячая коррозия типа II или низкотемпературная коррозия
Горячая коррозия II типа или низкотемпературная коррозия характеризуется наличием ямок с пластинчатой окалиной, богатой серой. Это происходит при более низких температурах. Многочисленные эксперименты показали, что горячая коррозия II типа может возникать при температуре 550°C и даже ниже при наличии напряжения (Brooking et al., 2018).
Горячая коррозия типа II возникает при температуре 593–750°C для широкого спектра материалов на основе никеля, используемых в компонентах ГТ. При этих температурах диффузионная способность менее важна. Сера не попадает внутрь. Вместо этого он образует на поверхности эвтектики триоксида серы и сульфата натрия с низкой температурой плавления, что приводит к точечной коррозии.
При этих температурах диффузионная способность менее важна. Сера не попадает внутрь. Вместо этого он образует на поверхности эвтектики триоксида серы и сульфата натрия с низкой температурой плавления, что приводит к точечной коррозии.
Горячая коррозия типа II является более опасным механизмом в наземных газовых турбинах, где более часто присутствуют загрязняющие вещества из низкокачественного топлива и рабочей среды, такие как сера и натрий. В этом случае компоненты, срок службы которых ограничен горячей коррозией, должны иметь достаточную толщину, чтобы уменьшить влияние потерь материала.
Всякий раз, когда горячая коррозия сочетается с другими нагрузками, эффект еще больше усугубляется, вызывая коррозионное растрескивание под напряжением.
На монокристаллическом суперсплаве «CMSX-4» был проведен эксперимент для определения влияния комбинированного напряжения и горячей коррозии на усталостную долговечность компонента. Было обнаружено, что горячая коррозия типа II в сочетании с напряжением приводит к форме коррозионного растрескивания под напряжением с морфологией береговой маркировки, как показано на рис. 5.18. В этом случае трещины развиваются быстрее, чем их единственный эффект, из-за роста градиента напряжения (Brooking et al., 2018).
5.18. В этом случае трещины развиваются быстрее, чем их единственный эффект, из-за роста градиента напряжения (Brooking et al., 2018).
Рис. 5.18. Коррозионное разрушение под напряжением.
Источник: Brooking, L, Gray, S., Sumner, J., Nicholls, J.R., Marchant, G., & Симмс, Нью-Джерси (2018). Влияние напряженного состояния и одновременной горячей коррозии на распространение трещин и усталостную долговечность монокристаллического жаропрочного сплава CMSX-4. Международный журнал усталости .
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B978012821834100006X
Инъекция ингибитора
Когда механизм коррозии полностью понятен, в поток продукта можно вводить определенные химические вещества для уменьшения или подавления реакции. Поскольку кислород является основным коррозионным агентом стали, химическое вещество, «поглощающее кислород», может сочетаться с кислородом в продукте, чтобы предотвратить реакцию этого кислорода со стенкой трубы. Более распространенный вид химического ингибитора образует защитный барьер между сталью и продуктом — по сути, покрытие. Ингибитор периодически или постоянно вводят повторно для замены ингибитора, который поглощается или вытесняется потоком продукта. В случаях, когда активность микроорганизмов представляет проблему, к ингибитору можно добавить биоциды. Оценщик должен быть уверен, что оборудование для ввода ингибитора находится в хорошем состоянии и вводит надлежащее количество ингибитора с надлежащей скоростью. Эффективность ингибитора часто проверяется программой внутреннего мониторинга, как описано выше.
Более распространенный вид химического ингибитора образует защитный барьер между сталью и продуктом — по сути, покрытие. Ингибитор периодически или постоянно вводят повторно для замены ингибитора, который поглощается или вытесняется потоком продукта. В случаях, когда активность микроорганизмов представляет проблему, к ингибитору можно добавить биоциды. Оценщик должен быть уверен, что оборудование для ввода ингибитора находится в хорошем состоянии и вводит надлежащее количество ингибитора с надлежащей скоростью. Эффективность ингибитора часто проверяется программой внутреннего мониторинга, как описано выше.
В дополнение к закачке ингибитора может потребоваться программа очистки скребками. Очистка скребками предназначена для удаления свободных жидкостей или защитных покрытий колоний бактерий, которые в противном случае могут повлиять на эффективность ингибитора или биоцида.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www. sciencedirect.com/science/article/pii/B9780750675796500078
sciencedirect.com/science/article/pii/B9780750675796500078
Wan Renpu, в Advanced Well Completion Engineering), 9 20 1 Edition10003
Механизмы и классификация нефтяной скважины
Коррозионная среда и коррозионная среда нефтяных скважин
Corrosive Media of Oil and Gas Wells
75956595659565956595865958695659586958659565
295869565
295869565
2
956595869565
56595659565 56595659565
2
595659565
Корросивные среды нефтяных и газовых скважин. и газовых скважин
Выбор материала и структура
Основная классификация и механизм коррозии
Electrochemical Corrosion
Effects of Environmental Factors on Electrochemical Corrosion
Environment-Assisted Fracture and Stress Corrosion
Stress Corrosion Fracture
Corrosion Fatigue
Коррозия, вызванная потоком и размывом
Коррозия, вызванная потоком
Scour Corrosion
Corrosion Mechanisms and Types of Corrosion of Main Corrosive Components
Hydrogen Sulfide Corrosion Mechanism and Types of Corrosion
Elemental Sulfur Corrosion
Кислородная коррозия
Солевая коррозия
Кислородная коррозия
Bacteria Corrosion
Interaction of Corrosive Components and the Effect on Corrosion
Acid Corrosion
View chapterPurchase book
Read full chapter
URL: https://www. sciencedirect.com/science/article/pii/B978012385868
sciencedirect.com/science/article/pii/B978012385868
8X
Барри Дули, Технология парогенераторов с рекуперацией тепла, 2017 г.
15.3.1.8 Механизмы отказа/повреждения в котлах-утилизаторах: выделение механизмов коррозии под отложениями
Три механизма UDC в котлах-утилизаторах, т. е. HD, APC и CG, возникают исключительно в трубах испарителя ВД [11–13] , и все они требуют относительно толстых пористых отложений и химического (либо загрязнителя, либо неоптимизированной обработки) механизма концентрации в этих отложениях. Повреждение UDC может произойти в начале срока службы котла-утилизатора из-за обратной зависимости между нагрузкой/толщиной отложений и серьезностью химического выброса.
Для ГД концентрирующим коррозионным веществом чаще всего является хлорид, который попадает в цикл через утечку через конденсатор (особенно при охлаждении морской или солоноватой водой) и через проскальзывание в деминерализованную подпиточную воду на водоочистных сооружениях, где ионообменные смолы регенерируются соляной кислотой.
APC относится к установке, использующей фосфатные смеси с молярным отношением натрия к фосфату ниже 2,6, и/или использованию СРТ с использованием одного или обоих моно- или динатрийфосфата.
CG включает концентрацию NaOH, используемую выше требуемого контрольного уровня при щелочной обработке, или с использованием координированного фосфата с высоким содержанием свободного гидроксида, или попадание NaOH из-за неправильной регенерации ионообменных смол или утечки конденсатора (охлаждение пресной водой ).
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B9780081019405000154
M. Bloeckmotive, in Advanced Materials in Automotive, 29
M. Bloeckmotive, in Advanced Materials in Automotive, 29
0003
Коррозионные характеристики сплавов AlMgSi
Основным механизмом коррозии сплавов AlMgSi при воздействии коррозионных условий является межкристаллитная коррозия. Межкристаллитная коррозия представляет собой избирательное растворение пограничной зоны зерен, при этом объемное зерно не подвергается воздействию. Межкристаллитная коррозия вызывается действием микрогальванических элементов на границах зерен. Границы зерен являются предпочтительными местами для сегрегации и осаждения, что делает их физически и химически отличными от матрицы. Кроме того, зона, прилегающая к границе зерна, обеднена растворенными элементами. В результате образуется «гальванический элемент». Если, например, выделения на границах зерен электрохимически более благородны, чем алюминиевая матрица, обедненная зона становится электрохимически активной, т.е. предпочтительно растворяется. Но возможен и обратный случай (Свеннингсен, 2003). На склонность к межкристаллитной коррозии влияют:
Межкристаллитная коррозия представляет собой избирательное растворение пограничной зоны зерен, при этом объемное зерно не подвергается воздействию. Межкристаллитная коррозия вызывается действием микрогальванических элементов на границах зерен. Границы зерен являются предпочтительными местами для сегрегации и осаждения, что делает их физически и химически отличными от матрицы. Кроме того, зона, прилегающая к границе зерна, обеднена растворенными элементами. В результате образуется «гальванический элемент». Если, например, выделения на границах зерен электрохимически более благородны, чем алюминиевая матрица, обедненная зона становится электрохимически активной, т.е. предпочтительно растворяется. Но возможен и обратный случай (Свеннингсен, 2003). На склонность к межкристаллитной коррозии влияют:
- •
Состав сплава : Повышенное содержание Cu делает материал более чувствительным к коррозии (Meissner, 1992). Это объясняется выделением на границах зерен частиц Al 2 Cu, более благородных, чем алюминиевая матрица.

- •
Термомеханическая обработка : Материал в состоянии, обработанном на твердый раствор (T4), более устойчив к коррозии, чем материал, подвергнутый холодной штамповке и термообработке.
Однако следует отметить, что не содержащие меди сплавы серии 6xxx, обычно используемые для автомобильных листов, устойчивы к этому типу коррозии. Следует соблюдать осторожность только для материалов с экстремальным соотношением Si/Mg (> 3), а также для медьсодержащих сплавов (Zhan et al ., 2008). Содержание меди выше 0,3 % повышает прочность сплавов серии 6ххх, но также может влиять на устойчивость к межкристаллитной коррозии. Чем выше содержание Cu, тем больше внимания требуется, чтобы избежать такого рода коррозии. Детали, изготовленные из медьсодержащих материалов 6ххх, должны быть испытаны на межкристаллитную коррозию или снабжены соответствующей защитой от коррозии. Это относится, например, к применениям BIW, когда используется подходящая система покрытия (предварительная обработка и лак). Сплав EN AW-6111 с номинальным содержанием Cu 0,7 мас.% широко используется для наружных панелей кузова с хорошим многолетним опытом.
Сплав EN AW-6111 с номинальным содержанием Cu 0,7 мас.% широко используется для наружных панелей кузова с хорошим многолетним опытом.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B9781845695613500053
Г. Генчев, А.
Стратегии защиты от коррозии
Поскольку механизм коррозии сложен и включает в себя несколько критических процессов с недостаточным пониманием на атомном уровне, одинаково сложно разработать простые и общие стратегии защиты. Далее мы кратко обсудим (а) выбор состава сплава, (б) использование покрытий, (в) облегчение образования защитного слоя продуктов коррозии и (г) использование ингибиторов.
Углеродистая сталь, обычно содержащая более 98% Fe, является предпочтительным материалом для технических инфраструктур, в том числе для нефте- и газопроводов. Легирование железа пассивирующими металлами, такими как Cr, Ni, Mo, дает нержавеющие стали с высокой коррозионной стойкостью (см. также раздел « «Коррозия других металлических материалов сернистым газом» »). Однако крупномасштабное применение этих материалов слишком дорого. 126
также раздел « «Коррозия других металлических материалов сернистым газом» »). Однако крупномасштабное применение этих материалов слишком дорого. 126
Защита может быть обеспечена нанесением красок или других, например органических, покрытий. 127 Такие покрытия в основном должны предотвращать доступ H 2 S и воды к поверхности стали в условиях эксплуатации. Основными проблемами этого метода являются ограниченный срок службы и сложность нанесения покрытий внутри трубопроводов и резервуаров. 127
В идеале образующиеся продукты коррозии замедляют дальнейшую коррозию. Действительно, при определенных условиях наблюдались защитные свойства чешуек, образующихся в H 2 S-содержащих растворах. Например, образование защитной пленки из сульфидов железа на стенках трубопроводов в оламиновых системах препятствует разрушению металла. 128 Сульфидная пленка действует как диффузионный барьер для веществ, участвующих в процессе коррозии, тем самым замедляя процесс коррозии и предотвращая дальнейшее растворение нижележащего материала. 129 Было показано, что защитное свойство коррозионной окалины зависит от различных факторов, например, от парциального давления H 2 S, температуры и pH. 130–134 В растворах с pH 7,0–8,8 наблюдалось образование прочных защитных сульфидных пленок. 90 , 135 Однако показано, что высокие концентрации сульфида (500 частей на миллион) имеют решающее значение для образования защитной пленки. 135 Таким образом, одной из стратегий может быть «предварительная коррозия» системы при больших концентрациях сульфидов. Для электрохимически выращенных чешуек снижение скорости коррозии наблюдалось при времени погружения > 2 ч при концентрациях H 2 S ≤ 0,04 ммоль дм − 3 и pH 3–5. 65
129 Было показано, что защитное свойство коррозионной окалины зависит от различных факторов, например, от парциального давления H 2 S, температуры и pH. 130–134 В растворах с pH 7,0–8,8 наблюдалось образование прочных защитных сульфидных пленок. 90 , 135 Однако показано, что высокие концентрации сульфида (500 частей на миллион) имеют решающее значение для образования защитной пленки. 135 Таким образом, одной из стратегий может быть «предварительная коррозия» системы при больших концентрациях сульфидов. Для электрохимически выращенных чешуек снижение скорости коррозии наблюдалось при времени погружения > 2 ч при концентрациях H 2 S ≤ 0,04 ммоль дм − 3 и pH 3–5. 65
Развитие фаз обычно идет от фаз, богатых железом, к фазам, богатым серой. Макинавит в большинстве случаев является начальным продуктом коррозии, но не может защитить поверхность от дальнейшей коррозии. Предполагается, что его структура имеет дефекты решетки, что обеспечивает быструю диффузию железа и, следовательно, высокую скорость коррозии. С другой стороны, пирит обычно является термодинамически стабильной фазой в H 2 Растворы S и, следовательно, самые защитные. 38 , 136
Предполагается, что его структура имеет дефекты решетки, что обеспечивает быструю диффузию железа и, следовательно, высокую скорость коррозии. С другой стороны, пирит обычно является термодинамически стабильной фазой в H 2 Растворы S и, следовательно, самые защитные. 38 , 136
Ингибиторы могут образовывать защитную пленку на поверхности материалов и, следовательно, снижать уровень доступа активных веществ к поверхности. Их использование широко распространено в промышленности, но часто чисто эмпирически оптимизировано и практически не исследовано с научной точки зрения. 29 Ингибиторы коррозии в полевых условиях сначала оцениваются в лаборатории. Крайне важно, чтобы выбранные лабораторные методологии включали важные аспекты, такие как контролируемые параметры (температура, давление, расход и состав), моделирование локальной коррозии и способность различать. При моделировании наихудшего сценария коррозии скорости коррозии рассчитываются с использованием различных лабораторных методологий и сравниваются. 137–140 Оценка различных методологий, например, колесных испытаний, пузырьковых испытаний, статических испытаний, вращающегося дискового электрода (RDE), вращающегося цилиндрического электрода (RCE), струйного соударения (JI) и вращающейся клетки (RC), показала RC должен быть лучшим, основанным на серьезности смоделированных условий коррозии, и обеспечивает строгое испытание для прохождения ингибиторов коррозии. Остальные методики также можно использовать для скрининга ингибиторов, но они не имитируют экстремальные условия эксплуатации месторождения. 141 Добавление различных химикатов, например, формальдегида, изменяет структуру сульфидных отложений, делая их эффективным барьером против коррозии, что измеряется потерей веса. 142 Ингибиторы коррозии, состоящие из имидазолина жирной кислоты, органических кислот и аминокарбоксилатов в качестве ингибиторов паровой фазы, были изучены для применения в кислых условиях. 143 Эффективность последних зависит от скорости потока, и при высоких уровнях коррозии необходимы повышенные концентрации.
137–140 Оценка различных методологий, например, колесных испытаний, пузырьковых испытаний, статических испытаний, вращающегося дискового электрода (RDE), вращающегося цилиндрического электрода (RCE), струйного соударения (JI) и вращающейся клетки (RC), показала RC должен быть лучшим, основанным на серьезности смоделированных условий коррозии, и обеспечивает строгое испытание для прохождения ингибиторов коррозии. Остальные методики также можно использовать для скрининга ингибиторов, но они не имитируют экстремальные условия эксплуатации месторождения. 141 Добавление различных химикатов, например, формальдегида, изменяет структуру сульфидных отложений, делая их эффективным барьером против коррозии, что измеряется потерей веса. 142 Ингибиторы коррозии, состоящие из имидазолина жирной кислоты, органических кислот и аминокарбоксилатов в качестве ингибиторов паровой фазы, были изучены для применения в кислых условиях. 143 Эффективность последних зависит от скорости потока, и при высоких уровнях коррозии необходимы повышенные концентрации. Сообщалось также об использовании химических веществ, способных переводить сульфидные соединения в более инертную форму. Эти так называемые поглотители используются в различных полевых условиях, например, в буровых работах и в процессах подслащивания. Соединения меди, 144 H 2 O 2 , 144 цинкосодержащие соединения, 145 и химические вещества на основе оксида железа 146–148 считаются эффективными поглотителями сульфидов. Однако у каждого из них есть ограничения либо из-за высоких цен, либо из соображений безопасности. Более поздние исследования в лабораторных условиях показали, что глюконат железа является эффективным и экологически безопасным альтернативным поглотителем сульфидов. 149
Сообщалось также об использовании химических веществ, способных переводить сульфидные соединения в более инертную форму. Эти так называемые поглотители используются в различных полевых условиях, например, в буровых работах и в процессах подслащивания. Соединения меди, 144 H 2 O 2 , 144 цинкосодержащие соединения, 145 и химические вещества на основе оксида железа 146–148 считаются эффективными поглотителями сульфидов. Однако у каждого из них есть ограничения либо из-за высоких цен, либо из соображений безопасности. Более поздние исследования в лабораторных условиях показали, что глюконат железа является эффективным и экологически безопасным альтернативным поглотителем сульфидов. 149
Просмотр главыКнига покупок
Читать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B978012409547211546X
Коррозия металлов
Теория коррозии металлов
Коррозия определяется как воздействие на материал в результате
химическая, часто электрохимическая реакция с окружающей средой.
Согласно этому определению, термин коррозия может применяться ко всем
материалов, в том числе неметаллов. Но на практике слово коррозия в основном используется в
сочетание с металлическими материалами.
Почему металлы ржавеют? Помимо золота, платины и некоторых других,
металлы не встречаются в природе в чистом виде. Они обычно
химически связанные с другими веществами в рудах, такими как сульфиды, оксиды и т. д.
Энергия должна быть затрачена (например, в доменной печи) для извлечения металлов из
сульфиды, оксиды и др. для получения чистых металлов.
Чистые металлы содержат больше связанной энергии, т.
более высокое энергетическое состояние, чем то, что встречается в природе в виде сульфидов или оксидов.
Энергетическое состояние металла в различных формах
Поскольку весь материал во Вселенной стремится вернуться к своему низшему
энергетическое состояние, чистые металлы также стремятся вернуться в свое самое низкое энергетическое состояние.
которые они имели в виде сульфидов или оксидов. Один из способов, которыми металлы могут
возврат к низкому энергетическому уровню происходит за счет коррозии. Продукты коррозии из
металлы часто представляют собой сульфиды или оксиды.
Химическая и электрохимическая коррозия
Химическая коррозия может рассматриваться как окисление и возникает под действием
сухих газов, часто при высоких температурах. С другой стороны, происходит электрохимическая коррозия.
электродными реакциями, часто во влажной среде, т. е. влажной коррозией.
Все металлы в сухом воздухе покрыты очень тонким слоем оксида,
около 100 (10 -2 м) толщ. Этот слой образован химическим
коррозия кислородом воздуха. При очень высоких температурах реакция
с кислородом в воздухе может продолжаться без ограничений, и металл быстро превратится в
оксид.
Окисление металла при различных температурах
При комнатной температуре реакция прекращается, когда слой становится тонким. Эти
Эти
тонкие слои оксида могут защитить металл от продолжительного воздействия, т.е. в
водный раствор. На самом деле это и есть эти слои оксида
и/или продукты коррозии, образующиеся на поверхности металла, защищающего
металл от продолжающегося воздействия в гораздо большей степени, чем коррозия
сопротивление самого металла.
Эти слои оксида могут быть более или менее прочными в
вода, например. Мы знаем, что обычная углеродистая сталь быстрее корродирует в воде.
чем нержавеющая сталь. Разница зависит от состава и
проницаемость их соответственно оксидных слоев. Следующее описание
явление коррозии будет иметь дело только с электрохимической коррозией, т.е.
мокрая коррозия.
Ячейки коррозии
Как корродируют металлы в жидкостях? Проиллюстрируем это,
с использованием явления коррозии, называемого биметаллической коррозией или гальванической коррозией.
Биметаллическая коррозионная ячейка может, например. состоит из стальной пластины и медной пластины
находящиеся в электрическом контакте друг с другом и погруженные в водный раствор
(электролит).
Электролит содержит растворенный кислород воздуха
и растворенная соль. Если лампа подключена между стальной пластиной и
медная пластина, она загорится. Это указывает на то, что ток течет между
металлические пластины. Медь будет положительным электродом, а сталь
быть отрицательным электродом.
Ток течет через лампу от медной пластины к стальной пластине 908:35
Движущей силой тока является разность электрических
потенциал между медью и сталью. Цепь должна быть замкнута и
следовательно, ток будет течь в жидкости (электролите) от стальной пластины.
к медной пластине. Течение тока происходит по положительно заряженным
атомы железа (ионы железа) покидают стальную пластину, и стальная пластина подвергается коррозии.
Поверхность металла, подверженная коррозии, называется анодом. Кислород
и вода потребляются на поверхности медной пластины и ионы гидроксила
(OH-), которые заряжены отрицательно. Отрицательные гидроксильные ионы
«нейтрализовать» положительно заряженные атомы железа. Ионы железа и гидроксила образуют
Ионы железа и гидроксила образуют
гидроксид железа (ржавчина).
В коррозионной ячейке, описанной выше, металлическая медь
называется катодом. Обе металлические пластины называются электродами.
определение анода и катода дано ниже.
Анод : Электрод, от которого течет положительный ток
в электролит.
Катод : Электрод, через который проходит положительная электрическая
ток уходит из электролита.
Когда положительные атомы железа переходят в раствор со стальной пластины,
электроны остаются в металле и переносятся в противоположном направлении, к
положительный ток.
Предпосылки для
образования биметаллической ячейки являются:
1. Электролит
2. Анод
3. Катод
4. Окислительная среда, такая как растворенный кислород (O 2 ) или ионы водорода.
(Н + ).
Потенциал электрода — серия Galvanic
В приведенном выше примере
было показано, что движущая сила течения тока и, следовательно,
коррозия — это разность электродных потенциалов. Электродный потенциал
Электродный потенциал
металл указывает на склонность металла к растворению и коррозии.
в определенном электролите.
Упоминается также «благородство» металла. Чем благороднее
металла, чем выше потенциал, тем меньше склонность к
растворяться в электролите.
Электродные потенциалы различных металлов могут быть указаны в
относительно друг друга в гальваническом ряду для разных электролитов.
гальванический ряд различных металлов в морской воде показан ниже.
Золото | +0,42 |
| Серебро | +0,19 |
Нержавеющая сталь (AISI 304), пассивное состояние | +0,09 |
| Медь | +0,02 |
| Олово | -0,26 |
Нержавеющая сталь (AISI 304), активное состояние | -0,29 |
| Свинец | -0,31 |
| Сталь | -0,46 |
| Кадмий | -0,49 |
| Алюминий | -0,51 |
| Оцинкованная сталь | -0,81 |
| Цинк | -0,86 |
| Магний | -1,36 |
Учитывая сталь-медь
Например, из приведенной выше таблицы следует, что медь имеет более высокий потенциал (соответствует
благороднее), чем обычная углеродистая сталь. Сталь будет анодом и будет корродировать,
Сталь будет анодом и будет корродировать,
тогда как медь будет катодом и не будет подвергаться коррозии.
Коррозия в микроячейках
сталь-медь
пример показал, как происходит коррозия, когда два различных материала
связаны в водном растворе. Как происходит коррозия на поверхности
из одного металла? Когда поверхность металла исследуют под микроскопом,
будет видно, что это не единый однородный металл. Различия в
структура и размер зерна возникают на поверхности. Химический состав может
различаются и могут присутствовать различные примеси.
Если электродный потенциал измеряется на внешнем
однородной поверхности, будет обнаружено, что она значительно различается только в областях
доли квадратного миллиметра. Итак, катоды и аноды, возможно, небольшие, но
достаточно большие, чтобы вызвать коррозию, могут образовываться на одной и той же металлической поверхности.
При анодной и катодной реакциях образовалась коррозионная микроячейка.
описано ниже.
Анодная часть поверхности корродирована
В случае низкого pH катодная реакция будет: 2e — +
2H + → H 2 . Поверхность катода может быть
Поверхность катода может быть
примеси, такие как оксидные включения, прирост графита или более благородная фаза.
Восемь форм коррозии Фонтаны
автор: Фонтана и Грин, 19 лет67
Идея описания различных способов, которыми коррозия может повредить металлы по внешнему виду, использовалась многими до того, как Фонтана и Грин написали в соавторстве свою знаменитую книгу в 1967 году. Маккей и Уортингтон уже обсуждали различные формы коррозии в своей книге о коррозии 1936 года. . вслед за Аланом Поллиттом в его собственной книге, опубликованной на тринадцать лет раньше, то есть в 1923 году. Однако следующая классификация, похоже, получила самое широкое признание с небольшими различиями между авторами.
Коррозию удобно классифицировать по формам, в которых она проявляется, основанием для этой классификации является внешний вид проржавевшего металла. Каждая форма может быть идентифицирована простым визуальным наблюдением. В большинстве случаев достаточно невооруженного глаза, но иногда полезно или требуется увеличение. Ценную информацию для решения проблемы коррозии часто можно получить путем тщательного наблюдения за корродированными испытательными образцами или вышедшим из строя оборудованием. Проверка перед очисткой особенно желательна. Некоторые из восьми форм коррозии уникальны, но все они более или менее взаимосвязаны. Восемь форм: (1) однородная или общая коррозия, (2) гальваническая или двухметаллическая коррозия, (3) щелевая коррозия, (4) точечная коррозия, (5) межкристаллитная коррозия, (6) избирательное выщелачивание или расслоение. , (7) коррозия под напряжением. Этот перечень является произвольным, но охватывает практически все отказы и проблемы, связанные с коррозией. Формы не перечислены в каком-либо конкретном порядке важности. Ниже обсуждаются восемь форм коррозии с точки зрения их характеристик, механизмов и профилактических мер. Водородное повреждение, хотя и не является формой коррозии, часто происходит косвенно в результате коррозионного воздействия и поэтому включено в это обсуждение.
Ценную информацию для решения проблемы коррозии часто можно получить путем тщательного наблюдения за корродированными испытательными образцами или вышедшим из строя оборудованием. Проверка перед очисткой особенно желательна. Некоторые из восьми форм коррозии уникальны, но все они более или менее взаимосвязаны. Восемь форм: (1) однородная или общая коррозия, (2) гальваническая или двухметаллическая коррозия, (3) щелевая коррозия, (4) точечная коррозия, (5) межкристаллитная коррозия, (6) избирательное выщелачивание или расслоение. , (7) коррозия под напряжением. Этот перечень является произвольным, но охватывает практически все отказы и проблемы, связанные с коррозией. Формы не перечислены в каком-либо конкретном порядке важности. Ниже обсуждаются восемь форм коррозии с точки зрения их характеристик, механизмов и профилактических мер. Водородное повреждение, хотя и не является формой коррозии, часто происходит косвенно в результате коррозионного воздействия и поэтому включено в это обсуждение. ссылка
ссылка
Равномерное воздействие
Равномерное воздействие является наиболее распространенной формой коррозии. Обычно он характеризуется химической или электрохимической реакцией, которая протекает равномерно по всей открытой поверхности или на большой площади. Металл становится тоньше и в конце концов выходит из строя. Например, кусок стали или цинка, погруженный в разбавленную серную кислоту, обычно растворяется с одинаковой скоростью по всей своей поверхности. Крыша из листового железа будет иметь одинаковую степень ржавчины по всей внешней поверхности.
Равномерное коррозионное воздействие, или общая общая коррозия, представляет собой наибольшее разрушение металла в пересчете на тоннаж. Эта форма коррозии, однако, не представляет большого интереса с технической точки зрения, так как срок службы оборудования можно точно оценить на основе сравнительно простых испытаний. Часто бывает достаточно просто погрузить образцы в соответствующую жидкость. Равномерное воздействие можно предотвратить или уменьшить с помощью (1) соответствующих материалов, включая покрытия, (2) ингибиторов или (3) катодной защиты.
Гальваническая коррозия или коррозия двух металлов
Разность потенциалов обычно существует между двумя разнородными металлами, когда они погружены в коррозионный или проводящий раствор. Если эти металлы находятся в контакте (или иным образом электрически соединены), эта разность потенциалов создает поток электронов между ними. Коррозия менее коррозионностойкого металла обычно увеличивается, а агрессивность более стойкого материала уменьшается по сравнению с поведением этих металлов, когда они не находятся в контакте. Менее стойкий металл становится анодным, а более стойкий – катодным. Обычно в парах такого типа катод или катодный металл корродируют очень мало или совсем не корродируют. Из-за того, что в ней участвуют электрические токи и разнородные металлы, эта форма коррозии называется гальванической или двухметаллической коррозией. Это электрохимическая коррозия, но для ясности мы ограничим термин «гальваническая» эффектами разнородных металлов.
Щелевая коррозия
Интенсивная локальная коррозия часто возникает в щелях и других защищенных областях на металлических поверхностях, подвергающихся воздействию коррозионных веществ. Этот тип повреждения обычно связан с небольшими объемами застойного раствора, вызванного отверстиями, поверхностями прокладок, соединениями внахлестку, поверхностными отложениями и щелями под головками болтов и заклепок. В результате эту форму коррозии называют щелевой коррозией или, иногда, коррозией отложений или прокладок.
Этот тип повреждения обычно связан с небольшими объемами застойного раствора, вызванного отверстиями, поверхностями прокладок, соединениями внахлестку, поверхностными отложениями и щелями под головками болтов и заклепок. В результате эту форму коррозии называют щелевой коррозией или, иногда, коррозией отложений или прокладок.
Точечная коррозия
Точечная коррозия — это форма чрезвычайно локализованного воздействия, в результате которого в металле появляются отверстия. Эти отверстия могут быть маленькими или большими в диаметре, но в большинстве случаев они относительно малы. Ямки иногда изолированы или расположены так близко друг к другу, что выглядят как шероховатая поверхность. Обычно яма может быть описана как полость или отверстие с диаметром поверхности примерно таким же или меньшим, чем глубина.
Точечная коррозия — одна из самых разрушительных и коварных форм коррозии. Это приводит к выходу из строя оборудования из-за перфорации с небольшой потерей веса всей конструкции. Часто бывает трудно обнаружить язвы из-за их небольшого размера и из-за того, что язвы часто покрыты продуктами коррозии. Кроме того, трудно количественно измерить и сравнить степень питтинга из-за разной глубины и количества питтингов, которые могут возникать в одинаковых условиях. Питтинг также трудно предсказать с помощью лабораторных тестов. Иногда ямы требуют длительного времени — нескольких месяцев или года — для того, чтобы проявить себя в реальной эксплуатации. Точечная коррозия особенно опасна, потому что это локальная и интенсивная форма коррозии, и отказы часто происходят с чрезвычайной внезапностью.
Часто бывает трудно обнаружить язвы из-за их небольшого размера и из-за того, что язвы часто покрыты продуктами коррозии. Кроме того, трудно количественно измерить и сравнить степень питтинга из-за разной глубины и количества питтингов, которые могут возникать в одинаковых условиях. Питтинг также трудно предсказать с помощью лабораторных тестов. Иногда ямы требуют длительного времени — нескольких месяцев или года — для того, чтобы проявить себя в реальной эксплуатации. Точечная коррозия особенно опасна, потому что это локальная и интенсивная форма коррозии, и отказы часто происходят с чрезвычайной внезапностью.
Межкристаллитная коррозия
Эффекты границ зерен практически не имеют значения в большинстве областей применения или использования металлов. Если металл подвергается коррозии, возникает однородная коррозия, поскольку границы зерен обычно лишь немного более реактивны, чем матрица. Однако при определенных условиях границы раздела зерен очень реактивны, что приводит к межкристаллитной коррозии. Локальное воздействие на границах зерен и рядом с ними с относительно небольшой коррозией зерен называется межкристаллитной коррозией. Сплав распадается (выпадают зерна) и/или теряет прочность.
Локальное воздействие на границах зерен и рядом с ними с относительно небольшой коррозией зерен называется межкристаллитной коррозией. Сплав распадается (выпадают зерна) и/или теряет прочность.
Межкристаллитная коррозия может быть вызвана примесями на границах зерен, обогащением одним из легирующих элементов или обеднением одного из этих элементов в областях границ зерен. Было показано, что небольшие количества железа в алюминии, где растворимость железа низкая, выделяются на границах зерен и вызывают межкристаллитную коррозию. Было показано, что, исходя из соображений поверхностного натяжения, содержание цинка в латуни выше на границах зерен. Истощение хрома в зернограничных областях приводит к межкристаллитной коррозии нержавеющих сталей.
Селективное выщелачивание
Селективное выщелачивание представляет собой удаление одного элемента из твердого сплава в результате процессов коррозии. Наиболее распространенным примером является селективное удаление цинка из латунных сплавов (децинкификация). Аналогичные процессы происходят и в других системах сплавов, в которых алюминий; удаляются железо, кобальт, хром и другие элементы. Селективное выщелачивание — это общий термин для описания этих процессов, и его использование исключает создание таких терминов, как деалюминирификация, декобальтификация и т. д. Разделение — это металлургический термин, который иногда применяется, но избирательное выщелачивание предпочтительнее.
Аналогичные процессы происходят и в других системах сплавов, в которых алюминий; удаляются железо, кобальт, хром и другие элементы. Селективное выщелачивание — это общий термин для описания этих процессов, и его использование исключает создание таких терминов, как деалюминирификация, декобальтификация и т. д. Разделение — это металлургический термин, который иногда применяется, но избирательное выщелачивание предпочтительнее.
Эрозионная коррозия
Эрозионная коррозия – это ускорение или увеличение скорости износа или воздействия на металл из-за относительного движения между коррозионной жидкостью и металлической поверхностью. Как правило, это движение довольно быстрое и связано с эффектами механического износа или истирания. Металл удаляется с поверхности в виде растворенных ионов или образует твердые продукты коррозии, которые механически смываются с поверхности металла. Иногда движение окружающей среды уменьшает коррозию, особенно когда локальное воздействие происходит в условиях застоя, но это не эрозионная коррозия, поскольку износ не увеличивается.
Эрозионная коррозия характеризуется появлением канавок, оврагов, волн, округлых отверстий и впадин и обычно имеет направленный рисунок. Во многих случаях отказы из-за эрозионной коррозии происходят за относительно короткое время, и они являются неожиданными в основном потому, что оценочные коррозионные испытания проводились в статических условиях или потому, что эффекты эрозии не учитывались.
Коррозионное растрескивание под напряжением
Под коррозионным растрескиванием понимается растрескивание, вызванное одновременным присутствием растягивающего напряжения и определенной коррозионной среды. Многие исследователи классифицировали все разрушения, связанные с растрескиванием, происходящие в агрессивных средах, как коррозионное растрескивание под напряжением, в том числе разрушения из-за водородного охрупчивания. Однако эти два типа отказов при взломе по-разному реагируют на переменные среды. Например, катодная защита является эффективным методом предотвращения коррозионного растрескивания под напряжением, поскольку она быстро ускоряет эффекты водородного охрупчивания. Отсюда очевидна важность рассмотрения коррозионного растрескивания и водородного охрупчивания как отдельных явлений. По этой причине два явления растрескивания обсуждаются отдельно в этой главе.
Отсюда очевидна важность рассмотрения коррозионного растрескивания и водородного охрупчивания как отдельных явлений. По этой причине два явления растрескивания обсуждаются отдельно в этой главе.
При коррозионном растрескивании металл или сплав практически не подвергается воздействию на большей части своей поверхности, в то время как по нему развиваются мелкие трещины. Это явление растрескивания имеет серьезные последствия, поскольку оно может возникать при напряжениях в пределах диапазона типичного расчетного напряжения. Показано, что воздействие кипящего MgCl2 при 310°F (154°C) снижает прочность примерно до уровня, доступного при 1200°F.
Два классических случая коррозионного растрескивания под напряжением — это «сезонное растрескивание» латуни и «охрупчивание под действием щелочи» стали. Оба этих устаревших термина описывают присутствующие условия окружающей среды, которые привели к коррозионному растрескиванию под напряжением. Сезонное растрескивание относится к растрескиванию латунных гильз под напряжением и коррозией. В периоды сильных дождей, особенно в тропиках, в латунных гильзах наблюдались трещины в месте прижатия гильзы к пуле. Позже было обнаружено, что важным экологическим компонентом сезонного растрескивания был аммиак, образующийся в результате разложения органического вещества.
В периоды сильных дождей, особенно в тропиках, в латунных гильзах наблюдались трещины в месте прижатия гильзы к пуле. Позже было обнаружено, что важным экологическим компонентом сезонного растрескивания был аммиак, образующийся в результате разложения органического вещества.
Многие взрывы клепаных котлов происходили в первых паровых локомотивах. Изучение этих отказов показало трещины или хрупкие разрушения в отверстиях для заклепок. Эти области были подвергнуты холодной обработке во время операций клепки, и анализ беловатых отложений, обнаруженных в этих областях, показал, что основным компонентом является едкий натр или гидроксид натрия. Следовательно, хрупкое разрушение в присутствии каустика привело к термину едкое охрупчивание. В то время как только напряжение будет реагировать способами, хорошо известными в механической металлургии (т. Е. Ползучесть, усталость, разрушение при растяжении), и только коррозия будет реагировать, вызывая характерные реакции растворения; одновременное действие обоих иногда приводит к катастрофическим результатам.
Формы коррозии — AMPP
Ценную информацию для решения проблем с коррозией часто можно получить путем тщательного наблюдения за корродированными испытательными образцами или вышедшим из строя оборудованием.
На самом деле коррозия классифицируется по тому, как она проявляется. Различные его формы сгруппированы по внешнему виду корродированного металла с формами коррозии, идентифицированными при визуальном наблюдении. В большинстве случаев достаточно невооруженного глаза, но иногда полезно или требуется увеличение.
Многие формы коррозии обсуждаются с точки зрения их характеристик, механизмов и профилактических мер по ссылкам ниже.
Связанный: Микробиологическая коррозия
Хотя технически это не форма коррозии, микробы или бактерии на поверхности материала могут ускорить процесс износа, вызывая микробиологическую коррозию.
Кавитационная эрозия
Кавитация возникает, когда рабочее давление жидкости падает ниже давления пара, вызывая образование и разрушение газовых карманов и пузырьков. Это может происходить довольно взрывным и драматичным образом. Фактически, это может произвести пар на всасывании насоса за считанные минуты. Когда технологической жидкостью должна быть вода с температурой 20-35°C, это совершенно неприемлемо. Кроме того, в этом состоянии может образоваться воздушная пробка, которая препятствует охлаждению поступающей жидкости, что еще больше усугубляет проблему. Места, где это наиболее вероятно, включают:
Это может происходить довольно взрывным и драматичным образом. Фактически, это может произвести пар на всасывании насоса за считанные минуты. Когда технологической жидкостью должна быть вода с температурой 20-35°C, это совершенно неприемлемо. Кроме того, в этом состоянии может образоваться воздушная пробка, которая препятствует охлаждению поступающей жидкости, что еще больше усугубляет проблему. Места, где это наиболее вероятно, включают:
- На всасывании насоса, особенно при работе вблизи необходимого чистого положительного напора на всасывании ((NPSHR)
- На выходе клапана или регулятора, особенно при работе в почти закрытом положении
- В других участках потока с геометрией, влияющих на геометрию, таких как отводы труб и расширения
- Процессами, сопровождающимися внезапным расширением, которое может привести к резкому падению давления
Эта форма коррозии разъедает улитки и рабочие колеса центробежных насосов со сверхчистой водой в качестве жидкости. Он съест седла клапанов. Это будет способствовать другим формам эрозионной коррозии, например, в отводах и тройниках. Кавитация должна быть спроектирована путем уменьшения градиентов гидродинамического давления и проектирования, чтобы избежать падения давления ниже давления паров жидкости и проникновения воздуха. Использование эластичных покрытий и катодной защиты также можно рассматривать как дополнительные методы контроля.
Он съест седла клапанов. Это будет способствовать другим формам эрозионной коррозии, например, в отводах и тройниках. Кавитация должна быть спроектирована путем уменьшения градиентов гидродинамического давления и проектирования, чтобы избежать падения давления ниже давления паров жидкости и проникновения воздуха. Использование эластичных покрытий и катодной защиты также можно рассматривать как дополнительные методы контроля.
Щелевая коррозия
Щелевая коррозия представляет собой локализованную форму коррозии, обычно связанную с застойным раствором на уровне микросреды. Такая застойная микросреда имеет тенденцию возникать в щелях, таких как щели, образованные под прокладками, шайбами, изоляционным материалом, головками крепежных изделий, поверхностными отложениями, отслоившимся покрытием, резьбой, соединениями внахлестку и хомутами. Щелевая коррозия инициируется изменениями местного химического состава в щели:
- Истощение ингибитора в щели
- Истощение кислорода в расщелине
- Переход к кислотным условиям в расщелине
- Накопление агрессивных ионов (например, хлорида) в щели
Все формы коррозии концентрационных ячеек могут быть очень агрессивными, и все они возникают из-за различий в окружающей среде на поверхности металла. Даже самая благоприятная атмосферная среда может стать чрезвычайно агрессивной, как показано на этом примере коррозии самолета (изображение предоставлено Майком Далагером). Эта развитая форма щелевой коррозии называется «подушкой».
Даже самая благоприятная атмосферная среда может стать чрезвычайно агрессивной, как показано на этом примере коррозии самолета (изображение предоставлено Майком Далагером). Эта развитая форма щелевой коррозии называется «подушкой».
Наиболее распространенной формой является кислородная дифференциальная коррозия ячеек. Это происходит потому, что влага имеет более низкое содержание кислорода, когда она находится в расщелине, чем когда она находится на поверхности. Меньшее содержание кислорода в щели образует анод на поверхности металла. Поверхность металла, соприкасающаяся с частью пленки влаги, контактирующей с воздухом, образует катод.
Особая форма щели, в которой происходит накопление агрессивных химических веществ под нарушенной защитной пленкой, называется «нитевидной коррозией». Под изоляцией может возникнуть сильная форма щелевой коррозии.
Коррозионная усталость
Коррозионная усталость является результатом совместного действия переменных или циклических напряжений и коррозионной среды. Считается, что процесс усталости вызывает разрыв защитной пассивной пленки, при котором ускоряется коррозия. Если металл одновременно подвергается воздействию агрессивной среды, разрушение может произойти при еще меньших нагрузках и по истечении более короткого времени.
Считается, что процесс усталости вызывает разрыв защитной пассивной пленки, при котором ускоряется коррозия. Если металл одновременно подвергается воздействию агрессивной среды, разрушение может произойти при еще меньших нагрузках и по истечении более короткого времени.
В агрессивной среде уровень напряжения, при котором можно предположить, что материал имеет бесконечный срок службы, снижается или полностью устраняется. В отличие от чисто механической усталости, при коррозионной усталости нет предельной усталостной нагрузки.
Коррозионная усталость и истирание относятся к этому классу. В коррозионной среде могут возникать гораздо более низкие напряжения разрушения и гораздо более короткое время отказа по сравнению с ситуацией, когда переменное напряжение возникает в некоррозионной среде.
Усталостное разрушение хрупкое, трещины чаще всего транскристаллитные, как при коррозионном растрескивании, но не разветвленные. Коррозионная среда может вызвать более быстрый рост трещин и/или рост трещин при более низком уровне натяжения, чем в сухом воздухе. Даже относительно мягкие коррозионные среды могут значительно снизить усталостную прочность алюминиевых конструкций, вплоть до 75-25% от усталостной прочности в сухом воздухе. Ни один металл не застрахован от некоторого снижения его стойкости к циклическим нагрузкам, если металл находится в агрессивной среде. Бороться с коррозионной усталостью можно либо путем снижения циклических напряжений, либо с помощью различных мер по борьбе с коррозией. См. контрольный список.
Даже относительно мягкие коррозионные среды могут значительно снизить усталостную прочность алюминиевых конструкций, вплоть до 75-25% от усталостной прочности в сухом воздухе. Ни один металл не застрахован от некоторого снижения его стойкости к циклическим нагрузкам, если металл находится в агрессивной среде. Бороться с коррозионной усталостью можно либо путем снижения циклических напряжений, либо с помощью различных мер по борьбе с коррозией. См. контрольный список.
Контрольный список возможностей защиты
- Минимизация или устранение циклических нагрузок
- Уменьшить концентрацию напряжения или перераспределить напряжение (сбалансировать прочность и напряжение по всему компоненту)
- Выберите правильную форму критических секций
- Защита от быстрых изменений нагрузки, температуры или давления
- Избегайте внутреннего напряжения
- Конструкция, исключающая трепетание и создание или передачу вибрации
- Увеличение собственной частоты для уменьшения усталости от резонансной коррозии
- Предельный коэффициент коррозии в коррозионно-усталостном процессе (более стойкий материал/менее коррозионная среда)
Делегирование (селективное выщелачивание)
Делегирование или селективное выщелачивание относится к селективному удалению одного элемента из сплава в результате процессов коррозии. Распространенным примером является обесцинкование нестабилизированной латуни, в результате чего образуется ослабленная пористая медная структура. Селективное удаление цинка может происходить равномерно или в локализованном (пробковом) масштабе. Обесцинкование трудно объяснить преимущественным растворением цинка из структуры решетки латуни. Скорее, считается, что латунь растворяется, когда Zn остается в растворе, а медь снова выходит из раствора. Еще одним примером селективного выщелачивания является графитная коррозия серого чугуна, при которой хрупкий графитовый скелет остается после предпочтительного растворения железа. Термин «графитизация» обычно используется для обозначения этой формы коррозии, но не рекомендуется из-за его использования в металлургии для разложения карбида до графита.
Распространенным примером является обесцинкование нестабилизированной латуни, в результате чего образуется ослабленная пористая медная структура. Селективное удаление цинка может происходить равномерно или в локализованном (пробковом) масштабе. Обесцинкование трудно объяснить преимущественным растворением цинка из структуры решетки латуни. Скорее, считается, что латунь растворяется, когда Zn остается в растворе, а медь снова выходит из раствора. Еще одним примером селективного выщелачивания является графитная коррозия серого чугуна, при которой хрупкий графитовый скелет остается после предпочтительного растворения железа. Термин «графитизация» обычно используется для обозначения этой формы коррозии, но не рекомендуется из-за его использования в металлургии для разложения карбида до графита.
При графитовой коррозии чугуна пористая графитовая сетка, составляющая 4-5% от общей массы сплава, пропитывается нерастворимыми продуктами коррозии. В результате чугун сохраняет свой внешний вид и форму, но структурно слабее. Проверка и идентификация графитовой коррозии осуществляется путем соскребания поверхности ножом, чтобы выявить крошение железа под ней. Когда происходит обширная графитовая коррозия, обычно единственным решением является замена поврежденного элемента.
Проверка и идентификация графитовой коррозии осуществляется путем соскребания поверхности ножом, чтобы выявить крошение железа под ней. Когда происходит обширная графитовая коррозия, обычно единственным решением является замена поврежденного элемента.
Растрескивание под воздействием окружающей среды
Растрескивание под воздействием окружающей среды относится к коррозионному растрескиванию, вызванному сочетанием условий, которые могут привести к одной из следующих форм коррозионного повреждения:
Коррозионное растрескивание под напряжением (SCC)
Напряжения, вызывающие растрескивание под воздействием окружающей среды, возникают в результате остаточной холодной обработки, сварки, шлифовки, термической обработки или могут возникать извне во время эксплуатации и, чтобы быть эффективными, должны быть растягивающими (в отличие от сжимающих).
Определение напряжения или переменные напряжения
- Среднее напряжение
- Максимальное напряжение
- Минимальное напряжение
- Постоянная нагрузка/постоянная деформация
- Скорость деформации
- Плоское напряжение/плоская деформация
- Режимы I, II или III
- Двухосный
- Циклическая частота
- Форма волны
Возникновение стресса
- Преднамеренное
- Остаток
- Резка, пробивка, резка
- Гибка, опрессовка, клепка
- Сварка
- Механическая обработка
- Шлифование
Производится из продуктов реакции
- Применяется
- Закалка
- Термоциклирование
- Тепловое расширение
- Вибрация
- Вращение
- Болтовое соединение
- Постоянная нагрузка
- Давление
Трещины образуются и распространяются примерно под прямым углом к направлению растягивающих напряжений при уровнях напряжений, значительно меньших, чем те, которые необходимы для разрушения материала в отсутствие агрессивной среды. По мере того, как трещины проникают глубже в материал, они в конечном итоге уменьшают опорное поперечное сечение материала до точки разрушения конструкции из-за перегрузки. SCC возникает в металлах, подвергающихся воздействию окружающей среды, в которой, если бы напряжение отсутствовало или было бы на гораздо более низком уровне, не было бы повреждений. Если бы конструкция, подверженная тем же нагрузкам, находилась в другой среде (неагрессивной для этого материала), разрушения не было бы. Примерами SCC в атомной промышленности являются трещины в трубопроводных системах из нержавеющей стали и штоках клапанов из нержавеющей стали.
По мере того, как трещины проникают глубже в материал, они в конечном итоге уменьшают опорное поперечное сечение материала до точки разрушения конструкции из-за перегрузки. SCC возникает в металлах, подвергающихся воздействию окружающей среды, в которой, если бы напряжение отсутствовало или было бы на гораздо более низком уровне, не было бы повреждений. Если бы конструкция, подверженная тем же нагрузкам, находилась в другой среде (неагрессивной для этого материала), разрушения не было бы. Примерами SCC в атомной промышленности являются трещины в трубопроводных системах из нержавеющей стали и штоках клапанов из нержавеющей стали.
Ячейки напряжения могут существовать в одном куске металла, где часть микроструктуры металла обладает большей накопленной энергией деформации, чем остальная часть металла. Атомы металлов находятся в самом низком энергетическом состоянии деформации, когда расположены в регулярном кристаллическом массиве.
Отклонения от этого состояния наименьшей деформации следующие:
- Границы усиления
- Высокое локализованное напряжение
- Холодная обработка
Границы зерен: По определению, атомы металла, расположенные вдоль границ зерен, не расположены в правильном кристаллическом массиве (то есть в зерне). Их повышенная энергия деформации преобразуется в электродный потенциал, анодный по отношению к металлу в самих зернах. Таким образом, коррозия может избирательно происходить по границам зерен.
Их повышенная энергия деформации преобразуется в электродный потенциал, анодный по отношению к металлу в самих зернах. Таким образом, коррозия может избирательно происходить по границам зерен.
Высокое локализованное напряжение: Области внутри металла, подверженные высокому локальному напряжению, будут содержать атомы металла в более высоком энергетическом состоянии деформации. В результате области с высоким напряжением будут анодными по отношению к областям с низким напряжением и могут подвергаться избирательной коррозии. Например, болты под нагрузкой подвержены большей коррозии, чем аналогичные болты без нагрузки. Хорошее эмпирическое правило состоит в том, чтобы выбирать крепеж, который является катодным (т.е. выше в электрохимической серии) по отношению к закрепляемому металлу, чтобы предотвратить коррозию крепежа.
Холодная обработка: Области в металле, подвергнутом холодной обработке, содержат более высокую концентрацию дислокаций и в результате будут анодными по отношению к не подвергнутым холодной обработке областям. Таким образом, нагартованные участки металла будут подвергаться коррозии быстрее. Например, согнутые гвозди часто подвергаются коррозии на изгибе или на головке, где их обрабатывали молотком.
Таким образом, нагартованные участки металла будут подвергаться коррозии быстрее. Например, согнутые гвозди часто подвергаются коррозии на изгибе или на головке, где их обрабатывали молотком.
Высокая твердость материала не обязательно гарантирует высокую степень устойчивости к эрозионной коррозии.
Эрозия
Эрозионная коррозия – это ускорение скорости коррозионного воздействия на металл из-за относительного движения агрессивной жидкости и поверхности металла. Повышенная турбулентность, вызванная питтингом на внутренних поверхностях трубы, может привести к быстрому увеличению скорости эрозии и, в конечном итоге, к утечке. Эрозионная коррозия также может усугубляться некачественной работой. Например, заусенцы, оставленные на концах обрезанных труб, могут нарушить плавный поток воды, вызвать локальную турбулентность и высокие скорости потока, что приведет к эрозионной коррозии. Сочетание эрозии и коррозии может привести к чрезвычайно высокой скорости точечной коррозии. В морских скважинных системах перерабатывающая промышленность, в которой компоненты вступают в контакт с жидкостями, содержащими песок, представляет собой проблему.
В морских скважинных системах перерабатывающая промышленность, в которой компоненты вступают в контакт с жидкостями, содержащими песок, представляет собой проблему.
Выбор материалов играет важную роль в минимизации повреждений, вызванных эрозией и коррозией. Следует соблюдать осторожность при прогнозировании эрозионно-коррозионного поведения на основе твердости. Высокая твердость материала не обязательно гарантирует высокую степень устойчивости к эрозионной коррозии. Особое значение имеют также конструктивные особенности.
Как правило, желательно снизить скорость жидкости и способствовать ламинарному потоку; В этом контексте полезны увеличенные диаметры труб. Грубые поверхности, как правило, нежелательны. Нежелательны конструкции, создающие турбулентность, ограничения потока и препятствия. Следует избегать резких изменений направления потока. Входные патрубки бака должны быть направлены от стен бака к центру. Сварные и фланцевые участки труб всегда должны быть тщательно выровнены. Ударные пластины перегородок, предназначенные для того, чтобы нести основную тяжесть повреждений, должны легко заменяться.
Ударные пластины перегородок, предназначенные для того, чтобы нести основную тяжесть повреждений, должны легко заменяться.
Толщина уязвимых мест должна быть увеличена. Сменные наконечники с коническим концом могут быть вставлены на входную сторону труб теплообменника, чтобы предотвратить повреждение самих трубок. Несколько модификаций окружающей среды могут быть реализованы для минимизации риска эрозионной коррозии. Абразивные частицы в жидкостях можно удалить путем фильтрации или отстаивания, а в системах с паром и сжатым воздухом можно использовать водоотделители для снижения риска попадания капель. Деаэрация и ингибиторы коррозии являются дополнительными мерами, которые можно предпринять. Катодная защита и нанесение защитного покрытия также могут снизить скорость атаки.
Отслаивание
Отслаивающая коррозия представляет собой особую форму межкристаллитной коррозии, связанную с высокопрочными алюминиевыми сплавами. Сплавы, подвергшиеся экструдированию или другой интенсивной обработке, с микроструктурой удлиненных, сплющенных зерен, особенно подвержены этому повреждению.
Продукты коррозии, накапливающиеся вдоль этих границ зерен, создают давление между зернами, и конечным результатом является эффект подъема или расслоения. Повреждение часто начинается с торцевых зерен, встречающихся на обработанных кромках, отверстиях или канавках, и впоследствии может распространяться на все сечение.
На изображении «Отслаивание компонента самолета» показано, как коррозия разделяется на отдельные слои, которые расширяются и занимают гораздо большую площадь, чем первоначальная некорродированная часть. Структурная целостность этой части давно исчезла.
Отслоение компонента самолета (Изображение предоставлено Майком Далагером).
Fillform Corrosion
Fillform — это особая форма щелевой коррозии, при которой накопление агрессивных химических веществ происходит под прорванной защитной пленкой. Нитевидная коррозия обычно начинается с небольших, иногда микроскопических дефектов покрытия. Наиболее подвержены этой проблеме лаки и «быстросохнущие» краски. Их использования следует избегать, если отсутствие неблагоприятного воздействия не доказано полевым опытом. Там, где требуется покрытие, оно должно обладать низкими характеристиками паропроницаемости и отличной адгезией. Покрытия с высоким содержанием цинка также следует рассматривать для покрытия углеродистой стали из-за их качества катодной защиты.
Их использования следует избегать, если отсутствие неблагоприятного воздействия не доказано полевым опытом. Там, где требуется покрытие, оно должно обладать низкими характеристиками паропроницаемости и отличной адгезией. Покрытия с высоким содержанием цинка также следует рассматривать для покрытия углеродистой стали из-за их качества катодной защиты.
Ползущая под краской коррозия под названием «нитевидная».
Фреттинг-коррозия
Фреттинг-коррозия относится к коррозионным повреждениям на неровностях контактных поверхностей. Это повреждение возникает под нагрузкой и при наличии повторяющихся относительных движений поверхности, например, вызванных вибрацией. Ямы или канавки и оксидные частицы характеризуют это повреждение, обычно встречающееся в механизмах, болтовых соединениях и шариковых или роликовых подшипниках. Контактные поверхности, подвергающиеся вибрации во время транспортировки, подвержены риску фреттинг-коррозии.
Повреждения, как видно на этом изображении (любезно предоставлено Майком Далагером), могут возникать на стыке двух высоконагруженных поверхностей, которые не предназначены для перемещения друг относительно друга. Наиболее распространенный тип истирания вызван вибрацией. Защитная пленка на металлических поверхностях снимается при трении и подвергает свежий активный металл коррозионному воздействию атмосферы.
Наиболее распространенный тип истирания вызван вибрацией. Защитная пленка на металлических поверхностях снимается при трении и подвергает свежий активный металл коррозионному воздействию атмосферы.
Гальваническая коррозия внутри горизонтального стабилизатора Статуи Свободы. Винт из нержавеющей стали со стопорной шайбой из стали с кадмиевым покрытием.
Гальваническая коррозия
Гальваническая коррозия (также называемая «коррозия разнородных металлов» или ошибочно «электролиз») относится к коррозионным повреждениям, возникающим при соединении двух разнородных материалов в агрессивном электролите. Это происходит, когда два (или более) разнородных металла приводят в электрический контакт под водой. Когда образуется гальваническая пара, один из металлов в паре становится анодом и подвергается коррозии быстрее, чем сам по себе, а другой становится катодом и подвергается коррозии медленнее, чем по отдельности.
Любой (или оба) металл в паре может или не может подвергаться коррозии сам по себе (сами). Однако при контакте с разнородным металлом скорость собственной коррозии изменится: коррозия анода ускорится, коррозия катода замедлится или даже прекратится. Гальваническая связь является основой многих методов мониторинга коррозии.
Однако при контакте с разнородным металлом скорость собственной коррозии изменится: коррозия анода ускорится, коррозия катода замедлится или даже прекратится. Гальваническая связь является основой многих методов мониторинга коррозии.
Движущей силой коррозии является разность потенциалов между различными материалами. Биметаллическая движущая сила была открыта в конце восемнадцатого века Луиджи Гальвани в серии экспериментов с обнаженными мышцами и нервами лягушки, которые сокращались при подключении к биметаллическому проводнику. Позднее этот принцип был применен на практике Алессандро Вольта, который построил в 1800 году первую электрическую ячейку или батарею: ряд металлических дисков двух видов, разделенных картонными дисками, пропитанными растворами кислот или солей. Это основа всех современных аккумуляторов с жидкостными элементами, и это было чрезвычайно важным научным открытием, потому что это был первый найденный метод генерации постоянного электрического тока.
Этот принцип был также использован для защиты металлических конструкций сэром Хамфри Дэви и Майклом Фарадеем в начале девятнадцатого века. Жертвенная коррозия одного металла, такого как цинк, магний или алюминий, является широко распространенным методом катодной защиты металлических конструкций.
Жертвенная коррозия одного металла, такого как цинк, магний или алюминий, является широко распространенным методом катодной защиты металлических конструкций.
В биметаллической паре менее благородный материал становится анодом этого коррозионного элемента и имеет тенденцию к коррозии с большей скоростью, чем в несвязанном состоянии. Более благородный материал будет действовать как катод в коррозионной ячейке. Гальваническая коррозия может быть одной из наиболее распространенных форм коррозии, а также одной из самых разрушительных.
Относительную благородность материала можно предсказать, измерив его коррозионный потенциал. Известный гальванический ряд перечисляет относительное благородство некоторых материалов в морской воде. Небольшое отношение площадей анод/катод крайне нежелательно. В этом случае гальванический ток концентрируется на небольшой анодной площади. В этих условиях имеет место быстрая потеря толщины растворяющегося анода. Проблемы гальванической коррозии должны быть решены путем проектирования, чтобы избежать этих проблем в первую очередь. Ячейки гальванической коррозии могут быть созданы на макроскопическом или микроскопическом уровне. На микроструктурном уровне гальваническим токам могут подвергаться различные фазы или другие особенности микроструктуры.
Ячейки гальванической коррозии могут быть созданы на макроскопическом или микроскопическом уровне. На микроструктурном уровне гальваническим токам могут подвергаться различные фазы или другие особенности микроструктуры.
Водородное охрупчивание
Этот тип износа может быть связан с коррозией и процессами борьбы с коррозией. Он включает проникновение водорода в компонент, событие, которое может серьезно снизить пластичность и несущую способность, а также вызвать растрескивание и катастрофические хрупкие разрушения при напряжениях ниже предела текучести восприимчивых материалов. Водородное охрупчивание происходит в нескольких формах, но общими чертами являются приложенное растягивающее напряжение и водород, растворенный в металле. Примерами водородного охрупчивания являются растрескивание сварных конструкций или закаленных сталей при воздействии условий, при которых водород впрыскивается в компонент. В настоящее время это явление до конца не изучено, и, в частности, обнаружение водородного охрупчивания представляется одним из самых сложных аспектов проблемы. Водородное охрупчивание не одинаково влияет на все металлические материалы. Наиболее уязвимыми являются высокопрочные стали, титановые и алюминиевые сплавы.
Водородное охрупчивание не одинаково влияет на все металлические материалы. Наиболее уязвимыми являются высокопрочные стали, титановые и алюминиевые сплавы.
Источники водорода
Источники водорода, вызывающие охрупчивание, встречались при производстве стали, обработке деталей, сварке, хранении или сдерживании газообразного водорода, а также связаны с водородом как загрязнителем окружающей среды, который часто является побочным продуктом общей коррозии. Именно последнее касается атомной отрасли. Водород может образовываться в результате коррозионных реакций, таких как ржавление, катодная защита и гальваническое покрытие. Водород также может быть добавлен к теплоносителю реактора для удаления кислорода из систем теплоносителя реактора. Поступление водорода, очевидное условие охрупчивания, может быть облегчено несколькими способами, кратко изложенными ниже: (Защитный стандарт 03-30, октябрь 2000 г.)
- некоторыми производственными операциями, такими как сварка, гальваническое покрытие, фосфатирование и травление; если материал, подвергнутый таким операциям, подвержен водородному охрупчиванию, то используется окончательная термообработка с обжигом для удаления любого водорода.

- в качестве побочного продукта реакции коррозии, например, в обстоятельствах, когда реакция образования водорода (уравнение 2) действует как катодная реакция, поскольку некоторая часть образующегося водорода может проникать в металл в атомарной форме, а не выделяться в виде газа в окружающая среда. В этой ситуации отказы от растрескивания часто можно рассматривать как разновидность коррозионного растрескивания под напряжением. Если присутствие сероводорода вызывает проникновение водорода в компонент, явление растрескивания часто называют «сульфидным растрескиванием под напряжением (SSC)» 9.1085
- использование катодной защиты для защиты от коррозии, если процесс не контролируется должным образом.
Водородное охрупчивание нержавеющей стали
Водород диффундирует по границам зерен и соединяется с углеродом, сплавленным с железом, с образованием газообразного метана. Газообразный метан неподвижен и скапливается в небольших пустотах вдоль границ зерен, где создает огромное давление, вызывающее трещины. Водородное охрупчивание является основной причиной того, что теплоноситель реактора поддерживается при нейтральном или щелочном pH на установках без алюминиевых компонентов.
Водородное охрупчивание является основной причиной того, что теплоноситель реактора поддерживается при нейтральном или щелочном pH на установках без алюминиевых компонентов.
Если металл находится под высоким растягивающим напряжением, может произойти хрупкое разрушение. При нормальных комнатных температурах атомы водорода поглощаются металлической решеткой и диффундируют через зерна, стремясь собраться во включениях или других дефектах решетки. Если напряжение вызывает растрескивание в этих условиях, траектория является транскристаллитной. При высоких температурах поглощенный водород имеет тенденцию собираться на границах зерен, и тогда вызванное напряжением растрескивание становится межкристаллитным. Считается, что растрескивание мартенситных и дисперсионно-твердеющих стальных сплавов является формой водородного коррозионного растрескивания под напряжением, которое возникает в результате проникновения в металл части атомарного водорода, образующегося в последующей коррозионной реакции.
Водородная хрупкость не является постоянным состоянием. Если растрескивания не происходит и условия окружающей среды изменены таким образом, что на поверхности металла не образуется водород, водород может повторно диффундировать из стали, так что пластичность восстанавливается.
Для решения проблемы водородного охрупчивания акцент делается на контроле количества остаточного водорода в стали, контроле количества водорода, поглощаемого при обработке, разработке сплавов с повышенной стойкостью к водородному охрупчиванию, разработке процессов гальванопокрытия или нанесения покрытий с низким или нулевым охрупчиванием , и ограничение количества водорода, вводимого на месте (в положении) в течение срока службы детали.
Межкристаллитная коррозия вышедшей из строя детали самолета из алюминия 7075-Т6.
Межкристаллитная коррозия
Микроструктура металлов и сплавов состоит из зерен, разделенных границами зерен. Межкристаллитная коррозия представляет собой локализованное воздействие вдоль границ зерен или непосредственно рядом с границами зерен, в то время как основная масса зерен остается практически незатронутой. Эта форма коррозии обычно связана с эффектами химической сегрегации (примеси имеют тенденцию накапливаться на границах зерен) или выделениями определенных фаз на границах зерен. Такие осадки могут создавать зоны пониженной коррозионной стойкости в непосредственной близости.
Эта форма коррозии обычно связана с эффектами химической сегрегации (примеси имеют тенденцию накапливаться на границах зерен) или выделениями определенных фаз на границах зерен. Такие осадки могут создавать зоны пониженной коррозионной стойкости в непосредственной близости.
Атака обычно связана с сегрегацией определенных элементов или образованием соединения на границе. Затем коррозия происходит за счет преимущественного воздействия на зернограничную фазу или в прилегающую к ней зону, которая потеряла элемент, необходимый для адекватной коррозионной стойкости, что делает зернограничную зону анодной по отношению к остальной части поверхности. Повреждение обычно распространяется по узкому пути вдоль границы зерен, и в тяжелых случаях зернограничной коррозии целые зерна могут быть смещены из-за полного разрушения их границ.
В любом случае механические свойства конструкции серьезно пострадают. Классическим примером является сенсибилизация нержавеющих сталей или распад сварного шва. Выделения на границах зерен, богатые хромом, приводят к локальному обеднению хромом, непосредственно прилегающим к этим выделениям, что делает эти области уязвимыми для коррозионного воздействия в определенных электролитах. Распространенной причиной этой проблемы является повторный нагрев свариваемого компонента во время многопроходной сварки. В аустенитных нержавеющих сталях титан или ниобий могут реагировать с углеродом с образованием карбидов в зоне термического влияния (ЗТВ), вызывая особый тип межкристаллитной коррозии, известный как коррозия по линии ножа. Эти карбиды накапливаются рядом с валиком сварного шва, где они не могут диффундировать из-за быстрого охлаждения металла сварного шва. Проблему повреждения по линии ножа можно решить повторным нагревом свариваемого металла, чтобы обеспечить диффузию.
Выделения на границах зерен, богатые хромом, приводят к локальному обеднению хромом, непосредственно прилегающим к этим выделениям, что делает эти области уязвимыми для коррозионного воздействия в определенных электролитах. Распространенной причиной этой проблемы является повторный нагрев свариваемого компонента во время многопроходной сварки. В аустенитных нержавеющих сталях титан или ниобий могут реагировать с углеродом с образованием карбидов в зоне термического влияния (ЗТВ), вызывая особый тип межкристаллитной коррозии, известный как коррозия по линии ножа. Эти карбиды накапливаются рядом с валиком сварного шва, где они не могут диффундировать из-за быстрого охлаждения металла сварного шва. Проблему повреждения по линии ножа можно решить повторным нагревом свариваемого металла, чтобы обеспечить диффузию.
Деформируемые алюминиевые сплавы
SL = короткая продольная
ST = короткая поперечная
LT = продольная поперечная
Расслаивающая коррозия является еще одной формой межкристаллитной коррозии, связанной с высокопрочными алюминиевыми сплавами. Сплавы, подвергшиеся экструдированию или другой интенсивной обработке, с микроструктурой удлиненных, сплющенных зерен, особенно подвержены этому повреждению. Продукты коррозии, накапливающиеся вдоль этих границ зерен, создают давление между зернами, и конечным результатом является эффект подъема или расслоения. Повреждение часто начинается с торцевых зерен, встречающихся на обработанных кромках, отверстиях или канавках, и впоследствии может распространяться на все сечение.
Сплавы, подвергшиеся экструдированию или другой интенсивной обработке, с микроструктурой удлиненных, сплющенных зерен, особенно подвержены этому повреждению. Продукты коррозии, накапливающиеся вдоль этих границ зерен, создают давление между зернами, и конечным результатом является эффект подъема или расслоения. Повреждение часто начинается с торцевых зерен, встречающихся на обработанных кромках, отверстиях или канавках, и впоследствии может распространяться на все сечение.
Пластинчатая коррозия
Пол Диллон, признанный авторитет в вопросах материалов и коррозии, говорит о пластинчатой коррозии следующее:
«Пламеллярная коррозия или отслоение? Глоссарий терминов ASM, том 13, коррозия, с. 6 определяет расслоение следующим образом:
Коррозия, которая развивается в поперечном направлении от мест возникновения вдоль плоскостей, параллельных поверхности, как правило, на границах зерен, образуя продукты коррозии, которые оттесняют металл от тела материала, придавая ему слоистый вид. Это также указывает на то, что это синоним «пластинчатой коррозии». Британская энциклопедия указывает, что этот термин предполагает состав или расположение в виде тонкого плоского слоя или чешуи. Ничто в глоссарии не ограничивает термин алюминием.
Это также указывает на то, что это синоним «пластинчатой коррозии». Британская энциклопедия указывает, что этот термин предполагает состав или расположение в виде тонкого плоского слоя или чешуи. Ничто в глоссарии не ограничивает термин алюминием.
В разделе «Выбор материалов», с. 334, Грег Кобрин утверждает, что отслоение затрагивает в первую очередь алюминиевые сплавы, при этом разрушение происходит латерально от мест инициации на поверхности и обычно происходит межкристаллитно вдоль плоскостей, параллельных поверхности. Дон Спроулс обсуждает оценку расслоения на стр. 242-3, особенно в отношении тестов ASTM (например, G34, G64, G66, G85 и т. д.).
Воздействие темперамента, с. 295 указано, что структурные слои раздвигаются объемными продуктами коррозии.
Я редактировал Руководство NACE № 1 «Формы распознавания и предотвращения коррозии» в 1977–1978 гг. вместе с серией авторитетных источников по «Восьми формам коррозии» Фонтана. В той версии не было упоминания об отшелушивании. Дейл Макинтайр обновил его в 1982 году как том 1 и 2. В последнем приведены две истории расслоения алюминия.
Дейл Макинтайр обновил его в 1982 году как том 1 и 2. В последнем приведены две истории расслоения алюминия.
Этот термин, по-видимому, был в значительной степени заимствован коррозионистами, занимающимися алюминием. Однако в т.ч. 13, сообщается об расслоении мельхиоров 80-20 и 70-30 в закрытых нагревателях питательной воды (стр. 9).89-990), восприимчивость увеличивается с содержанием никеля. Предположительно, эта проблема (в худшем случае при пиковых/циклических работах) решается за счет паровой или азотной подушки. Сообщалось также о пароперегревателях и подогревателях.
В сплавах черных металлов расслоение характеризуется чрезмерным внутренним ростом оксида, объем которого примерно в семь раз превышает объем стали. Чрезмерный внутренний рост оксида может повысить температуру, а отслоившийся материал может повредить турбины. Расслоение происходит в ферритных материалах, когда происходит многослойный рост. Напряжения вызываются температурными циклами и разницей в тепловом расширении шкалы и трубки. Расслоение также может происходить в аустенитных нержавеющих сталях, опять же из-за разницы в тепловом расширении между металлом и оксидом.
Расслоение также может происходить в аустенитных нержавеющих сталях, опять же из-за разницы в тепловом расширении между металлом и оксидом.
По-видимому, мы должны использовать более широкий термин «пластинчатая коррозия», если мы допускаем гораздо более широкое распространение расслоения в легких металлах. Лично меня это не волнует, но тогда Глоссарий должен быть переписан в этом замечательном новом 2-м издании тома 13!» Открытая атмосферная среда.Это выражение часто используется в отношении осмотра мостов для описания сборных элементов стальных мостов, на которых видны признаки ржавчины между стальными пластинами.(Изображения предоставлены Wayne A. Senick, Termarust)
При последующем осмотре должен быть обнаружен локальный катод, так как он останется невосприимчивым к коррозии.
Точечная коррозия
Точечная коррозия – это локальная форма коррозии, при которой в материале образуются полости или «отверстия». Точечная коррозия считается более опасной, чем равномерное коррозионное повреждение, потому что ее труднее обнаружить, предсказать и спроектировать против нее. Продукты коррозии часто покрывают ямки. Небольшой узкий шурф с минимальными общими потерями металла может привести к выходу из строя всей инженерной системы. Точечная коррозия, которая, например, является почти общим знаменателем всех видов локальной коррозии, может принимать различные формы. Питтинговая коррозия может образовывать язвы с открытым (незакрытым) устьем или покрытые полупроницаемой оболочкой продуктов коррозии. Ямы могут быть как полусферическими, так и чашеобразными.
Продукты коррозии часто покрывают ямки. Небольшой узкий шурф с минимальными общими потерями металла может привести к выходу из строя всей инженерной системы. Точечная коррозия, которая, например, является почти общим знаменателем всех видов локальной коррозии, может принимать различные формы. Питтинговая коррозия может образовывать язвы с открытым (незакрытым) устьем или покрытые полупроницаемой оболочкой продуктов коррозии. Ямы могут быть как полусферическими, так и чашеобразными.
Точечная коррозия вызывается:
- Локализованным химическим или механическим повреждением защитной оксидной пленки; Факторами химического состава воды, которые могут вызвать разрушение пассивной пленки, являются кислотность, низкие концентрации растворенного кислорода (которые делают защитную оксидную пленку менее стабильной) и высокие концентрации хлоридов (как в морской воде)
- Местное повреждение или плохое нанесение защитного покрытия
- Наличие неоднородностей в металлической структуре детали, напр.
 неметаллические включения
неметаллические включения
Теоретически локальная ячейка, которая приводит к возникновению ямки, может быть вызвана аномальным анодным участком, окруженным нормальной поверхностью, которая действует как катод, или наличием аномального катодного участка, окруженного нормальной поверхностью, на которой ямка исчезнет из-за коррозии.
Во втором случае постобследование должно выявить локальный катод, поскольку он останется невосприимчивым к коррозионному воздействию, как на изображении алюминиевого образца, показанного на изображении. Считается, что большинство случаев питтинга вызвано локальными катодными участками на нормальной поверхности.
Помимо локальной потери толщины, коррозионные язвы также могут быть опасны, действуя как концентраторы напряжения. В основании коррозионных ямок может начаться усталостное и коррозионное растрескивание под напряжением. Одной ямы в большой системе может быть достаточно, чтобы привести к катастрофическому отказу этой системы. Крайний пример такого катастрофического отказа произошел недавно в Мексике, где одной ямы на бензинопроводе, проходящем через канализационную трубу, было достаточно, чтобы создать большой хаос в городе, убив 215 человек в Гвадалахаре.
Крайний пример такого катастрофического отказа произошел недавно в Мексике, где одной ямы на бензинопроводе, проходящем через канализационную трубу, было достаточно, чтобы создать большой хаос в городе, убив 215 человек в Гвадалахаре.
Некоторые определения:
- Точечная коррозия: Коррозия металлической поверхности, ограниченная точечной или небольшой областью, которая принимает форму полостей.
- Коэффициент точечной коррозии: Отношение глубины самой глубокой язвы, образовавшейся в результате коррозии, к среднему проникновению, рассчитанному по потере веса.
- Эквивалентное число стойкости к точечной коррозии (PREN): эмпирическое соотношение для прогнозирования стойкости к точечной коррозии наустенитных и дуплексных нержавеющих сталей. Он выражается как PREN = Cr + 3,3 (Mo + 0,5 W) + 16N.
Типы коррозии пиття:
Квалы:
Узкие, Deep
Шлоу.
Подповерхностный слой
Подрезка
Горизонтальное разрушение зерен
Межкристаллитный SCC трубы теплообменника из инконеля с трещиной, идущей по границам зерен.
Коррозионное растрескивание под напряжением (SCC)
Коррозионное растрескивание под напряжением (SCC) — это растрескивание, вызванное совместным воздействием растягивающего напряжения и коррозионной среды. Воздействие SCC на материал обычно находится между сухим растрескиванием и порогом усталости этого материала. Требуемые растягивающие напряжения могут быть в виде непосредственно приложенных напряжений или в виде остаточных напряжений. Сама проблема может быть довольно сложной. Ситуация с подземными трубопроводами является хорошим примером такой сложности.
Холодная деформация и формовка, сварка, термическая обработка, механическая обработка и шлифовка могут создавать остаточные напряжения. Величина и важность таких стрессов часто недооценивается. Остаточные напряжения, возникающие в результате сварочных работ, стремятся к пределу текучести. Накопление продуктов коррозии в замкнутом пространстве также может создавать значительные напряжения, и его нельзя упускать из виду. SCC обычно возникает в определенных сочетаниях сплав-среда-напряжение.
Величина и важность таких стрессов часто недооценивается. Остаточные напряжения, возникающие в результате сварочных работ, стремятся к пределу текучести. Накопление продуктов коррозии в замкнутом пространстве также может создавать значительные напряжения, и его нельзя упускать из виду. SCC обычно возникает в определенных сочетаниях сплав-среда-напряжение.
Коррозионное растрескивание под напряжением (SCC) – это растрескивание, вызванное совместным воздействием растягивающего напряжения и коррозионной среды. Воздействие SCC на материал обычно находится между сухим растрескиванием и порогом усталости этого материала. Требуемые растягивающие напряжения могут быть в виде непосредственно приложенных напряжений или в виде остаточных напряжений. Сама проблема может быть довольно сложной. Ситуация с подземными трубопроводами является хорошим примером такой сложности.
Холодная деформация и формовка, сварка, термическая обработка, механическая обработка и шлифование могут создавать остаточные напряжения. Величина и важность таких стрессов часто недооценивается. Остаточные напряжения, возникающие в результате сварочных работ, стремятся к пределу текучести. Накопление продуктов коррозии в замкнутом пространстве также может создавать значительные напряжения, и его нельзя упускать из виду. SCC обычно возникает в определенных сочетаниях сплав-среда-напряжение.
Величина и важность таких стрессов часто недооценивается. Остаточные напряжения, возникающие в результате сварочных работ, стремятся к пределу текучести. Накопление продуктов коррозии в замкнутом пространстве также может создавать значительные напряжения, и его нельзя упускать из виду. SCC обычно возникает в определенных сочетаниях сплав-среда-напряжение.
SCC в системе трубопроводов химической обработки из нержавеющей стали 316.
Обычно большая часть поверхности остается нетронутой, но с мелкими трещинами, проникающими в материал. В микроструктуре эти трещины могут иметь межкристаллитную или трансзернистую морфологию. Макроскопически переломы SCC имеют хрупкий вид. SCC классифицируется как катастрофическая форма коррозии, поскольку обнаружение таких мелких трещин может быть очень трудным, а повреждение трудно предсказать. Экспериментальные данные SCC отличаются большим разбросом. Катастрофический отказ может произойти неожиданно с минимальными общими материальными потерями.
На первой микрофотографии (X500) показан межкристаллитный SCC трубы теплообменника из инконеля с трещиной, идущей по границам зерен.
На второй микрофотографии (X300) показан SCC в системе трубопроводов химической обработки из нержавеющей стали 316. Коррозионное растрескивание под напряжением хлорида в аустенитной нержавеющей стали характеризуется многоразветвленной транскристаллитной структурой трещин типа «молния». (Оба изображения любезно предоставлены Metallurgical Technologies, Inc.)
Катастрофический характер этой серьезной формы коррозионного воздействия неоднократно демонстрировался во многих заслуживающих внимания неудачах, включая обрушение крыши бассейна в Устере, Швейцария, и крушение Боинга 747 в Амстердам.
Одной из наиболее важных форм коррозии под напряжением в атомной промышленности является коррозия под напряжением хлоридов. Хлоридная коррозия под напряжением представляет собой тип межкристаллитной коррозии и возникает в аустенитной нержавеющей стали при растягивающем напряжении в присутствии кислорода, ионов хлорида и высокой температуры. Считается, что это начинается с отложений карбида хрома вдоль границ зерен, которые оставляют металл открытым для коррозии. Эту форму коррозии контролируют путем поддержания низкого содержания ионов хлорида и кислорода в окружающей среде и использования низкоуглеродистых сталей.
Эту форму коррозии контролируют путем поддержания низкого содержания ионов хлорида и кислорода в окружающей среде и использования низкоуглеродистых сталей.
Несмотря на обширную квалификацию инконеля для конкретных применений, с трубками из инконеля возник ряд проблем с коррозией. Улучшенная стойкость к коррозионному растрескиванию под действием щелочи может быть придана инконелю путем его термообработки при температуре от 620°C до 705°C, в зависимости от температуры предварительной обработки на твердый раствор. Другие проблемы, которые наблюдались при использовании инконеля, включают потери, вмятины на трубах, точечную коррозию и межкристаллитное разрушение.
Равномерная коррозия
Равномерная коррозия характеризуется коррозионным воздействием, распространяющимся равномерно по всей площади поверхности или на значительной ее части. Общее истончение происходит до отказа. Исходя из потерянного тоннажа, это самая важная форма коррозии.
Однако равномерную коррозию относительно легко измерить и предсказать, что делает катастрофические отказы относительно редкими. Во многих случаях это нежелательно только с точки зрения внешнего вида. Поскольку коррозия происходит равномерно по всей поверхности металлической детали, ее практически можно контролировать с помощью катодной защиты, использования покрытий или красок или просто путем определения допуска на коррозию. В других случаях равномерная коррозия придает поверхности цвет и привлекательность. Две классики в этом отношении — это патина, создаваемая естественным образом тускнеющими медными крышами, и оттенки ржавчины, возникающие на атмосферостойкой стали.
Во многих случаях это нежелательно только с точки зрения внешнего вида. Поскольку коррозия происходит равномерно по всей поверхности металлической детали, ее практически можно контролировать с помощью катодной защиты, использования покрытий или красок или просто путем определения допуска на коррозию. В других случаях равномерная коррозия придает поверхности цвет и привлекательность. Две классики в этом отношении — это патина, создаваемая естественным образом тускнеющими медными крышами, и оттенки ржавчины, возникающие на атмосферостойкой стали.
Разрушение систем защитных покрытий конструкций часто приводит к этой форме коррозии. Помутнение блестящей или полированной поверхности, травление кислотными очистителями или окисление (обесцвечивание) стали являются примерами поверхностной коррозии. Сплавы и нержавеющая сталь, устойчивые к коррозии, могут потускнеть или окислиться в агрессивных средах. Тем не менее, поверхностная коррозия может указывать на нарушение системы защитного покрытия и должна быть тщательно изучена для более серьезного воздействия. Если позволить поверхностной коррозии продолжаться, поверхность может стать шероховатой, а поверхностная коррозия может привести к более серьезным видам коррозии.
Если позволить поверхностной коррозии продолжаться, поверхность может стать шероховатой, а поверхностная коррозия может привести к более серьезным видам коррозии.
Типы коррозии и предотвращение — различные типы коррозии
Опубликовано в июне 2017 г.
В предыдущем посте мы обсудили основы коррозии — от фундаментальной химической реакции до типов сред, в которых может возникнуть коррозия. Поскольку коррозия чаще всего возникает в водной среде, теперь мы исследуем различные типы деградации металла, которые могут возникнуть в таких условиях: коррозии. Он также является наиболее безобидным, поскольку степень атаки относительно легко оценить, а результирующее влияние на характеристики материала довольно легко оценить благодаря способности последовательно воспроизводить и тестировать явление. Этот тип коррозии обычно возникает на относительно больших участках поверхности материала.
Точечная коррозия
Точечная коррозия является одним из наиболее разрушительных видов коррозии, поскольку ее трудно предсказать, обнаружить и охарактеризовать. Точечная коррозия представляет собой локализованную форму коррозии, при которой либо локальная анодная точка, либо, чаще, катодная точка образуют небольшую коррозионную ячейку с окружающей нормальной поверхностью. После образования ямы она превращается в «дыру» или «полость», которая принимает одну из множества различных форм. Ямы обычно проникают с поверхности вниз в вертикальном направлении. Питтинговая коррозия может быть вызвана локальным разрывом или повреждением защитной оксидной пленки или защитного покрытия; это также может быть вызвано неоднородностью самой структуры металла. Точечная коррозия опасна тем, что может привести к разрушению конструкции при относительно небольших общих потерях металла.
Точечная коррозия представляет собой локализованную форму коррозии, при которой либо локальная анодная точка, либо, чаще, катодная точка образуют небольшую коррозионную ячейку с окружающей нормальной поверхностью. После образования ямы она превращается в «дыру» или «полость», которая принимает одну из множества различных форм. Ямы обычно проникают с поверхности вниз в вертикальном направлении. Питтинговая коррозия может быть вызвана локальным разрывом или повреждением защитной оксидной пленки или защитного покрытия; это также может быть вызвано неоднородностью самой структуры металла. Точечная коррозия опасна тем, что может привести к разрушению конструкции при относительно небольших общих потерях металла.
Щелевая коррозия
Щелевая коррозия также является локализованной формой коррозии и обычно является результатом застойной микросреды, в которой существует разница в концентрации ионов между двумя участками металла. Щелевая коррозия возникает в защищенных зонах, например, под шайбами, головками болтов, прокладками и т. д., где доступ кислорода ограничен. Эти меньшие площади позволяют проникнуть коррозионному агенту, но не обеспечивают достаточной циркуляции внутри, истощая содержание кислорода, что предотвращает повторную пассивацию. По мере образования застойного раствора pH сдвигается от нейтрального. Этот растущий дисбаланс между щелью (микросреда) и внешней поверхностью (объемная среда) способствует более высокой скорости коррозии. Щелевая коррозия часто может возникать при более низких температурах, чем точечная коррозия. Правильная конструкция соединения помогает свести к минимуму щелевую коррозию.
д., где доступ кислорода ограничен. Эти меньшие площади позволяют проникнуть коррозионному агенту, но не обеспечивают достаточной циркуляции внутри, истощая содержание кислорода, что предотвращает повторную пассивацию. По мере образования застойного раствора pH сдвигается от нейтрального. Этот растущий дисбаланс между щелью (микросреда) и внешней поверхностью (объемная среда) способствует более высокой скорости коррозии. Щелевая коррозия часто может возникать при более низких температурах, чем точечная коррозия. Правильная конструкция соединения помогает свести к минимуму щелевую коррозию.
Межкристаллитная коррозия
При исследовании микроструктуры металла выявляются зерна, образующиеся при затвердевании сплава, а также границы зерен между ними. Межкристаллитная коррозия может быть вызвана примесями, присутствующими на этих границах зерен, или истощением или обогащением легирующим элементом на границах зерен. Межкристаллитная коррозия происходит вдоль этих зерен или рядом с ними, серьезно влияя на механические свойства металла, в то время как основная часть металла остается неповрежденной.
Примером межкристаллитной коррозии является осаждение карбида, химическая реакция, которая может происходить, когда металл подвергается воздействию очень высоких температур (например, 800°F — 1650°F) и/или локальным горячим работам, таким как сварка. В нержавеющих сталях во время этих реакций углерод «поглощает» хром, образуя карбиды и вызывая падение уровня хрома, оставшегося в сплаве, ниже 11%, необходимых для поддержания спонтанно формирующегося пассивного оксидного слоя. 304L и 316L представляют собой улучшенный химический состав нержавеющей стали 304 и 316, который содержит меньше углерода и обеспечивает наилучшую коррозионную стойкость к осаждению карбида.
Коррозионное растрескивание под напряжением (SCC)
Коррозионное растрескивание под напряжением (SCC) является результатом сочетания напряжения растяжения и агрессивной среды, часто при повышенных температурах. Коррозия под напряжением может возникнуть в результате внешнего напряжения, такого как фактические растягивающие нагрузки на металл или расширение/сжатие из-за быстрых изменений температуры. Это также может быть результатом остаточного напряжения, возникающего в процессе производства, например, при холодной штамповке, сварке, механической обработке, шлифовке и т. Д. При коррозии под напряжением большая часть поверхности обычно остается неповрежденной; однако в микроструктуре появляются мелкие трещины, из-за чего коррозию трудно обнаружить. Трещины обычно имеют хрупкий вид, формируются и распространяются в направлении, перпендикулярном местонахождению напряжения. Выбор подходящих материалов для данной среды (включая температуру и управление внешними нагрузками) может снизить вероятность катастрофического отказа из-за SCC.
Это также может быть результатом остаточного напряжения, возникающего в процессе производства, например, при холодной штамповке, сварке, механической обработке, шлифовке и т. Д. При коррозии под напряжением большая часть поверхности обычно остается неповрежденной; однако в микроструктуре появляются мелкие трещины, из-за чего коррозию трудно обнаружить. Трещины обычно имеют хрупкий вид, формируются и распространяются в направлении, перпендикулярном местонахождению напряжения. Выбор подходящих материалов для данной среды (включая температуру и управление внешними нагрузками) может снизить вероятность катастрофического отказа из-за SCC.
Гальваническая коррозия
Гальваническая коррозия представляет собой разрушение одного металла вблизи соединения, которое происходит, когда два электрохимически разнородных металла находятся в электрическом контакте в электролитической среде; например, когда медь находится в контакте со сталью в морской среде. Однако даже при выполнении этих трех условий существует множество других факторов, влияющих на вероятность и степень коррозии, например, температура и качество поверхности металлов. Крупные инженерные системы, в конструкции которых используются различные типы металлов, в том числе различные типы крепежных изделий и материалы, подвержены гальванической коррозии, если не соблюдать осторожность на этапе проектирования. Выбор металлов, которые находятся как можно ближе друг к другу в гальванической серии, помогает снизить риск гальванической коррозии.
Крупные инженерные системы, в конструкции которых используются различные типы металлов, в том числе различные типы крепежных изделий и материалы, подвержены гальванической коррозии, если не соблюдать осторожность на этапе проектирования. Выбор металлов, которые находятся как можно ближе друг к другу в гальванической серии, помогает снизить риск гальванической коррозии.
Заключение
В водной среде металлы могут подвергаться не только однородной коррозии, но и различным видам локальной коррозии, включая точечную, щелевую, межкристаллитную, стрессовую и гальваническую коррозию. В областях, где коррозия вызывает беспокойство, изделия из нержавеющей стали предлагают ценность и защиту от этих угроз. Благоприятный химический состав нержавеющей стали делает ее устойчивой ко многим распространенным коррозионным воздействиям, оставаясь при этом значительно более доступным по цене, чем специальные сплавы, такие как титан и сплавы Inconel®.
Нержавеющая сталь представляет собой высоколегированную низкоуглеродистую сталь с высоким (не менее 11%) содержанием хрома. Под воздействием насыщенной кислородом среды хром вступает в реакцию, образуя пассивный оксидный слой на поверхности металла, замедляя дальнейшее окисление и обеспечивая качество самовосстановления, что помогает противостоять равномерной и локальной коррозии. Никель помогает стабилизировать микроструктуру, повышая устойчивость к SCC. Марганец в умеренных количествах и в сочетании с никелем будет выполнять многие функции, присущие никелю, и помогает предотвратить точечную коррозию. Добавление молибдена (дополнительный элемент в нержавеющей стали типа 316, повышающий ее характеристики по сравнению с нержавеющей сталью типа 304) помогает повысить стойкость к точечной и щелевой коррозии. Пониженное содержание углерода, например, в стали 304L и 316L, поможет предотвратить межкристаллитную коррозию. Наконец, азот, хотя и не является основным элементом в составе нержавеющей стали, повышает устойчивость к точечной коррозии. Выбор нержавеющей стали может помочь значительно снизить риск коррозии и обеспечить долгосрочную экономию, избегая затрат, связанных с повторной установкой некачественных продуктов.
Под воздействием насыщенной кислородом среды хром вступает в реакцию, образуя пассивный оксидный слой на поверхности металла, замедляя дальнейшее окисление и обеспечивая качество самовосстановления, что помогает противостоять равномерной и локальной коррозии. Никель помогает стабилизировать микроструктуру, повышая устойчивость к SCC. Марганец в умеренных количествах и в сочетании с никелем будет выполнять многие функции, присущие никелю, и помогает предотвратить точечную коррозию. Добавление молибдена (дополнительный элемент в нержавеющей стали типа 316, повышающий ее характеристики по сравнению с нержавеющей сталью типа 304) помогает повысить стойкость к точечной и щелевой коррозии. Пониженное содержание углерода, например, в стали 304L и 316L, поможет предотвратить межкристаллитную коррозию. Наконец, азот, хотя и не является основным элементом в составе нержавеющей стали, повышает устойчивость к точечной коррозии. Выбор нержавеющей стали может помочь значительно снизить риск коррозии и обеспечить долгосрочную экономию, избегая затрат, связанных с повторной установкой некачественных продуктов.
По вопросам о различных типах коррозии или о нашем предложении из нержавеющей стали, пожалуйста, обращайтесь к нам.
8 наиболее распространенных форм коррозии металлов
Коррозия ежедневно воздействует на наше общество. Автомобили, здания, инфраструктура, бытовая техника и системы распределения энергии являются примерами некоторых компонентов, на которые отрицательно влияет это явление.
Реклама
Коррозия определяется как повреждение материала в результате химических реакций между ним и окружающей средой. Хотя коррозия затрагивает множество материалов, включая полимеры и керамику, этот термин чаще всего ассоциируется с деградацией металлов.
В исследовании 2016 года, проведенном NACE (ранее известной как Национальная ассоциация инженеров-коррозионистов) и изложенном в их публикации «Международные меры по предотвращению, применению и экономике технологии коррозии (IMPACT)», коррозия влечет за собой глобальные затраты в размере 2,5 триллиона долларов США. Эта цифра составляет примерно 3,4 процента мирового валового внутреннего продукта (ВВП).
Эта цифра составляет примерно 3,4 процента мирового валового внутреннего продукта (ВВП).
Реклама
Наиболее распространенные типы коррозии
Коррозия состоит из ряда обычно сложных химических реакций и может быть инициирована несколькими различными механизмами, которые зависят от окружающей среды. Это привело к появлению различных классификаций коррозии.
Все виды коррозии неодинаковы. Ключ к эффективному предотвращению и смягчению коррозии лежит в базовом понимании типа коррозии, с которой приходится иметь дело, и факторов, ответственных за ее образование. В этой статье мы рассмотрим наиболее распространенные виды коррозии и объясним механизм, лежащий в основе каждого из них.
Равномерная коррозия
Равномерная коррозия является наиболее распространенным типом и характеризуется поражением всей поверхности металла, подвергающегося воздействию коррозионного агента. Этот тип коррозии обычно вызывается химическими или электрохимическими реакциями, в результате которых металл расходуется с образованием оксидов или других соединений на больших видимых участках. Эти реакции вызывают потерю толщины металла с течением времени и могут продолжаться до тех пор, пока металл полностью не растворится. (Узнайте, как авиационная промышленность справляется с этим типом коррозии, в статье «Обнаружение и лечение однородной коррозии в самолетах».)
Эти реакции вызывают потерю толщины металла с течением времени и могут продолжаться до тех пор, пока металл полностью не растворится. (Узнайте, как авиационная промышленность справляется с этим типом коррозии, в статье «Обнаружение и лечение однородной коррозии в самолетах».)
Гальваническая/биметаллическая коррозия
Биметаллическая коррозия, также известная как гальваническая коррозия, представляет собой коррозию, возникающую при прямом или косвенном контакте двух разнородных металлов друг с другом. Визуально этот вид коррозии характеризуется ускоренным износом одного металла, в то время как другой остается нетронутым.
Реклама
Биметаллическая коррозия — это чисто электрохимическая реакция, вызванная разницей электродных потенциалов между двумя металлами. При воздействии электролита два металла образуют тип элемента, известный как биметаллическая пара, где один металл действует как анод, а другой — как катод. Движение электронов от анода к катоду инициирует реакцию окисления на аноде, которая вызывает его растворение, то есть коррозию.
На этот тип коррозии влияет величина разности потенциалов между двумя металлами. Следовательно, чем дальше друг от друга находятся металлы в гальваническом ряду, тем выше скорость коррозии на аноде. (Эта тема рассматривается в серии «Введение в гальваническую серию: гальваническая совместимость и коррозия».)
Щелевая коррозия
Щелевая коррозия — это высокопроникающий тип локальной коррозии, который возникает в зазорах или щелях на поверхности или непосредственно рядом с ними. металл. Эти щели могут быть результатом соединения двух поверхностей (металла с металлом или металла с неметаллом) или скопления отложений (грязь, грязь, биообрастание и т. д.). Этот тип коррозии характеризуется разрушением в области щели, в то время как окружающие участки металлической подложки остаются нетронутыми.
Одним из основных критериев развития щелевой коррозии является наличие застоя воды в щели. Это отсутствие движения жидкости приводит к истощению растворенного кислорода и обилию положительных ионов в щели. Это приводит к ряду электрохимических реакций, которые изменяют состав жидкости и делают ее кислой по своей природе. Кислотная жидкость в щели разрушает пассивный слой металла и делает его уязвимым для коррозии.
Это приводит к ряду электрохимических реакций, которые изменяют состав жидкости и делают ее кислой по своей природе. Кислотная жидкость в щели разрушает пассивный слой металла и делает его уязвимым для коррозии.
Точечная коррозия
Точечная коррозия, также известная как точечная коррозия, представляет собой еще одну локализованную форму коррозии, возникающую на металлических поверхностях. Питтинг обычно проявляется в виде полостей или отверстий небольшого диаметра на поверхности объекта, в то время как остальная часть металлической поверхности остается нетронутой. Эта форма коррозии также обладает высокой проникающей способностью и считается одним из наиболее опасных видов коррозии, поскольку ее трудно предсказать и она имеет тенденцию вызывать внезапные и экстремальные отказы.
Точечная коррозия обычно возникает на участках металлической поверхности, где существуют несоответствия защитной пассивной пленки. Эти несоответствия могут быть вызваны повреждением пленки, некачественным нанесением покрытия или посторонними отложениями на поверхности металла. Области, где пассивность была уменьшена или потеряна, теперь становятся анодом, а окружающие области действуют как катод. В присутствии влаги анод и катод образуют коррозионную ячейку, в которой анод (т. е. незащищенные пассивирующей пленкой области) подвергается коррозии. Поскольку коррозия ограничивается локализованной областью, точечная коррозия имеет тенденцию проникать в толщу материала.
Области, где пассивность была уменьшена или потеряна, теперь становятся анодом, а окружающие области действуют как катод. В присутствии влаги анод и катод образуют коррозионную ячейку, в которой анод (т. е. незащищенные пассивирующей пленкой области) подвергается коррозии. Поскольку коррозия ограничивается локализованной областью, точечная коррозия имеет тенденцию проникать в толщу материала.
Межкристаллитная коррозия
Межкристаллитная коррозия включает ускоренную коррозию по границам зерен металла, в то время как основная часть поверхности металла остается свободной от коррозии. Некоторые сплавы при неправильной термообработке могут иметь сегрегацию примесей на границах зерен, что может затруднить пассивирование этих областей. Границы зерен теперь представляют собой путь высокой коррозионной уязвимости.
Например, аустенитные нержавеющие стали могут быть подвержены межкристаллитному разрушению, если их нагревают от 500°С до 800°С (9от 30°F до 1470°F). При этих температурах карбид хрома может выделяться на границах зерен, что снижает локальную концентрацию хрома на границах. (Дополнительную информацию по этой теме см. в разделе «Роль хрома в межкристаллитной коррозии».) Маловероятно, что граница зерен образует эффективную пассивную пленку и теперь подвержена коррозии.
При этих температурах карбид хрома может выделяться на границах зерен, что снижает локальную концентрацию хрома на границах. (Дополнительную информацию по этой теме см. в разделе «Роль хрома в межкристаллитной коррозии».) Маловероятно, что граница зерен образует эффективную пассивную пленку и теперь подвержена коррозии.
Селективное выщелачивание
В определенных агрессивных средах некоторые металлические сплавы могут подвергаться коррозии, при которой только один элемент сплава разрушается и удаляется в результате коррозии. Это дискриминационное удаление определенного элемента известно как селективное выщелачивание или удаление примесей.
Наиболее распространенным примером этого явления является селективное удаление менее благородного элемента цинка из латунных сплавов, также известное как обесцинкование. Сплавы, состоящие из металлических элементов, наиболее удаленных друг от друга в гальваническом ряду, наиболее подвержены этому типу коррозии.
Эрозионная коррозия
Эрозионная коррозия определяется как ускоренный износ металла в результате относительного движения между коррозионной жидкостью и поверхностью металла. По мере того, как жидкость течет по поверхности (обычно с высокой скоростью), пассивный оксидный слой металла может быть удален или растворен, в результате чего сплав может быть поврежден. Во время этого процесса металл может удаляться в виде растворенных ионов или в виде продуктов коррозии, которые механически смываются с поверхности металла под действием протекающей жидкости.
Эрозионная коррозия визуально распознается по появлению борозд, канав, кратеров и впадин в направленном узоре на металлической основе. (Узнайте, как предотвратить эрозионную коррозию, в статье «Эрозионная коррозия: покрытия и другие профилактические меры».) поверхности металла, в то время как металл остается незатронутым на большей части своей поверхности. Это растрескивание обычно происходит из-за одновременного наличия растягивающих напряжений в агрессивной среде. SCC считается коварной формой коррозии, потому что повреждение иногда не сразу обнаруживается во время осмотра и может привести к внезапным катастрофическим отказам.
SCC считается коварной формой коррозии, потому что повреждение иногда не сразу обнаруживается во время осмотра и может привести к внезапным катастрофическим отказам.
Сварка, термическая обработка и холодная деформация могут вызвать остаточные напряжения в объекте, которые могут вызвать SCC. Одной из ситуаций, когда может возникнуть SCC, являются границы зерен, подвергшихся коррозии в результате межкристаллитной коррозии. Поскольку границы зерен ослабли из-за сегрегации примесей, приложенные остаточные силы растяжения могут привести к мелкому растрескиванию микроструктуры.
Заключение
Коррозия существует во многих формах и может быть вызвана многочисленными механизмами. Есть много других, хотя и менее известных, видов коррозии, не упомянутых в этой статье.
Тип коррозии, которая может образоваться на конкретной металлической поверхности, зависит в первую очередь от окружающей среды и физических и химических свойств металла. Поэтому очень важно понимать механизмы, связанные с каждым типом коррозии, чтобы гарантировать, что при необходимости будут применяться наиболее эффективные меры предотвращения и смягчения последствий.


 В такой ситуации на конструкцию действует водная коррозия и высокая концентрация атмосферного кислорода
В такой ситуации на конструкцию действует водная коррозия и высокая концентрация атмосферного кислорода

 Затрагивает равномерно всю поверхность металлоизделия или конструкции.
Затрагивает равномерно всю поверхность металлоизделия или конструкции. На поверхности алюминия и алюминиевых сплавов в газовых средах образуется защитная пленка, защищающая их от коррозии. Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород.
На поверхности алюминия и алюминиевых сплавов в газовых средах образуется защитная пленка, защищающая их от коррозии. Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород. Самая распространенная. Протекает в условиях атмосферы или другого влажного газа.
Самая распространенная. Протекает в условиях атмосферы или другого влажного газа. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.

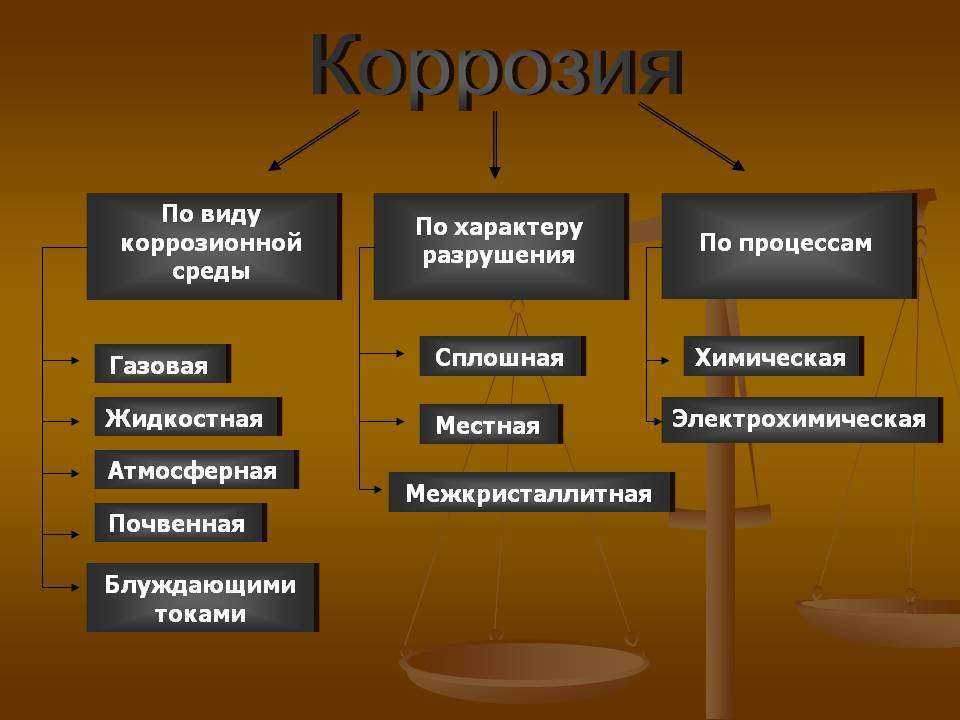 Увеличение массы происходит за счет реакции с кислородом и образования накипи.
Увеличение массы происходит за счет реакции с кислородом и образования накипи.
 Это является причиной агрессивной коррозионной реакции непокрытого материала.
Это является причиной агрессивной коррозионной реакции непокрытого материала.
