Содержание
Открытая Химия. Диаграммы плавкости
Диаграмма плавкости веществ с неограниченной растворимостью в жидком и полной нерастворимостью в твердом состоянии
Этот тип диаграмм характерен для веществ, заметно отличающихся структурой кристаллов.
Диаграмма температура–состав строится на основании кривых охлаждения (нагревания). Кривые охлаждения – графическое изображение зависимости температуры от времени для исходных чистых веществ A и B и их смесей различного состава. Вид этих кривых свидетельствует о наличии или отсутствии фазовых превращений при некоторых определенных температурах или в интервале температур (рис. 6.11.).
Расплав чистого компонента можно рассматривать как растворитель. Согласно закону Рауля, добавление второго компонента (растворенного вещества) вызывает понижение температуры кристаллизации системы (раствора). При охлаждении расплава, пока в охлаждаемой системе не происходит фазовых превращений, температура расплава падает с определенной скоростью. Появление кристаллов сопровождается выделением теплоты кристаллизации и замедляет или приостанавливает падение температуры, вызывая излом или площадку на кривой охлаждения.
При охлаждении расплава, пока в охлаждаемой системе не происходит фазовых превращений, температура расплава падает с определенной скоростью. Появление кристаллов сопровождается выделением теплоты кристаллизации и замедляет или приостанавливает падение температуры, вызывая излом или площадку на кривой охлаждения.
Из анализа кривых охлаждения (рис. 6.11а) следует, что смеси веществ при охлаждении претерпевают по два фазовых превращения, и изломы на их кривых характеризуют начало выделения из расплава кристаллов вещества A (кривая 2) или вещества B (кривая 4), а площадки – выделение эвтектической смеси, насыщенной в отношении обоих компонентов.
Таким образом, кристаллизация жидкой смеси в отличие от кристаллизации чистого вещества (кривые 1,5) сопровождается изменением состава жидкой фазы и лежит в некотором температурном интервале. Смесь эвтектического состава (кривая 3) кристаллизуется подобно чистым компонентам при постоянной температуре, поэтому дает монотонную кривую охлаждения с горизонтальным участком при эвтектической, наименьшей для данной системы температуре.
После окончания кристаллизации идет охлаждение отвердевшей системы до температуры окружающей среды.
Определив с помощью кривых охлаждения температуры кристаллизации для смесей различных составов, строят диаграмму состояния. Способ построения ясен из рисунка 6.11б.
На рис. 6.11б:
I – гомофазная жидкая область
II, III – гетерофазные области (расплав + твердая фаза)
IV – гетерофазная область (Aтв + Bтв)
E – эвтектика (состав с наименьшей tпл)
tАE – линия ликвидуса (liquid – жидкий) – геометрическое место точек, отвечающих температурам начала кристаллизации компонента A
tВE – линия ликвидуса – геометрическое место точек, отвечающих температурам начала кристаллизации компонента B
tAtEEtEtB – линия солидуса (solid – твердый), ниже которой существуют только твердые фазы.

Точка на диаграмме состояния, отвечающая составу образца, называется фигуративной.
Рассмотрим ход кристаллизации расплава с позиции правила фаз. Пока фигуративная точка 2 находится в гомогенной области I, никакие фазовые превращения не происходят, в системе имеет место дивариантное равновесие (С = 2 + 1 – 1 = 2), можно менять и температуру, и соотношение компонентов без изменения числа фаз. При температуре t1 расплав становится насыщенным по компоненту A, который выкристаллизовывается по мере понижения температуры. На кривой охлаждения наблюдается излом. При этом расплав обогащается компонентом B (состав расплава изменяется по линии ликвидуса к точке Е). В системе по линии ликвидуса и в двухфазной области II имеет место моновариантное равновесие, то есть изменение температуры в указанном интервале не приводит к изменению числа фаз (С = 2 + 1 – 2 = 1). Как только мы достигнем температуры tE, расплав окажется насыщенным относительно компонента В, и тогда оба компонента, А и В, выделяются в виде механической мелкодисперсной смеси кристаллов с постоянным составом до полной кристаллизации.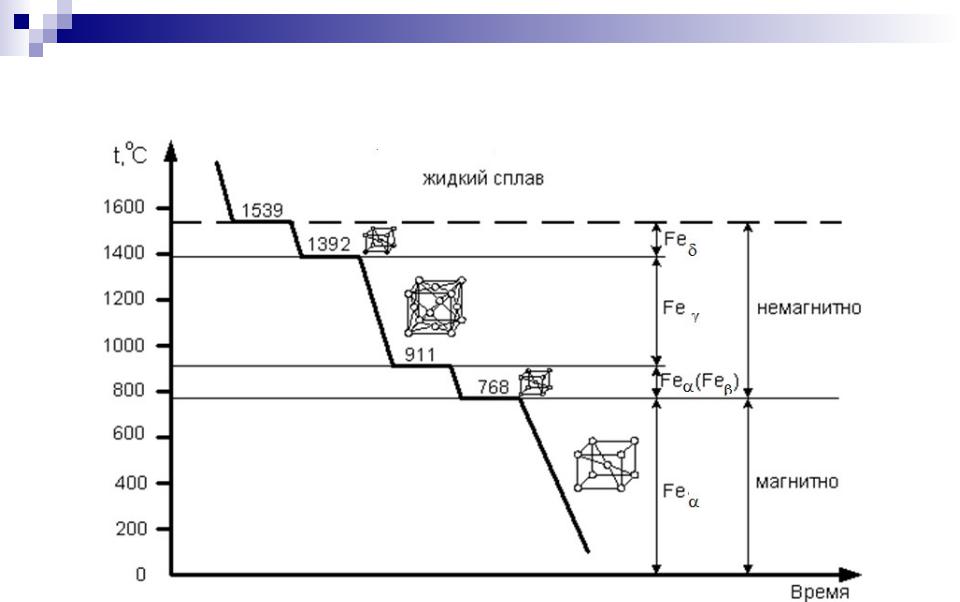 Этот расплав называется эвтектическим. Состав расплава не изменяется, температура тоже постоянна, и в равновесии находятся три фазы: одна жидкая и две твердые: LE и Aтв + Bтв. Следовательно, в эвтектической точке имеет место нонвариантное равновесие (С = 2 + 1 – 3 = 0). На кривой охлаждения горизонтальный участок. Нонвариантное равновесие имеет место также при кристаллизации чистого компонента и при кристаллизации химического соединения постоянного состава. Поскольку в данной системе из расплавов можно выделить два вида кристаллов (А и В), то и кривых ликвидуса тоже две. Аналогичным образом будет проходить кристаллизация расплавов по другую сторону от точки эвтектики.
Этот расплав называется эвтектическим. Состав расплава не изменяется, температура тоже постоянна, и в равновесии находятся три фазы: одна жидкая и две твердые: LE и Aтв + Bтв. Следовательно, в эвтектической точке имеет место нонвариантное равновесие (С = 2 + 1 – 3 = 0). На кривой охлаждения горизонтальный участок. Нонвариантное равновесие имеет место также при кристаллизации чистого компонента и при кристаллизации химического соединения постоянного состава. Поскольку в данной системе из расплавов можно выделить два вида кристаллов (А и В), то и кривых ликвидуса тоже две. Аналогичным образом будет проходить кристаллизация расплавов по другую сторону от точки эвтектики.
Каждая система имеет строго определенный состав фаз при данной температуре. В двухфазных областях II и III, называемых областями кристаллизации, состав твердой фазы однозначен, а состав жидкой фазы может быть определен пересечением соответствующей изотермы с линией ликвидуса и отнесением на ось состава.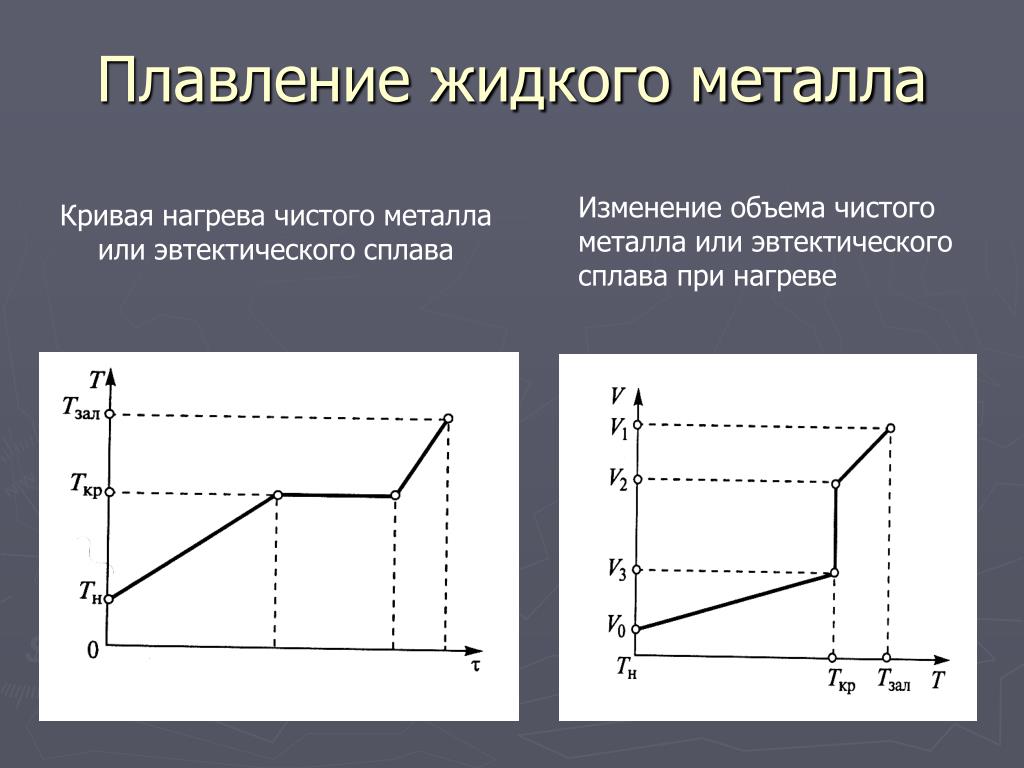 Например, для системы Р (рис. 6.9б) состав жидкой фазы отмечен точкой PL и составляет 30% вещества А и 70% вещества В, твердая фаза – 100% В.
Например, для системы Р (рис. 6.9б) состав жидкой фазы отмечен точкой PL и составляет 30% вещества А и 70% вещества В, твердая фаза – 100% В.
Отрезки канноды LS, проведенной через фигуративную точку Р, отображают относительные массовые количества жидкой и твердой фаз:
LP : PS = mж : mтв
по так называемому правилу рычага.
Так, из 100 г смеси для точки Р масса твердой фазы – около 33 г, а в жидкой – около 67 г.
Двухкомпонентная система, состоящая из воды и растворяющейся в ней соли, характеризуется диаграммой состояния эвтектического типа. Выделяющуюся в точке Е эвтектическую водно-солевую смесь называют криогидратом. Затвердевшие криогидраты состоят из мелкодисперсной смеси кристаллов льда и соли.
Криогидратные температуры некоторых солей:
| Соли | Криогидратная температура, °С | Содержание безводной соли в растворе, масс. % % | Состав криогидрата |
|---|---|---|---|
| Na2SO4 | –1,2 | 3,86 | Na2SO4ċ10H2O |
| KCl | –11,1 | 19,80 | KClċH2O |
| NaCl | –21,1 | 22,42 | NaClċ2H2O |
| CaCl2 | –55,5 | 29,90 | CaCl2ċ6H2O |
Такие составы широко используются в практике для получения низкотемпературных смесей.
Диаграмма плавкости веществ с неограниченной растворимостью в жидком и твердом состоянии
Весьма часто твердая фаза, выделяющаяся при охлаждении расплавов, состоит из кристаллов, образуемых обоими компонентами. Такая однородная система имеет переменный состав и называется твердым раствором. Твердые растворы – системы однофазные, подобно обычным жидким растворам, но в отличие от последних имеют кристаллическую структуру.
Твердые растворы – системы однофазные, подобно обычным жидким растворам, но в отличие от последних имеют кристаллическую структуру.
Неограниченной взаимной растворимостью в твердом состоянии обладают вещества, имеющие близкие значения атомных или ионных радиусов, энергии химической связи, сходное строение электронных оболочек и одинаковый тип кристаллической решетки (изоморфные вещества). Примерами таких систем могут служить Au–Ag, Cu–Au, Se–Ge, NaCl–NaBr и другие.
Представленная на рис. 6.12. диаграмма состоит из двух непрерывных сопряженных кривых: верхней tALtB (кривой ликвидуса) и нижней tAStB (кривой солидуса). Выше линии ликвидуса находится однофазная область – расплав компонентов A и B. В этой области при любых температурах и концентрациях система будет находиться в жидком состоянии (С = 2 + 1 – 1 = 2).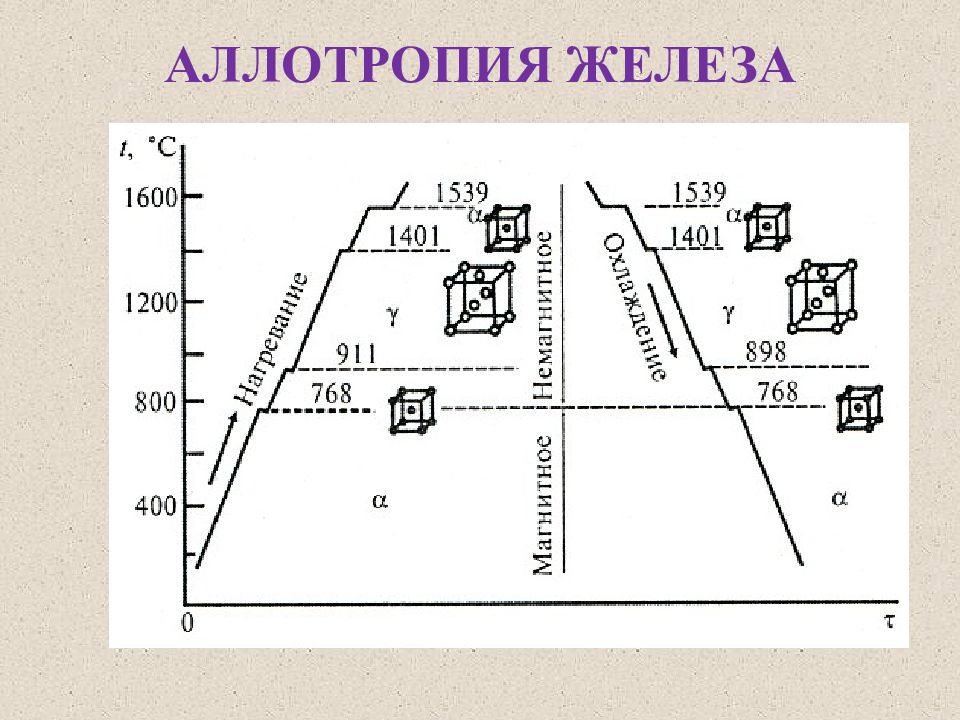 Ниже кривой солидуса система существует только в виде одной твердой фазы, представляющей собой непрерывный ряд твердых растворов (С = 2 + 1 – 1 = 2).
Ниже кривой солидуса система существует только в виде одной твердой фазы, представляющей собой непрерывный ряд твердых растворов (С = 2 + 1 – 1 = 2).
Точки tA и tB – температуры плавления компонентов A и B. Между кривыми ликвидуса и солидуса находится двухфазная область, в которой сосуществуют жидкие и твердые растворы (С = 2 + 1 – 2 = 1). Кристаллизация всех промежуточных составов проходит в интервале температур. На кривых охлаждения отмечаются два излома, отвечающих началу и концу кристаллизации.
Рассмотрим особенности кристаллизации систем этого типа (рис. 6.12). Расплав состава, отвечающий фигуративной точке 1, охлаждаем до точки L’. Начинают выпадать кристаллы S’. При охлаждении до точки P выпадают кристаллы S», состав расплава отвечает точке L». По мере охлаждения состав кристаллов изменяется по кривой S’ – S» – S»’, состав расплава – по кривой L’ – L» – L»’. Если отделить выкристаллизовавшиеся первые порции, обогащенные тугоплавким компонентом B, то неоднократным повторением процесса можно разделить A и B.
Составы жидкой и твердой фаз, сосуществующих при данной температуре, определяют точками пересечения изотермы соответственно с линиями ликвидуса и солидуса и отнесением их на ось составов. Так, для системы P (рис 6.12) при температуре tP состав жидкой фазы PL – 75% A и 25% B, твердой – PS – 28% A и 72% B. Количественные соотношения жидкой и твердой фаз в точке P определяют отношением отрезков PS»: PL» = mж : mтв.
Аналогичный вид имеет диаграмма состав–температура для двух жидкостей, неограниченно смешивающихся в жидком и парообразном состоянии.
Смотрите также:
Математика,
Английский язык,
Химия,
Биология,
Физика,
География,
Астрономия.
А также: библиотека ЭОРов и образовательный онлайн-сервис с тысячами интерактивных работ «Облако знаний».
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь.
Более подробную информацию об использовании файлов cookies можно найти здесь.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения
Вкл.
Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
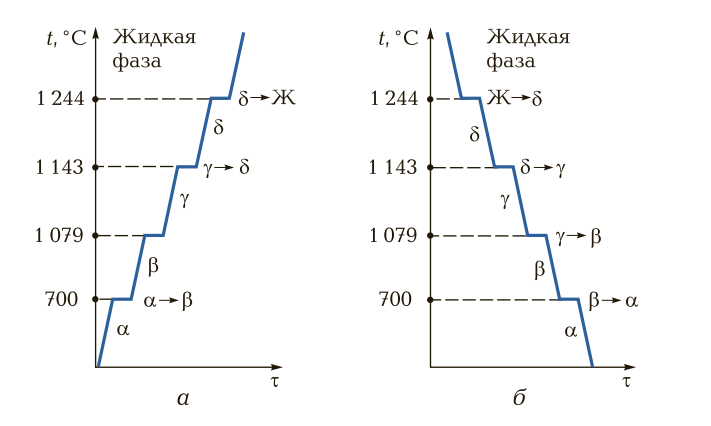
250+ ЛУЧШИХ MCQ по кривой охлаждения для чистого железа и ответы 2023
Формирование онлайн-викторины на тему «Кривая охлаждения чистого железа».
1. Какова температура плавления чистого железа?
a) 1500°C
b) 1535°C
c) 1570°C
d) 1605°C
Ответ: b
Пояснение: Железо существует во многих аллотропных формах, и каждая такая аллотропная форма имеет разные температуры плавления, кипения и затвердевания. Но для чистого железа температура плавления составляет 1535°C.
2. Какое железо образуется при замерзании расплава?
a) Альфа
b) Бета
c) Гамма
d) Дельта
Ответ: d
Пояснение: Альфа-железо, бета-железо или гамма-железо не могут образовываться, когда металл находится в замороженном виде. Когда расплавленный металл замерзает, образуется дельта-железо.
3. Какая решетка в треугольном железе?
а) Кубический центрированный по граням
б) Кубический центрированный по телу
в) Шестиугольный плотно упакованный
г) Тетрагональный плотно упакованный
Ответ: b
Пояснение: Дельта-форма твердого состояния железа, образующаяся при охлаждении расплава, имеет объемно-центрированную кубическую структуру решетки.
4. Какая решетка в гамма-железе?
a) Гранецентрированная кубическая
b) Объемно-центрированная кубическая
c) Гексагональная плотноупакованная
d) Тетрагональная плотноупакованная
Ответ: a
Пояснение: Гамма-форма твердого состояния железа, которая образуется при охлаждении расплава, имеет гранецентрированную кубическую структуру решетки.
5. До какой температуры нагревают доэвтектоидные стали при превращении в сталь?
a) 677°C
b) 700°C
c) 723°C
d) 746°C
Ответ: c
Пояснение: При превращении в сталь доэвтектоидные стали нагреваются до очень высокой температуры. Температура, до которой они доведены, составляет 723°С.
6. Какова твердость перлита по Бринеллю?
а) 150
б) 180
в) 210
г) 240
Ответ: б
Пояснение: Перлит не является самой твердой формой. Твердость перлита по Бринеллю составляет всего 180. Существует более твердый материал, чем перлит, называемый мартенситом, который имеет твердость по Бринеллю в диапазоне 650-700.
7. Альфа-железо сильно немагнитно.
a) Верно
b) Неверно
Ответ: b
Пояснение: Одним из свойств альфа-железа является то, что альфа-железо обладает высокой магнитной способностью, и обнаружено, что оно существует только при комнатной температуре. Альфа-железо является четвертой ретардацией железа.
8. Чему равна твердость мартенсита по Бринеллю?
a) 600-650
b) 650-700
c) 750-800
d) 800-850
Ответ: b
Пояснение: Мартенсит по своей природе является ферромагнитным веществом, известно, что его твердость по Бринеллю находится в пределах 650- 700.
9. Каково значение «а» в решетке дельта-железа?
a) 2,00 Å
b) 2,93 Å
c) 4,00 Å
d) 4,93 Å
Ответ: b
Пояснение: Величина a, представляющая собой расстояние между двумя последовательными атомами в решетке, в решетке дельта-железа составляет 2,93. Å, что составляет около 2,93 х 10-10 метров.
10. Альфа-железо существует только в условиях высокой температуры и давления.
a) Верно
b) Неверно
Ответ: b
Пояснение: Одним из свойств альфа-железа является то, что альфа-железо обладает высокой магнитной способностью, и обнаружено, что оно существует только при комнатной температуре.
Опубликовано
Опубликовано в Объективные вопросы по литью, формовке и сварке
Искать:
8.1: Кривые нагрева и фазовые переходы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 119748
Навыки развития
- Описать процессы, представленные типичными кривыми нагрева и охлаждения, и рассчитать тепловые потоки и изменения энтальпии, сопровождающие эти процессы
- Объясните построение и использование типичной фазовой диаграммы
- Использовать фазовые диаграммы для идентификации стабильных фаз при заданных температурах и давлениях, а также для описания фазовых переходов, происходящих в результате изменения этих свойств
- Опишите сверхкритическую флюидную фазу вещества
Кривые нагревания и охлаждения
На кафедре термохимии было введено соотношение между количеством теплоты, поглощенной или связанной с веществом, q, и сопутствующим ему изменением температуры, ΔT:
\[q=mcΔT\]
, где m — масса вещества, а c — его удельная теплоемкость. Это отношение применимо к материи, которая нагревается или охлаждается, но не претерпевает изменения в состоянии. Когда нагреваемое или охлаждаемое вещество достигает температуры, соответствующей одному из его фазовых переходов, дальнейший прирост или потеря тепла является результатом уменьшения или усиления межмолекулярного притяжения, а не увеличения или уменьшения кинетической энергии молекул. Пока вещество претерпевает изменение состояния, его температура остается постоянной. На рисунке \(\PageIndex{1}\) показана типичная кривая нагрева.
Это отношение применимо к материи, которая нагревается или охлаждается, но не претерпевает изменения в состоянии. Когда нагреваемое или охлаждаемое вещество достигает температуры, соответствующей одному из его фазовых переходов, дальнейший прирост или потеря тепла является результатом уменьшения или усиления межмолекулярного притяжения, а не увеличения или уменьшения кинетической энергии молекул. Пока вещество претерпевает изменение состояния, его температура остается постоянной. На рисунке \(\PageIndex{1}\) показана типичная кривая нагрева.
Рисунок \(\PageIndex{1}\) : Типичная кривая нагревания вещества показывает изменения температуры, происходящие по мере того, как вещество поглощает все больше тепла. Плато на кривой (области постоянной температуры) проявляются при фазовых переходах вещества.
Рассмотрим пример нагревания кастрюли с водой до кипения. Горелка плиты будет подавать тепло примерно с постоянной скоростью; первоначально это тепло служит для повышения температуры воды. Когда вода достигает точки кипения, температура остается постоянной, несмотря на постоянный ввод тепла от горелки печи. Эта же температура поддерживается водой до тех пор, пока она кипит. Если увеличить мощность горелки, чтобы обеспечить более высокую скорость нагрева, температура воды не повышается, а вместо этого кипение становится более энергичным (быстрым). Такое поведение наблюдается и для других фазовых переходов: например, температура остается постоянной, пока происходит изменение состояния.
Когда вода достигает точки кипения, температура остается постоянной, несмотря на постоянный ввод тепла от горелки печи. Эта же температура поддерживается водой до тех пор, пока она кипит. Если увеличить мощность горелки, чтобы обеспечить более высокую скорость нагрева, температура воды не повышается, а вместо этого кипение становится более энергичным (быстрым). Такое поведение наблюдается и для других фазовых переходов: например, температура остается постоянной, пока происходит изменение состояния.
Пример \(\PageIndex{1}\): Общее количество тепла, необходимое для изменения температуры и фазы вещества
Сколько тепла требуется для превращения 135 г льда при -15 °C в водяной пар при 120 °C?
Решение
Описанный переход включает следующие этапы:
- Нагрев льда от −15 °C до 0 °C
- Растаявший лед
- Нагрев воды от 0 °C до 100 °C
- Кипятить воду
- Нагрев пара от 100 °С до 120 °С
Теплота, необходимая для изменения температуры данного вещества (без фазового перехода): q = m × c × Δ T (см.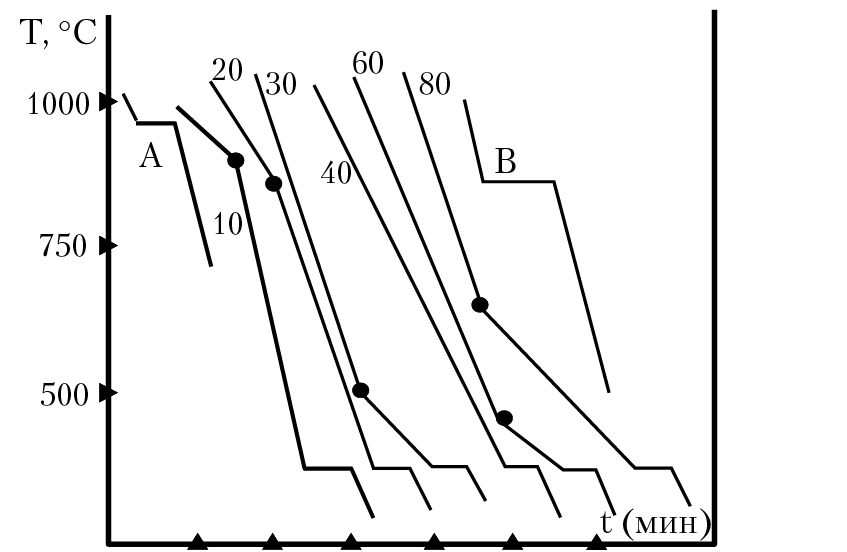 предыдущую главу о термохимии). Количество тепла, необходимое для того, чтобы вызвать заданное изменение фазы, определяется как q = n × Δ H .
предыдущую главу о термохимии). Количество тепла, необходимое для того, чтобы вызвать заданное изменение фазы, определяется как q = n × Δ H .
Используя эти уравнения с соответствующими значениями удельной теплоемкости льда, воды и пара, а также энтальпий плавления и испарения, мы имеем:
\[\begin{align*}
q_\ce{total}&=(m⋅c⋅ΔT)_\ce{лед}+n⋅ΔH_\ce{fus}+(m⋅c⋅ΔT)_\ce{вода}+n⋅ΔH_\ce{пар}+(m⋅c⋅ΔT)_\ ce{пар}\\[7pt]
&=\mathrm{(135\: г⋅2,09\: Дж/г⋅°C⋅15°C)+\left(135⋅\dfrac{1\: моль}{18,02\:g}⋅6,01\: кДж/моль
\right)}\\[7pt]
&\ma thrm{+(135\: g⋅4,18\: Дж/г⋅°C⋅100°C)+\left(135\: g⋅\dfrac{1\: моль}{18,02\:g}⋅40,67\: кДж/моль\right)}\\[7pt]
&\mathrm{+(135\: g⋅1,84\: J /g⋅°C⋅20°C)}\\[7pt]
&=\mathrm{4230\: Дж+45,0\: кДж+56 500\: Дж+305\: кДж+4970\: Дж}
\end{align*}\]
Преобразование величин в Дж в кДж позволяет суммировать их и получить общее необходимое количество тепла:
\[\mathrm{=4,23\:кДж+45,0\: кДж+56,5\: кДж+305\: кДж+4,97\: кДж=4 16\: кДж} \nonumber\]
Упражнение \(\PageIndex{1}\)
Какое общее количество тепла выделится при охлаждении 94,0 г воды при температуре 80,0 °C с образованием льда при температуре −30,0 °C?
- Ответить
40,5 кДж
- −10 °C и 50 кПа
- 25 °C и 90 кПа
- 50 °C и 40 кПа
- 80 °C и 5 кПа
- −10 °C и 0,3 кПа
- 50 °C и 0,3 кПа
- Ответ:
При 0,3 кПа: с⟶ г при −58 °C.
 При 50 кПа: s⟶ l при 0 °C, l ⟶ g при 78 °C
При 50 кПа: s⟶ l при 0 °C, l ⟶ g при 78 °C- −30 °C и 2000 кПа
- −60 °C и 1000 кПа
- −60 °C и 100 кПа
- 20 °C и 1500 кПа
- 0 °C и 100 кПа
- 20 °C и 100 кПа
- Ответить
при 1500 кПа: с⟶л при -45°С, л⟶г при -10°С; при 500 кПа: с⟶ г при −58 °C
- Ответить
Критическая температура аммиака составляет 405,5 К, что выше комнатной температуры. Критическая температура кислорода ниже комнатной температуры; таким образом, кислород не может быть сжижен при комнатной температуре.
- \(\ln P=-\dfrac{ΔH_\ce{vap}}{RT}+\ln A\)
- \(\ln\left(\dfrac{P_2}{P_1}\right)=\dfrac{ΔH_\ce{vap}}{R}\left(\dfrac{1}{T_1}−\dfrac{1}{T_2}\right)\)
В предыдущем разделе было описано изменение равновесного давления паров жидкости в зависимости от температуры.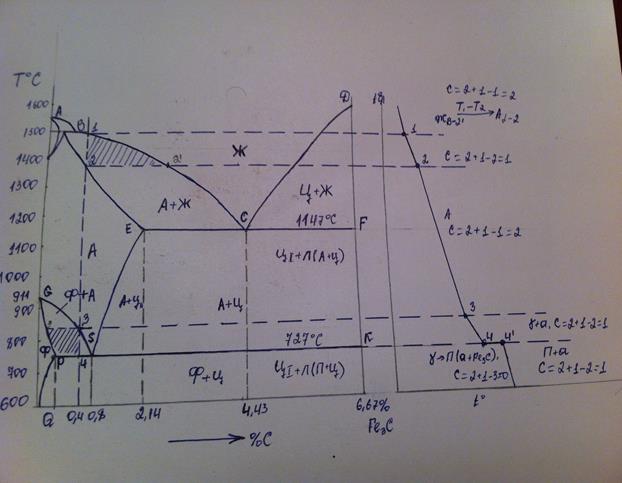 Принимая во внимание определение точки кипения, графики зависимости давления пара от температуры показывают, как точка кипения жидкости зависит от давления. Описано также использование кривых нагрева и охлаждения для определения температуры плавления (или замерзания) вещества. Выполнение таких измерений в широком диапазоне давлений дает данные, которые можно представить графически в виде фазовой диаграммы. Фазовая диаграмма объединяет графики зависимости давления от температуры для равновесий фазовых переходов жидкость-газ, твердое тело-жидкость и твердое тело-газ. На этих диаграммах показаны физические состояния, существующие при определенных условиях давления и температуры, а также приведена зависимость от давления температур фазовых переходов (температуры плавления, сублимации, кипения). Типичная фазовая диаграмма чистого вещества показана на рисунке \(\PageIndex{2}\).
Принимая во внимание определение точки кипения, графики зависимости давления пара от температуры показывают, как точка кипения жидкости зависит от давления. Описано также использование кривых нагрева и охлаждения для определения температуры плавления (или замерзания) вещества. Выполнение таких измерений в широком диапазоне давлений дает данные, которые можно представить графически в виде фазовой диаграммы. Фазовая диаграмма объединяет графики зависимости давления от температуры для равновесий фазовых переходов жидкость-газ, твердое тело-жидкость и твердое тело-газ. На этих диаграммах показаны физические состояния, существующие при определенных условиях давления и температуры, а также приведена зависимость от давления температур фазовых переходов (температуры плавления, сублимации, кипения). Типичная фазовая диаграмма чистого вещества показана на рисунке \(\PageIndex{2}\).
Рисунок \(\PageIndex{2}\): Физическое состояние вещества и температуры его фазовых переходов представлены графически на фазовой диаграмме.
Чтобы проиллюстрировать полезность этих графиков, рассмотрим фазовую диаграмму воды, показанную на рисунке \(\PageIndex{3}\).
Рисунок \(\PageIndex{3}\): Оси давления и температуры на этой фазовой диаграмме воды не нарисованы в постоянном масштабе, чтобы проиллюстрировать несколько важных свойств.
Мы можем использовать фазовую диаграмму для определения физического состояния образца воды при заданных условиях давления и температуры. Например, давление 50 кПа и температура -10 °С соответствуют области диаграммы, обозначенной как «лед». В этих условиях вода существует только в твердом состоянии (лед). Давление 50 кПа и температура 50 °С соответствуют области «вода» — здесь вода существует только в виде жидкости. При 25 кПа и 200 °C вода существует только в газообразном состоянии. Обратите внимание, что на H 2 O фазовая диаграмма, оси давления и температуры не вычерчены в постоянной шкале, чтобы можно было проиллюстрировать несколько важных особенностей, как описано здесь.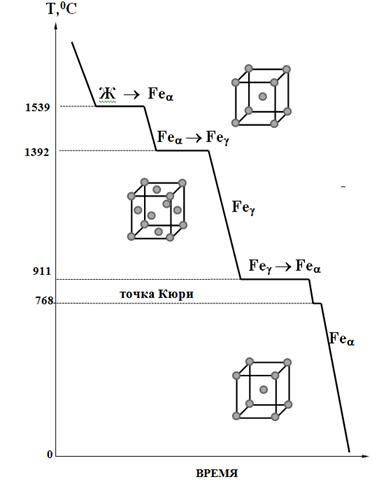
Кривая BC на рисунке \(\PageIndex{3}\) представляет собой график зависимости давления паров от температуры, как описано в предыдущем модуле этой главы. Эта кривая «жидкость-пар» разделяет жидкую и газообразную области фазовой диаграммы и дает точку кипения воды при любом давлении. Например, при 1 атм температура кипения составляет 100°С. Обратите внимание, что кривая жидкость-пар заканчивается при температуре 374 °C и давлении 218 атм, что указывает на то, что вода не может существовать в виде жидкости выше этой температуры, независимо от давления. Физические свойства воды в этих условиях занимают промежуточное положение между свойствами ее жидкой и газообразной фаз. Это уникальное состояние вещества называется сверхкритической жидкостью, и эта тема будет описана в следующем разделе этого модуля.
Кривая паров твердого тела, обозначенная AB на рисунке \(\PageIndex{3}\), показывает температуру и давление, при которых лед и водяной пар находятся в равновесии. Эти пары данных температура-давление соответствуют точкам сублимации или осаждения воды. Если бы мы могли увеличить линию твердого газа на рисунке \(\PageIndex{2}\), мы бы увидели, что лед имеет давление паров около 0,20 кПа при -10 °C. Так, если поместить замороженный образец в вакуум с давлением менее 0,20 кПа, лед возгонится. Это лежит в основе процесса «сублимационной сушки», часто используемого для сохранения продуктов, таких как мороженое, показанное на рисунке \(\PageIndex{4}\).
Если бы мы могли увеличить линию твердого газа на рисунке \(\PageIndex{2}\), мы бы увидели, что лед имеет давление паров около 0,20 кПа при -10 °C. Так, если поместить замороженный образец в вакуум с давлением менее 0,20 кПа, лед возгонится. Это лежит в основе процесса «сублимационной сушки», часто используемого для сохранения продуктов, таких как мороженое, показанное на рисунке \(\PageIndex{4}\).
>
Рисунок \(\PageIndex{4}\): Сублимированные продукты, такие как это мороженое, обезвоживаются путем сублимации при давлении ниже тройной точки для воды. (кредит: ʺlwaoʺ/Flickr)
Кривая твердой и жидкой фаз, обозначенная BD, показывает температуры и давления, при которых лед и жидкая вода находятся в равновесии, представляя точки плавления/замерзания воды. Обратите внимание, что эта кривая имеет небольшой отрицательный наклон (сильно преувеличенный для ясности), что указывает на то, что температура плавления воды немного снижается при увеличении давления. В этом отношении вода является необычным веществом, так как у большинства веществ температура плавления повышается с повышением давления. Такое поведение частично отвечает за движение ледников, как показано на рисунке \(\PageIndex{5}\). Дно ледника испытывает огромное давление из-за своего веса, которое может растопить часть льда, образуя слой жидкой воды, по которому леднику легче скользить.
В этом отношении вода является необычным веществом, так как у большинства веществ температура плавления повышается с повышением давления. Такое поведение частично отвечает за движение ледников, как показано на рисунке \(\PageIndex{5}\). Дно ледника испытывает огромное давление из-за своего веса, которое может растопить часть льда, образуя слой жидкой воды, по которому леднику легче скользить.
Рисунок \(\PageIndex{5}\): Огромное давление под ледниками приводит к их частичному таянию, образуя слой воды, обеспечивающий смазку, способствующую движению ледников. На этом спутниковом снимке показан наступающий край ледника Перито-Морено в Аргентине. (кредит: НАСА)
Точка пересечения всех трех кривых обозначена буквой B на рисунке \(\PageIndex{3}\). При давлении и температуре, представленных этой точкой, все три фазы воды сосуществуют в равновесии. Эта пара данных температура-давление называется тройной точкой. При давлении ниже тройной точки вода не может существовать в жидком состоянии независимо от температуры.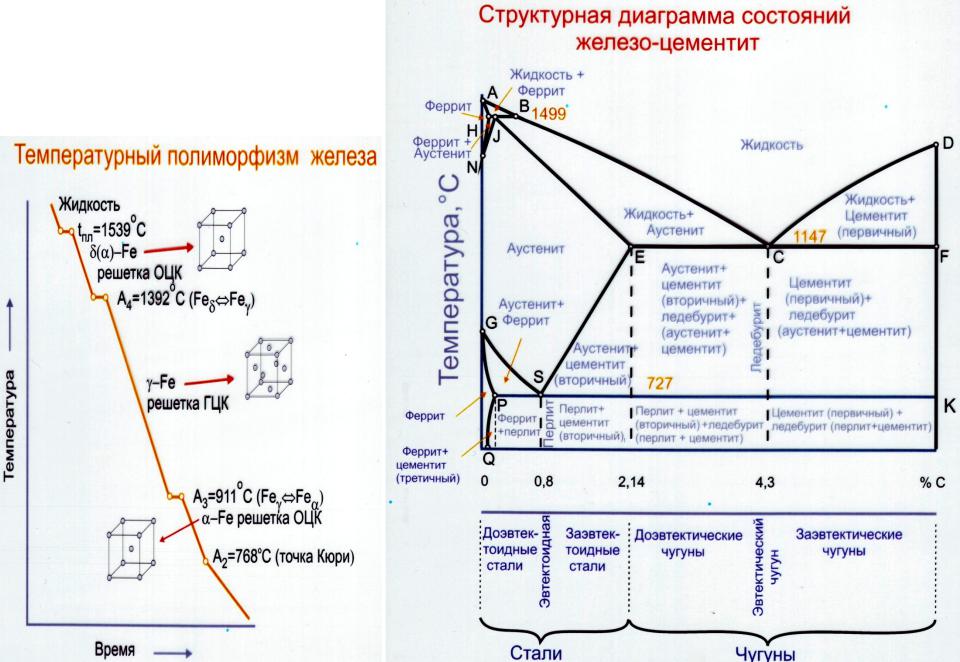
Видео \(\PageIndex{1}\): Циклогексан в тройной точке.
Пример \(\PageIndex{2}\): определение состояния воды
Используя диаграмму состояния воды, приведенную на рис. 10.4.2, определите состояние воды при следующих температурах и давлениях:
Раствор
Используя фазовую диаграмму для воды, мы можем определить, что состояние воды при каждой заданной температуре и давлении следующее: (а) твердое; (б) жидкость; (в) жидкость; (г) газ; (д) твердый; (е) газ.
Упражнение \(\PageIndex{2}\)
Какие фазовые превращения может претерпевать вода при изменении температуры, если поддерживать давление на уровне 0,3 кПа? Если давление держится на уровне 50 кПа?
В качестве другого примера рассмотрим фазовую диаграмму двуокиси углерода, показанную на рисунке \(\PageIndex{6}\). Кривая твердое тело-жидкость имеет положительный наклон, что указывает на то, что температура плавления CO 2 увеличивается с давлением, как и для большинства веществ (вода является заметным исключением, как описано ранее). Обратите внимание, что тройная точка намного выше 1 атм, что указывает на то, что углекислый газ не может существовать в виде жидкости в условиях атмосферного давления. Вместо этого охлаждение газообразного диоксида углерода до 1 атм приводит к его осаждению в твердом состоянии. Точно так же твердый диоксид углерода не плавится при давлении 1 атм, а возгоняется с образованием газообразного CO 9 .0238 2 . Наконец, обратите внимание, что критическая точка для углекислого газа наблюдается при относительно скромных температуре и давлении по сравнению с водой.
Рисунок \(\PageIndex{6}\) : Показана фазовая диаграмма двуокиси углерода.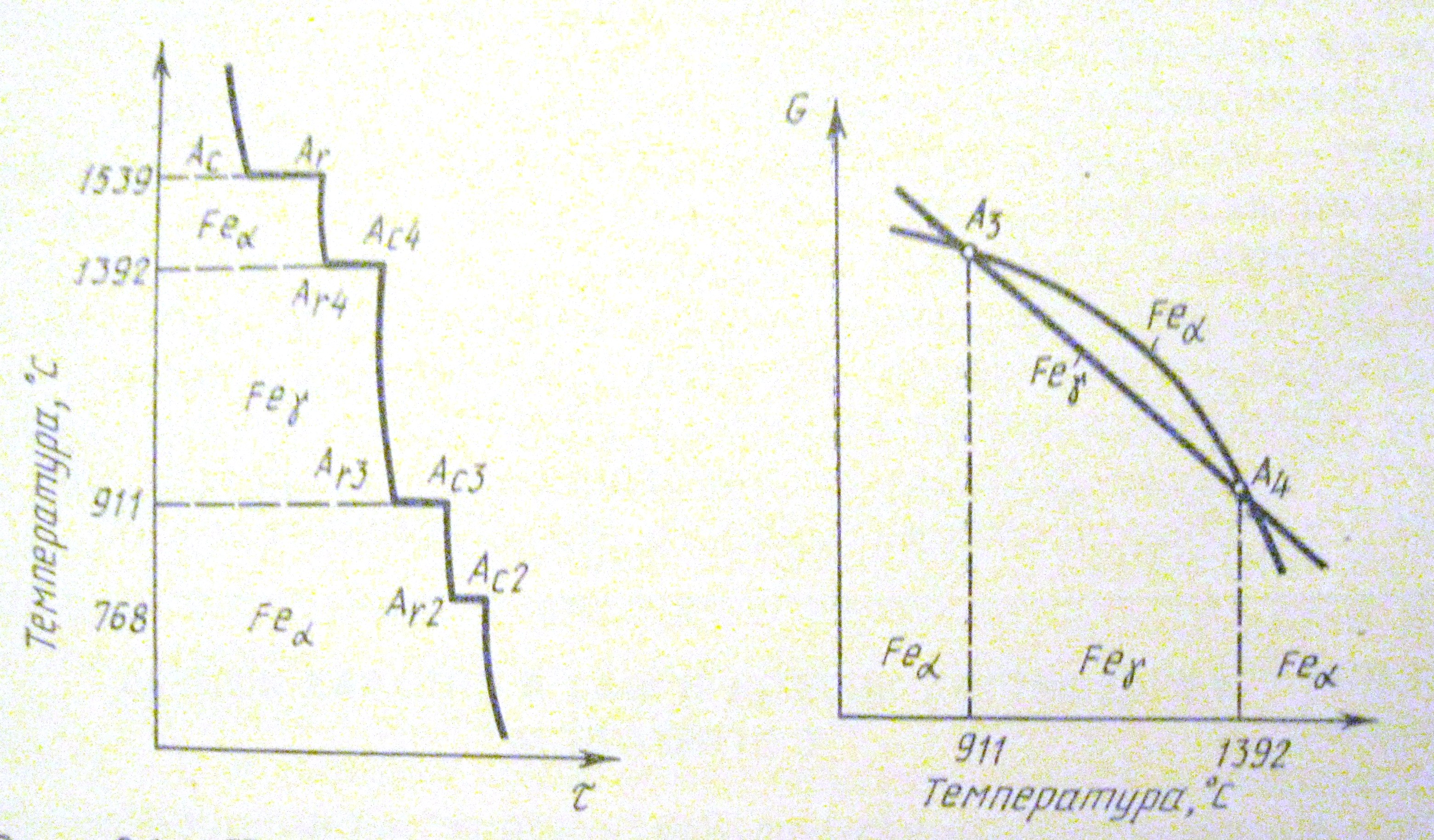 Ось давления построена в логарифмическом масштабе, чтобы соответствовать большому диапазону значений.
Ось давления построена в логарифмическом масштабе, чтобы соответствовать большому диапазону значений.
Пример \(\PageIndex{3}\): определение состояния углекислого газа
Используя фазовую диаграмму для углекислого газа, показанную на рисунке 10.4.5, определите состояние CO 2 при следующих температурах и давлениях:
Раствор
Используя приведенную фазовую диаграмму для двуокиси углерода, мы можем определить, что состояние CO 2 при каждой заданной температуре и давлении следующее: (a) жидкость; (б) твердый; (в) газ; (г) жидкость; д) газ; (е) газ.
Упражнение \(\PageIndex{3}\)
Определите, какие фазовые изменения претерпевает диоксид углерода при изменении его температуры, при этом его давление остается постоянным на уровне 1500 кПа? При 500 кПа? При каких примерных температурах происходят эти фазовые превращения?
Сверхкритические жидкости
Видео \(\PageIndex{2}\): Наблюдайте за поведением сверхкритических жидкостей.
Если мы поместим образец воды в герметичный контейнер при температуре 25 °C, удалив воздух и позволив установиться равновесию испарения-конденсации, мы получим смесь жидкой воды и водяного пара при давлении 0,03 атм. Отчетливо наблюдается четкая граница между более плотной жидкостью и менее плотным газом. По мере повышения температуры давление водяного пара увеличивается, как описано кривой жидкость-газ на фазовой диаграмме воды (рис. \(\PageIndex{3}\)), и сохраняется двухфазное равновесие жидкой и газообразной фаз. При температуре 374 °С давление пара возросло до 218 атм, и дальнейшее повышение температуры приводит к исчезновению границы между жидкой и паровой фазами. Вся вода в сосуде теперь находится в одной фазе, физические свойства которой занимают промежуточное положение между газообразным и жидким состояниями. Эта фаза вещества называется сверхкритической жидкостью, а температура и давление, выше которых эта фаза существует, являются критической точкой (рис. \(\PageIndex{5}\)). При температуре выше критической газ не может сжижаться, какое бы давление ни применялось. Давление, необходимое для сжижения газа при его критической температуре, называется критическим давлением. Критические температуры и критические давления некоторых обычных веществ приведены в таблице \(\PageIndex{1}\).
Эта фаза вещества называется сверхкритической жидкостью, а температура и давление, выше которых эта фаза существует, являются критической точкой (рис. \(\PageIndex{5}\)). При температуре выше критической газ не может сжижаться, какое бы давление ни применялось. Давление, необходимое для сжижения газа при его критической температуре, называется критическим давлением. Критические температуры и критические давления некоторых обычных веществ приведены в таблице \(\PageIndex{1}\).
| Вещество | Критическая температура (К) | Критическое давление (атм) |
|---|---|---|
| водород | 33,2 | 12,8 |
| азот | 126,0 | 33,5 |
| кислород | 154,3 | 49,7 |
| двуокись углерода | 304,2 | 73,0 |
| аммиак | 405,5 | 111,5 |
| диоксид серы | 430,3 | 77,7 |
| вода | 647,1 | 217,7 |
Видео \(\PageIndex{3}\): Переход из жидкости в сверхкритическую жидкость для двуокиси углерода.
Подобно газу, сверхкритическая жидкость будет расширяться и заполнять контейнер, но ее плотность намного выше, чем у обычного газа, и обычно близка к плотности жидкости. Подобно жидкостям, эти жидкости способны растворять нелетучие растворенные вещества. Однако они практически не проявляют поверхностного натяжения и имеют очень низкую вязкость, поэтому они могут более эффективно проникать в очень маленькие отверстия в твердой смеси и удалять растворимые компоненты. Эти свойства делают сверхкритические жидкости чрезвычайно полезными растворителями для широкого спектра применений. Например, сверхкритический диоксид углерода стал очень популярным растворителем в пищевой промышленности, его используют для декофеинизации кофе, удаления жиров из картофельных чипсов и извлечения вкусовых и ароматических соединений из цитрусовых масел.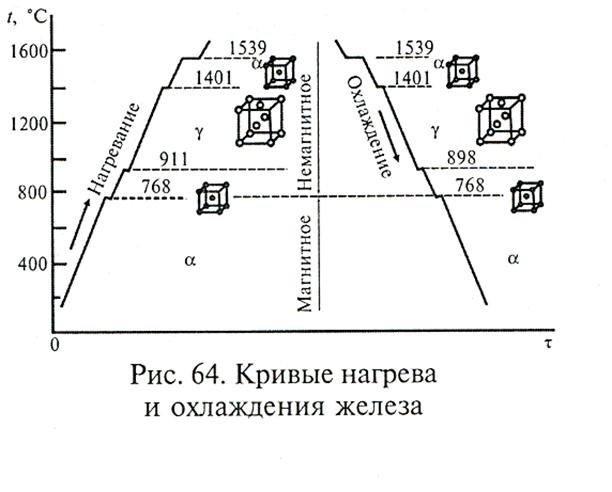 Он нетоксичен, относительно недорог и не считается загрязнителем. После использования CO 2 можно легко восстановить, снизив давление и собрав образовавшийся газ.
Он нетоксичен, относительно недорог и не считается загрязнителем. После использования CO 2 можно легко восстановить, снизив давление и собрав образовавшийся газ.
Рисунок \(\PageIndex{7}\): (a) Герметичный контейнер с жидким диоксидом углерода нагревается чуть ниже критической температуры, что приводит к (b) образованию сверхкритической флюидной фазы. Охлаждение сверхкритической жидкости снижает ее температуру и давление ниже критической точки, что приводит к восстановлению отдельных жидких и газообразных фаз (c и d). Цветные поплавки иллюстрируют разницу в плотности между жидким, газообразным и сверхкритическим флюидным состоянием. (кредит: модификация работы «mrmrobin»/YouTube)
Пример \(\PageIndex{4}\): Критическая температура углекислого газа
Если встряхнуть углекислотный огнетушитель в прохладный день (18 °C), можно услышать, как жидкий CO 2 плещется внутри цилиндра. Однако тот же самый цилиндр не содержит жидкости в жаркий летний день (35 °C). Объясните эти наблюдения.
Объясните эти наблюдения.
Раствор
В прохладный день температура СО 2 ниже критической температуры СО 2 , 304 K или 31 °C (таблица \(\PageIndex{1}\)), поэтому в цилиндре присутствует жидкий CO 2 . В жаркий день температура CO 2 выше его критической температуры 31 °C. Выше этой температуры никакое давление не может сжижать CO 2 , поэтому в огнетушителе нет жидкого CO 2 .
Упражнение \(\PageIndex{4}\)
Аммиак можно сжижать путем сжатия при комнатной температуре; кислород не может быть сжижен в этих условиях. Почему два газа ведут себя по-разному?
Декофеинизация кофе с использованием сверхкритического CO
2
Кофе является вторым наиболее широко продаваемым товаром в мире после нефти. Во всем мире люди любят аромат и вкус кофе. Многие из нас также зависят от одного компонента кофе — кофеина, который помогает нам двигаться утром или сохранять бодрость днем. Но в конце дня стимулирующий эффект кофе может помешать вам уснуть, поэтому вечером вы можете пить кофе без кофеина.
Во всем мире люди любят аромат и вкус кофе. Многие из нас также зависят от одного компонента кофе — кофеина, который помогает нам двигаться утром или сохранять бодрость днем. Но в конце дня стимулирующий эффект кофе может помешать вам уснуть, поэтому вечером вы можете пить кофе без кофеина.
С начала 1900-х годов для удаления кофеина из кофе применялось множество методов. У всех есть преимущества и недостатки, и все зависит от физических и химических свойств кофеина. Поскольку кофеин представляет собой несколько полярную молекулу, он хорошо растворяется в воде, полярной жидкости. Однако, поскольку многие из более чем 400 других соединений, влияющих на вкус и аромат кофе, также растворяются в H 2 O, процессы декофеинизации горячей водой также могут удалить некоторые из этих соединений, что отрицательно скажется на запахе и вкусе кофе без кофеина. Дихлорметан (СН 2 Cl 2 ) и этилацетат (CH 3 CO 2 C 2 H 5 ) имеют полярность, аналогичную кофеину, и поэтому являются очень эффективными растворителями для экстракции кофеина.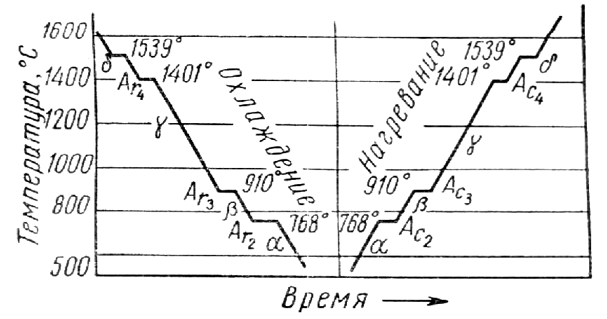 но оба также удаляют некоторые вкусовые и ароматические компоненты, и их использование требует длительного времени экстракции и очистки. Поскольку оба этих растворителя являются токсичными, возникают опасения по поводу воздействия остаточного растворителя, остающегося в кофе без кофеина, на здоровье.
но оба также удаляют некоторые вкусовые и ароматические компоненты, и их использование требует длительного времени экстракции и очистки. Поскольку оба этих растворителя являются токсичными, возникают опасения по поводу воздействия остаточного растворителя, остающегося в кофе без кофеина, на здоровье.
Рисунок \(\PageIndex{8}\): (a) Молекулы кофеина имеют как полярные, так и неполярные области, что делает его растворимым в растворителях различной полярности. (b) На схеме показан типичный процесс удаления кофеина с использованием сверхкритического диоксида углерода.
Сверхкритическая флюидная экстракция с использованием диоксида углерода в настоящее время широко используется как более эффективный и безвредный для окружающей среды метод декофеинизации (рис. \(\PageIndex{8}\)). При температуре выше 304,2 К и давлении выше 7376 кПа СО 2 — сверхкритическая жидкость, обладающая свойствами как газа, так и жидкости. Подобно газу, он проникает глубоко в кофейные зерна; подобно жидкости, он эффективно растворяет определенные вещества.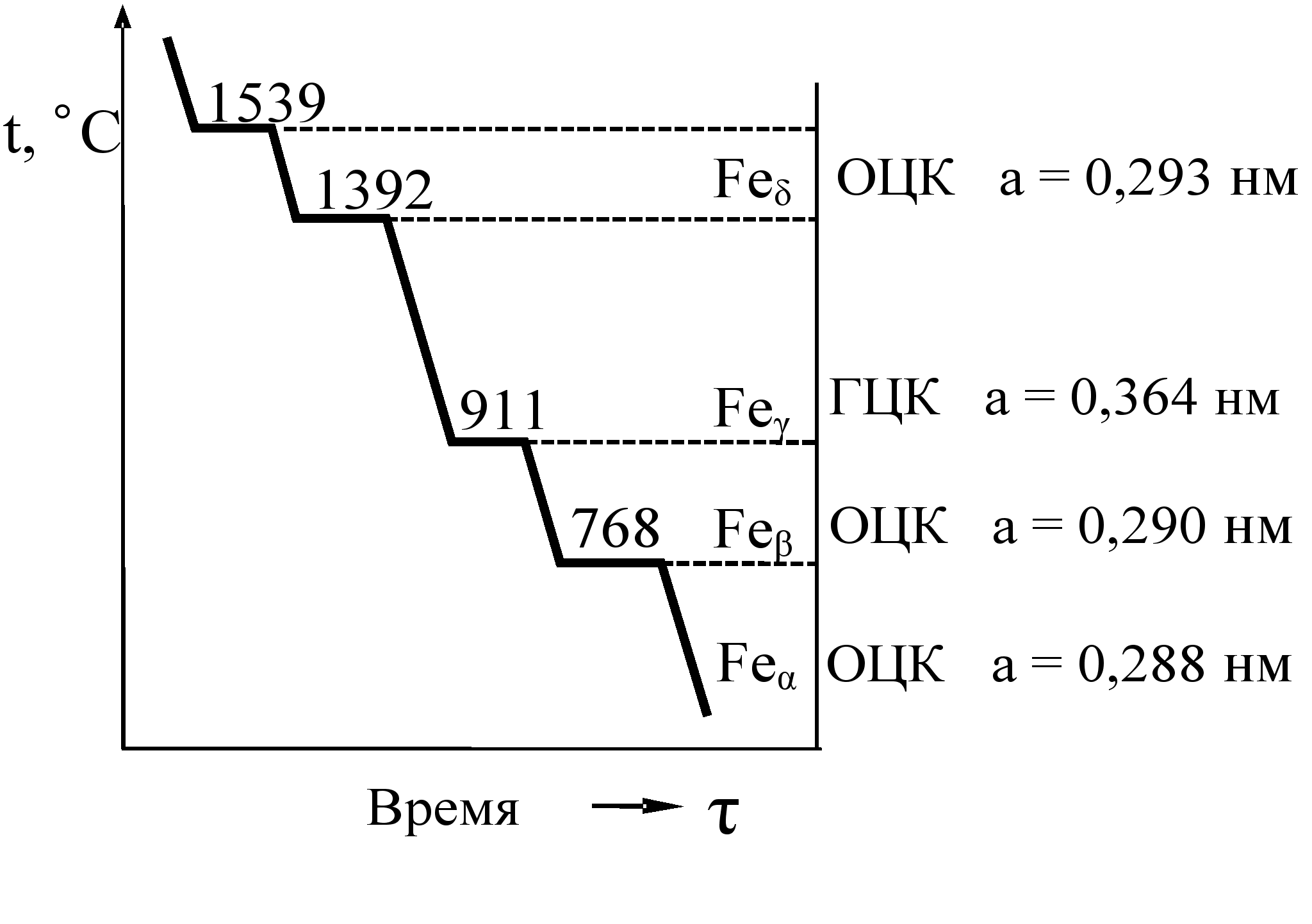 Экстракция пропаренных кофейных зерен сверхкритическим диоксидом углерода удаляет 97-99% кофеина, оставляя вкусовые и ароматические соединения кофе нетронутыми. Поскольку CO 2 представляет собой газ при стандартных условиях, его удаление из экстрагированных кофейных зерен осуществляется легко, как и извлечение кофеина из экстракта. Кофеин, извлеченный из кофейных зерен с помощью этого процесса, является ценным продуктом, который впоследствии можно использовать в качестве добавки к другим продуктам питания или лекарствам.
Экстракция пропаренных кофейных зерен сверхкритическим диоксидом углерода удаляет 97-99% кофеина, оставляя вкусовые и ароматические соединения кофе нетронутыми. Поскольку CO 2 представляет собой газ при стандартных условиях, его удаление из экстрагированных кофейных зерен осуществляется легко, как и извлечение кофеина из экстракта. Кофеин, извлеченный из кофейных зерен с помощью этого процесса, является ценным продуктом, который впоследствии можно использовать в качестве добавки к другим продуктам питания или лекарствам.
Сводка
Видео \(\PageIndex{4}\): Обзор фазовых переходов и фазовых диаграмм.
Температуры, при которых происходят фазовые переходы, определяются относительной силой межмолекулярного притяжения и, следовательно, зависят от химической идентичности вещества. Условия температуры и давления, при которых вещество существует в твердом, жидком и газообразном состояниях, суммированы на фазовой диаграмме для этого вещества.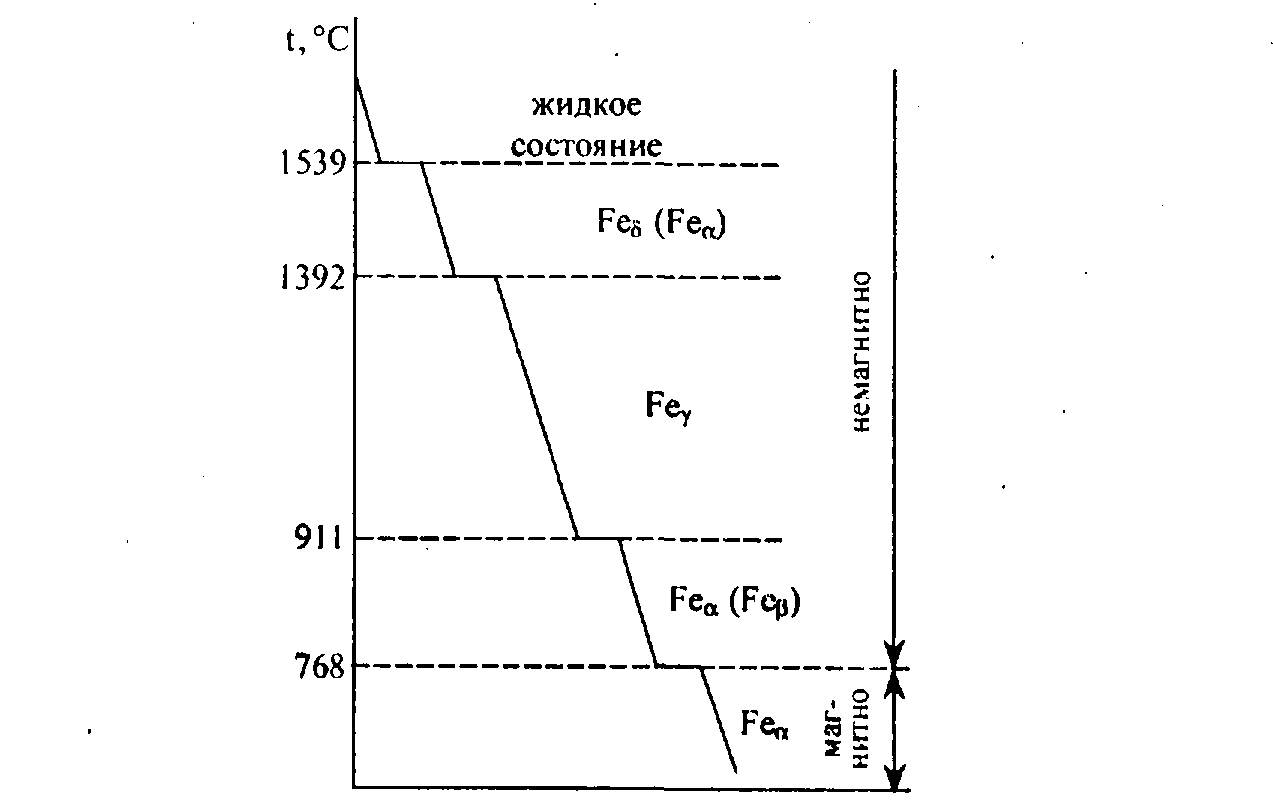 Фазовые диаграммы представляют собой объединенные графики трех кривых равновесия давления и температуры: твердое тело-жидкость, жидкость-газ и твердое тело-газ. Эти кривые представляют отношения между температурами фазового перехода и давлениями. Точка пересечения всех трех кривых представляет тройную точку вещества — температуру и давление, при которых все три фазы находятся в равновесии. При давлениях ниже тройной точки вещество не может существовать в жидком состоянии независимо от его температуры. Конец кривой жидкость-газ представляет критическую точку вещества, давление и температуру, выше которых не может существовать жидкая фаза. 9{−ΔH_\ce{испарение}/RT}\) 90 106
Фазовые диаграммы представляют собой объединенные графики трех кривых равновесия давления и температуры: твердое тело-жидкость, жидкость-газ и твердое тело-газ. Эти кривые представляют отношения между температурами фазового перехода и давлениями. Точка пересечения всех трех кривых представляет тройную точку вещества — температуру и давление, при которых все три фазы находятся в равновесии. При давлениях ниже тройной точки вещество не может существовать в жидком состоянии независимо от его температуры. Конец кривой жидкость-газ представляет критическую точку вещества, давление и температуру, выше которых не может существовать жидкая фаза. 9{−ΔH_\ce{испарение}/RT}\) 90 106
Глоссарий
- критическая точка
- температура и давление, выше которых газ не может сконденсироваться в жидкость
- фазовая диаграмма
- график давление-температура, обобщающий условия, при которых могут существовать фазы вещества
- сверхкритическая жидкость
- вещество при температуре и давлении выше его критической точки; проявляет промежуточные свойства между газообразным и жидким состояниями
- тройная точка
- температура и давление, при которых паровая, жидкая и твердая фазы вещества находятся в равновесии
Авторы
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…a7ac8df6@9.110).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…a7ac8df6@9.110).- Аделаида Кларк, Орегонский технологический институт
- Ускоренный курс Физика: Ускоренный курс является подразделением компании Complexly, и видео можно бесплатно транслировать в образовательных целях.
Обратная связь
Хотите оставить отзыв об этом тексте? Кликните сюда.
Нашли опечатку и хотите получить дополнительные баллы? Кликните сюда.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СС BY
- Показать страницу TOC
- № на стр.




 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав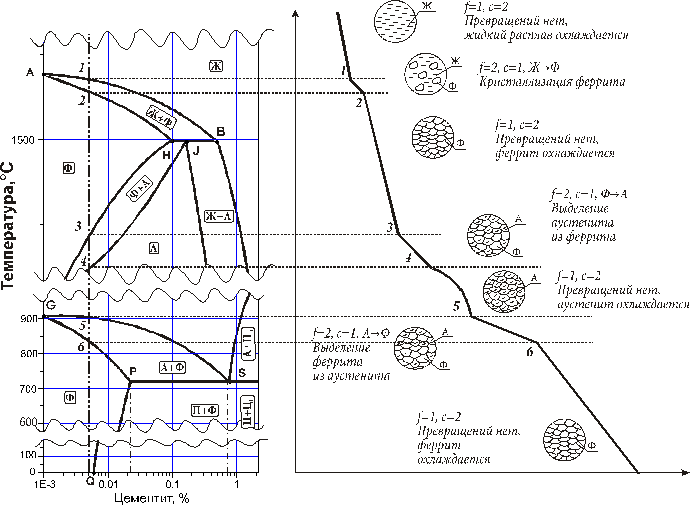 При 50 кПа: s⟶ l при 0 °C, l ⟶ g при 78 °C
При 50 кПа: s⟶ l при 0 °C, l ⟶ g при 78 °C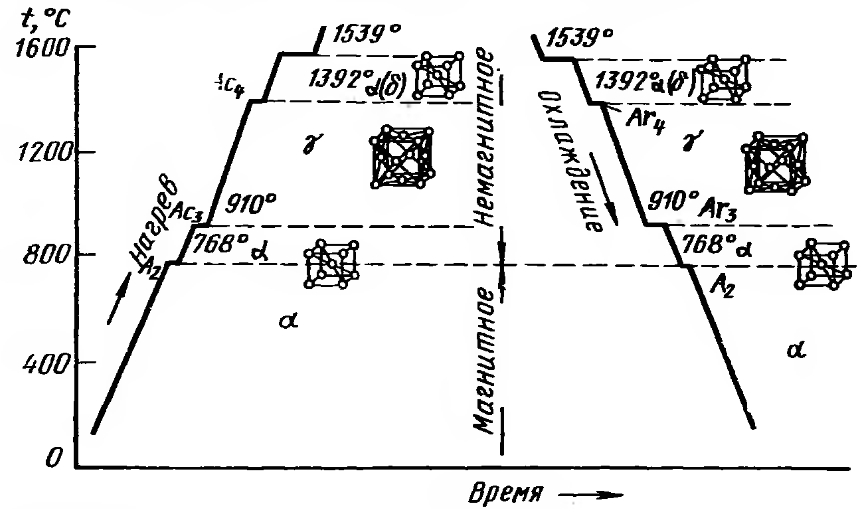 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…a7ac8df6@9.110).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…a7ac8df6@9.110).