Содержание
Критические точки железа и железоуглеродистых сплавов » Привет Студент!
Критические точки железа и железоуглеродистых сплавов
0
Кривые охлаждения и нагрева чистого железа представлены на фиг. 85. На них видим четыре критические точки: для кривой нагрева 770, 910, 1390 и 1539°; для кривой охлаждения 1539, 1390, 906 и 770°. Критическая точка 1539° соответствует переходу железа из жидкого состояния в твердое и из твердого в жидкое; температура 770° является температурой точки Кюри, остальные критические точки указывают на структурные превращения железа в твердом состоянии.
Неполное совпадение второй снизу критической точки на кривой охлаждения с аналогичной точкой на кривой нагрева указывает на склонность железа к переохлаждению (гистерезису) при переходе через эту критическую точку.
Обозначая различные модификации железа соответствующими буквами греческого алфавита, имеем: 1) a-Fe—при нагреве до 910°; y-Fe — от 910 до — 1390° и б-Fe — от 1390 до 1539°; 2) б-Fe — при охлаждении в интервале температур от 1539 до 1390°; y-Fe — от 1390 до 906°; a-Fe— от 906° и ниже. При 770° железо претерпевает магнитное превращение.
При 770° железо претерпевает магнитное превращение.
Критические точки на кривых охлаждения и нагрева железа принято обозначать буквой А с индексом r, если точка находится на кривой охлаждения, и с индексом с на кривой нагрева; кроме того, при r и с ставится цифра, указывающая положение рассматриваемой точки на кривой.
При охлаждении температура перехода от б к у обозначается точкой Ar4, от y к а — Ar3, при нагревании от а к у —- Ac3, от у к б — Aс4; при магнитном превращении явление гистерезиса не имеет места, поэтому соответствующая температура обозначается просто A2.
Точки Ar1 и Ac4 отсутствуют на кривых охлаждения и нагрева чистого железа; они появляются на кривых охлаждения и нагрева различных сплавов железа с углеродом и соответствуют равновесной температуре 723°
(фиг. 87 и 88).
Железо в модификациях y и б, а также а выше 770° не обладает ферромагнитными свойствами. Железо модификации у способно к образованию твердых растворов с углеродом; a-Fe и б-Fe обладают этой способностью в весьма слабой степени.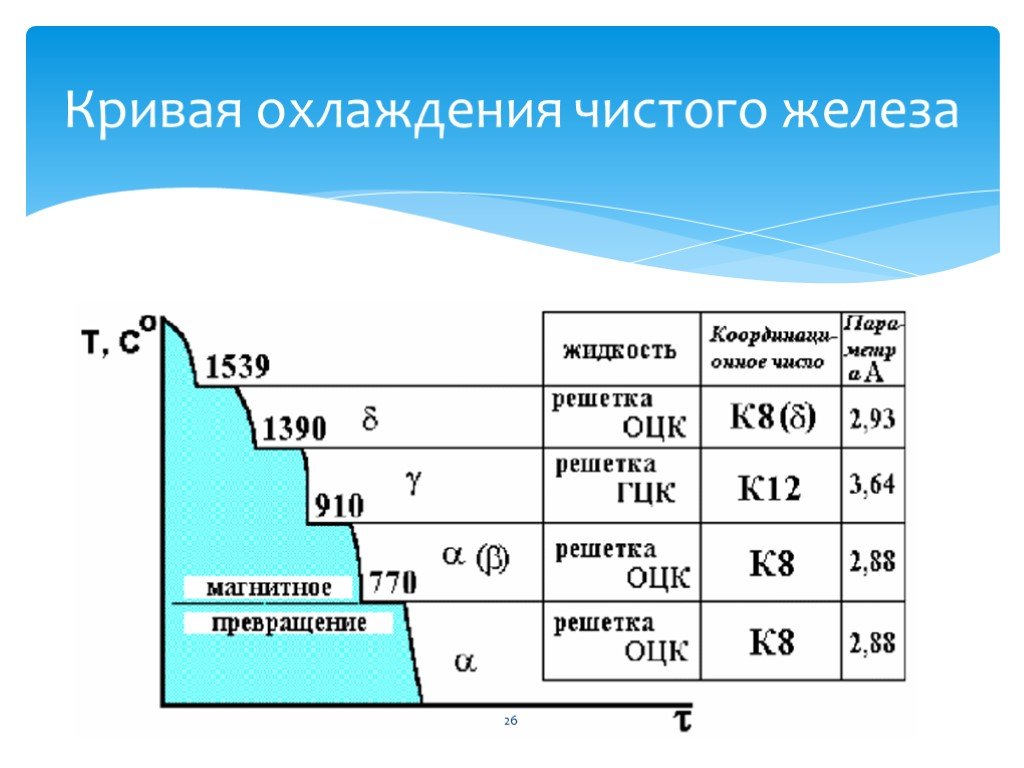 Все модификации железа способны к образованию твердых растворов с Mn, Si, Cr, W, Mo, V, Ni, Al, P.
Все модификации железа способны к образованию твердых растворов с Mn, Si, Cr, W, Mo, V, Ni, Al, P.
Твердый раствор на основе a-Fe носит название феррит, твердый раствор на основе y-Fe принято называть аустенитом.
Модификации а- и б-железо имеют одинаковую пространственную кристаллическую решетку — пространственно — центрированный куб, у-Fe имеет решетку гранецентрированного куба. На фиг. 86 представлена микрофотография шлифа чистого железа (структура феррита). Для сплавов железа с углеродом кривые охлаждения и нагрева будут иметь уже другой вид.
Так, например, для сплава, содержащего 4,3% С, кривая охлаждения будет иметь вид, представленный на фиг. 87, для сплава, содержащего 0,83% С, — вид, представленный на фиг, 88, и т. д. Анализ этих кривых дается ниже.
Скачать реферат: Kriticheskie-tochki-zheleza-i-zhelezouglerodistyh-splavov.rar
Пароль на архив: privetstudent.com
Категория: Рефераты / Производство
Уважаемый посетитель, Вы зашли на сайт как незарегистрированный пользователь.
Мы рекомендуем Вам зарегистрироваться либо войти на сайт под своим именем.
Превращения, происходящие в железе и стали при нагреве и охлаждении :: Технология металлов
Строение стали
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа.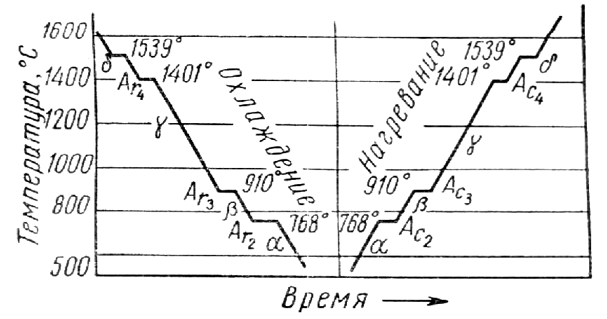 При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Перестройка кристаллической решетки при медленном охлаждении происходит в обратном порядке: дельта-железо при 1390° превращается в гамма-железо, а гамма-железо при 898° превращается в альфа-железо.
Рис. 1. Строение кристаллической решетки: а — альфа и дельта железа; б — гамма железа.
Критические точки превращения
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.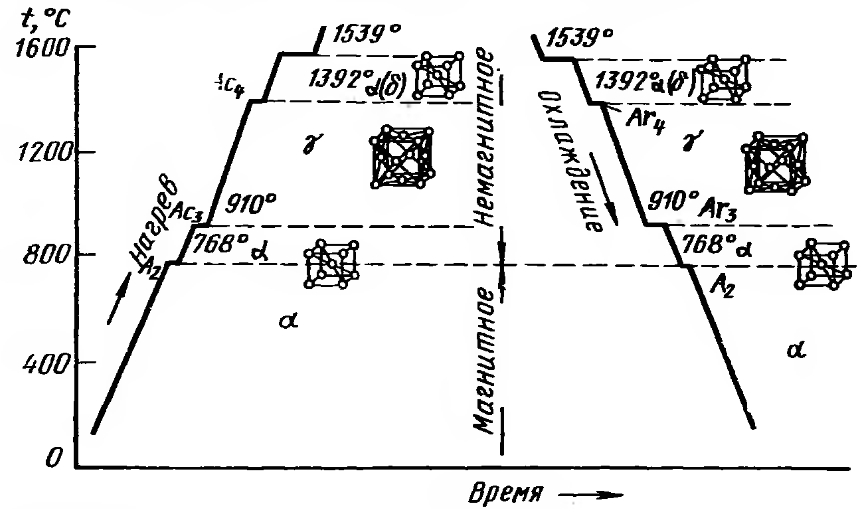
Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
На рис. 3 представлена диаграмма состояния углеродистой стали при медленном охлаждении и нагревании.
Рис.3. Диаграмма состояния углеродистых сталей.
Структура стали
Структурой стали называется внутреннее ее строение. Углерод в стали находится в виде химического соединения с железом, и это соединение называется — цементит. Кроме цементита, в стали имеется феррит, представляющий собой почти чистое железо. В зависимости от содержания углерода большая или меньшая часть феррита находится в механической смеси с цементитом, образуя новую структуру — перлит. Если небольшой кусок металла прошлифовать, отполировать и протравить в специальном реактиве, то под микроскопом можно различить структуры. Ниже приводится описание структур железоуглеродистых сплавов.
Аустенит представляет собою твердый раствор углерода и других элементов в гамма-железе. Наибольшее содержание углерода, которое может раствориться в ау-стените — это 2%.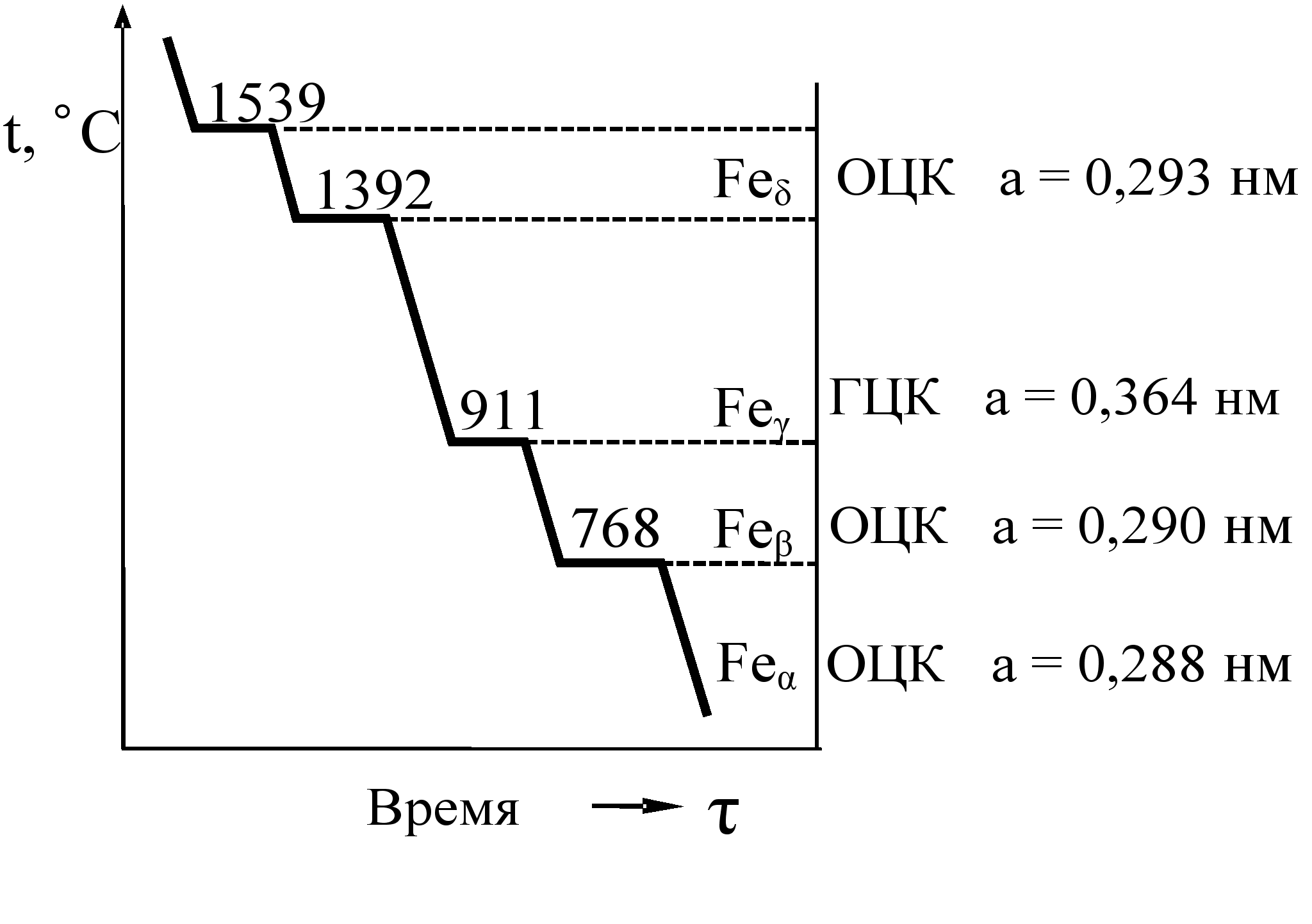 Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
В обычных сталях аустенит устойчив только лишь при температуре выше критических точек. При охлаждении, даже самом быстром, с этих температур аустенит превращается в другие структуры. При комнатной температуре аустенит полностью сохраняется в ряде марок нержавеющих сталей, в высокомарганцовистой стали и в незначительном количестве остается при закалке некоторых марок инструментальной и конструкционной сталей.
Аустенит мягок, пластичен, тягуч, мало упруг. Твердость его по Бринелю находится в пределах 170—220.
Аустенит немагнитен, обладает невысокой электропроводностью.
Феррит представляет собой твердый раствор углерода и других элементов в альфа-железе. Наибольшее содержание углерода, которое может раствориться в феррите, это 0,04%. Феррит устойчив при температурах ниже критической точки AC1. Он выделяется из аустенита при медленном охлаждении последнего ниже A6i. Феррит мягок, сильно тягуч. Твердость HB= 60—100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Феррит мягок, сильно тягуч. Твердость HB= 60—100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Цементит представляет собой химическое соединение железа с углеродом Fe3C—карбид железа. Цементит содержит углерода 6,67%. Выделяется из жидкого и твердого раствора при медленном охлаждении. Цементит весьма тверд и хрупок. Твердость его НB= 800—820. Он магнитен до 210°. Выше этой температуры цементит теряет магнитные свойства.
Перлит представляет собой механическую смесь феррита и цементита. Он образуется из аустенита при медленном его охлаждении. Температура превращения аустенита в перлит 723°С. При весьма медленном переходе через эту температуру цементит образуется в виде зерен (глобулей), и тогда перлит называется зернистым. При более быстром охлаждении цементит приобретает форму пластинок, и такой перлит называется пластинчатым. При весьма быстром охлаждении в результате значительного переохлаждения аустенита вместо перлита получаются другие структуры, о которых речь будет ниже.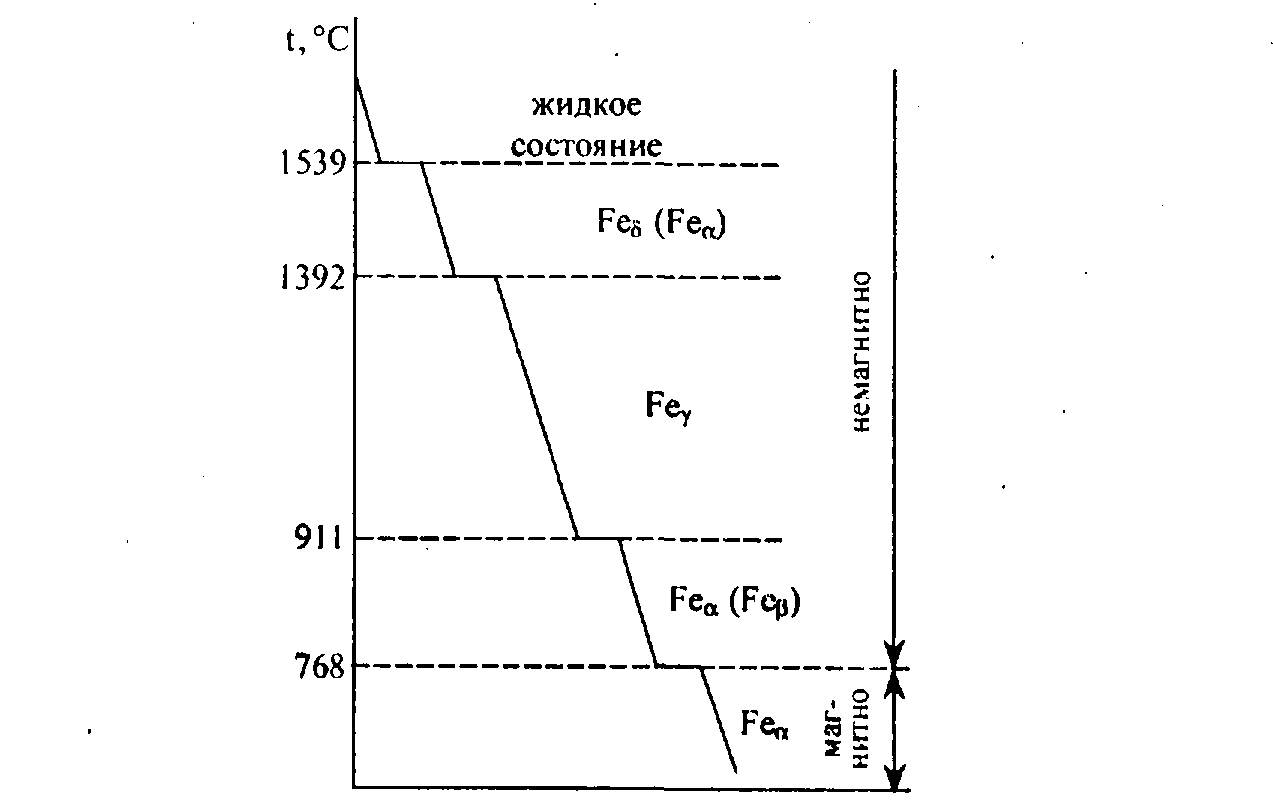
Перлит магнитен, прочен и пластичен. Твердость его находится в пределах от 160 до 230 кг/мм2 по Бринелю. При обработке резанием наиболее чистую поверхность дает структура зернистого перлита.
Мартенсит образуется в результате весьма быстрого охлаждения (закалки) аустенита. При быстром охлаждении успевает произойти перестройка кристаллической решетки гамма-железа в решетку альфа-железа, выделение же углерода в карбид железа не успевает произойти, и он весь остается растворенным в решетке альфа-железа. Так как нормально альфа-железо может растворить в себе не более 0,04% углерода, то такой раствор называют пересыщенным. Он отличается весьма большой твердостью (свыше Rc= 60) и хрупкостью. Следует указать, что решетка альфа-железа, получающаяся в результате закалки, имеет искаженную форму. Так, размеры ее граней не одинаковы — в одном направлении они удлинены за счет других (см. рис. 4). Такая решетка называется тетрагональной. Чем больше в стали углерода, тем больше тетрагональность решетки и тем более велики внутренние напряжения.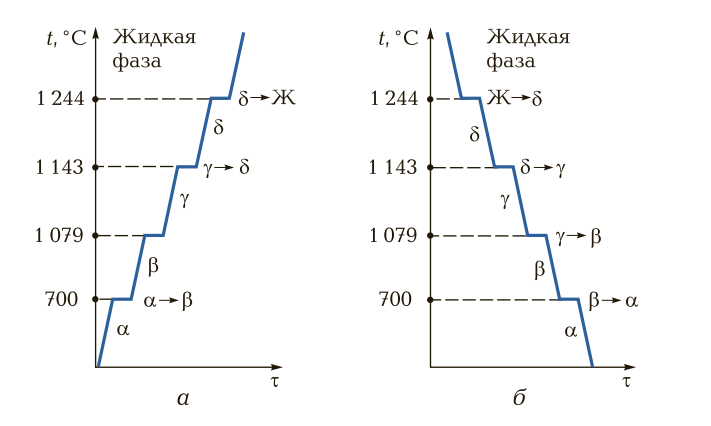 При нагревании до температур 100—200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
При нагревании до температур 100—200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
Рис. 4. Строение кристаллической решетки стали, закаленной на мартенсит.
Троостит представляет собой высокодисперсную (мелкораздробленную) смесь феррита и карбидов. Он образуется при охлаждении аустенита с замедленной против закалки скоростью или в результате нагрева (отпуска) мартенсита в пределах 250—400°.
При нагреве закаленной стали происходит постепенное выделение углерода из кристаллической решетки с образованием карбидов. Троостит менее прочен, более пластичен, чем мартенсит. Твердость его НB330—400. При охлаждении аустенита в горячих средах в интервале 250—400° (изотермическое превращение аустенита) происходит образование игольчатого троостита, несколько более прочного, чем обычный троостит.
Сорбит представляет собой дисперсную смесь феррита и карбидов. Он образуется при охлаждении аустенита с небольшой скоростью или при нагреве (отпуске) мартенсита до 400—650°. Карбиды сорбита более крупные, чем троостита. Сорбит пластичен, вязок и магнитен. Твердость НВ 270—320.
Ледебурит представляет собой эвтектическую смесь аустенита и цементита. Он содержит углерода 4 3% Образуется ледебурит при затвердевании жидкого сплава с содержанием углерода свыше 2%. Ледебурит хрупок.
На рис. 5. представлены фотоснимки структур стали с различным содержанием углерода.
Структура стали с содержанием углерода 0,83% состоит из сплошного перлита и называется эвтектоидной; при меньшем содержании углерода структура стали состоит из перлита и феррита и носит название доэвтектоидной, а при большем содержании углерода — из перлита и цементита и называется заэвтектоидной. Температура 723°, при которой перлит переходит в аустенит, также называется критической и обозначается Ас.
Для того чтобы доэвтектоидную и эвтектоидную сталь полностью отжечь, нормализовать или закалить, их нужно нагреть до такой температуры, при которой они перешли бы в аустенитное состояние.
Рис. 5. Микроструктура отожженной углеродистой стали:
а — с содержанием углерода -0,1%
б — с содержанием углерода -0,85%
в — с содержанием углерода -1,1%
Превращения, происходящие в стали при нагревании
По диаграмме на рис. 3 можно проследить за изменениями структуры трех разных марок стали при нагревании:
- Сталь с содержанием углерода 0,83%. Структура стали представляет собой перлит. При температуре 723° в точке Aс1 перлит переходит в аустенит.
- Сталь с содержанием углерода 0,4%. Структура стали представляет собой перлит и феррит. При температуре 723° в точке К1 перлит переходит в аустенит, и по мере повышения температуры происходит растворение свободного феррита в аустените.
 При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.
При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,. - Сталь с содержанием углерода 1,2%. Структура стали представляет собой перлит и цементит. При температуре 723° в точке Pi перлит переходит в аустенит, и при дальнейшем повышении температуры происходит постепенное растворение цементита в аустените. При пересечении линии SEв точке Р2 это растворение закончится. Для этой стали точка Р1 явится нижней критической точкой Ас1, а точка Ρ2 — верхней критической точкой, которая для заэвтектоидных сталей обозначается Асm.
Линия на диаграмме, обозначенная буквами GS, соответствует окончанию растворения феррита в аустените в доэвтектоидных сталях, а линия SE соответствует окончанию растворения цементита в аустените в заэвтектоидных сталях.
Следует указать, что заэвтектоидные стали при операциях термической обработки не нагревают выше линии Аcт(такая высокая температура нагрева приведет к перегреву и ухудшению свойств стали), а ограничиваются нагревом выше первой критической точки ACl, что полностью обеспечивает получение необходимых свойств.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры — мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей — сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле — троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.
На рис. 6 показаны микроструктуры закаленной стали.
Рис. 6. Микроструктура закаленной стали:
а — игольчатый мартенсит;
б — сорбит.
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей — и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит—при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250—400° — мартенсит и троостит и при нагреве от 400—650° — троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.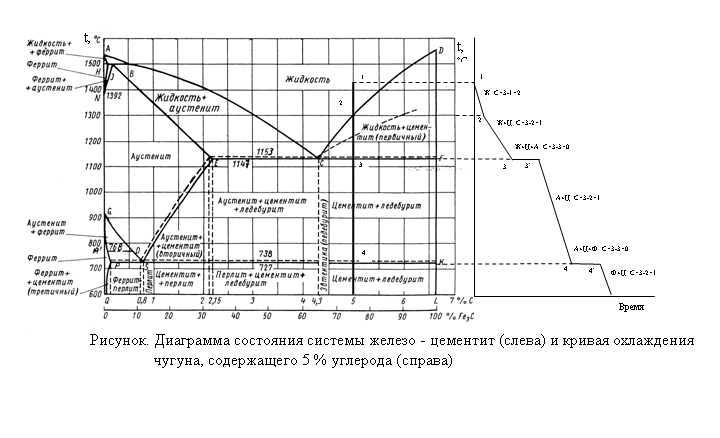
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.
Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной— температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн — образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45—55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Источник:
Остапенко Н.Н.,Крапивницкий Н.Н. Технология металлов. М. Высшая школа,1970г.
Каменичный И.С. Практика термической обработки инструмента. Киев, 1959 г.
Ответы: С подходящим наброском объясните…
Сварка: принципы и применение (список курсов MindTap) 8-е издание
ISBN: 9781305494695
Автор: Ларри Джеффус
Опубликовать er: Cengage Learning
1 Введение в сварку2 Безопасность при сварке3 Оборудование для дуговой сварки в среде защитного газа, настройка и эксплуатация4 Дуговая сварка листового металла в среде защитного газа5 Дуговая сварка труб в защитном металле6 Дуговая сварка в среде защитного металла Сертификация Aws Sense7 Пламенная резка8 Плазменно-дуговая резка9Сопутствующие процессы резки10 Оборудование для дуговой сварки металлическим электродом, установка и эксплуатация11 Дуговая сварка металлическим электродом12 Оборудование для дуговой сварки флюсом, установка и эксплуатация13 Дуговая сварка флюсом14 Дуговая и флюсовая дуговая сварка труб15 Дуговая сварка флюсом и дуговая сварка флюсом Сертификация Aws Sense16 Оборудование для дуговой сварки вольфрамовым электродом, установка, эксплуатация и присадочные металлы17 Газовая вольфрамовая дуга Производство листового металла18 Газовая вольфрамовая дуговая сварка труб19 Газовая вольфрамовая дуговая сварка листа и трубы Сертификация Aws Sense20 Расчет и стоимость сварки21 Чтение технических чертежей22 Проектирование сварных соединений и символы сварки23 Методы и практика изготовления24 Нормы и стандарты сварки25 Испытания и контроль26 Сварочная металлургия27 Свариваемость металлов28 Выбор присадочного металла29Автоматизация сварки и робототехника30 Другие процессы сварки31 Оборудование для кислородной сварки и резки, настройка и эксплуатация32 Ацетиленовая сварка33 Пайка, пайка и пайка expand_more
Вопросы к главам expand_more
Задача 1R : Что имеется в виду, когда говорят, что металл обладает хорошей свариваемостью? Задача 2R. Что включает в себя термин «свариваемость»? Задача 3R. На какие свойства металла может повлиять выбор процесса сварки? ze листовая нержавеющая сталь? Задача 6R. Ссылаясь на Таблицу 27-2, какие типы металлов можно использовать для соединения с помощью электрогазовой сварки? Задача 7R. Какие две организации разработали системы классификации стандартных конструкционных марок стали?R: Ссылаясь на таблицу 27-3, каков состав металла, обозначенного как 44XX? Задача 10R: Каково максимально допустимое процентное содержание марганца в углеродистой стали по определению AISI… Задача 11R: Согласно таблице 27-4, при каком уровне содержания углерода ухудшается свариваемость? Задача 12R: Какие факторы, кроме углерода, влияют на способность стали к сварке? углеродистые стали имеют сильную пористость при сварке методом GTA? Задача 14R: Что необходимо сделать со сталями перед сваркой и после сварки, если они содержат больше углерода? Задача 15R: Почему высокоуглеродистые стали предварительно нагревают перед сваркой? Задача 16R: Объясните, как сваривать инструментальную сталь кислородно-топливным процессом.
Что включает в себя термин «свариваемость»? Задача 3R. На какие свойства металла может повлиять выбор процесса сварки? ze листовая нержавеющая сталь? Задача 6R. Ссылаясь на Таблицу 27-2, какие типы металлов можно использовать для соединения с помощью электрогазовой сварки? Задача 7R. Какие две организации разработали системы классификации стандартных конструкционных марок стали?R: Ссылаясь на таблицу 27-3, каков состав металла, обозначенного как 44XX? Задача 10R: Каково максимально допустимое процентное содержание марганца в углеродистой стали по определению AISI… Задача 11R: Согласно таблице 27-4, при каком уровне содержания углерода ухудшается свариваемость? Задача 12R: Какие факторы, кроме углерода, влияют на способность стали к сварке? углеродистые стали имеют сильную пористость при сварке методом GTA? Задача 14R: Что необходимо сделать со сталями перед сваркой и после сварки, если они содержат больше углерода? Задача 15R: Почему высокоуглеродистые стали предварительно нагревают перед сваркой? Задача 16R: Объясните, как сваривать инструментальную сталь кислородно-топливным процессом.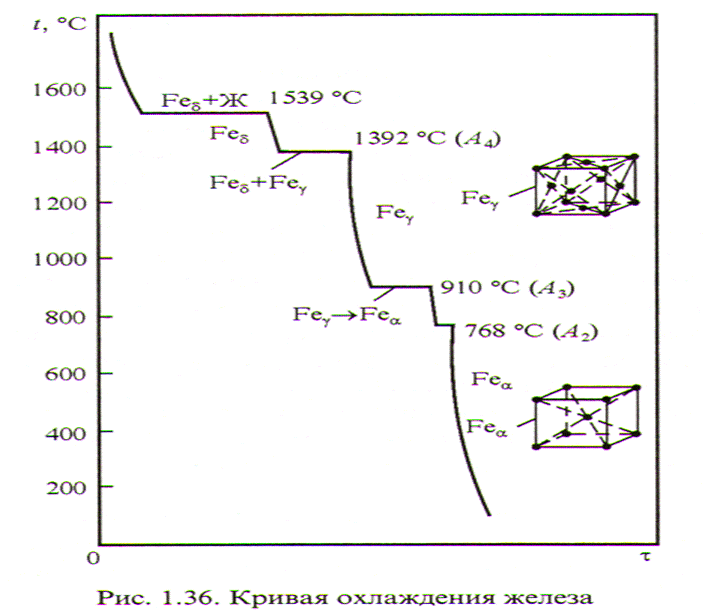 RПроблема 19R: Какие проблемы могут возникнуть с нержавеющей сталью, так как допускается образование карбидных отложений во время… Проблема 20R: Почему нержавеющую сталь нельзя выдерживать при температуре от 800F до 1500F (425C и 815C)? дюймов (6 мм) -толщина… Задача 23R: Почему металл сварного шва из чугуна должен быть пластичным? Задача 24R: Почему медь следует сваривать большими токами и предварительно нагревать? Задача 25R: Почему нельзя расплавить оксид алюминия с алюминия? ошибка 29Р: Как можно очистить деталь перед сваркой? Задача 30Р: Как можно использовать искровой тест для идентификации металлов? • 72 голоса • 14:51 минут
RПроблема 19R: Какие проблемы могут возникнуть с нержавеющей сталью, так как допускается образование карбидных отложений во время… Проблема 20R: Почему нержавеющую сталь нельзя выдерживать при температуре от 800F до 1500F (425C и 815C)? дюймов (6 мм) -толщина… Задача 23R: Почему металл сварного шва из чугуна должен быть пластичным? Задача 24R: Почему медь следует сваривать большими токами и предварительно нагревать? Задача 25R: Почему нельзя расплавить оксид алюминия с алюминия? ошибка 29Р: Как можно очистить деталь перед сваркой? Задача 30Р: Как можно использовать искровой тест для идентификации металлов? • 72 голоса • 14:51 минут
Виджей Кумар
Кривая охлаждения железа и фазовая диаграмма Fe-C
Продолжить в приложении
1
Обзор курса и фазовая диаграмма
12:38 минут
2
Фазовая диаграмма- 1
13:53 минут
3 9004 4
Фазовая диаграмма — 2 (Кривая охлаждения чистого железа и фазовая диаграмма Fe-C)
14:51 мин
4
ТТТ-диаграмма
14:22 мин 900 03
5
Термическая обработка — 1
14:27мин
6
Термическая обработка — 2
13:31 мин
7
Термическая обработка- 3
12:16 мин
8
Термообработка — 4
12:13мин
9
Термообработка -5
11:16мин
10
9003 8 Термическая обработка — 6
13:48 мин
11
Термическая обработка -7
12:28 мин
12
Термическая обработка — 8
14:33 мин
13
Инженерные материалы -1
13:52 мин
14
Инженерные материалы- 2
11:18 мин
15
Инженерные материалы — 3
11:13 мин
16
9000 3
Инженерные материалы -4
12:04 мин
17
Кристаллическая структура -1
10:34 мин
18
Кристаллическая структура — 2
11:43 мин
19
Кристаллическая структура — 3
14:22 мин
20
Кристаллическая структура -4
14:16 мин
20
Кристаллическая структура — 3
14:22 мин
21
Несовершенства кристалла — 1
12:25 мин.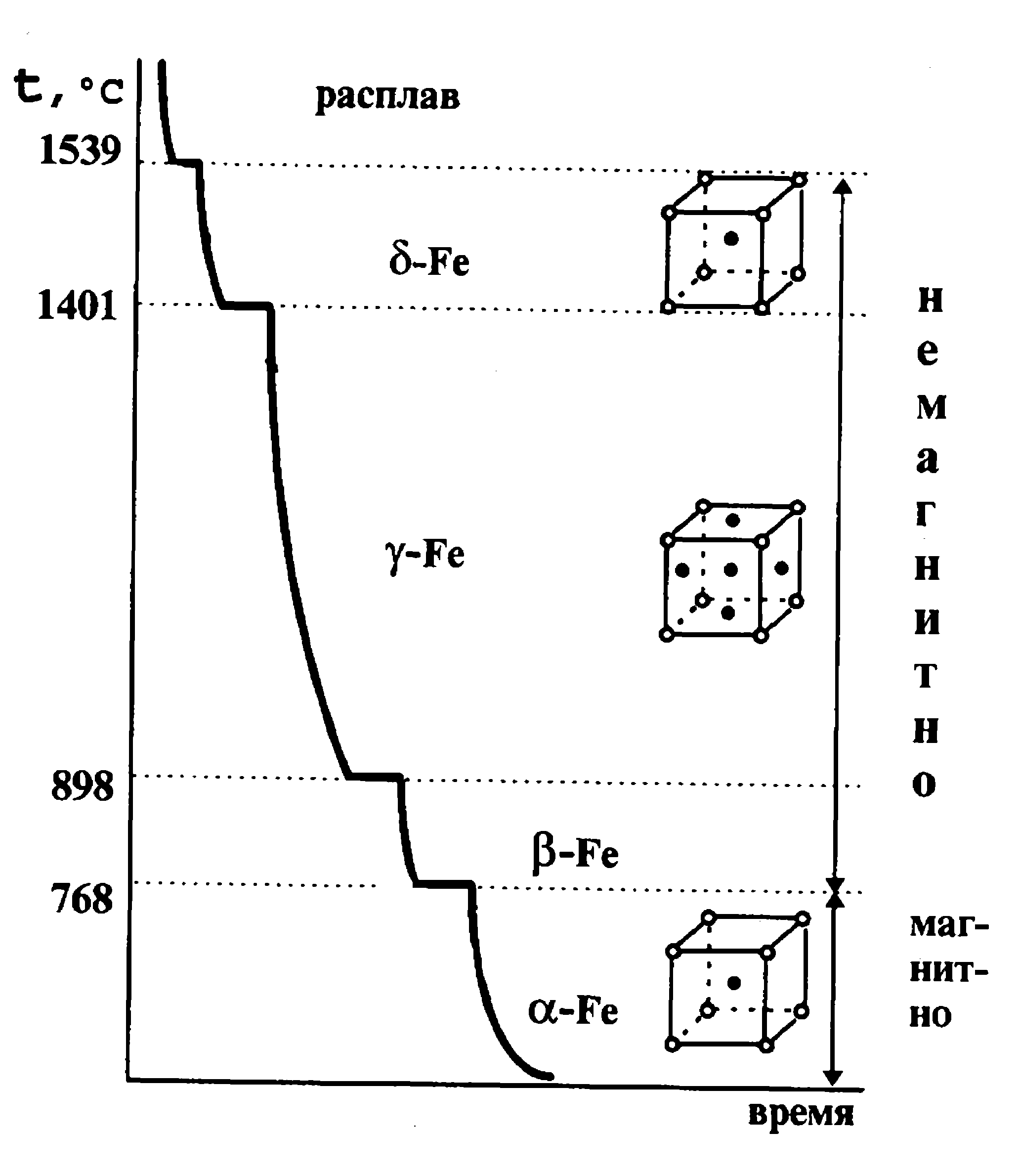
22
Несовершенства кристалла — 2
14:46 мин.
23
Черные и цветные металлы
11:29мин
24
Чугун -1
12 :26мин
25
Чугун — 2
14:25мин
26
Сталь — 1
9003 4 14:58мин
27
Легированная сталь
14:28мин
28
Сталь — 2
9 0034 13:03мин
29
Сталь — 3
12:20 мин
30
Пластическая деформация — 1
11:16 мин
9 -1 0006
33
Механические свойства металла — 2
13:09мин
34
Механические свойства металла -3
12:42 мин.


 При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.
При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.