Содержание
Студопедия — Критические точки сплавов
Критическая точка – температура, при которой в сплаве происходят фазовые превращения. Критические точки определяют по кривым охлаждения сплавов.
В зависимости от характера превращения критические точки имеют собственные имена: ликвидус, солидус, сольвус (табл. 6.1) и др.
Таблица 6.1
Виды критических точек сплавов
| Название точки
(обозначение) | Фазовое превращение при охлаждении (нагревании ) | Примечания |
| Ликвидус
| L↔ ТВ
Начало выпадения твердой фазы в жидком расплаве (конец расплавления твердой фазы ) | Для чистых компонентов и эвтектических сплавов точки ликвидус и солидус совпадают |
| Солидус
| L↔ ТВ
Конец выпадения твердой фазы в жидком расплаве (начало расплавления твердой фазы ) | |
| Сольвус
(точка вторичной кристаллизации) | ТВ↔ ТВ + ТВII
Выпадение вторичной фазы в результате снижении растворимости компонентов сплава в твердом состоянии | Вторичная фаза представляет собой химическое соединение АnBm |
| Точка Кюри
(точка магнитного превращения) | Приобретение ферромагнитных свойств твердым веществом | Не связано с перекристаллизацией.
Ni – 360 °C Fe – 768 °C Co – 1150 °C |
| Точка полиморфного превращения
(точка перекристаллизации) | ТВa ↔ ТВβ
Переход высокотемпературной аллотропической формы в низкотемпературную (переход низкотемпературной аллотропической формы в высокотемпературную ) | Для сплавов перекристаллизация проходит в интервале температур
|
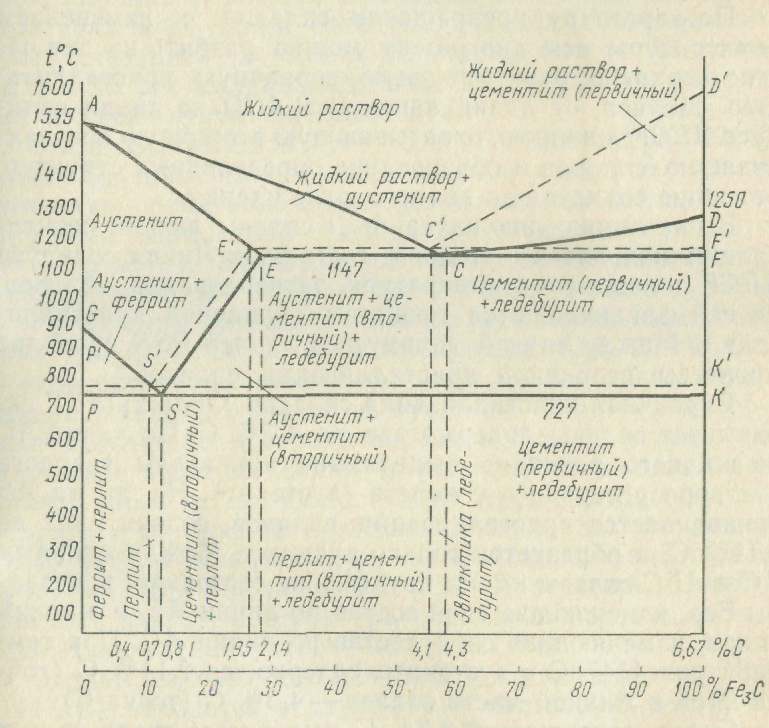
Каждая точка диаграммы состояния характеризует строго определенный состав сплава при соответствующей температуре. Точка А (1539°С) отвечает температуре плавления железа, точка D (≈ 1250°С) – температуре плавления цементита, точки N (1392оС) и G (910°С) соответствуют полиморфному превращению Feα ↔ Feγ.
Концентрация углерода (по массе) для характерных точек диаграммы состояния следующая: В – 0, 51% С в жидкой фазе, находящейся в равновесии с δ –ферритом (Feδ (C)) и аустенитом (Feγ (C)), при перитектической реакции и при 1499оС; Н – 0, 1% С в δ — феррите при 1490оС; J – 0, 16% C – в аустените-перитектике при 1490оС; Е – 2, 14% предельное содержание в аустените при 1147°С; S – 0, 8% С в аустените при реакции эвтектоидного превращения 727°С; Р – 0, 02% С – предельное содержание в феррите (Feα (C)) при 727°С.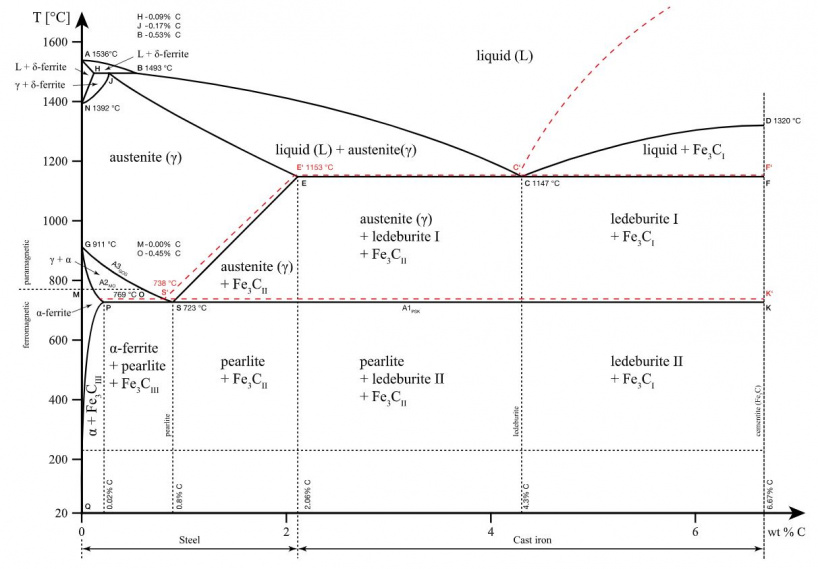
Линия, соединяющая точки АВСD на диаграмме – линия ликвидус. Выше этой линии все железоуглеродистые сплавы находятся в жидком состоянии. Линия АHJECF – линия солидус. Ниже этой линии все сплавы находятся в твердом состоянии и при дальнейшем охлаждении происходят только процессы, связанные с изменением растворимости углерода в Feα и Feγ, а также процессы, которые обусловливаются аллотропическим (полиморфным) превращением железа.
Линия АВ указывает температуру начала кристаллизации δ – феррита из жидкого сплава; линия ВС – температуру начала кристаллизации аустенита; линия CD – температуру начала кристаллизации первичного цементита. При достижении температуры 1147°С ECF (эвтектики) состав жидкой фазы любого сплава, расположенного между точками E и F диаграммы, будет соответствовать точке C (4, 3% С). При этой температуре оставшаяся часть жидкой фазы состава 4, 3% углерода кристаллизуется с образованием эвтектики – механической смеси кристаллов аустенита и цементита, называемой ледебуритом.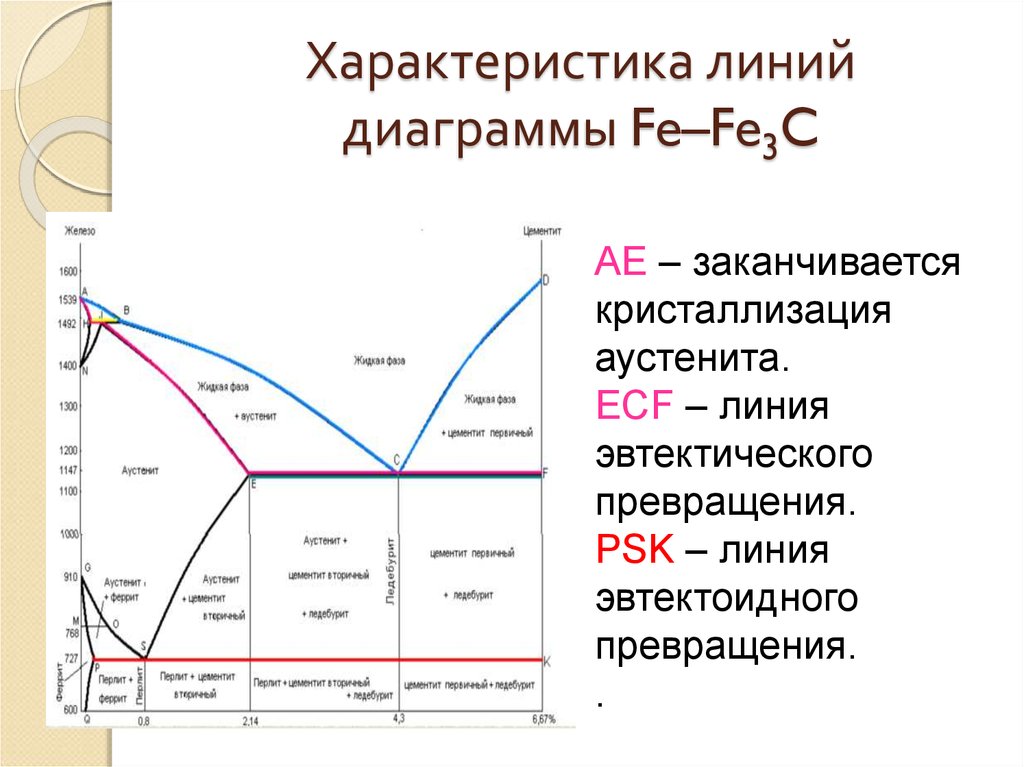
Ниже линии GS происходит полиморфное превращение аустенита в феррит.
Линия SE является линией насыщения и показывает, как изменяется растворимость углерода Feγ с изменением температуры. Вследствие уменьшения растворимости углерода в Feγ при понижении температуры из пересыщенного аустенита будет выделяться вторичный цементит ЦII.
Линия PSK 727°C является линией эвтектоидного превращения. При
этой температуре аустенит (Аs) состава точки S (0, 8% C) распадается с образованием перлита (Пs): Аs→ Пs→ (Ф + Ц).
Таблица 6.2
Значения точек на диаграмме железо — цементит
| Обозначение точки на диаграмме | Температура °С | Концентрация углерода % |
| А температура плавления чистого железа | ||
| Н предельная концентрация углерода
в высокотемпературном феррите | 0.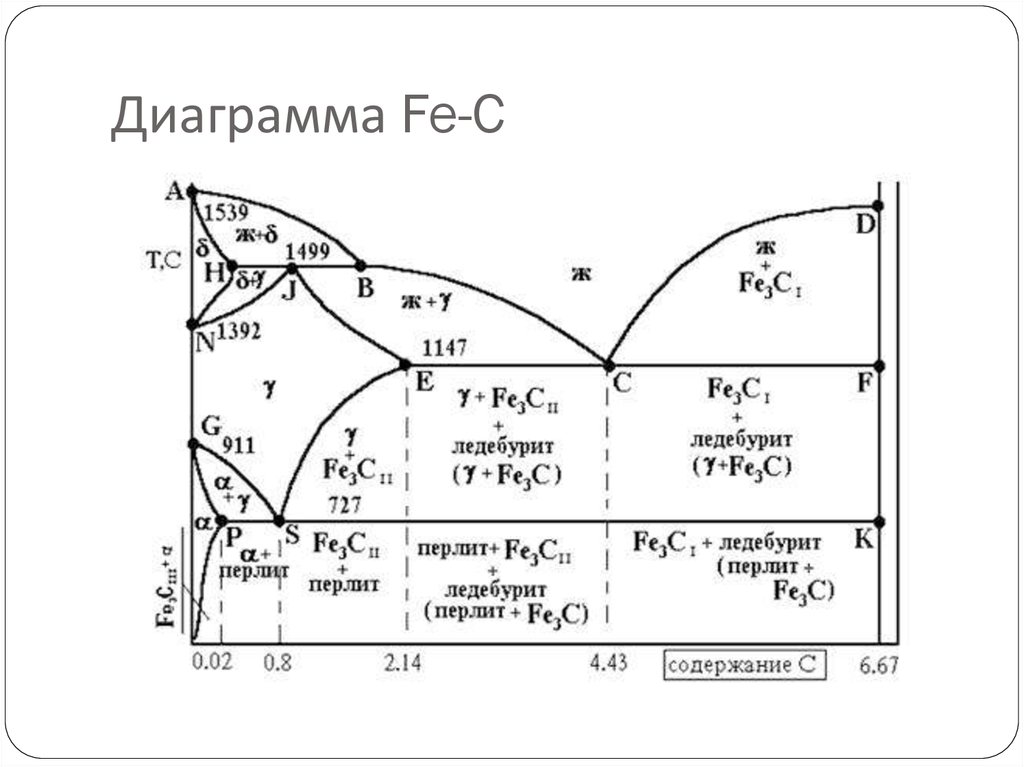 1 1
| |
| N температура аллотропического
превращения железа | ||
| D температура плавления цементита | 6.67 | |
| Е наибольшая концентрация углерода
в аустените | 2.14 | |
| Сточка эвтектики | 4.3 | |
| G температура аллотропического
превращения железа | ||
| Р предельная концентрация углерода
в низкотемпературном феррите | 0.02 | |
| S эвтектоидная точка | 0.8 |
Шрифт зодчего Шрифт зодчего состоит из прописных (заглавных), строчных букв и цифр…
Картограммы и картодиаграммы Картограммы и картодиаграммы применяются для изображения географической характеристики изучаемых явлений. ..
..
Практические расчеты на срез и смятие При изучении темы обратите внимание на основные расчетные предпосылки и условности расчета…
Функция спроса населения на данный товар Функция спроса населения на данный товар: Qd=7-Р. Функция предложения: Qs= -5+2Р,где…
Значення творчості Г.Сковороди для розвитку української культури Важливий внесок в історію всієї духовної культури українського народу та її барокової літературно-філософської традиції зробив, зокрема, Григорій Савич Сковорода (1722—1794 pp…
Постинъекционные осложнения, оказать необходимую помощь пациенту I.ОСЛОЖНЕНИЕ: Инфильтрат (уплотнение). II.ПРИЗНАКИ ОСЛОЖНЕНИЯ: Уплотнение…
Приготовление дезинфицирующего рабочего раствора хлорамина Задача: рассчитать необходимое количество порошка хлорамина для приготовления 5-ти литров 3% раствора…
ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЙ ПОМОЩИ НАСЕЛЕНИЮ В УСЛОВИЯХ ОМС 001.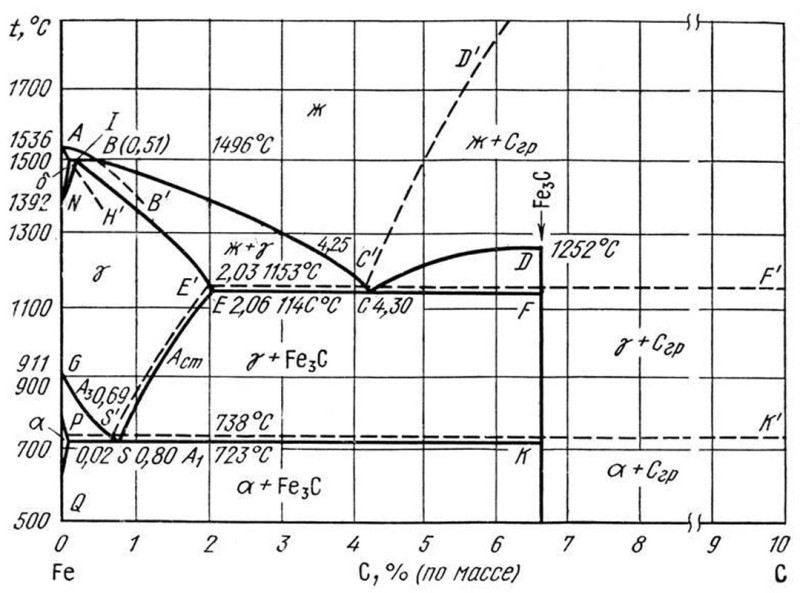 Основными путями развития поликлинической помощи взрослому населению в новых экономических условиях являются все…
Основными путями развития поликлинической помощи взрослому населению в новых экономических условиях являются все…
МЕТОДИКА ИЗУЧЕНИЯ МОРФЕМНОГО СОСТАВА СЛОВА В НАЧАЛЬНЫХ КЛАССАХ В практике речевого общения широко известен следующий факт: как взрослые…
СИНТАКСИЧЕСКАЯ РАБОТА В СИСТЕМЕ РАЗВИТИЯ РЕЧИ УЧАЩИХСЯ В языке различаются уровни — уровень слова (лексический), уровень словосочетания и предложения (синтаксический) и уровень
Словосочетание в этом смысле может рассматриваться как переходное звено от лексического уровня к синтаксическому…
Металловедение (Гуляев А. П.)
Металловедение (Гуляев А. П.)
Оглавление
|
Объяснение фазовой диаграммы железо-углерод [с графиками]
Легированные металлы могут существовать в различных фазах. Фазы – это физически однородные состояния сплава. Фаза имеет точный химический состав – определенное расположение и связи между атомами.
Эта структура атомов придает разные свойства разным фазам. Мы можем выбрать нужную фазу и использовать ее в наших приложениях.
Только некоторые специальные сплавы могут существовать в нескольких фазах. Нагрев металла до определенных температур с использованием процедур термообработки приводит к различным фазам. Некоторые специальные сплавы могут существовать более чем в одной фазе при одной и той же температуре.
Некоторые специальные сплавы могут существовать более чем в одной фазе при одной и той же температуре.
Что такое фазовые диаграммы?
Фазовые диаграммы представляют собой графическое представление фаз, присутствующих в сплаве при различных условиях температуры, давления или химического состава .
Диаграмма описывает подходящие условия для существования равновесия двух или более фаз. Например, диаграмма состояния воды описывает точку (тройную точку), в которой вода может сосуществовать в трех разных фазах одновременно. Это происходит при температуре чуть выше точки замерзания (0,01°C) и давлении 0,006 атм.
Использование диаграмм
Существуют четыре основных области применения фазовых диаграмм сплавов:
- Разработка новых сплавов на основе требований применения.
- Производство этих сплавов.
- Разработка и контроль соответствующих процедур термообработки, таких как отпуск, отжиг, нормализация и т.
 д., для улучшения химических, физических и механических свойств этих новых сплавов.
д., для улучшения химических, физических и механических свойств этих новых сплавов. - Устранение проблем, возникающих при применении этих новых сплавов, что в конечном итоге повышает предсказуемость продукта.
Когда дело доходит до разработки сплавов, фазовые диаграммы помогают предотвратить перепроектирование для приложений. Это снижает стоимость и время обработки. Они также помогают разрабатывать альтернативные сплавы или те же сплавы с альтернативными легирующими элементами. Это может помочь снизить потребность в использовании дефицитных, опасных или дорогих легирующих элементов.
Фазовые диаграммы помогают металлургам понять, какие фазы являются термодинамически стабильными, метастабильными или нестабильными в долгосрочной перспективе. Затем можно выбрать соответствующие элементы для легирования, чтобы предотвратить поломку оборудования. Неправильный выбор материала для выхлопной трубы, например, может привести к выходу из строя при более высоких температурах.
Срок службы также увеличивается, поскольку фазовые диаграммы показывают нам, как решать такие проблемы, как межкристаллитная коррозия, горячая коррозия и повреждение водородом.
Фазовая диаграмма железо-углерод
Фазовая диаграмма железо-углерод широко используется для понимания различных фаз стали и чугуна. И сталь, и чугун представляют собой смесь железа и углерода. Также оба сплава содержат небольшое количество микроэлементов.
График довольно сложный, но поскольку мы ограничиваем наши исследования Fe3C, мы сосредоточимся только на до 6,67 весовых процентов углерода.
Эта фазовая диаграмма железо-углерод построена с массовыми концентрациями углерода по оси X и температурной шкалой по оси Y.
youtube.com/embed/tYk5NMylHc0?start=5&feature=oembed&iv_load_policy=3&modestbranding=1&rel=0&autohide=1&playsinline=0&autoplay=1&enablejsapi=1″ title=»Iron crystal structures explained»/>
Объяснение кристаллических структур железа
Углерод в железе является примесью внедрения. Сплав может образовывать гранецентрированную кубическую (ГЦК) решетку или объемноцентрированную кубическую (ОЦК) решетку. Он образует твердый раствор с α-, γ- и δ-фазами железа.
Типы ферросплавов на фазовой диаграмме
Шкала весовых процентов по оси X фазовой диаграммы железо-углерод идет от 0% до 6,67% углерода. До максимального содержания углерода 0,008% по весу углерода металл называют просто железом или чистым железом. Он существует в форме α-феррита при комнатной температуре.
Железоуглеродистый сплав с содержанием углерода от 0,008% до 2,14% называется сталью. В этом диапазоне существуют различные марки стали, известные как низкоуглеродистая сталь (или мягкая сталь), среднеуглеродистая сталь и высокоуглеродистая сталь.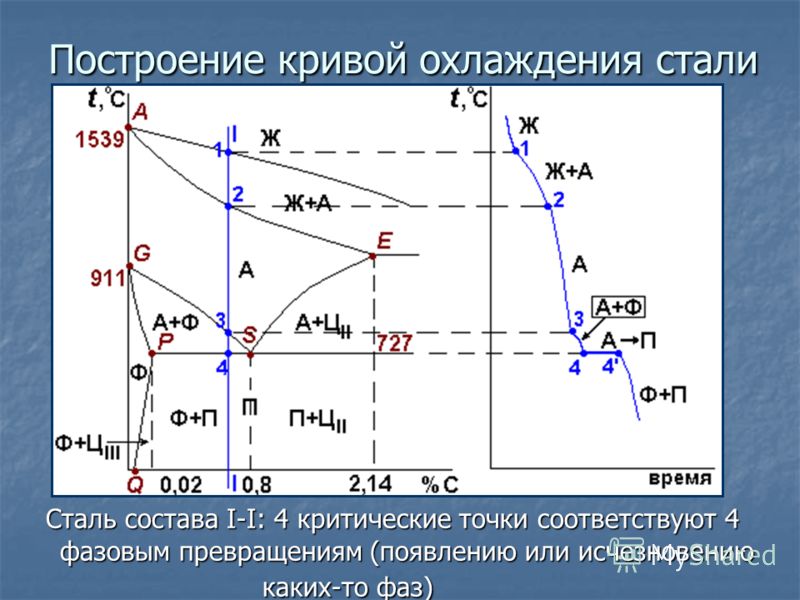
Когда содержание углерода превышает 2,14%, мы достигаем стадии чугуна. Чугун очень твердый, но его хрупкость сильно ограничивает его применение и методы формовки.
Границы
На диаграмме можно увидеть несколько линий под названиями A1, A2, A3, A4 и ACM. Буква А в их названии означает слово «арест». При повышении или понижении температуры металла на этих границах происходит фазовый переход, когда температура достигает значения на границе.
Обычно при нагреве сплава его температура увеличивается. Но по этим направлениям (А1, А2, А3, А4 и АСМ) нагрев приводит к перестройке структуры в другую фазу, и, таким образом, температура перестает расти до тех пор, пока фаза полностью не изменится. Это известно как термическая остановка, поскольку температура остается постоянной.
Элементы легированной стали, такие как никель, марганец, хром и молибден, влияют на положение этих границ на фазовой диаграмме. Границы могут сдвигаться в любом направлении в зависимости от используемого элемента. Например, на фазовой диаграмме железо-углерод добавление никеля снижает границу A3, а добавление хрома повышает ее.
Например, на фазовой диаграмме железо-углерод добавление никеля снижает границу A3, а добавление хрома повышает ее.
Точка эвтектики
Точка эвтектики — это точка, где встречаются несколько фаз. Для диаграммы сплава железо-углерод точка эвтектики находится там, где пересекаются линии A1, A3 и ACM. Образование этих точек случайно.
В этих точках происходят эвтектические реакции, когда жидкая фаза замерзает в смесь двух твердых фаз. Это происходит при охлаждении жидкого сплава эвтектического состава до его эвтектической температуры.
Сплавы, образующиеся в этой точке, известны как эвтектические сплавы. Слева и справа от этой точки сплавы известны как доэвтектические и заэвтектические сплавы соответственно («гипо» по-гречески означает «меньше», «гипер» — больше).
Фазовые поля
Границы, пересекающиеся друг с другом, отмечают определенные области на диаграмме Fe3C.
В каждом регионе могут существовать разные фазы или две фазы одновременно. На границе происходит фазовый переход. Эти области являются фазовыми полями.
На границе происходит фазовый переход. Эти области являются фазовыми полями.
Они указывают фазы, присутствующие при определенном составе и температуре сплава. Давайте немного узнаем о различных фазах железоуглеродистого сплава.
Различные фазы
α-феррит
Существующий при низких температурах и низком содержании углерода α-феррит представляет собой твердый раствор углерода в ОЦК Fe. Эта фаза стабильна при комнатной температуре. На графике это можно увидеть в виде полоски на левом краю с осью Y слева и A2 справа. Эта фаза является магнитной ниже 768°C.
Он имеет максимальное содержание углерода 0,022 % и превращается в γ-аустенит при 912°C, как показано на графике.
γ-аустенит
Эта фаза представляет собой твердый раствор углерода в ГЦК Fe с максимальной растворимостью 2,14 % С. При дальнейшем нагреве превращается в ОЦК δ-феррит при 1395°С. γ-аустенит нестабилен при температурах ниже температуры эвтектики (727°C), если его не охладить быстро. Эта фаза немагнитна.
Эта фаза немагнитна.
δ-феррит
Эта фаза имеет структуру, аналогичную структуре α-феррита, но существует только при высоких температурах. Фазу можно увидеть в верхнем левом углу графика. Он имеет температуру плавления 1538°C.
Fe3C или цементит
Цементит представляет собой метастабильную фазу этого сплава с фиксированным составом Fe3C. Он чрезвычайно медленно разлагается при комнатной температуре на железо и углерод (графит).
Это длительное время разложения, и оно займет намного больше времени, чем срок службы приложения при комнатной температуре. Некоторые другие факторы (например, высокие температуры и добавление определенных легирующих элементов) могут влиять на это разложение, поскольку они способствуют образованию графита.
Цементит твердый и хрупкий, что делает его пригодным для упрочнения сталей. Его механические свойства зависят от его микроструктуры, которая зависит от того, как он смешивается с ферритом.
Жидкий раствор Fe-C
Обозначен на диаграмме буквой «L», его можно увидеть в верхней части диаграммы. Как следует из названия, это жидкий раствор углерода в железе. Поскольку известно, что δ-феррит плавится при 1538°С, то видно, что температура плавления железа снижается с увеличением содержания углерода.
Как следует из названия, это жидкий раствор углерода в железе. Поскольку известно, что δ-феррит плавится при 1538°С, то видно, что температура плавления железа снижается с увеличением содержания углерода.
Fractory предлагает услуги по изготовлению металла, такие как лазерная резка, гибка листового металла, обработка с ЧПУ и т. д., для широкого спектра сталей и других металлов. Если вы не найдете подходящего материала на нашей платформе, свяжитесь с нашими инженерами по продажам, поскольку они, скорее всего, все еще могут удовлетворить ваши потребности.
Фазовая диаграмма железной углеродной фазы-ISPATGURU
Железно-углеродная фазовая диаграмма
- Satyendra
- 11 марта 2013 г.
- 15 Комментарии
- 124. термическая обработка сталей, мартенсит, микроструктура, перлит, фаза, фазовая диаграмма,
Фазовая диаграмма железо-углерод
Фазовые диаграммы являются очень важным инструментом в изучении сплавов для решения многих практических задач в металлургии .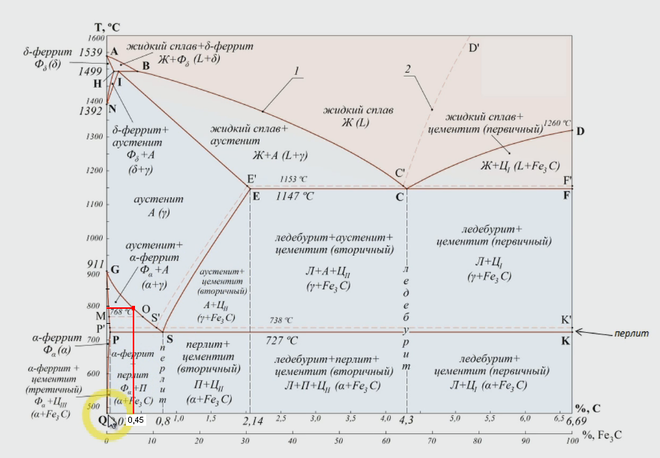 Эти диаграммы определяют области устойчивости фазы, которая может существовать в системе сплавов в условиях постоянного атмосферного давления. Для двойной системы координатами этих диаграмм являются температура и состав. Взаимоотношения между фазами, температурой и составом в системе сплава обычно представляются фазовой диаграммой только в равновесных условиях. Такие условия возникают при малых скоростях нагрева и охлаждения сплавов, когда кинетика превращений не играет существенной роли.
Эти диаграммы определяют области устойчивости фазы, которая может существовать в системе сплавов в условиях постоянного атмосферного давления. Для двойной системы координатами этих диаграмм являются температура и состав. Взаимоотношения между фазами, температурой и составом в системе сплава обычно представляются фазовой диаграммой только в равновесных условиях. Такие условия возникают при малых скоростях нагрева и охлаждения сплавов, когда кинетика превращений не играет существенной роли.
В своей простейшей форме железо и стали представляют собой сплавы железа (Fe) и углерода (C). Существует три типа ферросплавов. Эти сплавы состоят из (i) железа с содержанием углерода менее 0,0008 % при комнатной температуре, (ii) сталей с содержанием углерода от 0,008 % до 2,14 % (обычно менее 1 %) и микроструктуры, состоящей из феррита и цементита. ) и (iii) чугун с содержанием углерода от 2,14 % до 6,7 % (обычно менее 4,5 %). Изучение состава и структуры железа и стали начинается с фазовой диаграммы железо-углерод (Fe-C) (рис. 1). Фазовая диаграмма Fe-C также используется в качестве основы для понимания процессов термообработки.
1). Фазовая диаграмма Fe-C также используется в качестве основы для понимания процессов термообработки.
Многие из основных характеристик системы Fe-C влияют на поведение даже самых сложных сплавов железа и стали. Например, фазы, обнаруженные в простой бинарной системе Fe-C, сохраняются в сложных сталях, но необходимо изучить влияние легирующих элементов на формирование и свойства этих фаз. Диаграмма Fe-C представляет собой ценную основу, на которой можно построить знания как о простых углеродистых, так и о легированных сталях.
Рис. 1 Фазовая диаграмма железо-углерод
C — примесь внедрения в Fe. Он образует твердый раствор с альфа-, гамма- и дельта-фазами железа. Максимальная растворимость C в альфа-железе составляет 0,025% при 727°C. Объемно-центрированное кубическое (ОЦК) железо имеет относительно небольшие промежуточные положения. Максимальная растворимость C в гранецентрированном кубическом (ГЦК) гамма-железе составляет 2,14 % при 1148 °C. ГЦК-железо имеет более крупные промежуточные положения. Механические свойства железоуглеродистых сплавов (железо и стали) зависят от их микроструктуры, то есть от того, как смешаны различные фазы.
ГЦК-железо имеет более крупные промежуточные положения. Механические свойства железоуглеродистых сплавов (железо и стали) зависят от их микроструктуры, то есть от того, как смешаны различные фазы.
Фазовая диаграмма железо-углерод на рис. 2 фактически показывает две диаграммы, а именно (i) стабильную диаграмму железо-графит (красные линии), (ii) и метастабильную диаграмму Fe-Fe3C. Цементит метастабилен, и истинное равновесие должно быть между железом и графитом (С). Хотя графит широко встречается в чугунах, обычно трудно получить эту равновесную фазу в сталях. Для развития стабильного состояния обычно требуется очень много времени, особенно при низких температурах и низком содержании углерода. Следовательно, диаграмма нормального равновесия, которая обычно используется, представляет собой диаграмму метастабильного Fe-Fe3C, поскольку она имеет отношение к поведению большинства сталей на практике.
Детали стабильных и метастабильных фазовых диаграмм системы Fe-C, особенно на стороне, богатой железом, известны намного лучше, чем любые другие бинарные системы с аналогичной сложностью. Однако все еще существуют значительные области, в которых фазовая диаграмма не установлена, например, в диапазонах температур, составов и давлений, не связанных непосредственно с производством чугуна и стали.
Однако все еще существуют значительные области, в которых фазовая диаграмма не установлена, например, в диапазонах температур, составов и давлений, не связанных непосредственно с производством чугуна и стали.
Рис. 2 Диаграмма железо-углерод, показывающая стабильные и метастабильные фазы
В системе железо-углерод есть несколько важных металлургических фаз и микрокомпонентов. В системе Fe–Fe3C углерод является примесью внедрения в Fe. Он образует твердый раствор с альфа (альфа-феррит), гамма (аустенит) и дельта (дельта-феррит) фазами железа. Это важные фазы на фазовой диаграмме Fe – Fe3C. Между однофазными полями обнаруживаются области со смесями двух фаз, таких как феррит и цементит, аустенит и цементит, феррит и аустенит. При самых высоких температурах можно обнаружить поле жидкой фазы, а под ним находятся поля двух фаз: жидкость и аустенит, жидкость и цементит и жидкость и феррит. При термообработке сталей всегда избегают жидкой фазы. В точке эвтектики (4,26 % С) жидкий сплав при охлаждении непосредственно превращается в аустенит и цементит без какого-либо двухфазного поля. Точно так же в эвтектоидной точке (0,76 % C) аустенитная фаза при охлаждении напрямую превращается в феррит и цементит без какого-либо двухфазного поля. Некоторым важным границам в однофазных полях даны специальные названия, облегчающие понимание диаграммы.
Точно так же в эвтектоидной точке (0,76 % C) аустенитная фаза при охлаждении напрямую превращается в феррит и цементит без какого-либо двухфазного поля. Некоторым важным границам в однофазных полях даны специальные названия, облегчающие понимание диаграммы.
Основными фазами железа и стали в равновесии являются следующие фазы.
- Феррит или фаза альфа-железа — это стабильная форма железа при комнатной температуре. Это относительно мягкая низкотемпературная фаза и стабильная равновесная фаза. Он превращается в ГЦК-аустенит (гамма-фаза) при 910 °C. Феррит является обычным компонентом сталей и имеет ОЦК-структуру, которая менее плотно упакована, чем ГЦК-структура. Он мягкий и довольно пластичный. Он обладает магнитными свойствами при температуре ниже 768°C. Обладает низкой прочностью и хорошей ударной вязкостью.
- Фаза аустенита или гамма-железа. Аустенит представляет собой высокотемпературную фазу. Это твердый раствор C в FCC-железе. Следовательно, он имеет структуру FCC, которая представляет собой плотноупакованную структуру.
 Это немагнитная и пластичная фаза. Он превращается в дельта-феррит ОЦК при 1394 °C. Он нестабилен ниже температуры эвтектики (727 °C), если его не охладить быстро. Аустенит обладает хорошей прочностью и ударной вязкостью.
Это немагнитная и пластичная фаза. Он превращается в дельта-феррит ОЦК при 1394 °C. Он нестабилен ниже температуры эвтектики (727 °C), если его не охладить быстро. Аустенит обладает хорошей прочностью и ударной вязкостью. - Дельта-ферритная фаза – это твердый раствор C в ОЦК-железе. Он стабилен только при температуре выше 1394°С. Плавится при 1538°С. Обладает парамагнитными свойствами.
- Цементит – Fe3C или карбид железа. Это интерметаллическое соединение Fe и C. Он имеет сложную орторомбическую структуру и является метастабильной фазой. Это тяжелая, хрупкая фаза. Он имеет низкую прочность на растяжение, хорошую прочность на сжатие и низкую ударную вязкость. Он разлагается (очень медленно, в течение нескольких лет) на альфа-феррит и С (графит) в интервале температур от 650 до 700°С.
При сравнении аустенита с ферритом растворимость углерода больше в максимальное значение 2,14 % при 1148°С. Такая высокая растворимость углерода в аустените чрезвычайно важна при термообработке, когда обработка на твердый раствор в аустените с последующей быстрой закалкой до комнатной температуры позволяет образовать пересыщенный твердый раствор углерода в железе.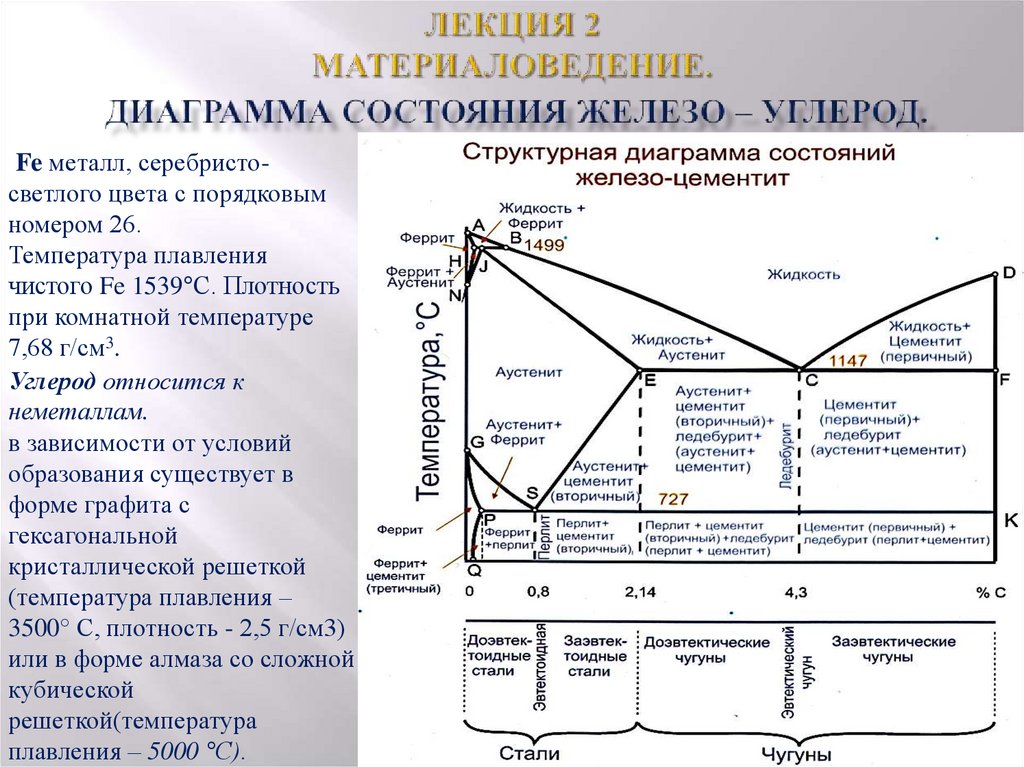 Ферритная фаза ограничена максимальной растворимостью углерода 0,025 % при 727°C. Поскольку диапазон содержания углерода в обычных сталях составляет от 0,05 % до 1,5 %, феррит обычно связан с цементитом в той или иной форме. Точно так же дельта-фаза очень ограничена и находится в диапазоне температур между 1394 град С и 1538 град С/ полностью исчезает, когда содержание углерода достигает 0,5 %.
Ферритная фаза ограничена максимальной растворимостью углерода 0,025 % при 727°C. Поскольку диапазон содержания углерода в обычных сталях составляет от 0,05 % до 1,5 %, феррит обычно связан с цементитом в той или иной форме. Точно так же дельта-фаза очень ограничена и находится в диапазоне температур между 1394 град С и 1538 град С/ полностью исчезает, когда содержание углерода достигает 0,5 %.
Сплав эвтектоидного состава (0,76% C) при медленном охлаждении образует перлит, представляющий собой слоистую структуру из двух фаз, а именно альфа-феррита и цементита. Перлит представляет собой смесь феррито-цементитной фазы. Он имеет характерный внешний вид и может рассматриваться как микроструктурная единица или микрокомпонент. Он представляет собой совокупность чередующихся пластинок феррита и цементита, которая после длительной выдержки ниже 727°С вырождается (сфероидизируется или укрупняется) в частицы цементита, диспергированные с ферритовой матрицей. Является эвтектоидом и имеет ОЦК-структуру.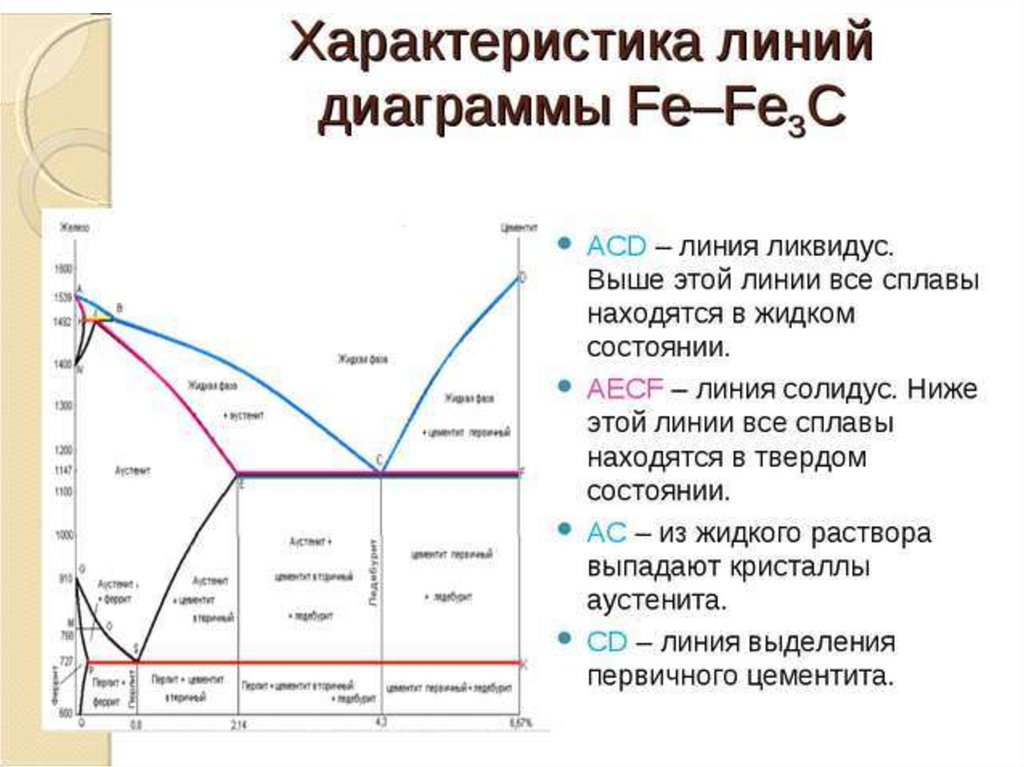 Это частично растворимый раствор Fe и C. Механически перлит имеет промежуточные свойства по сравнению с мягким, пластичным ферритом и твердым, хрупким цементитом. Обладает высокой прочностью и низкой вязкостью.
Это частично растворимый раствор Fe и C. Механически перлит имеет промежуточные свойства по сравнению с мягким, пластичным ферритом и твердым, хрупким цементитом. Обладает высокой прочностью и низкой вязкостью.
Гипоэвтектоидные сплавы содержат доэвтектоидный феррит (образованный при температуре выше эвтектоидной) вместе с эвтектоидным перлитом, который содержит эвтектоидный феррит и цементит. Заэвтектоидные сплавы содержат проэвтектоидный цементит (образуется выше температуры эвтектоида вместе с перлитом, содержащим эвтектоидный феррит и цементит). из этих микроструктур приведены ниже.
- Бейнит – фаза между перлитом и мартенситом. Это твердый метастабильный микрокомпонент, состоящий из непластинчатой смеси феррита и цементита в очень мелком масштабе. Верхний бейнит образуется при более высоких температурах и имеет перистый вид. Нижний бейнит образуется при более низких температурах и имеет игольчатый вид. Твердость бейнита увеличивается с понижением температуры его образования.
 Обладает хорошей прочностью и жесткостью.
Обладает хорошей прочностью и жесткостью. - Мартенсит – это очень твердая форма кристаллической структуры стали. Он назван в честь немецкого металлурга Адольфа Мартенса. Он образуется при быстром охлаждении, твердый и хрупкий. Это объемно-центрированная тетрагональная (BCT) форма железа, в которой растворено некоторое количество углерода. Он образуется во время закалки, когда гранецентрированная кубическая решетка аустенита искажается в объемноцентрированную тетрагональную структуру без потери содержащихся в ней атомов углерода на цементит и феррит. Это пересыщенный раствор атомов С в феррите. Это твердая метастабильная фаза. Он имеет решетчатую морфологию, когда С составляет менее 0,6 %, пластинчатую морфологию, когда С составляет более 1 %, и смесь промежуточных форм. Он имеет высокую прочность и твердость и низкую ударную вязкость.
- Сорбит/троостит – Структуры нижней перлитной стадии с очень мелкими чешуйками называются сорбитом и трооститом. Возрастающим скоростям охлаждения соответствуют структуры превращения перлитной стадии.
 Однако это меняет структурное соотношение и формирование перлита в зависимости от расстояния между чешуйками. Структура не видна под оптическим микроскопом.
Однако это меняет структурное соотношение и формирование перлита в зависимости от расстояния между чешуйками. Структура не видна под оптическим микроскопом. - Видманштеттеновый феррит – получается при быстром охлаждении доэвтектоидной простой углеродистой стали до температуры выше температуры A3. Из-за быстрого охлаждения у кристаллов феррита остается мало времени для зарождения не только на границе зерен, но и внутри крупных аустенитных зерен. Они быстро растут в некотором предпочтительном направлении кристалла внутри зерна и, таким образом, становятся удлиненными. Структура либо в виде игл (реек), либо в виде пластин, которые имеют тенденцию выстраиваться в одном направлении в пределах одного зерна.
На диаграмме железа-C есть много температур и критических точек, которые важны как с базовой, так и с практической точки зрения. Это температуры, когда при охлаждении или нагревании в них происходят как фазовые, так и магнитные превращения. Температуры, при которых происходят превращения в твердом состоянии, называются критическими температурами, или критическими точками.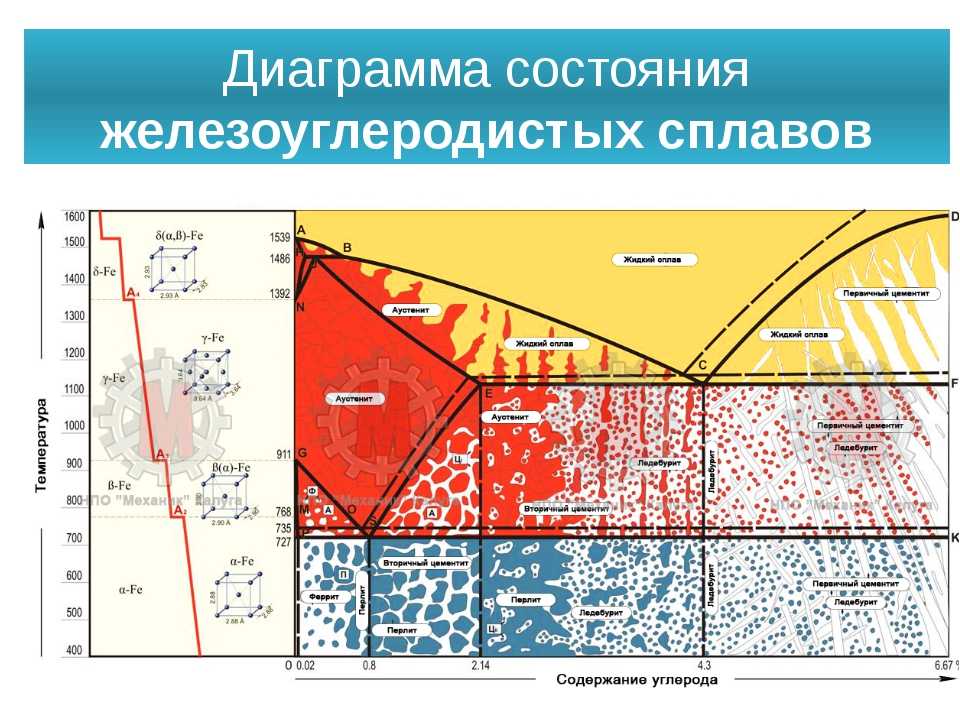 Основные температуры и критические точки приведены ниже.
Основные температуры и критические точки приведены ниже.
- Температура A0 – это температура Кюри, когда при нагревании происходит переход цементита из магнитного в немагнитный. В структуре могут образовываться дефекты, такие как дислокации, разломы и вакансии. Цементит является металлическим и ферромагнитным с температурой Кюри около 210 градусов C. При сплавлении металлические растворы замещают места железа; более мелкие атомы, такие как бор, заменяют углерод в междоузлиях.
- A1 температура – это температура (727 град С), при которой происходит эвтектоидное превращение. При этой температуре перлит превращается в аустенит при нагреве и наоборот
- Температура А2 – называется температурой Кюри феррита (768 град С), при которой ферромагнитный феррит при нагревании превращается в парамагнитный. При этой температуре микроструктура не меняется.
- A3 температура – это температура, при которой феррит только начинает формироваться из аустенита при охлаждении доэвтектоидной стали или последние следы свободного феррита превращаются в аустенит при нагревании.
 Таким образом, это температура, соответствующая границе раздела фаз гамма + альфа/гамма для доэвтектоидной стали, и она является функцией содержания углерода в стали, так как она уменьшается от 9от 10°С при 0 % С до 727°С при 0,76 % С. Ее также называют верхней критической температурой доэвтектоидных сталей. Температурный интервал между температурами А1 и А3 называется критическим диапазоном, в котором аустенит находится в равновесии с ферритом.
Таким образом, это температура, соответствующая границе раздела фаз гамма + альфа/гамма для доэвтектоидной стали, и она является функцией содержания углерода в стали, так как она уменьшается от 9от 10°С при 0 % С до 727°С при 0,76 % С. Ее также называют верхней критической температурой доэвтектоидных сталей. Температурный интервал между температурами А1 и А3 называется критическим диапазоном, в котором аустенит находится в равновесии с ферритом. - Температура Acm – это температура в заэвтектоидной стали, при которой доэвтектоидный цементит только начинает формироваться (при охлаждении) из аустенита. Он представляет собой температуру границы раздела фаз гамма/гамма + Fe3C и является функцией углерода. Линия Acm показывает, что растворимость углерода в твердом состоянии в аустените очень быстро снижается с максимума 2,14 % при 1148°C до максимума 0,76 % при 727°C из-за большей стабильности цементита при более низких температурах. Дополнительный углерод выделяется из аустенита в виде доэвтектоидного цементита в заэвтектоидных сталях (также называемого вторичным цементитом в чугунах).
 Отделение цементита от аустенита (при охлаждении) также сопровождается выделением тепла.
Отделение цементита от аустенита (при охлаждении) также сопровождается выделением тепла. - Температура A4 – это температура, при которой аустенит превращается в дельта-железо. Самое низкое значение этой температуры составляет 1394°С, что соответствует чистому железу. Эта температура увеличивается по мере увеличения процентного содержания углерода.
- Температура Ms – это температура, при которой начинается превращение аустенита в мартенсит при охлаждении.
- Температура Mf – это температура, при которой заканчивается образование мартенсита при охлаждении. Все изменения, кроме образования мартенсита, происходят при более низких температурах при охлаждении, чем при нагреве, и зависят от скорости изменения температуры.
Превращение аустенита в феррит – В равновесных условиях в железоуглеродистых сплавах, содержащих до 0,76 % углерода, образуется доэвтектоидный феррит. Реакция протекает при 910°С в чистом железе, а между 910°С и 727°С в сплавах железа с углеродом.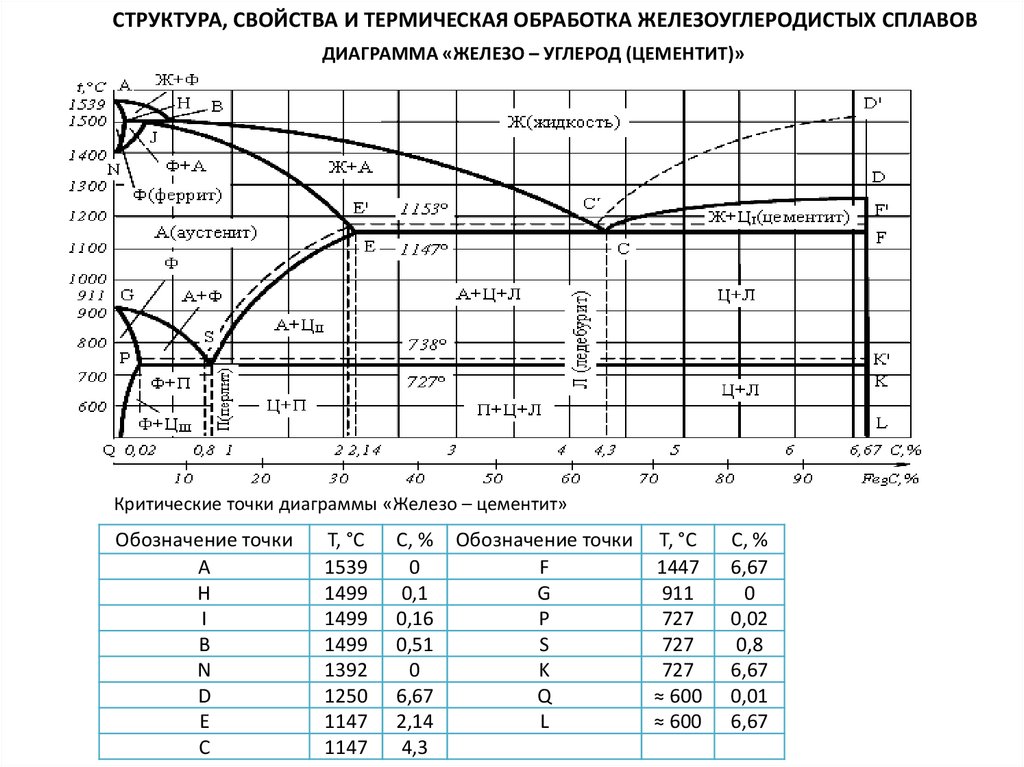 Однако при закалке из аустенитного состояния до температур ниже эвтектоидной температуры феррит может образовываться вплоть до температур 600°С. При понижении температуры превращения наблюдаются выраженные морфологические изменения, которые обычно относятся к доэвтектоидным формам. и заэвтектоидные фазы, хотя в каждом случае существуют вариации из-за точной кристаллографии вовлеченных фаз. Например, те же принципы применимы к образованию цементита из аустенита, но морфологически отличить феррит от цементита нетрудно.
Однако при закалке из аустенитного состояния до температур ниже эвтектоидной температуры феррит может образовываться вплоть до температур 600°С. При понижении температуры превращения наблюдаются выраженные морфологические изменения, которые обычно относятся к доэвтектоидным формам. и заэвтектоидные фазы, хотя в каждом случае существуют вариации из-за точной кристаллографии вовлеченных фаз. Например, те же принципы применимы к образованию цементита из аустенита, но морфологически отличить феррит от цементита нетрудно.
Превращение аустенита в цементит – Существуют различные морфологии цементита, которые образуются при постепенно более низких температурах превращения. Начальное развитие аллотриоморфов границ зерен очень похоже на развитие феррита, и рост боковых пластин или видманштеттовского цементита происходит по той же схеме. Аллотриоморф имеет форму, не отражающую его внутреннюю кристаллическую симметрию. Это связано с тем, что он имеет тенденцию образовываться на поверхности аустенитных зерен, образуя таким образом слои, которые повторяют контуры границ зерен. Пластинки цементита имеют более строго кристаллографическую форму, несмотря на то, что ориентационная связь с аустенитом более сложная. Как и в случае с ферритом, большинство боковых пластин происходит из аллотриоморфов границ зерен, но в реакции цементита больше боковых пластин зарождается на границах двойников в аустените.
Пластинки цементита имеют более строго кристаллографическую форму, несмотря на то, что ориентационная связь с аустенитом более сложная. Как и в случае с ферритом, большинство боковых пластин происходит из аллотриоморфов границ зерен, но в реакции цементита больше боковых пластин зарождается на границах двойников в аустените.
Реакция аустенита и перлита – Перлит является наиболее известной микроструктурой на фазовой диаграмме железо-углерод. Он был обнаружен Сорби более века назад, который правильно предположил, что это пластинчатая смесь железа и карбида железа. Это очень распространенный компонент самых разных сталей, где он вносит существенный вклад в прочность. Пластинчатые эвтектоидные структуры такого типа широко распространены в металлургии сталей. Эти структуры имеют много общего с реакциями клеточной преципитации. Оба типа реакций происходят путем зародышеобразования и роста и, следовательно, контролируются диффузией. Зародыши перлита встречаются на границах аустенитных зерен, но ясно, что они также могут быть связаны как с доэвтектоидным ферритом, так и с цементитом.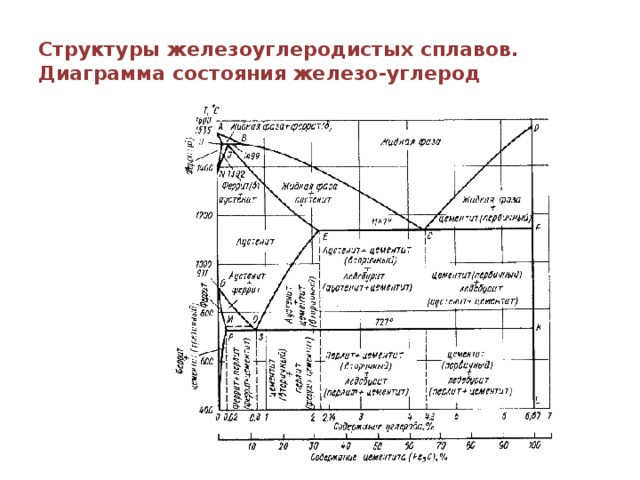


 — 544 с.
— 544 с.
 КРИСТАЛЛИЗАЦИЯ
КРИСТАЛЛИЗАЦИЯ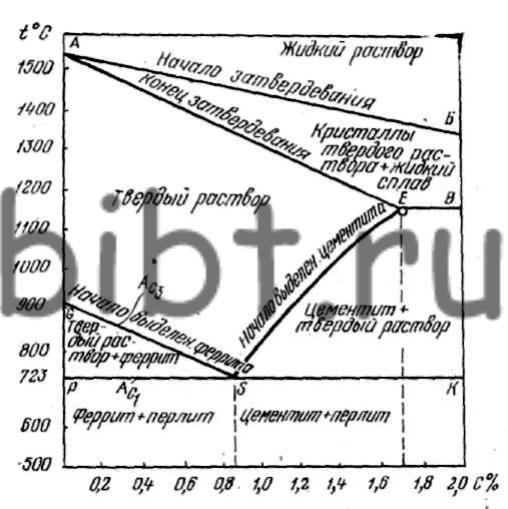 ДИАГРАММА СОСТОЯНИЯ
ДИАГРАММА СОСТОЯНИЯ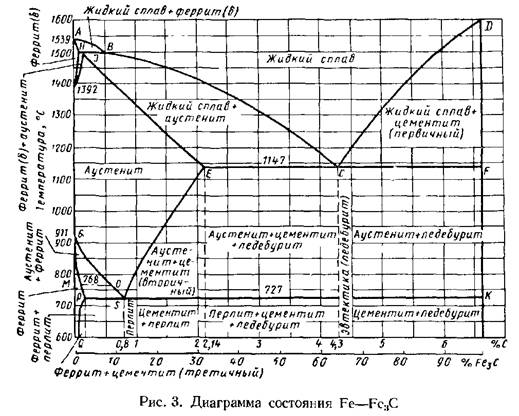 Влияние углерода на свойства стали
Влияние углерода на свойства стали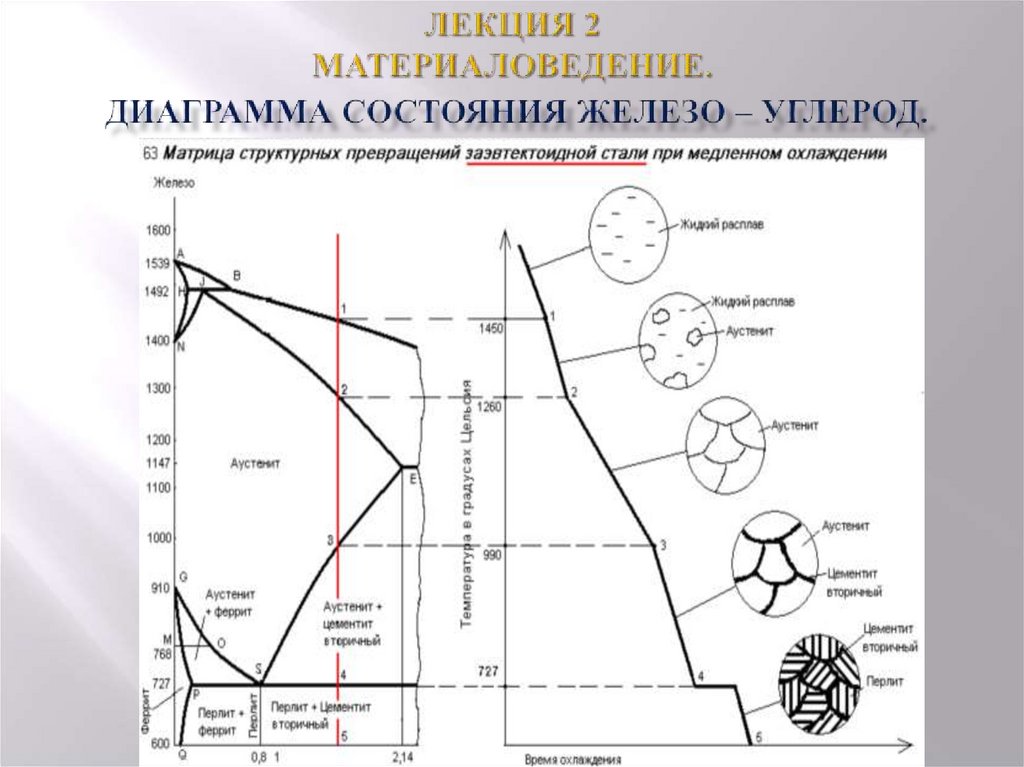 Термомеханическая обработка
Термомеханическая обработка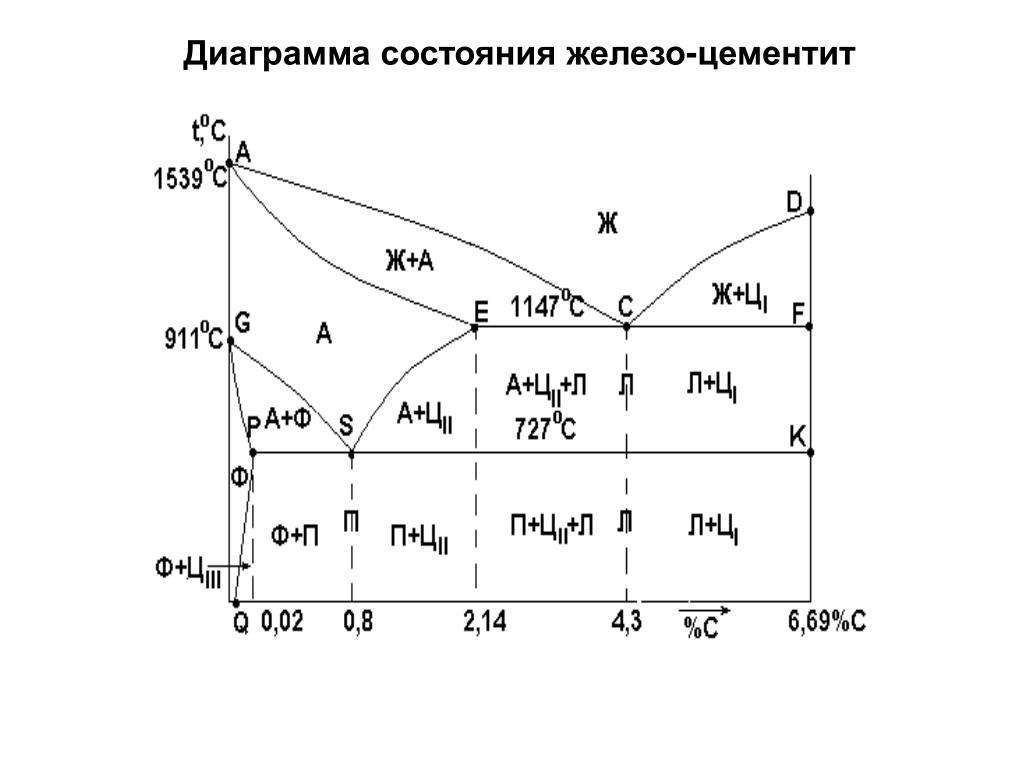 КОНСТРУКЦИОННЫЕ СТАЛИ
КОНСТРУКЦИОННЫЕ СТАЛИ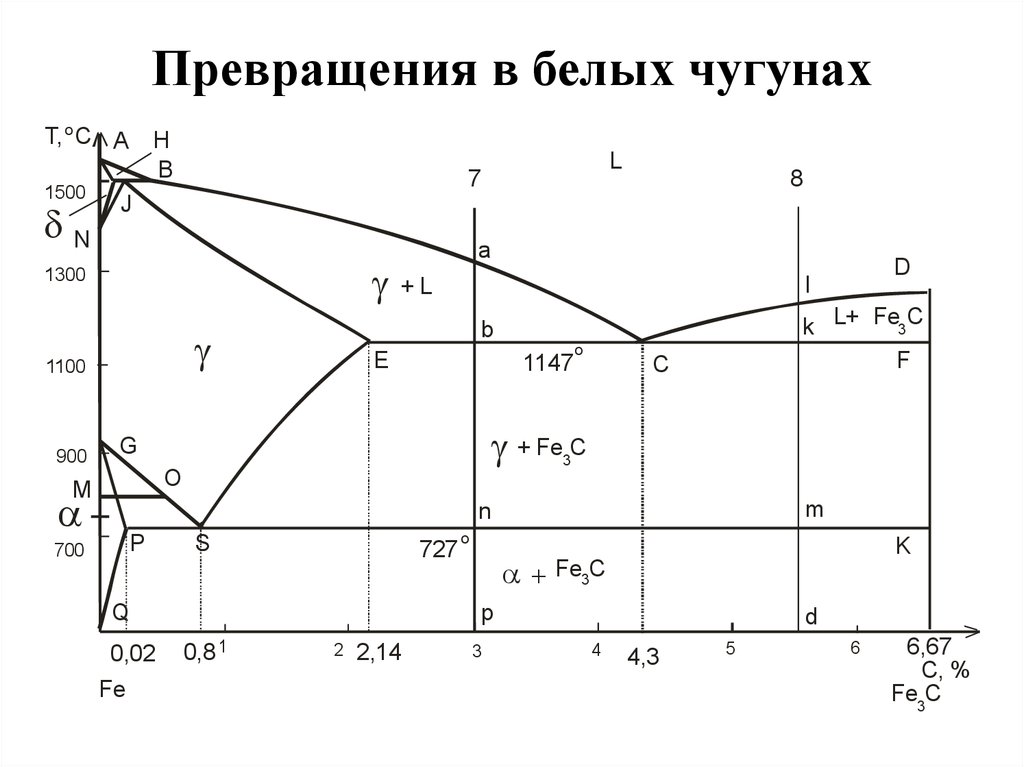 Никелевые и кобальтовые жаропрочные сплавы
Никелевые и кобальтовые жаропрочные сплавы Стали и сплавы для постоянных магнитов (магнитнотвердые сплавы)
Стали и сплавы для постоянных магнитов (магнитнотвердые сплавы)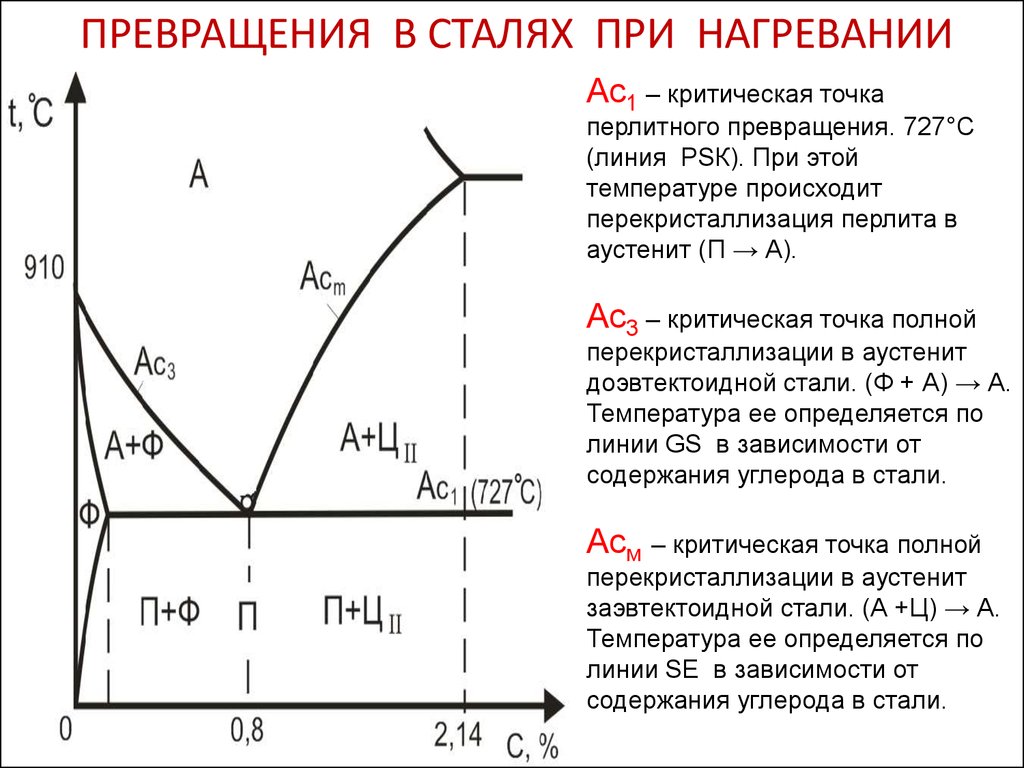 МЕДЬ И ЕЕ СПЛАВЫ
МЕДЬ И ЕЕ СПЛАВЫ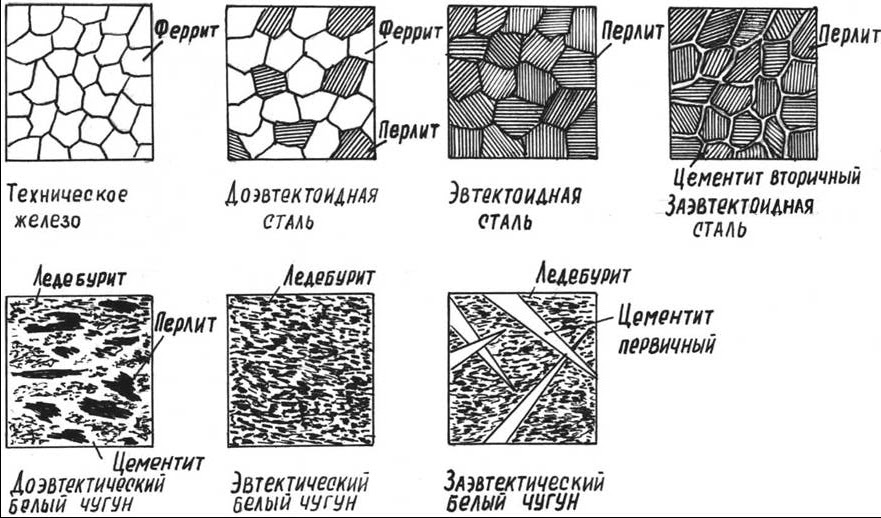 д., для улучшения химических, физических и механических свойств этих новых сплавов.
д., для улучшения химических, физических и механических свойств этих новых сплавов.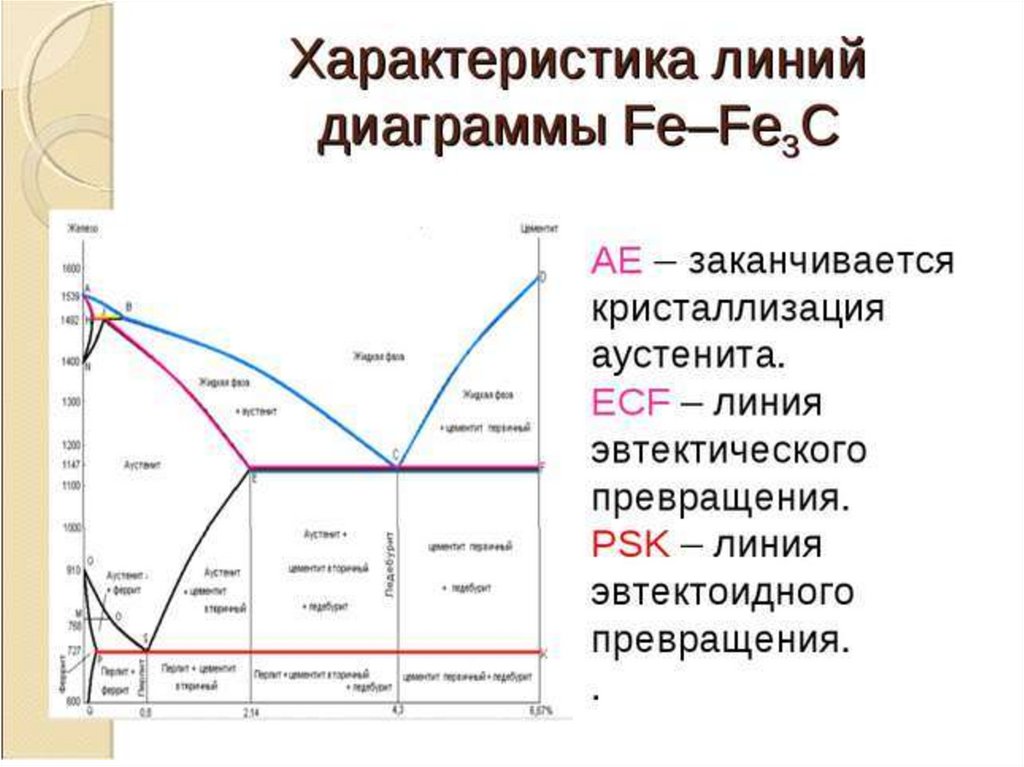 Это немагнитная и пластичная фаза. Он превращается в дельта-феррит ОЦК при 1394 °C. Он нестабилен ниже температуры эвтектики (727 °C), если его не охладить быстро. Аустенит обладает хорошей прочностью и ударной вязкостью.
Это немагнитная и пластичная фаза. Он превращается в дельта-феррит ОЦК при 1394 °C. Он нестабилен ниже температуры эвтектики (727 °C), если его не охладить быстро. Аустенит обладает хорошей прочностью и ударной вязкостью.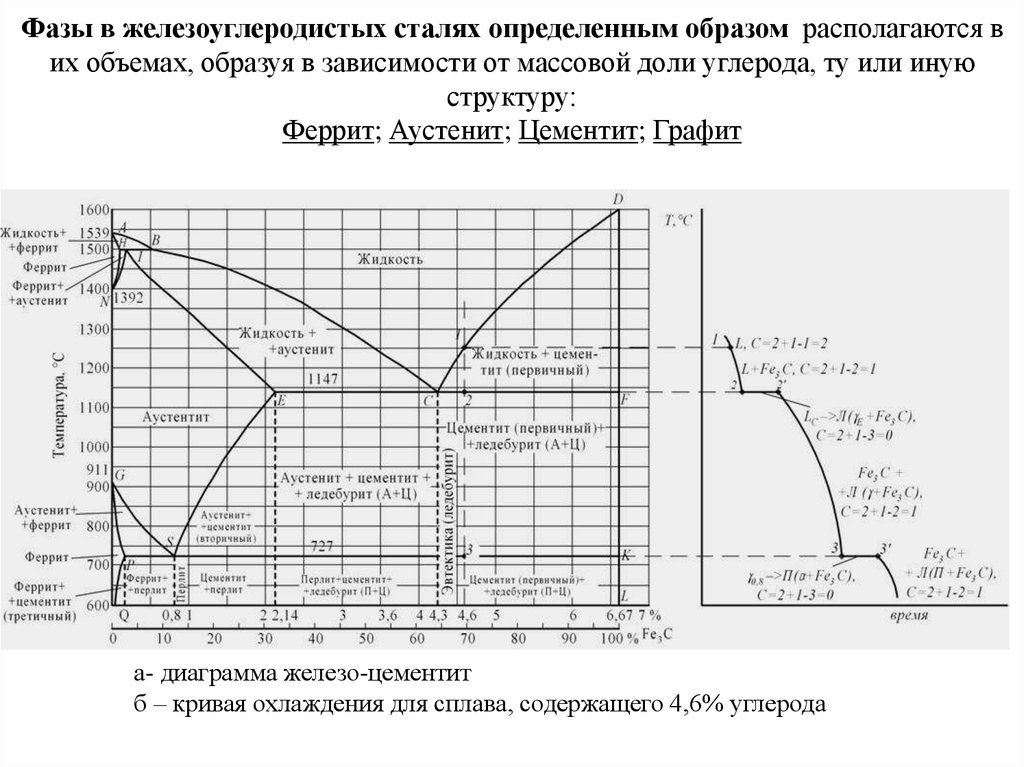 Обладает хорошей прочностью и жесткостью.
Обладает хорошей прочностью и жесткостью.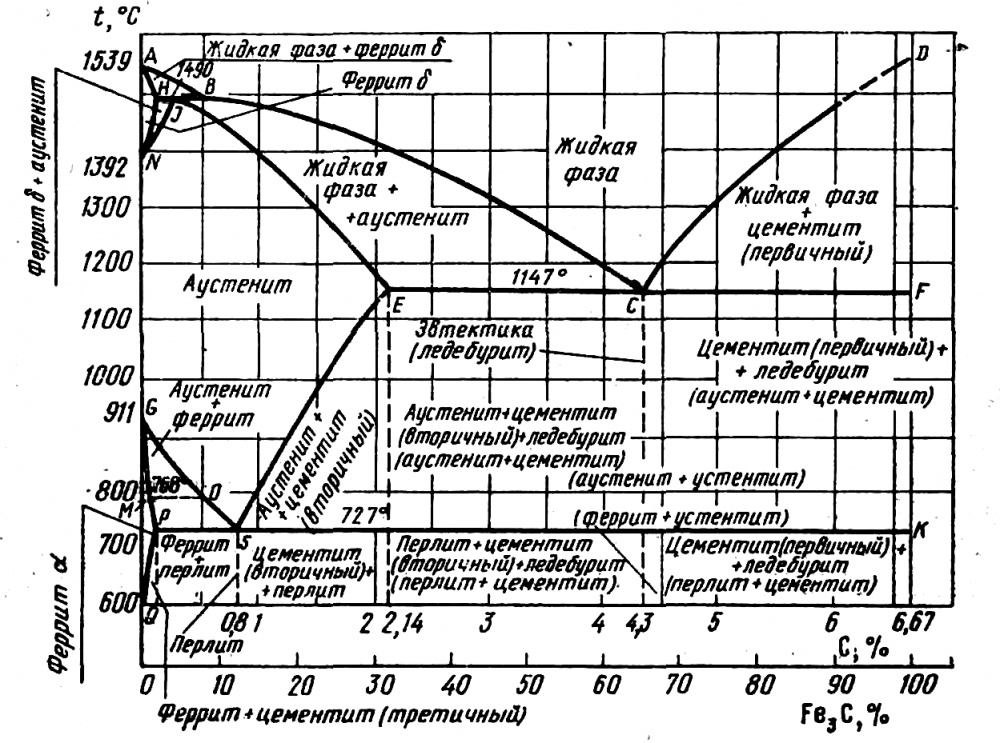 Однако это меняет структурное соотношение и формирование перлита в зависимости от расстояния между чешуйками. Структура не видна под оптическим микроскопом.
Однако это меняет структурное соотношение и формирование перлита в зависимости от расстояния между чешуйками. Структура не видна под оптическим микроскопом. Таким образом, это температура, соответствующая границе раздела фаз гамма + альфа/гамма для доэвтектоидной стали, и она является функцией содержания углерода в стали, так как она уменьшается от 9от 10°С при 0 % С до 727°С при 0,76 % С. Ее также называют верхней критической температурой доэвтектоидных сталей. Температурный интервал между температурами А1 и А3 называется критическим диапазоном, в котором аустенит находится в равновесии с ферритом.
Таким образом, это температура, соответствующая границе раздела фаз гамма + альфа/гамма для доэвтектоидной стали, и она является функцией содержания углерода в стали, так как она уменьшается от 9от 10°С при 0 % С до 727°С при 0,76 % С. Ее также называют верхней критической температурой доэвтектоидных сталей. Температурный интервал между температурами А1 и А3 называется критическим диапазоном, в котором аустенит находится в равновесии с ферритом.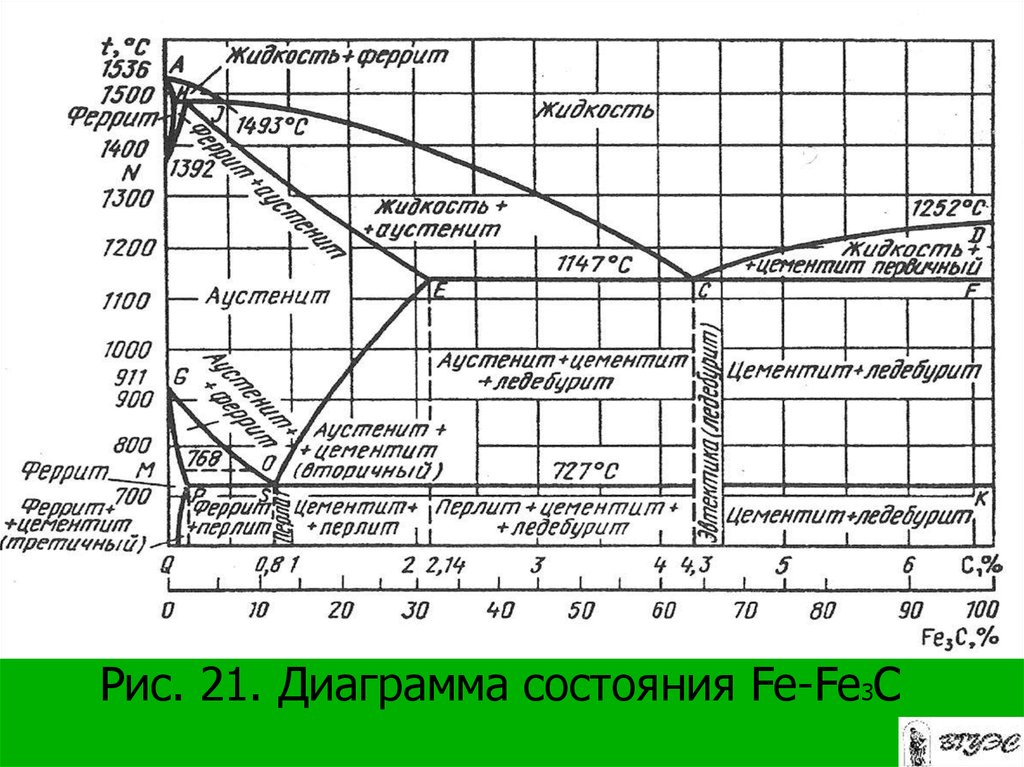 Отделение цементита от аустенита (при охлаждении) также сопровождается выделением тепла.
Отделение цементита от аустенита (при охлаждении) также сопровождается выделением тепла.