Содержание
Кристаллическая решетка — что это? Типы и свойства
Поможем понять и полюбить химию
Начать учиться
У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Важно!
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.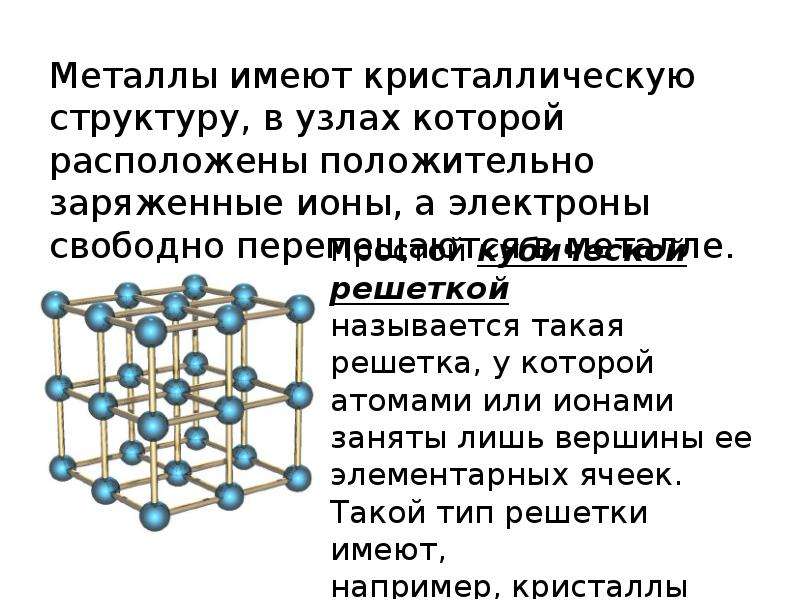
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
прочность,
твердость,
неспособность к растворению в воде,
высокая температура кипения и плавления.

К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Лайфхак
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
небольшая твердость;
низкая прочность;
легкоплавкость;
летучесть;
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие.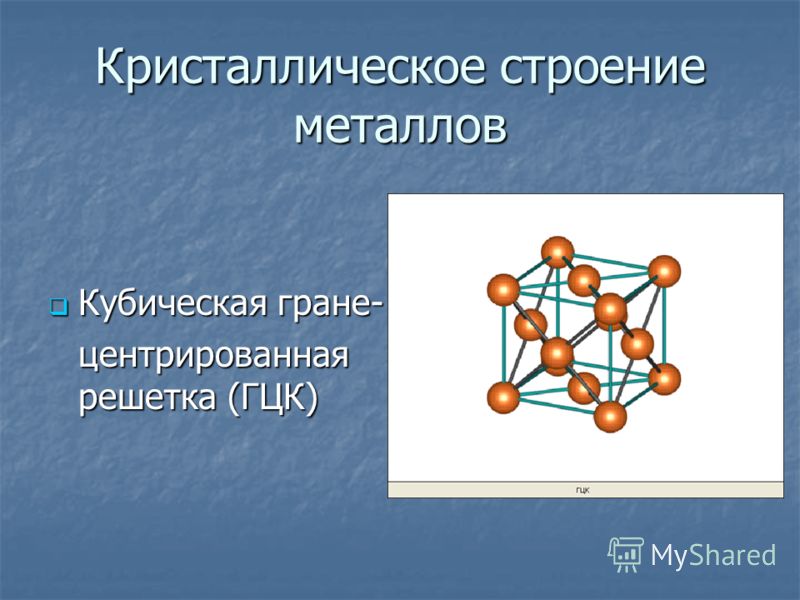 Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.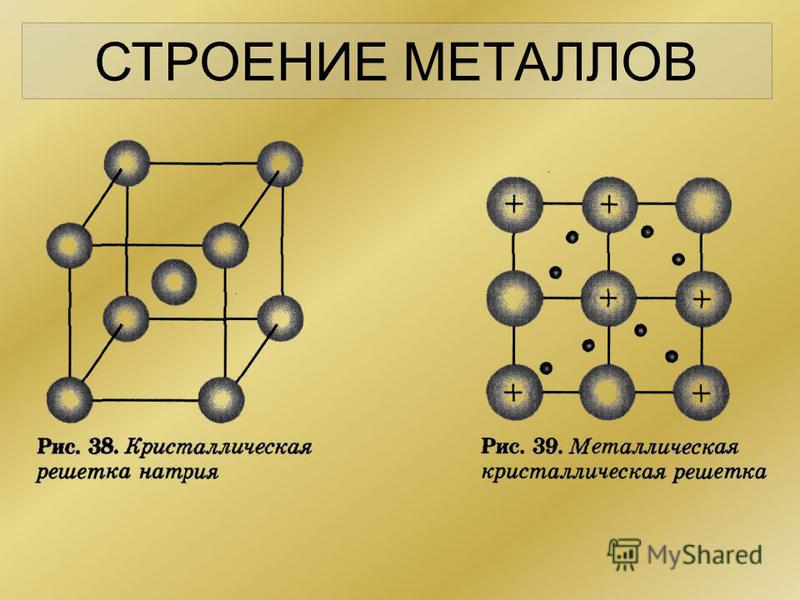
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Тип решетки | Частицы в узлах решетки | Тип связи между частицами | Примеры веществ | Физические свойства веществ |
|---|---|---|---|---|
| Атомная | Атомы | Ковалентная связь | Твердые неметаллы: графит, кремний, бор, германий и другие. | При обычных условиях прочные и твердые, тугоплавкие, нерастворимые в воде, нелетучие. |
| Молекулярная | Молекулы | Силы притяжения между молекулами | Вещества, образующие маленькие молекулы (CO2, Cl2, H2O), благородные газы, органические вещества. | При обычные условиях — газы или жидкости. Легкоплавкие, летучие, некоторые способны к возгонке. |
| Ионная | Ионы | Ионная связь | Соли, большая часть органических соединений, оксиды, щелочи. | Твердые, тугоплавкие, хрупкие, нелетучие, растворимы в воде, способны проводить электроток. |
| Металлическая | Атомы и ионы | Металлическая связь | Все металлы и сплавы. | Твердые (кроме ртути), ковкие, имеют блеск, отличаются теплопроводностью, электропроводностью. |
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.

Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.
Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.

Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
Какое строение вещества придает ему высокую электропроводность?
Какое строение кристалла может придать веществу способность к возгонке?
Яна Кононенко
К предыдущей статье
218.3K
Химическая связь
К следующей статье
Массовая доля
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
1.
 Кристаллическое строение металлов. Типы кристаллических решеток металлов
Кристаллическое строение металлов. Типы кристаллических решеток металлов
Лекция. Строение
и свойство металлов
Вопросы
1. Кристаллическое
строение металлов. Типы кристаллических
решеток металлов
2. Анизотропия.
Аллотропия (полиморфизм)
3. Аллотропические
видоизменения железа
4. Кристаллизация
металлов
5. Реальное
строение металлических кристаллов
6. Методы
исследования строения металлов
Твердые
вещества по взаимному расположению
атомов делят на аморфные и кристаллические.
Аморфными
называют
твердые вещества, атомы которых
располагаются в пространстве хаотично.
При нагревании они размягчаются и
переходят в жидкое состояние в широком
интервале температур и на кривой нагрева
(на штриховой на рис.1) не выражен этот
переход. К таким веществам относят
К таким веществам относят
стекло, смолу, канифоль, клей и др.
Кристаллическими
называют
твердые вещества, в которых атомы
расположены в пространстве в строго
определенном порядке. Эти вещества
при нагреве остаются в твердом состоянии
и переходят в жидкое при определенной
температуре (рис.1, сплошная линия).
Рис.1
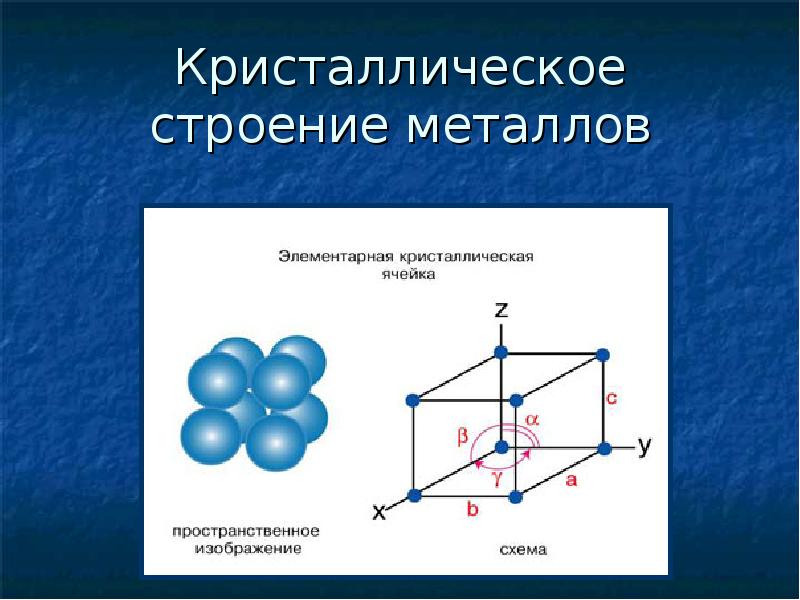
Все металлы являются
кристаллическими веществами. Для
описания кристаллической структуры
металлов пользуются понятием
кристаллической
решетки. Кристаллическая
решетка
— это воображаемая пространственная
сетка, в узлах которой расположены
атомы. Наименьшая часть кристаллической
решетки, определяющая структуру металла,
называется элементарной
кристаллической ячейкой.
Элементарная
ячейка повторяется во всех трех измерениях
и полностью характеризует структуру
кристалла. На рис. 2 изображены элементарные
ячейки для наиболее распространенных
кристаллических решеток, которые имеют
металлы:
Рис. 2.Пространственные
2.Пространственные
кристаллические решетки:
а) кубическая
объемно-центрированная; б) кубическая
гранецентрированная: в) гексагональная
плотноупакованная.
На
рис.2,а приведена схема элементарной
ячейки кубической объемно-центрированной
решетки; она ограничивается девятью
атомами, восемь из которых расположены
по вершинам куба, а девятый – в его
центре. Повторением этой ячейки путем
переносов образуется вся структура
кристалла.
Элементарная
ячейка кубической гранецентрированной
решетки (рис. 2, б)
ограничивается
14 атомами: восемь из них расположены по
вершинам куба, шесть — по его граням..
На
рис. 2,в приведена схема элементарной
ячейки гексагональной решетки. Она
ограничена 17 атомами, из которых 12
расположены по вершинам шестигранной
призмы, два атома — в центре оснований
и три -внутри призмы.
В
отдельно взятом кристалле свойства
различны в разных направлениях.
Если
взять большой кристалл
(
существуют методы выращивания крупных
кристаллов), вырезать из него несколько
одинаковых по размеру, но различно
ориентированных образцов и испытать
их свойства, можно иногда
наблюдать значительную разницу в
свойствах отдельных образцов. Например,
Например,
при испытании различных образцов из
кристалла меди относительное удлинение
изменяется от 10 до 55 %, а предел прочности
-от 140 до 350 МПа. Это свойство кристаллов
называют
анизотропностью.
Анизотропность
кристаллов определяется характером
расположения атомов в кристаллической
решетке.
Аморфные
тела изотропны,
т.
е. все их свойства одинаковы во всех
направлениях; излом аморфного тела
всегда имеет неправильную, искривленную,
так называемую раковистую форму.
Металлы,
затвердевшие в обычных условиях, состоят
из множества кристаллов, кристаллическая
решетка которых по-разному ориентирована,
поэтому свойства литого металла
приблизительно одинаковы по всем
направлениям; это называют квазиизотропностью.
Аллотропия
металлов.
Аллотропия металлов (или полиморфизм)-свойство
перестраивать решетку при определенных
температурах в процессе нагрева и
охлаждения — присуща многим металлам
(железу, марганцу, никелю, олову, титану,
ванадию и др. ). Каждое аллотропическое
). Каждое аллотропическое
превращение происходит при определенной
температуре (например, одно из
превращений железа происходит при
температуре 911о
С, ниже которой! атомы составляют решетку
центрированного куба, а выше — решетку
гранецентрированного куба).
Структура,
имеющая ту или иную решетку, называется
аллотропической
формой
или
модификацией.
Различные
модификации обозначают греческими
буквами α, β, γ и т. д., причем буквой α
обозначают модификацию, существующую
при температурах ниже первого
аллотропического превращения.
Аллотропические превращения
сопровождаются отдачей (уменьшением)
или поглощением (увеличением) энергии.
Кристалл | Определение, типы, структура и факты
кристалл
Просмотреть все средства массовой информации
- Ключевые люди:
- Николаус Стено
Ральф Уолтер Грейстоун Вайкофф
Макс фон Лауэ
Жорж Фридель
Торберн Улоф Бергман
- Похожие темы:
- жидкокристаллический
плеохроизм
двойное преломление
симметрия
полиморфизм
Просмотреть весь связанный контент →
Узнайте, как форма кристаллов определяет различные минералы в семейства
Просмотреть все видео к этой статье
кристалл , любой твердый материал, в котором атомы компонентов расположены в определенном порядке и чья поверхность регулярность отражает его внутреннюю симметрию.
Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако после проверки определение становится менее простым. Кусочек сливочного масла, например, после хранения в холодильнике становится твердым и явно твердым. Пролежав сутки на кухонном столе, тот же кубик становится довольно мягким, и неясно, следует ли по-прежнему считать масло твердым. Многие кристаллы ведут себя как масло в том смысле, что они тверды при низких температурах, но мягки при более высоких температурах. Они называются твердыми при всех температурах ниже их точки плавления. Возможное определение твердого тела — это объект, который сохраняет свою форму, если его не трогать. Актуальным вопросом является то, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет свою форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы измерения твердых тел
Основными единицами твердых тел являются либо атомы, либо атомы, объединившиеся в молекулы.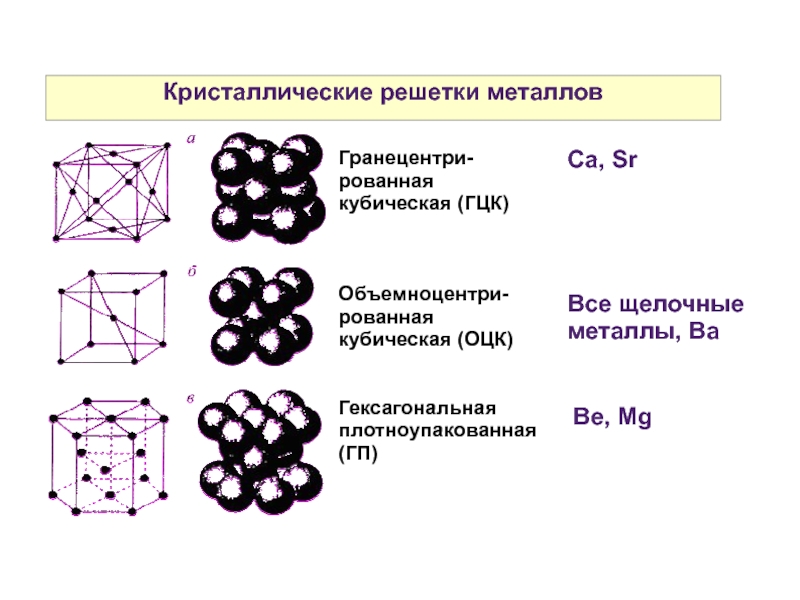 Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Все занятые оболочки атома аргона (Ar), например, заполнены, что приводит к сферической форме атома. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена лишь частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо является магнитом. Ковалентная связь между двумя атомами углерода (C) является самой прочной связью в природе. Эта сильная связь делает алмаз самым твердым телом.
Эта сильная связь делает алмаз самым твердым телом.
Твердое тело называется кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, место каждого атома точно известно во всем кристалле. У большинства жидкостей отсутствует дальний порядок, хотя у многих есть ближний порядок. Ближний радиус определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях первые соседние атомы расположены так же, как и в соответствующей твердой фазе. Однако на расстояниях, которые составляют много атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти специальные вещества называются жидкими кристаллами. Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые тела, имеющие ближний порядок, но не имеющие дальнего порядка, называются аморфными. Почти любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние). Это условие нестабильно, и твердое тело со временем кристаллизуется. Если время кристаллизации исчисляется годами, то аморфное состояние кажется стабильным. Стекла являются примером аморфных твердых тел. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) существует тот же ближний порядок, но направления связей изменяются на более удаленных от любого атома расстояниях. Аморфный кремний — это разновидность стекла. Квазикристаллы — еще один тип твердых тел, в которых отсутствует дальний порядок.
Почти любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние). Это условие нестабильно, и твердое тело со временем кристаллизуется. Если время кристаллизации исчисляется годами, то аморфное состояние кажется стабильным. Стекла являются примером аморфных твердых тел. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) существует тот же ближний порядок, но направления связей изменяются на более удаленных от любого атома расстояниях. Аморфный кремний — это разновидность стекла. Квазикристаллы — еще один тип твердых тел, в которых отсутствует дальний порядок.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Большинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла. На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, тогда как поликристаллические металлы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, тогда как поликристаллические металлы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и твердые молекулярные вещества. Монокристалл изолятора обычно прозрачен и напоминает кусок стекла.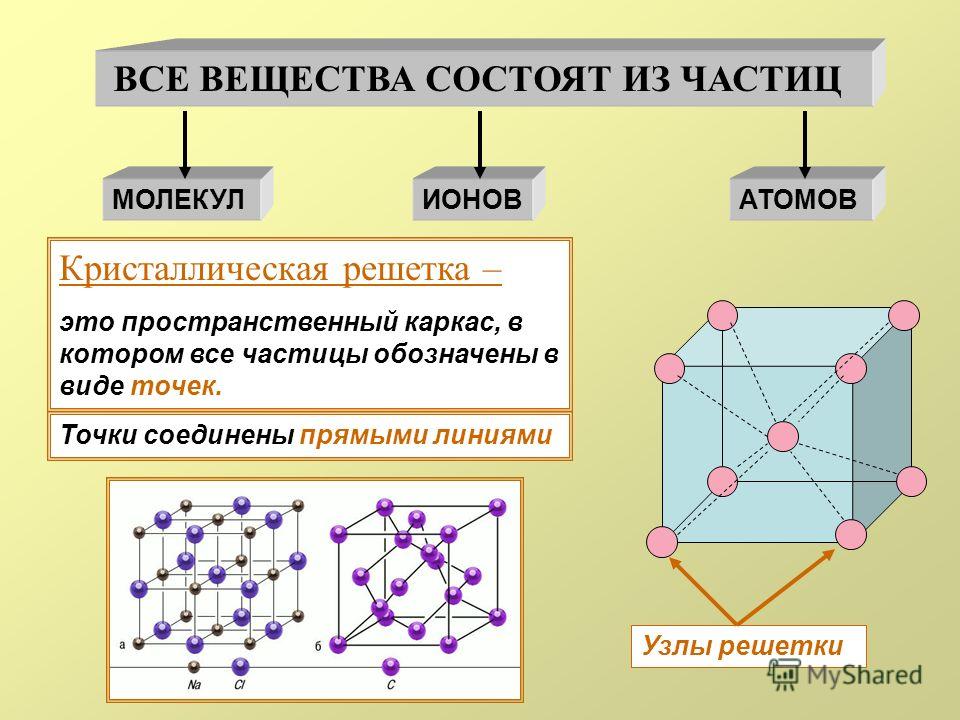 Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно.
Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно.
Единая картина кристаллических структур металлов
- Опубликовано:
- Пер Седерлинд 1 ,
- Олле Эрикссон 1 ,
- Берье Йоханссон 1 ,
- Дж. М. Уиллс 2 и
- …
- А. М. Сверление 2
Природа
том 374 , страницы 524–525 (1995)Цитировать эту статью
1134 доступа
185 цитирований
Детали показателей
Abstract
Кристаллические структуры легких актинидов интригуют физиков и химиков уже несколько десятилетий 1 . Простые металлы и переходные металлы имеют плотноупакованные высокосимметричные структуры, такие как объемно-центрированная кубическая, гранецентрированная кубическая и гексагональная плотная упаковка. Напротив, структуры легких актинидов очень рыхло упакованы и имеют низкую симметрию — тетрагональную, орторомбическую и моноклинную. Чтобы понять эти различия, мы выполнили расчеты полной энергии в зависимости от объема как для высоко-, так и для низкосимметричных структур простого металла (алюминия), немагнитного переходного металла (ниобия), ферромагнитного переходного металла. (железо) и легкий актинид (уран). Мы находим, что кристаллическая структура всех этих металлов определяется балансом между электростатическими (маделунговскими) взаимодействиями, способствующими высокой симметрии, и пайерлсовским искажением кристаллической решетки, способствующим низкой симметрии. Мы показываем, что простые металлы и переходные металлы могут принимать структуры с низкой симметрией при расширении решетки; и мы предсказываем, что, наоборот, легкие актиниды будут претерпевать переходы в структуры более высокой симметрии при сжатии.
Простые металлы и переходные металлы имеют плотноупакованные высокосимметричные структуры, такие как объемно-центрированная кубическая, гранецентрированная кубическая и гексагональная плотная упаковка. Напротив, структуры легких актинидов очень рыхло упакованы и имеют низкую симметрию — тетрагональную, орторомбическую и моноклинную. Чтобы понять эти различия, мы выполнили расчеты полной энергии в зависимости от объема как для высоко-, так и для низкосимметричных структур простого металла (алюминия), немагнитного переходного металла (ниобия), ферромагнитного переходного металла. (железо) и легкий актинид (уран). Мы находим, что кристаллическая структура всех этих металлов определяется балансом между электростатическими (маделунговскими) взаимодействиями, способствующими высокой симметрии, и пайерлсовским искажением кристаллической решетки, способствующим низкой симметрии. Мы показываем, что простые металлы и переходные металлы могут принимать структуры с низкой симметрией при расширении решетки; и мы предсказываем, что, наоборот, легкие актиниды будут претерпевать переходы в структуры более высокой симметрии при сжатии.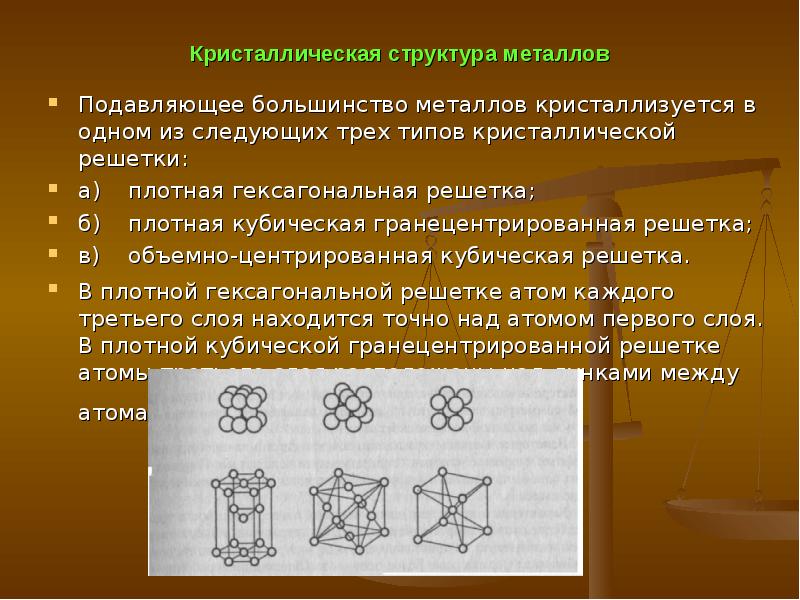
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Соответствующие статьи
Статьи открытого доступа со ссылками на эту статью.
Ускоренное предсказание кристаллической структуры случайного сплава из нескольких элементов с использованием расширяемых функций
- Тэвон Джин
- , Ина Пак
- … Джи Хун Шим
Научные отчеты
Открытый доступ
04 марта 2021 г.
Варианты доступа
Подписаться на этот журнал
Получите 51 печатный выпуск и доступ в Интернете
199,00 € в год
всего 3,90 € за выпуск
Узнайте больше
Арендуйте или купите эту статью
Получите только эту статью столько, сколько вам нужно
$39,95
Подробнее
Цены могут облагаться местными налогами, которые рассчитываются при оформлении заказа
Ссылки
Katz, J.
 J., Seaborg, G. T. & Morss, L. R. (eds) 90 127 Химия актинидных элементов Vols 1 и 2 (Chapman & Hall, Нью-Йорк, 1986).
J., Seaborg, G. T. & Morss, L. R. (eds) 90 127 Химия актинидных элементов Vols 1 и 2 (Chapman & Hall, Нью-Йорк, 1986).Harrison, WA Псевдопотенциалы в теории металлов (Benjamin/Cummings, Menlo Park, California, 1966).
Google Scholar
Friedel, J. in The Physics of Metals (изд. Ziman, JM) Ch. 8 (Cambridge Univ. Press, Нью-Йорк, 1969).
Google Scholar
Skriver, H. L. Phys. Ред. B 31 , 1909–1923 (1985).
Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Duthie, J.C. & Pettifor, D.G. Phys. Преподобный Летт. 38 , 564–567 (1977).
Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Pettifor, D.
 G. J. chem. физ. 69 , 2930–2931 (1978).
G. J. chem. физ. 69 , 2930–2931 (1978).Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Johansson, B. & Rosengren, A. Phys. Ред. B 11 , 2836–2857 (1975).
Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Skriver, H.L., Johansson, B. & Andersen, O.K. Phys. Преподобный Летт. 41 , 42–45 (1978).
Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Skriver, H.L., Johansson, B. & Andersen, O.K. Phys. Преподобный Летт. 44 , 1230–1233 (1980).
Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Моруцци, В. Л. и Маркус, П. М. Phys. Ред. B 38 , 1613–1620 (1988).
Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Brooks, M.
 S.S. & Johansson, B. J. Phys. F 13 , L197–202 (1983).
S.S. & Johansson, B. J. Phys. F 13 , L197–202 (1983).Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Wills, J. M. & Cooper, B. R. Phys. Rev. B 36 , 3809–3823 (1987).
Артикул
ОБЪЯВЛЕНИЯ
КАСGoogle Scholar
Harrison, W. A. Электронная структура и свойства твердых тел (Фриман, Сан-Франциско, 1980 г.).
Google Scholar
Ссылки для скачивания
Информация об авторе
Авторы и организации
Группа теории конденсированных сред, Факультет физики, Упсальский университет, PO Box 530, S-751 21, Up псала, Швеция
Per Söderlind, Olle Eriksson & Börje Johansson
Центр материаловедения и теоретического отдела, Лос-Аламосская национальная лаборатория, Лос-Аламос, Нью-Мексико, 87545, США
J.
 M. Wills & A.M. Boring
M. Wills & A.M. Boring
Авторы
- Per Söderlind
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Olle Eriksson
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Börje Johansson
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - J. M. Wills
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - A. M. Boring
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Исследование методом функционала плотности адсорбции h3O на поверхности γ-U(110)
- С-Л Чжу
- Y-X Ян
- Д Ли
Индийский журнал физики (2023)
Ускоренное предсказание кристаллической структуры случайного сплава из нескольких элементов с использованием расширяемых функций
- Тэвон Джин
- Ина Парк
- Джи Хун Шим
Научные отчеты (2021)
Исследование методом функционала плотности адсорбции молекулы h3O на поверхности α-U(001)
- Шанцисон Хуан
- Сю-Линь Цзэн
- Сюэхай Цзюй
Журнал молекулярного моделирования (2016)
Сайт-селективная электронная корреляция в металлическом α-плутонии
- Цзянь-Синь Чжу
- Р.






 J., Seaborg, G. T. & Morss, L. R. (eds) 90 127 Химия актинидных элементов Vols 1 и 2 (Chapman & Hall, Нью-Йорк, 1986).
J., Seaborg, G. T. & Morss, L. R. (eds) 90 127 Химия актинидных элементов Vols 1 и 2 (Chapman & Hall, Нью-Йорк, 1986). G. J. chem. физ. 69 , 2930–2931 (1978).
G. J. chem. физ. 69 , 2930–2931 (1978). S.S. & Johansson, B. J. Phys. F 13 , L197–202 (1983).
S.S. & Johansson, B. J. Phys. F 13 , L197–202 (1983). M. Wills & A.M. Boring
M. Wills & A.M. Boring
