Содержание
Крестовая муфта — Большая Энциклопедия Нефти и Газа, статья, страница 2
Cтраница 2
Кулачковые крестовые муфты на кранах применяют редко и лишь на тихоходных валах механизмов поворота и передвижения. Допустимые этой муфтой радиальные смещения и перекосы в 2 — 4 раза меньше втулочно-пальцевых.
[16]
Кулачковые крестовые муфты на кранах применяют редко и лишь на тихоходных валах механизмов. Допустимые этой муфтой радиальные смещения и перекосы в 2 — 4 раза меньше вт улочно-пал ьцевых.
[17]
| Крестовая муфта.
[18] |
Преимущество крестовых муфт заключается в том, что они дают возможность соединять два вала даже при расхождении соосности их в пределах 1 — 5 мм.
[19]
Из крестовых муфт наиболее распространена кулачково-дисковая муфта. Насаженные на валы полумуфты соединяются между собой при помощи диска благодаря тому, что на торцах диска имеются выступы, которые помещаются в соответствующих пазах полумуфт. Так как выступы расположены взаимно перпендикулярно, то муфта обеспечивает свободное радиальное перемещение соединяемых валов. Очевидно, что она допускает также осевое и угловое перемещения этих валов.
Так как выступы расположены взаимно перпендикулярно, то муфта обеспечивает свободное радиальное перемещение соединяемых валов. Очевидно, что она допускает также осевое и угловое перемещения этих валов.
[20]
Как устроены крестовые муфты — кулачково-дисковая и с плавающим вкладышем, где их применяют и как рассчитывают.
[21]
Как устроены крестовые муфты ( кулачково-дисковая и с плавающим вкладышем), где их применяют и как рассчитывают.
[22]
Критерием работоспособности крестовых муфт является износостойкость рабочих граней. Давление по длине граней распределяется неравномерно.
[23]
| Крестовая муфта с сухарем.
[24] |
Критерием работоспособности крестовых муфт является износостойкость рабочих граней. Давление по длине граней распределяется неравномерно.
[25]
Расчетная схема крестовой муфты.
[26] |
Критерием работоспособности крестовых муфт является износостойкое гь рабочих граней. Давление но длине граней распределяется неравномерно.
[27]
При передаче крестовыми муфтами крутящих моментов на рабочих гранях выступов и пазов возникают неравномерно распределенные давления. Для уменьшения потерь на трение и износа сопряженных поверхностей их периодически смазывают.
[28]
Довольно широко распространена крестовая муфта со скользящим вкладышем ( рис. 19.6), которая состоит из двух полумуфт 1 и 2 и вкладыша 3, имеющего форму параллелепипеда.
[29]
| Ремонт кулачковой крестовой муфты.
[30] |
Страницы:
1
2
3
4
5
цены, доставка по Москве и всей России — Деловая Русь
Сейчас вы будете перенаправлены на специализированный сайт компании «Деловая Русь»
Если этого не произошло, нажмите кнопку:
Оставить заявку на сервис
Ваше имя *
Телефон *
Ошибка в номере телефона
Код из СМС
Тема звонка *
Фаст фудПопкорнСахарная ватаОборудование для ресторанаПосудаСпециальное предложение
Ближайший офис ДР
Не выбраноJacksonvilleАлматыАстанаБишкекВоронежЕкатеринбургИркутскКазаньКалининградКировКраснодарКрасноярскМинскМоскваНовосибирскОмскРостов-на-ДонуСамараСанкт-ПетербургТашкентТверьТюменьУлан-БаторУфаХабаровскЧелябинск
Отправляя форму вы соглашаетесь с
политикой конфиденциальности
«THE MATRIX» — это новый клиентский портал в HoReCa от компании «ДЕЛОВАЯ РУСЬ» — «TRAPEZA. RU»!
RU»!
Это самый простой способ общаться с нами, смотреть все товары только с вашими ценами, удобно и
быстро оформлять заказы и доставку.
Оформляя заказ в «THE MATRIX» вы гарантировано получает скидку от 3% до 45%
. Окончательный размер зависит от товара и вашей персональной скидки в компании ДР.
Скидка действует на 97,6% из 70 028 товаров ассортимента в Деловой
Руси! (Может не действовать или действовать ограниченно там, где цены регулируют поставщики).
Удачных покупок!
Вперед за покупками!
Интернет-ресурс https://matrix.trapeza.ru/ носит исключительно информационный характер и не является
публичной офертой, определяемой положениями ст. 437 Гражданского кодекса РФ. Персональные предложения
носят конфиденциальный характер и не подлежат разглашению третьим лицам. Регистрируясь, вы подтверждаете
свое согласие с вышеописанной информацией.
Выберите список
Производитель:
СИКОМ, РОССИЯ
Модель:
9243
Код товара:
5163
617.34 руб
Добавить в корзину
Заголовок
Тема
Укажите тему вопроса
Разрешительные документыРегионы: наличие на складах и доставкаСахарная ватаПопкорнОборудование Фаст-ФудТехнологическое оборудованиеПосуда и аксессуарыЗИП.Наличие и доставкаДругое
Необязательные поля
Зачем
оставлять
номер телефона?
Получать информацию
о скидках, новинках и специальных предложениях.
В избранное
На почту
Email Отправить
Муфта Suzuki
Портал органической химии
Реакции >> Имя Реакции
Дополнительная информация
Литература
Связанные реакции
Hiyama Coupling
Kumada Coupling
Реакция Boorlation Miyaura
Negishi Coupling
Стилл -соединение
ТАК
выше показано первое опубликованное соединение Suzuki Coupling, которое является
катализируемое палладием кросс-сочетание между органобороновой кислотой и
галогениды. Недавние разработки катализаторов и методов расширили
возможности применения чрезвычайно велики, так что масштабы реакции
партнеров не ограничивается арилами, но включает алкилы, алкенилы и
алкинилы. Трифторбораты калия и органобораны или боронат
вместо бороновых кислот можно использовать сложные эфиры. Некоторые псевдогалогениды (для
Некоторые псевдогалогениды (для
например, трифлаты) также могут использоваться в качестве связующих компонентов.
Одно отличие механизма Suzuki от муфты Stille
заключается в том, что борная кислота должна быть активирована, например, основанием. Этот
активация атома бора усиливает поляризацию органического лиганда,
и облегчает трансметаллирование. Если исходные материалы заменить
основные лабильные группы (например, сложные эфиры), порошкообразный KF влияет на эту активацию
оставляя незатронутыми основные лабильные группы.
Частично из-за стабильности, простоты приготовления и низкой токсичности
соединений борной кислоты, в настоящее время существует большой интерес к приложениям
о муфте Suzuki, с новыми разработками и усовершенствованиями, о которых сообщается
постоянно.
Последняя литература
Алкил-алкильные кросс-сочетания Сузуки неактивированных вторичных алкилгалогенидов при
Комнатная температура
Б. Сайто, GC Fu, J. Am. хим. соц. , 2007 ,
Am. хим. соц. , 2007 ,
129 , 9602-9603.
Борные кислоты: новые партнеры по связыванию в реакциях Сузуки при комнатной температуре.
Алкилбромиды. Кристаллографическая характеристика окислительного присоединения
Аддукт, генерируемый в удивительно мягких условиях
JH Kirchhoff, M.R. Netherton, I.D. Hill, GC Fu, J. Am. хим. соц. ,
2002 ,
124 , 13662-13663.
B-Alkyl sp 3 -sp 2 Муфты Suzuki-Miyaura под мягким водным мицеллярным раствором
Условия
Н. Р. Ли, Р. Т. Х. Линштадт, Д. Дж. Глоистен, Ф. Галлоу, Б. Х. Липшутц, Org. лат. ,
2018 , 20 , 2902-2905.
Рациональное исследование разнообразия палладациклов N-гетероциклических карбенов (NHC):
Высокоактивный и универсальный прекатализатор для реакций сочетания Судзуки-Мияуры
дезактивированных арильных и алкильных субстратов
Г.-Р. Пех, Э.А.Б. Канчев, Ж.-К. Er, JY Ying, Chem. Евро. Дж. , 2010 ,
Евро. Дж. , 2010 ,
14 , 4010-4017.
Стереоконвергентные аминонаправленные алкил-алкильные реакции Судзуки неактивированных
Вторичные алкилхлориды
Z. Lu, A. Wilsily, GC Fu, J. Am. хим. соц. , 2011 ,
133 , 8154-8157.
Каталитическая селективная по энантиотопным группам реакция Судзуки для
Конструирование хиральных борорганических соединений
К. Сан, Б. Поттер, Дж. П. Моркен, J. Am. хим. соц. , 2014 ,
136 , 6534-6537.
Реакции перекрестного сочетания арила Сузуки, катализируемые тетрафосфином / палладием
галогениды с алкилборными кислотами
И. Кондольф, Х. Дусе, М. Сантелли, Тетраэдр, 2004 , 60 ,
3813-3818.
Реакции кросс-сочетания Сузуки-Мияуры первичных алкилтрифторборатов
с арилхлоридами
С. Д. Дреер, С.-Э. Лим, Д. Л. Сандрок, Г. А. Моландер, J. Org. хим. , 2009 ,
74 , 3626-3631.
Краткая и атомно-экономичная реакция сочетания Судзуки-Мияуры с использованием
Неактивированные триалкил- и триарилбораны с арилгалогенидами
Х. Ли, Ю.-Л. Чжун, К.-ю. Chen, AE Ferraro, D. Wang, Org. лат. ,
2015 ,
17 , 3616-3619.
[(NHC)PdCl 2 (анилин)] Комплексы: легко синтезируемые, высокоактивные
Прекатализаторы Pd(II)-NHC для реакций кросс-сочетания
Q. Xia, S. Shi, P. Gao, R. Lalancette, R. Szostak, M. Szostak, J. Org. хим. , 2021 , 86 ,
15650-15657.
Стереоспецифические Pd-катализируемые реакции кросс-сочетания вторичного алкилбора
Нуклеофилы и арилхлориды
Л. Ли, С. Чжао, А. Джоши-Пангу, М. Дайан, М. Р. Биско,
Варенье. хим. соц. , 2014 ,
136 , 14027-14030.
Pd( N,N -Диметил β-аланинат) 2 как высокооборачиваемый, не содержащий фосфина
Катализатор для Suzuki Reaction
X. Цуй, Т. Цинь, Ж.-Р. Ван, Л. Лю, Q.-X. Го, Синтез , 2007 ,
Цинь, Ж.-Р. Ван, Л. Лю, Q.-X. Го, Синтез , 2007 ,
393-399.
Гуанидин/Pd(OAc) 2 -Катализируемый Комнатная температура Suzuki
Реакция кросс-сочетания в водных средах в аэробных условиях
С. Ли, Ю. Линь, Дж. Цао, С. Чжан, J. Org. хим. , 2007 ,
72 , 4067-4072.
Водная муфта Suzuki-Miyaura со сверхнизким содержанием палладия и простой
Разделение продукта
В. Ян, В.-Д. Сюй, Дж.-Дж. Нин, З.-Г. Рен, Ди Джей Янг, Synlett , 2020 ,
31 ,
1303-1307 гг.
Ускорение измельчения с помощью жидкости: реакция Судзуки-Мияуры с арилом
Хлориды в условиях высокоскоростной шаровой мельницы
З.-Дж. Цзян, З.-Х. Ли, Ж.-Б. Ю, В.-К. Su, J. Org. хим. ,
2016 , 81 , 10049-10055.
[Bmim] PF 6 — Промотированная безлигандная реакция сочетания Suzuki-Miyaura калия
Арилтрифторбораты в воде
L. Liu, Y. Dong, B. Pang, J. Ma, J. Org. хим. , 2014 ,
Ma, J. Org. хим. , 2014 ,
79 , 7193-7198.
Стерически требовательные водорастворимые алкилфосфины как лиганды для высоких
Активность Сузуки-сочетание арилбромидов в водных растворителях
К. Х. Шонесси, Р. С. Бут, Org. лат. , 2001 ,
3 , 2757-2759.
Удобная и эффективная перекрестная связь Suzuki-Miyaura, катализируемая
Система палладий/диазабутадиен
Г. А. Граса, А. К. Хиллиер, С. П. Нолан,
Орг. лат. , 2001 , 3 , 1077-1080.
Неограниченно стабильный на воздухе прекатализатор σ-Ni II для количественного
Кросс-сочетание нереакционноспособных арилгалогенидов и мезилатов с арилом
Неопентилгликольборонаты
Дж. Малинени, Р. Л. Джезорек, Н. Чжан, В. Перцек, Синтез , 2016 ,
48 , 2795-2807.
Катализируемое медью сочетание Suzuki-Miyaura сложных арилборонатных эфиров:
Трансметаллирование с помощью (PN)CuF и идентификация промежуточных соединений
С. К. Гурунг, С. Тапа, А. Кафле, Д. А. Дики, Р. Гири, Org. лат. , 2014 ,
К. Гурунг, С. Тапа, А. Кафле, Д. А. Дики, Р. Гири, Org. лат. , 2014 ,
16 , 1264-1267.
Рациональный дизайн и синтез водорастворимых тиомочевинных лигандов для
Извлекаемые Pd-катализируемые аэробные водные реакции Судзуки-Мияуры в комнате
Температура
В. Чен, X.-Y. Лу, Б.-Хуа, В.-г. Ю, З.-н. Чжоу, Ю. Ху, Синтез , 2018 , 50 ,
1499-1510 гг.
Циклобутен-1,2-бис(имидазолиевая) соль как эффективный предшественник
Катализированные палладием реакции Судзуки-Мияуры при комнатной температуре
А. Рахими, А. Шмидт, Synlett , 2010 ,
1327-1330 гг.
Чрезвычайно активный и общий катализатор реакции сочетания Сузуки
Нереакционноспособные арилхлориды
Д.-Х. Ли, М.-Дж. Джин, Орг. лат. , 2011 ,
13 , 252-255.
Триарилфосфиновый лиганд, несущий цепи додека(этиленгликоля): усиленный
Эффективность катализируемой палладием реакции сочетания Судзуки-Мияуры
Т. Фуджихара, С. Йошида, Дж. Терао, Ю. Цудзи, Org. лат. , 2009 ,
Фуджихара, С. Йошида, Дж. Терао, Ю. Цудзи, Org. лат. , 2009 ,
11 , 2121-2124.
Новое семейство настраиваемых индолилфосфиновых лигандов с помощью сборки в одном горшке и
Их применение в реакции сочетания Сузуки-Мияуры арилхлоридов
C. M. So, C. C. Yeung, C. P. Lau, F. Y. Kwong, J. Org. хим. , 2008 ,
73 , 7803-7806.
Активный, универсальный и долгоживущий палладиевый катализатор для кросс-сочетаний
Дезактивированные (гетеро)арилхлориды и бромиды с арилбороновыми кислотами
Т. Хоши, Т. Хонма, А. Мори, М. Кониси, Т. Сато, Х. Хагивара, Т. Судзуки, J. Org. хим. , 2013 ,
78 , 11513-11524.
Бифенилен-замещенный рутеноценилфосфин для сочетания Сузуки-Мияуры
Арилхлориды
Т. Хоши, Т. Наказава, И. Сайто, Ю. Мори, Т. Судзуки, Дж.-и. Сакаи, Х.
Хагивара, С. Акаи, Org. лат. , 2008 ,
10 , 2063-2066.
Объем двухстадийного однореакторного борилирования с палладиевым катализатором/Suzuki
Реакция кросс-сочетания с использованием бис-бороновой кислоты
Г. А. Моландер, С. Л. Дж. Трайс, С. М. Кеннеди, Ж. Орг. хим. , 2012 ,
А. Моландер, С. Л. Дж. Трайс, С. М. Кеннеди, Ж. Орг. хим. , 2012 ,
77 , 8678-8688.
Легкий синтез высокостабильных наночастиц золота и их неожиданное развитие
Превосходная каталитическая активность в реакции кросс-сочетания Сузуки-Мияуры в воде
J. Han, Y. Liu, R. Guo, J. Am. хим. соц. , 2009 ,
131 , 2060-2061.
Бискарбоксифункционализированный имидазол и палладий как высокоактивные катализаторы
Система в протонных растворителях: метанол и вода
Мартнез Р., Пастор И.М., Юс М., Синтез , 2014 , 46 ,
2965-2975.
Соединения Suzuki-Miyaura при комнатной температуре в воде с использованием неионогенных материалов
Амфифилы
Б. Х. Липшуц, Т. Б. Петерсен, А. Р. Абела, Org. лат. , 2008 ,
10 , 1333-1336.
Надежные комплексы аценафтоимидазолилидена палладия: высокая эффективность
Катализаторы для муфт Сузуки-Мияура со стерически затрудненными подложками
T. Tu, Z. Sun, W. Fang, M. Xu, Y. Zhou, Org. лат. , 2012 ,
Tu, Z. Sun, W. Fang, M. Xu, Y. Zhou, Org. лат. , 2012 ,
14 , 4250-4253.
Не содержащая растворителей муфта Suzuki-Miyaura с микроволнами, катализируемая
ПЕППСИ-iPr
П. Нун, Дж. Мартинес, Ф. Ламати, Synlett , 2009 ,
1761-1764 гг.
Реакции кросс-сочетания и дегалогенирования, катализируемые ( N — Гетероциклический
карбен)Pd(аллил)Cl Комплексы
О. Наварро, Х. Каур, П. Махджор, С. П. Нолан, J. Org. хим., 2004 ,
69 , 3173-3180.
N-гетероциклический карбеновый лиганд с гибким стерическим объемом позволяет Suzuki
Кросс-сочетание стерически затрудненных арилхлоридов при комнатной температуре
Г. Альтенхофф, Р. Годдард, К. В. Леманн, Ф. Глориус, Angew. хим. Междунар. Эд. ,
2003 , 42 , 3690-3693.
Ферроценилмонофосфиновые лиганды: синтез и применение в
Соединение Suzuki-Miyaura из арилхлоридов
C. Baillie, L. Zhang, J. Xiao, J. Org. хим. , 2004 ,
Baillie, L. Zhang, J. Xiao, J. Org. хим. , 2004 ,
69 , 7779-7782.
Многоразовая и эффективная система Pd(OAc) 2 /TBAB/PEG-400 для Suzuki-Miyaura
Реакция кросс-сочетания в безлигандных условиях
В.-Дж. Лю, Ю.-Х. Се, Ю. Лян, Ж.-Х. Ли,
Синтез , 2006 , 860-864.
Катализируемая ацетатом палладия реакция Сузуки в воде без фосфина
Л. Лю, Ю. Чжан, Ю. Ван, J. Org. хим. , 2005 ,
70 , 6122-6125.
Cyrene как растворитель на биологической основе для перекрестной муфты Suzuki-Miyaura
К. Л. Уилсон, Дж. Мюррей, К. Джеймисон, А. Дж. Б. Уотсон,
Synlett , 2018 , 29 , 650-654.
Синтез и характеристика R2PN=P( i BuNCH 2 CH 2 ) 3 N: новый громоздкий
Обогащенный электронами фосфин для эффективной перекрестной связи Suzuki-Miyaura с добавлением Pd
Реакции
JV Kingston, JG Verkade, J. Org. хим. , 2007 ,
Org. хим. , 2007 ,
72 , 2816-2822.
Модифицированные комплексы (NHC)Pd(аллил)Cl (NHC = N -гетероциклический карбен)
для реакций Сузуки-Мияуры и Бухвальда-Хартвига при комнатной температуре
Н. Марион, О. Наварро, Дж. Мей, Э. Д. Стивенс, Н. М. Скотт, С. П. Нолан, J. Am. хим. соц. , 2006 , 128 , 4101-4111.
Высокоактивный катализатор реакций кросс-сочетания Судзуки-Мияуры.
Гетероарильные соединения
К. Л. Биллингсли, К. В. Андерсон, С. Л. Бухвальд, Angew. хим. Междунар. Эд. , 2006 , 45 , 3484-3488.
Катализируемое палладием сочетание Сузуки-Мияуры с арилхлоридами с использованием
громоздкий фенантрил N -гетероциклический карбеновый лиганд
К. Сонг, Ю. Ма, К. Чай, К. Ма, В. Цзян, М. Б. Андрус, Тетраэдр , 2005 ,
61 , 7438-7446.
Наночастицы палладия на носителе из ПВХ: эффективный катализатор для Suzuki
Реакции кросс-сочетания при комнатной температуре
М. Самарасимхаредди, Г. Прабху, Т. М. Вишванатха, В. В. Сурешбабу, Синтез , 2013 , 45 ,
Самарасимхаредди, Г. Прабху, Т. М. Вишванатха, В. В. Сурешбабу, Синтез , 2013 , 45 ,
1201-1206.
Перерабатываемые катализаторы для реакций кросс-сочетания Сузуки-Мияуры при температуре окружающей среды
Поддерживаемая температура на основе простой смолы Меррифилда
Комплекс фенантролин-палладий(II)
Дж. Ян, П. Ли, Л. Ван, Синтез , 2011 ,
1295-1301 гг.
Иммобилизация дипиридильного комплекса на магнитной наночастице с помощью Click
Химия как пригодный для повторного использования катализатор для реакций кросс-сочетания Сузуки
Г. Лв, В. Май, Р. Джин, Л. Гао, Синлетт , 2008 ,
1418-1422 гг.
PdEDTA, хранящийся в щетке с ионной жидкостью, как высокоэффективный и многоразовый
Катализатор для реакций Судзуки в воде
Ж.-Ф. Вэй, Дж. Цзяо, Дж.-Дж. Фэн, J. Lv, X.-R. Чжан, X.-Y. Ши, З.-Г. Чен, J. Org. хим. , 2009 ,
74 , 5967-5974.
Палладий-имидазолиевый карбен, катализируемый арилом, винилом и алкилом
Поперечная муфта Suzuki-Miyaura
М.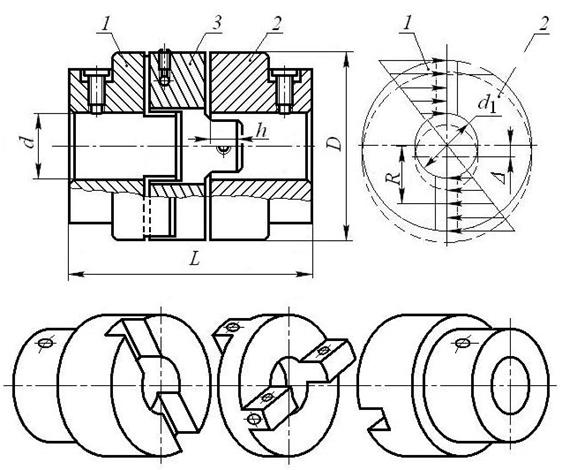 Б. Андрус, К. Сонг, Org. лат. , 2001 ,
Б. Андрус, К. Сонг, Org. лат. , 2001 ,
3 , 3761-3764.
Преодоление потребности в нафтиле в стереоспецифических кросс-сочетаниях для
Форма Четвертичные стереоцентры
J. Xu, O. P. Bercher, MP Watson, J. Am. хим. соц. ,
2021 , 143 , 8608-8613.
Винилтетрафторборат тиантрения: практичное и универсальное винилирование
Реагент из этилена
Ф. Джули, Дж. Ян, Ф. Паулюс, Т. Риттер, Дж. Ам. хим. соц. ,
2021 , 143 , 12992-12998.
Влияние лиганда на стереохимический результат соединений Судзуки-Мияура
Г.-П. Lu, K.R. Voigtritter, C. Cai, B.H. Lipshutz, J. Org. хим. , 2012 ,
77 , 3700-3703.
Синтез E -Алкилалкенов из терминальных алкинов с помощью никелевого катализатора
Кросс-сочетание алкилгалогенидов с B-алкенилом-9-борабицикло[3.3.1]нонаны
Т. Ди Франко, А. Эпеной, X. Ху, Org. лат. ,
2015 ,
17 , 4910-4913.
Highly E — селективный стереоконвергентный никелевый катализатор Suzuki-Miyaura
Кросс-сочетание алкениловых эфиров
Г.-М. Хо, Х. Зоммер, И. Марек,
Орг. лат. , 2019 , 21 , 2913-2917.
MIDA-винилсиланы: селективные перекрестные связи и применение в
Синтез функционализированных стильбенов
М. Г. Маклафлин, К. А. МакАдам, М. Дж. Кук, Org. лат. ,
2015 ,
17 , 10-13.
Эффективный и пригодный для вторичной переработки палладий с магнитными наночастицами
Катализатор реакций сочетания Сузуки борорганических кислот с алкинилом
Бромиды
X. Zhang, P. Li, Y. Ji, L. Zhang, L. Wang, Synthesis , 2011 ,
2975-2983.
Эффективная катализируемая палладием реакция кросс-сочетания алкинилгалогенидов
с борорганическими кислотами в аэробных условиях
Ж.-С. Тан, М. Тиан, В.-Б. Шэн, К.-К. Го, Синтез , 2012 , 44 ,
541-546.
Сочетание Сузуки-Мияуры алкинилборных эфиров, полученное in situ из
Ацетиленовые производные
КАК. Кастанье, Ф. Колобер, Т. Шлама,
Орг. лат. , 2000 , 2 , 3559-3561.
Высокоактивный катализатор гетерогенной реакции Судзуки-Мияуры:
Собранный комплекс палладия и несшитого амфифильного полимера
YMA Yamada, K. Takeda, H. Takashashi, S. Ikegami, J. Org. Хим.,
2003 ,
68 , 7733-7741.
Новые катализаторы реакций сочетания Судзуки-Мияуры
Гетероатом-замещенные гетероарилхлориды
А. С. Гурам, X. Ван, Э. Э. Бунел, М. М. Фаул, Р. Д. Ларсен, М. Дж. Мартинелли, J. Org. хим. , 2007 ,
72 , 5104-5112.
C 2 -Симметричные бис-гидразоны как лиганды в асимметричной системе Сузуки-Мияура
Перекрестная муфта
А. Бермехо, А. Рос, Р. Ферндес, Дж. М. Лассалетта, J. Am. хим. соц. , 2008 ,
130 , 15798-15799.
Общие условия реакции катализируемого палладием винилирования арила
Хлориды с алкенилтрифторборатами калия
E. Alacid, C. Njera, J. Org. хим. , 2009 ,
74 , 8191-8195.
Стереоселективное тозилирование енолов: получение трехзамещенных
α,β-ненасыщенные сложные эфиры
Дж. Бакстер, Д. Штайнхюбель, М. Палуки, И. В. Дэвис,
Орг. лат. , 2005 , 7 , 215-218.
N Соли тетрафторбората винилпиридиния и аммония: новые электрофильные
Партнеры связывания для Pd(0)-катализируемых реакций кросс-сочетания Сузуки
К. Р. Бушек, Н. Браун, Org. лат. , 2007 ,
9 , 707-710.
Кросс-сочетание Suzuki-Miyaura трифторборатогомоенолятов калия
Г. А. Моландер, Д. Э. Петрилло, Org. лат. , 2008 ,
10 , 1795-1798.
Катализируемое палладием однореакторное перекрестное сочетание фенолов с использованием
Нонафторбутансульфонилфторид
Т. Икава, К. Сайто, С. Акаи, Синлетт , 2012 , 23 ,
Икава, К. Сайто, С. Акаи, Синлетт , 2012 , 23 ,
2241-2246.
Семейство индолилфосфиновых лигандов было применено к Suzuki-Miyaura.
перекрестное сочетание арилтозилатов с бороновыми кислотами, трифторборатными солями и
боронатные эфиры. Загрузка катализатора может быть снижена до 0,2 мол. % для соединения
неактивированные арилтозилаты.
C. M. So, C. P. Lau, A. S. C. Chan, F. Y. Kwong, J. Org. хим. , 2008 ,
73 , 7731-7734.
Общая каталитическая система палладия для сочетания Suzuki-Miyaura с калием
Арилтрифторбораты и арилмезилаты
W.K.Chow, C.M.So, C.P.Lau, F.Y.Kwong, J. Org. хим. , 2010 ,
75 , 5109-5112.
Ni(COD) 2 /PCy 3 Катализируемое перекрестное связывание арила и гетероарила
Неопентилгликольборонаты с арил- и гетероарилмезилатами и сульфаматами в
ТГФ при комнатной температуре
П. Леованават, Н. Чжан, А.-М. Remerita, B. M. Rosen, V. Percec, J. Org. хим. , 2011 ,
M. Rosen, V. Percec, J. Org. хим. , 2011 ,
76 , 9946-9955.
Первый общий палладиевый катализатор для Suzuki-Miyaura и Carbonyl
Енолятное сочетание арил-аренсульфонатов
HN Nguyen, X. Huang, SL Buchwald, J. Am. хим. соц. , 2003 , 125 , 11818-11819.
Синтез биарильных производных с помощью магнитного катализатора Pd-NPs One Pot
Реакция диазотирования-кросс-сочетания
Y. Zong, J. Hu, P. Sun, X. Jiang, Synlett , 2012 , 23 ,
2393-2396.
Муфта Suzuki-Miyaura из нитроаренов
М. Р. Ядав, М. Нагаока, М. Кашихара, Р.-Л. Чжун, Т. Миядзаки, С. Сакаки, Ю.
Накао, J. Am. хим. соц. , 2017 ,
139 , 9423-9426.
Катализируемые палладием реакции кросс-сочетания калия
Алкенилтрифторбораты с органическими галогенидами в водной среде
E. Alacid, C. Njera, J. Org. хим. , 2009 ,
74 , 2321-2327.
Использование бисфосфиновых лигандов с большим углом закусывания P-Pd-P позволило
синтезировать Z -хлорированные внутренние алкены с хорошими выходами селективным
Процесс моносочетания Сузуки-Мияуры 9-алкил-9-BBN с
1,1-дихлор-1-алкены. Эти монохлорированные олефины могут быть дополнительно
Эти монохлорированные олефины могут быть дополнительно
трансформируется с получением стереоспецифически тризамещенных олефинов.
F. Liron, C. Fosse, A. Pernolet, E. Roulland, J. Org. хим. , 2007 ,
72 , 2220-2223.
Стереоселективная реакция кросс-сочетания 1,1-диборил-1-алкенов с
Электрофилы: высокостереоконтролируемый подход к 1,1,2-триарил-1-алкенам
М. Симидзу, К. Накамаки, К. Симоно, М. Шелпер, Т. Курахаши, Т. Хияма, J. Am. хим. соц. , 2005 , 127 , 12506-12507.
Реакции перекрестного сочетания Судзуки-Мияуры алкенилтрифторборатов калия
Г. А. Моландер, К. Р. Бернарди, J. Org. хим. ,
2002 , 67 , 8424-8429.
Механохимический синтез кетонов с помощью хемоселективного метода Судзуки-Мияуры.
Кросс-сочетание ацилхлоридов
Дж. Чжан, П. Чжан, Ю. Ма, М. Шостак, Org. лат. ,
2022 , 24 , 2338-2343.
Оценка циклических амидов в качестве активирующих групп в кросс-сочетании NC-связи:
Открытие N -ацил-δ-валеролактамов в качестве эффективных предшественников скрученных амидов для
Реакции кросс-сочетания
Md. M. Rahman, D. J. Pyle, E. Bisz, B. Dziuk, K. Ejsmont, R. Lalancette, Q.
M. Rahman, D. J. Pyle, E. Bisz, B. Dziuk, K. Ejsmont, R. Lalancette, Q.
Ван, Х. Чен, Р. Шостак, М. Шостак, J. Org. хим. , 2021 , 86 ,
10455-10466.
Общий метод перекрестной связи Судзуки-Мияуры для первичного
Электрофилы на основе амида, активированные [Pd(NHC)(cin)Cl] при комнатной температуре
P. Lei, G. Meng, Y. Ling, J. An, S. P. Nolan, M. Szostak, Org. лат. ,
2017 , 19 , 6510-6513.
Pd-PEPPSI: прекатализатор Pd-NHC для реакций кросс-сочетания Сузуки-Мияуры
Амиды
P. Lei, G. Meng, Y. Ling, J. An, M. Szostak, J. Org. хим. ,
2017 , 82 , 6638-6646.
Трифламиды: высокореактивные, активируемые электронным способом N -Сульфонил
Амиды в каталитической перекрестной связи N-C(O) амида
С. Ши, Р. Лалансетт, Р. Шостак, М. Шостак, Org. лат. , 2019 , 21 ,
1253-1257 гг.
Стерически затрудненные кетоны с помощью палладиевого катализатора Suzuki-Miyaura
Кросс-сочетание амидов путем активации N-C(O)
К. Лю, Р. Лалансетт, Р. Шостак, М. Шостак,
Лю, Р. Лалансетт, Р. Шостак, М. Шостак,
Орг. лат. , 2019 , 21 , 7976-7981.
Катализируемая палладием комбинация ариловых эфиров Suzuki-Miyaura
Т. Б. Халима, В. Чжан, И. Ялауи, С. Хун, Ю.-Ф. Ян, К. Н. Хоук, С. Г.
Ньюман, Дж. Ам. хим. соц. , 2017 ,
139 , 1311-1318.
Катализируемая палладациклом карбонилативная комбинация Сузуки-Мияура с высоким
Номер оборота и частота оборота
P. Gautam, B.M. Bhanage, J. Org. хим. ,
2015 ,
80 , 7810-7815.
Наночастицы палладия, нанесенные на полисилан/оксид алюминия, катализируют карбонилирование
Реакции сочетания Сузуки-Мияуры при атмосферном давлении газообразного CO с получением диарилкетонов с отличными выходами. безлигандный
иммобилизованные наночастицы палладия могут быть извлечены простой фильтрацией и
повторно использован.
Т. Ясукава, З. Чжу, Ю. Ямасита, С. Кобаяши, Synlett , 2021 ,
32 ,
502-504.
Дезаминативное арилирование солей пиридиния, полученных из аминокислот
ME Hoerrner, KM Baker, CH Basch, EM Bampo, MP Watson,
Орг. лат. , 2019 , 21 , 7356-7360.
Переключаемая селективность в Pd-катализируемом алкилативном кросс-сочетании
Эфиры
Дж. Массон-Макдисси, Дж. К. Вандаваси, С. Г. Ньюман, Org. лат. ,
2018 , 20 , 4094-4098.
Pd/NHC-катализируемое энантиоспецифическое и региоселективное арилирование Сузуки-Мияуры
2-Арилазиридинов: синтез энантиообогащенного 2-арилфенетиламина
Производные
Ю. Такеда, Ю. Икеда, А. Курода, С. Танака, С. Минатака, J. Am. хим. соц. , 2014 ,
136 , 8544-8547.
Успехи в реакциях кросс-сочетания — PMC
1. de Meijere A., Diederich F., editors. Катализируемые металлом реакции кросс-сочетания. 2-е изд. Wiley-ВЧ; Вайнхайм, Германия: 2004. [Google Scholar] 9.0003
2. Johansson Seechurn C.C.C., Kitching M. O., Colacot T.J., Snieckus V. Катализируемая палладием перекрестная связь: исторический контекстуальный взгляд на Нобелевскую премию 2010 года. Ангью. хим. Междунар. Эд. 2012;51:5062–5085. doi: 10.1002/anie.201107017. [PubMed] [CrossRef] [Google Scholar]
O., Colacot T.J., Snieckus V. Катализируемая палладием перекрестная связь: исторический контекстуальный взгляд на Нобелевскую премию 2010 года. Ангью. хим. Междунар. Эд. 2012;51:5062–5085. doi: 10.1002/anie.201107017. [PubMed] [CrossRef] [Google Scholar]
3. Николау К.С., Балджер П.Г., Сарла Д. Катализируемые палладием реакции кросс-сочетания в полном синтезе. Ангью. хим. Междунар. Эд. 2005; 44:4442–4489. doi: 10.1002/anie.200500368. [PubMed] [CrossRef] [Академия Google]
4. Кампо Л.-К., Хазари Н. Перекрёстные связи и родственные реакции: соединение прошлых успехов с развитием новых реакций на будущее. Металлоорганические соединения. 2019;38:3–35. doi: 10.1021/acs.organomet.8b00720. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Zhao K., Shen L., Shen Z.-L., Loh T.-P. Катализируемые переходными металлами реакции кросс-сочетания с использованием индийорганических реагентов. хим. соц. 2017; 46: 586–602. doi: 10.1039/C6CS00465B. [PubMed] [CrossRef] [Академия Google]
6. Gil-Negrete J.M., Pérez Sestelo J., Sarandeses L.A. Синтез стабильных на стенде твердых триорганоиндиевых реагентов и реакционная способность в реакциях кросс-сочетания, катализируемых палладием. хим. коммун. 2018;54:1453–1456. doi: 10.1039/C7CC09344F. [PubMed] [CrossRef] [Google Scholar]
Gil-Negrete J.M., Pérez Sestelo J., Sarandeses L.A. Синтез стабильных на стенде твердых триорганоиндиевых реагентов и реакционная способность в реакциях кросс-сочетания, катализируемых палладием. хим. коммун. 2018;54:1453–1456. doi: 10.1039/C7CC09344F. [PubMed] [CrossRef] [Google Scholar]
7. Джаннерини М., Фаньянас-Мастраль М., Феринга Б.Л. Прямое каталитическое кросс-сочетание литийорганических соединений. Нац. хим. 2013;5:667–672. doi: 10.1038/nchem.1678. [PubMed] [CrossRef] [Академия Google]
8. Knappke C.E.I., Jacobi von Wangelin A. 35 лет катализируемого палладием кросс-сочетания с реагентами Гриньяра: как далеко мы продвинулись? хим. соц. 2011; 40:4948–4962. doi: 10.1039/c1cs15137a. [PubMed] [CrossRef] [Google Scholar]
9. Johansson C.C.C., Colacot T.J. Катализируемое металлом α-арилирование карбонила и родственных молекул: новые тенденции в образовании связи C–C путем функционализации связи C–H. Ангью. хим. Междунар. Эд. 2010; 49: 676–707. doi: 10.1002/anie. 2004. [PubMed] [CrossRef] [Академия Google]
2004. [PubMed] [CrossRef] [Академия Google]
10. Ю Ж.-К., Ши З., ред. Активация CH: Topics in Current Chemistry, Vol. 292. Спрингер; Берлин, Германия: 2010. [PubMed] [Google Scholar]
11. Ruiz-Castillo P., Buchwald S.L. Применение катализируемых палладием реакций кросс-сочетания C – N. хим. 2016; 116:12564–12649. doi: 10.1021/acs.chemrev.6b00512. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Dorel R., Grugel C.P., Haydl A.M. Аминирование Бухвальда-Хартвига через 25 лет. Ангью. хим. Междунар. Эд. 2019;58:17118–17129. doi: 10.1002/anie.2015. [PubMed] [CrossRef] [Google Scholar]
13. Zeng H., Qiu Z., Domínguez-Huerta A., Hearne Z., Chen Z., Li C.-J. Приключение в области устойчивой перекрестной связи фенолов и их производных посредством разрыва связи углерод-кислород. Катал. 2017;7:510–519. doi: 10.1021/acscatal.6b02964. [CrossRef] [Google Scholar]
14. Yang Y. Катализируемое палладием перекрестное сочетание нитроаренов. Ангью. хим. Междунар. Эд. 2017;56:15802–15804. doi: 10.1002/anie.201708940. [PubMed] [CrossRef] [Академия Google]
хим. Междунар. Эд. 2017;56:15802–15804. doi: 10.1002/anie.201708940. [PubMed] [CrossRef] [Академия Google]
15. Rössler S.L., Jelier B.J., Magnier E., Dagousset G., Carreira E.M., Togni A. Соли пиридиния в качестве окислительно-восстановительных реагентов для переноса функциональных групп. Ангью. хим. Междунар. Эд. 2020;59:9264–9280. doi: 10.1002/anie.201911660. [PubMed] [CrossRef] [Google Scholar]
16. Корнелла Дж., Эдвардс Дж.Т., Цинь Т., Кавамура С., Ван Дж., Пан С.-М., Джанатассио Р., Шмидт М., Истгейт М.Д. , Баран П.С. Практическая Ni-катализируемая арил-алкильная кросс-сочетание вторичных редокс-активных эфиров. Варенье. хим. соц. 2016;138:2174–2177. doi: 10.1021/jacs.6b00250. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Лю С., Шостак М. Декарбонилативное перекрестное сочетание амидов. Орг. биомол. хим. 2018;16:7998–8010. doi: 10.1039/C8OB01832D. [PubMed] [CrossRef] [Google Scholar]
18. Су Б., Цао З.-К., Ши З.-Дж. Исследование распространенных в земле переходных металлов (Fe, Co и Ni) в качестве катализаторов нереакционноспособной активации химических связей. Акк. хим. Рез. 2015; 48: 886–896. doi: 10.1021/ar500345f. [PubMed] [CrossRef] [Google Scholar]
Акк. хим. Рез. 2015; 48: 886–896. doi: 10.1021/ar500345f. [PubMed] [CrossRef] [Google Scholar]
19. Хан Ф.-С. Реакции кросс-сочетания Сузуки-Мияуры, катализируемые переходными металлами: значительный шаг вперед от палладиевых катализаторов к никелевым. хим. соц. 2013; 42:5270–5298. doi: 10.1039/c3cs35521g. [PubMed] [CrossRef] [Google Scholar]
20. Tellis J.C., Primer D.N., Molander G.A. Одноэлектронное трансметаллирование в кросс-сочетании борорганических соединений с помощью двойного фотоокислительно-восстановительного / никелевого катализа. Наука. 2014; 345:433–436. doi: 10.1126/science.1253647. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Twilton J., Le C.C., Zhang P., Shaw M.H., Evans R.W., MacMillan D.W.C. Слияние переходного металла и фотокатализа. Нац. Преподобный Хим. 2017;1:52. doi: 10.1038/s41570-017-0052. [Перекрестная ссылка] [Академия Google]
22. Мацуи Дж.К., Ланг С.Б., Хайц Д.Р., Моландер Г.А. Фоторедокс-опосредованные пути к радикалам: значение генерации каталитических радикалов в развитии синтетических методов. Катал. 2017;7:2563–2575. doi: 10.1021/acscatal.7b00094. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Катал. 2017;7:2563–2575. doi: 10.1021/acscatal.7b00094. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Martin R., Buchwald S.L. Катализируемые палладием реакции кросс-сочетания Сузуки-Мияуры с использованием диалкилбиарилфосфиновых лигандов. Акк. хим. Рез. 2008;41:1461–1473. doi: 10.1021/ar800036s. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Froese R.D.J., Lombardi C., Pompeo M., Rucker R.P., Organ M.G. Разработка комплексов Pd–N-гетероциклических карбенов с высокой реакционной способностью и селективностью для приложений кросс-сочетания. Акк. хим. Рез. 2017;50:2244–2253. doi: 10.1021/acs.accounts.7b00249. [PubMed] [CrossRef] [Google Scholar]
25. Choi J., Fu G.C. Образование алкил-алкильной связи, катализируемое переходным металлом: еще одно измерение в химии кросс-сочетаний. Наука. 2017;356:eaaf7230. doi: 10.1126/science.aaf7230. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Сантьяго С., Сотомайор Н. , Лете Э. Pd(II)-катализируемое СН-ацилирование (гетеро)аренов — последние достижения. Молекулы. 2020;25:3247. doi: 10,3390/молекулы25143247. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
, Лете Э. Pd(II)-катализируемое СН-ацилирование (гетеро)аренов — последние достижения. Молекулы. 2020;25:3247. doi: 10,3390/молекулы25143247. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
27. Собенина Л.Н., Трофимов Б.А. Недавние успехи в кросс-сочетании галогенацетиленов без переходных металлов с богатыми электронами гетероциклами в твердых средах. Молекулы. 2020;25:2490. doi: 10,3390/молекулы25112490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Yan X., Tang Y.-D., Jiang C.-S., Liu X., Zhang H. Окислительное деаромативное кросс-дегидрогенативное сочетание индолов с различными C-H нуклеофилами: эффективный подход к 2,2-дизамещенным индолин-3-оны. Молекулы. 2020;25:419. doi: 10,3390/молекулы25020419. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Chotana G.A., Montero Bastidas J.R., Miller S.L., Smith M.R., Maleczka R.E. Катализируемое иридием однореакторное борилирование C – H / кросс-сочетание Соногаширы: доступ к борилированным арилалкинам. Молекулы. 2020;25:1754. дои: 10.3390/молекул 25071754. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Молекулы. 2020;25:1754. дои: 10.3390/молекул 25071754. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Kanwal S., Ann N.-U., Fatima S., Emwas A.-H., Alazmi M., Gao X., Ibrar М., Заиб Салим Р.С., Чотана Г.А. Легкий синтез NH-свободных 5-(гетеро)арилпиррол-2-карбоксилатов путем каталитического C-H борилирования и сочетания Сузуки. Молекулы. 2020;25:2106. doi: 10,3390/молекулы25092106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Buskes M.J., Blanco M.-J. Влияние перекрестных реакций на открытие и разработку лекарств. Молекулы. 2020;25:3493. doi: 10,3390/молекулы25153493. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
32. Нейманн Х., Сергеев А.Г., Спанненберг А., Беллер М. Эффективный палладий-катализируемый синтез 2-арилпропионовых кислот. Молекулы. 2020;25:3421. doi: 10,3390/молекулы25153421. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Чури М., Базилио Лопес А., Блонд Г., Гулеа М. Синтез гетероциклов среднего размера с помощью внутримолекулярной циклизации, катализируемой переходными металлами.


