Содержание
Лекция 11. Коррозия металлов и методы защиты от коррозии
Химическая
и электрохимическая коррозия.
Способы защиты металлов от коррозии
Коррозией
называется процесс самопроизвольного
разрушения металлов под воздействием
внешней среды. Все
случаи коррозии принято делать на два
вида: химическую и электрохимическую.
Химическая
коррозия —
это окисление металлов, не сопровождающееся
возникновением электрического тока.
Примером химической коррозии является
образование окалины на железе при
высокой температуре без участия
электролитов,
Электрохимическая
коррозия — разрушение
металла, обусловленное его окислением
в среде электролита и сопровождающееся
возникновением электрического тока в
результате образования гальванического
элемента, который в этом случае называют
коррозионным гальваническим элементом.
Работа коррозионного гальванического
элемента обусловлена разностью
потенциалов активного (анодного) участка
и пассивного (катодного) участка. На
На
анодных участках коррозионного
гальванического элемента происходит
окисление (растворение) основного
металла
Анод:
Me — Ze = Mez+
.
На
катодных участках, в зависимости от
состава-среды, может протекать
восстановление кислорода, воды или
ионов водорода, которые всегда содержатся
в воде и растворах, соприкасающихся с
воздухом.
Коррозия
с участием кислорода называется коррозией
с кислородной деполяризацией. Она
описывается уравнениями:
Анодный
процесс: Me — Ze = Mez+
Катодный процесс:
а) в кислой среде
(рН < 7)
О2
+ 4Н+ + 4ё=2Н2O;
б) в нейтральной
и щелочной среде (рН > 7)
О2
+ 2Н2О
+ 4e =
4OH.
Коррозия,
сопровождающаяся выделением водорода
на катоде, называется коррозией с
водородной деполяризацией и описывается
уравнениями:
Анодный
процесс: Me — Z e = Mez+
Катодный процесс:
а) в кислой среде
(рН < 7)
2Н+
+ 2e = Н2↑;
б) в нейтральной
и щелочной среде (рН ≥ 7)
2H2O
+ 2e = H2↑
+ 2OH. .
.
Таким
образом, электрохимическая коррозия
возможна при условии, когда электроны
с анодных участков постоянно отводятся
на катодные, а затем удаляются с них
окислителем. Коррозионный гальванический
элемент изображают следующим образом:
(A)
MI| Н2О/Окислитель(О2
или Н+)| МII (примеси) (К).
Выделяемая
иногда в отдельный вид грунтовая
(почвенная) коррозия может быть сведена
к одному из вышеперечисленных случаев.
Примеры решения
задач
Пример
1. Хром
находится в контакте с медью. Какой из
металлов будет окисляться при коррозии,
если эта пара металлов находится в
кислой среде (НСl). Составьте схему
образующегося при этом гальванического
элемента. Какой процесс будет протекать
на катоде?
Решение.
Исходя из положения металлов в ряду
напряжений, находим, что хром более
активный металл: (φ0Cr2+/Cr
= -0,74 В,φ0Cu2+/Cu
= +0,34 В). В образующемся гальваническом
В образующемся гальваническом
элементе он будет выполнять роль анода,
а медь — катода:
(А)Сr|Н2О/НС1|Сu(К).
Хромовый анод
растворяется, а на медном катоде
выделяется водород:
Анод:Сr-3е
=Сr3+
Катод:
2Н2+
2е =Н2↑
Пример
2. Какие
процессы протекают при коррозии
технического железа в атмосферных
условиях?
Решение.
Техническое железо содержит примеси
углерода и некоторых металлов, которые,
как правило, менее активны, чем железо,
и выполняют роль катода в образующемся
гальваническом элементе, основная масса
железа является анодом. Адсорбированная
на поверхности железа вода, с растворенными
в ней кислородом и другими газами,
образует пленку электролита.
Схема, образующегося
гальванического элемента имеет вид
(A)Fe|H2O/O2|Me(K).
При работе
гальванического элемента протекают
процессы:
Анод:Fе-2е
=Fe2+
Катод:
2Н2О
+ О2
+ 4 e — 4ОH.
Вторичные
процессы: Fe2+
+2ОH. = Fe(OH)2,
4Fe(OH)2
+ О2
+ Н2О = 4Fe(OH)3.
На
скорость коррозии влияют как внутренние
факторы (наличие дефектов кристаллической
решетки металла, механические напряжения
и др.), так и внешние: температура, природа
и состав электролита. С повышением
температуры скорость коррозии, как и
большинства химических реакций,
возрастает. Усиливают коррозию
содержащаяся в атмосфере промышленных
городов пыль, SO2,
СO2
и другие газы. Поэтому в городах коррозия
протекает в 5-10 раз быстрее, чем в сельской
местности. Ионы Сl—,
присутствующие в морской воде, являются
катализаторами коррозии железа и его
сплавов, так как адсорбируясь на
поверхности металла, разрушают или
препятствуют образованию на нем защитных
слоев. Кроме того, скорость коррозии
двух контактирующих металлов будет тем
больше, чем больше разность потенциалов
этих металлов.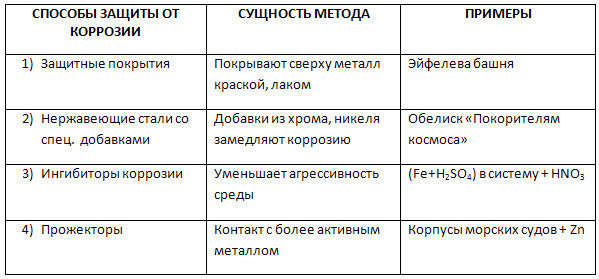 Полностью предотвратить
Полностью предотвратить
процессы коррозии металлов практически
не удается, однако существуют способы
защиты металлов от коррозии.
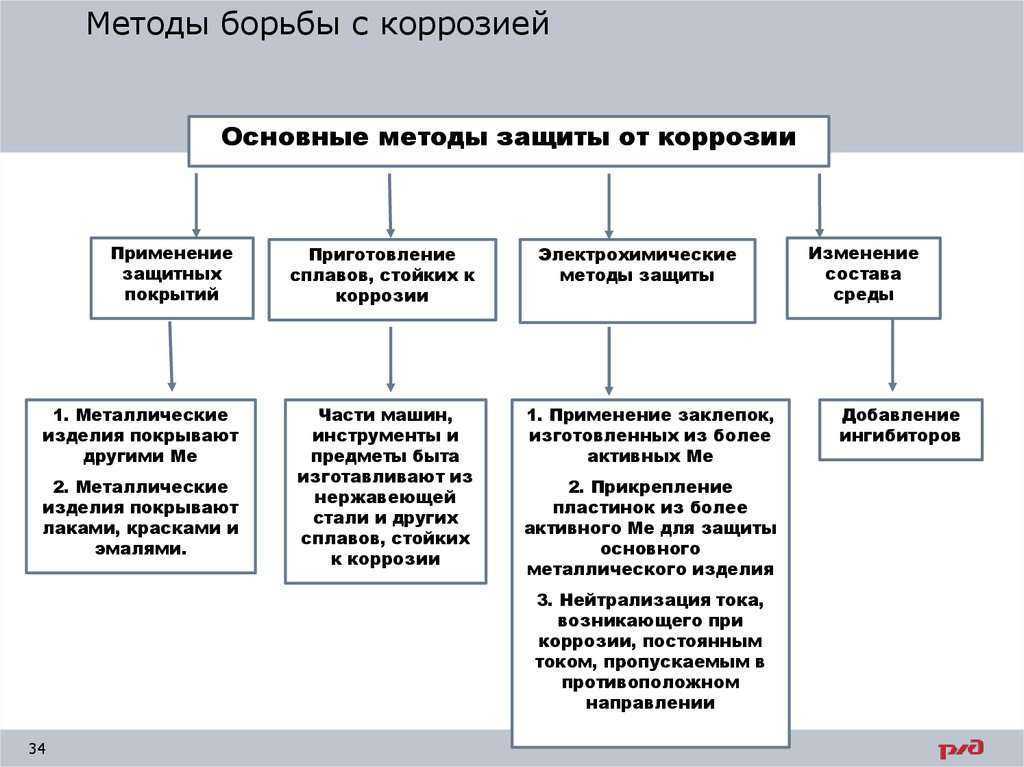
1.
Изменение
коррозионной среды — этот
метод пригоден для тех случаев, когда
защищаемые изделия эксплуатируются в
небольшом объеме. Суть метода состоит
в удалении из электролита растворенного
кислорода или добавлении к этому раствору
веществ, замедляющих коррозию —
ингибиторов.
2.
Легирование
металлов. Это
введение в состав сплавов компонентов,
повышающих химическую стойкость.
Наибольшее применение находят нержавеющие
стали, в состав которых входит хром (до
15 %) и никель (до 10 %). Кроме того, в качестве
легирующих компонентов используют
марганец, кремний, вольфрам, молибден,
титан и другие металлы.
3.
Неметаллические
покрытия. Механически
защищают металлы от коррозии, изолируя
их от влияния внешней среды. Неметаллические
покрытия делятся на неорганические и
органические. Из неорганических покрытий
Из неорганических покрытий
наиболее распространены оксидные и
фосфатные пленки. Так, при кипячении
железа в растворе солей фосфорной
кислоты (обычно солей Fe и Мn) получают
фосфатные пленки, хорошо защищающие от
коррозии в атмосфере. Среди органических,
покрытий наиболее распространенными
являются масляные краски, лаки, полимерные
пленки. Лакокрасочные покрытия — самый
дешевый метод защиты от коррозии.
4.
Металлические
покрытия. По
характеру защитного действия различают
анодные и катодные покрытия. Анодным
является
покрытие металлом, электродный потенциал
которого меньше, чем у защищаемого
металла. Покрытие из металла менее
активного (с большим электродным
потенциалом), чем защищаемый металл,
называется катодным.
Если покрытие
не нарушено и полностью изолирует
основной металл от воздействия окружающей
среды, принципиального различия между
анодными и катодными покрытиями нет.
При нарушении слоя защищающего металла
возникают коррозионные гальванические
элементы, в которых защищаемый металл
может играть роль или инертного катода,
или активного анода. Так, при нарушении
Так, при нарушении
в атмосферных условиях алюминиевого
покрытия на медном изделии (φ0Al3+/Al=
-1,67 В, φ0 Cu2+/Cu
= +0,34 В) возникает гальванический элемент
(А)А1|Н2О/О2|Cu(К).
В
этом элементе, покрывающий металл Аl
является анодом, он разрушается
(окисляется) и, растворяясь, защищает
основной металл, несмотря на нарушение
целостности покрывающего слоя:
Анод:
Аl — 3 е = Аl3+
Катод:
2Н2О
+ О2
+ 4 е = 4ОН.
Катодное
же покрытие (например, свинцовое покрытие
железа) в аналогичном случае
перестает
защищать основной металл и, создавая с
ним гальванический элемент, усиливает
своим присутствием его коррозию:
(А)Fе|Н2О/О2|Рb(К)
Анод:
Fe — 2 e = Fe2+
Катод:
Н2О
+ О2
+ 4 е = 4ОН.
5.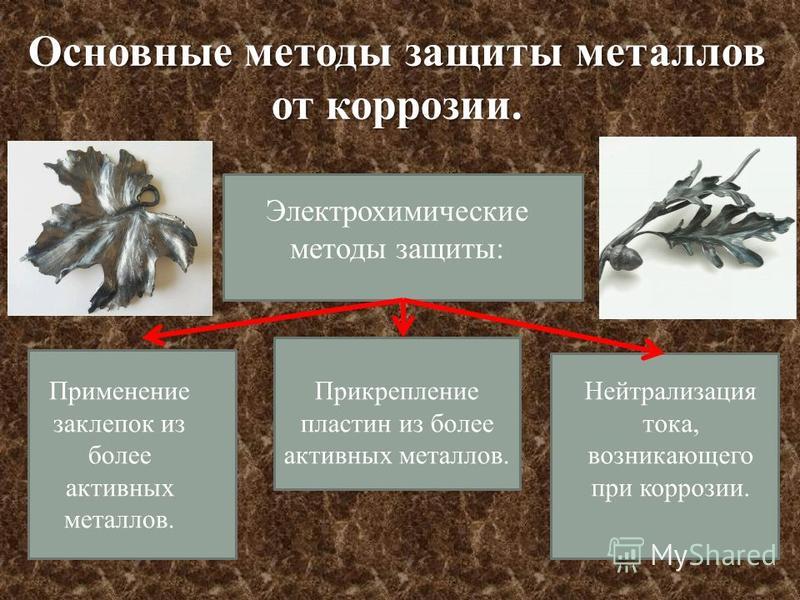 Электрохимическая
Электрохимическая
защита:
а)
катодная
защита. Защищаемую
конструкцию присоединяют к катоду
внешнего источника тока, в результате
она становится катодом, не окисляется,
на ней идет восстановление компонентов
среды. В качестве анода применяют любой
металлический лом, ко-торый присоединяют
к аноду внешнего источника тока. Таким
способом защищают, например, подземные
трубопроводы;
б)
протекторная
защита. Защищаемый
металл соединяют с более активным
металлом, имеющим меньший электродный
потенциал. Последний служит анодом,
растворяется и защищает основной металл.
Так цинк является протектором для
стального корпуса судна:
(А)
Zn | Н2О/
О2|
Fe (К)
Анод:Zn-2е
=Zn2+
Катод:
Н2О
+ О2
+ 4e =4ОН.
Для
более активной защиты металлических
конструкций можно совмещать несколько
способов защиты от коррозии, например,
покрытие и катодную электрозащиту.
Коррозия металлов. Способы защиты от коррозии
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Добрый день!
2. Яхта «Зов моря»
3. Колосс Родосский
4. Рухнувший мост в Квебеке
5. Антенная мачта
6. Коррозия металлов. Способы защиты от коррозии.
7. Цель урока:
Сформировать представление
о коррозии металлов как
самопроизвольном
окислительновосстановительном процессе,
ее значении, причинах,
механизме и способах защиты
металлов от коррозии
А.Н. Несмеянов
9.
 Коррозия – от лат. corrodere — разъедать
Коррозия – от лат. corrodere — разъедать
12. Коррозия – это процесс самопроизвольного разрушения материалов и изделий из них под химическим воздействием окружающей среды.
По виду
коррозионной
средКоррозия
металлов.
Способы защиты
металлов от
Газовая
коррозии.ы
Жидкостная
Атмосферная
Почвенная
Блуждающими
токами
По характеру
разрушения
Сплошная
Местная
Межкристаллитная
По процессам
Химическая
Электрохимическая
Газовая
Атмосферная
По виду
коррозионной среды
Жидкосная
Почвенная
Блуждающие тока
15. По характеру разрушений
16. Сплошная коррозия
Равномерная
Неравномерная
17. Местная коррозия
Язвенная
Точечная
Пятнами
18. Химическая коррозия
Химическая коррозия – самопроизвольное разрушение металлов
в среде окислительного газа (кислорода, галогенов и т.д.) при
повышенных температурах или в жидких неэлектролитах.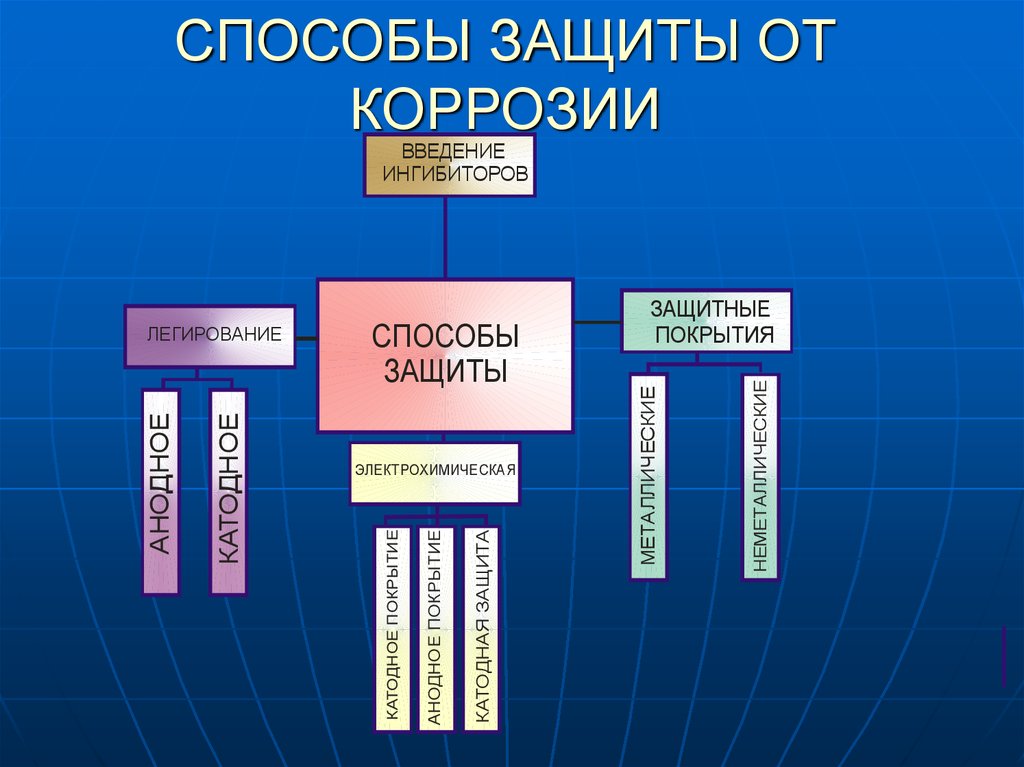
Газовая
2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
В жидких
неэлектролитах
• В нефти
• В сере
• В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
19. Электрохимическая коррозия
Электрохимическая коррозия – самопроизвольный
процесс разрушения металлов в среде электролитов или при контакте
с менее активным металлом.
Me – ne = Me +n
2Сu + O2+ 2h3O + CO2= CuCO3∙Cu(OH)2
О2 О2
О2
4Fe + 3O2 + 6h3O = 4Fe(OH)3
Fe — 3е- → Fe3+
Ущерб, наносимый коррозией
Мировая потеря 20 млн. тонн металла в год
Еще более значимы косвенные потери
Факторы, влияющие на
скорость коррозии
( лабораторные исследования)
1 стакан: Fe + h3O
2 стакан: Fe + р-р NaCl
3 стакан: Fe, Cu + р-р NaCl
4 стакан: Fe, Zn + р-р NaCl
5 стакан: Fe + р-р (NaCl + NaOH)
23. Защита металлов от коррозии
«Просто знать – ещё не
всё, знания нужно уметь
использовать»
Гёте
24.
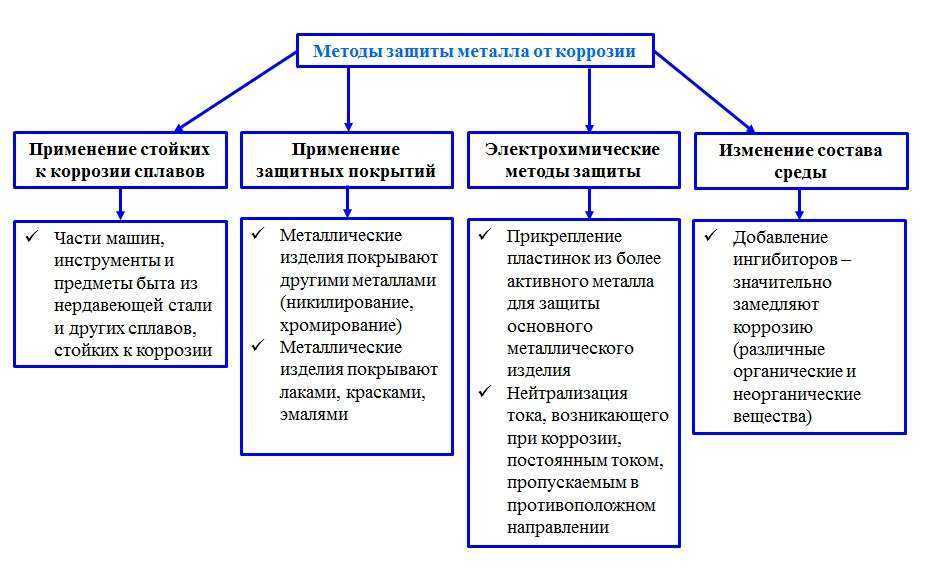 Нанесение защитных покрытий
Нанесение защитных покрытий
•Краска
•Лак
•Грунтовка
•Смола
•Эмаль
Пластмасса
Масло
25. Покрытие антикоррозионным металлом
Никелирование
Хромирование
Оцинковка
26. Покрытие антикоррозионным металлом
Покрытие
алюминием
Лужение
Позолота
27. Нержавеющие стали
Co
Cu
Cr
Ni
28. Применение ингибиторов
Ингибиторы — это вещества,
способные замедлять протекание
химических процессов или
останавливать их.
Известно более 5 тысяч
29. Протекторная защита
О2 О2
Zn
анод
О2
Zn — 2е- → Zn2+
Fe
катод
Zn более активный металл, чем Fe
Делийская
железная колонна
Возраст 1600 лет
Высота 7, 2 м,
вес около 6,5 тонн
31. Тренировочный тест
1. Слово “коррозия” в переводе с латинского означает:
а) разрушать;
б) разъедать;
в) ржаветь.
2. Требуется скрепить железные детали. Каким металлом
целесообразно воспользоваться
а) медью;
б) цинком;
в) свинцом.
3. Окисление металла в среде неэлектролита:
а) электрохимическая коррозия;
б) язвенная коррозия;
в) химическая коррозия.
4. Разрушение металла, находящегося в контакте с другим
металлом в присутствии водного раствора электролита:
а) газовая коррозия;
б) электрохимическая коррозия;
в) химическая коррозия.
5. Эмалирование это:
а) защитное неметаллическое покрытие металла;
б) электрохимический метод защиты металлов от коррозии;
в) способ придания красоты металлическому изделию.
6. Легирование это:
а) специальное введение в сплав элементов, замедляющих
процесс коррозии;
б) покрытие железного листа слоем олова;
в) создание контакта с более активным металлом.
7. Вещества, замедляющие процесс коррозии называются:
а) протекторы;
б) электроды;
в) ингибиторы.
8. Присоединение к защищаемому металлу другого, более
активного металла называется:
а) металлопокрытие;
б) контактная защита;
в) протекторная защита.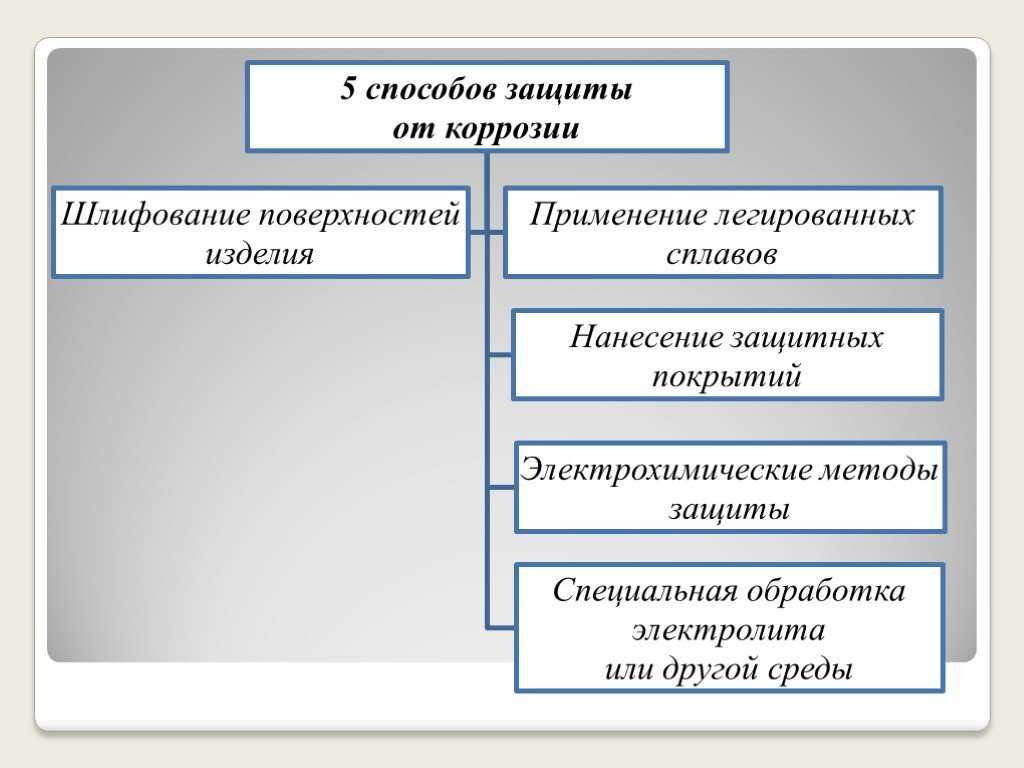
9. Процесс ржавления металла можно наблюдать при коррозии:
а) железа;
б) алюминия;
в) цинка.
10. По характеру разрушений выделяют:
а) повсеместную коррозию;
б) сплошную;
в) разрозненную.
11. Некоторые металлы не подвергаются коррозии, т.к. они
покрыты:
а) защитным покрытием;
б) водонепроницаемым покрытием;
в) оксидной плёнкой.
12. Для протекания электрохимической коррозии необходимо
наличие:
а) воздуха;
б) раствора электролита;
в) органического растворителя.
Ключ к тесту
1–б
2–б
3–в
4–б
5–а
6–а
7–в
8–в
9–а
10 – б
11 – в
12 — б
36. Домашнее задание
& 13(с. 47-51 выучить), упр. № 1, 2 с. 86
(выполнить письменно)
Дополнительное задание № 1: Склёпаны 2
металла. Укажите, какой из металлов
подвергается коррозии а) Mn – Al; б) Sn – Bi
Дополнительное задание № 2: Образец латуни
(медь + цинк) массой 200 грамм с массовой
долей меди 60 % обработали избытком
соляной кислоты. Определите объём газа,
Определите объём газа,
который выделится (н.у.)
English
Русский
Правила
Как предотвратить коррозию — Cor Pro
Коррозия – это разрушение металлов в результате химической реакции с окружающей средой. Коррозия возникает из-за окисления металлов из-за воздействия катализаторов, таких как воздух и вода. Когда металлы реагируют на коррозионные катализаторы, возникает коррозия, и они медленно разрушают металлы до полной деградации.
Существуют различные формы коррозионного воздействия на металлы. Каждый тип коррозии зависит от уровня воздействия катализатора на металл, а также от типа металла, подверженного коррозии.
Ржавчина является наиболее распространенной формой коррозии с одинаковым уровнем деградации на всех участках оборудования. Другие типы коррозии включают гальваническую коррозию, щелевую коррозию, точечную коррозию, межкристаллитную коррозию, селективное выщелачивание, эрозию и коррозию под напряжением.
Коррозия — естественный процесс, но надлежащее управление коррозией может замедлить его с помощью экспертов в отрасли. Надлежащие методы защиты от коррозии требуют современного оборудования, обширных знаний в области управления и предотвращения коррозии, а также обученного персонала, готового работать с любой формой коррозионного воздействия.
Надлежащие методы защиты от коррозии требуют современного оборудования, обширных знаний в области управления и предотвращения коррозии, а также обученного персонала, готового работать с любой формой коррозионного воздействия.
Почти 30 лет компания Cor-Pro Systems возглавляет антикоррозионную отрасль на побережье Мексиканского залива и предлагает своим клиентам только лучшие услуги по защите от коррозии.
Типы методов предотвращения коррозии
Существуют различные способы предотвращения коррозии металлов. Эти методы различаются в зависимости от различных переменных, таких как тип металла, окружающая среда, тип коррозионного агента и других, чтобы обеспечить эффективную защиту от коррозии, которая может действовать в течение длительного времени.
Среди наиболее распространенных методов защиты от коррозии:
- Ингибиторы коррозии. Ингибиторы коррозии — это химические вещества, добавляемые в оборудование для образования тонкого слоя защиты от катализаторов коррозии.
 Эти присадки добавляются даже во время работы защищаемой машины. Хотя ингибиторы смешиваются с жидкостью во время нанесения, последняя не влияет на качество добавок. Хранилища жидкостей являются одними из частых клиентов, которые получают ингибиторы коррозии.
Эти присадки добавляются даже во время работы защищаемой машины. Хотя ингибиторы смешиваются с жидкостью во время нанесения, последняя не влияет на качество добавок. Хранилища жидкостей являются одними из частых клиентов, которые получают ингибиторы коррозии. - Покрытия. Покрытие — самый простой способ защитить ваше оборудование. Покрывающие материалы, такие как эпоксидная смола, уретан и цинк, могут добавить дополнительный уровень защиты вашим объектам при правильном нанесении и отверждении. Покрытия зависят от защищаемого материала и типа используемого химического соединения.
- Абразивоструйная очистка. При абразивоструйной очистке используется высокоскоростная машина, которая перемещает среду к поверхности материала. При этом вы можете контролировать ущерб, вызванный коррозией, и подготовить его к нанесению антикоррозионных материалов. Обычно абразивоструйную очистку проводят непосредственно перед нанесением на поверхность оборудования других антикоррозионных материалов.

Преимущества защиты стали от коррозии
Cor-Pro Systems обеспечивает качественную защиту стали от коррозии в Хьюстоне, штат Техас, и других районах побережья Мексиканского залива. Ниже приведены преимущества получения высококачественной защиты стали от коррозии с помощью Cor-Pro Systems:
- Качественная защита от коррозии может продлить срок службы вашего оборудования на 250% .
- Защита от коррозии может снизить затраты на ремонт из-за коррозионного повреждения.
- Защищенное оборудование может избежать перерывов в обслуживании и сбоев в работе .
- Защита от коррозии может спасти жизни от травм, вызванных атмосферным воздействием оборудования и объектов.
- Предотвращая травмы и ущерб от коррозии оборудования, компании могут избежать юридических и экологических обязательств .
Обладая многолетним опытом работы с самыми жесткими методами борьбы с коррозией у широкого круга клиентов, Cor-Pro Systems предоставит специализированные услуги по управлению коррозией стали, которые специально разработаны в зависимости от потребностей клиента.
Скорость: часть приверженности Cor-Pro «золотому стандарту Cor-Pro» Cor-Pro Gold Standard», высшая сертификация в области защиты от коррозии.
С помощью нашего сервиса Velocity вы получите готовые проекты по защите от коррозии в течение нескольких часов, а не дней. Кроме того, наш высококвалифицированный персонал позаботится о том, чтобы вы были в курсе наших проектов по мере их реализации.
О Cor-Pro Systems
С 1987 года Cor-Pro Systems Inc. обеспечивает первоклассную защиту от коррозии в Хьюстоне и других районах побережья Мексиканского залива. Наша цель — повысить осведомленность о коррозии и ее влиянии на всю отрасль, а также обеспечить удовлетворительную защиту от коррозии с помощью наших качественных методов, основанных на многолетних обширных исследованиях и разработках.
Помимо нашего беспрецедентного опыта в обеспечении защиты от коррозии для наших клиентов, мы также поддерживаем долгосрочные отношения с нашими партнерами в отрасли, чтобы гарантировать, что они никогда не столкнутся с инцидентами, связанными с коррозией в будущем.
Высококачественные методы борьбы с коррозией с помощью Cor-Pro Systems, Inc. электронная почта на
Три режима защиты от коррозии
При всем том, что мы говорим о защите от коррозии, у вас может возникнуть соблазн подумать, что существует миллион способов сделать это. Но на самом деле защитные покрытия обеспечивают защиту от коррозии одним из трех способов.
По сути, они либо блокируют соединение необходимых элементов, чтобы начать процесс коррозии, активно предотвращают возникновение электрохимической реакции, либо направляют процесс коррозии в направлении, которое в конечном итоге не наносит вреда активу.
Вот как работает каждая из этих трех стратегий:
Барьерные покрытия
Барьерные покрытия предназначены для предотвращения контакта воды, кислорода и других химических веществ с подложкой. На самом деле считается само собой разумеющимся, что некоторое количество воды и кислорода достигнет поверхности, которую защищают барьерные покрытия. Но поскольку вода, которая проходит через барьерное покрытие, не имеет значительного заряда (это означает, что в воде нет высокой концентрации ионов), не все основные элементы, необходимые для запуска процесса коррозии, присутствуют.
Но поскольку вода, которая проходит через барьерное покрытие, не имеет значительного заряда (это означает, что в воде нет высокой концентрации ионов), не все основные элементы, необходимые для запуска процесса коррозии, присутствуют.
Согласно NACE важно, чтобы барьерное покрытие обладало следующими характеристиками:
- Химическая стойкость
- Виброустойчивость
- Хорошие смачивающие свойства для обеспечения равномерного нанесения
- Высокая адгезия даже в присутствии влаги
Большинство покрытий обладают хотя бы некоторыми свойствами барьерного покрытия. В зависимости от обстоятельств некоторые из перечисленных ниже типов защиты от коррозии могут сочетаться с продуктом, специально разработанным с учетом барьерных свойств, для достижения максимальной защиты.
Термические барьерные покрытия являются одним из наиболее часто используемых примеров этого типа защиты от коррозии. Они используются для защиты от влаги на подложках, которые обычно нагреваются до очень высоких температур. Поскольку между слоем изоляции и подложкой часто создается зазор, любая влага, попадающая на поверхность, может вызвать процесс коррозии в отсутствие барьерного покрытия. Известная как коррозия под изоляцией (CUI), это распространенная проблема, которую призваны решить теплозащитные покрытия.
Поскольку между слоем изоляции и подложкой часто создается зазор, любая влага, попадающая на поверхность, может вызвать процесс коррозии в отсутствие барьерного покрытия. Известная как коррозия под изоляцией (CUI), это распространенная проблема, которую призваны решить теплозащитные покрытия.
Ингибирующие покрытия
Находящиеся в грунтовочной части системы покрытий, ингибирующие покрытия состоят из пигментов, которые активно препятствуют химическим реакциям. Эти покрытия были разработаны для предотвращения коррозии. Они делают это, мешая электролитам, необходимым для запуска процесса коррозии.
Свинцовый сурик является хорошо известным примером ингибиторного покрытия, поэтому он так широко использовался до того, как были полностью осознаны вредные последствия воздействия свинца. Поскольку свинцовые пигменты стали строго регулироваться в конце 19В 70-х годах эта стратегия коррозионной стойкости была жестко регламентирована до такой степени, что больше не использовалась широко в Соединенных Штатах.
Защитные покрытия
Защитные покрытия представляют собой бескорыстную породу покрытий, состоящую из металла, обычно цинка, который корродирует преимущественно по сравнению со сталью. По сути, этот метод захватывает процесс коррозии и направляет его в направлении, которое не будет вредным для актива, для защиты которого предназначено покрытие. Чтобы быть эффективными, расходуемые покрытия (также иногда называемые «катодной защитой») должны наноситься непосредственно на черный металл, такой как сталь.
Поскольку расходуемые покрытия, такие как неорганические и органические цинковые грунтовки, предназначены для нанесения непосредственно на подложку, их часто комбинируют с верхними покрытиями, обладающими другими барьерными свойствами, для комбинированной защиты от коррозии.
Цинковые грунтовки являются отличными примерами катодной защиты подложки. Цинк не только корродирует преимущественно сталь, но и, как правило, корродирует медленнее, чем другие расходуемые покрытия, что позволяет увеличить промежутки времени между нанесением покрытия.


 Эти присадки добавляются даже во время работы защищаемой машины. Хотя ингибиторы смешиваются с жидкостью во время нанесения, последняя не влияет на качество добавок. Хранилища жидкостей являются одними из частых клиентов, которые получают ингибиторы коррозии.
Эти присадки добавляются даже во время работы защищаемой машины. Хотя ингибиторы смешиваются с жидкостью во время нанесения, последняя не влияет на качество добавок. Хранилища жидкостей являются одними из частых клиентов, которые получают ингибиторы коррозии.
