Содержание
Основные способы защиты металлоизделий от коррозии
05
Мар
Dasha2022-07-08T13:50:05+03:00
Комментарии к записи Основные способы защиты металлоизделий от коррозии отключены
Коррозия представляет собой процесс разрушения металлопроката из-за воздействия химических или электрохимических воздействий. Простыми словами, это ржавчина, которая возникает в процессе эксплуатации изделий по причине частого контакта металла с влагой, почвой или другой агрессивной средой. Согласно последним подсчетам развитые страны несут около 5 % ущерба от национального дохода в связи с возникновением коррозии, поэтому борьбе с ней уделяется весомое значение.
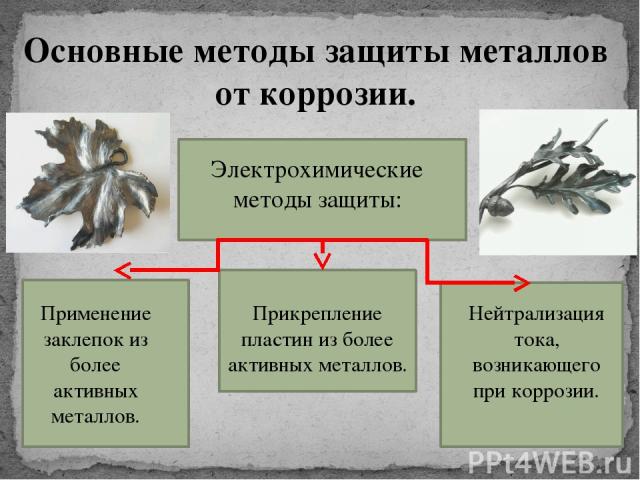
Защита металлов от возникновения ржавчины базируется на ряде принципов:
- Изолирование поверхности от агрессивных факторов;
- Улучшение химсопротивления материала;
- Снижение агрессивности среды;
- Электрохимическая защита.
Некоторые методы используются еще на этапе производства, другие же — в процессе эксплуатации.
Какие из них наиболее эффективны?
Проявляться коррозия на металлических изделиях, в том числе и на двутавровой балке, может по-разному — поверхностное или глубинное проникновение, ржавый слой, окисление компонентов. Метод борьбы с этой проблемой подбирается в зависимости от особенностей условий эксплуатации конструкции. Очень важно определить природу процесса. Это может быть контакт с кислородом, химически активными веществами, влагой, почвой.
Самыми надежными и эффективными защитными мерами с проявлениями ржавчины считаются следующие методы:
- Защитные покрытия;
- Легирование;
- Металлизация;
- Изменение состава материала.
Рассмотрим каждый из них подробнее.
Использование защитных покрытий
Поверхностная защита металлических балок может выполняться как нанесением специальных пленок, так и окрашиванием конструкций. В быту чаще всего для этих целей используется краска, содержащая в своем составе алюминий. Задача такого способа – перекрыть поступление кислорода к поверхности стали, тем самым защитить ее от разрушений. Вне зависимости от состава покрытий к ним предъявляется ряд требований: отличные адгезионные качества, возможность сохранять свои характеристики в агрессивной среде.
Вне зависимости от состава покрытий к ним предъявляется ряд требований: отличные адгезионные качества, возможность сохранять свои характеристики в агрессивной среде.
Главными достоинствами защитных покрытий является простота реализации и доступная цена. Но вот только долговечность их, к сожалению, невелика.
Химические покрытия металла
Основываются на покрытии металлических конструкций специальной пленкой, устойчивой к воздействию кислорода, влаги, перепаду температур. Речь идет о оксидировании, сульфидировании и т.п.
Процедура выполняться может в горячем и холодном состоянии и требует наличия специального оборудования. Есть у этого метода один недостаток — защитная пленка изменяет цвет изделия, что в некоторых ситуациях не совсем уместно.
Легирование
Выполняется на стадии производства изделий. При изготовлении детали, конструкции в металл вводятся специальные добавки. Чаще всего ими является марганец, хром, которые придают стали устойчивости к агрессивной среде.
Например, для возведения высоток используется исключительно легированная сталь для максимальной надежности и защиты от экстремальных климатических условий.
Металлизация
Заключается в покрытии поверхностного слоя деталей присадком расплавленного металла. Процедура выполняется с помощью пульверизатора.
Изменение состава атмосферы
Это может быть вакуумирование или среда инертных газов. Достаточно эффективные способы, но довольно дорогостоящие, так как требуют использования дополнительного оборудования.
Вывод: производители много сил и ресурсов тратят на то, чтобы изделия были устойчивы к коррозии и прослужили долгую службу. В связи с этим можно быть уверенным, что металлоизделия будут надежно защищены от ржавчины, обеспечена максимальная устойчивость и надежность конструкции, но только при условии приобретения ее у надежных поставщиков.
Тема 3 Коррозия металлов и способы защиты от неё. Коррозия металлов
Металлические
материалы — металлы и сплавы на основе
металлов, — приходя в соприкосновение
с окружающей их средой (газообразной
или жидкой), подвергаются с той или иной
скоростью разрушению. Причина этого
Причина этого
разрушения лежит в химическом
взаимодействии: металлы вступают в
окислительно-восстановительные реакции
с веществами, находящимися в окружающей
среде, и окисляются.
Самопроизвольное
разрушение металлических материалов,
происходящее под химическим воздействием
окружающей среды, называется коррозией.
Общая
масса металлических материалов,
используемых в виде различных изделий
в мировом хозяйстве, очень велика.
Поэтому, несмотря на то, что обычно
скорость коррозии мала, ежегодно из-за
коррозии безвозвратно теряются огромные
количества металла. Но еще больший вред
связан не с потерей металла, а с порчей
изделий, вызываемой коррозией. Затраты
на ремонт или на замену деталей судов,
автомобилей, аппаратуры химических
производств, приборов во много раз
превышают стоимость металла, из которого
они изготовлены. Наконец, существенными
бывают косвенные потери, вызванные
коррозией. К ним можно отнести, например,
утечку нефти или газа из подвергшихся
коррозии трубопроводов, порчу продуктов
питания, потерю здоровья, а иногда и
жизни людей в тех случаях, когда это
вызвано коррозией. Таким образом,
Таким образом,
борьба с коррозией представляет собой
важную проблему, а на защиту от коррозии
тратятся большие средства.
Большинство
металлов в реальных условиях способны
разрушаться, переходя в окисленное
состояние. Самым доступным окислителем
для металлов является кислород. Изменение
энергии Гиббса в этом процессе меньше
нуля, т. е. металлы — термодинамически
неустойчивые системы.
К
важнейшим случаям коррозии относятся
химическая и электрохимическая коррозия.
Коррозия
металлов может протекать при взаимодействии
металлов с сухими газами или растворами
неэлектролитов. Такая коррозия называется
химической.
Взаимодействие
металлов с газами (газовая
коррозия)
происходит при повышенных температурах,
когда конденсация влаги на поверхности
металла невозможна. Газовой коррозии
подвергаются арматура печей, детали
двигателей внутреннего сгорания, лопатки
газовых турбин и т. п. Газовую коррозию
претерпевает также металл, подвергаемый
термической обработке.
Механизм
газовой коррозии связан с протеканием
на поверхности раздела твердой и
газообразной фаз двух сопряженных
реакций: окисления металла и восстановления
газообразного окислителя, причем в
пространстве эти два процесса, как
правило, не разделены. В этом же месте
происходит и накопление продуктов
реакции окисления. Для непрерывного
осуществления реакции атомы и ионы
металла, с одной стороны, и атомы или
ионы кислорода или другого окислителя,
с другой, диффундируют сквозь постепенно
утолщающуюся пленку продуктов
коррозии. В результате газовой коррозии
на поверхности металла образуются
соответствующие соединения: оксиды,
сульфиды и др. В зависимости от свойств
образующихся продуктов может происходить
торможение процесса окисления.
Газовой коррозии
подвергаются углеродистые стали, чугуны,
которые взаимодействуя с кислородом
могут терять прочность и твердость,
особенно при повышенных температурах
(300°С и выше):
Fe
+ 02
—> FeO
+ Fe304
+ Fe203
.
Образующаяся
смесь продуктов называется окалиной.
Одновременно
протекает обезуглероживание
поверхностного слоя металла за счет
превращения цементита:
Fe3C
+ 02
—►Fe
+ CO2.
Водород
взаимодействует с имеющимся в стали
углеродом, превращая его в углеводороды
(обычно в метан), что приводит к резкому
ухудшению свойств стали. Поэтому в
присутствии водорода возникает водородная
хрупкость стали
за счет того, что в результате реакции
также происходит обезуглероживание
стали, возникновение микротрещин.
Fe3C
+ H2
—>Fe
+ CH4
Сталь
при температурах выше 200 °С начинает
интенсивно корродировать в присутствии
многих других газов (хлора, оксидов
азота, углерода, серы).
Медь
активно взаимодействует с оксидами
углерода и серы, содержащимися в
атмосфере.
Из цветных металлов
устойчив к газовой коррозии в воздушных
средах никель, а его сплавы с хромом
устойчивы к коррозии даже при температурах,
превышающих 1000 °С.
Основными
способами защиты от газовой коррозии
являются легирование металлов, создание
защитных покрытий и замена агрессивной
газовой среды. Для изготовления
аппаратуры, подвергающейся действию
коррозионно-активных газов, применяют
жаростойкие
сплавы. Для
придания жаростойкости стали и чугуну
в их состав вводят хром, кремний, алюминий;
применяются также сплавы на основе
никеля или кобальта. Защита от газовой
коррозии осуществляется, кроме того,
насыщением в горячем состоянии поверхности
изделия некоторыми металлами, обладающими
защитным действием. К таким металлам
принадлежат алюминий и хром. Защитное
действие этих металлов обусловлено
образованием на их поверхности весьма
тонкой, но прочной оксидной пленки,
препятствующей взаимодействию
металла с окружающей средой. В случае
алюминия этот метод носит название
алитирования,
в
случае хрома — термохромирования.
Для
защиты используют и неметаллические
покрытия, изготовленные из керамических
и керамико-металлических материалов.
17.5: Коррозия и ее предотвращение
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 41640
Цели обучения
- Понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной. Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия – это окислительно-восстановительный процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение.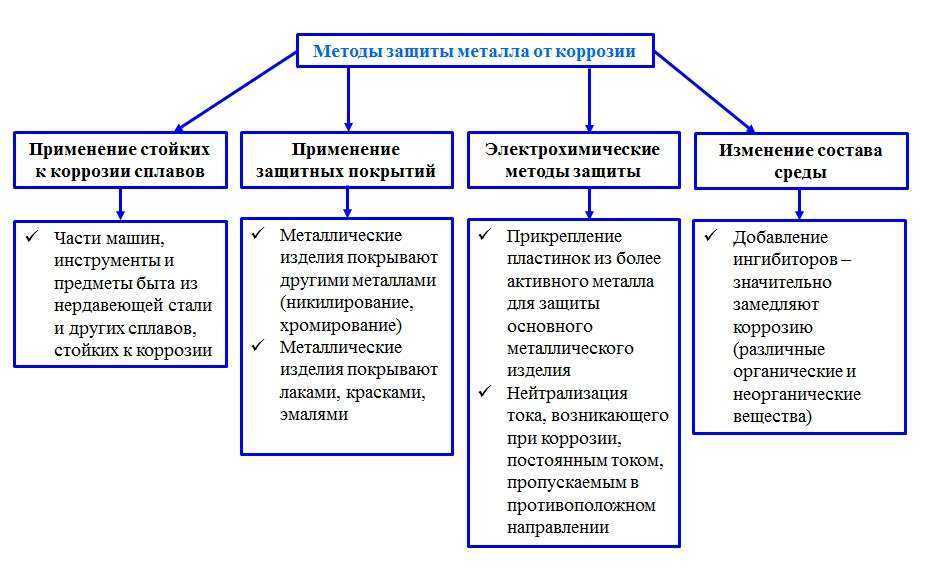 Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов, железо при коррозии образует красно-коричневый гидратированный оксид металла (\(\ce{Fe2O3 \cdot xh3O}\)), известный как ржавчина, который не образует плотной защитной пленки ( Рисунок \(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
Рисунок \(\PageIndex{1}\): Ржавчина, результат коррозии металлического железа. Железо окисляется до Fe 2 + (водн.) на анодном участке на поверхности железа, который часто является примесью или дефектом решетки. Кислород восстанавливается до воды в другом месте на поверхности железа, которое действует как катод. Электроны переходят от анода к катоду через электропроводящий металл. Вода является растворителем для Fe 2 + , который производится изначально и действует как солевой мостик. Ржавчина (Fe 9o_{cell}\) для процесса коррозии (уравнение \(\ref{Eq3}\)) указывают на то, что существует сильная движущая сила для окисления железа O 2 в стандартных условиях (1 M H + ) . В нейтральных условиях движущая сила несколько меньше, но все же заметна (Е = 1,25 В при рН 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)).
Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)).
Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
Рисунок \(\PageIndex{3}\): Гальваническая коррозия. Если железо находится в контакте с более устойчивым к коррозии металлом, таким как олово, медь или свинец, другой металл может действовать как большой катод, который значительно увеличивает скорость восстановления кислорода. Поскольку восстановление кислорода связано с окислением железа, это может привести к резкому увеличению скорости окисления железа на аноде. Гальваническая коррозия, вероятно, возникает всякий раз, когда два разнородных металла соединяются напрямую, позволяя электронам передаваться от одного к другому. 9{2+}}\) (E° = -0,14 В) и Fe 2 + (E° = -0,45 В) в таблице P2 показывают, что \(\ce{Fe}\) легче окисляется, чем \(\ce{Sn}\). В результате более устойчивый к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рис. \(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
Более активный металл реагирует с кислородом и в конечном итоге растворяется, «жертвуя» себя, чтобы защитить железный предмет. Катодная защита — это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защите (защита нижележащей стали от кислорода воздуха), так и катодной защите (после воздействия цинк окисляется раньше, чем нижележащая сталь).
В аналогичной стратегии расходуемые электроды с использованием магния, например, используются для защиты подземных резервуаров или труб (Рисунок \(\PageIndex{4}\)). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Рисунок \(\PageIndex{4}\): Использование жертвенного электрода для защиты от коррозии. Присоединение магниевого стержня к подземному стальному трубопроводу защищает трубопровод от коррозии. Поскольку магний (E ° = -2,37 В) окисляется гораздо легче, чем железо (E ° = -0,45 В), стержень Mg действует как анод в гальваническом элементе. Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Почва между анодом и катодом действует как солевой мост, который замыкает электрическую цепь и поддерживает электрическую нейтральность. Поскольку Mg(s) окисляется до Mg 2 + на аноде, анионы в почве, такие как нитраты, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они восполняют протоны, потребляемые при восстановлении кислорода. Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Пример \(\PageIndex{1}\)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7–10 % олова). 9\circ_{\textrm{overall}} =\textrm{1,68 В}
\end{align*} \nonumber \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии, в порядке снижения затрат и неудобств, следующие: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \(\ref{Eq7}\)).

Цинковый расходуемый анод (округлый предмет, привинченный к нижней части корпуса), используемый для предотвращения коррозии винта в лодке посредством катодной защиты. Изображение Реми Каупп и используется с разрешения.
Упражнение \(\PageIndex{1}\)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме — из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще нужно сделать сантехнику в вашем доме?
- Ответить на
Нет, если только вы не планируете продать дом в ближайшее время, потому что соединения труб \(\ce{Cu/Fe}\) приведут к быстрой коррозии.
- Ответ б
Любые существующие соединения \(\ce{Pb/Fe}\) должны быть тщательно проверены на наличие коррозии железных труб из-за соединения \(\ce{Pb–Fe}\); менее активный \(\ce{Pb}\) будет служить катодом для восстановления \(\ce{O2}\), способствуя окислению более активного \(\ce{Fe}\) поблизости.

Резюме
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Ухудшение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Метки
Методы предотвращения коррозии | Типы коррозии
Эта жидкость может быть или не быть абразивной.
Точечная коррозия
При этом типе коррозии эрозия неравномерна по поверхности.
металл.
Это связано с тем, что металл находится в стабильной жидкости или низкоскоростном
жидкость.
Щелевая коррозия
Эти типы коррозии обычно возникают там, где болты и гайки, соединения внахлестку
из-за чего могут возникнуть трещины.
Коррозия ячейки концентрации
Это происходит, когда поверхность находится в электролитической среде, где
концентрация агрессивной жидкости или количество растворенного кислорода
варьируется.
Графитная коррозия
Это потеря части железа в отливке.
железо из-за проживания в соленой воде или кислоте.
Графит остается на месте, а металл становится мягким и
слабый.
Гальваническая коррозия
Это вызвано соединением двух металлов с разными электродными потенциалами в
агрессивная электролитическая среда.
В этой коррозии глубокие ямы и
на поверхности анодированного металла образуются канавки.
Взаимодействие двух разнородных металлов может привести к гальванической коррозии.
Будет деформироваться только один металл, который будет меньше
стабилен и будет находиться внизу на элементарной диаграмме.
Например, если латунь или медь подвергаются воздействию железа, железо начинает разлагаться.
Этот процесс будет продолжаться до полного истощения железа.
Теперь мы узнаем, каковы методы предотвращения коррозии?
Существуют следующие распространенные методы предотвращения коррозии:
- Окраска
- Грунтовка
- Гальваника
- Гальваника
- Хромирование
- Плакирование
- Серебрение
- 0
Золотое покрытие - Никелирование
- Меднение
- Родирование
- Цинкование
- Кадмирование
- Лужение
- Воронение
- Калоризация
Покраска
Роспись металла выполняется как для консервации, так и для украшения.
Перед покраской поверхность металла должна быть тщательно очищена от окисления, прокатной окалины, ржавчины, жиров или смазок, пыли и т.п.
Которые должны быть удалены напильником, наждаком, шлифовкой и т.п.
Используемый метод должен не только очистить металл, но и немного протравить его, чтобы обеспечить хорошую связь между краской и металлом.
Грунтовка
Сразу после подготовки и очистки лакокрасочной поверхности очень важно нанести на нее подходящую грунтовку, чтобы на металлической поверхности не было дальнейшего окисления.
В основном для стали используется грунтовка из сурика, сурика или хромата цинка.
Для меди рекомендуется использовать хромат цинка.
Для
алюминий и оцинкованное железо, рекомендуется использовать травильный грунт или цинк
хромат.
Гальваническое покрытие
Гальваника – это процесс нанесения одного металла на другой с помощью
гидролиз, предназначенный для защиты от коррозии.
Гальваническое покрытие также относится к особому типу, такому как меднение,
серебрение и хромирование.
Гальваническое покрытие широко используется в таких отраслях, как автомобилестроение, электроника, ювелирные изделия и т. д.
Этот процесс в основном заключается в использовании электролитических элементов.
Он должен дать отрицательный заряд металлу и быть погруженным в
раствор, содержащий соль металла (электролит) и имеющий
положительно заряженный ион металла.
Тогда из-за отрицательных и положительных
заряд, два металла притягиваются друг к другу.
Есть много металлов, которые можно использовать для покрытия.
Следовательно, необходимо выбрать правильный тип электролита.
Некоторые электролиты – кислотно-щелочные, соли металлов или расплавленные
соли.
Цинкование
В этом процессе используются цинковые покрытия.
на стали или железе, чтобы предотвратить коррозию.
Наиболее распространенным методом является горячее погружение, при котором деталь погружается в ванну с
расплавленный цинк.
Оцинковка защищает нижнее железо или сталь в
следующими основными способами:
1. Цинковое покрытие, если оно не повреждено, не пропускает коррозионно-активный материал
переходить к стали или железу.
2. Цинк действует как жертвенный анод, который сохраняет
оставшийся цинк из открытой стали, даже если
есть царапина на покрытии.
3. Для достижения лучших результатов нанесение хроматов на цинк рассматривается как
индустриальное направление.
Хромирование
Хромирование – это гальванический процесс,
какая хромовая кислота, называемая шестивалентным хромом,
используется.
Хромирование часто используется в декоративных целях, но также
повышает устойчивость к коррозии и трению.
Плакирование
Плакирование — это соединение двух разнородных металлов. Это
отличается от сварки или склеивания.
Это делается путем удаления двух металлов из красителя и прессования или
прокатка листов под высоким давлением.
Серебряное покрытие
Это процесс, при котором проводящая поверхность покрывается серебром для предотвращения коррозии и одновременного придания блестящего блеска.
Серебрение бывает разных видов, от матового до блестящего и полублестящего.
В то время как некоторые покрытия могут быть выполнены без хромата, другие используют хромат.
Также возможно покрытие чистым серебром. Самый распространенный
серебрение используется для украшения украшений, тарелок, кубков и др.
трофеи.
Результатом этого процесса является хорошая полировка поверхности покрытия.
Позолота
Золото известно своей высокой стойкостью
окислению и электропроводности.
Этот процесс часто
используется для улучшения проводимости электрических разъемов, таких как ювелирные изделия и
части электроники.
Никелирование
Никель – известный материал для покрытия. Это используется для
Это используется для
хорошая декоративная и коррозионная стойкость.
Обычно используется для нанесения покрытий на предметы домашнего обихода, такие как дверные петли, ножи и душевые принадлежности.
Меднение
Меднение также известно для
металлическое покрытие в применениях, требующих высокой проводимости
по низким ценам.
Он известен тем, что наносит покрытие на электронные компоненты, такие как печатные платы.
Медь – один из самых дешевых металлов для покрытия из-за
благодаря высокой эффективности покрытия и низкому потреблению материала
цена.
Покрытие родием
Родий — это разновидность платины, которая устойчива к царапинам и придает поверхности блеск.
Покрытие родием используется в ювелирном производстве, особенно там, где
есть необходимость сделать покрытие из белого золота.
Цинковое покрытие
Цинковое покрытие часто используется в автомобильной промышленности.
Цинковое покрытие противостоит окислению и
коррозия.
Автомобильные доски и другие металлические детали, такие как гайки и болты,
крепеж, автомобильные детали оцинкованы.
Кадмирование
Кадмирование улучшает адгезию, смазывающую способность и коррозионную стойкость.
Толщина кадмиевого покрытия обеспечивает достаточный износ
защиты, несмотря на то, что он очень маленький.
Кадмий можно эффективно покрывать
практически все токопроводящие металлы.
Лужение
Лужение эффективно в тех случаях, когда требуется нетоксичность, высокая пластичность, хорошая растворимость и повышенная устойчивость к коррозии.
Эти преимущества полезны для
электронная промышленность и пищевая промышленность.
Воронение
Воронение используется для создания защитного покрытия на стали.
часть.
Процесс окисления обеспечивает некоторую защиту от
коррозия.





