Содержание
§42. Кислотные аккумуляторы | Электротехника
Принцип действия. Аккумулятором называется химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от
Рис. 158. Заряд (а) и разряд (б) аккумулятора
постороннего источника (рис. 158,а). Этот процесс, называемый зарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 158, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы, которые имеют значительно больший срок службы, чем кислотные. Кислотные аккумуляторы ТН-450 применяют только на тепловозах, они имеют емкость 450 А*ч, номинальное напряжение — 2,2 В. Аккумуляторная батарея 32 ТН-450 состоит из 32 последовательно соединенных аккумуляторов; буква Т означает, что батарея установлена на тепловозе, буква Н — тип положительных пластин (намазные).
Устройство. В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
Пластины аккумулятора могут иметь конструкцию поверхностного или намазного типа. Пластины поверхностного типа отливают из свинца; поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию ребер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
В аккумуляторных батареях тепловозов применяют пластины намазного типа (рис. 159, а). Такие пластины имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой.
Ячейки пластин после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий. Эти листы предотвращают возможность выпадания из пластин активной массы и не препятствуют в то же время доступу к ней электролита.
Исходным материалом для изготовления пасты для положительных пластин служит порошок свинца Pb, а для отрицательных— порошок , перекиси свинца PbO2, которые замешиваются на водном растворе серной кислоты. Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемые расширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Намазные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массы и размеров аккумулятора и позволяет получать при разряде большие токи.
Рис. 159. Устройство пластин (а) и общий вид (б) кислотного аккумулятора: 1 — блок намазных отрицательных пластин; 2 — выводные штыри; 3 — блок панцирных положительных пластин; 4 — панцирь; 5 — активная масса; 6 — отверстие с пробкой для заливки электролита; 7 — крышка; 8 — эбонитовый сосуд; 9 — пространство для осаждения шлама
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2 и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2 и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
В некоторых аккумуляторах применены положительные пластины панцирного типа. В них каждая положительная пластина заключена в специальный панцирь (чехол) из эбонита или стеклоткани. Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 159,б) так, чтобы между каждыми двумя
Рис. 160. Прохождение через электролит положительных и отрицательных ионов при разряде (а) и заряде (б) кислотного аккумулятора
пластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
Разряд и заряд. При разряде аккумулятора (рис. 160, а) положительные ионы H2+ и отрицательные ионы кислотного остатка
S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному
1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает
разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результате
электрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2 положительного
электрода и ионов сернокислого остатка S04— со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04— — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04— — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
PbO2 + Pb + 2H2SO4 ? 2PbSO4 + 2H2O
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Номинальный разрядный ток численно равен 0,1СНОМ, максимальный при запуске дизеля (стартерный режим) — примерно 3СНОМ, зарядный ток — 0,2 СНОМ, где СНОМ — номинальная емкость.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8—1,7 В (рис. 161), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстанавливается до среднего значения 2 В. Это явление носит название «отдыха» аккумулятора. При нагрузке подобного «отдохнувшего» аккумулятора напряжение быстро понижается, поэтому измерение напряжения аккумулятора без нагрузки не дает правильного суждения о степени разряда.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6—2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
Уход за аккумуляторами. Кислотные аккумуляторы быстро теряют емкость или даже приходят в полную негодность при
Рис. 161. Кривые напряжения кислотного аккумулятора при заряде и разряде
неправильной эксплуатации. В них происходит саморазряд, в результате которого они теряют свою емкость (примерно 0,5— 0,7 % в сутки). Для компенсации саморазряда неработающие аккумуляторные батареи необходимо периодически подзаряжать. При загрязнении электролита, а также крышек аккумуляторов, их выводов и междуэлементных соединений происходит повышенный саморазряд, быстро истощающий батарею.
Батарея аккумулятора должна быть всегда чистой, а выводы для предохранения от окисления покрыты тонким слоем технического вазелина. Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.
Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.
Теория работы свинцово-кислотного аккумулятора 🔋
В свинцово-кислотном аккумуляторе основные продукты реакции, происходящие между положительным и отрицательным электродами аккумулятора в водном растворе серной кислоты, подчиняются так называемой теории двойной сульфатации в соответствии с уравнением:
⇐ заряд Pb + PbO2 + 2H2SO4 ⇐ ⇒ 2PbSO4 + 2H2 O (1) разряд ⇒
Этому соотношению подчиняется взаимодействие активных веществ в аккумуляторе во время разряда, заряда, подзаряда, а также во время бездействия (холостого хода).
Основные соотношения между реагентами при бездействии (при разомкнутой внешней цепи аккумулятора) определяются следующими реакциями:
— на отрицательном электроде:
2H+ + 2e- ⇒ H2↑ анодная полуреакция
Pb + SO42- ⇒ PbSO4 + 2e- катодная полуреакция
Pb + H2 SO4 ⇒ PbSO4 + H2↑ общая реакция (2)
— на положительном электроде:
PbO2 + 4H+ + SO42- + 2e- ⇒ PbSO4 + 2H2 O катодная полуреакция
H2 O ⇒ 1/2 O2 ↑ + 2H+ + 2e- анодная полуреакция
PbO2 + H2 SO4 + H2O ⇒ PbSO4 + 2H2 O + 1/2 O2↑ общая реакция (3)
Приведенные уравнения реакций на отрицательном и положительном электродах показывают, что даже при разомкнутой внешней цепи аккумулятора в нем происходит образование сульфата свинца на обоих электродах, снижение плотности электролита, а также разложение воды с выделением газообразных водорода и кислорода, что приводит, таким образом, к снижению емкости аккумулятора, т. е. к саморазряду. Объем продуктов этих реакций зависит от концентрации серной кислоты (плотности электролита), температуры, состава сплава решеток и активной массы электродов, возраста аккумулятора и других причин.
е. к саморазряду. Объем продуктов этих реакций зависит от концентрации серной кислоты (плотности электролита), температуры, состава сплава решеток и активной массы электродов, возраста аккумулятора и других причин.
При подключении к аккумулятору нагрузки токообразующий процесс подчиняется уравнению (1) для фазы разряда. На отрицательном электроде (на границе раздела свинец — сульфат свинца) происходит образование электронов, поступающих во внешнюю цепь:
Pb ⇒ Pb2+ + 2e-
На положительном электроде на границе раздела окись свинца -сульфат свинца происходит поглощение электронов, поступающих через замкнутую внешнюю цепь, и образование воды:
PbO2 + 4H+ + 2e- ⇒ Pb2+ + 2H2 O
Анионы свинца , связываясь с кислотным остатком, образуют на обоих электродах сульфат свинца, покрывающий поверхность активных масс пластин.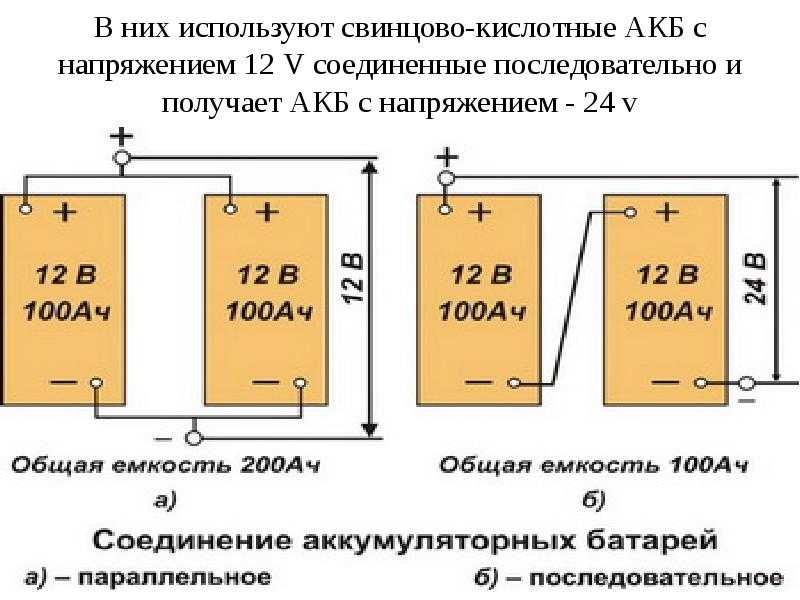 По мере разряда концентрация серной кислоты в электролите убывает.
По мере разряда концентрация серной кислоты в электролите убывает.
₽20 590
В корзину
₽16 190
В корзину
₽15 990
В корзину
При подключении аккумулятору зарядного устройства токообразующий процесс проходит согласно уравнению (1) для фазы заряда.
На отрицательном электроде анионы свинца, образованные из сульфата свинца при растворении в электролите, связываются с электронами, поступающими из внешней цепи, образуя чистый (губчатый) свинец:
Pb2+ + 2e- ⇒ Pb
На положительном электроде процесс протекает согласно реакции (4) с образованием на электроде окиси свинца и отдачи во внешнюю цепь электронов:
Pb2+ + 2H2 O ⇒ PbO2 + 4H+ + 2e- (4)
По мере заряда увеличивается напряжение поляризации аккумулятора, и, когда оно превысит величину перенапряжения по кислороду, на положительном электроде начинает выделяться кислород:
2OH— ⇒ 1/2 O2↑ + H2 O + 2e-
Когда напряжение поляризации превысит величину перенапряжения по водороду, на положительном электроде начинается образование водорода:
2H+ + 2e- ⇒ H2↑
Таким образом, при заряде наряду с образованием на электродах исходных продуктов (свинца и окиси свинца) происходит повышение плотности электролита за счет восстановления серной кислоты, а на последней стадии заряда при повышенном напряжении часть подводимого электричества идет на разложение воды:
H2 O ⇒ H2↑ + 1/2 O2↑
Из других побочных реакций на положительном электроде при заряде следует обратить внимание на образование озона и на окисление (коррозию) решетки, что оказывает решающее влияние на сокращение срока службы аккумулятора.
С уважением,
коллектив Бэттери Сервис
Устройство и параметры свинцово-кислотных аккумуляторов — принцип работы
Основная доля на рынке по-прежнему остается у свинцово-кислотных аккумуляторов. Это обусловлено простотой конструкции и невысокой ценой. Применяемых в них принцип используется многие десятки лет, но со временем он претерпевает разные изменения по увеличению емкости, росту энергетических характеристик и долговечности. Так, например, введение в свинцовый сплав легирующих добавок привело к росту многих практических показателей. Рассмотрим подробнее свинцовый аккумулятор и разберемся с особенностями его работы на химическом и физическом уровнях.
Конструкция АКБ
Устройство свинцово-кислотного аккумулятора не является загадкой. Условно в его конструкции имеется всего три компонента. Это корпус, энергетические ячейки и электролит, но, казалось бы, такое простое устройство постоянно изменяется, водятся какие-то добавки и дополнительные элементы, способствующие росту характеристик. Рассмотрим более подробно, из чего состоит аккумулятор:
Рассмотрим более подробно, из чего состоит аккумулятор:
- Снаружи имеется защитная герметичная оболочка, изготовленная из прочного кислотостойкого пластика. Внутри она разделена на отсеки, в каждой из которых находится электродная пара. Для повышения прочности корпус оснащен внутренними ребрами жесткости. Он должен быть герметичным, так как внутренняя среда способна сильно навредить окружающей. В самых бюджетных модификациях аккумуляторов типа WET также присутствуют пробки для доливки жидкости.
- В каждой ячейке находятся электродные решетки. Они представляют собой пары разнополюсных пластин, которые чередуются. Положительные и отрицательные закреплены к токовым шинам. Электроды — в виде решеток с окном определенного размера и формы. В ранних моделях батарей их изготавливали методом литья под высоким давлением. В современных для введения легирующих добавок их производят методом штампования и ковки. Введение сурьмы и кальция увеличили стойкости к глубоким разрядам, отдачи высоких токов и продлению срока службы.

- В электродных решетках содержится активная паста. На положительных — оксид свинца, на отрицательных — губчатая свинцовая масса. Активная паста накапливает заряд и обеспечивает свободное перемещение электронов между пластинами. Один из электродов изолировано сепаратором, необходимый для исключения возникновения короткого замыкания между банками, когда начнет обсыпаться активная паста.
- В конструкции свинцового аккумулятора имеется 6 энергетических ячеек, которые соединены последовательно. Это сделано для того, чтобы получилось требуемое напряжение 12 В, потому что одна ячейка выдает всего 2 В. Токосъемные электроды вынесены в крышку корпуса батареи. Могут быть в виде конусовидных клемм, лепестков, болтов или углублений под болты. В зависимости от страны производителя и первоначального назначения, АКБ могут быть оборудованы клеммами сверху или на боковой стороне.
Особенности корпуса
Корпус, как и конфигурация клемм, бывает нескольких типов в зависимости от того, для какой машины страны был изготовлен источник постоянного тока. Можно разделить:
Можно разделить:
- на американские с резьбовыми клеммами;
- европейские с технологическим выступом для фиксации на штатном месте в нижней и верхней части;
- азиатские без выступов и клеммы выступают за пределы крышки, что указывает на особенности подключения батареи.
В моделях EFB-типа, это усовершенствованные классические свинцово-кислотные аккумуляторы, применена технология рециркуляции испарений электролита. Сам при этом источник тока считается необслуживаемым, то есть в него не нужно добавлять жидкость. Обычно электролит испаряется во время заряда батареи постоянным током или при потреблении больших токов. Это приводит к нагреву, и кислота начинает испаряться. Поднимаемый пар оседает на внутренней стороне крышки и охлаждается там, обратно сворачиваясь в жидкость и возвращаясь обратно в корпус.
На случай, если внутреннее давление критически возрастет, автоматически откроется спускной клапана. Он есть не на всех моделях батарей, но на всех современных источниках.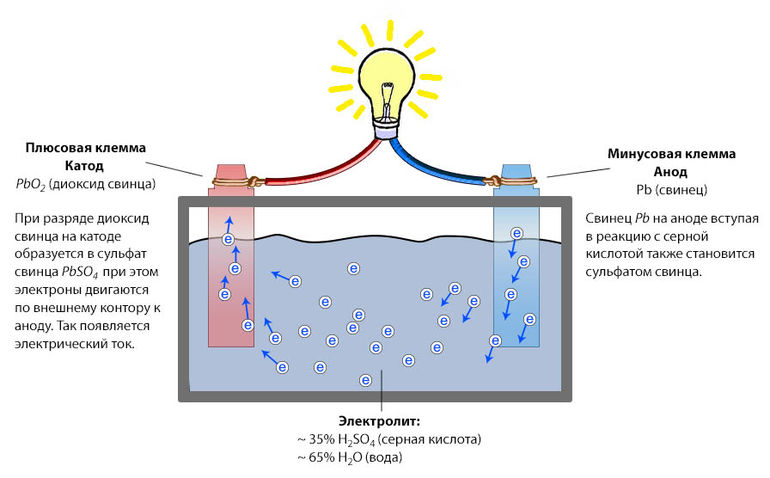 Его наличие позволяет исключить возникновение аварии в случае перегрева или перегрузки.
Его наличие позволяет исключить возникновение аварии в случае перегрева или перегрузки.
Легирование пластин
В общем, конструкция всех модификаций свинцово-кислотных автомобильных аккумуляторов одинаковая. Это касается как стартерных, так и тяговых с большими рабочими токами, которые могут генерироваться в течение длительного времени. Несовершенство первой свинцово-кислотной аккумуляторной батареи было связано со множеством проблем:
- коррозия электродов;
- высокая чувствительность к глубоким разрядам;
- саморазряд;
- утечка электролита и его проникновение опасных испарений в окружающую атмосферу;
- малый срок службы и др.
Все это искоренить, конечно, не получается по многочисленным причинам, но несколько продлить срок эксплуатации АКБ, увеличить отдаваемый ею ток реально. Для этого разработчики стали экспериментировать с составом активной пасты, конструкцией электродов и сплавом, из которого они изготовлены.
В результате проб и ошибок было определено, что в сплав следует добавлять сурьму и кальций. Такой источник получил название гибридный. Сурьма снизила чувствительность к глубоким разрядам, а кальций продлили срок службы, так как он препятствует разрушению свинца. А для получения больших токов в производстве аккумуляторов применяют чистый свинцовый сплав. Чем меньше в нем примесей, тем больше энергии, но в чистом виде он разрушается быстрее.
Применяют следующие типы легирования:
- сурьма-свинец;
- сурьма-кальций;
- кальций-кальций;
- серебро-кальций.
Электродные решетки изготавливают цельнолитыми, то есть, льют в форму под высоким давлением и штампованными. В первом случае из-за высоких температур возможно легирование только добавление сурьмы. Она придает пластинам повышенную прочность и при ее введении электролит начинает закипать уже при 12 В. Для продления срока службы и сохранения высоких токов отдачи в свинцовый сплав стали добавлять кальций.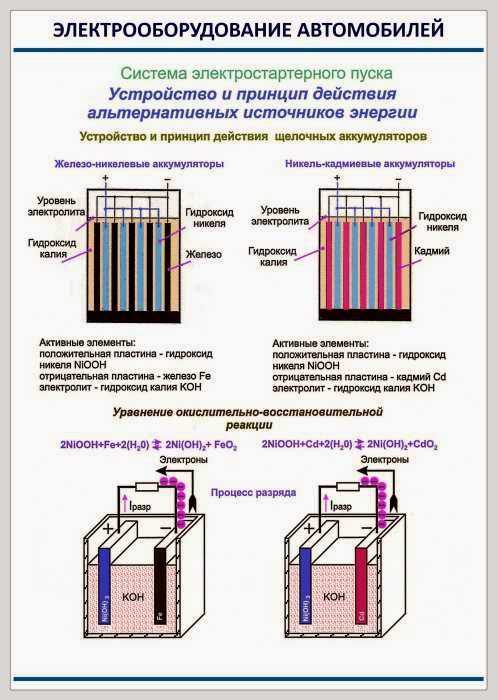
Такие решетки производятся преимущественно методом штампования. Второй электрод остается сурьмянистым. Комбинация металлов увеличивает срок службы и отдаваемее токи. Так, например, обычной свинцово-кислотный аккумулятор с сурьмянистым легированием работает не более 3 лет. Аккумуляторы с кальцием и сурьмой служат вдвое дольше, поэтому и дороже.
Электролит
В свинцово-кислотных аккумуляторах производители применяют 3 типа электролита в зависимости от его состояния:
- Жидкий — привычный всем раствор серной кислоты. Батареи токсичны при зарядке и опасны при аварии, так как кислота попадет в окружающую атмосферу.
- В капиллярном виде в абсорбере. Он представляет собой пористый материал со множеством пустот, которые заполняются кислотой. Так как материал пропитан, то даже при повороте источника постоянного тока вверх ногами батарея не перестанет работать.
- Гелеобразный — тип электролита в виде оксида кремния. Это густая малоподвижная масса, которая надежно обволакивает пластины со всех сторон, обеспечивая максимальный контакт и токоотдачу.
 Именно поэтому эти батареи обладают самыми высокими пусковыми токами и огромным сроком службы. Производитель заявляет о 12 годах работы.
Именно поэтому эти батареи обладают самыми высокими пусковыми токами и огромным сроком службы. Производитель заявляет о 12 годах работы.
Принцип работы
Работа автомобильного свинцово-кислотного аккумулятора основан на двойном преобразовании. В процессе зарядки электрическая энергия в виде тока и напряжения преобразуется в химическую. Во время штатной работы процесс оборачивается, и химическая реакция выделяет ток на зажимах при замыкании цепи. Во время заряда происходит процесс восстановления пластин АКБ и заполнения пустых ест в активной пасте положительно заряженными на плюсовом контакте и отрицательно заряженными частицами на минусовом.
Когда пользователь смыкает цепь, начинается преобразование химической энергии в электрическую, то есть, положительные частицы переходят на отрицательную обкладку с выделением определенного количества энергии через нагрузку. Величина этой энергии и ток зависят от сопротивления в нагрузке.
Пластины
Казалось бы, такая часть АКБ, как электродная пластина, может разнится от одной линейки батареи к другой. Существует две основных технологии производства пластин, но также есть и разные архитектурные решения, которые неизбежно влияют на работу батареи в целом. Простая прямоугольная решетка уже давно не используется. Применяют лучевые конструкции, так как при такой конфигурации токи лучше распределяются по пластине, обеспечивая ее равномерную выработку. В производстве применяются следующие технологии:
Существует две основных технологии производства пластин, но также есть и разные архитектурные решения, которые неизбежно влияют на работу батареи в целом. Простая прямоугольная решетка уже давно не используется. Применяют лучевые конструкции, так как при такой конфигурации токи лучше распределяются по пластине, обеспечивая ее равномерную выработку. В производстве применяются следующие технологии:
- Expandet metal — штамповка с просечкой и вытягиванием;
- Power Frame — в конструкции таких пластин присутствует опорная рамка, внутри которой находятся тонкие жилки.
- Power Pass — в такой архитектуре вертикально расположенные жилки направлены к ушкам пластин.
- Chess Plate — применена шахматная архитектура устройства пластин.
Что такое сульфация?
Важно знать о том, что свинцово-кислотные аккумуляторы со временем изнашиваются. В них появляется выработка, а на пластинах возникают различные наросты. Одним из подобных состояний является сульфация пластин. Он возникает в результате окисления активной пасты в результате длительного нахождения в разряженном состоянии. Белый налет становится настоящим диэлектриком, через который электроны неспособны просочиться. Данное состояние присуще батареям, которые регулярно разряжаются до 80% от начального состояния и долго находятся в таком виде. Существует технология удаления этого налета. Она заключается в зарядке импульсными зарядными и разрядными токами.
Он возникает в результате окисления активной пасты в результате длительного нахождения в разряженном состоянии. Белый налет становится настоящим диэлектриком, через который электроны неспособны просочиться. Данное состояние присуще батареям, которые регулярно разряжаются до 80% от начального состояния и долго находятся в таком виде. Существует технология удаления этого налета. Она заключается в зарядке импульсными зарядными и разрядными токами.
Сохраните эту статью в популярных соц. сетях:
Какой аккумулятор устанавливается на Mazda 6 GG >
В чем различия между кислотными и щелочными аккумуляторами?
На складах и заводах, как всем известно, большой объём работы, грузы всевозможной весовой категории, зачастую без подъёмной техники, например, погрузчиков или штабелеров, просто не обойтись. Данная техника работает благодаря тяговым аккумуляторам, стоит заметить, что тяговые батареи подразделяются на несколько наиболее известных видов – кислотные, щелочные и литий-ионные. Однако, сегодня мы разберем основные отличительные особенности между щелочными и кислотными аккумуляторами.
Однако, сегодня мы разберем основные отличительные особенности между щелочными и кислотными аккумуляторами.
Для начала разберем устройство каждого из представленных аккумуляторов.
Устройство кислотного аккумулятора. Первое, на что стоит обратить внимание, это то, что тяговый кислотный аккумулятор, как правило, состоит из двух групп свинцовых пластин, которые по своему внешнему виду напоминают решётку, при этом сами пластины помещены в серную кислоту.
Теперь рассмотрим устройство щелочного аккумулятора. В данном типе, в основном используются никелевые или железные пластины, которые помещены в раствор едкого калия. Пластины изготавливаются из никелированного железа, с большим количеством отверстий. В качестве электролита у щелочных тяговых аккумуляторов выступает раствор щёлочи.
Одним из немаловажных факторов в сравнении двух вышеперечисленных батарей является – переносимость нагрузок.
В этом вопросе отдельно стоит выделить кислотный тип батарей, так как напряжение одного аккумулятора составляет 2 В. , когда как, у щелочных всего 1,25 В. (Не стоит забывать, что батарея состоит из аккумуляторов. Модели батарей могут состоять из различного количества аккумуляторов, которые, чаще всего встречаются в диапазоне от 6 до 48 штук.)
, когда как, у щелочных всего 1,25 В. (Не стоит забывать, что батарея состоит из аккумуляторов. Модели батарей могут состоять из различного количества аккумуляторов, которые, чаще всего встречаются в диапазоне от 6 до 48 штук.)
Но при этом, при больших отрицательных температурах щелочные батареи свои свойства сохраняют гораздо лучше, нежели кислотные. Сохранение данных свойств во многом зависит от должного обслуживания батареи, а также необходимой качественной подзарядкой. Информируем о том, что устройство зарядки для щелочных батарей довольно таки дорогостоящее. Чтобы зарядное устройство работало гораздо дольше, нужно помнить о том, что щелочные аккумуляторы не стоит доводить до глубокой разрядки и зарядки, всё должно быть в меру.
Далее поговорим об одном из главных критериев в сравнении щелочных и кислотных батарей – срок службы!
В данном вопросе предпочтение с лёгкостью можно отдать щелочным видам батарей. Как мы ранее говорили, щелочные типы при долгом простое сохраняют свои свойства и характеристики эффективнее кислотных. Стойкость никель-железных пластин щелочной батареи гораздо лучше, нежили кислотной, у которой пластины более хрупкие, так как изготавливаются они из свинца с добавками сурьмы. За счёт этого, они подвержены ломкости, соответственно, к кислотным видам батарей стоит относится бережно.
Стойкость никель-железных пластин щелочной батареи гораздо лучше, нежили кислотной, у которой пластины более хрупкие, так как изготавливаются они из свинца с добавками сурьмы. За счёт этого, они подвержены ломкости, соответственно, к кислотным видам батарей стоит относится бережно.
Так же нельзя оставить без внимания моменты по уходу за каждым типом АКБ.
Сначала разберем кислотные батареи:
- Ни в коем случае нельзя оставлять разряженный АКБ более, чем на сутки. Если все же планируется простой, то при дальнейшем хранении батареи необходимо сделать следующее – аккумулятор следует немного разрядить, затем слить старый электролит и, желательно, промыть пластины дистиллированной водой.
- Заряд батареи не должен падать ниже 1,8 В.
- Зарядка аккумулятора происходит при открытых банках, до того момента пока в каждый не начнёт одинаково кипеть электролит.
- Если ваш заряженный аккумулятор некоторое время был в инертном состоянии, то через некоторое время его следует подзарядить.

Основные моменты по эксплуатации щелочных АКБ:
- При зарядке щелочной батареи крышки необходимо обязательно снимать для того, чтобы не допустить перегрева и, как следствие, разрушение аккумулятора. Соответственно, после полной зарядки, их нужно поставить на место.
- Заряд аккумулятора не должен падать ниже 1,1 В.
- По истечении каждого года во время эксплуатации необходимо заново заливать электролит, а в течение года подливать дистиллированную воду.
- Если заряженная батарея некоторое время была в инертном состоянии, то через некоторое время её необходимо подзарядить.
И самое главное, на что обращают свое внимание большинство пользователей батарей – это ценовая политика.
В данном вопросе предпочтение отдаётся кислотным видам аккумуляторов за счёт своей низкой стоимости. Во внимание можно взять даже тот фактор, что они намного лучше переносят сильную разрядку и, соответственно, зарядку с нуля.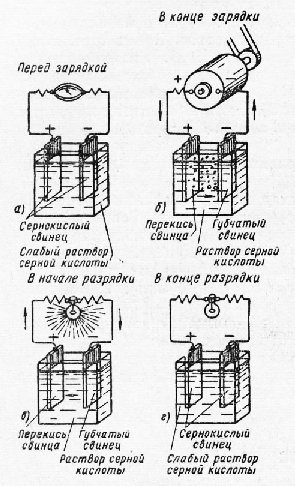 Поэтому им не нужны особенные или специальные зарядки, а подойдут самые обыкновенные и дешёвые.
Поэтому им не нужны особенные или специальные зарядки, а подойдут самые обыкновенные и дешёвые.
Пришла пора делать выводы всему вышеперечисленному – если у вас производство не стоит на месте, и соответственно, вы проводите обслуживание батареи на регулярной основе, то кислотный аккумулятор определенно вам подойдет. Если все же на производстве случаются простои, а батарея обслуживается не регулярно, то лучше приобрести щелочной аккумулятор!
Принцип действия аккумулятора | Аккумуляторные батареи
- Подробности
- Категория: Оборудование
- эксплуатация
- ремонт
- хранение энергии
Содержание материала
- Аккумуляторные батареи
- Электрические характеристики аккумуляторных батарей
- Принцип действия аккумулятора
- Свинцово-кислотные аккумуляторы
- Пластины аккумуляторов
- Сепараторы для свинцово-кислотных аккумуляторов
- Сосуды для свинцово-кислотных аккумуляторов
- Сборка для свинцово-кислотных аккумуляторов
- Железо–никелевые аккумуляторы
- Никель-кадмиевые аккумуляторы
- Серебряно-цинковые аккумуляторы
- Электролит для свинцовых аккумуляторов
- Свойства щелочных электролитов
- Приготовление электролита
- Источники повреждений аккумуляторных батарей
- Заряд аккумуляторных батарей
- Зарядные устройства
- Ремонт аккумуляторных батарей
- Оборудование мастерской по ремонту аккумуляторных батарей
- Ремонт
- Сборка аккумуляторных батарей
- Охрана труда и техника безопасности
- Особенности эксплуатации аккумуляторных батарей на электростанциях и подстанциях
- Основные сведения по монтажу
- Порядок эксплуатации аккумуляторных батарей
- Техническое обслуживание аккумуляторных батарей
Страница 3 из 26
1. 4. Принцип действия аккумулятора
4. Принцип действия аккумулятора
В настоящее время выпускаются следующие типы электрических аккумуляторов: свинцово-кислотные, щелочные железо-никелевые, кадмий-никелевые и серебряно-цинковые аккумуляторы.
Наиболее массовыми типами аккумуляторов являются свинцово-кислотные автомобильные батареи и тяговые щелочные железо-никелевые аккумуляторы. Серебряно-цинковые аккумуляторы находят ограниченное применение из-за дороговизны и дефицитности исходных материалов и сравнительно малого срока службы.
Кислотные аккумуляторы представляют собой сосуд, заполненный электролитом соответствующей плотности, т. е. раствором серной кислоты h3SO4 в дистиллированной воде, в который погружен блок пластин из чистого свинца РЬ и блок пластин из перекиси свинца РЬО2 (рис. 1.7). Вследствие постоянно происходящей диссоциации молекул кислоты в электролите заряженного аккумулятора имеются ионы водорода Н2 (катионы) и ионы кислотного остатка SO4 (анионы). Если пластины аккумулятора замкнуть на некоторое сопротивление, то через него потечет ток. Отрицательно заряженные ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято называть отрицательными, а из двуокиси свинца – положительными.
Отрицательно заряженные ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято называть отрицательными, а из двуокиси свинца – положительными.
При разрядке кислотного аккумулятора происходят следующие химические реакции:
у отрицательной пластины
Pb + SO4 = PbS04;
у положительной пластины
РЬО2 + h3+h3SO4=PbSO4+2h3O.
Рис. 1.7. Устройство и принцип действия кислотного аккумулятора.
Из рассмотренных химических реакций видно, что при разрядке кислотных аккумуляторов на всех пластинах выделяется сернокислый свинец PbSO4 и уменьшается концентрация электролита (вследствие диссоциации кислоты и выделения воды).
Сернокислый свинец обладает двумя недостатками. Во-первых, при интенсивном образовании сернокислого свинца возможно коробление или выпучивание пластин, а также «высыпание» из пластин активной массы, так как объем сернокислого свинца больше объема исходных продуктов, из которых он образуется.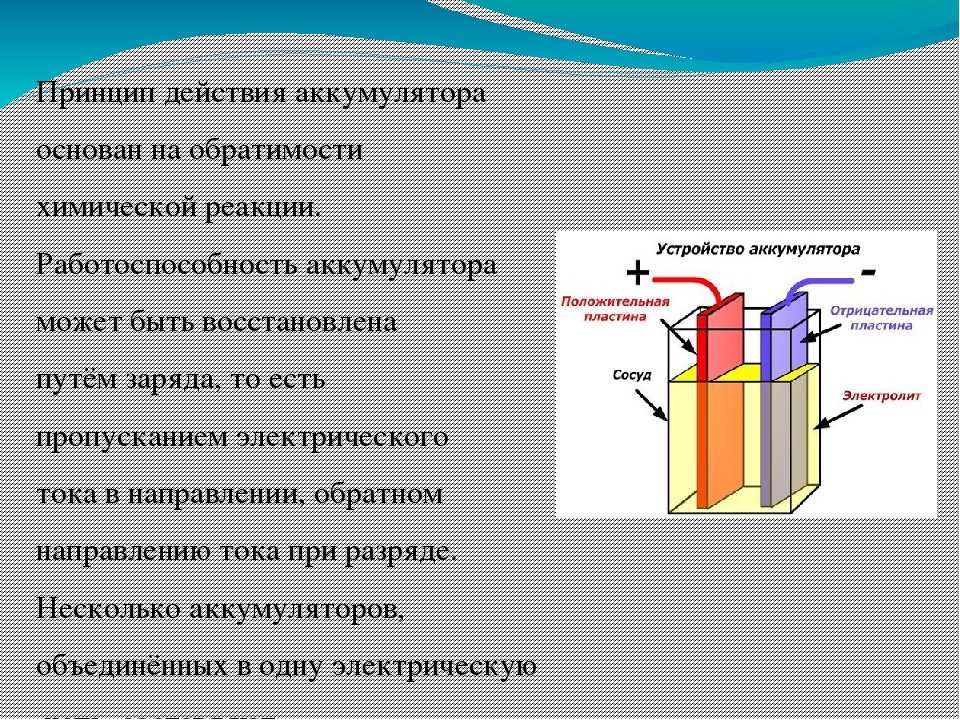 Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора.
Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора.
Зарядка аккумуляторов производится от внешнего источника электроэнергии, генератора постоянного тока или выпрямителя. При зарядке к отрицательным пластинам направляются ионы водорода, а к положительным — ионы кислотного остатка. В результате возникают следующие химические реакции:
у отрицательной пластины
PbS04 + h3 = Pb + h3S04;
у положительной пластины
PbS04 + 2 Н20 + S04 = Рb02 + 2 Н2 + 2 h3SO4.
Следовательно, при зарядке аккумуляторов происходит разложение сернокислого свинца на исходные продукты, а также восстановление концентрации электролита. Очевидно, что окончанием зарядки аккумуляторов можно считать такой момент, когда весь сернокислый свинец разложился и концентрация электролита восстановилась до нормальной. При дальнейшей зарядке потребляемая аккумулятором электрическая энергия будет расходоваться на разложение воды, имеющейся в электролите. Вода разлагается на водород и кислород. Кислород, как наиболее активный газ, производит окисление металлов, имеющихся в аккумуляторе. Водород выделяется в атмосферу. Поэтому на поверхности электролита появляются пузырьки, создающие впечатление «кипения» электролита. В смеси с воздухом водород образует взрывчатый гремучий газ, который должен быть немедленно удален из аккумуляторного помещения.
ЭДС не включенного на разрядку кислотного аккумулятора, принимается в среднем равной 2,1 В независимо от размеров аккумулятора.
Напряжение, создаваемое аккумулятором на зажимах, определяется уравнениями:
при разрядке
U = E-IPr;
при зарядке
U=E+Iзар r
где Е – ЭДС аккумулятора;
Ip,Iзар – соответственно ток разрядки и зарядки аккумулятора;
r – внутреннее сопротивление аккумулятора.
Кислотные аккумуляторы имеют небольшое внутреннее сопротивление, поэтому напряжение на зажимах аккумулятора незначительно снижается даже при больших токах нагрузки. В среднем сопротивление кислотного аккумулятора составляет 0,005 Ом и является величиной, зависящей от плотности электролита, а также от габаритов аккумуляторов (чем больше габариты, тем меньше сопротивление). С уменьшением плотности электролита, т. е. с увеличением степени разряда, ЭДС кислотных аккумуляторов уменьшается, а внутреннее сопротивление увеличивается. Вследствие этого напряжение аккумулятора в начале разрядки понижается незначительно, а к концу падает быстро.
В настоящее время применяются в основном две разновидности щелочных аккумуляторов: кадмиево-никелевые и железо-никелевые.
Электролитом их является раствор едкого калия КОН в дистиллированной воде (плотность электролита 1,19—1,21). В качестве активной массы положительных пластин служит гидрат окиси никеля Ni(OH)3, а активной массы отрицательных – губчатый кадмий Cd (рис. 1.8).
Рис. 1.8. Устройство и принцип действия щелочного кадмиево-никелевого аккумулятора
При разрядке аккумулятора анионы щелочного остатка ОН стремятся к пластинам из чистого кадмия. Избыточные электроны кислотного остатка направляются во внешнюю цепь и к пластинам из гидрата окиси никеля, где они нейтрализуются катионами калия. Таким путем создается разрядный ток аккумулятора.
При разрядке щелочного аккумулятора происходят следующие химические реакции:
у отрицательной пластины
Cd + 20H = Cd(OH)2;
у положительной пластины
Ni (ОН)3 + К = Ni (OH)a + КОН.
Из данных реакций видно, что при разрядке щелочного аккумулятора кадмий переходит в гидроокись кадмия Cd(OH)2, а трехатомный гидрат окиси никеля Ni(OH)3 – в двухатомную гидроокись никеля Ni(ОН)2. Эти вещества не обладают отрицательными свойствами, поэтому щелочные аккумуляторы не требуют тщательного ухода в эксплуатации, могут быть длительно незаряженными, мало разрушаются при коротких замыканиях.
При зарядке щелочных аккумуляторов катионы калия движутся к отрицательным пластинам, а анионы щелочного остатка – к положительным. При зарядке происходят следующие химические реакции:
у отрицательной пластины
Cd(OH)2 + 2K = 2KOH+Cd;
у положительной пластины
Ni(OH)2 + OH = Ni(OH)3.
При разрядке, и при зарядке щелочных аккумуляторов плотность электролита остается постоянной, так как диссоциация едкого калия на ионы К и ОН компенсируется образованием КОН.
После переработки всех веществ, участвующих в химических реакциях, при зарядке щелочных аккумуляторов происходит разложение воды электролита и «кипение» аккумулятора.
- Назад
- Вперёд
- Назад
- Вперёд
- Вы здесь:
- Главная
- Книги
- Оборудование
- Аккумуляторные батареи
Еще по теме:
- Предремонтные испытания электрических машин
- Взрывозащищенная контрольно-измерительная и аппаратура автоматики
- Ремонт электрооборудования на судах
- Интеграция системы передачи и хранения ремонтных заявок с системой их режимной проработки
- Строительство, реконструкция и ремонт дымовых труб
Герметизированные свинцово-кислотные аккумуляторы.
 Принцип работы, характеристики, особенности использования
Принцип работы, характеристики, особенности использования
- 1
Ключевые электрохимические процессы в свинцово-кислотном аккумуляторе - 2
Особенности герметизированного свинцово-кислотного аккумулятора - 3
Конструкция герметизированных свинцово-кислотных аккумуляторов - 4
Электрические и эксплуатационные характеристики герметизированных свинцово-кислотных аккумуляторов - 5
Изменения характеристик свинцово-кислотных аккумуляторов при эксплуатации - 6
Факторы, влияющие на срок службы свинцово-кислотных аккумуляторов
Первый работоспособный свинцово-кислотный аккумулятор был изобретен в 1859 г. французским ученым Гастоном Планте. Конструкция аккумулятора представляла собой электроды из листового свинца, разделенные сепараторами из полотна, которые были свернуты в спираль и помещены в сосуд с 10 % раствором серной кислоты. Недостатком первых свинцово-кислотных аккумуляторов была их невысокая емкость. Поначалу для ее увеличения проводили большое число циклов заряда-разряда. Для достижения существенных результатов требовалось до двух лет таких тренировок. Причина недостатка была явной — конструкция пластин. Поэтому дальнейшее совершенствование конструкции свинцово-кислотных аккумуляторов было сосредоточено на совершенствование конструкции используемых в них пластин и сепараторов.
Недостатком первых свинцово-кислотных аккумуляторов была их невысокая емкость. Поначалу для ее увеличения проводили большое число циклов заряда-разряда. Для достижения существенных результатов требовалось до двух лет таких тренировок. Причина недостатка была явной — конструкция пластин. Поэтому дальнейшее совершенствование конструкции свинцово-кислотных аккумуляторов было сосредоточено на совершенствование конструкции используемых в них пластин и сепараторов.
В 1880 г. К. Фор предложил методику изготовления намазных электродов путем нанесения на пластины окислов свинца. Такая конструкция электродов позволила значительно повысить емкость аккумуляторов. А в 1881 г. Э. Фолькмар предложил применять в качестве электродов намазную решетку. В том же году ученому Селлону был выдан патент на технологию изготовления решеток из сплава свинца и сурьмы.
Первоначально практическое использование свинцово-кислотных аккумуляторов было затруднено из-за отсутствия зарядных устройств — для заряда применяли первичные элементы конструкции Бунзена. То есть химический источник тока заряжался от другого химического источника — батареи гальванических элементов. Положение кардинально поменялось с появлением недорогих генераторов постоянного тока.
То есть химический источник тока заряжался от другого химического источника — батареи гальванических элементов. Положение кардинально поменялось с появлением недорогих генераторов постоянного тока.
Именно свинцово-кислотные батареи первыми в мире из аккумуляторных батарей нашли коммерческое применение. К 1890 году во многих промышленно развитых странах был освоен их серийный выпуск. В 1900 году немецкая фирма Varta произвела первые стартерные аккумуляторы для автомобилей.
В 70-х годах XX века были созданы необслуживаемые свинцово-кислотные аккумуляторные батареи, способные работать в любом положении. Жидкий электролит в них сменили гелиевым или адсорбированным (впитанным) сепараторами электролитом, батареи герметизировали, а для отвода газов, выделяющихся при заряде или разряде, установили клапаны. Строго говоря, абсолютная герметизация свинцово-кислотных аккумуляторов не может быть достигнута, так как нельзя обеспечить полную рекомбинацию кислорода и водорода, которые выделяются в них при заряде и хранении. Но специальными мерами выделение газов и потери воды в процессе эксплуатации удается свести к минимуму.
Но специальными мерами выделение газов и потери воды в процессе эксплуатации удается свести к минимуму.
Были разработаны новые конструкции пластин на базе медно-кальциевых сплавов, покрытых оксидом свинца, а также на основе титановых, алюминиевых и медных решеток.
Свинцовые аккумуляторы являются наиболее распространенными среди всех существующих в настоящее время химических источников тока. Их масштабное производство определяется как относительно низкой ценой, обусловленной сравнительной не дефицитностью исходных материалов, так и разработкой разных вариантов этих аккумуляторов, отвечающих требованиям широкого круга потребителей.
Ключевые электрохимические процессы в свинцово-кислотном аккумуляторе
Активные вещества аккумулятора сосредоточены в электролите и положительных и отрицательных электродах, а совокупность этих веществ называется электрохимической системой. В свинцово-кислотных аккумуляторных батареях электролитом является раствор серной кислоты (H2SO4), активным веществом положительных пластин — двуокись свинца (PbO2), отрицательных пластин — свинец (Pb).
Основные процессы, проходящие на электродах, описывают реакции:
На отрицательном электроде:
Pb + HSO4— → PbSO4 + H+ + 2e— (разряд)
PbSO4 + H+ + 2e— → Pb + HSO4— (заряд)
На положительном электроде:
PbO2 + HSO4— + 3H+ + 2e— → PbSO4 + 2H2O (разряд)
PbSO4 + 2H2O → PbO2 + HSO4— + 3H+ + 2e— (заряд)
Суммарная реакция в свинцовом аккумуляторе имеет вид:
PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O (разряд)
2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 (заряд)
Таким образом, при разряде свинцового аккумулятора на обоих электродах формируется малорастворимый сульфат свинца (двойная сульфатация) и происходит сильное разбавление серной кислоты.
Напряжение разомкнутой цепи заряженного аккумулятора равно 2,05-2,15 В, в зависимости от концентрации серной кислоты. При разряде по мере разбавления электролита напряжение разомкнутой цепи аккумулятора понижается и после полного разряда становится равным 1,95-2,03 В.
При заряде свинцово-кислотного аккумулятора, как и в других аккумуляторах с водным электролитом, имеют место побочные реакции выделения газов. Выделение водорода начинается при полном заряжении отрицательного электрода. Кислород начинает выделяться гораздо раньше: в обычных условиях заряда при 50-80% заряженности (в зависимости от тока заряда), а при температуре 0 °С уже после заряда на 30-40 %. Вследствие этого отдача положительного электрода по емкости составляет 85-90 %. Для получения полной разрядной емкости при заряде аккумулятору должен быть обеспечен перезаряд на 10-20 %. Этот перезаряд сопровождается существенным выделением водорода на отрицательном электроде и кислорода — на положительном.
Выделение водорода имеет место и при хранении заряженного свинцово-кислотного аккумулятора. Саморазряд его определяется преимущественно скоростью растворения свинца согласно реакции:
Саморазряд его определяется преимущественно скоростью растворения свинца согласно реакции:
Pb + H2SO4 → PbSO4 + H2
Скорость этого процесса зависит от температуры, объема электролита и его концентрации, но более всего от чистоты компонентов. В отсутствие примесей реакция протекает медленно из-за большого перенапряжения выделения водорода на свинце. Но на практике, на поверхности свинцового электрода всегда много примесей, среди которых наибольшее влияние оказывает сурьма, количество которой в сплаве для решеток и токоведущих деталей доходит до 6 %.
На положительном электроде может также самопроизвольно проходить реакция восстановления диоксида свинца:
PbO2 + H2SO4 → PbSO4 + 1/2O2 + H2O
в результате которой выделяется кислород, но скорость ее незначительна.
В процессе эксплуатации саморазряд аккумулятора может увеличиваться из-за образования дендритных мостиков из металлического свинца. Потери емкости свежеизготовленного аккумулятора за счет саморазряда как правило не превышают 2-3 % в месяц. Но при эксплуатации они быстро увеличиваются.
Потери емкости свежеизготовленного аккумулятора за счет саморазряда как правило не превышают 2-3 % в месяц. Но при эксплуатации они быстро увеличиваются.
Особенности герметизированного свинцово-кислотного аккумулятора
Главные проблемы при создании герметичного варианта свинцово-кислотного аккумулятора связаны с необходимостью обеспечения условий для уменьшения газовыделения и содействия рекомбинации выделяющегося газа. При создании герметизированного аккумулятора, который в обычных условиях эксплуатации не требовал бы доливки воды в электролит в течение всего срока службы и не выделял бы газов, был предпринят ряд мер:
1. В аккумуляторе применяется иммобилизированный (обездвиженный) электролит, который сохраняет высокую электропроводность серной кислоты. Небольшое его количество позволяет обеспечить лучший транспорт кислорода от положительного электрода к отрицательному и высокий уровень его рекомбинации.
При одном методе иммобилизации электролита для его загущивания применяется силикагель (SiO2), который обладает высокой пластичностью и заполняет и электроды, и сепаратор. Благодаря своей вязкости он хорошо удерживается в порах и способствует эффективному использованию активных веществ электродов. Транспортировка кислорода обеспечивается по трещинам, которые появляются при усадке твердеющего электролита.
Благодаря своей вязкости он хорошо удерживается в порах и способствует эффективному использованию активных веществ электродов. Транспортировка кислорода обеспечивается по трещинам, которые появляются при усадке твердеющего электролита.
При другом методе иммобилизации применяется сепаратор из стекловолокна с высокой объемной пористостью и хорошей смачиваемостью в растворе серной кислоты. Такой сепаратор не только осуществляет функцию разделения электродов, но и благодаря тонкой структуре волокон обеспечивает удержание электролита в порах и высокую скорость переноса кислорода. Применение стекловолокнистого сепаратора и плотная сборка блока электродов способствуют также уменьшению оплывания активной массы положительного электрода и разбухания губчатого свинца на отрицательном.
2. Для снижения вероятности выделения водорода свинцово-сурьмяные сплавы токоведущих решеток заменяются другими, обеспечивающими более высокое перенапряжение выделения водорода. Применяются сплавы свинца с кальцием (до 0,1 % Ca), иногда легированного алюминием, сплавы свинца с оловом (0,5-2,5 % Sn), которые имеют неплохие литейные характеристики, и другие.
3. В отрицательный электрод закладывается ёмкость больше, чем в положительный. В данном случае при полном заряде положительного электрода оставшаяся недозаряженной часть активной массы отрицательного электрода практически исключает вероятность разряда ионов водорода. Кислород, выделяющийся на диоксиде свинца, достигает отрицательного электрода и окисляет губчатый свинец до оксида свинца, который в кислотном электролите переходит в сульфат свинца PbSO4 и воду. Следовательно, условия для герметизации аккумулятора улучшаются: газы не выделяются и вода не испаряется.
Снижению газовыделения способствуют и рекомендуемые для герметизированных аккумуляторов режимы заряда, при которых ток понижается по мере их заряжения.
И все-таки все реализованные варианты безуходного свинцово-кислотного аккумулятора оснащены клапаном, который время от времени открывается для сброса излишнего количества газа, главным образом водорода. Именно поэтому аккумулятор называется не герметичным, а герметизированным.
Успехи исследователей и технологов, достигнутые за прошедшие два десятилетия, тщательный контроль процесса изготовления и сотрудничество с потребителями, которые научились понимать, что безуходность этих батарей не означает полной свободы от контроля за их работой, позволяют в настоящее время выпускать на рынок продукцию, которая в ряде случаев может конкурировать с более дорогими герметичными щелочными аккумуляторами.
Герметизированные свинцово-кислотные аккумуляторные батареи ёмкостью до 10-20 А*ч применяются как источники питания для разнообразной портативной аппаратуры и инструментов в тех случаях, когда масса не является определяющим критерием для выбора источника тока, а также в системах бесперебойного питания, телекоммуникаций, информационных системах, для аварийного оборудования и т.д., где они работают в буферном режиме.
Конструкция герметизированных свинцово-кислотных аккумуляторов
Портативные герметизированные свинцово-кислотные аккумуляторы выпускаются в виде батарей, которые собраны в едином призматическом контейнере из пластмассы или резины (моноблочная конструкция). Положительные и отрицательные электроды аккумуляторов делаются обычно намазкой на решетку сотовой структуры. Контейнер и крышка загерметизированы. Межэлементные соединения утапливаются в углублениях крышки и залиты мастикой. Выводы аккумуляторной батареи (в виде ушка или борна) также загерметизированы. Клапанное приспособление для сброса газа при излишнем давлении состоит из резинового клапана и отражателя, служащего для улавливания капель электролита. Воздух в аккумулятор через него не поступает.
Положительные и отрицательные электроды аккумуляторов делаются обычно намазкой на решетку сотовой структуры. Контейнер и крышка загерметизированы. Межэлементные соединения утапливаются в углублениях крышки и залиты мастикой. Выводы аккумуляторной батареи (в виде ушка или борна) также загерметизированы. Клапанное приспособление для сброса газа при излишнем давлении состоит из резинового клапана и отражателя, служащего для улавливания капель электролита. Воздух в аккумулятор через него не поступает.
На электрических и эксплуатационных характеристиках герметизированных свинцовых аккумуляторных батарей большой емкости значительно сказываются различия в конструкции электродов (поверхностного типа, панцирные или стержневые), а также различия в сплавах, используемых для изготовления токоведущих основ.
При выборе герметизированной свинцовой аккумуляторной батареи большой емкости следует внимательно отнестись к использованному в ней способу иммобилизации электролита, поскольку известно, что в высоких аккумуляторах со стекловолокнистым сепаратором (технология AGM) со временем отмечается расслоение электролита. Такие аккумуляторы стараются проектировать высотой не более 35 см.
Такие аккумуляторы стараются проектировать высотой не более 35 см.
Электрические и эксплуатационные характеристики герметизированных свинцово-кислотных аккумуляторов
Напряжение разомкнутой цепи свинцово-кислотных аккумуляторов линейно возрастает с ростом степени заряженности аккумулятора (рисунок 1). По значению напряжения разомкнутой цепи можно судить о степени разряда свинцового аккумулятора.
Рис.1. Зависимость напряжения разомкнутой цепи свинцово-кислотного аккумулятора от уровня заряженности
Номинальной ёмкостью свинцово-кислотного аккумулятора считается ёмкость, полученная при разряде в течение 20 ч, т.е. током 0,05С. Отдаваемая аккумулятором ёмкость значительно зависит от тока разряда, который может достигать нескольких С. Типичные разрядные характеристики при различных токах нагрузки показаны на рисунке 2. Из рисунка видно, что от тока разряда зависит также и конечное разрядное напряжение свинцового аккумулятора.
Рис.2. Разрядные характеристики герметизированной свинцово-кислотной аккумуляторной батареи
Герметизированные свинцовые аккумуляторные батареи работоспособны в интервале температур от -30 до +50 °С, чаще гарантируется работоспособность при температуре не ниже -15 °С. При более низких температурах возможности разряда мешает замерзание электролита. Работоспособность аккумуляторов при низких температурах может быть обеспечена увеличением концентрации электролита, как это и делается в специальных аккумуляторах.
При более низких температурах возможности разряда мешает замерзание электролита. Работоспособность аккумуляторов при низких температурах может быть обеспечена увеличением концентрации электролита, как это и делается в специальных аккумуляторах.
Заряд свинцово-кислотного аккумулятора.
Заряд батарей, как было сказано ранее, должен осуществляться в режиме, при котором ток должен сильно понижаться к концу заряда. Используется несколько стратегий заряда, которые требуют оборудования различной сложности и стоимости. Наиболее простое и дешёвое оборудование осуществляет заряд при постоянном напряжении 2,4-2,45В/ак (потенциостатический режим). Заряд считается законченным если ток заряда остается неизменным в течении 3-х часов.
Рис.3. Зарядные кривые герметизированной свинцово-кислотной аккумуляторной батареи при комбинированном режиме заряда нормированным током 0,1С и нормированным напряжением 2,45В/ак: 1-напряжение, 2-зарядная емкость, 3-ток заряда
Но чаще применяют комбинированный режим, при котором начальный ток ограничивают, а по достижении заданного напряжения, заряд проводится при стабилизации напряжения (рисунок 3). Заряд проводится при постоянном токе 0,1С на первом этапе и при постоянном напряжении источника тока на втором. Большинство производителей советуют проводить заряд циклируемых батарей при постоянном напряжении 2,4В на аккумулятор.
Заряд проводится при постоянном токе 0,1С на первом этапе и при постоянном напряжении источника тока на втором. Большинство производителей советуют проводить заряд циклируемых батарей при постоянном напряжении 2,4В на аккумулятор.
Ускорение процесса заряда достигается при повышении тока на первой стадии заряда, но в соответствии с советами производителей не более чем до 0,3С. В конце заряда для большей безопасности может быть применена еще одна ступень заряда: при снижении напряжения источника питания до напряжения подзаряда аккумулятора 2,30-2,35 В.
Заряд аккумуляторных батарей, используемых, для работы в буферном режиме, проводится как правило при более низком напряжении (2,23-2,275 В).
Указанные напряжения заряда не требуют изменения при заряде в некотором интервале температуры (обычно от 5 до 35 °С). За пределами указанного температурного интервала, требуется компенсация влияния температуры: повышение напряжения при пониженных температурах и снижение при более высоких.
Рис.4. Рекомендуемое напряжение заряда при разных температурах для герметизированного свинцово-кислотного аккумулятора
Саморазряд свинцово-кислотной аккумуляторной батареи.
Саморазряд в герметизированных свинцово-кислотных аккумуляторах значительно уменьшен по сравнению с вентилируемыми аккумуляторами и составляет 40% в год при 20 °С и 15% при 5 °С. При более высоких температурах хранения саморазряд увеличивается: при 40 °С батареи лишаются 40 % ёмкости за 4-5 месяцев.
При продолжительном хранении в заряженном состоянии батареи рекомендуют периодически подзаряжать. Если они хранились при температуре ниже -20 °С, то подзаряд должен проводиться 1 раз в год в течение 48 ч при постоянном напряжении 2,275 В/ак. При хранении при комнатной температуре — 1 раз в 8 месяцев в течение 6-12 ч при постоянном напряжении 2,4 В/ак. Хранение при температуре выше 30 °С не желателен.
Продолжительное хранение батареи в разряженном состоянии приводит к быстрой потере ее работоспособности.
Изменения характеристик свинцово-кислотных аккумуляторов при эксплуатации
Рис.5. Действие температуры на остаточную емкость герметизированного свинцово-кислотного аккумулятора: 1-40°С, 2-20°С, 3-10°С, 4-0°С
Срок службы герметизированных свинцово-кислотных аккумуляторных батарей, как и вентилируемых, в большинстве случаев определяется деградацией положительного электрода, которая определяется коррозией его решетки и изменениями в активной массе.
Скорость коррозии решеток зависит как от состава сплава, конструкции и условий отливки, так и от температуры, при которой работают батареи. Коррозия решетки из сплава без сурьмы или с низким ее содержанием существенно медленнее по сравнению с коррозией традиционных решеток вентилируемых аккумуляторов. В качественно отлитых решетках из сплавов Pb-Ca-Sn скорость коррозии маленькая, но в плохо отлитых — отдельные участки подвергаются глубокой коррозии, что вызывает локальный ее рост и деформацию. Деформация решеток может привести к короткому замыканию разнополярных пластин. Коррозия решеток положительных пластин — самый частый дефект батарей, эксплуатируемых в буферном режиме.
Коррозия решеток положительных пластин — самый частый дефект батарей, эксплуатируемых в буферном режиме.
При эксплуатации в режиме циклирования происходит также разрыхление активных масс положительного электрода, которое приводит к потере контакта между частицами PbO2. Емкость источника тока при этом уменьшается. Процесс разрыхления ускоряется при разряде большими импульсами тока.
В герметизированных аккумуляторах могут протекать и специфические коррозионные процессы на токоведущих деталях отрицательных пластин, которые находятся выше уровня электролита, и на борне. Так как продукты коррозии имеют больший объем, чем свинец, в результате может иметь место выдавливание компаунда, герметизирующего вывод, и повреждение борна, крышки и даже бака. Дефекты такого рода часто отмечались в аккумуляторах разных производителей на ранних этапах разработок и производства. Сейчас большая часть производителей решила эту проблему подбором сплавов для всех компонентов аккумулятора и контролем за металлургическим процессом их изготовления.
В течении эксплуатации герметизированных аккумуляторов из-за неизбежных потерь воды при открывании клапана для сброса излишнего давления газа происходит некоторое осушение сепаратора и повышение внутреннего сопротивления аккумулятора. При эксплуатации в буферном режиме количество отказов, спровоцированных высыханием аккумулятора, становится соизмеримым с отказами из-за коррозии решеток положительных электродов. В аккумуляторах с гелиевым электролитом снижение количества электролита менее критично, чем в аккумуляторах с сепаратором из стекловолокна.
Факторы, влияющие на срок службы свинцово-кислотных аккумуляторов
Рис.6. Зависимость срока службы герметизированной свинцово-кислотной батареи от глубины разряда
Самое большое влияние на срок службы герметизированного свинцово-кислотного аккумулятора оказывают: рабочая температура, глубина разряда и величина перезаряда, а также периодичность срабатывания клапана для сброса газа.
На рисунках 6 и 7 изображено изменение срока службы в зависимости от глубины разряда и температуры окружающей среды. .
.
Рис.7. Зависимость срока службы герметизированной свинцово-кислотной батареи от температуры при работе в буферном режиме
Герметизированные свинцово-кислотные аккумуляторы очень чувствительны к перезаряду. На рисунке 8 изображено, как быстро уменьшается срок их службы при работе в режиме постоянного подзаряда при повышении напряжения (и тем самым — тока подзаряда) источника питания подключенного к аккумулятору.
Следует помнить, что при заряде герметизированных аккумуляторов их температура может быть значительно выше температуры окружающей среды. Это связано как с разогревом аккумуляторов из-за реакции рекомбинации кислорода, так и с неудовлетворительным отводом тепла от плотноупакованной батареи. Разница температур особенно ощутима при ускоренном режиме заряда. Если нельзя избежать существенного увеличения температуры, то при заряде следует вводить корректировку напряжения источника питания.
Рис.8. Воздействие режима заряда на срок службы герметизированной свинцово-кислотной аккумуляторной батареи при работе в буферном режиме
Переразряд также вреден для свинцово-кислотных батарей, как и перезаряд. При многократных переразрядах уменьшается разрядная емкость и понижается срок службы аккумулятора. Такие же изменения могут происходить и при продолжительном хранении батарей в разряженном состоянии.
При многократных переразрядах уменьшается разрядная емкость и понижается срок службы аккумулятора. Такие же изменения могут происходить и при продолжительном хранении батарей в разряженном состоянии.
В связи с расширением сферы применения герметизированных свинцовых аккумуляторов до обитаемых комплексов специального назначения, где должны применяться мощные источники тока с большим напряжением, стало необходимым исследование последствий возникновения аварийных ситуаций в эксплуатации. Такие ситуации могут происходить как при разбалансировании характеристик аккумуляторов, составляющих батарею, так и в результате ошибочного обслуживания батарей или отказе управляющего оборудования. В этом случае при перезаряде или переразряде батарей, приводящем к переполюсованию наиболее слабых аккумуляторов, может произойти разгерметизация аккумуляторов или даже разрушение их баков.
Было показано, что повреждение корпуса приводит к снижению отдаваемой ёмкости, но более серьезных проблем не возникает. Даже при полном разрушении контейнера аккумулятора емкость его стала меньше только на 14 %, так как электролит не вытекает, а задерживается в порах электродов и сепаратора. При вскрытии 5 % площади контейнера, аккумуляторы оставались годными для циклирования при снижении разрядной емкости на 15-20 %.
Даже при полном разрушении контейнера аккумулятора емкость его стала меньше только на 14 %, так как электролит не вытекает, а задерживается в порах электродов и сепаратора. При вскрытии 5 % площади контейнера, аккумуляторы оставались годными для циклирования при снижении разрядной емкости на 15-20 %.
При продолжительном перезаряде (током 0,25 Сн) как свежих аккумуляторов, так и после полтора года эксплуатации в режиме постоянного подзаряда, а также при заряде аккумуляторов при завышенном напряжении (2,6В), чрезвычайного разогрева аккумуляторов не происходило. Температура стабилизируется спустя 4-6 ч на уровне 50-70 °С или затем медленно понижается. Но из-за выброса газов через аварийный клапан происходит осушение аккумуляторов и быстрая их деградация.
Современные герметизированные свинцово-кислотные аккумуляторные батареи обладают достаточно высокими удельными энергетическими характеристиками (до 40 Втч/кг и 100 Втч/л). Они работоспособны в буферном режиме при нормальной температуре в течение продолжительного периода (более 10 лет), а при циклировании обеспечивают несколько сотен циклов до потери 20 % ёмкости.
Источник
Эта статья прочитана 9403 раз(а)!
Эксплуатационный ресурс герметичных АБ
64
Эксплуатационный ресурс герметичных свинцовых аккумуляторных батарей в составе электронного оборудования Мерунко Александр Анатольевич Технический директор ООО «Диск», г.Томск В настоящее время на потребительском рынке вторичных источников тока лидирующее положения (вследствие относительно низкой стоимости) занимают герметичные свинцовые аккумуляторные батареи. Их применяют…
Эксплуатация герметичных аккумуляторов
53
Применение и эксплуатация кислотно-свинцовых герметичных аккумуляторов Автор: Журавлев О. В. В статье рассмотрены вопросы применения и эксплуатации кислотно-свинцовых герметичных аккумуляторных батарей, наиболее широко используемых для резервирования аппаратуры охранно-пожарной сигнализации (ОПС) Появившиеся на российском рынке в начале 90-х годов кислотно-свинцовые герметичные…
Замена щелочных АБ на свинцово-кислотные
50
Замена щелочных АБ на свинцово-кислотные Источник: Химические источники тока АККУМУЛЯТОР — химический источник тока, который после разряда обладает возможностью заряда (преобразования электрической энергии в химическую) путем пропускания через него электрического тока обратного направления.
 Мы рассматриваем две электрохимические системы аккумуляторов, свинцовую…
Мы рассматриваем две электрохимические системы аккумуляторов, свинцовую…Новый аккумулятор нужно заряжать ⚡
50
В каких случаях необходимо заряжать новый аккумулятор? Любому автолюбителю известно, что необходимо время от времени обслуживать аккумуляторную батарею, установленную в транспортном средстве, но далеко не всем известно, что необходимо так же обслужить новый аккумулятор перед началом использования. Нужно ли заряжать…
Знакомство со свинцово-кислотными батареями: конструкция, принцип работы и типы
Ann
04 марта 2021 г.
1699
Категория перезаряжаемых и вторичных батарей включает свинцово-кислотные батареи. Несмотря на низкое отношение энергии к объему и энергии к весу батареи, она может обеспечивать более высокие импульсные токи. Это связано с тем, что свинцово-кислотные аккумуляторы имеют высокое отношение мощности к весу.
Свинцово-кислотный аккумулятор: как они работают? | Рабочая анимация | Электрика4U
Каталог
I. Конструкция Конструкция | |
| II. Принцип работы | |
| III. Типы | |
| IV. Features | 1. Chemical Reaction |
| 2. Life | |
| 3. Applications | |
In the year 1801, a French physicist named Nicolas Gautherot discovered that even though the main battery is disconnected, there малый объем тока в исследовании электролиза. В 1859 г., физик по имени Гатсон изобрел свинцово-кислотную батарею , которая была первой, подзаряжаемой за счет прохождения обратного тока. Это был первый прототип батареи такого типа, к которому Фор добавил больше усовершенствований, пока Анри Тюдор не изобрел практичный тип свинцово-кислотной батареи в 1886 году. Давайте углубимся в этот тип батареи, ее работу, типы, структуру и преимущества. .
Категория перезаряжаемых и вторичных батарей включает свинцово-кислотные батареи. Несмотря на низкое отношение энергии к объему и энергии к весу батареи, она может обеспечивать более высокие импульсные токи. Это связано с тем, что свинцово-кислотные аккумуляторы имеют высокое отношение мощности к весу.
Это связано с тем, что свинцово-кислотные аккумуляторы имеют высокое отношение мощности к весу.
Это батареи, которые преобразуют химическую энергию в электрическую с использованием перекиси свинца и губчатого свинца. Из-за повышенных уровней напряжения в элементах и низкой стоимости они обычно используются на подстанциях и в энергосистемах.
I. Конструкция свинцово-кислотной батареи
Пластины и контейнеры являются важными элементами конструкции свинцово-кислотной батареи. Каждая часть, используемая в конструкции, подробно описана в разделе ниже. Схема свинцово-кислотного аккумулятора показана ниже:
Контейнер со свинцово-кислотной батареей
Этот элемент банки изготовлен из эбонита, дерева со свинцовым покрытием, стекла, твердой битумной резины, керамических материалов или кованого пластика, которые крепятся к поверхности для предотвращения любого разряд электролита. В нижней части контейнера имеется четыре ребра, два из которых закреплены на положительной пластине, а остальные — на отрицательной.
Призма служит основанием для обеих пластин, а также защищает их от короткого замыкания. Материалы, используемые в конструкции контейнера, не должны содержать серную кислоту, не должны изгибаться или проникать, а также не должны содержать никаких примесей, которые могут повредить электролит.
Пластины свинцово-кислотной батареи
Пластины свинцово-кислотной батареи построены по-разному, но все они состоят из одинаковых типов сетки, состоящей из активных компонентов и свинца. Сетка необходима для установления проводимости тока и распределения равных величин тока по активным компонентам. Если распределение неравномерно, активная переменная будет ослаблена. В этой батарее есть два типа пластин. Пластины Plante/formed и Faure/клееные пластины являются двумя типами.
Фасонные пластины в основном используются в статических батареях, они тяжелые и дорогие. Однако даже при непрерывных циклах зарядки и разрядки они имеют длительный срок службы и маловероятно, что они потеряют свои активные компоненты. Это имеет низкое соотношение мощности к весу.
Это имеет низкое соотношение мощности к весу.
Хотя процедура вставки чаще используется для создания негативных пластин, чем позитивных, она часто используется для создания позитивных пластин. Отрицательно-активный аспект более сложен, и механизмы зарядки и разрядки немного изменены.
Активный компонент свинцово-кислотного аккумулятора
Активный компонент — это компонент, который активно участвует в процессах химических реакций, происходящих в аккумуляторе, в основном во время зарядки и разрядки. Ниже приведены активные ингредиенты:
Перекись свинца – Это полезный активный ингредиент.
Губчатый провод — отрицательная активная часть системы.
Кислота серная разбавленная – Это в основном используется в качестве электролита.
Сепараторы свинцово-кислотных аккумуляторов
Для изготовления этих тонких плит используются пористая резина, обработанный свинец и стекловолокно. Сепараторы используются для обеспечения активной изоляции между пластинами. С одной стороны они имеют рифленую форму, а с другой стороны плоские.
Сепараторы используются для обеспечения активной изоляции между пластинами. С одной стороны они имеют рифленую форму, а с другой стороны плоские.
Кромки свинцово-кислотной батареи
Имеет положительные и отрицательные наконечники диаметром 17,5 мм и 16 мм соответственно.
II. Принцип работы свинцово-кислотного аккумулятора
Поскольку серная кислота используется в качестве электролита в батарее, при ее растворении молекулы рассеиваются в виде SO4– (отрицательные ионы) и 2H+ (положительные ионы), которые могут свободно перемещаться. Когда эти электроды погружаются в растворы и подается постоянный ток, положительные ионы начинают двигаться в направлении отрицательной стороны батареи. Отрицательные ионы также могут проходить в том же направлении, что и положительные ионы, двигаясь к положительному краю батареи.
Каждый ион водорода и сульфата собирает один и два электрона, а также отрицательные ионы с катода и анода и вступает в реакцию с водой. В результате образуются водород и серная кислота. Продукты вышеуказанных реакций соединяются с оксидом свинца с образованием пероксида свинца. Это означает, что во время фазы зарядки часть свинцового катода остается в виде свинца, а свинцовый анод формируется в виде темно-коричневого пероксида свинца.
В результате образуются водород и серная кислота. Продукты вышеуказанных реакций соединяются с оксидом свинца с образованием пероксида свинца. Это означает, что во время фазы зарядки часть свинцового катода остается в виде свинца, а свинцовый анод формируется в виде темно-коричневого пероксида свинца.
Если питание постоянного тока отсутствует, а между электродами закреплен вольтметр, отображается расхождение потенциалов между электродами. Поток тока от отрицательной к положительной пластине по внешней цепи происходит, когда провода соединяются между электродами, что указывает на то, что ячейка может производить электрический источник энергии.
III. Типы свинцово-кислотных аккумуляторов
Герметичный тип . Этот тип свинцово-кислотного аккумулятора представляет собой просто разновидность залитого типа. Насчет того, что ни у кого нет доступа к каждой ячейке батареи, внутренняя архитектура практически идентична залитой форме. Самая большая разница в этой форме заключается в том, что в ней содержится достаточное количество кислоты, чтобы обеспечить плавное протекание химических реакций во время существования батареи.
VRLA Form . Также известные как герметичные батареи, они известны как свинцово-кислотные батареи с клапанным управлением. В момент зарядки процесс контроля стоимости обеспечивает стабильное выделение газов O2 и h3.
AGM Type – это аккумулятор из матового стекла, который позволяет останавливать электролит на материале пластины. Аккумуляторы этого типа улучшают производительность процессов разрядки и зарядки. В основном они используются в автоспорте и при запуске двигателя.
Гелевый тип — это свинцово-кислотный аккумулятор мокрого типа, в котором электролит в ячейке изготовлен на основе диоксида кремния, что приводит к затвердеванию материала. По сравнению с другими формами значения напряжения перезарядки элемента малы, а также он обладает большей чувствительностью.
IV. Характеристики свинцово-кислотного аккумулятора
1. Химическая реакция свинцово-кислотного аккумулятора
Химическая реакция в аккумуляторе происходит в основном во время процессов разрядки и перезарядки, и она описывается следующим образом:
Когда батарея полностью заряжена, анод и катод состоят из PbO2 и Pb соответственно. Поскольку они связаны с сопротивлением, батарея разряжается, а электроны заряжаются в противоположном направлении. Ионы h3 проходят в анод и сливаются вместе, образуя атом. Он реагирует с PbO2 с образованием PbSO4 белого цвета.
Поскольку они связаны с сопротивлением, батарея разряжается, а электроны заряжаются в противоположном направлении. Ионы h3 проходят в анод и сливаются вместе, образуя атом. Он реагирует с PbO2 с образованием PbSO4 белого цвета.
Подобно иону сульфата, ион сульфата движется к катоду, где он превращается в SO4. Он становится сульфатом свинца, когда реагирует со свинцовым катодом.
PbSO4 + 2H = PbO + h3O
PbO + h3SO4 = PbSO4 + 2h3O
PbO2 + h3SO4 + 2H = PbSO4 + 2h3O процесс. Положительные ионы h3 переходят на катод, приобретая два электрона и превращаясь в атом h3. Он образует свинец и серную кислоту после химической реакции с сульфатом свинца.
2. Срок службы свинцово-кислотной батареи
Оптимальная рабочая температура для свинцово-кислотной батареи составляет 250 градусов Цельсия или 770 градусов по Фаренгейту. Срок службы сокращается по мере расширения температурного спектра. Согласно закону, любое повышение температуры на 80°C сокращает период полураспада батареи. Срок службы свинцово-кислотной батареи с рабочими характеристиками при рабочей температуре 250°C составляет десять лет. И его срок службы составляет всего 5 лет при температуре 330 градусов по Цельсию.
Срок службы свинцово-кислотной батареи с рабочими характеристиками при рабочей температуре 250°C составляет десять лет. И его срок службы составляет всего 5 лет при температуре 330 градусов по Цельсию.
3. Приложения
Поделиться этой публикацией
Часто задаваемые вопросы
Что находится в свинцово-кислотном аккумуляторе?
Свинцово-кислотный аккумулятор состоит из отрицательного электрода из губчатого или пористого свинца. Свинец является пористым, чтобы облегчить образование и растворение свинца. Положительный электрод состоит из оксида свинца. Оба электрода погружены в электролитический раствор серной кислоты и воды.
Каковы недостатки свинцово-кислотных аккумуляторов?
Основным недостатком свинцово-кислотных аккумуляторов является то, что свинец имеет очень большой атомный вес, что снижает удельную энергию и мощность аккумулятора.
 В настоящее время во всем мире производятся сотни миллионов свинцово-кислотных аккумуляторов, что делает свинцово-кислотные аккумуляторы самым успешным источником энергии всех времен.
В настоящее время во всем мире производятся сотни миллионов свинцово-кислотных аккумуляторов, что делает свинцово-кислотные аккумуляторы самым успешным источником энергии всех времен. Как долго работает свинцово-кислотный аккумулятор?
Срок службы герметичных свинцово-кислотных аккумуляторов может составлять от 3 – От 5 лет до 12+ лет в зависимости от производственного процесса батареи. На срок службы батареи влияет множество факторов, в том числе температура. Для получения дополнительной информации см. наше техническое руководство.
Посмотреть больше
Свинцово-кислотный аккумулятор: работа, конструкция и зарядка/разрядка
Почти каждое портативное и переносное устройство состоит из аккумулятора. Аккумулятор — это накопительное устройство, в котором хранится энергия для обеспечения питания, когда это необходимо. В современном мире электроники доступны различные типы батарей, среди них 9.0016 Свинцовый Кислотный аккумулятор обычно используется для питания высокой мощности. Обычно свинцово-кислотные батареи имеют большие размеры, жесткую и тяжелую конструкцию, они могут хранить большое количество энергии и обычно используются в автомобилях и инверторах.
Обычно свинцово-кислотные батареи имеют большие размеры, жесткую и тяжелую конструкцию, они могут хранить большое количество энергии и обычно используются в автомобилях и инверторах.
Даже несмотря на конкуренцию с литий-ионными аккумуляторами, спрос на свинцово-кислотные аккумуляторы растет день ото дня, поскольку они дешевле и проще в обращении по сравнению с литий-ионными аккумуляторами. Согласно некоторым исследованиям рынка, рынок свинцово-кислотных аккумуляторов в Индии, по прогнозам, будет расти в среднем на более чем 9% в течение 2018-24 гг. Таким образом, он имеет огромный рыночный спрос в области автоматизации, автомобилестроения и бытовой электроники. Хотя большая часть электромобилей поставляется с литий-ионными батареями, но все же есть много электрических двухколесных транспортных средств, которые используют свинцово-кислотные батареи для питания транспортного средства.
В предыдущем уроке мы узнали о литий-ионных батареях, здесь мы разберемся с работой, конструкцией и применением свинцово-кислотных батарей . Мы также узнаем о характеристиках зарядки/разрядки, требованиях и безопасности свинцово-кислотных аккумуляторов.
Мы также узнаем о характеристиках зарядки/разрядки, требованиях и безопасности свинцово-кислотных аккумуляторов.
Конструкция свинцово-кислотного аккумулятора
Что такое свинцово-кислотный аккумулятор? Если мы сломаем название «Свинцово-кислотная батарея», мы получим «Свинец, кислота» и «Батарея» . Свинец — химический элемент (символ — Pb, атомный номер — 82). Это мягкий и податливый элемент. Мы знаем, что такое Кислота; он может отдавать протон или принимать пару электронов, когда реагирует. Итак, батарея, состоящая из свинца и безводной свинцовой кислоты (иногда ошибочно называемой перекисью свинца), называется свинцово-кислотной батареей.
Итак, какая внутренняя конструкция?
Свинцово-кислотная батарея состоит из следующих элементов, мы можем видеть это на изображении ниже:
Свинцово-кислотная батарея состоит из пластин, сепаратора и электролита, твердого пластика с корпусом из твердой резины .
В батареях пластины двух типов , положительные и отрицательные. Положительный состоит из диоксида свинца, а отрицательный — из губчатого свинца. Эти две пластины разделены с помощью сепаратор , который представляет собой изоляционный материал. Вся эта конструкция хранится в жестком пластиковом корпусе с электролитом. Электролит представляет собой воду и серную кислоту.
Жесткий пластиковый корпус на одну ячейку. В одной ячейке обычно хранится 2,1 В. По этой причине 12-вольтовая свинцово-кислотная батарея состоит из 6 элементов и обычно обеспечивает 6 x 2,1 В/элемент = 12,6 В.
Теперь, , какова емкость накопителя заряда?
Очень сильно зависит от активного материала (количества электролита) и размера пластины. Возможно, вы видели, что емкость литиевой батареи описывается в мАч или миллиампер-часах, но в случае свинцово-кислотной батареи это Ампер час . Мы опишем это в следующем разделе.
Мы опишем это в следующем разделе.
Работа свинцово-кислотного аккумулятора
Работа свинцово-кислотного аккумулятора полностью посвящена химии, и знать об этом очень интересно. В условиях зарядки и разрядки свинцово-кислотных аккумуляторов задействован огромный химический процесс. Молекулы разбавленной серной кислоты H 2 SO 4 при растворении кислоты распадаются на две части. Это создаст положительные ионы 2H+ и отрицательные ионы SO 4 -. Как мы уже говорили ранее, два электрода соединены в виде пластин, анода и катода. Анод улавливает отрицательные ионы, а катод притягивает положительные ионы. Это соединение в аноде и SO 4 — и катоде с 2H+ обмениваются электронами и которые далее реагируют с H3O или с водой (разбавленная серная кислота, серная кислота + вода).
Аккумулятор имеет два состояния химической реакции: Зарядка и Разрядка .
Зарядка свинцово-кислотного аккумулятора
Как мы знаем, чтобы зарядить аккумулятор, нам нужно обеспечить напряжение, превышающее напряжение на клеммах. Таким образом, для зарядки аккумулятора 12,6 В можно подать напряжение 13 В.
Таким образом, для зарядки аккумулятора 12,6 В можно подать напряжение 13 В.
Но что на самом деле происходит, когда мы заряжаем свинцово-кислотную батарею?
Ну, те самые химические реакции, которые мы описали ранее. В частности, когда аккумулятор подключен к зарядному устройству, молекулы серной кислоты распадаются на два иона: положительные ионы 2H+ и отрицательные ионы SO 4 -. Водород обменивается электронами с катодом и становится водородом, этот водород реагирует с PbSO 4 на катоде и образует серную кислоту (H 2 SO 4 ) и свинец (Pb). С другой стороны, SO 4 — обмениваются электронами с анодом и становятся радикалами SO 4 . Этот SO 4 реагирует с PbSO 4 анода и образует пероксид свинца PbO 2 и серную кислоту (H 2 SO 4 ). Энергия накапливается за счет увеличения плотности серной кислоты и увеличения потенциального напряжения ячейки.
Как объяснялось выше, в процессе зарядки на аноде и катоде происходят следующие химические реакции.
На катоде
PbSO 4 + 2e - => Pb + SO 4 2-
На аноде
PbSO 4 + 2H 2 O => PbO 2 + SO 4 2- + 4H - + 2e -
Объединив два приведенных выше уравнения, общая химическая реакция будет
2PBSO 4 + 2H 2 O => PBO 2 + PB + 2H 2 SO 4
9000 2
9000 . Каждый метод можно использовать для конкретных свинцово-кислотных аккумуляторов для конкретных приложений. В некоторых приложениях используется метод зарядки постоянным напряжением , в некоторых приложениях используется метод . 0016 метод постоянного тока , в то время как зарядка щекоткой также полезна в некоторых случаях. Обычно производитель аккумуляторов предоставляет надлежащий метод зарядки конкретных свинцово-кислотных аккумуляторов. Зарядка постоянным током обычно не используется при зарядке свинцово-кислотных аккумуляторов .
0016 метод постоянного тока , в то время как зарядка щекоткой также полезна в некоторых случаях. Обычно производитель аккумуляторов предоставляет надлежащий метод зарядки конкретных свинцово-кислотных аккумуляторов. Зарядка постоянным током обычно не используется при зарядке свинцово-кислотных аккумуляторов .
Наиболее распространенным методом зарядки свинцово-кислотных аккумуляторов является метод зарядки постоянным напряжением , который является эффективным процессом с точки зрения времени зарядки. При полном цикле заряда напряжение заряда остается постоянным, а ток постепенно уменьшается с увеличением уровня заряда аккумулятора.
Разрядка свинцово-кислотного аккумулятора
Разрядка свинцово-кислотного аккумулятора снова связана с химическими реакциями. Серная кислота находится в разбавленной форме, как правило, в соотношении 3:1 с водой и серной кислотой. При подключении нагрузок поперек пластин серная кислота снова распадается на положительные ионы 2H+ и отрицательные ионы SO 4 . Ионы водорода реагируют с PbO 2 и образуют PbO и воду H 2 O. PbO начинает реагировать с H 2 SO 4 и создает PbSO 4 и H 2 O.
Ионы водорода реагируют с PbO 2 и образуют PbO и воду H 2 O. PbO начинает реагировать с H 2 SO 4 и создает PbSO 4 и H 2 O.
С другой стороны SO 4 — ионы обменивают электроны с Pb, создавая радикал SO 4 , который далее создает реагирует с Pb.
Как объяснялось выше, в процессе разрядки на аноде и катоде происходят следующие химические реакции. Эти реакции прямо противоположны реакциям зарядки:
На катоде
Pb + SO 4 2- => PbSO 4 + 2e -
На аноде:
PBO 2 + SO 4 2- + 4H - + 2E - => PBSO 4 + 2H 2 o 4 + 2H 2 o + 2H 2 . будетPbO 2 + Pb + 2H 2 SO 4 => 2PbSO 4 + 2H 2 O
Из-за обмена электронами между анодом и катодом нарушается баланс электронов между пластинами.
Затем электроны проходят через нагрузку, и батарея разряжается.
Во время этого сброса плотность разбавленной серной кислоты уменьшается. Также при этом уменьшается разность потенциалов клетки.
Фактор риска и электрические характеристики
Свинцово-кислотный аккумулятор вреден, если не обслуживается безопасно. Поскольку батарея выделяет газообразный водород во время химического процесса, она очень опасна, если не используется в вентилируемом помещении. Также неаккуратная зарядка сильно портит батарею.
Каковы стандартные характеристики свинцово-кислотных аккумуляторов?
Каждая свинцово-кислотная батарея снабжена паспортом стандартного тока заряда и разряда. Обычно свинцово-кислотный аккумулятор на 12 В, который подходит для автомобильного применения, может иметь емкость от 100 до 350 Ач. Этот рейтинг определяется как рейтинг разряда с 8-часовым периодом времени.
Например, батарея емкостью 160 Ач может обеспечить ток питания 20 А на нагрузку в течение 8 часов пролета .
Мы можем потреблять больше тока, но это не рекомендуется делать. Потребление тока, превышающего максимальный ток разряда в течение 8 часов, приведет к снижению эффективности батареи, а также может измениться внутреннее сопротивление батареи, что еще больше повысит ее температуру.
С другой стороны, во время фазы зарядки, , мы должны быть осторожны с полярностью зарядного устройства , она должна быть правильно подключена к полярности аккумулятора. Обратная полярность опасна для зарядки свинцово-кислотного аккумулятора. Готовое зарядное устройство поставляется с измерителем зарядного напряжения и зарядного тока с возможностью управления. Мы должны обеспечить большее напряжение, чем напряжение батареи, чтобы зарядить батарею. Максимальный зарядный ток должен быть таким же, как максимальный ток питания при 8-часовой скорости разрядки. Если мы возьмем тот же пример 12 В 160 Ач, то максимальный ток питания составляет 20 А, поэтому максимальный безопасный ток зарядки составляет 20 А.
Не следует увеличивать или обеспечивать большой зарядный ток , так как это приведет к выделению тепла и повышенному газообразованию.
Правила обслуживания свинцово-кислотных аккумуляторов
- Полив — наиболее часто игнорируемая функция обслуживания залитых свинцово-кислотных аккумуляторов. Поскольку избыточная зарядка уменьшает количество воды, нам необходимо часто ее проверять. Меньшее количество воды вызывает окисление пластин и сокращает срок службы батареи. При необходимости добавьте дистиллированную или ионизированную воду.
- Проверьте вентиляционные отверстия, их нужно доработать резиновыми заглушками, часто резиновые заглушки слишком плотно прилегают к отверстиям.
- Подзаряжайте свинцово-кислотные батареи после каждого использования. Длительный период без подзарядки обеспечивает сульфатацию пластин.
- Не замораживайте аккумулятор и не заряжайте его при температуре выше 49 градусов по Цельсию.
При низких температурах окружающей среды аккумуляторы необходимо полностью заряжать, так как полностью заряженные аккумуляторы безопаснее, чем разряженные аккумуляторы в отношении замерзания.
- Не допускайте глубокой разрядки аккумулятора менее 1,7 В на элемент.
- Для хранения свинцово-кислотного аккумулятора его необходимо полностью зарядить, а затем слить электролит. Тогда батарея станет сухой и может храниться в течение длительного периода времени.
Что такое свинцово-кислотная батарея? Строительство, работа, разгрузка и перезарядка
Определение: Аккумулятор, в котором используется губчатый свинец и перекись свинца для преобразования химической энергии в электрическую, такой тип аккумулятора называется свинцово-кислотным аккумулятором. Свинцово-кислотные батареи чаще всего используются на электростанциях и подстанциях, потому что они имеют более высокое напряжение и более низкую стоимость.
Конструкция свинцово-кислотного аккумулятора
Различные части свинцово-кислотного аккумулятора показаны ниже.
Контейнер и пластины являются основной частью свинцово-кислотного аккумулятора. Контейнер хранит химическую энергию, которая с помощью пластин преобразуется в электрическую энергию.
1. Контейнер – Контейнер свинцово-кислотного аккумулятора изготовлен из стекла, облицованного свинцом дерева, эбонита, твердой резины из битумного компаунда, керамических материалов или формованных пластиков и установлен сверху во избежание вытекания электролита. . На дне контейнера есть четыре ребра, на двух из которых опирается положительная пластина, а на другие - отрицательные.
Призма служит опорой для пластин и одновременно предохраняет их от короткого замыкания. Материал, из которого изготовлены контейнеры аккумуляторов, должен быть стойким к серной кислоте, не должен деформироваться, быть пористым, содержать примеси, повредить электролит.
2. Пластина – Пластина свинцово-кислотного элемента имеет различную конструкцию, и все они состоят из некоторой формы сетки, состоящей из свинца и активного материала.
Сетка необходима для проведения электрического тока и для равномерного распределения тока по активному материалу. Если ток распределяется неравномерно, то активный материал ослабнет и выпадет.
Решетки изготовлены из сплава свинца и сурьмы. Обычно их делают с поперечным ребром, пересекающим места под прямым углом или по диагонали. Сетка для положительных и отрицательных пластин имеет одинаковую конструкцию, но сетки для отрицательных пластин сделаны более легкими, поскольку они не так важны для равномерного проведения тока.
Пластины аккумулятора бывают двух типов. Они представляют собой формованные пластины или плантные пластины и вклеенные или пластинчатые пластины.
Пластины Планте в основном используются для стационарных батарей, так как они тяжелее и дороже, чем вклеенные пластины. Но пластины более долговечны и менее подвержены потере активного материала при быстрой зарядке и разрядке. Плита плантеса имеет низкую удельную массу.
Процесс Фора больше подходит для изготовления отрицательных, чем положительных пластин.
Отрицательный активный материал довольно прочен и сравнительно слабо изменяется при зарядке и разрядке.
3. Активный материал – Материал в элементе, который принимает активное участие в химической реакции (поглощение или выделение электрической энергии) во время зарядки или разрядки, называется активным материалом элемента. Активными элементами свинцовой кислоты являются
- Перекись свинца (PbO 2 ) – образует положительный активный материал. PbO 2 имеют цвет темного шоколада.
- Губчатый провод – Его форма представляет собой отрицательный активный материал. Он серого цвета.
- Разбавленная серная кислота (H 2 SO 4 ) – Используется в качестве электролита. Он содержит 31% серной кислоты.
Пероксид свинца и губчатый свинец, которые образуют отрицательный и положительный активные материалы, имеют небольшую механическую прочность и поэтому могут использоваться отдельно.
4. Сепараторы – Сепараторы представляют собой тонкие листы непроводящего материала, изготовленные из химически обработанного свинцового дерева, пористой резины или матов из стекловолокна, которые помещаются между плюсом и минусом, чтобы изолировать их друг от друга. Сепараторы имеют вертикальные канавки с одной стороны и гладкие с другой стороны.
5. Клеммы аккумулятора – Аккумулятор имеет две клеммы: положительную и отрицательную. Положительная клемма диаметром 17,5 мм в верхней части немного больше, чем отрицательная клемма диаметром 16 мм.
Принцип работы свинцово-кислотного аккумулятора
При растворении серной кислоты ее молекулы распадаются на положительные ионы водорода (2H + ) и сульфатные отрицательные ионы (SO 4 — ) и свободно перемещаются. Если два электрода погружены в растворы и подключены к источнику постоянного тока, то ионы водорода заряжаются положительно и перемещаются к электродам и подключаются к отрицательной клемме источника питания.
ТАК 4 — отрицательно заряженные ионы двигались к электродам, подключенным к положительному выводу питающей магистрали (т. е. к аноду).
Каждый ион водорода забирает один электрон с катода, а каждый сульфат-ион забирает два отрицательных иона с анода и вступает в реакцию с водой с образованием серной и водородной кислоты.
Кислород, полученный из приведенного выше уравнения, реагирует с оксидом свинца и образует пероксид свинца (PbO 2 .) Таким образом, во время зарядки свинцовый катод остается в виде свинца, а свинцовый анод превращается в пероксид свинца шоколадного цвета.
Если источник питания постоянного тока отключен и вольтметр подключен между электродами, он покажет разность потенциалов между ними. Если провод соединяет электроды, то ток будет течь от положительной пластины к отрицательной через внешнюю цепь, т.е. ячейка способна поставлять электрическую энергию.
Химическое действие во время разрядки
Когда элемент полностью разряжен, анод изготавливается из перекиси свинца (PbO 2 ), а катод из металлического губчатого свинца (Pb).
Когда электроды соединены через сопротивление, ячейка разряжается, и электроны текут в направлении, противоположном направлению заряда.
Ионы водорода движутся к аноду и, достигая анодов, получают один электрон от анода и становятся атомом водорода. Атом водорода вступает в контакт с PbO 2 , поэтому он атакует и образует сульфат свинца (PbSO 4 ), беловатого цвета и воду в соответствии с химическим уравнением.
Каждый сульфат-ион (SO 4 — ) движется к катоду и, достигая его, отдает два электрона, становится радикалом SO 4 , атакует катод из металлического свинца и образует сульфат свинца беловатого цвета в соответствии с химическим уравнением .
Химическое действие во время перезарядки
Для перезарядки анод и катод подключаются к положительной и отрицательной клемме сети постоянного тока. Молекулы серной кислоты распадаются на ионы 2Н + и SO 4 — . Ионы водорода, будучи положительно заряженными, движутся к катодам, получают оттуда два электрона и образуют атом водорода.
Атом водорода реагирует с катодом сульфата свинца с образованием свинца и серной кислоты в соответствии с химическим уравнением.
SO 4 — ион движется к аноду, отдает два своих дополнительных электрона, становится радикалом SO 4 , реагирует с сульфатом свинца анодом и образует пероксид свинца и сернокислоту свинца по химическому уравнению. Зарядка и разрядка представлены одним обратимым уравнением, приведенным ниже.
Уравнение должно читаться вниз для разряда и вверх для перезарядки.
Работа свинцово-кислотного аккумулятора | Свинцово-кислотная вторичная аккумуляторная батарея
by Electrical4U
Работа свинцово-кислотной батареи преобразуется в электрическую энергию по мере необходимости. Преобразование электрической энергии в химическую с помощью внешнего источника электричества называется зарядкой батареи.
Тогда как преобразование химической энергии в электрическую энергию для питания внешней нагрузки известно как разрядка аккумуляторной батареи.
Во время зарядки аккумулятора через него проходит ток, который вызывает некоторые химические изменения внутри аккумулятора. Эти химические изменения поглощают энергию во время их формирования.Когда батарея подключена к внешней нагрузке, химические превращения происходят в обратном направлении, во время которых поглощенная энергия высвобождается в виде электрической энергии и поступает в нагрузку.
Теперь мы попытаемся понять принцип работы свинцово-кислотного аккумулятора , и для этого мы сначала обсудим свинцово-кислотная батарея , которая очень часто используется в качестве аккумуляторной батареи или вторичной батареи.Материалы, используемые для элементов свинцово-кислотной аккумуляторной батареи
Основными активными материалами, необходимыми для создания свинцово-кислотной батареи, являются
- Перекись свинца (PbO 2 ).
- Губчатый свинец (Pb)
- Разбавленная серная кислота (H 2 SO 4 ).
Перекись свинца (PbO
2 )
Положительная пластина изготовлена из перекиси свинца. Это темно-коричневое, твердое и хрупкое вещество.
Губчатый свинец (Pb)
Отрицательная пластина изготовлена из чистого свинца в состоянии мягкой губки.
Разбавленная серная кислота (H
2 SO 4 )
Разбавленная серная кислота, используемая для свинцово-кислотных аккумуляторов, имеет соотношение вода:кислота = 3:1.
Свинцово-кислотная аккумуляторная батарея изготавливается путем погружения пластины пероксида свинца и губчатой свинцовой пластины в разбавленную серную кислоту. Между этими пластинами внешне подключается нагрузка. В разбавленной серной кислоте молекулы кислоты расщепляются на положительные ионы водорода (H + ) и отрицательные сульфат-ионы (SO 4 - - ).
Ионы водорода, достигая пластины PbO 2 , получают от нее электроны и становятся атомом водорода, который снова атакует PbO 2 и образует PbO и H 2 O (вода). Этот PbO реагирует с H 2 SO 4 и образует PbSO 4 и H 2 O (вода).
SO 4 − − ионы свободно перемещаются в растворе, поэтому некоторые из них достигают пластины из чистого свинца, где отдают свои дополнительные электроны и становятся радикалами SO 4 . Поскольку радикал SO 4 не может существовать сам по себе, он атакует Pb и образует PbSO 4 .
Поскольку ионы H + забирают электроны с пластины PbO 2 , а ионы SO 4 - - отдают электроны пластине Pb, между этими двумя пластинами будет неравенство электронов. Следовательно, через внешнюю нагрузку между этими пластинами будет протекать ток для уравновешивания этого неравенства электронов.Этот процесс называется разрядкой свинцово-кислотного аккумулятора.
Сульфат свинца (PbSO 4 ) беловатого цвета. Во время разрядки
- Обе пластины покрыты PbSO 4 .
- Удельный вес раствора серной кислоты падает из-за образования воды при реакции на пластине PbO 2 .
- В результате скорость реакции падает, что означает уменьшение разности потенциалов между пластинами в процессе разрядки.
Теперь отключим нагрузку и подключим PbSO 4 с пластиной из PbO 2 с положительной клеммой внешнего источника постоянного тока и PbO 2 с пластиной из Pb с отрицательной клеммой этого источника постоянного тока. При разрядке плотность серной кислоты падает, но серная кислота все еще присутствует в растворе. Эта серная кислота также остается в растворе в виде ионов H + и SO 4 − − . Ионы водорода (катион), заряженные положительно, перемещаются к электроду (катоду), соединенному с отрицательным полюсом источника постоянного тока.
Здесь каждый H 9Ион 0346 + забирает у него один электрон и становится атомом водорода. Затем эти атомы водорода атакуют PbSO 4 и образуют свинец и серную кислоту.
SO 4 − − ионы (анионы) движутся к электроду (аноду), соединенному с положительной клеммой источника постоянного тока, где они отдают свои лишние электроны и становятся радикалами SO 4 . Этот радикал SO 4 не может существовать сам по себе, поэтому вступает в реакцию с PbSO 4 анода и образует пероксид свинца (PbO 2 ) и серная кислота (H 2 SO 4 ).
Следовательно, при зарядке элемента свинцово-кислотной аккумуляторной батареи
- Анод из сульфата свинца превращается в пероксид свинца.
- Катодный сульфат свинца превращается в чистый свинец.
- Терминал; потенциал клетки возрастает.
- Увеличивается удельный вес серной кислоты.
Видеопрезентация принципа работы свинцово-кислотного аккумулятора
Хотите учиться быстрее? 🎓
Каждую неделю получайте электротехнические товары в свой почтовый ящик.

Кредитная карта не требуется — это абсолютно бесплатно.О Electrical4U
Electrical4U посвящен обучению и распространению всего, что связано с электротехникой и электроникой.
...
Свинцово-кислотная батарея: принципы работы
Свинцово-кислотная батарея: принципы работы
Свинцово-кислотный аккумулятор: принципы работы
John Denker
* Содержание
- 1 Реакции полуклеток
- 2 Дрейф и диффузия
- 2.1 Предварительная притча
- 2.2 Ионы бисульфата
- 3 Порядок реакции
- 4 Номера
1 Реакции полуэлементов
Фабрика изготавливает каждый элемент батареи следующим образом:
клемма «-» представляет собой толстую пористую пластину металлического свинца. Подключен к
клемма «+» представляет собой пластину, состоящую в основном из пористого диоксида свинца
пасты, поддерживаемой тонкой металлической сеткой. В
между пластинами находится довольно концентрированная серная кислота (около 4М).Предварительно отметим, что серная кислота является
сильная кислота по отношению к ее первому протону, поэтому даже
до того, как кислота была добавлена в аккумулятор,
завершилась следующая реакция:
H 2 SO 4 → H + + HSO 4 − 8
(1)Эта реакция связана с объемом электролита, независимо от
пластины аккумулятора. Это не электрохимическая реакция, а
не зависит от зарядки и разрядки аккумулятора. Мы делаем
не ожидайте, что серная кислота высвободит свой второй протон с любым
большая вероятность – всего доли процента – поскольку
К а2 всего 0,012.При разрядке аккумулятора происходит следующая реакция полуэлемента
происходит на пластине «-»:
Pb + HSO 4 − → PbSO 4 + H + + 2e − (с) (водн. )
дисч (с) (водн.) (с) 903 (2)
Эта реакция имеет большой смысл. Как обсуждалось в
ссылка 1, когда ячейка находится под нагрузкой, есть
электрическое поле в электролите, вызывающее появление отрицательных ионов (в этом
казебисульфат) дрейфовать в сторону «-» пластины. См. рисунок 2. Отрицательный ион расходуется в результате реакции с
пластина. В реакции также образуется положительный ион (протон), который
дрейфует под действием упомянутого поля. Два
электроны остаются в пластине, чтобы быть доставленными к
Терминал. В этом нет ничего удивительного.«Прямое» направление уравнения 2 представляет
разрядка аккумулятора. Для представления зарядки (она же подзарядка)
операции, просто измените направление стрелки. Результат делает
смысл тоже.Между тем, вторая половина реакции разряда происходит на
Табличка "+". Это может быть записано по-разному, из которых
следующее условно:
PbO 2 + 3H + + HSO 4 − + 2e − → PbSO 4 + 2H 2 O (s) (aq) (aq) (s) disch (s) (3) Некоторые детали уравнения 3 требуют особого внимания.
анализ, как будет обсуждаться в разделе 2 и
раздел 3. Однако сначала давайте обсудим несколько моментов,
относительно легко понять.На каждой пластине соединения свинца нерастворимы и остаются прикрепленными к
плита; в растворе никогда не бывает значительного количества свинца.
Остальные продукты реакции (вода и серная кислота) полностью
растворимый. Эти свойства являются важной частью того, почему клетка
перезаряжаемый. (Напротив, в неперезаряжаемых батареях
обычно продукты реакции, которые становятся недоступными для повторного использования,
выходящий в виде газа или нерастворимого осадка.)Аналогично, свободные электроны, которые высвобождаются по уравнению 2 и потребляются по уравнению 3, не
растворим в электролите. Ионы H + и HSO 4 − являются
растворимы, а электроны нет. Это может показаться очевидным, но это
не банально. Если бы электроны были растворимы, батарея не работала бы.
Это закоротило бы себя.Если мы сложим вместе две реакции полуячейки, мы получим реакцию полной ячейки
реакция разряда:
Pb + PbO 2 + 2H 2 SO 4 → 2PbSO 4 + 2H 2 O (s) (s) (aq) disch (s) (4) При разгрузке потребляется кислота и образуется вода.
В процессе заряда расходуется вода и образуется кислота.
Поскольку серная кислота намного плотнее воды, широко используемый
Метод проверки состояния заряда аккумулятора заключается в измерении
удельный вес электролита. (Неспециалисты иногда догадываются
что изменение плотности связано с присутствием тяжелого свинца
соединения в растворе, как будто произошла какая-то реакция свинцового покрытия.
участвует, но это не так.) См. рис. 1.При разряде на пластине «–» происходит окисление свинца из
металлический Pb в двухвалентный Pb(II). Это высвобождает отрицательный заряд в
табличка «-». При этом на пластине «+» свинец
восстанавливается из четырехвалентного Pb(IV) в двухвалентный Pb(II). Это освобождает
Положительный заряд в пластину «+».Конечно, во время перезарядки происходят противоположные окислительно-восстановительные реакции.
Остерегайтесь сложной терминологии:
- Во время операции разряда пластина «-» называется
анод (поскольку материал пластины окисляется), а
Пластина «+» называется катодом (поскольку материал пластины
уменьшенный).- Во время зарядки пластина «–» теперь должна быть
называется катодом (поскольку материал пластины теперь уменьшается),
а пластину «+» теперь надо называть анодом (поскольку пластина
материал окисляется).Ситуация представлена в следующей таблице:
зарядка разгрузка 900 30023
− plate: cathode
being reducedanode
being oxidized+ plate: anode
being oxidizedcathode
сокращаетсяОтсюда можно сделать вывод, что для аккумуляторной батареи следует
никогда не маркируйте слова «катод» или «анод» на клеммах. Видеть
ссылка 2 для правильного определения «анода» и
«катод», а также сопутствующие вопросы.2 Дрейф и диффузия
2.1 Предварительная притча
В качестве основы рассмотрим гетерогенный катализ, такой как
каталитическое окисление паров ацетона на поверхности меди. Если там есть
без перемешивания реакция будет протекать медленно, т.к.
реагенты должны диффундировать на поверхность, а продукты должны
рассеиваться. Диффузия — довольно медленный процесс, особенно
диффузия на большие расстояния.Обратите внимание, что это изображение реагентов (или продуктов), протекающих по
градиент концентрации несовместим с вашими интуитивными представлениями о
протекание электрического тока в цепи постоянного тока. Рассмотрим следующее
контраст:
Химическая реакция Цепь постоянного тока
Реагенты и продукты не являются неразрушимыми.
реагенты истощаются в ходе реакции. Продукты
накапливать.Заряд течет несжимаемым, нерушимым
жидкость, без скопления или истощения в любом месте.2.2 Ионы бисульфата
Обратите внимание, что в свинцово-кислотном аккумуляторе во время разрядки ионы бисульфата
потребляется в обоих местах, как на «-» тарелке, так и на «+»
пластины, как указано в уравнении 2 и уравнении 3. Во время разряда электролит становится
значительно более разбавленным, так как расходуется бисульфат, а вода
освобожден. Одним из практических следствий является то, что вы можете измерить, насколько
полностью заряженный аккумулятор измеряется плотностью
электролита с помощью ареометра, возможно, простого типа, показанного на рис.
рисунок 1.Рис. 1. Простой ареометр
Сначала рассмотрим условия разомкнутой цепи, нулевой нагрузки, равновесия.
Там
отсутствует электрическое поле в объеме электролита. Это означает
причина. Если бы существовало электрическое поле, ионы двигались бы
поле. Положительные ионы будут течь в одном направлении, а
отрицательные ионы будут течь в другом направлении, что противоречит
предположение, что это ситуация равновесия с нулевым током.Также в равновесии отсутствует значительный градиент концентрации в
основная масса электролита.Теперь рассмотрим операцию разряда, как показано на рис. 2. Синяя пластина — это пластина «+», а красная
тарелка — это тарелка «-». Фиолетовые стрелки показывают направление
текущий поток. Они также показывают направление электрического поля. Это
Энергетически выгодно, чтобы положительный заряд протекал в
направление стрелок.Рис. 2. Ток и поля во время разряда
К тому же энергетически выгоден для отрицательных видов
течь в направлении, противоположном стрелкам. В частности, это
означает, что ионы бисульфата будут перемещаться слева направо на рисунке 2, обеспечивая подачу реагентов в соответствии с требованиями
уравнение 2.Пока все хорошо.
Увы, мы не можем использовать эту цепочку рассуждений, чтобы объяснить, как бисульфат
ионы попадают на положительный полюс. Уравнение 3 будет
вскоре поглощают все ионы бисульфата в непосредственной близости. Если
реакция должна продолжаться, они должны быть восполнены из
где-то. Это требует, чтобы ионы текли вверх (против градиента
электрохимического потенциала).Единственным возможным объяснением является то, что некоторые ионы диффундируют
в гору. Это, безусловно, возможно, учитывая очень большой
концентрациях и коротких расстояниях. Распределение
маленькие черные кружки на рисунке 2 означают
сильно преувеличенное представление концентрации бисульфата
анионы. Диффузия заставит анионы течь из объема в сторону
плиты в обе стороны.Давайте проясним: на пластине «-» жизнь проста, потому что дрейф и
диффузия работают вместе, чтобы привести реагенты к пластине.
Напротив, на клемме «+» ситуация неразбериха, т.к.
дрейф работает в бесполезном направлении, и мы должны полагаться на
диффузия для доставки реагентов на пластину.Это намного хуже, чем
реакция с ацетоном, рассмотренная в разделе 2.1, где
распространение не встретило сопротивления.Легко предположить, что все, что происходит вблизи положительного
пластина накладывает существенное ограничение на то, какой ток мы можем получить
из батареи. Мы также можем предсказать, что перемешивание
электролит повысит производительность батареи. Много перемешивания
схемы обсуждаются в литературе, но обычно только при
феноменологический, недетализированный уровень.Трудно найти количественные данные о любых микроскопических
процессы, происходящие в электролите вблизи
Табличка "+". Стандартная книга по свинцово-кислотным аккумуляторам
ссылка 3, но в ней не рассматривается этот вопрос. Немного
дразнящие веб-страницы – эталон 4 и эталон 5.
Если кто-нибудь знает хорошие ссылки на эту тему, пожалуйста, дайте мне
знать.Подведем некоторые цифры: Ячейка имеет напряжение холостого хода 2,2
вольты такие. Предположим, что мы поместили его под большую нагрузку, так что там
составляет Δv = 0,4 В «ИК» падение на электролите.В качестве
всегда комнатная температура соответствует 25 мэВ, т.е. 0,025
электрон-вольт. Мы можем использовать это для вычисления коэффициента Больцмана,
т. е. доля ионов бисульфата успевает подняться до потенциала
exp(q Δv/kT) = exp(0,4/0,025) = 9 000 000. Итак, под
сильноточные условия, если скорость реакции ограничена
наличия бисульфат-ионов, ожидаем реакцию на «+»
пластина двигаться в миллионы раз медленнее, чем это было бы «идеально».Напротив, в слаботочных условиях реакция
скорость ограничена наличием электронов, поэтому доступность
Ионы бисульфата не проблема.В предыдущем расчете мы не учитывали влияние диэлектрической
скрининг. Это могло или не могло быть правильным поступком. Аргумент
за: энергия сохраняется. В конце дня, чтобы перейти на бисульфат
ион вверх по холму высотой 0,4 вольта, вы должны сделать 0,4 эВ работы. Аргумент
минус: большая часть высоты холма связана с диполем
слой у кромки воды, в месте, где электролит
встречается с тарелкой; в объеме электролита поле
меньше.Ионы могут с относительно разумной вероятностью получить
замкните на пластину «+», сразу за дипольным слоем.
Вопрос без ответа: если они подойдут так близко, достаточно ли этого?В любом случае экранирование не устраняет полностью энергию
барьер. По обычному аргументу Клаузиуса-Моссотти
(ссылка 6), поле внутри сферического отверстия в
диэлектрическая проницаемость составляет 1/3 пути между полностью экранированным значением и
неэкранированное значение. Итак, если мы подставим числа, мы получим куб
корень из предыдущего числа, то есть коэффициент 200. Это намного меньше
чем 9миллионов, но это все еще достаточно много, чтобы заслуживать внимания
к. Я предполагаю, что это ограничивает количество тока, которое
батарея может потушить.3 Порядок реакции
Является ли реакция действительно третьего порядка по концентрации протонов, как
предложено уравнением 3? Я сомневаюсь в этом. я подозреваю это
придаст батарее очень своеобразную вольт-амперную характеристику, в отличие от
что наблюдается.Если реакция протекает через некоторую последовательность промежуточных стадий,
возможно, в соответствии с гипотетическими реакциями, приведенными в этом
сечении была бы зависимость более низкого порядка от H + активность.Возможная последовательность:
PbO 2 + H + + e − → PbOOH (5а) (с) (водн.) disch (s) PbOOH + H + + e − → Pb( ОХ) 2 (5б) (с) (водн. )
disch (s) Pb(OH) 2 + HSO 4 − → PbSO 4 + OH − + H 2 O 3 900 0 3 (5с) (с) (aq) disch (s) (aq) H + + OH − → H 2 O 3 3
(5д)(водн.) (aq) disch Как обсуждалось в разделе 2, это энергетически невыгодно.
чтобы анионы бисульфата двигались к положительной пластине, что
ограничение на уравнение 5c. Напротив, такого ограничения нет
относится к анионам OH − в уравнении 5d, поскольку они
производятся на положительной пластине. Им не нужно двигаться
к тарелке. Это энергетически выгодно для H + ионов к
дрейфовать к положительной пластине.С точки зрения заряда чистый эффект уравнения 5 заключается в том, что два
электроны переходят с пластины в электролит, поэтому
что две единицы положительного заряда доставляются к терминалу.Вот еще одна гипотетическая последовательность, использующая PbO вместо Pb(OH) 2
как промежуточный:
PbO 2 + H + + e − → PbOOH (6а) (с) (водн. )
DISCH (S) PBOOH + H + H + H + H + ч + H + H + 347 + e − → PbO + H 2 O (6б) (с) (водн.) DISCH (S) PBO + HSO 4 4
+ HSO 4
6 4
6
+ HSO 4
6 4
6 +
HSO 4
6
+ 4
+ 4
+ 4
+ . 0346 −
→ PbSO 4 + OH − (6с) (s) (aq) disch (s) (aq) H + + OH - → H 2 O (6д) (AQ) (AQ) DISCH 9898
.
выше играют какую-либо роль в реальных батареях.4 Ссылки
1.
«Как работает батарея», то есть микроскопия того, как она работает.
производит напряжение: www.av8n.com/physics/battery.htm
2.
Джон Денкер, «Как определить анод и катод»
./анод-катод.htm
3.
Ганс Боде Свинцово-кислотные батареи Wiley (1977).
4.
«Отчет о батареях подводных лодок»
http://www.mcs.vuw.ac.nz/~markm/preprints/SubBatteriesReport.pdf
5.
«Свинцово-кислотные аккумуляторы»
http://www.accuoerlikon.com/html/accud02.htm
6.
«Внутри диэлектриков» Фейнмановские лекции по физике, том II
глава 11.Принцип работы свинцово-кислотных и литий-ионных аккумуляторов
Свинцово-кислотные и литиевые аккумуляторы в настоящее время широко используются в быту. Давайте посмотрим на принципы работы свинцово-кислотных аккумуляторов и литиевых аккумуляторов.
Как работает свинцово-кислотный аккумулятор
Когда серная кислота растворяется, ее молекулы распадаются на положительные ионы водорода (2H+) и сульфатные отрицательные ионы (SO4—) и свободно перемещаются.
Если два электрода погружены в растворы и подключены к источнику постоянного тока, то ионы водорода заряжаются положительно и перемещаются к электродам и подключаются к отрицательной клемме источника питания. Отрицательно заряженные ионы SO4- перемещались к электродам, подключенным к положительной клемме питающей сети (т. е. к аноду).
Каждый ион водорода забирает один электрон с катода, а каждый сульфат-ион забирает два отрицательных иона с анода и вступает в реакцию с водой с образованием серной и водородной кислоты.
Кислород, полученный по приведенному выше уравнению, реагирует с оксидом свинца и образует пероксид свинца (PbO2). Таким образом, во время зарядки свинцово-кислотных аккумуляторов свинцовый катод остается в виде свинца, а свинцовый анод превращается в пероксид свинца шоколадного цвета. .
Если источник постоянного тока отключен и вольтметр подключен между электродами, он покажет разность потенциалов между ними. Если провод соединяет электроды, то ток будет течь от положительной пластины к отрицательной через внешнюю цепь, т.
е. ячейка способна поставлять электрическую энергию.
Химическое действие во время разрядки
Когда элемент полностью разряжен, анод изготавливается из перекиси свинца (PbO2), а катод из металлического губчатого свинца (Pb). Когда электроды соединены через сопротивление, ячейка разряжается, и электроны текут в направлении, противоположном тому, что происходит во время зарядки.
Ионы водорода движутся к аноду и, достигая анодов, получают один электрон от анода и становятся атомом водорода. Атом водорода вступает в контакт с PbO2, поэтому он атакует и образует сульфат свинца (PbSO4), беловатого цвета и воду согласно химическому уравнению.
Каждый ион сульфата (SO4—) движется к катоду и, достигая там, отдает два электрона, становится радикалом SO4, атакует катод из металлического свинца и образует сульфат свинца беловатого цвета в соответствии с химическим уравнением.
Химическое действие во время перезарядки
Для перезарядки анод и катод подключаются к положительной и отрицательной клемме сети постоянного тока.
Молекулы серной кислоты распадаются на ионы 2Н+ и SO4—. Ионы водорода, будучи положительно заряженными, движутся к катодам, получают оттуда два электрона и образуют атом водорода. Атом водорода реагирует с катодом сульфата свинца с образованием свинца и серной кислоты в соответствии с химическим уравнением.
SO4— ион движется к аноду, отдает два дополнительных электрона, становится радикалом SO4, реагирует с анодом из сульфата свинца и образует пероксид свинца и серную кислоту в соответствии с химическим уравнением.
Зарядка и разрядка представлены одним обратимым уравнением, приведенным ниже.
Уравнение должно читаться вниз для разряда и вверх для перезарядки.
Химия литий-ионных аккумуляторов
Как следует из названия, ионы лития (Li+) участвуют в реакциях, приводящих в действие аккумулятор. Оба электрода в литий-ионном элементе изготовлены из материалов, которые могут интеркалировать или «поглощать» ионы лития (немного похоже на гидрид-ионы в NiMH-батареях).
Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионного аккумулятора ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Литий-ионный аккумулятор начинает свою жизнь в состоянии полного разряда: все его ионы лития интеркалированы внутри катода, а его химический состав еще не способен производить электричество. Прежде чем вы сможете использовать аккумулятор, его необходимо зарядить. Когда аккумулятор заряжается, на катоде происходит реакция окисления, а это означает, что он теряет часть отрицательно заряженных электронов. Для поддержания баланса зарядов на катоде в раствор электролита растворяют равное количество положительно заряженных интеркалированных ионов лития. Они перемещаются к аноду, где внедряются в графит.
Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Во время разряда ионы лития деинтеркалируются с анода и возвращаются через электролит к катоду. Это также высвобождает электроны, которые привязывали их к аноду, и они текут по внешнему проводу, обеспечивая электрический ток, который мы использовали для выполнения работы. Именно соединение внешнего провода позволяет протекать реакции — когда электроны могут свободно перемещаться, то и положительно заряженные ионы лития уравновешивают движение своего отрицательного заряда.
Когда катод заполняется ионами лития, реакция прекращается и батарея разряжается. Затем мы снова перезаряжаем наши литий-ионные батареи, и внешний электрический заряд, который мы прикладываем, выталкивает ионы лития обратно в анод от катода.
Электролит в литий-ионном элементе обычно представляет собой раствор солей лития в смеси растворителей (таких как диметилкарбонат или диэтилкарбонат), разработанный для улучшения характеристик аккумулятора.
Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (интеркалироваться) катодом. Обратное происходит во время перезарядки.
Будучи маленьким и легким, большое количество лития может храниться (интеркалироваться) в обоих электродах. Поэтому литиевые батареи часто используются в ховер-картах. Именно это придает литий-ионным батареям высокую плотность энергии. Например, один ион лития может храниться на каждые шесть атомов углерода в графите, и чем больше ионов лития участвует в путешествии от анода к катоду (и обратно во время циклов перезарядки), тем больше электронов остается на пути. уравновешивают их движение и обеспечивают электрический ток.
Перенос ионов лития между электродами происходит при гораздо более высоком напряжении, чем в батареях других типов, и, поскольку они должны быть уравновешены равным количеством электронов, один литий-ионный элемент может производить напряжение 3,6 вольта или выше.
, в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
Из-за их высокой плотности энергии и относительной легкости установка большого количества литий-ионных элементов вместе в одном месте позволяет получить аккумуляторный блок, который намного легче и компактнее, чем стек из других типов аккумуляторов. Если мы сложим вместе достаточное количество литий-ионных элементов, мы сможем достичь довольно высокого напряжения, например, необходимого для запуска электромобиля. Конечно, во всех наших автомобилях уже есть аккумуляторы, но они нужны только для того, чтобы запустить бензиновый или дизельный двигатель, тогда всю работу делает топливо. Аккумулятор электромобиля — это его источник энергии и то, что дает ему возможность подняться на крутой холм. Таким образом, он обычно будет иметь 96 вольт или даже больше, что даже при высоком напряжении литий-ионного элемента требует довольно много элементов, сложенных вместе.



 Именно поэтому эти батареи обладают самыми высокими пусковыми токами и огромным сроком службы. Производитель заявляет о 12 годах работы.
Именно поэтому эти батареи обладают самыми высокими пусковыми токами и огромным сроком службы. Производитель заявляет о 12 годах работы.
