Содержание
ᐉ Устройство карданной передачи
Трансмиссия полноприводной колесной машины включает в себя несколько карданных передач с карданными шарнирами неравных угловых скоростей, а также карданные передачи с карданными шарнирами равных угловых скоростей, которые устанавливаются в приводе управляемых ведущих колес.
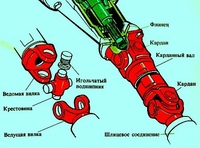
Рассмотрим устройство основных частей карданных передач. Карданный шарнир неравных угловых скоростей состоит из двух вилок — 1 и соединенных крестовиной 3. Одна из вилок иногда имеет фланец, а другая приварена к трубе карданного вала или имеет шлицевой наконечник 6 (или втулку) для соединения с карданным валом. Шипы крестовины устанавливаются в проушины обеих вилок на игольчатых подшипниках 7. Каждый подшипник размещается в корпусе 2 и удерживается в проушине вилки крышкой, которая присоединена к вилке двумя болтами, стопорящимися усиками шайбы. В отдельных случаях подшипники закрепляются в вилках стопорными кольцами. Для удержания смазки в подшипнике и защиты его от попадания воды и грязи имеется резиновый самоподжимной сальник. Внутренняя полость крестовины через масленку заполняется смазкой, поступающей к подшипникам. В крестовине обычно имеется предохранительный клапан, защищающий сальник от повреждения под действием давления нагнетаемой в крестовину смазки. Шлицевое соединение 6 смазывается с помощью масленки 5.
Внутренняя полость крестовины через масленку заполняется смазкой, поступающей к подшипникам. В крестовине обычно имеется предохранительный клапан, защищающий сальник от повреждения под действием давления нагнетаемой в крестовину смазки. Шлицевое соединение 6 смазывается с помощью масленки 5.
Максимальный угол между осями валов, соединенных карданными шарнирами неравных угловых скоростей, обычно не превышает 20°, так как при больших углах значительно снижается КПД карданных передач. Если угол между осями валов изменяется в пределах 0 …2%, то шипы крестовины деформируются иглами подшипников, и карданный шарнир быстро разрушается.
Рис. Детали карданного шарнира неравных угловых скоростей
В трансмиссиях быстроходных гусеничных машин часто применяются карданные передачи с карданными шарнирами типа зубчатых муфт, допускающими передачу вращающего момента между валами, оси которых пересекаются под углом до 1,5… 2°.
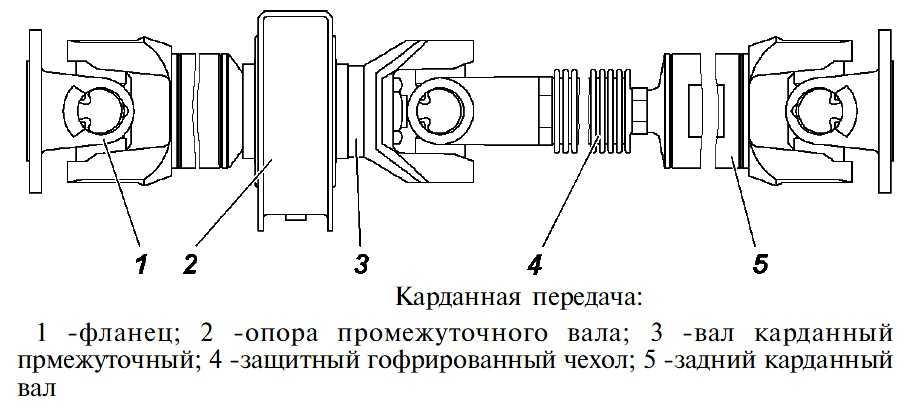
Карданные валы выполняют, как правило, трубчатыми, для чего применяют специальные стальные цельнотянутые или сварные трубы. К трубам приваривают вилки карданных шарниров, шлицевые втулки или наконечники. Для уменьшения поперечных нагрузок, действующих на карданный вал, осуществляют его динамическую балансировку в сборе с карданными шарнирами. Дисбаланс устраняют приваркой к карданному валу балансировочных пластин, а иногда установкой балансировочных пластин под крышки подшипников карданных шарниров. Взаимное положение деталей шлицевого соединения после сборки и балансировки карданной передачи на заводе обычно отмечается специальными метками.
К трубам приваривают вилки карданных шарниров, шлицевые втулки или наконечники. Для уменьшения поперечных нагрузок, действующих на карданный вал, осуществляют его динамическую балансировку в сборе с карданными шарнирами. Дисбаланс устраняют приваркой к карданному валу балансировочных пластин, а иногда установкой балансировочных пластин под крышки подшипников карданных шарниров. Взаимное положение деталей шлицевого соединения после сборки и балансировки карданной передачи на заводе обычно отмечается специальными метками.
Компенсирующее соединение карданной передачи обычно выполняют в виде шлицевого соединения, допускающего осевое перемещение деталей карданной передачи и состоящего из шлицевого наконечника, который входит в шлицевую втулку карданной передачи. Смазку вводят в шлицевое соединение из масленки или при сборке закладывают смазку, которую заменяют после длительного пробега ТС. Для защиты шлицевого соединения от вытекания смазки и загрязнения обычно устанавливают сальник и чехол.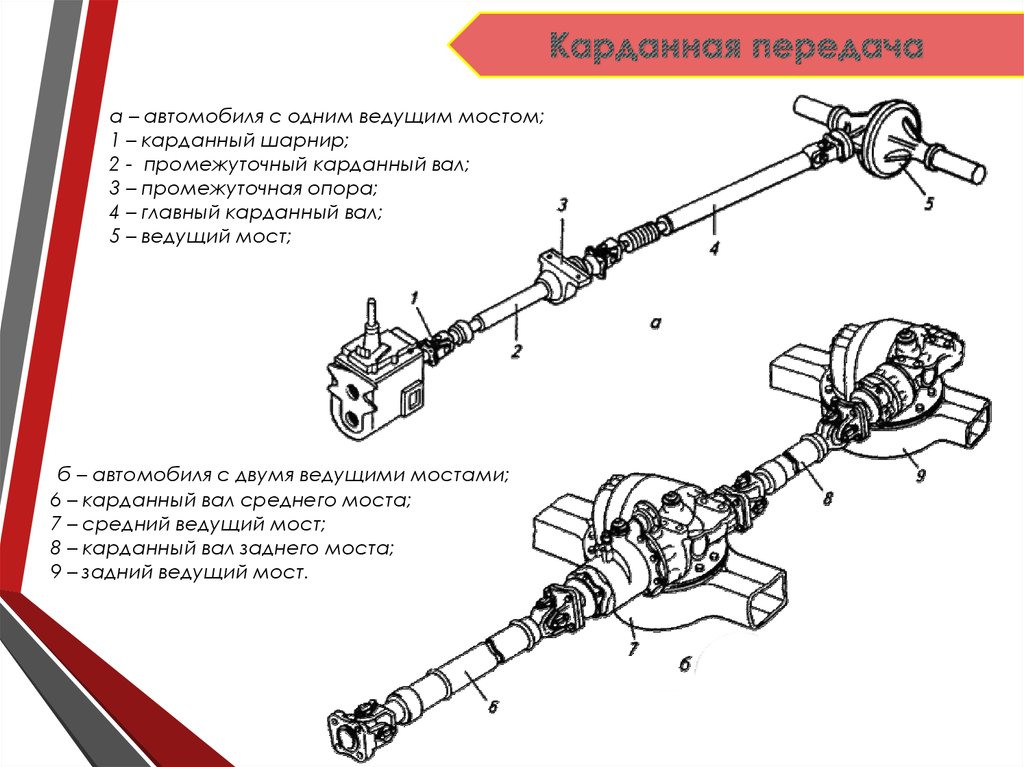
При большой длине карданных валов в карданных передачах обычно применяют промежуточные опоры. Промежуточная опора, как правило, представляет собой прикрепленный болтами к поперечине рамы кронштейн, в котором установлен в резиновом упругом кольце шариковый подшипник, закрытый с обеих сторон крышками с сальниками и устройством для его смазывания. Наличие упругого резинового кольца позволяет компенсировать неточности сборки и перекосы подшипника, возможные при деформациях рамы ТС.
Карданный шарнир равных угловых скоростей шарикового типа с делительными канавками состоит из двух вилок, пяти шариков, штифта и стопорной шпильки. Ведущая вилка изготавливается как единое целое с полуосью 6, а ведомая вилка — с приводным валом 23 колеса. В каждой вилке 3 и 4 (рис. а) выполнено по четыре канавки, в них устанавливаются четыре ведущих (боковых) шарика 7, через которые и передается вращение от одной вилки к другой. При любом угле между валами боковые шарики в канавках вилок находятся в плоскости, делящей этот угол пополам, благодаря чему вращение от ведущего вала к ведомому передается равномерно. Центральный (пятый) шарик 2 помещается между торцами вилок и обеспечивает их центрирование. Для возможности установки ведущих шариков в канавки вилок центральный шарик имеет лыску с отверстием, которым он при сборке карданного шарнира устанавливается против вставляемого бокового шарика. После сборки карданного шарнира центральный шарик фиксируется в определенном положении штифтом 6, закрепляемым стопорной шпилькой 5 в отверстии ведомой вилки.
Центральный (пятый) шарик 2 помещается между торцами вилок и обеспечивает их центрирование. Для возможности установки ведущих шариков в канавки вилок центральный шарик имеет лыску с отверстием, которым он при сборке карданного шарнира устанавливается против вставляемого бокового шарика. После сборки карданного шарнира центральный шарик фиксируется в определенном положении штифтом 6, закрепляемым стопорной шпилькой 5 в отверстии ведомой вилки.
Рис. Детали карданных шарниров равных угловых скоростей:
а — шариковый; б — кулачковый; 1 — ведущие (боковые) шарики; 2 — центральный шарик; 3, 4, 7, 11 — вилки; 5 — шпилька; 6 — штифт; 8, 10 — кулачки; 9 — диск
Карданные шарниры такой конструкции могут работать при углах между валами до 30…35°. Их недостатками являются необходимость точной фиксации валов в осевом направлении, а также высокие давления на контактных поверхностях, что снижает их долговечность и ограничивает применение таких карданных шарниров на полноприводных колесных машинах большой грузоподъемности.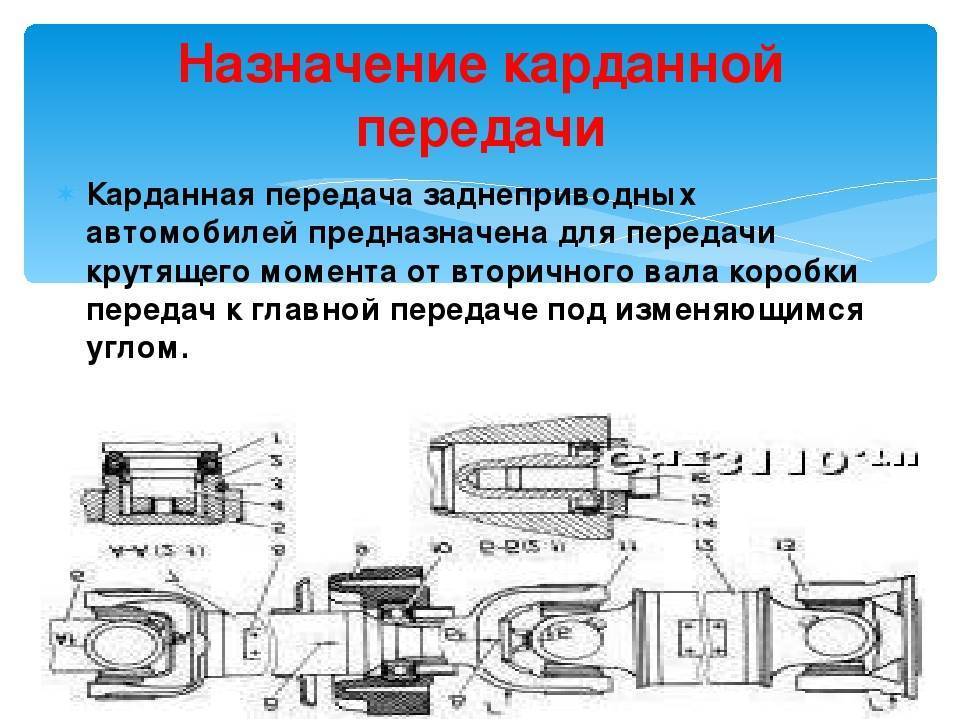 На них в приводе управляемых ведущих колес устанавливают карданные шарниры равных угловых скоростей шарикового типа с делительным рычажком или кулачковые, а также сдвоенные карданные шарниры неравных угловых скоростей.
На них в приводе управляемых ведущих колес устанавливают карданные шарниры равных угловых скоростей шарикового типа с делительным рычажком или кулачковые, а также сдвоенные карданные шарниры неравных угловых скоростей.
На рисунке б показано устройство кулачкового карданного шарнира равных угловых скоростей, устанавливаемого в приводе управляемых ведущих колес автомобилей КамАЗ, «Урал» и др.
В вилках 7 и 11, связанных с валами (полуосями) привода колеса, могут поворачиваться кулачки 8 и 10, которые шарнирно соединяются между собой диском 9, входящим в их вырезы (пазы). При передаче вращения, когда валы привода расположены под углом (поворот управляемых колес), каждый из кулачков 8 и 10 поворачивается одновременно относительно вилки и реи диска. Оси отверстий вилок лежат в одной плоскости и совпадают со средней плоскостью диска 9. Эти оси расположены на равных расстояниях от точки пересечения осей валов и всегда перпендикулярны валам, поэтому точка их пересечения при любом положении вилок располагается в биссекторной плоскости. Вал внутренней вилки 11 шлицами соединяется с полуосевой шестерней дифференциала, а вал наружной вилки 7 — со ступицей колеса.
Вал внутренней вилки 11 шлицами соединяется с полуосевой шестерней дифференциала, а вал наружной вилки 7 — со ступицей колеса.
Кулачковые карданные шарниры могут работать при углах поворота до 50°. Благодаря большой контактной поверхности деталей, через которые передаются усилия, кулачковый карданный шарнир имеет небольшие размеры. Их основной недостаток — более низкий, чем у карданных шарниров, КПД и как следствие сильный нагрев при работе.
Карданные валы и вилки изготавливаются из углеродистой, а крестовины — из хромистой и хромоникелевой сталей. Для смазывания карданных передач применяется трансмиссионное масло (нигрол).
Карданная передача | Устройство автомобиля
Что входит в устройство карданной передачи?
Карданная передача автомобиля ЗИЛ-130 (рис.130) состоит из карданных шарниров I, карданных валов II, промежуточной опоры III (на некоторых автомобилях с короткой базой промежуточная опора может не устанавливаться). Карданный вал представляет собой стальную пустотелую трубу 11, к концам которой приварены вилки с проушинами карданного шарнира.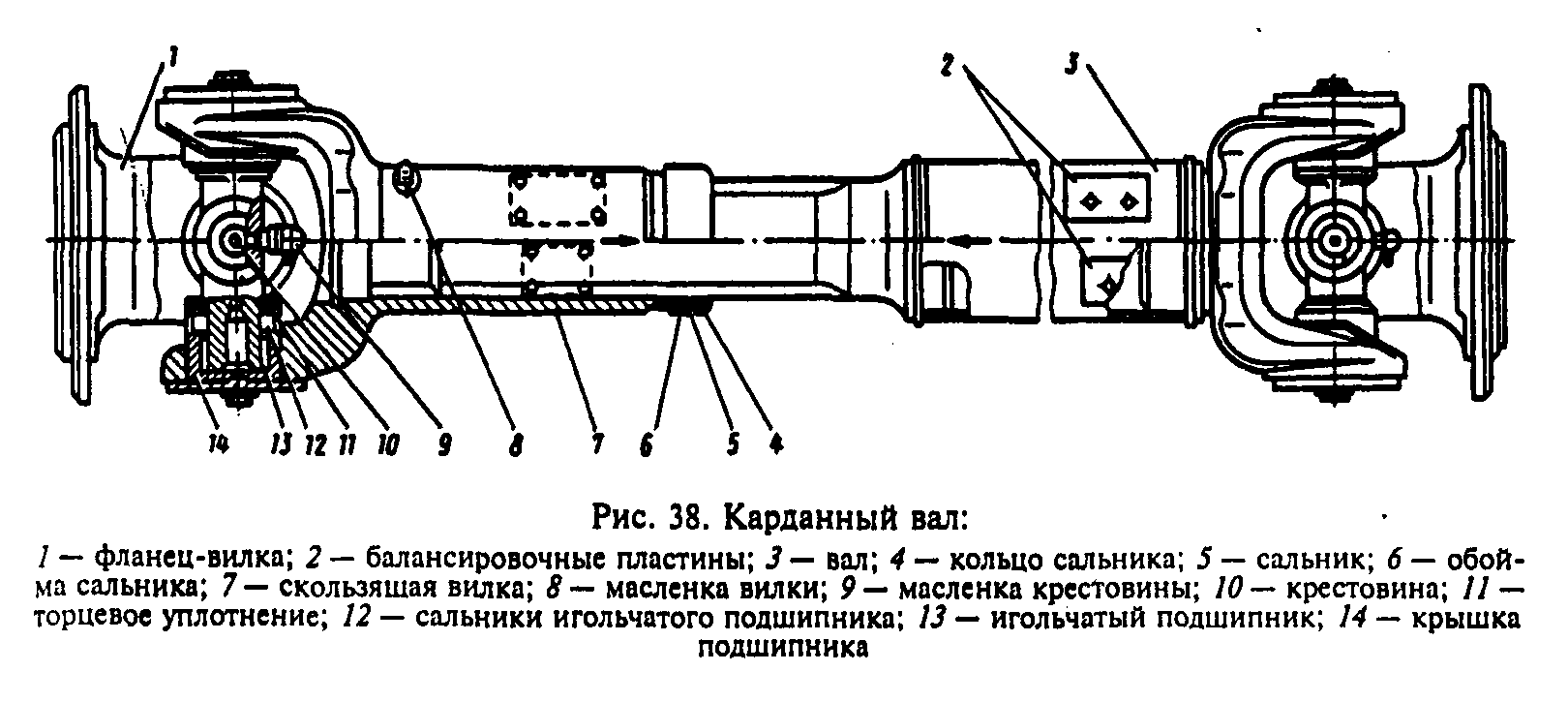 Так как во время прогиба рессор изменяется расстояние между осями автомобиля, то к одной вилке карданного шарнира приваривают стальной вал 15 со шлицами, который входит во втулку со шлицами 16, приваренную к ведомой вилке 17, что позволяет компенсировать изменяющееся расстояние между осями автомобиля.
Так как во время прогиба рессор изменяется расстояние между осями автомобиля, то к одной вилке карданного шарнира приваривают стальной вал 15 со шлицами, который входит во втулку со шлицами 16, приваренную к ведомой вилке 17, что позволяет компенсировать изменяющееся расстояние между осями автомобиля.
Рис.130. Карданная передача автомобиля ЗИЛ-130.
Что представляет собой карданный шарнир?
Карданный шарнир представляет собой подвижное сочленение, передающее крутящий момент с одного вала на другой при изменяющемся угле наклона.
Каких типов могут быть карданные шарниры?
Карданные шарниры могут быть упругими (мягкими), жесткими на игольчатых подшипниках и равных угловых скоростей. Упругие карданные шарниры применяют в передачах, где угол между соединяемыми валами не превышает 5°. Жесткими карданными шарнирами соединяют валы с углами между ними до 25°. Карданными шарнирами равных угловых скоростей соединяют части полуоси переднего ведущего моста, передающего крутящий момент при повороте управляемых колес до 40°.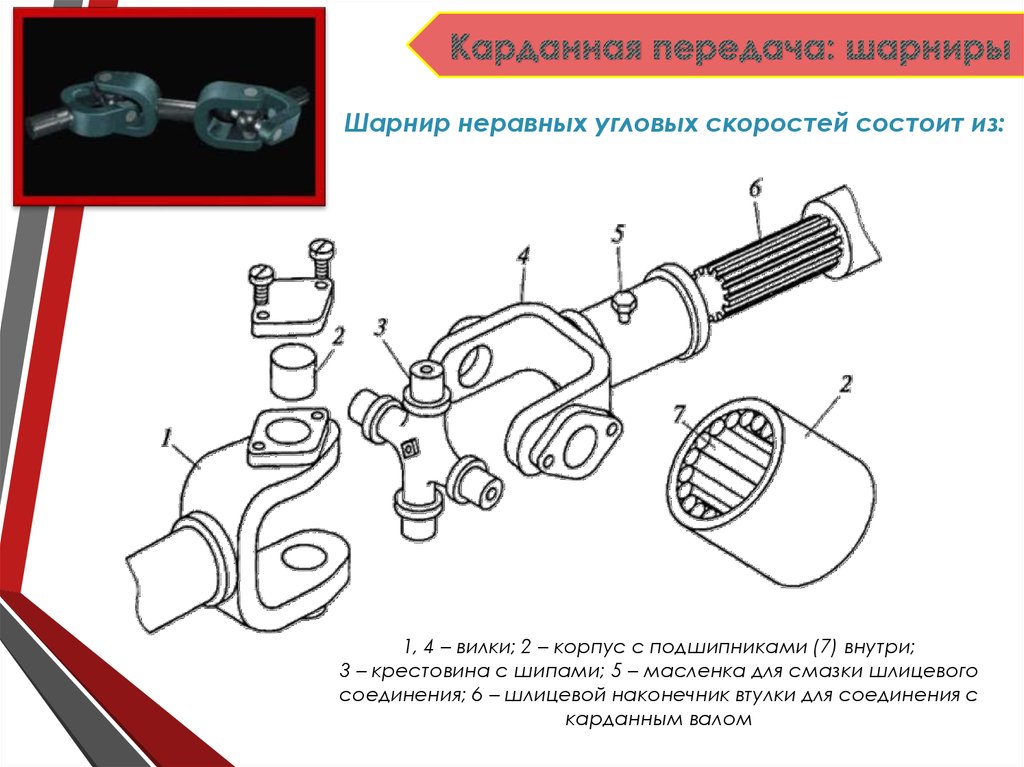
Как устроен и работает жесткий карданный шарнир?
Жесткий карданный шарнир состоит из двух вилок 1 и 8, соединенных между собой крестовиной 7, на шипы которой одеты стаканы 4 с игольчатыми подшипниками 5 и сальниками 6. Стаканы плотно входят в проушины вилок и удерживаются там крышками 3 и стопорными пластинами 2, прикручиваемыми болтами или удерживаемыми стопорными кольцами. Игольчатые подшипники смазывают через масленку 10 до появления масла с предохранительного клапана 9 или из-под уплотнительных колец 6. Вилка 18 жестко крепится к фланцу вторичного вала коробки передач, вилка 17 приварена к втулке со шлицами 16 или трубе карданного вала. При вращении вторичного вала крутящий момент передается ведущей вилке 18 через подшипники и крестовину на ведомую вилку 17 и карданный вал. Вилка 8 соединяется с фланцем, установленным на валу ведущей шестерни главной передачи и приводит ее во вращательное движение.
Как устроена и работает промежуточная опора?
Промежуточная опора состоит из шарикоподшипника 13 помешенного в резиновую обойму 12, закрытую металлическим кожухом.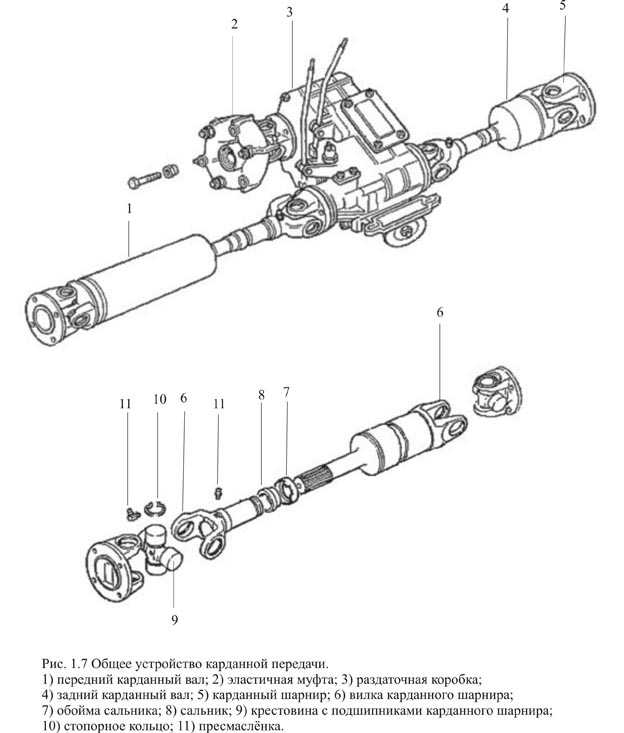 Опора крепится к поперечине рамы автомобиля. Промежуточная опора позволяет уменьшить длину карданного вала, передающего крутящий момент под углом, и предотвратить появление крутильных колебаний и биение вала, что увеличивает срок службы подшипников и способствует плавному ходу автомобиля. Подшипник промежуточной опоры и шлицевое соединение карданного вала смазывают вязкой смазкой УС-1, утечка которого предотвращается сальниками 14. Снаружи шлицевое соединение карданного пала закрыто резиновым гофрированным чехлом, предотвращающим попадание пыли и влаги на шлицы.
Опора крепится к поперечине рамы автомобиля. Промежуточная опора позволяет уменьшить длину карданного вала, передающего крутящий момент под углом, и предотвратить появление крутильных колебаний и биение вала, что увеличивает срок службы подшипников и способствует плавному ходу автомобиля. Подшипник промежуточной опоры и шлицевое соединение карданного вала смазывают вязкой смазкой УС-1, утечка которого предотвращается сальниками 14. Снаружи шлицевое соединение карданного пала закрыто резиновым гофрированным чехлом, предотвращающим попадание пыли и влаги на шлицы.
Что представляет собой упругий полукарданный шарнир?
Упругий полукарданный шарнир представляет собой резиновую обойму с металлическими втулками и соединяет ведущую и ведомую вилки.
***
Проверьте свои знания и ответьте на контрольные вопросы по теме «Карданная передача. Ведущий мост»
автомобиль, вал, вилка, карданная передача, карданный, передача, шарнир
Смотрите также:
Инфекции трансмиссии вспомогательных устройств левого желудочка: последние достижения и цели на будущее
1. Переда Д., Конте Дж.В. Инфекции привода вспомогательного устройства левого желудочка.
Переда Д., Конте Дж.В. Инфекции привода вспомогательного устройства левого желудочка.
Кардиол Клин
2011;29:515-27. [PubMed] [Google Scholar]
2. Ахтер С.А., Бадами А., Мюррей М. и соавт.
Повторные госпитализации после имплантации вспомогательного устройства для левого желудочка с непрерывным потоком: частота, причины и анализ затрат.
Энн Торак Сург
2015;100:884-9. [PubMed] [Google Scholar]
3. Wickline SA, Fischer KC. Можно ли визуализировать инфекции в имплантированных устройствах?
АСАИО Ж
2000;46:S80-1. [PubMed] [Академия Google]
4. Nienaber JJ, Kusne S, Riaz T, et al.
Клинические проявления и лечение инфекций, связанных с вспомогательным устройством левого желудочка.
Клин заразить Dis
2013;57:1438-48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Trachtenberg BH, Cordero-Reyes A, Elias B, et al.
Обзор инфекций у пациентов с вспомогательными устройствами для левого желудочка: профилактика, диагностика и лечение.
Методист Дебейки Кардиоваск Дж.
2015;11:28-32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Goldstein DJ, Naftel D, Holman W, et al.
Устройства с непрерывным потоком и чрескожные инфекции: клинические результаты.
Трансплантация легкого сердца J
2012;31:1151-7. [PubMed] [Google Scholar]
7. Коваль С.Е., Ракита Р., АСТ Сообщество специалистов по инфекционным заболеваниям. Инфекции, связанные с вспомогательным желудочковым устройством, и трансплантация паренхиматозных органов.
Am J трансплантат
2013;13
Дополнение 4:348-54. [PubMed] [Google Scholar]
8. Hannan MM, Husain S, Mattner F, et al.
Рабочая формулировка для стандартизации определений инфекций у пациентов, использующих вспомогательные желудочковые устройства.
Трансплантация легкого сердца J
2011;30:375-84. [PubMed] [Академия Google]
9. Lushaj EB, Badami A, Osaki S, et al.
Влияние возраста на исходы после имплантации вспомогательного устройства для левого желудочка с непрерывным потоком.
Interact Cardiovasc Thorac Surg
2015;20:743-8. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
10. Zierer A, Melby SJ, Voeller RK, et al.
Инфекции трансмиссии с поздним началом: ахиллесова пята длительной поддержки вспомогательного устройства левого желудочка.
Энн Торак Сург
2007;84:515-20. [PubMed] [Google Scholar]
11. Levy DT, Minamoto GY, Da Silva R, et al.
Роль ОФЭКТ-КТ с галлием в диагностике инфекций вспомогательных устройств левого желудочка.
АСАИО Ж
2015;61:e5-10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Dell’Aquila AM, Mastrobuoni S, Alles S, et al.
Содействующая роль фтор-18-фтордезоксиглюкозы позитронно-эмиссионной томографии/компьютерной томографии в диагностике и клиническом лечении инфекций у пациентов, поддерживаемых устройством поддержки левого желудочка с непрерывным потоком.
Энн Торак Сург
2016;101:87-94. [PubMed] [Google Scholar]
13. Fujino T, Higo T, Tanoue Y, et al.
ФДГ-ПЭТ/КТ при инфекции трансмиссии у пациента с имплантируемым вспомогательным устройством для левого желудочка.
Eur Heart J Cardiovasc Imaging
2016;17:23.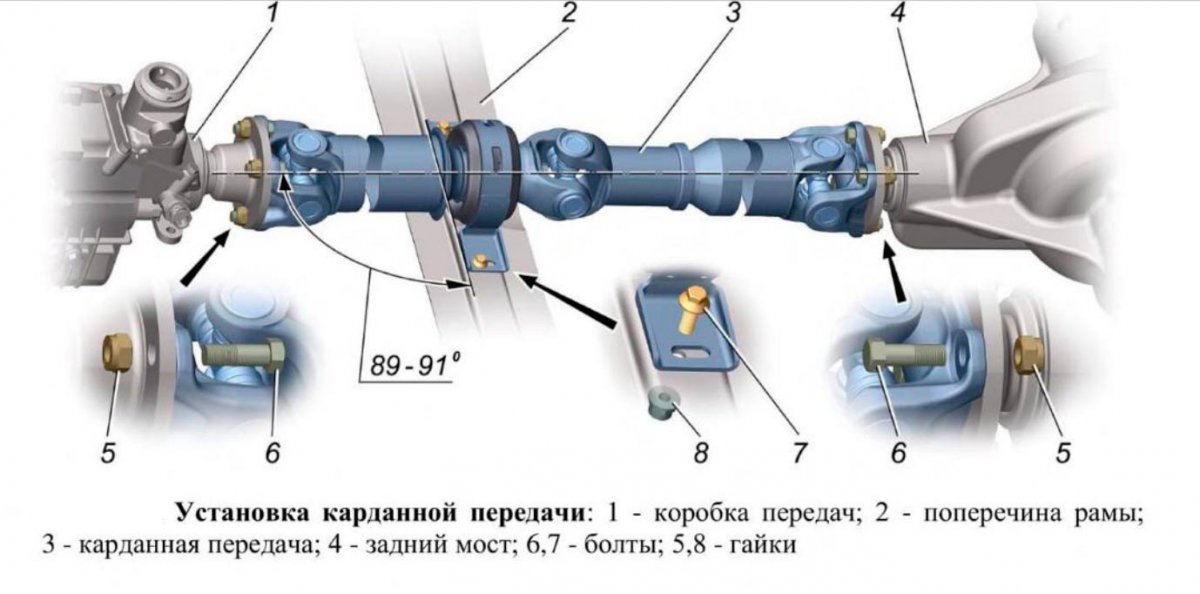 [PubMed] [Академия Google]
[PubMed] [Академия Google]
14. Ниенабер Дж., Вильгельм М.П., Сохаил М.Р. Современные концепции диагностики и лечения инфекций вспомогательных устройств левого желудочка.
Expert Rev Anti Infect Ther
2013;11:201-10. [PubMed] [Google Scholar]
15. Хамдан Р., Али Ф., Сааб М.
Осложненная инфекция вспомогательного устройства левого желудочка, леченная заменой помпы и резекцией верхушки левого желудочка.
Артиф Органы
2015;39:981-2. [PubMed] [Google Scholar]
16. Koval CE, Thuita L, Moazami N, et al.
Эволюция и влияние инфекции трансмиссии на большую когорту реципиентов вспомогательных желудочковых устройств с непрерывным потоком.
Трансплантация легкого сердца J
2014;33:1164-72. [PubMed] [Академия Google]
17. Kornberger A, Walter V, Khalil M, et al.
Подозрение на поражение мембраны EPTFE при стерильном внутригрудном абсцессе и эмпиеме перикарда у реципиента с полиаллергическим поражением левого желудочка: клинический случай.
J Кардиоторакальная хирургия
2015;10:99.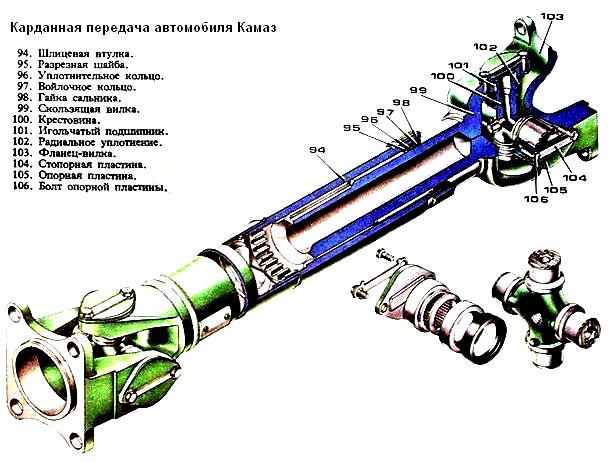 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Toba FA, Akashi H, Arrecubieta C, et al.
Роль биопленки в инфекциях, вызванных Staphylococcus aureus и Staphylococcus epidermidis.
J Грудной сердечно-сосудистый хирург
2011;141:1259-64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Флемминг Х.К., Вингендер Дж. Матрица биопленки.
Нат Рев Микробиол
2010;8:623-33. [PubMed] [Google Scholar]
20. Haglund NA, Davis ME, Tricarico NM, et al.
Повторные госпитализации после имплантации вспомогательного устройства для левого желудочка с непрерывным потоком: различия, наблюдаемые между двумя современными типами устройств.
АСАИО Ж
2015;61:410-6. [PubMed] [Google Scholar]
21. Coiffier G, Albert JD, Arvieux C, et al.
Оптимизация комбинированной терапии рифампином при стафилококковых остеоартикулярных инфекциях.
Совместная кость позвоночника
2013;80:11-7. [PubMed] [Академия Google]
22. Tang HJ, Chen CC, Cheng KC, et al.
In vitro эффективность и профили резистентности комбинированных схем на основе рифампина для встроенных в биопленку метициллин-резистентных золотистых стафилококков.
Противомикробные агенты Chemother
2013;57:5717-20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Форрест Г.Н., Тамура К. Комбинированная терапия рифампином при немикобактериальных инфекциях.
Clin Microbiol Rev.
2010;23:14-34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Lopilato AC, Doligalski CT, Caldeira C. Анализ частоты и факторов риска желудочно-кишечного кровотечения и тромбоза помпы у получателей вспомогательного устройства для левого желудочка.
Артиф Органы
2015;39: 939-44. [PubMed] [Google Scholar]
25. Trachtenberg BH, Cordero-Reyes AM, Aldeiri M, et al.
Стойкая инфекция кровотока у пациентов, поддерживаемых вспомогательным устройством для левого желудочка с непрерывным потоком, связана с повышенным риском цереброваскулярных нарушений.
Ошибка карты J
2015;21:119-25. [PubMed] [Google Scholar]
26. Jennings DL, Chopra A, Chambers R, et al.
Клинические результаты, связанные с хронической противомикробной супрессивной терапией у пациентов с устройствами поддержки левого желудочка с непрерывным потоком.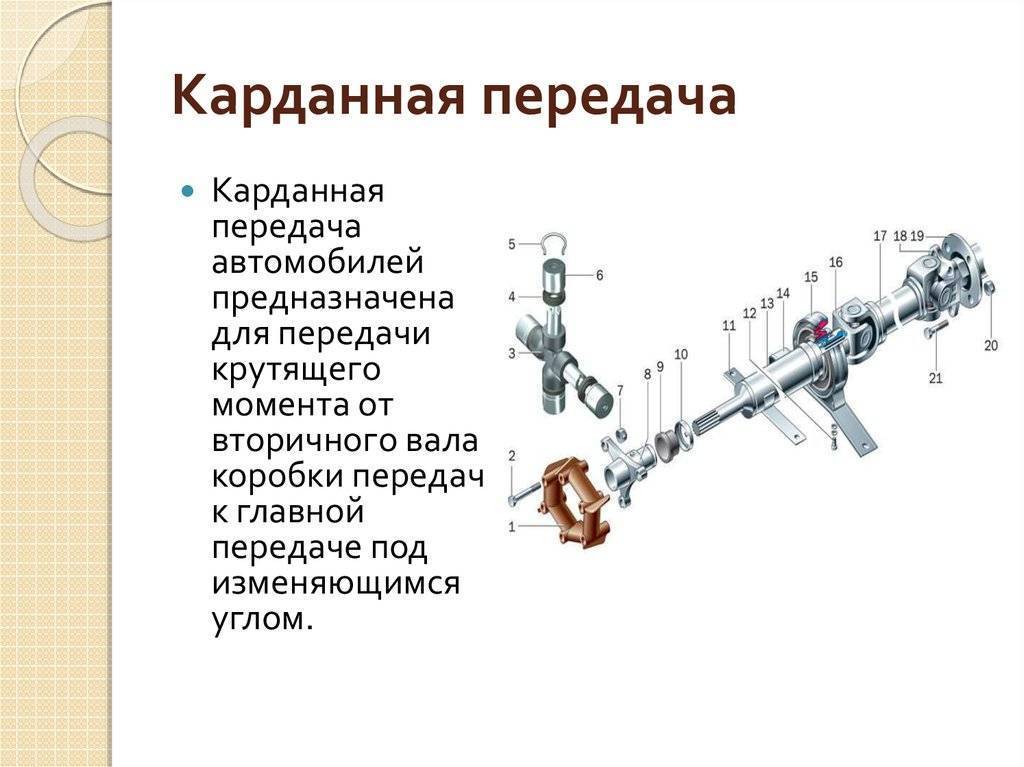
Артиф Органы
2014;38:875-9. [PubMed] [Google Scholar]
27. Moazami N, Milano CA, John R, et al.
Замена помпы при отказе вспомогательного устройства левого желудочка может быть выполнена безопасно и связана с низкой смертностью.
Энн Торак Сург
2013;95:500-5. [PubMed] [Google Scholar]
28. Anand J, Singh SK, Hernández R, et al. Замена устройства поддержки желудочков с непрерывным потоком безопасна и эффективна для продления времени поддержки у пациентов с сердечной недостаточностью в терминальной стадии. J Thorac Cardiovasc Surg 2015;149:267-75, 278.e1. [ПубМед]
29. Levy DT, Guo Y, Simkins J, et al.
Замена вспомогательного устройства левого желудочка при персистирующей инфекции: серия случаев и обзор литературы.
Transpl Infect Dis
2014;16:453-60. [PubMed] [Google Scholar]
30. Bhatia N, Voelkel AJ, Hussain Z, et al.
Безопасность и осуществимость индукционной иммуносупрессии, когда инфекция трансмиссии является показанием к трансплантации сердца.
Грудной сердечно-сосудистый хирург
2015;63:675-83. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
31. Swartz TH, Huprikar S, Labombardi V, et al.
Трансплантация сердца у пациента с гетерорезистентным ванкомицин-промежуточным медиастинитом Staphylococcus aureus с желудочковым вспомогательным устройством и бактериемией.
Transpl Infect Dis
2013;15:E177-81. [PubMed] [Академия Google]
32. Evans AC, Wright GA, McCandless SP, et al.
Ультрафиолетовое излучение влияет на механические свойства трансмиссии Thoratec HeartMate II: пилотный эксперимент.
АСАИО Ж
2015;61:731-3. [PubMed] [Google Scholar]
33. John R, Aaronson KD, Pae WE, et al.
Трансмиссивные инфекции и сепсис у пациентов, получающих систему HVAD в качестве вспомогательного устройства для левого желудочка.
Трансплантация легкого сердца J
2014;33:1066-73. [PubMed] [Google Scholar]
34. Fleissner F, Avsar M, Malehsa D, et al.
Сокращение инфекций трансмиссии за счет двойного туннелирования трансмиссии вспомогательных устройств для левого желудочка.
Артиф Органы
2013;37:102-7. [PubMed] [Академия Google]
[PubMed] [Академия Google]
35. Энтвистл Дж.
Интраоперационное позиционирование для предотвращения того, чтобы изоляция трансмиссии служила каналом для инфицирования кармана устройства вспомогательного кровообращения левого желудочка.
J Грудной сердечно-сосудистый хирург
2014;148:2437. [PubMed] [Google Scholar]
36. Пиннинти М., Тохан В., Сулеманджи, Новая Зеландия. Изоляция трансмиссии как канал для инфекции кармана устройства вспомогательного кровообращения левого желудочка.
J Грудной сердечно-сосудистый хирург
2014;148:e135-6. [PubMed] [Google Scholar]
37. Дин Д., Каллел Ф., Эвальд Г.А. и соавт.
Снижение уровня инфицирования трансмиссии: результаты реестра многоцентрового интерфейса трансмиссии (SSI) HeartMate II.
Трансплантация легкого сердца J
2015;34:781-9. [PubMed] [Google Scholar]
38. Rubinfeld G, Levine JP, Reyentovich A, et al.
Управление быстро распространяющейся инфекцией туннеля трансмиссии.
J Card Surg
2015;30:853-5. [PubMed] [Google Scholar]
39. Imamura T, Kinugawa K, Nitta D, et al.
Imamura T, Kinugawa K, Nitta D, et al.
Реадмиссию из-за инфекции трансмиссии можно предсказать по новой оценке с помощью сывороточного альбумина и индекса массы тела во время длительной поддержки вспомогательным устройством для левого желудочка.
Джей Артиф Органс
2015;18:120-7. [PubMed] [Google Scholar]
40. Iseler J, Hadzic KG. Разработка комплекта и видео для стандартизации смены повязок вспомогательного устройства для левого желудочка.
Прог Трансплантат
2015;25:224-9. [PubMed] [Google Scholar]
41. Wus L, Manning M, Entwistle JW, 3rd. Инфекция приводного устройства вспомогательного левого желудочка и частота смены повязок у госпитализированных пациентов.
сердце легкое
2015;44:225-9. [PubMed] [Google Scholar]
42. Menon AK, Baranski SK, Unterkofler J, et al.
Специальная обработка и уход за раной в месте выхода карданного вала после имплантации вспомогательного устройства для левого желудочка.
Грудной сердечно-сосудистый хирург
2015;63:670-4. [PubMed] [Google Scholar]
Перемещение кабеля насоса при двухэтапной хирургической стратегии и превентивной частичной замене карданной передачи
Имплантация механического вспомогательного устройства для левого желудочка (LVAD) стала хорошо зарекомендовавшим себя методом лечения пациентов с тяжелой застойной сердечной недостаточностью. Инфекция трансмиссии считается ахиллесовой пятой этой процедуры, а сообщаемый хирургический подход посредством топического и/или перемещения трансмиссии характеризуется высокой частотой рецидивов. Предложен альтернативный подход, заключающийся в двухэтапном оперативном вмешательстве с применением антисептической ванны для эрадикации бактерий из карданной передачи. Также предлагается превентивная ранняя замена карданной передачи с описанным здесь оригинальным техническим решением.
Инфекция трансмиссии считается ахиллесовой пятой этой процедуры, а сообщаемый хирургический подход посредством топического и/или перемещения трансмиссии характеризуется высокой частотой рецидивов. Предложен альтернативный подход, заключающийся в двухэтапном оперативном вмешательстве с применением антисептической ванны для эрадикации бактерий из карданной передачи. Также предлагается превентивная ранняя замена карданной передачи с описанным здесь оригинальным техническим решением.
L-VAD, инфекция трансмиссии, перемещение кабеля насоса
Имплантация механического вспомогательного устройства левого желудочка (LVAD) стала хорошо зарекомендовавшим себя вариантом лечения пациентов с тяжелой застойной сердечной недостаточностью не только в качестве моста к трансплантации сердца, но и как целевая терапия. Нехватка доноров и улучшение характеристик вспомогательных устройств сделали последние более популярными, что увеличило количество пациентов, которые будут иметь устройство на всю жизнь. Разработка устройств с осевым потоком меньшего размера, повышенная надежность и меньшая инвазивность процедуры имплантации привели к уменьшению таких осложнений, как кровотечение и тромбоэмболия [1]. Согласно базе данных Intermacs, в последнее десятилетие процент пациентов, получавших LVAD с непрерывными осевыми насосами в качестве терапии назначения, постоянно увеличивался и достиг 73% в 2017 г. [2]. Однако, когда такие устройства используются в течение более длительного времени, пациенты будут подвергаться осложнениям, связанным с устройством, включая инфекции и, в частности, трансмиссию; действительно, кожа на выходе из трансмиссии считается ахиллесовой пятой. Отсутствие инфекции, связанной с устройством, составляет примерно 75, 65 и 55% через 12, 24 и 36 месяцев после имплантации, соответственно, и большинство инфекций, специфичных для LVAD, связаны с компонентом трансмиссии с долей более 80% (для более чем 80% ) [3]. Принимая во внимание факторы риска инфицирования, о которых сообщается в различных публикациях, фактически все пациенты находятся в группе риска, независимо от возраста и пола; кроме того, по-видимому, может играть роль и материал карданной передачи [2,4].
Разработка устройств с осевым потоком меньшего размера, повышенная надежность и меньшая инвазивность процедуры имплантации привели к уменьшению таких осложнений, как кровотечение и тромбоэмболия [1]. Согласно базе данных Intermacs, в последнее десятилетие процент пациентов, получавших LVAD с непрерывными осевыми насосами в качестве терапии назначения, постоянно увеличивался и достиг 73% в 2017 г. [2]. Однако, когда такие устройства используются в течение более длительного времени, пациенты будут подвергаться осложнениям, связанным с устройством, включая инфекции и, в частности, трансмиссию; действительно, кожа на выходе из трансмиссии считается ахиллесовой пятой. Отсутствие инфекции, связанной с устройством, составляет примерно 75, 65 и 55% через 12, 24 и 36 месяцев после имплантации, соответственно, и большинство инфекций, специфичных для LVAD, связаны с компонентом трансмиссии с долей более 80% (для более чем 80% ) [3]. Принимая во внимание факторы риска инфицирования, о которых сообщается в различных публикациях, фактически все пациенты находятся в группе риска, независимо от возраста и пола; кроме того, по-видимому, может играть роль и материал карданной передачи [2,4]. Со временем кожа в районе выхода карданного вала теряет свои характеристики из-за реакции на инородное тело и травмы краев кожи, вызванной движением троса и лежанием. Гольдштейн и др. . связывают высокую частоту инфицирования карданной передачи у молодых пациентов с их активным образом жизни и постоянным смещением карданной передачи [5]. Более того, постоянное использование дезинфицирующих материалов вызовет постоянное раздражение и воспаление кожи. В результате кожа теряет свои механические барьерные свойства, так что бактерии сначала колонизируются в месте выхода, а затем со временем распространяются по трансмиссии, даже несмотря на проводимую антибактериальную терапию. Присутствие инородного тела, такого как трансмиссия, скорее всего, сделает невозможной попытку искоренить бактерии только с помощью антибиотикотерапии.
Со временем кожа в районе выхода карданного вала теряет свои характеристики из-за реакции на инородное тело и травмы краев кожи, вызванной движением троса и лежанием. Гольдштейн и др. . связывают высокую частоту инфицирования карданной передачи у молодых пациентов с их активным образом жизни и постоянным смещением карданной передачи [5]. Более того, постоянное использование дезинфицирующих материалов вызовет постоянное раздражение и воспаление кожи. В результате кожа теряет свои механические барьерные свойства, так что бактерии сначала колонизируются в месте выхода, а затем со временем распространяются по трансмиссии, даже несмотря на проводимую антибактериальную терапию. Присутствие инородного тела, такого как трансмиссия, скорее всего, сделает невозможной попытку искоренить бактерии только с помощью антибиотикотерапии.
Различные предлагаемые хирургические методы лечения и стратегии, включая перемещение карданного вала с использованием лоскута сальника, часто недостаточны и характеризуются плохими результатами. Мы предлагаем новое лечение, состоящее из двухэтапной стратегии перемещения трансмиссии с попыткой уничтожить колонизированные бактерии из трансмиссии с помощью «ванны» с антисептическим раствором.
Мы предлагаем новое лечение, состоящее из двухэтапной стратегии перемещения трансмиссии с попыткой уничтожить колонизированные бактерии из трансмиссии с помощью «ванны» с антисептическим раствором.
56-летний мужчина с неишемической дилатационной кардиомиопатией на поздних стадиях сердечной недостаточности перенес имплантацию LVAD (HeartMate 3, Thoratec Corp, Плезантон, Калифорния) в качестве целевой терапии в марте 2017 г. Послеоперационный период протекал без осложнений, поэтому он был выписан и периодически наблюдался в поликлинике. Инфекция в месте выхода карданной передачи, проявляющаяся воспалением кожи и выделением гноя, была впервые обнаружена через 18 месяцев после имплантации (рис. 1А). На основании полученных из колтуры антибиотикограмм проводилась специфическая антибактериальная терапия, место выхода карданного вала консервативно обрабатывалось антисептическими растворами. В течение 20 месяцев были взяты повторные образцы культур, показывающие изменения в бактериальной флоре, сначала Klebsiella, а затем Pseudomonas aeruginosa, требующие корректировки антибактериальной терапии.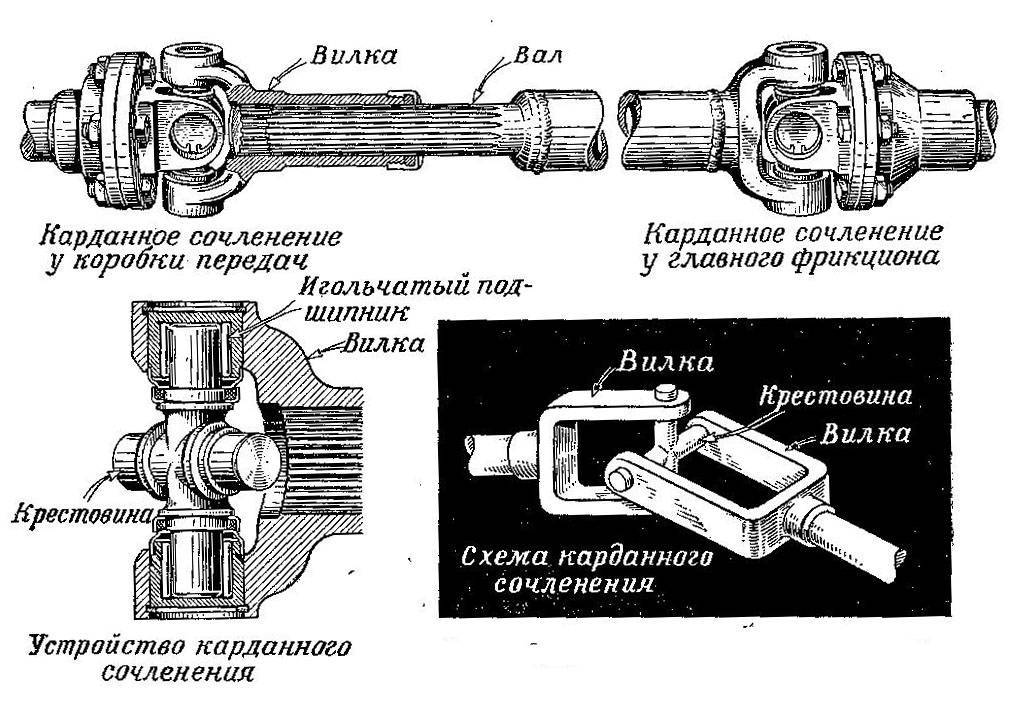 Несмотря на антибактериальную терапию и местное лечение, признаки инфекции ухудшились, и по ходу карданной передачи наблюдалось образование свищей (рис. 1B-1D). Учитывая высокую частоту рецидивов инфекции, описанную в литературе, мы выбрали альтернативный хирургический подход, заключающийся в двухэтапной релокации карданной передачи.
Несмотря на антибактериальную терапию и местное лечение, признаки инфекции ухудшились, и по ходу карданной передачи наблюдалось образование свищей (рис. 1B-1D). Учитывая высокую частоту рецидивов инфекции, описанную в литературе, мы выбрали альтернативный хирургический подход, заключающийся в двухэтапной релокации карданной передачи.
Рис. 1. Изображения A-D, показывающие распространение инфекции вдоль карданной передачи и формирование свища в течение 18, 23, 30 и 36 месяцев соответственно после имплантации устройства. На изображениях C и D видно полиэфирное покрытие из-за ретракции кожи
За 48 часов до операции введение варфарина было прервано и заменено подкожным низкомолекулярным гепарином. Мониторинг включал инвазивное измерение артериального давления, ЭКГ и периферическую оксиметрию и позиционирование катетера в центральной вене для внутривенного вливания и под общей анестезией, силовой блок LVAD временно отключали несколько раз на короткие промежутки времени до 3 минут, для оценки гемодинамического состояния пациента.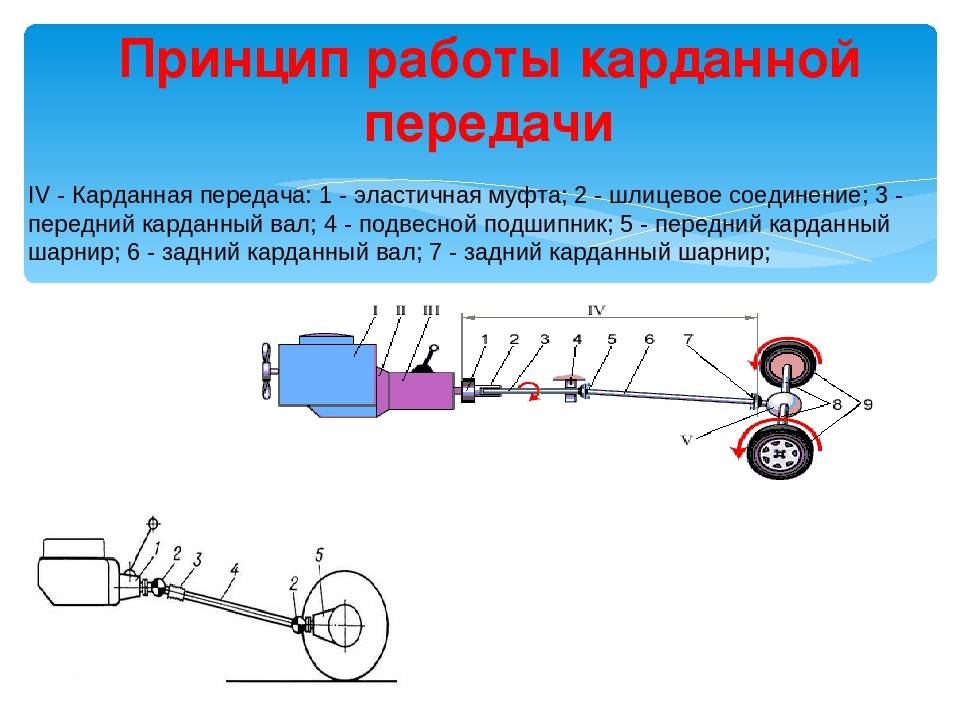 После дезинфекции кожи и наложения простыней был сделан разрез над линией привода, вдали от области фистулы и там, где кожа и подкожная клетчатка казались неповрежденными и свободными от инфекции. Затем обнажали кабель подкожной помпы непосредственно под диафрагмой, отсоединяли от кабеля консоли, дезинфицировали повидон-йодом и вытягивали, стараясь не повредить кабель и разъем. Полностью обнаженный кабель насоса был вставлен в трубку, извлеченную из экстракорпорального контура (сегмент венозной линии с наибольшим диаметром), чтобы создать «ванну». Затем блок питания был снова подключен, а концы трубки были плотно заклеены лентой. Инфузионные линии были вставлены в проксимальный и дистальный концы для приточной ирригации и пассивного дренажа соответственно (рис. 2). Первый хирургический этап был завершен хирургической обработкой с целью ликвидации свища и части туннеля карданного вала. Для уменьшения натяжения подкожный слой был мобилизован и ушит, чтобы обеспечить заживление первичным натяжением.
После дезинфекции кожи и наложения простыней был сделан разрез над линией привода, вдали от области фистулы и там, где кожа и подкожная клетчатка казались неповрежденными и свободными от инфекции. Затем обнажали кабель подкожной помпы непосредственно под диафрагмой, отсоединяли от кабеля консоли, дезинфицировали повидон-йодом и вытягивали, стараясь не повредить кабель и разъем. Полностью обнаженный кабель насоса был вставлен в трубку, извлеченную из экстракорпорального контура (сегмент венозной линии с наибольшим диаметром), чтобы создать «ванну». Затем блок питания был снова подключен, а концы трубки были плотно заклеены лентой. Инфузионные линии были вставлены в проксимальный и дистальный концы для приточной ирригации и пассивного дренажа соответственно (рис. 2). Первый хирургический этап был завершен хирургической обработкой с целью ликвидации свища и части туннеля карданного вала. Для уменьшения натяжения подкожный слой был мобилизован и ушит, чтобы обеспечить заживление первичным натяжением. Место выхода из туннеля не оставляли открытым, чтобы обеспечить остаточный дренаж. «Ванну» наполняли 10% повидон-йодом и поддерживали непрерывное орошение/промывание со скоростью потока 1 л/24 ч. «Ванну» держали горизонтально, поэтому кабель был полностью погружен в воду. Через два дня была проведена вторая хирургическая операция. Создан новый туннель, диаметр которого строго соответствует размеру карданной передачи. Уровень в крови лейкоцитов, фибриногена, С- Реактивный белок постоянно оценивали, показывая постепенное улучшение вплоть до полной нормализации. Антибиотикотерапия продолжалась в течение 6 недель после операции. Никаких признаков инфекции не было обнаружено как в старом, так и в новом месте выхода карданного вала при контрольном осмотре через два месяца.
Место выхода из туннеля не оставляли открытым, чтобы обеспечить остаточный дренаж. «Ванну» наполняли 10% повидон-йодом и поддерживали непрерывное орошение/промывание со скоростью потока 1 л/24 ч. «Ванну» держали горизонтально, поэтому кабель был полностью погружен в воду. Через два дня была проведена вторая хирургическая операция. Создан новый туннель, диаметр которого строго соответствует размеру карданной передачи. Уровень в крови лейкоцитов, фибриногена, С- Реактивный белок постоянно оценивали, показывая постепенное улучшение вплоть до полной нормализации. Антибиотикотерапия продолжалась в течение 6 недель после операции. Никаких признаков инфекции не было обнаружено как в старом, так и в новом месте выхода карданного вала при контрольном осмотре через два месяца.
Рисунок 2. Схема иллюстрирует ирригационно-дренажную систему, в которой подкожно открытый сегмент кабеля насоса погружен в трубку из ПВХ, «ванну». * укажите предыдущее место выхода карданного вала
Bauer et al . в систематическом обзоре подчеркнули сложность лечения инфекций, связанных с устройством, и, в частности, отсутствие стандартизированного хирургического лечения раневых инфекций, связанных с трансмиссией [3]. Выполнение операции в загрязненном поле при сохранении той же трансмиссии является сложной задачей и приводит к высокой частоте рецидивов.
в систематическом обзоре подчеркнули сложность лечения инфекций, связанных с устройством, и, в частности, отсутствие стандартизированного хирургического лечения раневых инфекций, связанных с трансмиссией [3]. Выполнение операции в загрязненном поле при сохранении той же трансмиссии является сложной задачей и приводит к высокой частоте рецидивов.
Линия привода состоит из двух отдельных кабелей: кабеля насоса, выходящего из вспомогательного устройства и предназначенного для частичного размещения в подкожном слое, и модульного кабеля, который подключается через штекер кабеля насоса к системному контроллеру. Для стимулирования роста тканей кабель насоса частично покрыт тканым полиэстером. Со временем ткань приклеится к текстурированному материалу и закрепит трансмиссию на окружающей ткани; предназначение специального чехла состоит в том, чтобы стимулировать рост тканей, но при возникновении инфекции, скорее всего, будет трудно уничтожить колонизированные бактерии из тканого полиэфирного материала, что приведет к рецидиву. Существуют различные методы лечения инфекций, специфичных для LVAD, от традиционной антибиотикотерапии под контролем ушивания отдельно или в сочетании с незначительным лечением до радикального лечения, включая перемещение карданной передачи и даже замену помпы. Цирер и др. . сообщили о плохих результатах после агрессивного хирургического лечения, направленного на устранение инфекции карданного вала, характеризующегося повторными ревизионными процедурами у большинства пациентов [6]. Следует подчеркнуть, что успех процедур, направленных на эрадикацию инфекции, что невозможно, так как загрязненный кабель насоса не подлежит замене; такое условие может объяснить высокий уровень отказов.
Существуют различные методы лечения инфекций, специфичных для LVAD, от традиционной антибиотикотерапии под контролем ушивания отдельно или в сочетании с незначительным лечением до радикального лечения, включая перемещение карданной передачи и даже замену помпы. Цирер и др. . сообщили о плохих результатах после агрессивного хирургического лечения, направленного на устранение инфекции карданного вала, характеризующегося повторными ревизионными процедурами у большинства пациентов [6]. Следует подчеркнуть, что успех процедур, направленных на эрадикацию инфекции, что невозможно, так как загрязненный кабель насоса не подлежит замене; такое условие может объяснить высокий уровень отказов.
В этом отчете мы предложили полностью на некоторое время погрузить кабель насоса в «ванну», сделанную из трубы ПВХ, запаянной с обоих концов. Непрерывная промывка агрессивными антисептическими растворами может помочь уничтожить бактерии, глубоко укоренившиеся в тканом материале, используемом для покрытия устройства. Принцип непрерывного орошения различными растворами, включая повидон-йод, физиологический раствор или антибиотики, применялся для лечения послеоперационного медиастинита, и от него отказались из-за некоторых ограничений, включая большое пространство средостения и связанный с этим риск интоксикации йодом, и были предложены другие подходы [7,8]. . В отличие от орошения средостения, при предлагаемой «ванне» обнаженный кабель полностью погружается и постоянно промывается. Поскольку это экстракорпоральное лечение, риск интоксикации отсутствует; кроме того, можно использовать любой антибактериальный раствор. Высокая частота рецидивов инфекции после перемещения карданной передачи может негативно повлиять на процесс принятия решений либо врачами, что затрудняет предложение хирургического лечения, либо самим пациентом, который может отказаться от процедуры на основании предоставленной информации. Как и в представленном случае, радикальная операция была проведена с большим опозданием, через 20 месяцев после выявления первых признаков инфекции, и инфекция распространилась по трансмиссии, что поставило под угрозу карман и устройство.
Принцип непрерывного орошения различными растворами, включая повидон-йод, физиологический раствор или антибиотики, применялся для лечения послеоперационного медиастинита, и от него отказались из-за некоторых ограничений, включая большое пространство средостения и связанный с этим риск интоксикации йодом, и были предложены другие подходы [7,8]. . В отличие от орошения средостения, при предлагаемой «ванне» обнаженный кабель полностью погружается и постоянно промывается. Поскольку это экстракорпоральное лечение, риск интоксикации отсутствует; кроме того, можно использовать любой антибактериальный раствор. Высокая частота рецидивов инфекции после перемещения карданной передачи может негативно повлиять на процесс принятия решений либо врачами, что затрудняет предложение хирургического лечения, либо самим пациентом, который может отказаться от процедуры на основании предоставленной информации. Как и в представленном случае, радикальная операция была проведена с большим опозданием, через 20 месяцев после выявления первых признаков инфекции, и инфекция распространилась по трансмиссии, что поставило под угрозу карман и устройство.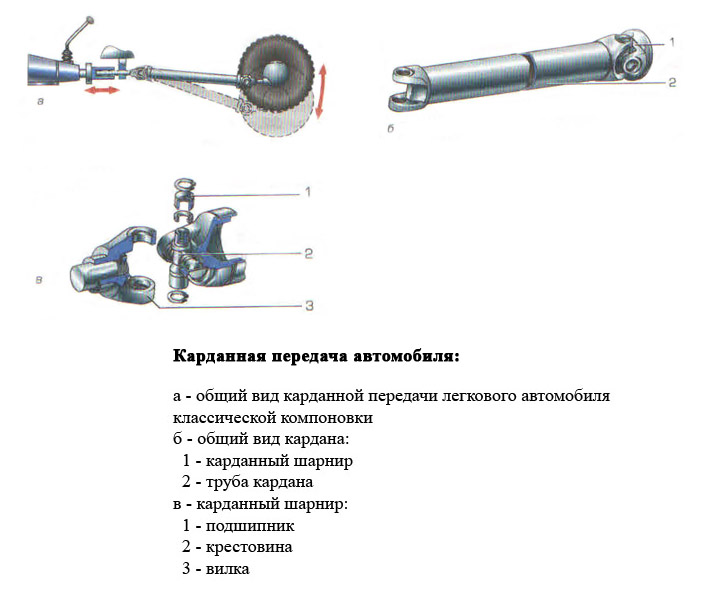
Логично будет добавить еще один коннектор, расположенный в подкожном слое брюшной полости. При наличии показаний подкожный разъем может быть открыт хирургическим путем, а кабель насоса может быть отсоединен и вытянут, что исключает загрязнение трансмиссии; затем в новый чистый туннель можно ввести новый стерильный кабель, что снижает риск рецидива. Учитывая высокую частоту инфицирования в зависимости от времени, прошедшего с момента имплантации, вопрос, скорее всего, будет заключаться не в том, произойдет ли инфицирование, а когда. Ранняя замена и изменение положения нового кабеля, как только появляются признаки инфекции, могут быть выполнены безопасно с низким риском заражения. Более ранняя замена кабеля также снизит риск заражения кармана и устройства. Наконец, хотя и редко, Stulak и др. . сообщил о ремонте поврежденного кабеля, а Schima и др. . также сообщалось об успешном восстановлении поврежденной наружной оболочки с помощью расширяемой латексной трубки [9].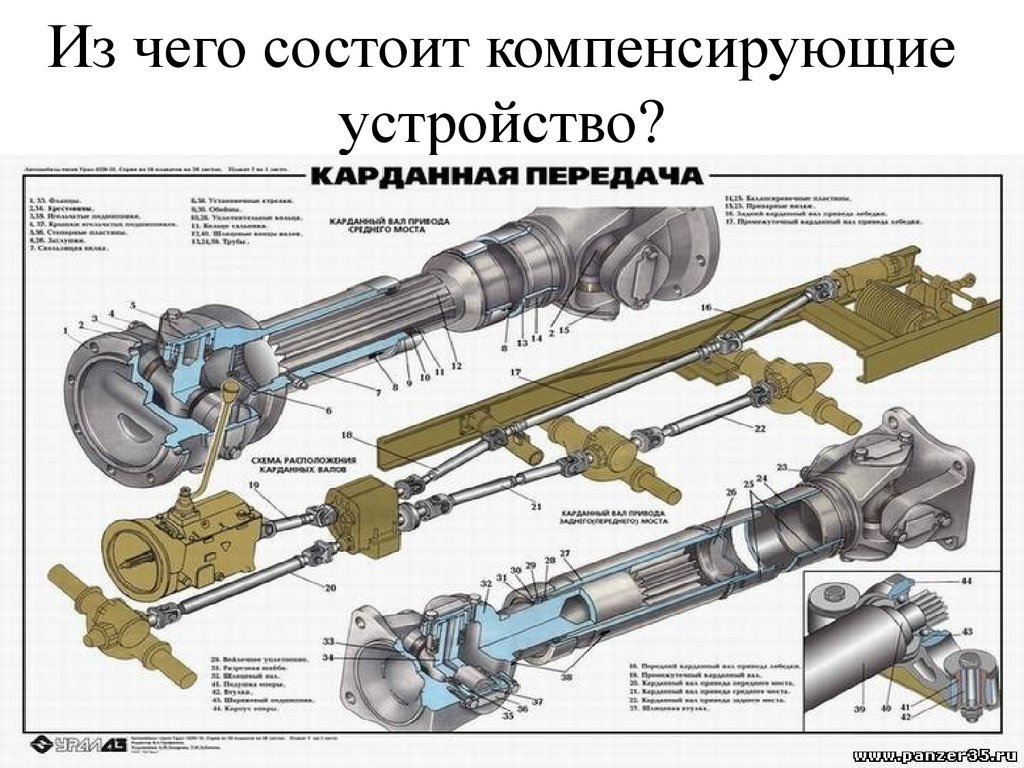 Вместо кустарного ремонта новый сегмент кабеля насоса и разъем упростят процедуру и в конечном итоге гарантируют долговечное восстановление. Тем не менее предлагаемое решение может снизить повторные госпитализации, длительную антибактериальную терапию, улучшить психологическое состояние пациентов и экономические затраты.
Вместо кустарного ремонта новый сегмент кабеля насоса и разъем упростят процедуру и в конечном итоге гарантируют долговечное восстановление. Тем не менее предлагаемое решение может снизить повторные госпитализации, длительную антибактериальную терапию, улучшить психологическое состояние пациентов и экономические затраты.
Несмотря на то, что показатели выживаемости пациентов с терминальной стадией сердечной недостаточности улучшились после имплантации вспомогательных желудочковых устройств, инфекции, связанные с LVAD, являются важной причиной заболеваемости, смертности и повторных госпитализаций. Лечение инфекций трансмиссии остается серьезной проблемой, поэтому поиск альтернативных решений имеет первостепенное значение.
- Кирклин Дж. К., Пагани Ф. Д., Гольдштейн Д. Д. (2020 г.) Американская ассоциация торакальной хирургии, международное общество по трансплантации сердца и легких, рекомендации по отдельным темам механической поддержки кровообращения. Трансплантация сердца и легких 39: 187-121.
 [Перекрестная ссылка]
[Перекрестная ссылка] - Кормос Р.Л., Каугер Дж., Пагани Э.Д. (2019) Годовой отчет базы данных общества торакальных хирургов intermacs: развитие показаний, результатов и научного партнерства. J. Heart Lung Trans 38: 114-126. [Перекрестная ссылка]
- 3 Bauer TM, Choi JH, Luc JGY (2019) Методы замены устройства по сравнению с режимами без обмена при инфекциях, связанных с вспомогательным устройством левого желудочка: систематический обзор и метаанализ. Дж. Артиф. Органы 43: 448-457.
- Имамура Т., Мурасава Т., Кавасаки Х. (2017) Корреляция между особенностями трансмиссии и инфекцией трансмиссии при выборе вспомогательного устройства для левого желудочка. Дж. Артиф. Органы 20: 34-41. [Перекрестная ссылка]
- Goldstein DJ, Naftel D, Holman W (2012)Устройства с непрерывным потоком и чрескожные инфекции: клинические результаты. J. Heart Lung Trans 31: 1151-1157.

- Цирер А., Мелби С.Дж., Воеллер Р.К. (2007)Инфекции трансмиссии с поздним началом – ахиллесова пята продолжительной поддержки вспомогательного устройства левого желудочка. Ann Thorac Surg 84: 515-520. [Перекрестная ссылка]
- Zeitani J, Pompeo E, Nardi P (2013)Ранние и отдаленные результаты реконструкции лоскута грудной мышцы по сравнению с повторной проводкой грудины после неудачного закрытия грудины. Европейский журнал кардио-торакальной хирургии 43: 144-150. [Перекрестная ссылка]
- Стулак Дж. М., Шеттл С., Хаглунд Н. (2017) Чрескожный перелом трансмиссии после имплантации устройства поддержки левого желудочка Heartmate II. ASAIO J 63: 542-545. [Перекрестная ссылка]
- Schima H, Stoiber M, Schloglhofer T (2013)Ремонт повреждения трансмиссии вспомогательного устройства левого желудочка непосредственно в месте чрескожного выхода. Artif Organs 38: 422-425.
 [Перекрестная ссылка]
[Перекрестная ссылка]
Редакционная информация
Главный редактор
Терри Лихтор
Цуёси Хирата
Шинья Мидзуно
Джакомо Коррадо
Тип статьи
История болезни
История публикации
Получено: 11 декабря 2020 г. 9 0171 Принято: 19 декабря 2020 г.
Опубликовано: 22 декабря 2020 г.
Авторское право
© Zeitani J., 2020. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Citation
Jacob Zeitani, Saimir Kuci, Alfred Ibrahimi, Antonio Pellegrino and Ermal Likaj (2020) Инфекция трансмиссии LVAD: перемещение кабеля насоса в двухэтапной хирургической стратегии и превентивная частичная замена трансмиссии?. J Transl Sci 7: DOI: 10.15761/JTS.1000442.
Рис.


 [Перекрестная ссылка]
[Перекрестная ссылка]
 [Перекрестная ссылка]
[Перекрестная ссылка]