Содержание
Интересные факты о популярных металлах и их сплавах
Металл используется везде и повсюду. Только оглянитесь вокруг и вы поймёте, что в наше время почти в любом изделии используется металл, будь то какая-либо деталь или изделие целиком. Мы ни случайно выбрали для рассмотрения данную тему, ведь большая часть нашей продукции сделана из металла или имеет металлические детали. Поэтому мы решили, что вам будет интересно просмотреть несколько интересных фактов о металлах.
Такая широкая распространенность металлических изделий обусловлена многими факторами: они крепки, практичны и имеют высокий срок эксплуатации. Такие предметы менее требовательны к уходу, нежели, например, изделия из дерева. Тем более, что отдельные части металлических изделий зачастую покрыты другими материалами, поэтому по красоте внешнего вида они ничуть не уступают остальным.
Итак, поговорим же о самых интересных свойствах металлов. Один из самых распространенных металлов в почве нашей планеты — алюминий, однако, если брать всю планету целиком, то на первое место выходит железо, так как ядро Земли в большей части состоит из него.
Из всего добываемого в мире титана только 7% используется в машиностроении, 13% — на обработку бумаги, 20% — производство пластика и 60% на производство краски.
Характерный запах монет — это не запах металла. Он получается из соединений, образующихся при соприкосновении с металлом, например человеческого пота. Чтобы получить такой «металлический» запах, достаточно лишь малого количества реагентов.
Эффект «памяти»
Некоторым металлическим сплавам, например нитинолу (55% никеля и 45% титана), присущ эффект памяти формы. Он заключается в том, что деформированное изделие из такого материала при нагреве до определённой температуры возвращается к своей первоначальной форме. Это связано с тем, что данные сплавы имеют особую внутреннюю структуру под названием мартенсит, обладающую свойством термоупругости.
В деформированных частях структуры возникают внутренние напряжения, которые стремятся вернуть структуру в исходное состояние. Материалы с памятью формы нашли широкое применение в производстве — например, для соединительных втулок, которые при очень низкой температуре сжимаются, а при комнатной — распрямляются, формируя соединение гораздо надёжнее сварки.
Медь убивает грибок
Предметы, изготовленные из такого металла как медь, а также из ее сплавов, не могут создавать искры. Это свойство меди применяется в производстве инструментов для проведения огнеопасных работ. В Японии, подверженной частым землетрясениям, медь применяют для производства газовых трубопроводов, которые отличаются высокой сейсмоустойчивостью.
Еще одно интересное свойство меди было выявлено в ходе исследования водоемов, в которых обитают карпы. Оказывается, в воде, не содержащей медь, развивается грибок, который губительно влияет на развитие карпов, а в воде, содержащей медь, карпы хорошо растут и размножаются. Медь есть и в организме человека, но она регулярно выводится, и поэтому мы нуждаемся в своеобразной дозаправке ежедневно 2 мг меди.
О богатой история металлов
Впервые железо было выплавлено из руды во втором тысячелетии до нашей эры на территории Западной Азии. Технология железной металлургии начинала распространяться по всему миру и в 9-7 веках нашей эры получило повсеместное распространение практически во всех племенах Европы и Азии. Этот период именуется железным веком, сменившим бронзовый век.
Этот период именуется железным веком, сменившим бронзовый век.
Основным продуктом практически любой промышленности является сталь (сплав железа с углеродом). Для изготовления любых станков и оборудования необходима сталь, а в автомобильной промышленности из стали и вовсе производят кузова и детали ходовой части автомобиля. Сложная электроника и космическая промышленность без стали существовать также не могут.
В данной статье мы рассмотрели одни из самых интересных фактов о металлах и их сплавах. Надеемся, что данная статья была вам интересна.
Структура металлов и сплавов: атомная и кристаллическая структура
Металлы состоят из агрегатов атомов, последовательно организованных в кристаллическую структуру. Металлы и сплавы обычно имеют кристаллическую структуру. Обычно чистые металлы имеют довольно простую кристаллическую структуру с кубическими или гексагональными элементарными ячейками, как мы увидим. С другой стороны, кристаллические образования сплава могут быть довольно сложными.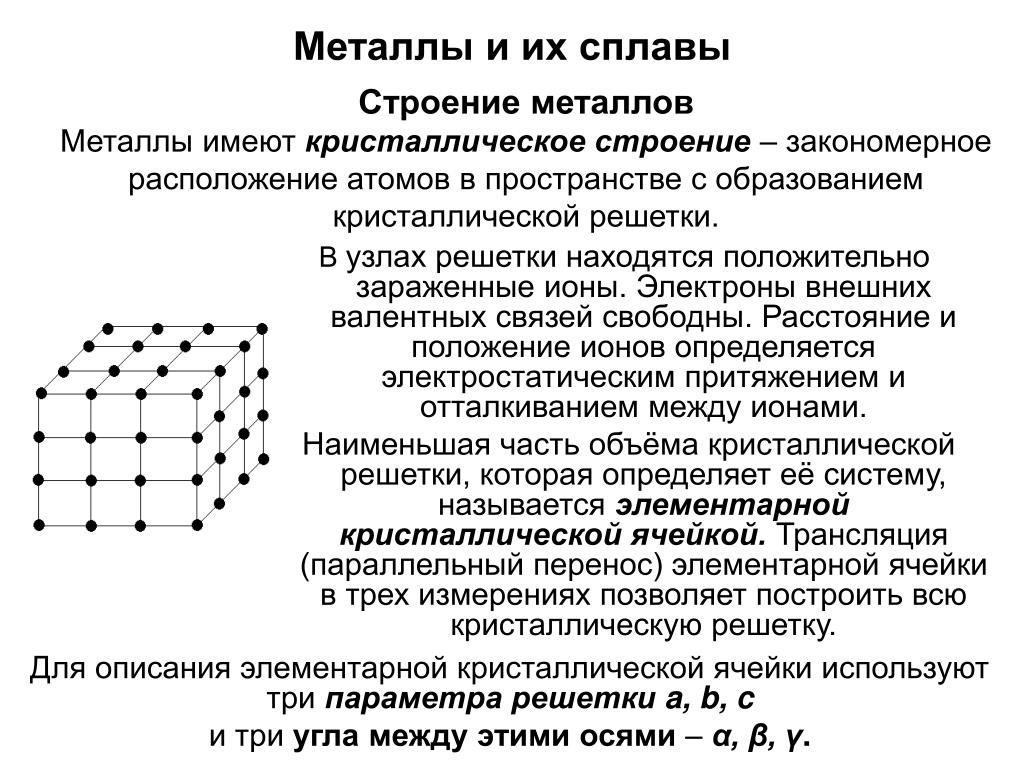
Структура металлов и сплавов
Содержание
Toggle
Знакомство с металлами
Элементы подразделяются на три типа: металлы, металлоиды и неметаллы
Любая группа веществ, отличающаяся высокой электро- и теплопроводностью, а также ковкостью, пластичностью и высоким коэффициентом отражения света. Металл — это материал с блестящим видом, который достаточно хорошо проводит электричество и тепло, когда он только что изготовлен, отполирован или разбит. Металлы бывают пластичными (из них можно формовать проволоку) и ковкими (из них можно выковывать тонкие листы). Эти качества обусловлены металлической связью, образованной между атомами или молекулами металла.
Металлы составляют около трех четвертей всех известных химических элементов. Алюминий, железо, кальций, натрий, калий и магний наиболее распространены в земной коре. Хотя подавляющее большинство металлов находится в рудах (минералосодержащих веществах), некоторые из них, такие как медь, золото, платина и серебро, обычно находятся в свободном состоянии, поскольку они плохо реагируют с другими элементами.
Сплавы
Сплав представляет собой металлический твердый раствор или смесь двух или более элементов.
Сплавы включают металлы, включая латунь, олово, фосфористую бронзу, амальгаму и сталь. Микроструктура сплавов полных твердых растворов представляет собой единую твердую фазу. В зависимости от термической предыстории частичные растворы образуют две или более фаз, которые могут быть или не быть однородными по распределению. В общем, свойства сплава часто отличаются от свойств составляющих его элементов.
Сплавы включают металлы, включая латунь, олово, фосфористую бронзу, амальгаму и сталь. Микроструктура сплавов полного твердого раствора представляет собой единую твердую фазу. В зависимости от термической предыстории частичные растворы образуют две или более фаз, которые могут быть или не быть однородными по распределению. Свойства сплава часто отличаются от свойств составляющих его элементов.
Характеристики металлов и сплавов
Металлы отличаются своими особыми свойствами. Вот некоторые примеры:
Вот некоторые примеры:
- Чрезвычайно высокая температура плавления
- Отличные проводники тепла и электричества
- ковкий (легко сгибается/формируется)
- Пластичный (легко растягивается без повреждений) (легко растягивается без поломки)
- Высокая плотность.
Обычно сплавы создаются для «максимизации» определенных свойств. Ниже приведены различия между металлами и сплавами: Более твердые, чем составные металлы.
- Более устойчивы к коррозии, чем чистые металлы
- Более низкая температура плавления, чем у составных металлов
- Более пластичный, чем металлы компонентов
- Более прочный, чем металлы компонентов
- Менее проводящая, чем металлы компонентов
Сталь (железо + углерод) — типичный сплав, используемый в строительных материалах. Это имеет смысл, потому что он может выдерживать больший вес, менее подвержен коррозии и его легче формовать, чем железо.
Структура металлов и сплавов
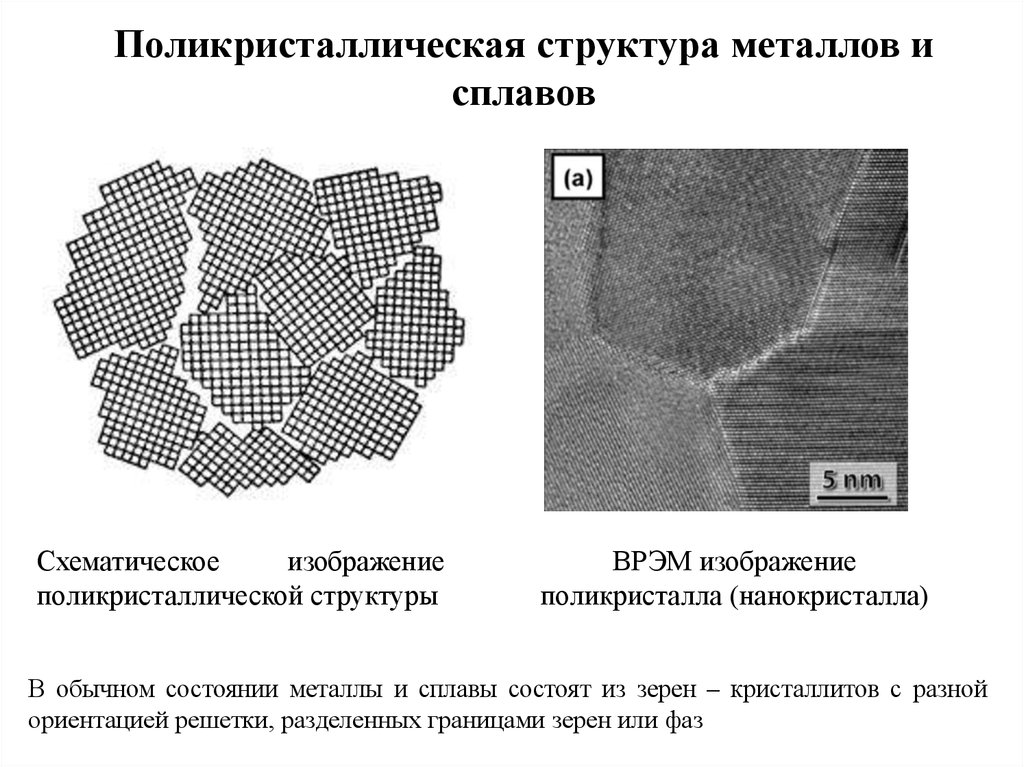
Совокупность атомов, правильно организованных в кристаллическую структуру, составляют металлы. В отличие от того, что мы обсуждали до сих пор, а именно производства монокристаллов, металлы обычно образуются из множества крошечных кристаллов, а не в результате единственного затвердевания из расплава.
Это происходит потому, что расплавленный металл часто содержит большое количество рассеянных зародышей кристаллизации. Когда четыре атома способны образовать элементарную ячейку и потерять достаточно тепловой энергии, могут возникнуть такие ядра. По мере того, как все больше атомов металла получают достаточно низкую энергию, чтобы присоединиться к ним, эти элементарные ячейки будут расширяться, что приведет к развитию кристаллов. Гомогенная нуклеация — это название, данное этой процедуре.
Чаще всего присутствие загрязняющих веществ в расплаве вызывает начало затвердевания. Кристаллы начинают формироваться, когда температура падает ниже точки плавления, и в результате атомы металла начинают накапливаться на этих примесях. Гетерогенная нуклеация — это название, данное этому явлению. Когда весь металл сформируется, кристаллы (также известные как зерна) перестанут расти. Они начнут сталкиваться по мере расширения, тем самым создавая границы между кристаллами, где атомы расположены хаотично. Эта граница, известная как граница зерен, в основном является дефектом кристаллической структуры металла.
Гетерогенная нуклеация — это название, данное этому явлению. Когда весь металл сформируется, кристаллы (также известные как зерна) перестанут расти. Они начнут сталкиваться по мере расширения, тем самым создавая границы между кристаллами, где атомы расположены хаотично. Эта граница, известная как граница зерен, в основном является дефектом кристаллической структуры металла.
Атомная структура металлов и сплавов
Атомы в металлической решетке образуют структуру, которая может быть представлена в виде трехмерной коробки, известной как элементарная ячейка, которая повторяется по всему металлу.
Сплавы разные. Тип сплава определяет атомную структуру: замещение или внедрение.
В сплаве замещения атомы одного металла замещаются атомами другого. Эти новые атомы по размеру аналогичны атомам других металлов.
Атомы второго металла в сплаве внедрения значительно меньше атомов чистого исходного металла. Эти более мелкие атомы вписываются в «дыры» исходной структуры.
Кристаллическая структура металлов и сплавов
Кристаллы представляют собой трехмерные повторяющиеся узоры. Основная повторяющаяся единица кристалла называется элементарной ячейкой. Это трехмерная форма, которую можно воспроизводить бесконечно, используя единичные перемещения для заполнения дыр в структуре.
Обычно кристалл имеет одну из трех основных структур:
- Объемно-центрированная кубическая (ОЦК)
- Шестигранник в закрытой упаковке (Hcp)
- Замкнутая кубическая упаковка (ccp)/гранецентрированная кубическая (fcc)
Шестиугольные или ромбические элементарные ячейки этого шаблона будут заменены в трех измерениях трехмерными прямоугольниками, которые будут складываться вместе, чтобы занять все пространство.
Поскольку атомы металла имеют грубую форму сфер, они не упакованы полностью плотно и между сферами есть промежутки. Эффективность упаковки различных элементарных ячеек различается. Количество атомов в элементарной ячейке включает только процент атомов, содержащихся в ячейке. Атомы в углах элементарной ячейки считаются за 18 атомов, атомы на грани считаются за 12, а атом в центре считается за полный атом. Давайте воспользуемся этим, чтобы выяснить, сколько атомов находится в простой кубической элементарной ячейке, гранецентрированной кубической (ГЦК) элементарной ячейке и объемно-центрированной кубической (ОЦК) элементарной ячейке.
Количество атомов в элементарной ячейке включает только процент атомов, содержащихся в ячейке. Атомы в углах элементарной ячейки считаются за 18 атомов, атомы на грани считаются за 12, а атом в центре считается за полный атом. Давайте воспользуемся этим, чтобы выяснить, сколько атомов находится в простой кубической элементарной ячейке, гранецентрированной кубической (ГЦК) элементарной ячейке и объемно-центрированной кубической (ОЦК) элементарной ячейке.
Простая кубическая
Простая кубическая
Название этой структуры — простая кубическая упаковка. В этой конструкции каждая сфера касается четырех других сфер, идентичных ей. Кроме того, он вступает в контакт со сферами в плоскостях выше и ниже соответственно. В таком расположении каждый атом может создавать связи со своими шестью ближайшими соседями. Таким образом, утверждается, что каждая сфера имеет координационное число 6. Неэффективно использовать пространство в простой кубической форме. В простой кубической конструкции сферы фактически занимают всего 52% доступной площади. Остальная площадь пуста. Только один элемент кристаллизуется в простой кубической форме, полоний, из-за неэффективности этой структуры.
Остальная площадь пуста. Только один элемент кристаллизуется в простой кубической форме, полоний, из-за неэффективности этой структуры.
8 угловых атомов × ⅛ = 1 атом/ячейка. Упаковка в этой структуре неэффективна (52%), поэтому такой тип структуры в металлах встречается крайне редко.
Объемно-центрированная кубическая (ОЦК)
Объемно-центрированная кубическая (ОЦК)
Поскольку каждая сфера соприкасается с четырьмя сферами в плоскости вверху и еще с четырьмя сферами в плоскости внизу, расположенными по углам куба, такое расположение известная как объемно-центрированная кубическая структура. Объемно-центрированный куб является повторяющейся единицей в этой конструкции и состоит из куба с восемью сферами и девятой идентичной сферой посередине. Координационное число этой структуры равно 8. Объемно-центрированная кубическая упаковка использует пространство более эффективно, чем простая кубическая упаковка; в этой конструкции используется 68% доступного пространства. Ряд ранних переходных металлов, включая Ti, V, Cr, Mo, W и Fe, упаковываются в объемно-центрированную кубическую форму, как и все металлы группы IA (Li, Na, K и т. д.). ), более тяжелые металлы группы IIA (Ca, Sr и Ba) и металлы группы IIA.
Ряд ранних переходных металлов, включая Ti, V, Cr, Mo, W и Fe, упаковываются в объемно-центрированную кубическую форму, как и все металлы группы IA (Li, Na, K и т. д.). ), более тяжелые металлы группы IIA (Ca, Sr и Ba) и металлы группы IIA.
(8 угловых атомов × ⅛) + (1 центральный атом × 1) = 2 атома на ячейку. Структура обычная для щелочных металлов и ранних переходных металлов, а упаковка более эффективна (68%). Эти структуры также используются сплавами, такими как латунь (CuZn).
Кубическая гранецентрированная (ГЦК) / Кубическая закрытоупакованная (ГЦК)
Кубическая гранецентрированная (ГЦК)
В кубической плотноупакованной структуре атомы в этих плоскостях ориентированы в разных направлениях. И гексагональная, и кубическая структуры одинаково эффективны, когда они расположены близко друг к другу. (Оба занимают 74% пространства.) Многие металлы кристаллизуются в кубической форме с плотнейшей упаковкой, включая Ag, Al, Au, Ca, Co, Cu, Ni, Pb и Pt. Когда эти газы охлаждаются до температуры, достаточной для затвердевания, все они затвердевают, за исключением гелия.
Когда эти газы охлаждаются до температуры, достаточной для затвердевания, все они затвердевают, за исключением гелия.
Простейшей повторяющейся единицей в кубической плотноупакованной структуре является гранецентрированная кубическая элементарная ячейка. Фактически, название структуры, кубическая плотнейшая упаковка, происходит от того факта, что она содержит гранецентрированные кубические элементарные ячейки.
(8 угловых атомов × ⅛)+ (6 гранных атомов × ½) = 4 атома/ячейка. Эта структура имеет самую высокую эффективную упаковку (74%), наряду со своим гексагональным родственником (ГПУ). Многие металлы имеют ГЦК- или ГПУ-структуру.
Шестигранник в закрытой упаковке (Hcp)
Гексагональная закрытая упаковка (Hcp)
Известна как гексагональная структура с плотнейшей упаковкой, поскольку состоит из сфер, попеременно упакованных в шестиугольники в двух плоскостях. Каждая сфера соприкасается с шестью сферами на той же плоскости, с тремя сферами на нижней плоскости и с тремя сферами наверху.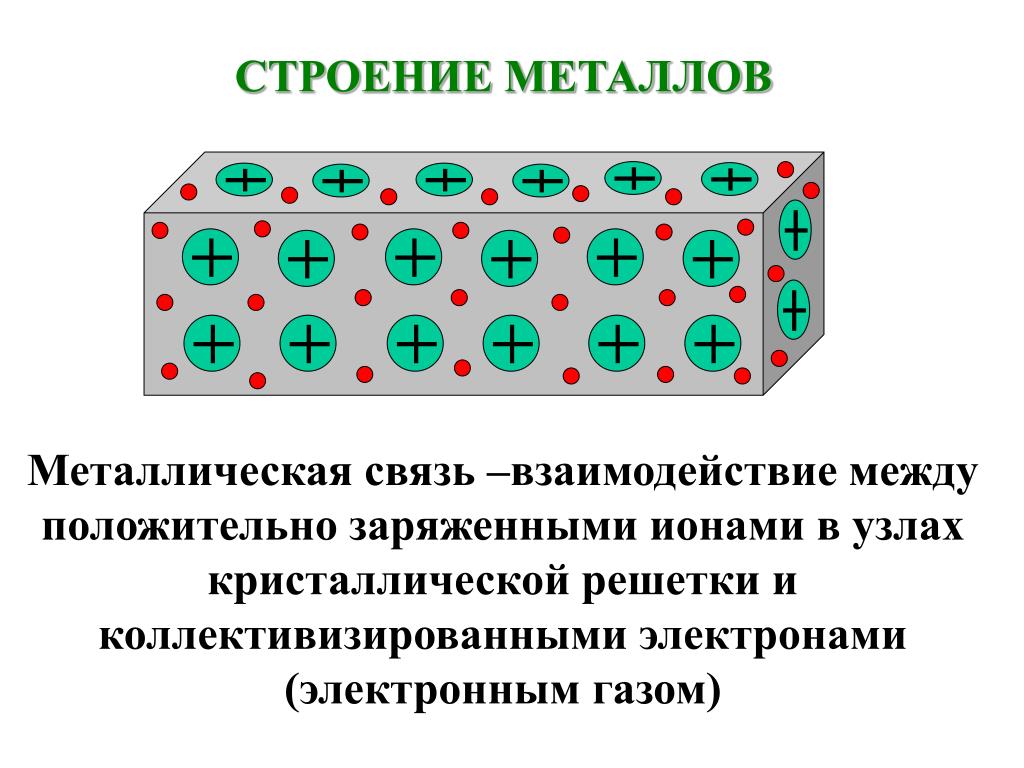 В гексагональной плотнейшей упаковке занято 74% доступного пространства, поэтому координационное число равно 12. Гексагональная плотнейшая упаковка имеет решающее значение для низкотемпературных материалов, таких как Be, Co, Mg и Zn, а также для редкий газ He, потому что не известно более эффективного способа упаковки сфер. Следовательно, плотность упаковки ГПУ составляет 74%, как и в ГЦК-структуре.
В гексагональной плотнейшей упаковке занято 74% доступного пространства, поэтому координационное число равно 12. Гексагональная плотнейшая упаковка имеет решающее значение для низкотемпературных материалов, таких как Be, Co, Mg и Zn, а также для редкий газ He, потому что не известно более эффективного способа упаковки сфер. Следовательно, плотность упаковки ГПУ составляет 74%, как и в ГЦК-структуре.
Зернистая структура металлов и сплавов
Отдельные кластеры кристаллов, или «зерна», составляют внутреннюю структуру металла. Форма, размер и ориентация этих зерен зависят от состава сплава и производственного процесса (например, ковка, литье или аддитивное производство). Когда расплавленный материал затвердевает, образуются зерна. Эти зерна взаимодействуют друг с другом, а также с фазами и загрязнениями. Структура зерна, как правило, приспособлена для технологического использования. В основном механические и технические свойства этих материалов тесно связаны с размером, ориентацией и другими структурными особенностями зерен. Кроме того, будущие внешние раздражители влияют на структурные свойства. Эти факторы включают:
Кроме того, будущие внешние раздражители влияют на структурные свойства. Эти факторы включают:
- Химические факторы (например, коррозия)
- Физические или химические эффекты (например, процессы термообработки)
- Механические факторы (например, после процессов формовки, таких как ковка, прокатка, гибка и т. д.)
Когда жидкий материал затвердевает, образуются сами зерна. Как правило, для использования металлического сплава зернистая структура модифицируется. Медно-никелевый сплав, например, имеет зернистую структуру, которая позволяет дробить металл на никель и десятицентовик.
Вы можете определить характеристики материала, такие как его прочность, твердость и пластичность, по зернистой структуре, также известной как микроструктура.
Координационное число и структура металлов
Общее количество атомов, ионов или молекул, связанных с определенным атомом, определяется координационным числом атома в данной молекуле или кристалле. Другое название координационного числа атома — «лигантность».
Другое название координационного числа атома — «лигантность».
Лиганды – это атомы, ионы или молекулы, связанные с основным атомом (или молекулой/ионом). При определении координационного числа центрального атома в кристалле расчет лигантности молекул отличается.
Легко понять, почему металлы образуют структуры, которые плотно упакованы в шестиугольные или кубические формы. Эти структуры имеют максимально возможные координационные числа, что позволяет каждому атому металла устанавливать связи с наибольшим числом соседних атомов металла, а также максимально использовать доступное пространство.
| Структура | Координационный номер | Схема укладки |
| Простой Кубическая структура | 6 | АААААААА . . . |
| Объемно-центрированная кубическая структура | 8 | ABABABAB . . . . . . . |
| Шестигранная закрытая упаковка | 12 | ABABABAB . . . |
Ссылки
- https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Book%3A_Introduction_to_Inorganic_Chemistry_(Wikibook)/06%3A_Metals_ and_Alloys-_Structure_Bonding_Electronic_and_Magnetic_Properties
- https://www.struers.com/en/Knowledge/Materials/Metallic-grain-structures#main
- https://pocketdentistry.com/1-4-structure-of-metals-and-alloys/
- https://www.studysmarter.co.uk/explanations/chemistry/ionic-and-morphic-compounds/structure-of-metals-and-alloys/
- https://chemed.chem.purdue.edu/genchem/topicreview/bp/ch23/structure.php
Внутренние конструкции из металлов, используемых в сварочной промышленности
Toggle Nav
Поиск
То, как выглядит металл внутри, в атомном масштабе оказывает большое влияние на его реакцию на тепло, подаваемое к нему в процессе сварки и резки. Расположение и расположение атомов настолько малы, что их невозможно увидеть даже в самые мощные в мире микроскопы, однако именно это расположение отвечает за большинство свойств его материала. Прочность является основным свойством материала, на которое влияет теплота сварки, но есть и другие свойства, о которых говорилось в предыдущих статьях.
Расположение и расположение атомов настолько малы, что их невозможно увидеть даже в самые мощные в мире микроскопы, однако именно это расположение отвечает за большинство свойств его материала. Прочность является основным свойством материала, на которое влияет теплота сварки, но есть и другие свойства, о которых говорилось в предыдущих статьях.
Материалы могут существовать в четырех различных агрегатных состояниях. Твердые тела, жидкости, газы и плазма — это четыре состояния материи, в которых могут существовать материалы на этой Земле. Металлы состоят из кристаллических структур, имеющих определенный рисунок и форму. Каждый металл имеет свою кристаллическую структуру, но большинство металлов состоит из четырех преобладающих типов. Объемно-центрированный кубический (BCC), объемно-центрированный кубический (FCC), гексагональный плотно упакованный (HCP) и объемно-центрированный тетрагональный (BCT). Каждый металл имеет свой предпочтительный тип, но некоторые материалы, такие как углеродистая сталь, колеблются между различными структурами в зависимости от температуры и содержания сплава.
Например, при комнатной температуре мягкая сталь имеет структуру ОЦК, но при нагревании выше 1333°F структура меняется на FCC и фактически теряет свои магнитные свойства. Я видел несколько замечательных научных экспериментов, которые показывают это преобразование в макромасштабе, легко видимом невооруженным глазом.
Именно это изменение между кристаллическими структурами и фазами позволяет углеродистым и легированным сталям реагировать на широкий спектр операций термической обработки, включая размягчение или отжиг, закалку, закалку и отпуск, снятие напряжений и нормализацию.
Именно эти изменения внутренней структуры, вызванные выделением тепла в процессе сварки или резки, вызывают изменения механических свойств металла, которые мы видим и можем измерить. Некоторые металлы не поддаются термической обработке, например, такие как алюминиевые сплавы серии 5ХХХ, но это не означает, что их внутренняя структура не изменяется.
Все металлы состоят из атомов, заключенных в кристаллической структуре материалов. Атомы находятся в постоянной вибрации из-за ряда факторов, одним из которых является количество доступного тепла, а другими факторами, такими как механические силы. Электроны, вращающиеся вокруг центра атомов, никогда не останавливаются.
Атомы находятся в постоянной вибрации из-за ряда факторов, одним из которых является количество доступного тепла, а другими факторами, такими как механические силы. Электроны, вращающиеся вокруг центра атомов, никогда не останавливаются.
Атомные силы атомов поддерживают порядок в кристаллической структуре и отталкивают силы, пытающиеся нарушить или переместить атомы. Когда мы добавляем к металлу тепло и энергию, атомы начинают быстро вибрировать, в конце концов вибрация в их кристаллической структуре становится слишком большой, и упорядоченная структура исчезает. В нашем сварочном колпаке мы видим, как металл превращается из твердого в жидкое. Жидкая лужица — это всего лишь группа всех этих атомов, вырвавшихся из своих кристаллических структурных связей. Точно так же, как тепло заставило их распасться, удаление тепла приводит к восстановлению порядка в форме кристаллической структуры.
По мере остывания лужи происходит затвердевание. Когда кристаллическая структура реформируется, ни один атом не возвращается на прежнее место. В зависимости от того, как атомы решили переместиться, большое влияние оказывает изменение механических свойств, которое мы наблюдаем после охлаждения сварного шва. Именно эта повторная сборка атомов в их упорядоченную кристаллическую структуру также приводит к деформации и старению.
В зависимости от того, как атомы решили переместиться, большое влияние оказывает изменение механических свойств, которое мы наблюдаем после охлаждения сварного шва. Именно эта повторная сборка атомов в их упорядоченную кристаллическую структуру также приводит к деформации и старению.
Скорость охлаждения в сочетании с содержанием сплава также влияет на размер зерен в металле. Металлы с крупными зернами, как правило, имеют более низкую пластичность и прочность. С другой стороны, мелкозернистые материалы обладают лучшей пластичностью и прочностью. Скорость охлаждения и элементы сплава будут влиять на конечный размер зерна, который мы получим. Зерна металла видны с помощью микроскопа. Процесс металлографии позволяет увидеть сами зерна и измерить их размер.
Как мы видим своими глазами, избыточное тепло не является нашим другом в большинстве сварочных и производственных операций. Способность понять, что происходит в атомарном масштабе, как правило, улучшает наши общие знания и понимание того, что важность выбора процесса возрастает.