Содержание
Физические свойства. Из химических свойств металлов наиболее важными в производстве ху-дожественных изделий являются растворение и окисление
Поделись с друзьями:
Химические свойства.
Из химических свойств металлов наиболее важными в производстве ху-дожественных изделий являются растворение и окисление.
Растворение (разъедание) – способность металлов растворяться в силь-ных кислотах и едких щелочах. Наиболее часто в производстве употребляются серная, азотная и соляная кислоты, а также смесь азотной и соляной кислот – царская водка. Из щелочей широко применяется едкий натр и едкий калий.
Свойство металлов растворяться имеет очень широкое применение в са-мых различных областях производства художественных изделий. При этом оно иногда носит частичный характер (т.е. затрагивает только поверхностный слой металла), а иногда имеются случаи полного растворения металла и пере-хода его в раствор. Пример частичного растворения – травление изделий в ки-слотах для получения чистой поверхности или узора. Пример полного раство-рения металла является растворение цинка в соляной кислоте для приготовле-ния хлористого цинка, употребляемого в качестве флюса при пайке.
Пример полного раство-рения металла является растворение цинка в соляной кислоте для приготовле-ния хлористого цинка, употребляемого в качестве флюса при пайке.
Окисление – способность металла соединяться с кислородом и образо-вывать окислы металлов. Обычно почти все металлы покрыты поверхностной окисной пленкой, представляющей из себя тончайший слой, состоящий из окислов. Скорость окисления у разных металлов неодинакова. Магний и алю-миний окисляются особенно быстро, бронза и латунь значительно медленнее, а золото и платина вообще не окисляются.
В одних случаях такое окисление и образование оксидной пленки на по-верхности весьма желательно, так как изделие при этом предохраняется от да-льнейшего окисления в глубину. В этом случае оксидная пленка является за-щитной, например, у алюминия и его сплавов. В других случаях это явление нежелательно, так как затрудняет пайку и сварку, если это необходимо по тех-нологическому процессу. Очень нежелательно образование окалины и на ста-льных изделиях.
Процесс окисления сказывается на внешнем виде художественного изде-лия, особенно если оно находится снаружи помещения и подвергается актив-ному воздействия окружающей среды. Часто можно увидеть памятники из ме-ди и ее сплавов (бронзы), покрытые налетом зеленого цвета. Иногда это добав-ляет определенный шарм художественному произведению, как бы намекая на его старину, и тем самым повышая его значимость для зрителя.
В этом пункте рассматриваются некоторые свойства, характеризующие собственно природу материалов и, в частности, металлов.
Цвет и блеск — эти два свойства, обуславливая в основном внешний вид металла, являются чрезвычайно важными для художников, так как характери-зуют художественно-эстетические достоинства металлов как материалов, из которых «изготавливаются» (а почему нет!) произведения искусства. Каждый металл обладает определенным присущим ему цветом, хотя большинство из них имеют довольно однообразную гамму серовато-белых, иногда серебрис-тых тонов. Исключение составляют два металла: золото, имеющее насыщен-ный желтый цвет и медь, имеющая сильный оранжево-красный цвет. При до-бавлении этих металлов в другие сплавы позволяет придать им гораздо более богатую палитру оттенков.
Исключение составляют два металла: золото, имеющее насыщен-ный желтый цвет и медь, имеющая сильный оранжево-красный цвет. При до-бавлении этих металлов в другие сплавы позволяет придать им гораздо более богатую палитру оттенков.
Иногда для обогащения цвета применяют не сам металл, а его окислы или другие химические соединения. Такой прием называется оксидированием или патинированием. Он позволяет получить очень разнообразные по силе и яркости тона и цвета металла и значительно расширить палитру художника.
Температура плавления — характеризует свойство металла быть в раз-ных агрегатных состояниях (твердом и жидком) и, в частности, температуру перехода из твердого состояния в жидкое. В долях от температуры плавления часто указывают температурный интервал обработки давлением металлов в тех или иных процессах.
Температуры плавления металлов и их сплавов очень сильно различают-ся. Например, наиболее тугоплавкий металл – вольфрам плавится при 33800С, а один из легкоплавких металлов — ртуть имеет температуру плавления — 390С (!), т. е. при комнатной температуре она находится в жидком состоянии.
е. при комнатной температуре она находится в жидком состоянии.
По температурам плавления все металлы делятся на легкоплавкие (тем-пература плавления не превышает 7000С) и тугоплавкие (температура плавле-ния свыше 19000С). В табл.1 приведена температура плавления ряда металлов.
Табл. 1. Температура плавления некоторых металлов (0С).
Плотность — свойство металла, определяющее количество массы метал-ла в единице объема. При расчетах процессов обработки металлов давлением в подавляющем большинстве случаев принимают, что плотность остается неизменной. В действительности обработка давлением, как правило, способст-вует увеличению плотности металла (уплотнению) из–за наличия в исходном (после плавки и литья) состоянии заготовки большого количества пор, рако-вин и других дефектов структуры.
По плотности все металлы разделяются на легкие и тяжелые. Легкими принято называть металлы с плотностью до 3 г/см3, а тяжелыми с плотностью от 6 г/см3 и выше. Данные по плотности различных металлов приведены в табл. 2.
Данные по плотности различных металлов приведены в табл. 2.
Табл. 2. Плотность различных металлов и сплавов (г/см3).
Теплопроводность — свойство металла передавать теплоту от более наг-ретых частей менее нагретым. Чем выше теплопроводность, тем быстрее и ра-вномернее прогревается весь объем металл при нагреве его в печи. Это облег-чает процесс деформирования и снижает вероятность образования дефектов.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Физические и химические свойства металлов
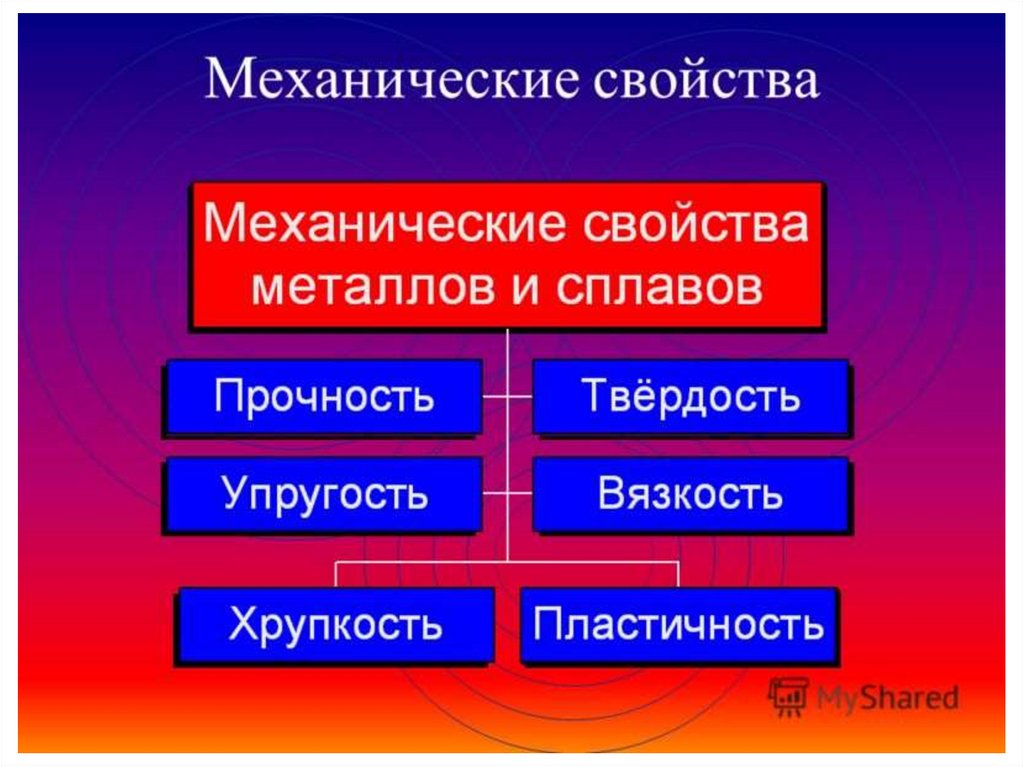
Различают технологические, физические, механические и химические свойства металлов. К физическим относят удельный вес, цвет, электропроводность. К характеристикам этой группы относятся также теплопроводность, плавкость и плотность металла.
К механическим характеристикам относят пластичность, упругость, твердость, прочность, вязкость.
Химические свойства металлов включают в себя коррозийную стойкость, растворимость и окисляемость.
Такие характеристики, как «жидкотекучесть», прокаливаемость, свариваемость, ковкость, являются технологическими.
Физические свойства
- Цвет. Металлы не пропускают свет сквозь себя, то есть непрозрачны. В отраженном свете каждый элемент обладает своим собственным оттенком – цветом. Среди технических металлов окраску имеет только медь и сплавы с ней. Для остальных элементов характерным является оттенок от серебристо-белого до серо-стального.
- Плавкость. Эта характеристика указывает на способность элемента под воздействием температуры переходить в жидкое состояние из твердого. Плавкость считается важнейшим свойством металлов. В процессе нагревания все металлы из твердого состояния переходят в жидкое. При охлаждении же расплавленного вещества происходит обратный переход – из жидкого в твердое состояние.
- Электропроводность. Данная характеристика свидетельствует о способности переноса свободными электронами электричества. Электропроводность металлических тел в тысячи раз больше, чем неметаллических.
 При увеличении температуры показатель проводимости электричества снижается, а при уменьшении температуры, соответственно, повышается. Необходимо отметить, что электропроводность сплавов будет всегда ниже, нежели какого-либо металла, составляющего сплав.
При увеличении температуры показатель проводимости электричества снижается, а при уменьшении температуры, соответственно, повышается. Необходимо отметить, что электропроводность сплавов будет всегда ниже, нежели какого-либо металла, составляющего сплав. - Магнитные свойства. К явно магнитным (ферромагнитным) элементам относят только кобальт, никель, железо, а также ряд их сплавов. Однако в процессе нагревания до определенной температуры указанные вещества теряют магнитность. Отдельные сплавы железа при комнатной температуре не относятся к ферромагнитным.
- Теплопроводность. Эта характеристика указывает на способность перехода тепла к менее нагретому от более нагретого тела без видимого перемещения составляющих его частиц. Высокий уровень теплопроводности позволяет равномерно и быстро нагревать и охлаждать металлы. Среди технических элементов наибольшим показателем обладает медь.
Металлы в химии занимают отдельное место. Наличие соответствующих характеристик позволяет применять то или иное вещество в определенной области.
Химические свойства металлов
- Коррозийная стойкость. Коррозией называют разрушение вещества в результате электрохимического или химического взаимоотношения с окружающей средой. Самым распространенным примером считается ржавление железа. Коррозийная стойкость относится к важнейшим природным характеристикам ряда металлов. В связи с этим такие вещества, как серебро, золото, платина получили название благородных. Обладает высокой коррозийной сопротивляемостью никель и прочие цветные металлы. Черные металлы подвержены разрушению быстрее и сильнее, нежели цветные.
- Окисляемость. Эта характеристика указывает на способность элемента вступать в реакцию с О2 под влиянием окислителей.
- Растворимость. Металлы, обладающие в жидком состоянии неограниченной растворимостью, при затвердении могут формировать твердые растворы. В этих растворах атомы от одного компонента встраиваются в кристаллическую решетку другого составляющего только в определенных пределах.

Необходимо отметить, что физические и химические свойства металлов являются одними из основных характеристик этих элементов.
Свойства металлов и неметаллов
Мы можем разделить элементы на металлы и неметаллы на основе их химических и физических свойств. Этили определяются как элементы, обладающие такими свойствами, как ковкость, пластичность, звучность и хорошие проводники тепла. и электричество. В то время как неметаллы — это те элементы, которые не податливы, пластичны, звучны и являются плохими проводниками тепла и электричества. На следующем рисунке в периодической таблице выделены металлы и неметаллы, а также металлоиды.
(Изображение будет загружено в ближайшее время)
В этой статье мы подробно обсудим свойства металлов и неметаллов и разницу между ними на основе их свойств (с исключениями).
Что такое металл?
Металл в химии определяется как элемент, который может легко образовывать положительные ионы, называемые катионами, и имеет тенденцию образовывать металлические связи. Металлы отличаются своими химическими и физическими свойствами, такими как ковкость, пластичность, ионизационные и связующие свойства и т. д.
Металлы отличаются своими химическими и физическими свойствами, такими как ковкость, пластичность, ионизационные и связующие свойства и т. д.
Свойства металлов
Примерами металлов являются золото, алюминий, железо, магний и т. д. Они обладают следующими свойствами.
Физические свойства металлов: Некоторые из основных физических свойств металлов приведены ниже.
Металлы можно ковать в тонкие листы. Это значит, что они обладают свойством податливости.
Металлы пластичны. Их можно втянуть в провода.
Металлы являются хорошими проводниками тепла и электричества.
Металлы блестящие, что означает, что они имеют блестящий вид.

Металлы обладают высокой прочностью на растяжение. Это означает, что они могут держать тяжеловесов.
Металлы звонкие. Это означает, что когда мы ударяем их, они издают звонкий звук.
Металлы твердые. Это означает, что их нельзя легко разрезать.
Химические свойства металлов: Некоторые химические свойства металлов приведены ниже.
Металл + кислород Оксид металла
Оксид металла + вода Основание
Пример. Магний является металлом, и когда он реагирует с кислородом, он образует оксид магния. Когда мы растворяем оксид магния в воде, получается гидроксид магния. Реакции приведены ниже.
2Mg + O2 2MgO
MgO + h3O Mg(OH)2
Водный раствор оксида металла превращает красную лакмусовую бумажку в синюю.

Реакция с водой — Металлы реагируют с водой. Когда металл реагирует с водой, образуются гидроксид металла и газообразный водород.
Металл + вода Гидроксид металла + водород
Пример. Металлический натрий реагирует с водой с образованием гидроксида натрия и газообразного водорода. Реакция представлена ниже –
Na + h3O NaOH + h3
Металл + Кислота Соль металла + водород
Пример. Металлический магний реагирует с соляной кислотой и образует хлорид магния и водород. Реакция представлена ниже –
Mg + 2HCl MgCl2 + h3
Металл + соль основного металла + водород
Пример. Металлический алюминий реагирует с гидроксидом натрия с образованием алюмината натрия и газообразного водорода. Реакция приведена ниже –
Al + NaOH NaAlO2 + h3
Пример – Железо более реакционноспособно, чем медь. Таким образом, он вытесняет медь из соли. Реакция приведена ниже –
Таким образом, он вытесняет медь из соли. Реакция приведена ниже –
CuSO4 + Fe FeSO4 + Cu
Что такое неметалл?
Неметалл в химии можно определить как химический элемент, который обычно в химической реакции получает электроны при взаимодействии с металлом. Он имеет тенденцию образовывать кислоту в сочетании с кислородом и водородом. Неметаллы демонстрируют большее разнообразие цветов и состояний по сравнению с металлами.
Свойства неметаллов
Примерами неметаллов являются хлор, углерод, бром, сера, фосфор и т. д. Они проявляют следующие свойства:
Физические свойства неметаллов: некоторые из основных физических свойств неметаллы приведены ниже.
Неметаллы нельзя забивать в тонкие листы. Это означает, что они не обладают свойством податливости.
 Вместо этого они хрупкие, так как при ударе молотком распадаются на куски.
Вместо этого они хрупкие, так как при ударе молотком распадаются на куски.Неметаллы не пластичны. Их нельзя втягивать в провода.
Неметаллы являются плохими проводниками тепла и электричества.
Неметаллы не блестят, что означает, что они не блестят. Вместо унылого вида.
Неметаллы имеют низкую прочность на растяжение. Это означает, что они не могут удерживать тяжеловесов.
Неметаллы не звонкие. Это означает, что когда мы ударяем их, они не издают ни звука.
Неметаллы мягкие. Это означает, что их можно легко разрезать ножом.
Химические свойства неметаллов: Некоторые химические свойства элементов приведены ниже.
Неметалл + кислород Оксид неметалла
Оксид неметалла + вода Кислота
Пример. Сера является неметаллом и при взаимодействии с кислородом образует диоксид серы. Когда мы растворяем диоксид серы в воде, получается сернистая кислота. Реакции приведены ниже.
S + O2 SO2
SO2 + h3O h3SO3
Водный раствор оксида неметалла превращает синюю лакмусовую бумажку в красную.
Неметаллы обычно не реагируют с водой.
Неметаллы не реагируют с разбавленными кислотами, хотя могут реагировать с концентрированными кислотами.
Пример – C + конц. 4HNO3 CO2 + 4NO2 + 2h3O
Пример – 4S + 8NaOH Na2SO4 + 3Na2S + 4h3O (при >600 ℃)
Пример. Бром более активен, чем йод. Таким образом, он замещает йод в соединениях йодида калия. Реакция приведена ниже –
Бром более активен, чем йод. Таким образом, он замещает йод в соединениях йодида калия. Реакция приведена ниже –
2KI + Br2 2KBr + I2
Разница между металлами и неметаллами
Мы различаем металлы и неметаллы по их физическим и химическим свойствам. Здесь разница между металлом и неметаллом представлена в виде таблицы с исключениями для лучшего понимания. Приведенные выше физические и химические свойства металлов и неметаллов сравниваются здесь.
Серийный номер | Имущество | Металл | Неметалл | Исключения |
1 | Пластичность | Ковкость | Нековкость | |
2 | Пластичность | Пластичность | Непластичность | — |
3 | Хрупкий | Нехрупкий | Хрупкий | — 9000 3 |
4 | Проводимость | Хороший проводник тепла и электричества | Плохой проводник тепла и электричества | Алмаз – неметалл, но хороший проводник тепла. Графит – неметалл, но хороший проводник электричества. |
5 | Блеск | Блеск | Матовый 90 003 | Алмаз и йод – неметаллы, но блестящие. |
6 | Прочность | Высокая прочность на растяжение | Низкая прочность на растяжение | Натрий и калий являются металлами, но имеют низкую прочность на растяжение. |
7 | Звонкость | Звонкость | Незвонкость | — |
8 | Твердость | Твердость | Мягкий | Натрий и калий — это металлы, но они мягкие и могут резаться ножом. Алмаз — неметалл, но очень твердое вещество. Это самое твердое известное природное вещество. |
9 | Реакция с кислородом | Металл + кислород Оксид металла 2Mg + O2 2MgO | Неметалл + кислород Оксид неметалла S + O2 SO2 | — |
10 | Реакция с водой | Металл + вода Гидроксид металла + водород Na + h3O NaOH + h3 | Не реагирует с водой | — 900 03 |
11 | Реакция с кислотой | Металл + кислота Соль металла + водород Mg + 2HCl MgCl2 + h3 | Неметаллы не реагируют с разбавленной кислотой, но реагируют с концентрированной кислотой. С + конц. 4HNO3 CO2 + 4NO2 + 2h3O | — |
12 | Реакция с основанием 901 99 | Металл + соль основного металла + водород Al + NaOH NaAlO2 + h3 | Реагировать с сильными основаниями и не выделяют газообразный водород. 4S + 8NaOH Na2SO4 + 3Na2S + 4h3O (при >600 ℃) | — |
| 9 0002 13 | Реакция замещения | Более активный металл вытесняет менее активный металл из его соли. Железо более реакционноспособно, чем Cu. CuSO4 + Fe FeSO4 + Cu | Более активный неметалл вытесняет менее реакционноспособный неметалл из его соли. Бром более активен, чем йод. 2KI + Br2 2KBr + I2
| — |
14 | Природа оксидов | Основные | Кислые | — |
15 | Действие оксидов на лакмусовую бумагу | Оксиды металлов окрашивают лакмусовую бумагу в красный цвет в синий. | Оксиды неметаллов превращают синюю лакмусовую бумагу в красную. | — |
16 | Реакции оксидов с водой | Оксиды металлов реагируют с водой и образуют соответствующие гидроксиды. MgO + h3O Mg(OH)2 | Оксиды неметаллов реагируют с водой и образуют кислоты. SO2 + h3O h3SO3 | — |
Прочитав эту статью, вы сможете решать задачи по теме. Мы получаем необходимые базовые знания, связанные с металлами и неметаллами. Если вы ищете решения проблем с учебниками NCERT, основанные на этой теме, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning. Таким образом, вы сможете получить доступ к бесплатным PDF-файлам с решениями NCERT, а также к примечаниям к изменениям, пробным тестам и многому другому.
Что такое металлы и неметаллы? |Изучите важные термины и понятия
Металлы и неметаллы — это два различных типа материалов, с которыми мы сталкиваемся в повседневной жизни. Металлы и неметаллы — две категории элементов. Неметаллы (такие как фосфор и сера) являются изоляторами, а металлы (такие как медь и алюминий) хорошо проводят тепло и электричество. Материалы классифицируют по их физическим и химическим свойствам. Понимание разницы между металлом и неметаллом поможет учащимся сформировать основу для изучения химии. На основе их физических и химических свойств ученые открыли расположение металлов и неметаллов в периодической таблице.
Металлы
Металлы составляют большинство элементов периодической таблицы. Щелочные металлы, лантаноиды, актиноиды, переходные металлы и щелочноземельные металлы — все это примеры. В периодической таблице металлы отделены от неметаллов линией, идущей от углерода к радону. Элементы, которые отличают эти два, являются фосфором, селеном и йодом.
Неметаллы
Неметаллы составляют половину таблицы Менделеева. Их можно найти в правой части периодической таблицы. Сера, углерод, все галогены, фосфор, водород, кислород, селен, азот и инертные газы — все это неметаллы. Бром – это неметалл, который при комнатной температуре находится в жидком состоянии.
Положение металлов в периодической таблице
Неметаллы – это эти и следующие за ними элементы в периодической таблице. Полуметаллы или металлоиды — это элементы, которые существуют слева от линии. Они будут иметь качества, которые представляют собой смесь металлов и неметаллов.
Положение неметаллов в периодической таблице
Неметаллы находятся слева от галогенов и справа от металлоидов в периодической таблице. Благородные газы и галогены обычно называют неметаллами.
Металлы и неметаллы в Периодической таблице Позиции
В Периодической таблице металлы и неметаллы показаны выше. Розовый цвет выше указывает на периодическую таблицу неметаллов, а синий цвет указывает на периодическую таблицу металлов. Среди этих алмазов и йода — блестящие неметаллы. Фтор является наиболее реакционноспособным неметаллом. Бром представляет собой жидкий неметалл при комнатной температуре.
Розовый цвет выше указывает на периодическую таблицу неметаллов, а синий цвет указывает на периодическую таблицу металлов. Среди этих алмазов и йода — блестящие неметаллы. Фтор является наиболее реакционноспособным неметаллом. Бром представляет собой жидкий неметалл при комнатной температуре.
Физические свойства металлов
Металлы являются твердыми веществами при комнатной температуре (галлий находится в жидком состоянии в жаркие дни), кроме ртути, которая находится в жидком состоянии при комнатной температуре.
Блеск: Металлы, такие как золото, серебро и медь, обладают способностью отражать свет от своей поверхности и могут полироваться.
Металлы ковкие, то есть они могут выдерживать удары молотком и превращаться в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, достаточно большой, чтобы покрыть футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, достаточно большой, чтобы покрыть футбольное поле.Металлы можно вытягивать в проволоку благодаря их пластичности. Например, 100 г серебра можно натянуть на тонкую проволоку длиной 200 метров.
Твердость: За исключением натрия и калия, которые являются мягкими и могут быть разрезаны ножом, все металлы твердые.
Металлы имеют от 1 до 3 электронов на внешней оболочке их атомов, что придает им их валентность.
Металлы являются хорошими проводниками из-за большого количества свободных электронов. Серебро и медь являются лучшими проводниками тепла и электричества. Свинец является наименее эффективным проводником тепла. Железо, висмут и ртуть также являются плохими проводниками.

Металлы имеют высокую плотность и поэтому тяжелые. Плотность иридия и осмия самая высокая, а у лития самая низкая.
Температура кипения и плавления: Металлы имеют высокие температуры плавления и кипения. Температура плавления и кипения у вольфрама самая высокая, у ртути самая низкая. Температуры плавления натрия и калия также низкие.
Физические свойства неметаллов
При температуре окружающей среды большинство неметаллов существуют в двух из трех агрегатных состояний: газообразном (кислород) и твердом (углерод). При комнатной температуре бром существует в виде жидкости.
Непластичные и пластичные материалы являются хрупкими и не могут быть свернуты в проволоку или расколоты в листы.

Проводимость: Плохие проводники тепла и электричества.
Они не имеют металлического блеска и не отражают свет.
Точки плавления и кипения неметаллов обычно ниже, чем у металлов, но они сильно различаются.
Примеры неметаллов – h3(g), N2(g), O2(g), F2(g), Cl2(g), Br2(l), I2(s) – семь существующих неметаллов как двухатомные молекулы при нормальных условиях.
Разница между металлами и неметаллами 02 Неметаллы
Металлы пластичны и ковки.
Хрупкость – свойство неметаллов (легко ломаются). Они не податливы и не пластичны.
Металлы являются хорошими проводниками электричества и тепла.
Неметаллы являются плохими проводниками тепла и электричества. Графит, с другой стороны, является хорошим проводником электричества.
Металлы по своей природе блестят.
Неметаллы имеют тусклый вид и не поддаются полировке. За исключением йода.
При комнатной температуре металлы являются твердыми телами. Ртуть, с другой стороны, представляет собой жидкий металл
При комнатной температуре неметаллы могут быть твердыми, жидкими или газообразными.
Металлы прочные и долговечные
Неметаллы слабые и хрупкие.
Разница между металлами и неметаллами на основе химических свойств приведена в таблице ниже.
Металлы | Неметаллы |
Основные оксиды образуются металлами | Неметаллы образуют кислотные или нейтральные оксиды. |
Водород вытесняется из воды металлами (или паром). | Неметаллы не реагируют с водородом. |
Металлы вытесняют водород из разбавленных кислот. | Неметаллы не реагируют с разбавленными кислотами |
Ионные хлориды образуются при взаимодействии металлов с хлором. | При контакте с хлором неметаллы образуют ковалентные хлориды. |
Металлы обычно не соединяются с водородом. Только некоторые химически активные металлы соединяются с водородом с образованием ионных гидридов металлов. | Неметаллы реагируют с водородом с образованием ковалентных гидридов, устойчивых в природе. |
Знаете ли вы?
Железо является самым распространенным металлом на Земле, и оно также составляет значительную часть ядра планеты.

Алюминий — самый распространенный металл в земной коре.
Серебро является лучшим проводником электричества из всех металлов.
Во влажном воздухе благородные металлы, такие как серебро, золото и платина, устойчивы к окислению и коррозии.
Сплавы состоят из двух или более элементов, обычно двух металлов или металла и неметалла.
Заключение
Металлы и неметаллы — это два разных типа материалов, с которыми мы сталкиваемся в повседневной жизни. В периодической таблице металлы находятся в левой части периодической таблицы от 1-й до 2-й группы, а неметаллы находятся в правой части периодической таблицы от 13-й до 18-й группы. Металлы блестящие, твердые, ковкие, звучные, с высокой температурой плавления.







