Содержание
Кристаллизация сплавов.
Кристаллизация
сплавов подчиняется тем же закономерностям,
что и кристаллизация чистых металлов.
Необходимым условием является стремление
системы в состояние с минимумом свободной
энергии.
Основным отличием
является большая роль диффузионных
процессов, между жидкостью и
кристаллизующейся фазой. Эти процессы
необходимы для перераспределения
разнородных атомов, равномерно
распределенных в жидкой фазе.
В сплавах в твердых
состояниях, имеют место процессы
перекристаллизации, обусловленные
аллотропическими превращениями
компонентов сплава, распадом твердых
растворов, выделением из твердых
растворов вторичных фаз, когда
растворимость компонентов в твердом
состоянии меняется с изменением
температуры.
Эти превращения
называют фазовыми превращениями в
твердом состоянии.
При перекристаллизации
в твердом состоянии образуются центры
кристаллизации и происходит их рост.
Обычно центры
кристаллизации возникают по границам
зерен старой фазы, где решетка имеет
наиболее дефектное строение, и где
имеются примеси, которые могут стать
центрами новых кристаллов. У старой и
новой фазы, в течение некоторого времени,
имеются общие плоскости. Такая связь
решеток называется когерентной
связью. В случае различия
строения старой и новой фаз превращение
протекает с образованием промежуточных
фаз.
Нарушение
когерентности и обособления кристаллов
наступает, когда они приобретут
определенные размеры.
Процессы
кристаллизации сплавов изучаются по
диаграммам состояния.
Диаграмма состояния.
Диаграмма
состоянияпредставляет собой
графическое изображение состояния
любого сплава изучаемой системы в
зависимости от концентрации и температуры
(рис. 4.5)
.
Рис. 4.5. Диаграмма состояния
Диаграммы состояния
показывают устойчивые состояния, т. е.
е.
состояния, которые при данных условиях
обладают минимумом свободной энергии,
и поэтому ее также называют диаграммой
равновесия, так как она показывает,
какие при данных условиях существуют
равновесные фазы.
Построение диаграмм
состояния наиболее часто осуществляется
при помощи термического
анализа.
В результате
получают серию кривых охлаждения, на
которых при температурах фазовых
превращений наблюдаются точки перегиба
и температурные остановки.
Температуры,
соответствующие фазовым превращениям,
называют критическими точками.Некоторые критические точки имеют
названия, например, точки отвечающие
началу кристаллизации называют точкамиликвидус,а концу кристаллизации –
точкамисолидус.
По кривым охлаждения
строят диаграмму состава в координатах:
по оси абсцисс –концентрация компонентов,
по оси ординат – температура.
Шкала концентраций
показывает содержание компонента В.
Основными линиями являются линии
ликвидус (1) и солидус (2), а также линии
соответствующие фазовым превращениям
в твердом состоянии (3, 4).
По диаграмме
состояния можно определить температуры
фазовых превращений, изменение фазового
состава, приблизительно, свойства
сплава, виды обработки, которые можно
применять для сплава.
Методы термического анализа
Термический
анализ
представляет собой совокупность методов
определения температур фазовых
превращений и других термических
характеристик индивидуальных соединений
или систем взаимодействующих веществ.
Основа термического
анализа — определение зависимости
температуры кристаллизации (или
плавления) изучаемой системы от ее
состава. Объектами термического анализа
являются как чистые вещества, так и
системы различных веществ — металлов,
солей, органических соединений и т.д.
История становления
термического анализа связывается с
появлением первых термоизмерительных
приборов. Особое место здесь занимает
Особое место здесь занимает
открытый Зеебеком в 1821 г. эффект,
позволивший создать термопару и применить
ее для измерения высоких температур.
Впервые термопара была использована с
этой целью в 1886 году Ле-Шателье. В 1889
году для измерения небольших разностей
температур образца и окружающей среды
Робертс-Остин использовал дифференциальную
термопару. Этот способ лег в основу
дифференциально-термического анализа
(ДТА). Именно развитие методов ДТА стало
толчком рождения новой дисциплины —
физико-химического анализа. Рассмотрим
простейший случай термического анализа,
суть которого заключается в снятии
кривых нагревания и охлаждения в
координатах температура — время.
Рис.5.1.
Кривая охлаждения чистого вещества
(а)
и зависимость
времени показаний прямой (б) и
дифференциальной (в) термопар
При постепенном охлаждении
расплавленного чистого вещества кривая
охлаждения будет иметь вид, приведенный
на рис.5.1 (а).
Участок «ab»
этой зависимости характеризует охлаждение
жидкой фазы. Если бы кристаллизации не
Если бы кристаллизации не
было , то дальнейшее охлаждение жидкости,
характеризовалось бы пунктирным
продолжением отрезка «ab». Однако
в точке b начинается кристаллизация и
в соответствии с правилом фаз Гиббса
(Ф=2, К=1 и С=К-Ф+1=1-2+1=0) дальнейшая
кристаллизация вещества во времени
должна проходить при постоянной
температуре (Ткр),
хотя температура окружающего пространства
продолжает убывать. Причина этого
заключается в том, что выделяющаяся
теплота кристаллизации компенсирует
тепловой поток, направленный от более
нагретого образца к более холодной
окружающей среде. В точке c кристаллизация
вещества заканчивается. Однако более
высокая температура образца сохраняется.
Единственным процессом, протекающим
во времени, остается теплопередача от
образца во внешнюю среду (участок cd).
Характер кривой,
изображенный на рисунке , отчетливо
проявляется при достаточно большой
массе образца и соответствующем масштабе
температурной шкалы. Эти условия в
эксперименте трудно выполнимы.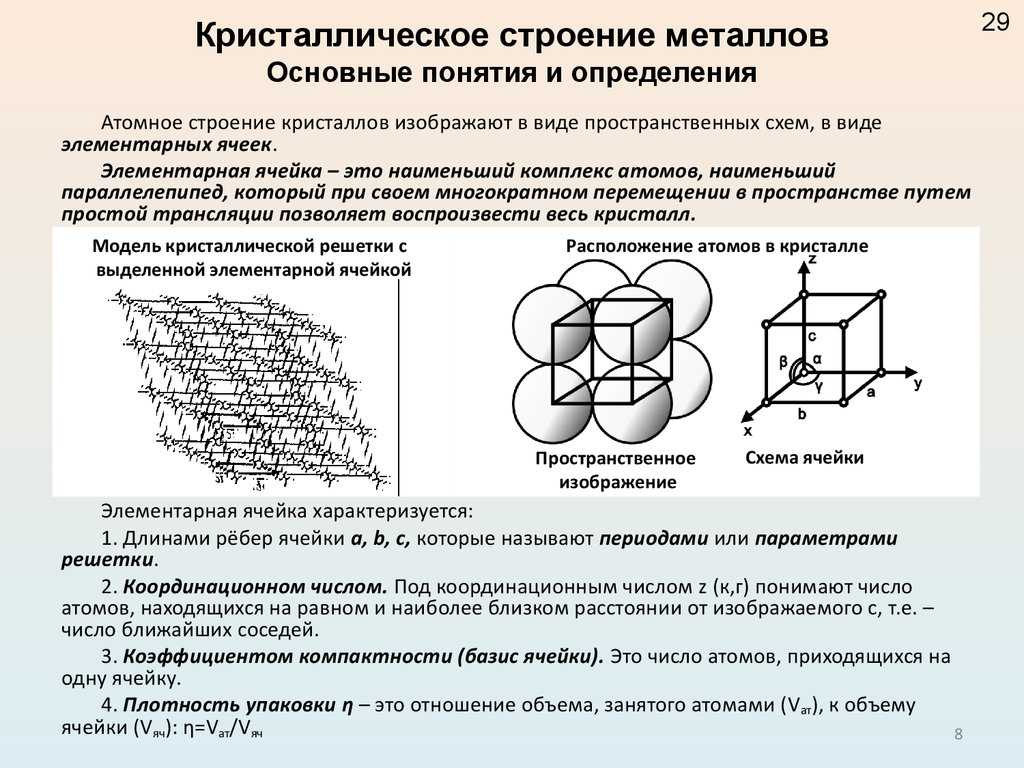 Поэтому
Поэтому
чаще используют т.н. дифференциально-термический
метод.
Другим методов
физико-химического исследования является
дифференциальный
термический анализ (ДТА).
Он позволяет изучать характер фазовых
превращений и осуществлять построение
диаграммы состояния (ДС).
При дифференциальном
термическом анализе возможно обеспечить
более высокую точность и отделить
случайные колебания температур от
вызванных протеканием истинных фазовых
превращений, в отличие от термического
анализа.
Рис.5.2.
Схема дифференциальной термопары: а —
электроды из одного материала; б-
электрод из другого материала; Т1
и Т2 —
горячие спаи
При ДТА используется
одновременный нагрев или охлаждение
эталонного и испытуемого вещества как
в твердом, так и в расплавленном состоянии.
В этом случае в момент фазового перехода
возникает разность температур между
образцом и эталоном. Она фиксируется
дифференциальной термопарой, соединенной
с прибором высокой чувствительности.
Дифференциальная термопара состоит из
двух горячих спаев, связанных между
собой общим электродом (рис.5.2). При
одинаковой температуре спаев разность
возникающих термо ЭДС равна нулю. В
момент фазового превращения температуры
эталона и образца становятся разными
из-за выделения или поглощения тепла
и, соответственно, результирующая термо
ЭДС дифференциальной термопары отличается
от нуля. Разность температур и абсолютная
температура образца одновременно
фиксируются либо обычной термопарой,
либо от соответствующих электродов
дифференциальной термопары.
Можно отчетливо
наблюдать (рис.5,1 б,в), что температура
критической точки «с’» отчетливее
выявляется по дифференциальной кривой,
чем по кривой охлаждения, поэтому
точность анализа в этом случае выше,
чем при обычном термическом.
Глава 2.4. Кристаллизация металлов — Купити в Харкові, Києві, Україні. Безкоштовне тестування
Переход металла из жидкого состояния в твердое называется первичной кристаллизацией. Она протекает вследствие перехода системы из неустойчивого термодинамического состояния в устойчивое, т. е. из состояния с большей энергией в состояние с меньшей энергией.
е. из состояния с большей энергией в состояние с меньшей энергией.
Проиллюстрируем этот процесс с помощью схемы, изображенной на рис. 2.10. Шарик из положения 1 стремится занять более устойчивое положение 2, так как его потенциальная энергия в положении 2 меньше, чем в положении 1.
Рис. 2.10. Стремление системы к уменьшению свободной энергии
Одной из характеристик энергетического состояния системы является свободная энергия. Свободной энергией называется часть полной энергии вещества, которая обратимо изменяется при изменении температуры, полиморфных превращениях, плавлении и т.д. С повышением температуры величина свободной энергии уменьшается. Изменение свободной энергии жидкого и твердого вещества показано на рис. 2.11. При равновесной температуре TS величины свободных энергий металла в жидком и твердом состоянии равны. При температуре выше TS более устойчив жидкий металл, имеющий меньший запас свободной энергии, а ниже этой температуры более устойчив твердый металл. Процесс кристаллизации будет развиваться лишь в том случае, если жидкий металл охладить ниже TS.
Процесс кристаллизации будет развиваться лишь в том случае, если жидкий металл охладить ниже TS.
Рис. 2.11. Изменение свободной энергии (F) жидкого (Fж) и твердого (FТВ) металла в зависимости от температуры: ΔF = FЖ – FТВ
Температура, при которой практически начинается процесс кристаллизации, называется фактической температурой кристаллизации ТK.
Разность между температурами Ts и Тк называется степенью переохлаждения:
ΔТ = ТS – Tk
Процесс перехода металла из жидкого состояния в твердое можно описать с помощью кривых охлаждения в координатах время % — температура Т.
На рис. 2.12 показаны кривые охлаждения, характеризующие кристаллизацию чистых металлов при охлаждении с разной скоростью (иь v2, v3). Кристаллизация происходит при постоянной температуре, поэтому на кривой охлаждения появляется горизонтальная площадка (остановка в падении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации. , Во время плавления происходит поглощение теплоты, которая расходуется на повышение энергии атомов, т.е. на разрушение кристаллической решетки металла. Эта теплота называется скрытой. В процессе кристаллизации происходит обратное явление, а именно выделение энергии в виде скрытой теплоты кристаллизации, которая задерживает падение температуры.
, Во время плавления происходит поглощение теплоты, которая расходуется на повышение энергии атомов, т.е. на разрушение кристаллической решетки металла. Эта теплота называется скрытой. В процессе кристаллизации происходит обратное явление, а именно выделение энергии в виде скрытой теплоты кристаллизации, которая задерживает падение температуры.
Рис. 2.12. Кривые охлаждения чистого металла: ΔT1, Δ T2, Δ T3 — степени переохлаждения
При очень медленном охлаждении степень переохлаждения мала и кристаллизация происходит при температуре, близкой к равновесной. С увеличением скорости охлаждения степень переохлаждения возрастает (кривые, соответствующие скоростям охлаждения и и3), и процесс кристаллизации протекает при температурах значительно более низких, чем равновесная температура кристаллизации.
Необходимая для кристаллизации степень переохлаждения зависит от природы и чистоты металла. Чем чище металл, тем большее переохлаждение требуется для возникновения зародышей твердых кристаллов.
Чем чище металл, тем большее переохлаждение требуется для возникновения зародышей твердых кристаллов.
Рис. 2.13. Схема процесса кристаллизации: а—е — этапы кристаллизации
Необходимая для кристаллизации степень переохлаждения зависит от природы и чистоты металла. Чем чище металл, тем большее переохлаждение требуется для возникновения зародышей твердых кристаллов.
Схематически процесс кристаллизации показан на рис. 2.13. В начале во многих участках жидкого сплава образуются центры кристаллизации (зародыши кристаллов). Пока их окружает жид-кость, кристаллы растут свободно и могут иметь правильную геометрическую форму. Однако при столкновении растущих кристаллов их правильная форма нарушается, так как на участках контактов (границах) их рост прекращается. Кристалл растет лишь в том направлении, где он соприкасается с жидкостью. В результате после окончательного затвердевания кристаллы имеют несимметричную (неправильную) форму.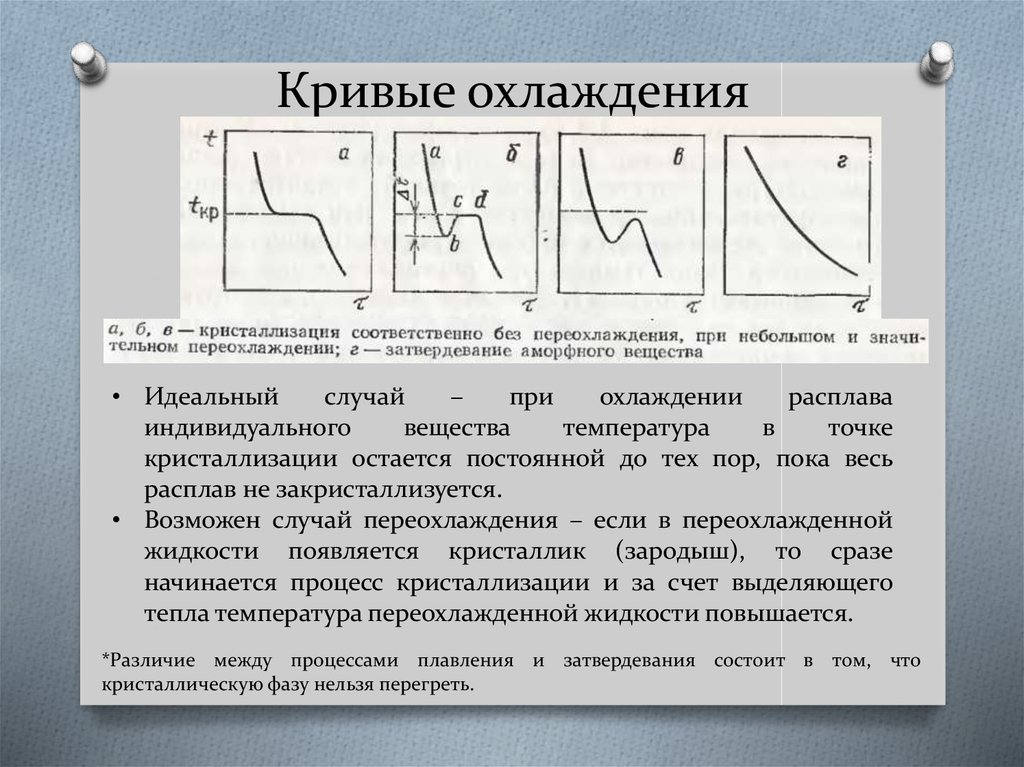 Их называют зернами или кристаллитами.
Их называют зернами или кристаллитами.
Скорость процесса кристаллизации определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов.
Под скоростью зарождения центров кристаллизации понимают число зародышей, возникающих за единицу времени в единице объема. Под скоростью роста кристаллов понимают скорость увеличения линейных размеров кристалла за единицу времени.
Рис. 2.14. Зависимость скорости зарождения центров кристаллизации (ЧЦ) и скорости роста кристаллов (СК) от степени переохлаждения: Ts — равновесная температура
Число центров (ЧЦ) кристаллизации и скорость роста кристаллов(СК) зависят от степени переохлаждения. При равновесной температуре кристаллизации Ts число зародышей и скорость их роста равны нулю (рис. 2.14), поэтому затвердевания не происходит. При увеличении степени переохлаждения эти параметры возрастают и достигают максимума, но при разных степенях переохлаждения.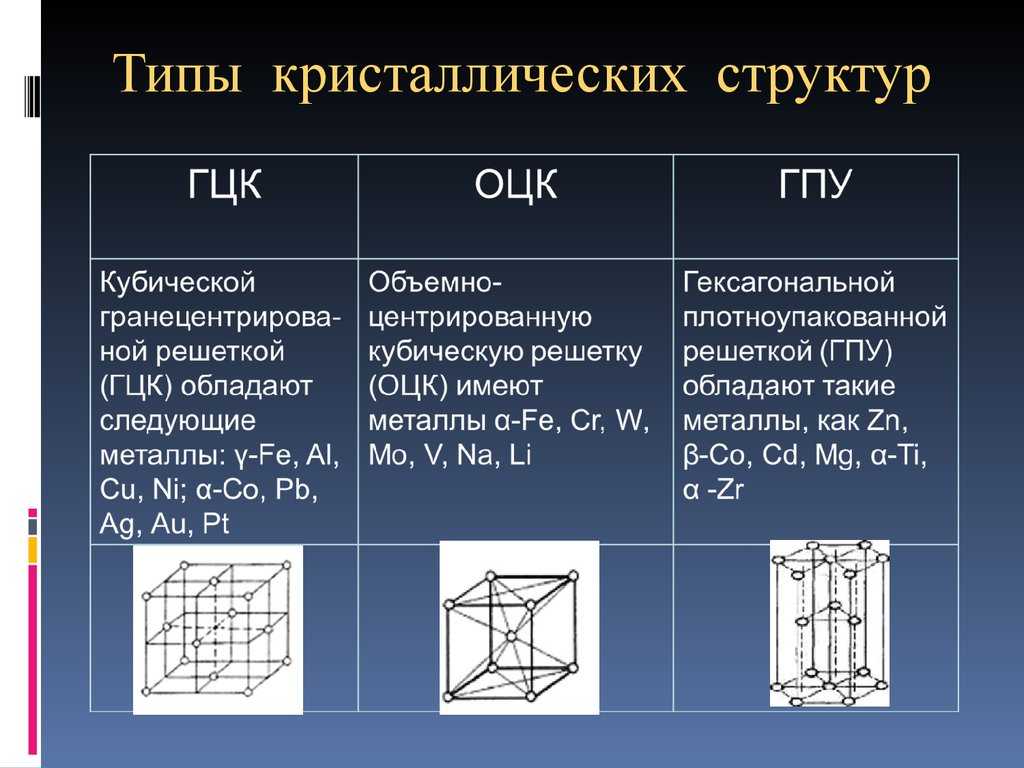 При небольшой степени переохлаждения Д71, (см. рис. 2.14) число зародышей мало, а скорость велика. В этих условиях будет получено крупное зерно. С увеличением степени переохлаждения — при & Т2 и АТ2 — число зародышей возрастает в большей мере, чем скорость их роста, и размер зерна в металле уменьшается.
При небольшой степени переохлаждения Д71, (см. рис. 2.14) число зародышей мало, а скорость велика. В этих условиях будет получено крупное зерно. С увеличением степени переохлаждения — при & Т2 и АТ2 — число зародышей возрастает в большей мере, чем скорость их роста, и размер зерна в металле уменьшается.
При весьма больших степенях переохлаждения Д ТА число центров кристаллизации и скорость роста равны нулю, так как при низких температурах диффузионная подвижность атомов очень низкая и кристаллизация не происходит. В результате после затвердевания получается аморфная структура без упорядоченного расположения атомов. В металлах это достигается лишь при очень высоких скоростях охлаждения (см. подразд. 8.9), тогда как в стеклах (см. подразд. 12.2.2) такое строение получается при обычных скоростях охлаждения.
Таким образом, скорость охлаждения определяет величину зерна: чем она выше, тем мельче зерно металла. Металл, имеющий мелкозернистое строение, обладает не только более высокой прочностью, но также и большей ударной вязкостью и пластичностью.
Охлаждение с высокой скоростью для получения мелкого зерна невозможно для отливок большой массы. В этом случае в жидкий металл вводят тугоплавкие частицы (оксиды и др.), которые являются искусственными центрами кристаллизации и называются модификаторами, а сам процесс — модифицированием. Модифицирование, практически без изменения состава металла, обеспечивает при кристаллизации получение мелкого зерна.
Попередня
Наступна
Затвердевание металлических материалов. Термические кривые охлаждения при кристаллизации металлов.
Оглавление:
- Упрочнение металлических материалов. Кривые охлаждения при кристаллизации металлов. Кристаллизация представляет собой переход из жидкого состояния в твердое с образованием кристаллической решетки или crystal.
In в реальном металлическом теле кристаллизация расплава заканчивается образованием сложной переплетенной структуры кристаллов-дендритов. Их форма определяет свойства материала. При образовании кристаллов их развитие протекает преимущественно в направлении, перпендикулярном плоскости при максимальной плотности заполнения атома.
Их форма определяет свойства материала. При образовании кристаллов их развитие протекает преимущественно в направлении, перпендикулярном плоскости при максимальной плотности заполнения атома.
Это приводит к тому, что сначала образуется длинная ветвь, так называемая первичная ось.
Людмила Фирмаль
В то же время, как расширение 1-й оси, та же 2-я ветвь перпендикулярно им возникает и растет на edge. In поверните, 3-я ось растет в них. Образуются дендритные древовидные кристаллы. Основной рост кристаллов происходит в направлении рассеивания тепла. Дендритные ветви разделены небольшими полостями и порами за счет очень тонкого слоя примесей, нерастворимых в жидкости, особенно твердой, и уменьшения объема при переходе металла из жидкого состояния в твердое.
С tmetelt определенным для каждого металла, твердый металл поворачивает в a liquid. At в то же время, многие свойства меняются незначительно. Например, плотность уменьшается на 5-7%, увеличивается электрическая и теплопроводность. Природа внутренних сил не меняется. Металлическая жидкость-это структура, близкая к твердому телу. Кристаллическая решетка поддерживается до момента ее плавления. После плавления, решетка разрушается, но динамический ближний порядок сохраняется. Отверждение происходит при температуре tzatv и меньше tpl.
Природа внутренних сил не меняется. Металлическая жидкость-это структура, близкая к твердому телу. Кристаллическая решетка поддерживается до момента ее плавления. После плавления, решетка разрушается, но динамический ближний порядок сохраняется. Отверждение происходит при температуре tzatv и меньше tpl.
- Происходит переохлаждение и перегрев фигуры. 6. Рисунок 6.Рисунок 7.Рисунок 8 Рисунок 6.Изменение свободной энергии F металла в жидком (f g) и твердом состоянии (F t) в зависимости от температуры T. Рисунок 7.Кривая охлаждения получена при кристаллизации металлов. Рисунок 8.Обсуждается зависимость скорости образования Центра n и скорости роста кристаллов C от переохлаждения. 9. При температуре Tn свободная энергия жидкого и твердого состояний равна. Процесс кристаллизации протекает при температурах ниже Tp. To для начала затвердевания необходимо переохлаждение (разность энергий).
Чем выше степень переохлаждения, тем больше скорость изменения температуры рис. 7.. В 1878 году русский ученый-металлург Д. Чернов установил, что процесс кристаллизации состоит из 2 основных процессов. Нуклеация центров (скорость-N-1 * см-3) и рост кристаллов (скорость-C см сек-1). установлено, что N и C зависят от переохлаждения. 8.Это определяет степень детализации: 3/4 N = a (C / n) (3) N-степень детализации. Коэффициент » а » равен почти 1. В самом деле, кривые N и C расположены друг относительно друга так, что
7.. В 1878 году русский ученый-металлург Д. Чернов установил, что процесс кристаллизации состоит из 2 основных процессов. Нуклеация центров (скорость-N-1 * см-3) и рост кристаллов (скорость-C см сек-1). установлено, что N и C зависят от переохлаждения. 8.Это определяет степень детализации: 3/4 N = a (C / n) (3) N-степень детализации. Коэффициент » а » равен почти 1. В самом деле, кривые N и C расположены друг относительно друга так, что
чем больше переохлаждение, тем мельче кристаллы, тем больше скорость охлаждения, тем мельче кристаллы.
Людмила Фирмаль
Падающие ветви кривой экспериментально не наблюдаются, поэтому их рисуют пунктирной линией. Критический размер ядра первичного Кристалла определяется следующим уравнением. Rk =(4×) / fÅ(4) Где η-поверхностное натяжение. fÅ-это разность между объемной свободной энергией жидких и твердых металлов. Примечание: F. 4.Эффективная при малых значениях nucle нуклеация требует энергии, равной 3 мин 1 от ее поверхностной энергии. Уменьшение объема свободной энергии при миграции атомов в кристаллическое тело является недостаточным для зарождения. Нуклеации способствует неравномерное распределение энергии между атомами, то есть колебания.
Уменьшение объема свободной энергии при миграции атомов в кристаллическое тело является недостаточным для зарождения. Нуклеации способствует неравномерное распределение энергии между атомами, то есть колебания.
При температурах, близких к ТМ, размер критического ядра очень велик, и вероятность его образования должна быть small. As степень переохлаждения возрастает, fÅ увеличивается(см. рис. 6), а поверхностное натяжение на границах фаз существенно не изменяется. Чем больше¤, тем меньше Rk. Если степень переохлаждения низкая (скорость охлаждения медленная), то количество ядер будет небольшим. В этих условиях крупные зерна являются obtained. As степень переохлаждения увеличивается, процент нуклеации увеличивается, а размер частиц затвердевшего металла уменьшается.
Размер частиц влияет на свойства, особенно вязкость. Вязкость значительно выше для металлов с мелкими частицами. Примените правило фазы. Чаще всего в технологии используются металлические материалы-сплавы. Сплав-это вещество, полученное сплавлением нескольких (2 или более) элементов, которые в основном являются металлами. Структура сплава более сложная, чем у чистых металлов. В сплавах могут наблюдаться зерна чистых металлов и других компонентов Твердые растворы и соединения.
Структура сплава более сложная, чем у чистых металлов. В сплавах могут наблюдаться зерна чистых металлов и других компонентов Твердые растворы и соединения.
Твердым раствором называют сплав, в котором ионы растворенных элементов находятся в кристаллической решетке растворителя. Твердый раствор классифицируется на 3 типа твердых растворов на основе замещения, включения, вычитания или соединения. Есть также заказанные твердые растворы. 10. Совокупность всех сплавов, которые могут состоять из данного компонента, называется системой сплавов. Фазы представляют собой однородные части системы с одинаковым составом, одинаковым агрегатным состоянием и отделены от других частей системы поверхностью раздела. Фаза может быть газом, жидкостью или твердым веществом. В сплаве может быть несколько фаз.
Вещества, входящие в состав системы, называются компонентами. Число степеней свободы системы (изменчивость) — это число внешних и внутренних факторов (t, P и концентрация C%), которые могут изменяться без изменения числа фаз в системе. system. It определяется по правилам фазы. ф = п-к + 2(5) Где f-число степеней свободы. n — количество компонентов. K — количество фаз. Если давление не учитывается: f = n-K + 1 для того, чтобы рассчитать количество фаз в определенном термодинамическом состоянии, правило фазы применяется для анализа процессов, происходящих в сплавах при нагреве и охлаждении. Рисунок 9.Рисунок для применения правил фазы. Факторы, влияющие на процесс кристаллизации. Риформинг жидкого металла. Кристаллизация происходит с образованием теплового эффекта.
system. It определяется по правилам фазы. ф = п-к + 2(5) Где f-число степеней свободы. n — количество компонентов. K — количество фаз. Если давление не учитывается: f = n-K + 1 для того, чтобы рассчитать количество фаз в определенном термодинамическом состоянии, правило фазы применяется для анализа процессов, происходящих в сплавах при нагреве и охлаждении. Рисунок 9.Рисунок для применения правил фазы. Факторы, влияющие на процесс кристаллизации. Риформинг жидкого металла. Кристаллизация происходит с образованием теплового эффекта.
Степень детализации зависит от его размера. РК = [4 ** * ТС / М] /¤(6) Где Q-тепловой эффект затвердевания на единицу объема. Ts-температура затвердевания. Эта формула применима к равномерной кристаллизации. Теоретическое число центров кристаллизации значительно меньше, чем число реально образованных ядер. Это связано с наличием примесей в расплаве. Неравномерная кристаллизация происходит с примесями. Схема кристаллизации примесей показана на рисунке. 10. Рисунок 10.Схема кристаллизации примесей. Рисунок b1-поверхностное натяжение примесей. b2-поверхностное натяжение закаленных металлов. b3-поверхностное натяжение расплавленного металла. 11. Рост кристаллов происходит за счет послойного прикрепления атомов к ядру.
10. Рисунок 10.Схема кристаллизации примесей. Рисунок b1-поверхностное натяжение примесей. b2-поверхностное натяжение закаленных металлов. b3-поверхностное натяжение расплавленного металла. 11. Рост кристаллов происходит за счет послойного прикрепления атомов к ядру.
Обычно b1 больше b2, а-b1 + b2 меньше нуля, то есть с точки зрения энергии процесса кристаллизация примесей более благоприятна, чем самопроизвольная crystallization. In реальный процесс, примеси являются основными центрами кристаллизации. При перегреве расплавленного металла часть примесей растворяется, а другая часть дезактивируется. Количество центров и размер частиц могут быть изменены 4 способами.- Изменить скорость охлаждения и тем самым изменить величину переохлаждения. — Увеличение или уменьшение перегрева металла перед разливкой. — Ввести в жидкий металл мельчайшие нерастворимые примеси. — Уменьшает активные растворимые примеси, добавляя их к поверхностному натяжению.
Последние 2 способа выполняются в момент изменения, соответственно, гетерогенного и гомогенного.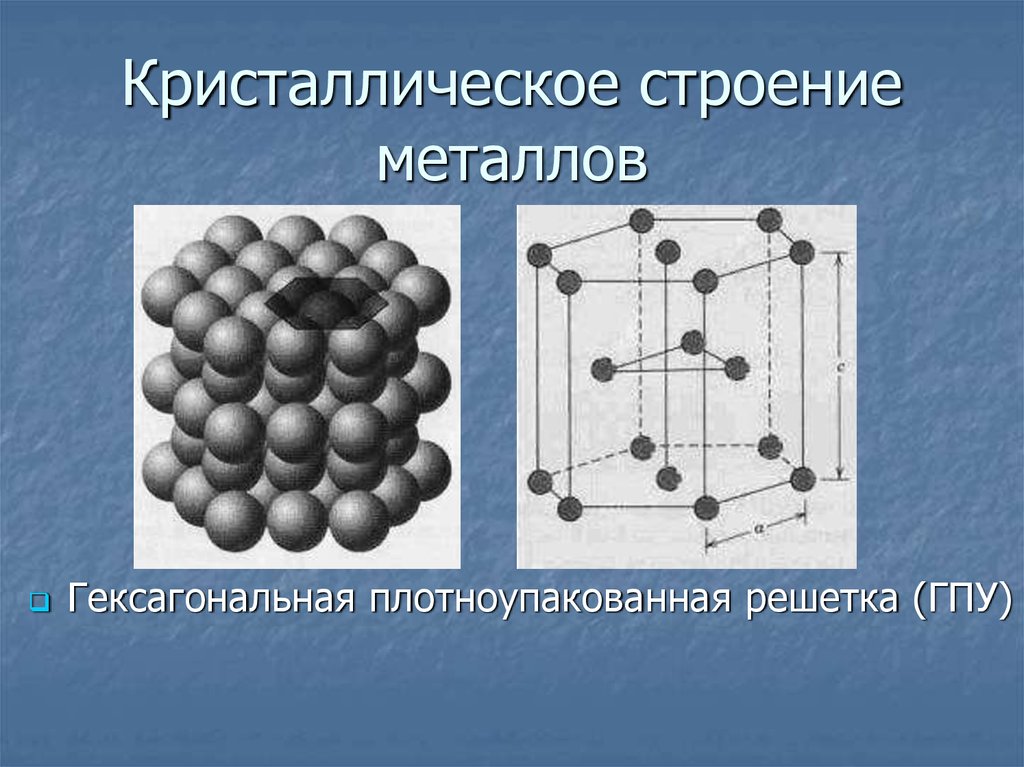 Изменения вносятся путем введения специальных добавок, образующих тугоплавкие соединения (карбиды, нитриды, оксиды). Процесс кристаллизации начинается со стенок пены и играет ту же роль, что и нерастворимые примеси. На поверхности слитка образуется слой мелких кристаллов, который трудно обрабатывать, но это снимается в Металлургическом процессе(lab. Work. No. см. 1). Аморфный материал и его применение. К аморфным материалам относятся стекла, изготовленные из неорганических веществ, металлов и многих пластмасс.
Изменения вносятся путем введения специальных добавок, образующих тугоплавкие соединения (карбиды, нитриды, оксиды). Процесс кристаллизации начинается со стенок пены и играет ту же роль, что и нерастворимые примеси. На поверхности слитка образуется слой мелких кристаллов, который трудно обрабатывать, но это снимается в Металлургическом процессе(lab. Work. No. см. 1). Аморфный материал и его применение. К аморфным материалам относятся стекла, изготовленные из неорганических веществ, металлов и многих пластмасс.
Аморфное состояние характеризуется отсутствием дальнего порядка в расположении атомов упаковки. Самое большое применение неорганического стекла. Основной химический состав конструкционного стекла: добавление диоксида кремния и алюминия, безводного бора, фосфора и диоксида металла-титана, ванадия и циркония. Среди материалов производства машины, безосколочное стекло, огнеупорное стекло, теплостойкое стекло и закаленное стекло наиболее широко used. In в отличие от других материалов, неорганическое стекло, полученное затвердеванием минеральных расплавов в результате непрерывного повышения вязкости, имеет макроскопическую изотропную аморфную структуру, в некоторой степени прозрачную и обладает механическими свойствами твердого тела.
Тонкое исследование структуры стекла показывает микро-однородную структуру стекла. Стекло не имеет определенной температуры плавления, по сравнению с кристаллическими веществами. При нагревании он постепенно становится мягким и переходит из твердого хрупкого состояния в очень вязкое, а затем в жидкое состояние(расплавленное стекло).При падении температуры вязкость стекла непрерывно возрастает, что приводит к обратному переходу в хрупкое твердое состояние. Рисунок 11.Температурная зависимость свойств стекла.
В диапазоне температур Tg-Tf характеристики стекла изменяются шаг за шагом. Стекло термодинамически новое. Устойчивая система. В ТГ стекло легко кристаллизуется. Химический состав стекла металла составлен элементов металла и аморфизируя агентов, используемых как бор, углерод, кремний, азот и другое В12 До 30%.Аморфное состояние металла достигается сверхбыстрым охлаждением из газообразного, жидкого или ионизированного состояния. Основным методом получения МС является закалка из жидкого состояния и фиксация структуры расплава.
Отличительной особенностью МС является сочетание высокой эластичности и высокой твердости и прочности. Например, обычное стекло обладает очень высокой твердостью и относительно низкой прочностью. MS можно проштемпелевать, отрезать и свернуть. Аморфное состояние МС метастабильно. (0,4–0,65) при температуре отжига выше Tm материал кристаллизуется. В большинстве случаев пластик представляет собой аморфное тело. Как и у неорганического стекла, также происходит изменение характеристик из-за температуры(рис.11). Есть 3 разных аморфных состояниях-стеклообразном, высокоэластическом, вязкая.2. температура, при которой свойства пластика резко меняются.
Tc-температура стеклования, а температура выше температуры вязкого жидкого состояния — TT. Пластичная масса кристаллизуется в процессе длительного отжига и деформационных процессов по механизму ориентации полимерной цепи или звена в одной плоскости или направлении. Аморфные материалы являются перспективными конструкционными материалами. МС используется при изготовлении пружин. Стекло-для изделий с оптическими свойствами. Пластик как конструкционный материал. Применение аморфных материалов в первую очередь ограничено их узким рабочим диапазоном и низкой температурой.
МС используется при изготовлении пружин. Стекло-для изделий с оптическими свойствами. Пластик как конструкционный материал. Применение аморфных материалов в первую очередь ограничено их узким рабочим диапазоном и низкой температурой.
Полиморф металла. В зависимости от температуры, металлы и сплавы могут сосуществовать в различных кристаллических формах или в различных modifications. In полиморфные превращения, одна кристаллическая решетка сменяется другой. Полиморфные превращения происходят тогда, когда при определенной температуре могут существовать металлы с различными кристаллическими решетками и низким уровнем свободной энергии. Рисунок показан на фиг. 図12は 、 純 純のとと金属の多形変態を示す。фигура Рисунок 12.Чистая кривая охлаждения металла (утюга). Полиморфная трансформация — это процесс кристаллизации, который осуществляется путем образования ядер и их последующего роста. Эмбриогенез следует принципу структурного и размерного соответствия.
Зерна новой фазы вырастают за границу фазы Майо за счет неупорядоченных и не связанных между собой переходов отдельных атомов (групп атомов), в результате чего границы нового зерна смещаются в сторону исходного зерна и поглощают его. Зародыш новой фазы происходит вдоль границ старого зерна или в зонах с повышенным уровнем свободной энергии. 13. Вновь образованные кристаллы ориентированы естественно относительно первого модифицированного crystals. As в результате полиморфных превращений образуются новые частицы, которые отличаются по размеру и форме. Происходит резкое изменение свойств материала. Полиморфное превращение также называют перекристаллизацией.
Зародыш новой фазы происходит вдоль границ старого зерна или в зонах с повышенным уровнем свободной энергии. 13. Вновь образованные кристаллы ориентированы естественно относительно первого модифицированного crystals. As в результате полиморфных превращений образуются новые частицы, которые отличаются по размеру и форме. Происходит резкое изменение свойств материала. Полиморфное превращение также называют перекристаллизацией.
Если металл нагреть до температуры, несколько превышающей температуру полиморфного превращения (критическая точка), то получаются очень мелкие зерна. Это явление используется в практике термической обработки металлов. Жидкокристаллический. Жидкокристаллическое состояние представляет собой термодинамически стабильное агрегатное состояние, в котором материал сохраняет анизотропию физических свойств, присущих твердым кристаллам и свойствам течения жидкости.
Существует ряд преимущественно органических соединений с такими сложными свойствами. Например, производные ароматических эфиров-трансциклогексан, фенилбензоат; азот-Метин; АЗОСОЕДИНЕНИЯ и др. Жидкий кристалл имеет такое же преобразование элемента, которое не изменяет жидкое состояние. Трансформация наблюдается при воздействии электромагнитных полей, изменении температуры и давления, а также других физических воздействий. Их свойства изменяются поэтапно, а также в твердых телах. Жидкие кристаллы используются в качестве оптоэлектронных индикаторов и материалов композитных стеклянных структур, которые требуют резкого изменения оптических свойств системы под воздействием внешней среды.
Жидкий кристалл имеет такое же преобразование элемента, которое не изменяет жидкое состояние. Трансформация наблюдается при воздействии электромагнитных полей, изменении температуры и давления, а также других физических воздействий. Их свойства изменяются поэтапно, а также в твердых телах. Жидкие кристаллы используются в качестве оптоэлектронных индикаторов и материалов композитных стеклянных структур, которые требуют резкого изменения оптических свойств системы под воздействием внешней среды.
Жидкокристаллическое состояние и его уникальные свойства обусловлены способностью одних органических молекул агрегироваться с другими, создавая частично упорядоченную структуру и sensing. In в практическом смысле особое место занимает нематический Жидкий Кристалл. Нематические жидкие кристаллы отличаются от других типов жидких кристаллов одноосным расположением, в котором молекулы расположены так, что их длинные оси параллельны друг другу.
Смотрите также:
Решения задач по материаловедению
Затвердевание и кристаллизация металлов и сплавов
Выбранный тип:
Твердый переплет
Количество:
Печать по требованию
$156,00
Хассе Фредрикссон,
Улла Окерлинд
ISBN: 978-1-119-99305-6
август 2012 г.
832 страницы
Электронная книга
От 125,00 долларов США
Печать
От 156,00 долларов США
О-бук
Электронная книга
com are delivered on the VitalSource platform. To download and read them, users must install the VitalSource Bookshelf Software.</li><li>E-books have DRM protection on them, which means only the person who purchases and downloads the e-book can access it.</li><li>E-books are non-returnable and non-refundable.</li><li>To learn more about our e-books, please refer to our <a href="https://www.wiley.com/wiley-ebooks" target="_blank">FAQ</a>.</li></ul>» data-original-title=»» title=»»/>
125,00 $
Твердый переплет
156,00 $
O-Book
</p>» data-original-title=»» title=»»/>
Загрузить рекламный проспект
Загрузить рекламный проспект
Загрузить флаер продукта для загрузки PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Загрузить флаер продукта — загрузить PDF в новой вкладке. Это фиктивное описание.
Описание
Процесс затвердевания и кристаллизации металлов и сплавов
Hasse Fredriksson KTH, Королевский технологический институт, Стокгольм, Швеция из неупорядоченного жидкого состояния в более упорядоченное твердое состояние, что имеет основополагающее значение для обработки металлов. Задуманный как дополнение к более ранним работам, Обработка материалов при литье (2006 г.) и Физика функциональных материалов (2008 г.), в этой книге подробно анализируются процессы затвердевания и кристаллизации.
Задуманный как дополнение к более ранним работам, Обработка материалов при литье (2006 г.) и Физика функциональных материалов (2008 г.), в этой книге подробно анализируются процессы затвердевания и кристаллизации.
Начиная с термодинамической точки зрения, он дает полное описание с учетом кинетики и массопереноса вплоть до окончательной структуры. Важно отметить, что в книге показана связь между теорией и экспериментальными результатами. Рассматриваемые темы включают:
- Основы термодинамики
- Свойства интерфейсов
- зародышеобразования
- Рост кристаллов — в паре, жидкости и расплаво Обработка затвердевания и кристаллизации в металлах и сплавах содержит множество решенных примеров в тексте и упражнения (с ответами) для учащихся. Предназначенный для магистров и аспирантов, а также исследователей в области материаловедения, машиностроения, химии и металлургии, он также является ценным ресурсом для инженеров в промышленности.

Связанные ресурсы
Об авторе
Hasse Fredriksson , KTH, Швеция.
Улла Окерлинд , Стокгольмский университет, Швеция.
Разрешения
Запросить разрешение на повторное использование контента с этого сайта
Содержание
Предисловие
Глава 1 Термодинамические понятия и взаимосвязи
1.1 Введение
1.2 Термодинамические понятия и отношения
1.3 Термодинамика однокомпонентных систем
1.4. Термодинамика многокомпонентных систем. и сплавы
2.1 Введение
2.2 Термодинамика чистых металлов
2.3 Термодинамика бинарных сплавов
2. 4 Равновесие между фазами в бинарных растворах. Фазовые диаграммы бинарных сплавов
4 Равновесие между фазами в бинарных растворах. Фазовые диаграммы бинарных сплавов
2.5 Движущая сила затвердевания в бинарных сплавах
2.6 Термодинамика тройных сплавов
2.7 Термодинамика вакансий в чистых металлах и сплавах
Резюме
Упражнения
Ссылки
3.2 Классическая теория энергетики и поверхностного натяжения границы
3.3 Термодинамика интерфейсов
3.4 Структуры интерфейсов
3,5 равновесные формы кристаллов
РЕЗЮМЕ
Упражнения
СсылкиГЛАВНА 40120 4.1. ВВЕДЕНИЕ
40002 ГЛАВА 4. . Инокуляция
4.4 Зарождение пузырьков
4.5 Размножение кристаллов
Резюме
Упражнения
СсылкиГлава 5 Рост кристаллов в парах
5.1 Введение
5.2 Морфология кристаллов
5.3 Химическое осаждение из паровой фазы
5.4 Рост кристаллов
5.5 Нормальный рост кристаллов с шероховатыми поверхностями в парах
Рост кристаллов в парах
5.8 Эпитаксиальный рост
5. 9 Рост нитевидных кристаллов
9 Рост нитевидных кристаллов
5.10 Механические ограничения для тонких пленок
Резюме
Упражнения
СсылкиГлава 6 Рост кристаллов в жидкостях и расплавах
6.1 Введение
6.2 Структуры кристаллов и расплавов
6.3 Методы роста
6.4 Рост кристаллов
6.5 Изменение объема и релаксационные процессы при неупругом росте кристаллов в металлических расплавах
6.6 Нормальный рост кристаллов в чистых Расплавы металлов
6.7 Рост слоевых кристаллов с гладкими поверхностями в жидкостях
6.8 Рост нормальных кристаллов в бинарных сплавах
6.9 Контролируемый диффузией рост плоских кристаллов в бинарных сплавах
6.10 Диффузионный контролируемый рост сферических кристаллов в сплавах
6.11. Упражнения
6.12 Осаждение пор
РЕЗЮМЕ
Упражнения
СсылкиГЛАВА 7 Транспорт тепла во время процессов затвердевания. Термальный анализ
7.1. Введение
7.2 Основная концепция.
7. 3 Конвекция
3 Конвекция
7.4 Теория переноса тепла при однонаправленном затвердевании
7.5 Получение монокристаллов однонаправленным затвердеванием
7.6 Термический анализ
7.7 Переменная теплота плавления металлов и сплавов
7.8 Переменная теплоемкость металлов и сплавов
Резюме
Упражнения
СсылкиМассопереносы в сплавах при однонаправленном затвердевании
8.3 Зонное рафинирование
8.4 Получение монокристаллов методом Чохральского
8.5 Рост клеток. Конституциональное переохлаждение. Стабильность интерфейса 9
Резюме
Упражнения
СсылкиГлава 9 Ограненные и дендритные структуры кристаллизации
9.1 Введение
9.2 Формирование ограненных кристаллов
9.3 Рост ограненных кристаллов в расплавах чистых металлов
Кристаллы
9.6 Развитие дендритов
9.7 Переходы между типами структуры в сплавах
Резюме
Упражнения
СсылкиГлава 10 Эвтектические структуры затвердевания
10. 1 Введение
1 Введение
10.2 Классификация эвтектических структур
10.3 Нормальный эвтектический рост
10,4 дегенерат и связанный эвтектический рост
10,5 Структуры тройного сплава
10.6. и стержневые эвтектические наросты
Резюме
Упражнения
СсылкиГлава 11 Перитектические структуры затвердевания
11.1 Введение
11.2 Перитектические реакции и превращения
11.3 Перитектические реакции и превращения в сплавах на основе железа
11.4 Метастабильные реакции в сплавах на основе железа
11.5 Метатектические реакции и превращения
11.6 Микросегрегация в пертектических реакциях в сплавах на основе железа и эвтектических сплавах - 0 Сплавы на основе железа
Резюме
Упражнения
СсылкиГлава 12 Металлические стекла и расплавы аморфных сплавов
12.1 Введение
12.1 История и развитие аморфных сплавов
12.2 Основные понятия и определения
12.3 Производство металлических стекол
12. 4 Экспериментальные методы определения структуры металлических стекол и расплавов аморфных сплавов
4 Экспериментальные методы определения структуры металлических стекол и расплавов аморфных сплавов
12.5 Структура металлических стекол
12.6 Сравнение структур металлических стекол и расплавов Расплавы аморфных сплавов.
Грубая модель расплавов металлических стекол и аморфных сплавов
12.7 Литье металлических стекол. Процессы кристаллизации в расплавах аморфных сплавов
12.8 Классификация металлических стекол
12.9 Свойства и применение металлических стекол
Резюме
Упражнения
СсылкиОтветы на упражнения
Алфавитный указатель
кристалл | Определение, типы, структура и факты
кристалл
Посмотреть все средства массовой информации
- Ключевые люди:
- Николаус Стено
Ральф Уолтер Грейстоун Вайкофф
Макс фон Лауэ
Жорж Фридель
Торберн Улоф Бергман
- Похожие темы:
- жидкокристаллический
плеохроизм
двойное преломление
симметрия
полиморфизм
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
Узнайте, как форма кристаллов определяет различные минералы в семейства
Посмотреть все видео к этой статье
кристалл , любой твердый материал, в котором атомы компонентов расположены определенным образом и регулярность поверхности которого отражает его внутреннюю симметрию.

Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако после проверки определение становится менее простым. Кусочек сливочного масла, например, после хранения в холодильнике становится твердым и явно твердым. Пролежав сутки на кухонном столе, тот же кубик становится довольно мягким, и неясно, следует ли по-прежнему считать масло твердым. Многие кристаллы ведут себя как масло в том смысле, что они тверды при низких температурах, но мягки при более высоких температурах. Они называются твердыми при всех температурах ниже их точки плавления. Возможное определение твердого тела — это объект, который сохраняет свою форму, если его не трогать. Актуальным вопросом является то, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет свою форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы измерения твердых тел
Основными единицами твердых тел являются либо атомы, либо атомы, объединившиеся в молекулы.
 Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.Все занятые оболочки атома аргона (Ar), например, заполнены, что приводит к сферической форме атома. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена лишь частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо является магнитом. Ковалентная связь между двумя атомами углерода (C) является самой прочной связью в природе.
 Эта сильная связь делает алмаз самым твердым телом.
Эта сильная связь делает алмаз самым твердым телом.Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Твердое тело называется кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, место каждого атома точно известно во всем кристалле. У большинства жидкостей отсутствует дальний порядок, хотя у многих есть ближний порядок. Ближний радиус определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях первые соседние атомы расположены так же, как и в соответствующей твердой фазе. Однако на расстояниях, которые составляют много атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти специальные вещества называются жидкими кристаллами.
 Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые кристаллы имеют как ближний, так и дальний порядок.Твердые тела, имеющие ближний порядок, но не имеющие дальнего порядка, называются аморфными. Почти любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние). Это условие нестабильно, и твердое тело со временем кристаллизуется. Если время кристаллизации исчисляется годами, то аморфное состояние оказывается стабильным. Стекла являются примером аморфных твердых тел. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) существует тот же ближний порядок, но направления связей меняются на более удаленных от любого атома расстояниях. Аморфный кремний — это разновидность стекла. Квазикристаллы — еще один тип твердых тел, в которых отсутствует дальний порядок.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчасБольшинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла.
 На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и твердые молекулярные вещества.
 Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно.
Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно.Аномальная корреляция между фазовым превращением и скоростью охлаждения для чистых металлов
Abstract
Целью данной работы является глубокое понимание явления фазового превращения при быстром охлаждении в металлических системах и раскрытие физического смысла разброса времени достижения кристаллизация.
 Общее количество чистых металлов, рассматриваемых в данной работе, составляет 14. На примере чистой меди корреляция между фазовым отбором кристалла или стекла и скоростью охлаждения была исследована с помощью молекулярно-динамического моделирования. Полученные результаты показывают, что существует область скоростей охлаждения 6,3 × 10 11 –16,6 × 10 11 К/с, в которой кристаллические фракции сильно колеблются вместе со скоростями охлаждения. Превращение стекла в этой области скоростей охлаждения определяется флуктуациями атомной структуры, которая контролируется термодинамическими факторами. В соответствии с особенностью порядка ориентации связей при различных скоростях охлаждения мы предлагаем два механизма стеклообразования: (i) кинетическое замедление перестройки атомов или структурная релаксация при высокой скорости охлаждения; и (ii) конкуренция икосаэдрического порядка с кристаллическим порядком вблизи критической скорости охлаждения.
Общее количество чистых металлов, рассматриваемых в данной работе, составляет 14. На примере чистой меди корреляция между фазовым отбором кристалла или стекла и скоростью охлаждения была исследована с помощью молекулярно-динамического моделирования. Полученные результаты показывают, что существует область скоростей охлаждения 6,3 × 10 11 –16,6 × 10 11 К/с, в которой кристаллические фракции сильно колеблются вместе со скоростями охлаждения. Превращение стекла в этой области скоростей охлаждения определяется флуктуациями атомной структуры, которая контролируется термодинамическими факторами. В соответствии с особенностью порядка ориентации связей при различных скоростях охлаждения мы предлагаем два механизма стеклообразования: (i) кинетическое замедление перестройки атомов или структурная релаксация при высокой скорости охлаждения; и (ii) конкуренция икосаэдрического порядка с кристаллическим порядком вблизи критической скорости охлаждения.Введение
Металлические стекла (МС) являются одним из наиболее интенсивно изучаемых передовых материалов из-за их научной значимости и потенциальных технических применений 1 .
 Большинство МС изготавливают из расплавленных жидкостей при охлаждении, избегая зародышеобразования и роста кристаллических фаз. Поскольку металлические жидкости имеют сильную склонность к кристаллизации при охлаждении ниже температуры ликвидуса, МГ термодинамически метастабильны. Таким образом, образование МГ и его конкуренция с кристаллизацией вызвали значительный интерес. Когда металлические жидкости затвердевают при высоких скоростях охлаждения, можно подавить зародышеобразование, в результате чего образуются металлические стекла с аморфной структурой. При таких условиях жидкая структура с ближним порядком остается в твердом аморфном состоянии без дальнего трансляционного порядка. Большинству сплавов требуется критическая скорость охлаждения около 10 6 К/с для образования аморфной структуры 1,2,3 , в то время как для чистых металлов требуются критические скорости охлаждения до 10 12 К/с. В принципе, критическую скорость охлаждения для формирования стекла для данной системы можно оценить по положению «носа» на диаграмме время-температура-превращение (ТТТ) 4 .
Большинство МС изготавливают из расплавленных жидкостей при охлаждении, избегая зародышеобразования и роста кристаллических фаз. Поскольку металлические жидкости имеют сильную склонность к кристаллизации при охлаждении ниже температуры ликвидуса, МГ термодинамически метастабильны. Таким образом, образование МГ и его конкуренция с кристаллизацией вызвали значительный интерес. Когда металлические жидкости затвердевают при высоких скоростях охлаждения, можно подавить зародышеобразование, в результате чего образуются металлические стекла с аморфной структурой. При таких условиях жидкая структура с ближним порядком остается в твердом аморфном состоянии без дальнего трансляционного порядка. Большинству сплавов требуется критическая скорость охлаждения около 10 6 К/с для образования аморфной структуры 1,2,3 , в то время как для чистых металлов требуются критические скорости охлаждения до 10 12 К/с. В принципе, критическую скорость охлаждения для формирования стекла для данной системы можно оценить по положению «носа» на диаграмме время-температура-превращение (ТТТ) 4 . Широко распространено мнение, что при скорости охлаждения выше критической любую жидкость можно превратить в аморфное твердое тело. Таким образом, превращение стекла рассматривается как процесс, при котором кристаллизация кинетически замедляется в течение определенного периода времени. В этом смысле металлическая жидкость, закаленная при более высокой скорости охлаждения, может сохранять более случайную структуру, чем закаленная при более низкой скорости охлаждения, как указывает теория нестационарного зародышеобразования 9.0364 5,6 .
Широко распространено мнение, что при скорости охлаждения выше критической любую жидкость можно превратить в аморфное твердое тело. Таким образом, превращение стекла рассматривается как процесс, при котором кристаллизация кинетически замедляется в течение определенного периода времени. В этом смысле металлическая жидкость, закаленная при более высокой скорости охлаждения, может сохранять более случайную структуру, чем закаленная при более низкой скорости охлаждения, как указывает теория нестационарного зародышеобразования 9.0364 5,6 .В отличие от кристаллического аналога, в конфигурационном пространстве которого преобладает уникальный минимум свободной энергии, соответствующий идеально упорядоченной структуре, стекло может принимать большое количество эквивалентно неупорядоченных, несовершенных структур 7 . Это следствие является следствием тепловых флуктуаций, наряду со структурными флуктуациями, происходящих в переохлажденной жидкости при охлаждении. В рамках случайного перехода первого рода (RFOT) 8 динамика переохлажденной жидкости связана с переходами между аморфными минимумами свободной энергии, разделенными соответствующими барьерами.
 Было указано, что замедление динамики при понижении температуры вызвано тем, что доступно меньше конфигураций, а кинетические пути между ними становятся более сложными и коллективными 8 . При поддержке расчетов среднего поля 9 термодинамически-кинетическая корреляция перехода жидкости в стекло была хорошо установлена 10,11 . Однако зависимость такой корреляции от скорости охлаждения в этих теориях почти не учитывается, а также неясна картина фазового превращения (стекло или кристалл) в критической точке фазового отбора.
Было указано, что замедление динамики при понижении температуры вызвано тем, что доступно меньше конфигураций, а кинетические пути между ними становятся более сложными и коллективными 8 . При поддержке расчетов среднего поля 9 термодинамически-кинетическая корреляция перехода жидкости в стекло была хорошо установлена 10,11 . Однако зависимость такой корреляции от скорости охлаждения в этих теориях почти не учитывается, а также неясна картина фазового превращения (стекло или кристалл) в критической точке фазового отбора.Недавно было указано, что на устойчивость переохлажденной жидкости к кристаллизации, которая связана с уровнем структурной неоднородности 12 , влияет термическая предыстория жидкости. Следуя этому сценарию, плотность зародышеобразования чувствительна к атомным структурам в свежеприготовленной переохлажденной жидкости 9.0364 13 , что приводит к различным путям кристаллизации. На самом деле это может быть связано с разбросом времени начала зародышеобразования в процессе изотермического отжига металлических жидких систем, о чем сообщают экспериментальные измерения и теоретические предсказания в литературе 14,15 .
 Поэтому разумно полагать, что структурные флуктуации играют важную роль в превращении стекла или зарождении кристаллов. Фазовое превращение переохлажденной жидкости будет определяться сочетанием структурных колебаний и остановки динамики. С точки зрения зависимости релаксации структуры от времени эта связь предсказывается как значительная, особенно вблизи критической скорости охлаждения для фазового отбора. До настоящего времени влияние термодинамически-кинетических корреляций на фазовые превращения в этой области изучено недостаточно. Вопрос о том, как сочетание структурных флуктуаций и остановки динамики определяет фазовое превращение в переохлажденной жидкости, остается открытым. Чтобы решить эту проблему, в настоящей работе мы выбрали системы металлов с чистыми элементами, включая Cu, Ag, Au, Ni, Pd, Pt, Al, Pb, Fe, Mo, Ta, W, Ti и Zr, для исследования. влияние структурных флуктуаций на фазовое превращение при скоростях охлаждения вблизи критической точки, что позволяет исключить фактор флуктуаций состава.
Поэтому разумно полагать, что структурные флуктуации играют важную роль в превращении стекла или зарождении кристаллов. Фазовое превращение переохлажденной жидкости будет определяться сочетанием структурных колебаний и остановки динамики. С точки зрения зависимости релаксации структуры от времени эта связь предсказывается как значительная, особенно вблизи критической скорости охлаждения для фазового отбора. До настоящего времени влияние термодинамически-кинетических корреляций на фазовые превращения в этой области изучено недостаточно. Вопрос о том, как сочетание структурных флуктуаций и остановки динамики определяет фазовое превращение в переохлажденной жидкости, остается открытым. Чтобы решить эту проблему, в настоящей работе мы выбрали системы металлов с чистыми элементами, включая Cu, Ag, Au, Ni, Pd, Pt, Al, Pb, Fe, Mo, Ta, W, Ti и Zr, для исследования. влияние структурных флуктуаций на фазовое превращение при скоростях охлаждения вблизи критической точки, что позволяет исключить фактор флуктуаций состава. Мы исследовали структурное происхождение и физический смысл разброса времени начала нуклеации на основе моделирования классической молекулярной динамики (МД) методом внедренного атома (МЭА), предложенного Менделевым 16 и поставляется в LAMMPS 17 . Механизм атомного масштаба, лежащий в основе фазового превращения в зависимости от скорости охлаждения, характеризуется адаптивным анализом общих соседей (a-CNA) 18 и параметрами локального порядка ориентации связей (BOO) 19 . Из-за аналогичных результатов и последовательных выводов из этих систем металлов с чистыми элементами здесь мы приводим результаты только для меди.
Мы исследовали структурное происхождение и физический смысл разброса времени начала нуклеации на основе моделирования классической молекулярной динамики (МД) методом внедренного атома (МЭА), предложенного Менделевым 16 и поставляется в LAMMPS 17 . Механизм атомного масштаба, лежащий в основе фазового превращения в зависимости от скорости охлаждения, характеризуется адаптивным анализом общих соседей (a-CNA) 18 и параметрами локального порядка ориентации связей (BOO) 19 . Из-за аналогичных результатов и последовательных выводов из этих систем металлов с чистыми элементами здесь мы приводим результаты только для меди.Результаты и обсуждение
Критические скорости охлаждения из диаграммы ТТТ
На рис. 1 представлена зависимость между временем и потенциальной энергией при изотермическом отжиге при температурах от 500 К до 900 К для трех независимых образцов переохлажденной жидкой меди. Поскольку появление зарождения кристаллов сопровождается внезапным изменением потенциальной энергии 20 , точки отклонения потенциальной энергии, отмеченные на рис.
 1 красными квадратами, соответствуют временам, необходимым для начала процесса кристаллизации при температурах отжига. Рисунок 1 ясно показывает, что при заданной температуре время начала кристаллизации отличается друг от друга в трех независимых образцах переохлажденной жидкой меди. Эти результаты свидетельствуют о том, что исходная структура жидкости оказывает существенное влияние на процесс нуклеации в соответствии с предыдущей работой 9.0364 14 . Аналогичные результаты наблюдались и в экспериментах с повторными изотермическими методами и изолированными частицами в многокомпонентных металлических системах 4,15 . Диаграмма ТТТ показывает типичную форму «носа» для времени начала кристаллизации. Критические скорости охлаждения R c для стеклования оцениваются как 2,2 × 10 12 К/с, 5,1 × 10 12 К/с и 5,3 × 10 12 К/с и 5,3 × 6 10 К/с. , применяя температуры изотермического отжига к уравнению , где t n – время носа, T m – температура плавления, T n – температура носа, определенная по диаграмме ТТТ.
1 красными квадратами, соответствуют временам, необходимым для начала процесса кристаллизации при температурах отжига. Рисунок 1 ясно показывает, что при заданной температуре время начала кристаллизации отличается друг от друга в трех независимых образцах переохлажденной жидкой меди. Эти результаты свидетельствуют о том, что исходная структура жидкости оказывает существенное влияние на процесс нуклеации в соответствии с предыдущей работой 9.0364 14 . Аналогичные результаты наблюдались и в экспериментах с повторными изотермическими методами и изолированными частицами в многокомпонентных металлических системах 4,15 . Диаграмма ТТТ показывает типичную форму «носа» для времени начала кристаллизации. Критические скорости охлаждения R c для стеклования оцениваются как 2,2 × 10 12 К/с, 5,1 × 10 12 К/с и 5,3 × 10 12 К/с и 5,3 × 6 10 К/с. , применяя температуры изотермического отжига к уравнению , где t n – время носа, T m – температура плавления, T n – температура носа, определенная по диаграмме ТТТ. Из-за нелинейности зародышеобразования и наличия времени индукции зародышеобразования значения R c по носовому методу из кривых ТТТ всегда больше, чем определенные из условий постоянной скорости охлаждения 21 . Следовательно, расчетные выше критические скорости охлаждения для стеклования расплавленной меди могут быть верхней границей фактической требуемой скорости охлаждения. Таким образом, моделирование непрерывного охлаждения соответственно выполнялось при скоростях охлаждения в диапазоне от 10 11 до 10 13 К/с.
Из-за нелинейности зародышеобразования и наличия времени индукции зародышеобразования значения R c по носовому методу из кривых ТТТ всегда больше, чем определенные из условий постоянной скорости охлаждения 21 . Следовательно, расчетные выше критические скорости охлаждения для стеклования расплавленной меди могут быть верхней границей фактической требуемой скорости охлаждения. Таким образом, моделирование непрерывного охлаждения соответственно выполнялось при скоростях охлаждения в диапазоне от 10 11 до 10 13 К/с.Рис. 1. Зависимость потенциальной энергии от времени при отжиге при разных температурах для трех независимых образцов.
Линии разного цвета представляют потенциальную энергию при разных температурах. Красная кривая представляет собой типичную диаграмму ТТТ, показывающую зависимость между временем начала падения потенциальной энергии и температурой. Критические скорости охлаждения R c для стеклования оцениваются как ( A ) 2,2 × 10 12 K S -1 , ( B ) 5,1 × 10 12 K S -1 и ( C ) 5,3 × 10 12 и ( C ) 5,3 × 10 12 и ( C ) 5,3 × 10 12 и ( C ) −1 соответственно.

Изображение полного размера
Аномальная корреляция между фазовым отбором и скоростью охлаждения
На рис. 2 показаны доли кристаллического компонента в охлажденном образце меди в зависимости от скорости охлаждения в диапазоне от 4,0 × 10 11 К/с до 119,7 × 10 11 К/с после охлаждения от 149от 5 K до 298 K. Атомные структуры, например, гранецентрированные кубические (подобные FCC), гексагональные плотноупакованные (подобные HCP) и объемно-центрированные кубические (подобные BCC) кристаллические структуры, а также другие аморфные структуры , можно идентифицировать в течение всего процесса охлаждения с помощью a-CNA, как показано на изображениях, включенных в рис. 2а. Следует отметить, что, поскольку атомы в границах зерен могут быть идентифицированы как аморфные структуры в образцах после быстрого охлаждения, кристаллическая доля в охлажденных образцах едва ли может достигать 100 % даже при полной кристаллизации жидкости. Установлено, что образцы всегда содержат высококристаллическую фракцию при скоростях охлаждения ниже 6,3 × 10 9 .
 0364 11 К/с. В этой области скоростей охлаждения переходная частота зародышеобразования, по-видимому, мало влияет на структурную эволюцию, поскольку скорость релаксации зародышеобразования превышает скорость изменения барьера зародышеобразования во время охлаждения 6 . Напротив, релаксация зародышеобразования за счет перегруппировки атомов замедляется при скорости охлаждения выше 16,6 × 10 11 К/с. В этой области скорости охлаждения высокая скорость охлаждения предотвращает кристаллизацию жидкости, и происходит превращение стекла. Эти наблюдения согласуются с общей кинетической точкой зрения на фазовое превращение 5 . Удивительно, но мы обнаруживаем аномальное влияние скорости охлаждения на фазовое превращение в узком диапазоне скоростей охлаждения между 16,6 × 10 11 К/с и 6,3 × 10 11 К/с, где кристаллические фракции могут сильно колебаться в зависимости от скорости охлаждения. Из рис. 2б видно, что фазовое превращение очень чувствительно к скорости охлаждения, и доля кристаллов продолжает колебаться в этой области скоростей охлаждения.
0364 11 К/с. В этой области скоростей охлаждения переходная частота зародышеобразования, по-видимому, мало влияет на структурную эволюцию, поскольку скорость релаксации зародышеобразования превышает скорость изменения барьера зародышеобразования во время охлаждения 6 . Напротив, релаксация зародышеобразования за счет перегруппировки атомов замедляется при скорости охлаждения выше 16,6 × 10 11 К/с. В этой области скорости охлаждения высокая скорость охлаждения предотвращает кристаллизацию жидкости, и происходит превращение стекла. Эти наблюдения согласуются с общей кинетической точкой зрения на фазовое превращение 5 . Удивительно, но мы обнаруживаем аномальное влияние скорости охлаждения на фазовое превращение в узком диапазоне скоростей охлаждения между 16,6 × 10 11 К/с и 6,3 × 10 11 К/с, где кристаллические фракции могут сильно колебаться в зависимости от скорости охлаждения. Из рис. 2б видно, что фазовое превращение очень чувствительно к скорости охлаждения, и доля кристаллов продолжает колебаться в этой области скоростей охлаждения. Что еще более важно, более высокая скорость охлаждения больше не будет гарантировать более низкую фракцию кристаллов, чем более низкая скорость охлаждения. Например, кристаллическая фракция твердого тела, закаленного при скорости охлаждения 12,6 × 10 11 К/с выше, чем на скорость охлаждения 11,4 × 10 11 К/с. Чтобы подтвердить эти результаты, были выполнены различные условия моделирования, включая исходные структуры и размер системы для различных систем из чистых металлов, и можно обнаружить, что это явление универсально (дополнительные рисунки S1 и S2). Этот факт показывает, что общее эмпирическое правило нарушается в этой области скоростей охлаждения, убедительно предполагая, что фазовое превращение в этой области умеренных скоростей охлаждения связано с эволюцией атомной структуры, контролируемой не кинетическим фактором, а термической историей различных факторов. скорости охлаждения.
Что еще более важно, более высокая скорость охлаждения больше не будет гарантировать более низкую фракцию кристаллов, чем более низкая скорость охлаждения. Например, кристаллическая фракция твердого тела, закаленного при скорости охлаждения 12,6 × 10 11 К/с выше, чем на скорость охлаждения 11,4 × 10 11 К/с. Чтобы подтвердить эти результаты, были выполнены различные условия моделирования, включая исходные структуры и размер системы для различных систем из чистых металлов, и можно обнаружить, что это явление универсально (дополнительные рисунки S1 и S2). Этот факт показывает, что общее эмпирическое правило нарушается в этой области скоростей охлаждения, убедительно предполагая, что фазовое превращение в этой области умеренных скоростей охлаждения связано с эволюцией атомной структуры, контролируемой не кинетическим фактором, а термической историей различных факторов. скорости охлаждения.Рис. 2. Кристалличность образцов в зависимости от скорости охлаждения.

( a ) Скорость охлаждения варьируется от 119,7 × 10 11 К/с до 4,0 × 10 11 К/с, с ( b ) увеличенные интервалы от 11,3 × K/) с до 12,7 × 10 11 К/с для уточнения. Два изображения в ( и ) представляют собой типичную аморфную структуру (справа) и кристаллическую структуру (слева), характеризующуюся a-CNA. Атомы с ГЦК-подобным окружением представлены зеленым цветом, ГПУ-подобным — красным, ОЦК-подобным — синим, икосаэдроподобным — желтым, а остальные — серым.
Изображение полного размера
Эволюция атомной структуры при быстром охлаждении
Чтобы визуализировать зависимость эволюции атомной структуры от скорости охлаждения, на рис. 3 показано распределение кристаллоподобных кластеров при более высокой скорости охлаждения 12,6 × 10 11 К. /с и более медленная скорость охлаждения 11,4 × 10 11 К/с. В начале кажется, что изолированные кристаллоподобные кластеры случайным образом появляются из жидкости с сопоставимой скоростью для обеих скоростей охлаждения.
 Некоторые ранее сформированные кластеры растворяются по мере появления других, независимо от типа кристаллической структуры. При температуре ниже 750 К образуются стабильные кристаллоподобные зародыши. Удивительно, но зародыши, достигшие критического размера, действительно появляются при более высокой скорости охлаждения 12,6 × 10 11 К/с, а более медленная скорость 11,4 × 10 11 К/с. Это указывает на то, что в этой области скорости охлаждения зародышеобразование и рост могут определяться термической историей с точки зрения структурных флуктуаций, а не динамикой, подобной диффузии для чистой меди. Мониторинг процесса зародышеобразования с точки зрения изменения размера кристаллоподобных кластеров может дать представление о термодинамике и кинетике зародышеобразования в течение сложной температурно-временной истории. Графики справа на рис. 3 показывают количество и размер зародышей в зависимости от количества кристаллоподобных кластеров при понижении температуры.
Некоторые ранее сформированные кластеры растворяются по мере появления других, независимо от типа кристаллической структуры. При температуре ниже 750 К образуются стабильные кристаллоподобные зародыши. Удивительно, но зародыши, достигшие критического размера, действительно появляются при более высокой скорости охлаждения 12,6 × 10 11 К/с, а более медленная скорость 11,4 × 10 11 К/с. Это указывает на то, что в этой области скорости охлаждения зародышеобразование и рост могут определяться термической историей с точки зрения структурных флуктуаций, а не динамикой, подобной диффузии для чистой меди. Мониторинг процесса зародышеобразования с точки зрения изменения размера кристаллоподобных кластеров может дать представление о термодинамике и кинетике зародышеобразования в течение сложной температурно-временной истории. Графики справа на рис. 3 показывают количество и размер зародышей в зависимости от количества кристаллоподобных кластеров при понижении температуры. Кристаллоподобные кластеры не накапливаются постоянно при повышенном переохлаждении, хотя количество кристаллоподобных кластеров немного больше при более высоких скоростях охлаждения, чем при более низких скоростях охлаждения. Это предполагает уравновешивающую связь между кристаллоподобными кластерами и икосаэдрическими кластерами в переохлажденных жидкостях. Кристаллоподобные кластеры с числом атомов менее четырех нестабильны по сравнению с икосаэдрическими кластерами, часто растворяясь в переохлажденной жидкости 22 . Установлено также, что две жидкие системы с разной скоростью охлаждения по-разному ведут себя при приближении температуры к 775 K, т. е. в переохлажденной жидкости растут некоторые кристаллоподобные кластеры, и кристаллизация происходит при более высокой скорости охлаждения, тогда как неупорядоченная структура сохраняется в переохлажденной жидкости. переохлажденная жидкость с меньшей скоростью охлаждения. Этот результат свидетельствует о том, что в области умеренных скоростей охлаждения образование стабильного кристаллоподобного кластера зависит от его размера, что происходит во время структурных флуктуаций, контролируемых термической историей, а не скоростью охлаждения 22 .
Кристаллоподобные кластеры не накапливаются постоянно при повышенном переохлаждении, хотя количество кристаллоподобных кластеров немного больше при более высоких скоростях охлаждения, чем при более низких скоростях охлаждения. Это предполагает уравновешивающую связь между кристаллоподобными кластерами и икосаэдрическими кластерами в переохлажденных жидкостях. Кристаллоподобные кластеры с числом атомов менее четырех нестабильны по сравнению с икосаэдрическими кластерами, часто растворяясь в переохлажденной жидкости 22 . Установлено также, что две жидкие системы с разной скоростью охлаждения по-разному ведут себя при приближении температуры к 775 K, т. е. в переохлажденной жидкости растут некоторые кристаллоподобные кластеры, и кристаллизация происходит при более высокой скорости охлаждения, тогда как неупорядоченная структура сохраняется в переохлажденной жидкости. переохлажденная жидкость с меньшей скоростью охлаждения. Этот результат свидетельствует о том, что в области умеренных скоростей охлаждения образование стабильного кристаллоподобного кластера зависит от его размера, что происходит во время структурных флуктуаций, контролируемых термической историей, а не скоростью охлаждения 22 . На рис. 4 приведены средние значения потенциальной энергии атомов в кристаллоподобных кластерах при разных температурах для скоростей охлаждения 12,6 × 10 11 К/с и 11,4 × 10 11 К/с. Установлено, что ниже примерно 750 К средние потенциальные энергии атомов в кристаллоподобных кластерах при скорости охлаждения 12,6 × 10 11 К/с ниже, чем при скорости охлаждения 11,4 × 10 11 К/с. с, что способствует росту кристаллоподобных кластеров и запускает кристаллизацию при охлаждении в случае 12,6 × 10 11 К/с скорость охлаждения.
На рис. 4 приведены средние значения потенциальной энергии атомов в кристаллоподобных кластерах при разных температурах для скоростей охлаждения 12,6 × 10 11 К/с и 11,4 × 10 11 К/с. Установлено, что ниже примерно 750 К средние потенциальные энергии атомов в кристаллоподобных кластерах при скорости охлаждения 12,6 × 10 11 К/с ниже, чем при скорости охлаждения 11,4 × 10 11 К/с. с, что способствует росту кристаллоподобных кластеров и запускает кристаллизацию при охлаждении в случае 12,6 × 10 11 К/с скорость охлаждения.Рисунок 3: Структура и размеры кластеров в зависимости от температуры.
Изображения сверху вниз и слева направо с левой стороны представляют температуры при 900 K, 800 K, 750 K и 700 K.( a ) Размер кластеров как функция температуры для скорости охлаждения 12,6 × 10 11 К/с; ( b ) размер кластеров в зависимости от температуры при скорости охлаждения 11,4 × 10 11 К/с.

Изображение полного размера
Рис. 4. Средние потенциальные энергии атомов в кристаллоподобных кластерах.
Средние потенциальные энергии атомов в кристаллоподобных кластерах в зависимости от температуры для обеих скоростей охлаждения 12,6 × 10 11 К/с и 11,4 × 10 11 К/с.
Изображение полного размера
Разница в стекловании между умеренными скоростями охлаждения и высокими скоростями охлаждения
Мы использовали параметры BOO для анализа эволюции локальной структуры переохлажденной жидкости и изучения разницы в стекловании между умеренными скоростями охлаждения 7,1 × 10 11 К/с и высокой скоростью охлаждения 2394,0 × 10 11 К/с. Один случай кристаллизации при скорости охлаждения 12,6 × 10 11 К/с используется для выяснения механизма стеклообразования при умеренной скорости охлаждения. Эволюция локальной атомной структуры идентифицируется параметрами BOO, представленными в разделе методов.
 На рис. 5 представлены контурные карты возникновения конфигурации со значениями Q 6 в зависимости от температуры для скоростей охлаждения (а) 2394,0 × 10 11 К/с, (б) 12,6 × 10 11 К/с и (в) 7,1 × 10 11 К/с соответственно. Эти три случая соответственно представляют образование стекла при высокой скорости охлаждения, кристаллизацию и образование стекла при умеренной скорости охлаждения. Отмечается, что максимальное количество точек на измерение установлено равным 60 для облегчения визуализации.
На рис. 5 представлены контурные карты возникновения конфигурации со значениями Q 6 в зависимости от температуры для скоростей охлаждения (а) 2394,0 × 10 11 К/с, (б) 12,6 × 10 11 К/с и (в) 7,1 × 10 11 К/с соответственно. Эти три случая соответственно представляют образование стекла при высокой скорости охлаждения, кристаллизацию и образование стекла при умеренной скорости охлаждения. Отмечается, что максимальное количество точек на измерение установлено равным 60 для облегчения визуализации.Рисунок 5: Эволюция локальной атомной структуры.
Контурные карты возникновения конфигурации со значениями Q6 в зависимости от температуры для скоростей охлаждения ( A ) 2394,0 × 10 11 K/S, ( B ) 12,6 × 10 11 K/S и ( C ) 7,1 × 10 11 К/с соответственно.
Увеличенное изображение
В случае стеклообразования при высокой скорости охлаждения значения Q 6 для каждого атома практически остаются постоянными без существенных изменений или флуктуаций в процессе охлаждения, как видно на рис.
 5а. Это указывает на то, что атомные структуры, характеризуемые симметрией ориентации связей в переохлажденной жидкости и стеклообразном твердом теле, аналогичны таковым в жидком состоянии. Другими словами, конечное металлическое стекло в этом случае получается путем замораживания атомной структуры жидкости в значительной степени без значительной структурной релаксации и флуктуации. Кроме того, замораживание действительно навязчиво, хотя в процессе охлаждения появляются небольшие кристаллоподобные порядки. Однако все обстоит иначе, когда скорость охлаждения снижается до умеренной области. Как показано на рис. 5б,в, значения Q 6 варьируются примерно от 0,1 до 0,4, что находится в типичной области между икосаэдрическим порядком и кристаллоподобным порядком на ранней стадии переохлажденной жидкости. Эти результаты показывают, что локальные атомные структуры с икосаэдрическим порядком и кристаллоподобным порядком постоянно конкурируют друг с другом, поскольку вся система ищет минимум на поверхности потенциальной энергии.
5а. Это указывает на то, что атомные структуры, характеризуемые симметрией ориентации связей в переохлажденной жидкости и стеклообразном твердом теле, аналогичны таковым в жидком состоянии. Другими словами, конечное металлическое стекло в этом случае получается путем замораживания атомной структуры жидкости в значительной степени без значительной структурной релаксации и флуктуации. Кроме того, замораживание действительно навязчиво, хотя в процессе охлаждения появляются небольшие кристаллоподобные порядки. Однако все обстоит иначе, когда скорость охлаждения снижается до умеренной области. Как показано на рис. 5б,в, значения Q 6 варьируются примерно от 0,1 до 0,4, что находится в типичной области между икосаэдрическим порядком и кристаллоподобным порядком на ранней стадии переохлажденной жидкости. Эти результаты показывают, что локальные атомные структуры с икосаэдрическим порядком и кристаллоподобным порядком постоянно конкурируют друг с другом, поскольку вся система ищет минимум на поверхности потенциальной энергии. Основная причина сохранения этого типа конкуренции заключается в том, что изменения ориентации связей для соседних атомов сильно нерезонансны, что можно продемонстрировать плотными контурными линиями, а икосаэдрический порядок и кристаллоподобный порядок передаются каждому. другое, так как кристаллоподобные кластеры, если и появляются в какой-то момент, то неустойчивы из-за своих малых размеров (см. предыдущий раздел). Эта структурная флуктуация в конечном итоге приводит к образованию металлического стекла, когда изменения ориентации связей для соседних атомов остаются сильно нерезонансными в течение всего процесса охлаждения, как показано на рис. 5c. Тем не менее, это не всегда так в области умеренного охлаждения. Из рис. 5б при снижении температуры до 750 К значения Q 6 для нескольких атомов резко увеличиваются в сторону кристаллоподобного порядка при более высокой скорости охлаждения 12,6 × 10 11 К/с. Более того, эти кристаллические порядки, по-видимому, не имеют тенденции возвращаться к икосаэдрическому порядку, а становятся все более и более стабильными, а также запускают стабилизацию кристаллического порядка для других окружающих атомов.
Основная причина сохранения этого типа конкуренции заключается в том, что изменения ориентации связей для соседних атомов сильно нерезонансны, что можно продемонстрировать плотными контурными линиями, а икосаэдрический порядок и кристаллоподобный порядок передаются каждому. другое, так как кристаллоподобные кластеры, если и появляются в какой-то момент, то неустойчивы из-за своих малых размеров (см. предыдущий раздел). Эта структурная флуктуация в конечном итоге приводит к образованию металлического стекла, когда изменения ориентации связей для соседних атомов остаются сильно нерезонансными в течение всего процесса охлаждения, как показано на рис. 5c. Тем не менее, это не всегда так в области умеренного охлаждения. Из рис. 5б при снижении температуры до 750 К значения Q 6 для нескольких атомов резко увеличиваются в сторону кристаллоподобного порядка при более высокой скорости охлаждения 12,6 × 10 11 К/с. Более того, эти кристаллические порядки, по-видимому, не имеют тенденции возвращаться к икосаэдрическому порядку, а становятся все более и более стабильными, а также запускают стабилизацию кристаллического порядка для других окружающих атомов. С увеличением числа атомов в кристаллоподобном кластере возрастает и энергетический барьер процесса обратного превращения кристалла в переохлажденную жидкость 22 . Следовательно, фазовое превращение в области умеренных скоростей охлаждения зависит от структурных флуктуаций, а не от скоростей охлаждения. Хотя он не может подтвердить фазовое превращение при одном заданном процессе охлаждения, можно сделать вывод, что более высокая скорость охлаждения не может гарантировать более низкую долю кристаллов вблизи критической скорости охлаждения. Примечательно, что «неопределенность» здесь связана с независимыми событиями, а не с вероятностью по статистике. Вышеприведенные результаты продемонстрировали совершенно различное поведение эволюции структуры, когда жидкости подвергаются высокой скорости охлаждения и умеренной скорости охлаждения, поэтому мы можем соответственно постулировать два различных механизма образования стекла: i) кинетическое замедление перестройки атомов и структурная релаксация при высоких скоростях охлаждения и ii) конкуренция икосаэдрического порядка с кристаллическим порядком при умеренных скоростях охлаждения.
С увеличением числа атомов в кристаллоподобном кластере возрастает и энергетический барьер процесса обратного превращения кристалла в переохлажденную жидкость 22 . Следовательно, фазовое превращение в области умеренных скоростей охлаждения зависит от структурных флуктуаций, а не от скоростей охлаждения. Хотя он не может подтвердить фазовое превращение при одном заданном процессе охлаждения, можно сделать вывод, что более высокая скорость охлаждения не может гарантировать более низкую долю кристаллов вблизи критической скорости охлаждения. Примечательно, что «неопределенность» здесь связана с независимыми событиями, а не с вероятностью по статистике. Вышеприведенные результаты продемонстрировали совершенно различное поведение эволюции структуры, когда жидкости подвергаются высокой скорости охлаждения и умеренной скорости охлаждения, поэтому мы можем соответственно постулировать два различных механизма образования стекла: i) кинетическое замедление перестройки атомов и структурная релаксация при высоких скоростях охлаждения и ii) конкуренция икосаэдрического порядка с кристаллическим порядком при умеренных скоростях охлаждения.
В заключение, аномальные фазовые превращения часто наблюдаются при скоростях охлаждения, близких к критическому значению фазового отбора, что приводит к флуктуациям кристаллической фракции со скоростями охлаждения. Зарождение кристаллов происходит за счет появления адекватных кристаллоподобных кластеров, в то время как образование стекла в этой области критической скорости охлаждения определяется атомными структурными флуктуациями, контролируемыми термодинамическим фактором, а не кинетическим фактором. Соответственно, предлагаются два различных механизма образования стекла. Результаты этой работы расширяют наше общее понимание того, что образование стекла является результатом кинетического замораживания переохлажденной жидкости, а также здравый смысл фазового превращения, зависящего от скорости охлаждения.
Методы
МД-моделирование
МД-моделирование выполнялось на кубе с 5324 атомами при трехмерных периодических граничных условиях. При моделировании мы использовали ансамбль постоянного числа частиц, давления и температуры (NPT); этот метод сочетает в себе канонический ансамбль Нозе 23 с переменной формой и объемом.
 NPT MD собирает очень подробную микроскопическую информацию о системе, что позволяет изучать фазовые превращения, а также позволяет изменять форму и объем системы. Временной интервал был установлен равным 1 фс, чтобы интегрировать законы движения Ньютона. МД-моделирование проводилось при повышении температуры от 0 К до 149°С.5 К, что на десять процентов выше температуры плавления меди. После уравновешивания структуры в жидком состоянии в течение 300 пс мы провели два типа моделирования: изотермический отжиг и непрерывное охлаждение. Исходные жидкие структуры были приготовлены путем увеличения времени установления равновесия на 0 пс, 1 пс и 10 пс соответственно при температуре 1495 K. K с интервалом 50 K. Этот диапазон был выбран из-за его близости к прогнозируемой температуре носа 700 K, согласно нашим наблюдениям при изучении фазового превращения при охлаждении. Для моделирования непрерывного охлаждения система непрерывно охлаждалась до 298 К при скоростях охлаждения от 4,0 × 10 11 К с −1 до 2394,0 × 10 11 К/с.
NPT MD собирает очень подробную микроскопическую информацию о системе, что позволяет изучать фазовые превращения, а также позволяет изменять форму и объем системы. Временной интервал был установлен равным 1 фс, чтобы интегрировать законы движения Ньютона. МД-моделирование проводилось при повышении температуры от 0 К до 149°С.5 К, что на десять процентов выше температуры плавления меди. После уравновешивания структуры в жидком состоянии в течение 300 пс мы провели два типа моделирования: изотермический отжиг и непрерывное охлаждение. Исходные жидкие структуры были приготовлены путем увеличения времени установления равновесия на 0 пс, 1 пс и 10 пс соответственно при температуре 1495 K. K с интервалом 50 K. Этот диапазон был выбран из-за его близости к прогнозируемой температуре носа 700 K, согласно нашим наблюдениям при изучении фазового превращения при охлаждении. Для моделирования непрерывного охлаждения система непрерывно охлаждалась до 298 К при скоростях охлаждения от 4,0 × 10 11 К с −1 до 2394,0 × 10 11 К/с.
ВОО параметры
Локальная структура частицы i характеризуется параметрами ВОО, определяемыми следующим образом 19 :
где
где, n ( i 9006 ) — координационное число частицы . Y lm ( r ij ) – сферические гармоники, где r ij представляет собой вектор от частицы i до j , l — целое число, а m — целое число в диапазоне от отрицательного до положительного. Для металлов анализы BOO обычно проводятся при л = 4 и л = 6 24 . В частности, Q 6 ( i ) связано с шестикратной симметрией в трехмерном пространстве. Атомы с высокими значениями для Q 6 , более 0,2, служат потенциальными предшественниками кристаллического ядра, в то время как те, у которых низкое Q 6 менее 0,2, имеют типичный икосаэдрический порядок.
 В этой работе мы использовали Q 6 для определения тенденции кристаллоподобного порядка и икосаэдрического порядка.
В этой работе мы использовали Q 6 для определения тенденции кристаллоподобного порядка и икосаэдрического порядка.Дополнительная информация
Как цитировать эту статью : Han, J. J. et al. Аномальная корреляция между фазовым превращением и скоростью охлаждения для чистых металлов. Науч. Респ. 6 , 22391; doi: 10.1038/srep22391 (2016).
Каталожные номера
Wang, W. H., Dong, C. & Shek, C. H. Металлические стекла оптом. Матер. науч. англ. R-Rep 44 , 45–89 (2004).
Артикул
Google ученый
Faupel, F. et al. Диффузия в металлических стеклах и переохлажденных расплавах. Ред. Мод. физ. 75 , 237–280 (2003).
ОБЪЯВЛЕНИЕ
СтатьяGoogle ученый
Чжун, Л.
 , Ван, Дж., Шэн, Х., Чжан, З. и Мао, С. X. Формирование моноатомных металлических стекол путем сверхбыстрой закалки в жидкости. Природа 512 , 177–180 (2014).
, Ван, Дж., Шэн, Х., Чжан, З. и Мао, С. X. Формирование моноатомных металлических стекол путем сверхбыстрой закалки в жидкости. Природа 512 , 177–180 (2014).КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Schroers, J., Wu, Y., Busch, R. & Johnson, W.L. Переход от кристаллизации, контролируемой зародышеобразованием, к контролируемой росту кристаллизации в расплавах Pd43Ni10Cu27P20. Acta Mater. 49 , 2773–2781 (2001).
КАС
СтатьяGoogle ученый
Дэвис, М.Дж. и Айхингер, П.Д. Влияние термической предыстории на зарождение кристаллов в силикатном расплаве: Численное моделирование. Ж. Геофиз. Рез. 107 , 2284 (2002).
ОБЪЯВЛЕНИЕ
Google ученый
Деметриу, М. Д., Гоньем, Н. М. и Лавин, А. С.
 Влияние быстротечности зародышеобразования на кинетику кристаллизации в сильно неравновесных условиях. J. Chem. физ. 117 , 10739–10743 (2002).
Влияние быстротечности зародышеобразования на кинетику кристаллизации в сильно неравновесных условиях. J. Chem. физ. 117 , 10739–10743 (2002).КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Киркпатрик Т. Р., Тирумалай Д. и Волинс П. Г. Концепции масштабирования динамики вязких жидкостей вблизи идеального стеклообразного состояния. Физ. Ред. A 40 , 1045–1054 (1989).
КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Лубченко В., Волинс П. Г. Теория структурных стекол и переохлажденных жидкостей. Год. Преподобный физ. хим. 58 , 235–266 (2007).
КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Франц, С. и Паризи, Г. Фазовая диаграмма связанных стеклообразных систем: исследование среднего поля.
 физ. Преподобный Письмо . 79 , 2486–2489 (1997).
физ. Преподобный Письмо . 79 , 2486–2489 (1997).КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Каммарота, К. и Бироли, Г. Случайное закрепление стеклования: признаки, теория среднего поля и анализ ренормализационной группы. J. Chem. физ. 138 , 12А547 (2013).
Артикул
Google ученый
Бироли Г., Каммарота К., Таржус Г. и Тарция М. Случайно-полевая критичность в стеклообразующих жидкостях. Физ. Преподобный Летт. 112 , 175701 (2014).
ОБЪЯВЛЕНИЕ
СтатьяGoogle ученый
Чудо Д. Б., Эгами Т., Флорес К. М. и Келтон К. Ф. Структурные аспекты металлических стекол. MRS Bull 32 , 629–634 (2007 г.).
КАС
СтатьяGoogle ученый
Перепецко, Дж.
 Х., Хаманн, Дж., Хеберт, Р. Дж., Рёснер, Х. и Уайльд, Г. Реакции аморфизации и расстеклования в сплавах металлического стекла. Матер. науч. Eng . 449–451 , 84–89 (2007).
Х., Хаманн, Дж., Хеберт, Р. Дж., Рёснер, Х. и Уайльд, Г. Реакции аморфизации и расстеклования в сплавах металлического стекла. Матер. науч. Eng . 449–451 , 84–89 (2007).Артикул
Google ученый
Wu, Z.W., Li, M.Z., Wang, W.H., Song, W.J. & Liu, K.X. Влияние локальных структур на структурную эволюцию во время кристаллизации в переохлажденных металлических стеклообразующих жидкостях. J. Chem. физ. 138 (2013).
Schroers, J., Johnson, W.L. & Busch, R. Повторная кристаллизация в переохлажденных жидкостях Zr41Ti14Cu12Ni10Be23. Заявл. физ. лат. 76 , 2343–2345 (2000).
КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Менделев, М. И., Крамер, М. Дж., Беккер, К. А. и Аста, М. Анализ полуэмпирических межатомных потенциалов, подходящих для моделирования кристаллических и жидких Al и Cu.
 Филос. Маг. 88 , 1723–1750 (2008).
Филос. Маг. 88 , 1723–1750 (2008).КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Плимптон, С. Быстрые параллельные алгоритмы для молекулярной динамики ближнего действия. Дж. Вычисл. физ. 117 , 1–19 (1995).
КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Александр, С. Методы идентификации структуры для атомистического моделирования кристаллических материалов. Модель. Симул. Матер. науч. англ. 20 , 045021 (2012).
Артикул
Google ученый
Стейнхардт, П.Дж., Нельсон, Д.Р. и Ронкетти, М. Ориентационный порядок связи в жидкостях и стеклах. Физ. B 28 , 784–805 (1983).
КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Портер, Д.
 А. и Истерлинг, К. Е. Фазовые превращения в металлах и сплавах , Третье издание (пересмотренное переиздание). Тейлор и Фрэнсис (1992).
А. и Истерлинг, К. Е. Фазовые превращения в металлах и сплавах , Третье издание (пересмотренное переиздание). Тейлор и Фрэнсис (1992).Вайнберг, М. К., Ульманн, Д. Р. и Занотто, Э. Д. «Метод носа» расчета критических скоростей охлаждения для образования стекла. Дж. Ам. хим. соц. 72 , 2054–2058 (1989).
КАС
Google ученый
Хан, Дж. Дж. и др. J. Механизмы зарождения чистых жидких металлов на атомном уровне при быстром охлаждении. ChemPhysChem 16 , 3916–3927 (2015).
КАС
СтатьяGoogle ученый
Нос, С. Унифицированная формулировка методов молекулярной динамики при постоянной температуре. J. Chem. физ. 81 , 511–519 (1984).
КАС
ОБЪЯВЛЕНИЯ
СтатьяGoogle ученый
Танака Х.
 Ориентационный порядок связей в жидкостях: к единому описанию водоподобных аномалий, перехода жидкость-жидкость, стеклования и кристаллизации. евро. физ. JE 35 , 1–84 (2012).
Ориентационный порядок связей в жидкостях: к единому описанию водоподобных аномалий, перехода жидкость-жидкость, стеклования и кристаллизации. евро. физ. JE 35 , 1–84 (2012).КАС
СтатьяGoogle ученый
Скачать ссылки
Благодарности
Эта работа была поддержана Национальной ключевой программой фундаментальных исследований Китая (Программа 973) (№ 2012CB825700), Фондами фундаментальных исследований для центральных университетов (№ 20720150079), Министерством образования Китая (№ 20120121130004) и Национального фонда естественных наук Китая (№ 51031003 и 51171159).
Информация об авторе
Авторы и организации
Ключевая лаборатория генома материалов Фуцзянь, Колледж материалов, Сямэньский университет, Сямынь, 361005, КНР
Дж. Дж. Хан, С. П. Ван и X. Дж. Лю
Совместный инновационный центр химии энергетических материалов, Сямэньский университет 361005, P.
 R. China
R. ChinaX. J. Liu
Факультет материаловедения и инженерии, Pennsylvania State University, University Park, Pennsylvania, 16802, USA
Y. Wang & Z.-K. Лю
Институт генома материалов Шанхайского университета и Институт генома материалов Шанхайского университета, Шанхайский университет, 99 Shangda Road, 200444, Шанхай, Китай
T.-Y. Чжан
Международный центр материалов с новой структурой (ICNSM), Лаборатория материалов с новой структурой, Государственная ключевая лаборатория кремниевых материалов и Школа материаловедения и инженерии, Чжэцзянский университет, Ханчжоу, 310027, КНР
J.Z. Цзян
Авторы
- J. J. Han
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - C. P. Wang
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - X.
 J. Liu
J. LiuПросмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Y. Wang
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - З.-К. Liu
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - T.-Y. Чжан
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Дж. З. Цзян
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
J.J.H. и X.J.L. разработал исследование, J.J.H., X.J.L. и Дж.З.Дж. написал рукопись. Дж.Дж.Х. провел симуляции. К.П.В., Ю.В., З.-К.Л., Т.-Ю.З. и Дж.З.Дж. обсудили и прокомментировали рукопись.
Автор, ответственный за переписку
Переписка с
XJ Лю.



 4 Равновесие между фазами в бинарных растворах. Фазовые диаграммы бинарных сплавов
4 Равновесие между фазами в бинарных растворах. Фазовые диаграммы бинарных сплавов  9 Рост нитевидных кристаллов
9 Рост нитевидных кристаллов  3 Конвекция
3 Конвекция  1 Введение
1 Введение  4 Экспериментальные методы определения структуры металлических стекол и расплавов аморфных сплавов
4 Экспериментальные методы определения структуры металлических стекол и расплавов аморфных сплавов 
 Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел. Эта сильная связь делает алмаз самым твердым телом.
Эта сильная связь делает алмаз самым твердым телом. Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые кристаллы имеют как ближний, так и дальний порядок. На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность. Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно.
Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно. Общее количество чистых металлов, рассматриваемых в данной работе, составляет 14. На примере чистой меди корреляция между фазовым отбором кристалла или стекла и скоростью охлаждения была исследована с помощью молекулярно-динамического моделирования. Полученные результаты показывают, что существует область скоростей охлаждения 6,3 × 10 11 –16,6 × 10 11 К/с, в которой кристаллические фракции сильно колеблются вместе со скоростями охлаждения. Превращение стекла в этой области скоростей охлаждения определяется флуктуациями атомной структуры, которая контролируется термодинамическими факторами. В соответствии с особенностью порядка ориентации связей при различных скоростях охлаждения мы предлагаем два механизма стеклообразования: (i) кинетическое замедление перестройки атомов или структурная релаксация при высокой скорости охлаждения; и (ii) конкуренция икосаэдрического порядка с кристаллическим порядком вблизи критической скорости охлаждения.
Общее количество чистых металлов, рассматриваемых в данной работе, составляет 14. На примере чистой меди корреляция между фазовым отбором кристалла или стекла и скоростью охлаждения была исследована с помощью молекулярно-динамического моделирования. Полученные результаты показывают, что существует область скоростей охлаждения 6,3 × 10 11 –16,6 × 10 11 К/с, в которой кристаллические фракции сильно колеблются вместе со скоростями охлаждения. Превращение стекла в этой области скоростей охлаждения определяется флуктуациями атомной структуры, которая контролируется термодинамическими факторами. В соответствии с особенностью порядка ориентации связей при различных скоростях охлаждения мы предлагаем два механизма стеклообразования: (i) кинетическое замедление перестройки атомов или структурная релаксация при высокой скорости охлаждения; и (ii) конкуренция икосаэдрического порядка с кристаллическим порядком вблизи критической скорости охлаждения. Большинство МС изготавливают из расплавленных жидкостей при охлаждении, избегая зародышеобразования и роста кристаллических фаз. Поскольку металлические жидкости имеют сильную склонность к кристаллизации при охлаждении ниже температуры ликвидуса, МГ термодинамически метастабильны. Таким образом, образование МГ и его конкуренция с кристаллизацией вызвали значительный интерес. Когда металлические жидкости затвердевают при высоких скоростях охлаждения, можно подавить зародышеобразование, в результате чего образуются металлические стекла с аморфной структурой. При таких условиях жидкая структура с ближним порядком остается в твердом аморфном состоянии без дальнего трансляционного порядка. Большинству сплавов требуется критическая скорость охлаждения около 10 6 К/с для образования аморфной структуры 1,2,3 , в то время как для чистых металлов требуются критические скорости охлаждения до 10 12 К/с. В принципе, критическую скорость охлаждения для формирования стекла для данной системы можно оценить по положению «носа» на диаграмме время-температура-превращение (ТТТ) 4 .
Большинство МС изготавливают из расплавленных жидкостей при охлаждении, избегая зародышеобразования и роста кристаллических фаз. Поскольку металлические жидкости имеют сильную склонность к кристаллизации при охлаждении ниже температуры ликвидуса, МГ термодинамически метастабильны. Таким образом, образование МГ и его конкуренция с кристаллизацией вызвали значительный интерес. Когда металлические жидкости затвердевают при высоких скоростях охлаждения, можно подавить зародышеобразование, в результате чего образуются металлические стекла с аморфной структурой. При таких условиях жидкая структура с ближним порядком остается в твердом аморфном состоянии без дальнего трансляционного порядка. Большинству сплавов требуется критическая скорость охлаждения около 10 6 К/с для образования аморфной структуры 1,2,3 , в то время как для чистых металлов требуются критические скорости охлаждения до 10 12 К/с. В принципе, критическую скорость охлаждения для формирования стекла для данной системы можно оценить по положению «носа» на диаграмме время-температура-превращение (ТТТ) 4 . Широко распространено мнение, что при скорости охлаждения выше критической любую жидкость можно превратить в аморфное твердое тело. Таким образом, превращение стекла рассматривается как процесс, при котором кристаллизация кинетически замедляется в течение определенного периода времени. В этом смысле металлическая жидкость, закаленная при более высокой скорости охлаждения, может сохранять более случайную структуру, чем закаленная при более низкой скорости охлаждения, как указывает теория нестационарного зародышеобразования 9.0364 5,6 .
Широко распространено мнение, что при скорости охлаждения выше критической любую жидкость можно превратить в аморфное твердое тело. Таким образом, превращение стекла рассматривается как процесс, при котором кристаллизация кинетически замедляется в течение определенного периода времени. В этом смысле металлическая жидкость, закаленная при более высокой скорости охлаждения, может сохранять более случайную структуру, чем закаленная при более низкой скорости охлаждения, как указывает теория нестационарного зародышеобразования 9.0364 5,6 . Было указано, что замедление динамики при понижении температуры вызвано тем, что доступно меньше конфигураций, а кинетические пути между ними становятся более сложными и коллективными 8 . При поддержке расчетов среднего поля 9 термодинамически-кинетическая корреляция перехода жидкости в стекло была хорошо установлена 10,11 . Однако зависимость такой корреляции от скорости охлаждения в этих теориях почти не учитывается, а также неясна картина фазового превращения (стекло или кристалл) в критической точке фазового отбора.
Было указано, что замедление динамики при понижении температуры вызвано тем, что доступно меньше конфигураций, а кинетические пути между ними становятся более сложными и коллективными 8 . При поддержке расчетов среднего поля 9 термодинамически-кинетическая корреляция перехода жидкости в стекло была хорошо установлена 10,11 . Однако зависимость такой корреляции от скорости охлаждения в этих теориях почти не учитывается, а также неясна картина фазового превращения (стекло или кристалл) в критической точке фазового отбора. Поэтому разумно полагать, что структурные флуктуации играют важную роль в превращении стекла или зарождении кристаллов. Фазовое превращение переохлажденной жидкости будет определяться сочетанием структурных колебаний и остановки динамики. С точки зрения зависимости релаксации структуры от времени эта связь предсказывается как значительная, особенно вблизи критической скорости охлаждения для фазового отбора. До настоящего времени влияние термодинамически-кинетических корреляций на фазовые превращения в этой области изучено недостаточно. Вопрос о том, как сочетание структурных флуктуаций и остановки динамики определяет фазовое превращение в переохлажденной жидкости, остается открытым. Чтобы решить эту проблему, в настоящей работе мы выбрали системы металлов с чистыми элементами, включая Cu, Ag, Au, Ni, Pd, Pt, Al, Pb, Fe, Mo, Ta, W, Ti и Zr, для исследования. влияние структурных флуктуаций на фазовое превращение при скоростях охлаждения вблизи критической точки, что позволяет исключить фактор флуктуаций состава.
Поэтому разумно полагать, что структурные флуктуации играют важную роль в превращении стекла или зарождении кристаллов. Фазовое превращение переохлажденной жидкости будет определяться сочетанием структурных колебаний и остановки динамики. С точки зрения зависимости релаксации структуры от времени эта связь предсказывается как значительная, особенно вблизи критической скорости охлаждения для фазового отбора. До настоящего времени влияние термодинамически-кинетических корреляций на фазовые превращения в этой области изучено недостаточно. Вопрос о том, как сочетание структурных флуктуаций и остановки динамики определяет фазовое превращение в переохлажденной жидкости, остается открытым. Чтобы решить эту проблему, в настоящей работе мы выбрали системы металлов с чистыми элементами, включая Cu, Ag, Au, Ni, Pd, Pt, Al, Pb, Fe, Mo, Ta, W, Ti и Zr, для исследования. влияние структурных флуктуаций на фазовое превращение при скоростях охлаждения вблизи критической точки, что позволяет исключить фактор флуктуаций состава. Мы исследовали структурное происхождение и физический смысл разброса времени начала нуклеации на основе моделирования классической молекулярной динамики (МД) методом внедренного атома (МЭА), предложенного Менделевым 16 и поставляется в LAMMPS 17 . Механизм атомного масштаба, лежащий в основе фазового превращения в зависимости от скорости охлаждения, характеризуется адаптивным анализом общих соседей (a-CNA) 18 и параметрами локального порядка ориентации связей (BOO) 19 . Из-за аналогичных результатов и последовательных выводов из этих систем металлов с чистыми элементами здесь мы приводим результаты только для меди.
Мы исследовали структурное происхождение и физический смысл разброса времени начала нуклеации на основе моделирования классической молекулярной динамики (МД) методом внедренного атома (МЭА), предложенного Менделевым 16 и поставляется в LAMMPS 17 . Механизм атомного масштаба, лежащий в основе фазового превращения в зависимости от скорости охлаждения, характеризуется адаптивным анализом общих соседей (a-CNA) 18 и параметрами локального порядка ориентации связей (BOO) 19 . Из-за аналогичных результатов и последовательных выводов из этих систем металлов с чистыми элементами здесь мы приводим результаты только для меди. 1 красными квадратами, соответствуют временам, необходимым для начала процесса кристаллизации при температурах отжига. Рисунок 1 ясно показывает, что при заданной температуре время начала кристаллизации отличается друг от друга в трех независимых образцах переохлажденной жидкой меди. Эти результаты свидетельствуют о том, что исходная структура жидкости оказывает существенное влияние на процесс нуклеации в соответствии с предыдущей работой 9.0364 14 . Аналогичные результаты наблюдались и в экспериментах с повторными изотермическими методами и изолированными частицами в многокомпонентных металлических системах 4,15 . Диаграмма ТТТ показывает типичную форму «носа» для времени начала кристаллизации. Критические скорости охлаждения R c для стеклования оцениваются как 2,2 × 10 12 К/с, 5,1 × 10 12 К/с и 5,3 × 10 12 К/с и 5,3 × 6 10 К/с. , применяя температуры изотермического отжига к уравнению , где t n – время носа, T m – температура плавления, T n – температура носа, определенная по диаграмме ТТТ.
1 красными квадратами, соответствуют временам, необходимым для начала процесса кристаллизации при температурах отжига. Рисунок 1 ясно показывает, что при заданной температуре время начала кристаллизации отличается друг от друга в трех независимых образцах переохлажденной жидкой меди. Эти результаты свидетельствуют о том, что исходная структура жидкости оказывает существенное влияние на процесс нуклеации в соответствии с предыдущей работой 9.0364 14 . Аналогичные результаты наблюдались и в экспериментах с повторными изотермическими методами и изолированными частицами в многокомпонентных металлических системах 4,15 . Диаграмма ТТТ показывает типичную форму «носа» для времени начала кристаллизации. Критические скорости охлаждения R c для стеклования оцениваются как 2,2 × 10 12 К/с, 5,1 × 10 12 К/с и 5,3 × 10 12 К/с и 5,3 × 6 10 К/с. , применяя температуры изотермического отжига к уравнению , где t n – время носа, T m – температура плавления, T n – температура носа, определенная по диаграмме ТТТ. Из-за нелинейности зародышеобразования и наличия времени индукции зародышеобразования значения R c по носовому методу из кривых ТТТ всегда больше, чем определенные из условий постоянной скорости охлаждения 21 . Следовательно, расчетные выше критические скорости охлаждения для стеклования расплавленной меди могут быть верхней границей фактической требуемой скорости охлаждения. Таким образом, моделирование непрерывного охлаждения соответственно выполнялось при скоростях охлаждения в диапазоне от 10 11 до 10 13 К/с.
Из-за нелинейности зародышеобразования и наличия времени индукции зародышеобразования значения R c по носовому методу из кривых ТТТ всегда больше, чем определенные из условий постоянной скорости охлаждения 21 . Следовательно, расчетные выше критические скорости охлаждения для стеклования расплавленной меди могут быть верхней границей фактической требуемой скорости охлаждения. Таким образом, моделирование непрерывного охлаждения соответственно выполнялось при скоростях охлаждения в диапазоне от 10 11 до 10 13 К/с.
 0364 11 К/с. В этой области скоростей охлаждения переходная частота зародышеобразования, по-видимому, мало влияет на структурную эволюцию, поскольку скорость релаксации зародышеобразования превышает скорость изменения барьера зародышеобразования во время охлаждения 6 . Напротив, релаксация зародышеобразования за счет перегруппировки атомов замедляется при скорости охлаждения выше 16,6 × 10 11 К/с. В этой области скорости охлаждения высокая скорость охлаждения предотвращает кристаллизацию жидкости, и происходит превращение стекла. Эти наблюдения согласуются с общей кинетической точкой зрения на фазовое превращение 5 . Удивительно, но мы обнаруживаем аномальное влияние скорости охлаждения на фазовое превращение в узком диапазоне скоростей охлаждения между 16,6 × 10 11 К/с и 6,3 × 10 11 К/с, где кристаллические фракции могут сильно колебаться в зависимости от скорости охлаждения. Из рис. 2б видно, что фазовое превращение очень чувствительно к скорости охлаждения, и доля кристаллов продолжает колебаться в этой области скоростей охлаждения.
0364 11 К/с. В этой области скоростей охлаждения переходная частота зародышеобразования, по-видимому, мало влияет на структурную эволюцию, поскольку скорость релаксации зародышеобразования превышает скорость изменения барьера зародышеобразования во время охлаждения 6 . Напротив, релаксация зародышеобразования за счет перегруппировки атомов замедляется при скорости охлаждения выше 16,6 × 10 11 К/с. В этой области скорости охлаждения высокая скорость охлаждения предотвращает кристаллизацию жидкости, и происходит превращение стекла. Эти наблюдения согласуются с общей кинетической точкой зрения на фазовое превращение 5 . Удивительно, но мы обнаруживаем аномальное влияние скорости охлаждения на фазовое превращение в узком диапазоне скоростей охлаждения между 16,6 × 10 11 К/с и 6,3 × 10 11 К/с, где кристаллические фракции могут сильно колебаться в зависимости от скорости охлаждения. Из рис. 2б видно, что фазовое превращение очень чувствительно к скорости охлаждения, и доля кристаллов продолжает колебаться в этой области скоростей охлаждения. Что еще более важно, более высокая скорость охлаждения больше не будет гарантировать более низкую фракцию кристаллов, чем более низкая скорость охлаждения. Например, кристаллическая фракция твердого тела, закаленного при скорости охлаждения 12,6 × 10 11 К/с выше, чем на скорость охлаждения 11,4 × 10 11 К/с. Чтобы подтвердить эти результаты, были выполнены различные условия моделирования, включая исходные структуры и размер системы для различных систем из чистых металлов, и можно обнаружить, что это явление универсально (дополнительные рисунки S1 и S2). Этот факт показывает, что общее эмпирическое правило нарушается в этой области скоростей охлаждения, убедительно предполагая, что фазовое превращение в этой области умеренных скоростей охлаждения связано с эволюцией атомной структуры, контролируемой не кинетическим фактором, а термической историей различных факторов. скорости охлаждения.
Что еще более важно, более высокая скорость охлаждения больше не будет гарантировать более низкую фракцию кристаллов, чем более низкая скорость охлаждения. Например, кристаллическая фракция твердого тела, закаленного при скорости охлаждения 12,6 × 10 11 К/с выше, чем на скорость охлаждения 11,4 × 10 11 К/с. Чтобы подтвердить эти результаты, были выполнены различные условия моделирования, включая исходные структуры и размер системы для различных систем из чистых металлов, и можно обнаружить, что это явление универсально (дополнительные рисунки S1 и S2). Этот факт показывает, что общее эмпирическое правило нарушается в этой области скоростей охлаждения, убедительно предполагая, что фазовое превращение в этой области умеренных скоростей охлаждения связано с эволюцией атомной структуры, контролируемой не кинетическим фактором, а термической историей различных факторов. скорости охлаждения.
 Некоторые ранее сформированные кластеры растворяются по мере появления других, независимо от типа кристаллической структуры. При температуре ниже 750 К образуются стабильные кристаллоподобные зародыши. Удивительно, но зародыши, достигшие критического размера, действительно появляются при более высокой скорости охлаждения 12,6 × 10 11 К/с, а более медленная скорость 11,4 × 10 11 К/с. Это указывает на то, что в этой области скорости охлаждения зародышеобразование и рост могут определяться термической историей с точки зрения структурных флуктуаций, а не динамикой, подобной диффузии для чистой меди. Мониторинг процесса зародышеобразования с точки зрения изменения размера кристаллоподобных кластеров может дать представление о термодинамике и кинетике зародышеобразования в течение сложной температурно-временной истории. Графики справа на рис. 3 показывают количество и размер зародышей в зависимости от количества кристаллоподобных кластеров при понижении температуры.
Некоторые ранее сформированные кластеры растворяются по мере появления других, независимо от типа кристаллической структуры. При температуре ниже 750 К образуются стабильные кристаллоподобные зародыши. Удивительно, но зародыши, достигшие критического размера, действительно появляются при более высокой скорости охлаждения 12,6 × 10 11 К/с, а более медленная скорость 11,4 × 10 11 К/с. Это указывает на то, что в этой области скорости охлаждения зародышеобразование и рост могут определяться термической историей с точки зрения структурных флуктуаций, а не динамикой, подобной диффузии для чистой меди. Мониторинг процесса зародышеобразования с точки зрения изменения размера кристаллоподобных кластеров может дать представление о термодинамике и кинетике зародышеобразования в течение сложной температурно-временной истории. Графики справа на рис. 3 показывают количество и размер зародышей в зависимости от количества кристаллоподобных кластеров при понижении температуры. Кристаллоподобные кластеры не накапливаются постоянно при повышенном переохлаждении, хотя количество кристаллоподобных кластеров немного больше при более высоких скоростях охлаждения, чем при более низких скоростях охлаждения. Это предполагает уравновешивающую связь между кристаллоподобными кластерами и икосаэдрическими кластерами в переохлажденных жидкостях. Кристаллоподобные кластеры с числом атомов менее четырех нестабильны по сравнению с икосаэдрическими кластерами, часто растворяясь в переохлажденной жидкости 22 . Установлено также, что две жидкие системы с разной скоростью охлаждения по-разному ведут себя при приближении температуры к 775 K, т. е. в переохлажденной жидкости растут некоторые кристаллоподобные кластеры, и кристаллизация происходит при более высокой скорости охлаждения, тогда как неупорядоченная структура сохраняется в переохлажденной жидкости. переохлажденная жидкость с меньшей скоростью охлаждения. Этот результат свидетельствует о том, что в области умеренных скоростей охлаждения образование стабильного кристаллоподобного кластера зависит от его размера, что происходит во время структурных флуктуаций, контролируемых термической историей, а не скоростью охлаждения 22 .
Кристаллоподобные кластеры не накапливаются постоянно при повышенном переохлаждении, хотя количество кристаллоподобных кластеров немного больше при более высоких скоростях охлаждения, чем при более низких скоростях охлаждения. Это предполагает уравновешивающую связь между кристаллоподобными кластерами и икосаэдрическими кластерами в переохлажденных жидкостях. Кристаллоподобные кластеры с числом атомов менее четырех нестабильны по сравнению с икосаэдрическими кластерами, часто растворяясь в переохлажденной жидкости 22 . Установлено также, что две жидкие системы с разной скоростью охлаждения по-разному ведут себя при приближении температуры к 775 K, т. е. в переохлажденной жидкости растут некоторые кристаллоподобные кластеры, и кристаллизация происходит при более высокой скорости охлаждения, тогда как неупорядоченная структура сохраняется в переохлажденной жидкости. переохлажденная жидкость с меньшей скоростью охлаждения. Этот результат свидетельствует о том, что в области умеренных скоростей охлаждения образование стабильного кристаллоподобного кластера зависит от его размера, что происходит во время структурных флуктуаций, контролируемых термической историей, а не скоростью охлаждения 22 . На рис. 4 приведены средние значения потенциальной энергии атомов в кристаллоподобных кластерах при разных температурах для скоростей охлаждения 12,6 × 10 11 К/с и 11,4 × 10 11 К/с. Установлено, что ниже примерно 750 К средние потенциальные энергии атомов в кристаллоподобных кластерах при скорости охлаждения 12,6 × 10 11 К/с ниже, чем при скорости охлаждения 11,4 × 10 11 К/с. с, что способствует росту кристаллоподобных кластеров и запускает кристаллизацию при охлаждении в случае 12,6 × 10 11 К/с скорость охлаждения.
На рис. 4 приведены средние значения потенциальной энергии атомов в кристаллоподобных кластерах при разных температурах для скоростей охлаждения 12,6 × 10 11 К/с и 11,4 × 10 11 К/с. Установлено, что ниже примерно 750 К средние потенциальные энергии атомов в кристаллоподобных кластерах при скорости охлаждения 12,6 × 10 11 К/с ниже, чем при скорости охлаждения 11,4 × 10 11 К/с. с, что способствует росту кристаллоподобных кластеров и запускает кристаллизацию при охлаждении в случае 12,6 × 10 11 К/с скорость охлаждения.
 На рис. 5 представлены контурные карты возникновения конфигурации со значениями Q 6 в зависимости от температуры для скоростей охлаждения (а) 2394,0 × 10 11 К/с, (б) 12,6 × 10 11 К/с и (в) 7,1 × 10 11 К/с соответственно. Эти три случая соответственно представляют образование стекла при высокой скорости охлаждения, кристаллизацию и образование стекла при умеренной скорости охлаждения. Отмечается, что максимальное количество точек на измерение установлено равным 60 для облегчения визуализации.
На рис. 5 представлены контурные карты возникновения конфигурации со значениями Q 6 в зависимости от температуры для скоростей охлаждения (а) 2394,0 × 10 11 К/с, (б) 12,6 × 10 11 К/с и (в) 7,1 × 10 11 К/с соответственно. Эти три случая соответственно представляют образование стекла при высокой скорости охлаждения, кристаллизацию и образование стекла при умеренной скорости охлаждения. Отмечается, что максимальное количество точек на измерение установлено равным 60 для облегчения визуализации. 5а. Это указывает на то, что атомные структуры, характеризуемые симметрией ориентации связей в переохлажденной жидкости и стеклообразном твердом теле, аналогичны таковым в жидком состоянии. Другими словами, конечное металлическое стекло в этом случае получается путем замораживания атомной структуры жидкости в значительной степени без значительной структурной релаксации и флуктуации. Кроме того, замораживание действительно навязчиво, хотя в процессе охлаждения появляются небольшие кристаллоподобные порядки. Однако все обстоит иначе, когда скорость охлаждения снижается до умеренной области. Как показано на рис. 5б,в, значения Q 6 варьируются примерно от 0,1 до 0,4, что находится в типичной области между икосаэдрическим порядком и кристаллоподобным порядком на ранней стадии переохлажденной жидкости. Эти результаты показывают, что локальные атомные структуры с икосаэдрическим порядком и кристаллоподобным порядком постоянно конкурируют друг с другом, поскольку вся система ищет минимум на поверхности потенциальной энергии.
5а. Это указывает на то, что атомные структуры, характеризуемые симметрией ориентации связей в переохлажденной жидкости и стеклообразном твердом теле, аналогичны таковым в жидком состоянии. Другими словами, конечное металлическое стекло в этом случае получается путем замораживания атомной структуры жидкости в значительной степени без значительной структурной релаксации и флуктуации. Кроме того, замораживание действительно навязчиво, хотя в процессе охлаждения появляются небольшие кристаллоподобные порядки. Однако все обстоит иначе, когда скорость охлаждения снижается до умеренной области. Как показано на рис. 5б,в, значения Q 6 варьируются примерно от 0,1 до 0,4, что находится в типичной области между икосаэдрическим порядком и кристаллоподобным порядком на ранней стадии переохлажденной жидкости. Эти результаты показывают, что локальные атомные структуры с икосаэдрическим порядком и кристаллоподобным порядком постоянно конкурируют друг с другом, поскольку вся система ищет минимум на поверхности потенциальной энергии. Основная причина сохранения этого типа конкуренции заключается в том, что изменения ориентации связей для соседних атомов сильно нерезонансны, что можно продемонстрировать плотными контурными линиями, а икосаэдрический порядок и кристаллоподобный порядок передаются каждому. другое, так как кристаллоподобные кластеры, если и появляются в какой-то момент, то неустойчивы из-за своих малых размеров (см. предыдущий раздел). Эта структурная флуктуация в конечном итоге приводит к образованию металлического стекла, когда изменения ориентации связей для соседних атомов остаются сильно нерезонансными в течение всего процесса охлаждения, как показано на рис. 5c. Тем не менее, это не всегда так в области умеренного охлаждения. Из рис. 5б при снижении температуры до 750 К значения Q 6 для нескольких атомов резко увеличиваются в сторону кристаллоподобного порядка при более высокой скорости охлаждения 12,6 × 10 11 К/с. Более того, эти кристаллические порядки, по-видимому, не имеют тенденции возвращаться к икосаэдрическому порядку, а становятся все более и более стабильными, а также запускают стабилизацию кристаллического порядка для других окружающих атомов.
Основная причина сохранения этого типа конкуренции заключается в том, что изменения ориентации связей для соседних атомов сильно нерезонансны, что можно продемонстрировать плотными контурными линиями, а икосаэдрический порядок и кристаллоподобный порядок передаются каждому. другое, так как кристаллоподобные кластеры, если и появляются в какой-то момент, то неустойчивы из-за своих малых размеров (см. предыдущий раздел). Эта структурная флуктуация в конечном итоге приводит к образованию металлического стекла, когда изменения ориентации связей для соседних атомов остаются сильно нерезонансными в течение всего процесса охлаждения, как показано на рис. 5c. Тем не менее, это не всегда так в области умеренного охлаждения. Из рис. 5б при снижении температуры до 750 К значения Q 6 для нескольких атомов резко увеличиваются в сторону кристаллоподобного порядка при более высокой скорости охлаждения 12,6 × 10 11 К/с. Более того, эти кристаллические порядки, по-видимому, не имеют тенденции возвращаться к икосаэдрическому порядку, а становятся все более и более стабильными, а также запускают стабилизацию кристаллического порядка для других окружающих атомов. С увеличением числа атомов в кристаллоподобном кластере возрастает и энергетический барьер процесса обратного превращения кристалла в переохлажденную жидкость 22 . Следовательно, фазовое превращение в области умеренных скоростей охлаждения зависит от структурных флуктуаций, а не от скоростей охлаждения. Хотя он не может подтвердить фазовое превращение при одном заданном процессе охлаждения, можно сделать вывод, что более высокая скорость охлаждения не может гарантировать более низкую долю кристаллов вблизи критической скорости охлаждения. Примечательно, что «неопределенность» здесь связана с независимыми событиями, а не с вероятностью по статистике. Вышеприведенные результаты продемонстрировали совершенно различное поведение эволюции структуры, когда жидкости подвергаются высокой скорости охлаждения и умеренной скорости охлаждения, поэтому мы можем соответственно постулировать два различных механизма образования стекла: i) кинетическое замедление перестройки атомов и структурная релаксация при высоких скоростях охлаждения и ii) конкуренция икосаэдрического порядка с кристаллическим порядком при умеренных скоростях охлаждения.
С увеличением числа атомов в кристаллоподобном кластере возрастает и энергетический барьер процесса обратного превращения кристалла в переохлажденную жидкость 22 . Следовательно, фазовое превращение в области умеренных скоростей охлаждения зависит от структурных флуктуаций, а не от скоростей охлаждения. Хотя он не может подтвердить фазовое превращение при одном заданном процессе охлаждения, можно сделать вывод, что более высокая скорость охлаждения не может гарантировать более низкую долю кристаллов вблизи критической скорости охлаждения. Примечательно, что «неопределенность» здесь связана с независимыми событиями, а не с вероятностью по статистике. Вышеприведенные результаты продемонстрировали совершенно различное поведение эволюции структуры, когда жидкости подвергаются высокой скорости охлаждения и умеренной скорости охлаждения, поэтому мы можем соответственно постулировать два различных механизма образования стекла: i) кинетическое замедление перестройки атомов и структурная релаксация при высоких скоростях охлаждения и ii) конкуренция икосаэдрического порядка с кристаллическим порядком при умеренных скоростях охлаждения.
 NPT MD собирает очень подробную микроскопическую информацию о системе, что позволяет изучать фазовые превращения, а также позволяет изменять форму и объем системы. Временной интервал был установлен равным 1 фс, чтобы интегрировать законы движения Ньютона. МД-моделирование проводилось при повышении температуры от 0 К до 149°С.5 К, что на десять процентов выше температуры плавления меди. После уравновешивания структуры в жидком состоянии в течение 300 пс мы провели два типа моделирования: изотермический отжиг и непрерывное охлаждение. Исходные жидкие структуры были приготовлены путем увеличения времени установления равновесия на 0 пс, 1 пс и 10 пс соответственно при температуре 1495 K. K с интервалом 50 K. Этот диапазон был выбран из-за его близости к прогнозируемой температуре носа 700 K, согласно нашим наблюдениям при изучении фазового превращения при охлаждении. Для моделирования непрерывного охлаждения система непрерывно охлаждалась до 298 К при скоростях охлаждения от 4,0 × 10 11 К с −1 до 2394,0 × 10 11 К/с.
NPT MD собирает очень подробную микроскопическую информацию о системе, что позволяет изучать фазовые превращения, а также позволяет изменять форму и объем системы. Временной интервал был установлен равным 1 фс, чтобы интегрировать законы движения Ньютона. МД-моделирование проводилось при повышении температуры от 0 К до 149°С.5 К, что на десять процентов выше температуры плавления меди. После уравновешивания структуры в жидком состоянии в течение 300 пс мы провели два типа моделирования: изотермический отжиг и непрерывное охлаждение. Исходные жидкие структуры были приготовлены путем увеличения времени установления равновесия на 0 пс, 1 пс и 10 пс соответственно при температуре 1495 K. K с интервалом 50 K. Этот диапазон был выбран из-за его близости к прогнозируемой температуре носа 700 K, согласно нашим наблюдениям при изучении фазового превращения при охлаждении. Для моделирования непрерывного охлаждения система непрерывно охлаждалась до 298 К при скоростях охлаждения от 4,0 × 10 11 К с −1 до 2394,0 × 10 11 К/с.
 В этой работе мы использовали Q 6 для определения тенденции кристаллоподобного порядка и икосаэдрического порядка.
В этой работе мы использовали Q 6 для определения тенденции кристаллоподобного порядка и икосаэдрического порядка. , Ван, Дж., Шэн, Х., Чжан, З. и Мао, С. X. Формирование моноатомных металлических стекол путем сверхбыстрой закалки в жидкости. Природа 512 , 177–180 (2014).
, Ван, Дж., Шэн, Х., Чжан, З. и Мао, С. X. Формирование моноатомных металлических стекол путем сверхбыстрой закалки в жидкости. Природа 512 , 177–180 (2014). Влияние быстротечности зародышеобразования на кинетику кристаллизации в сильно неравновесных условиях. J. Chem. физ. 117 , 10739–10743 (2002).
Влияние быстротечности зародышеобразования на кинетику кристаллизации в сильно неравновесных условиях. J. Chem. физ. 117 , 10739–10743 (2002). физ. Преподобный Письмо . 79 , 2486–2489 (1997).
физ. Преподобный Письмо . 79 , 2486–2489 (1997). Х., Хаманн, Дж., Хеберт, Р. Дж., Рёснер, Х. и Уайльд, Г. Реакции аморфизации и расстеклования в сплавах металлического стекла. Матер. науч. Eng . 449–451 , 84–89 (2007).
Х., Хаманн, Дж., Хеберт, Р. Дж., Рёснер, Х. и Уайльд, Г. Реакции аморфизации и расстеклования в сплавах металлического стекла. Матер. науч. Eng . 449–451 , 84–89 (2007). Филос. Маг. 88 , 1723–1750 (2008).
Филос. Маг. 88 , 1723–1750 (2008). А. и Истерлинг, К. Е. Фазовые превращения в металлах и сплавах , Третье издание (пересмотренное переиздание). Тейлор и Фрэнсис (1992).
А. и Истерлинг, К. Е. Фазовые превращения в металлах и сплавах , Третье издание (пересмотренное переиздание). Тейлор и Фрэнсис (1992). Ориентационный порядок связей в жидкостях: к единому описанию водоподобных аномалий, перехода жидкость-жидкость, стеклования и кристаллизации. евро. физ. JE 35 , 1–84 (2012).
Ориентационный порядок связей в жидкостях: к единому описанию водоподобных аномалий, перехода жидкость-жидкость, стеклования и кристаллизации. евро. физ. JE 35 , 1–84 (2012). R. China
R. China J. Liu
J. Liu
