Содержание
Автомобильный аккумулятор — устройство, схема, принцип работы и параметры АКБ
Аккумулятор или сокращённо (АКБ), очень важная деталь в любом автомобиле. Нет ни одной машины с двигателем внутреннего сгорания, где бы его не было.
Он отвечает за всё электрооборудование машины и без него она просто мертва. Далее рассмотрим, что же это такое и из чего он состоит.
Содержание статьи:
- 1 Что такое АКБ для автомобиля, предназначение
- 2 Из чего сделан и что внутри аккумулятора
- 3 Принцип работы АКБ
- 4 Особенности конструкции современных АКБ
- 5 Параметры и характеристики аккумуляторной батареи
- 6 Аккумуляторы будущего
Что такое АКБ для автомобиля, предназначение
То, что аккумулятор отвечает за всё электрооборудование в машине, было указано выше, но тут не всё так просто и однозначно. Главная задача батареи обеспечить запуск силового агрегата.
Когда двигатель запущен вся бортовая сеть запитывается от генератора. В середине 20-го века и даже ближе к его концу были двигатели внутреннего сгорания без аккумуляторов, например, моторы мотоциклов. В них запуск осуществлялся за счёт мускульной силы, а дальше все системы работали уже от генератора.
В середине 20-го века и даже ближе к его концу были двигатели внутреннего сгорания без аккумуляторов, например, моторы мотоциклов. В них запуск осуществлялся за счёт мускульной силы, а дальше все системы работали уже от генератора.
Однако в последнее время, с насыщением автомобилей различными электроприборами, мультимедийными центрами или климатическими системами, генераторы не всегда справляются с обеспечением их энергией. В этом случае подпитка идёт от АКБ.
Но вернёмся к основному предназначению батареи. Как бы там не было главная задача по-прежнему остаётся это обеспечение электроэнергией стартера двигателя.
Читайте также: Что делать если при зарядке аккумулятор начинает кипеть?
При запуске, особенно в холодное время года, батарея серьёзно разряжается. Однако генератор кроме питания электроэнергией бортовой сети машины ещё и обеспечивает зарядку батареи.
Поэтому если генератор вышел из строя, то АКБ очень быстро разряжается.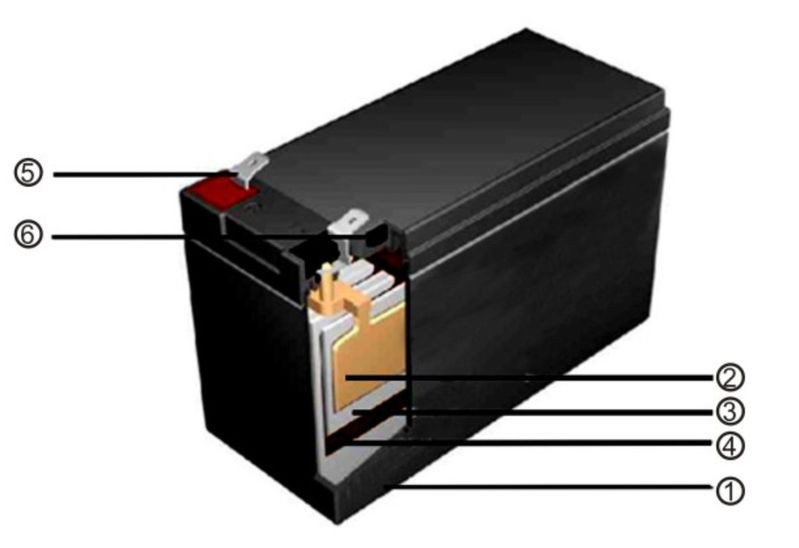 Новой заряженной батареи хватает не более чем на 100 км пробега. Во всех остальных случаях машина с неисправным генератором пройдёт ещё меньше.
Новой заряженной батареи хватает не более чем на 100 км пробега. Во всех остальных случаях машина с неисправным генератором пройдёт ещё меньше.
Из чего сделан и что внутри аккумулятора
Не смотря, на весь технический прогресс, до сих пор, в автомобилях, используются аккумуляторные батареи, изобретённые в середине 19-го века.
Изобретателем АКБ считается Гастон Планте, которые изобрёл его в 1860 году. Ну а современный вид батареи приобрели в 1878 году, после того как его усовершенствовал Камилл Фор.
С этого времени батареи принципиально не менялись, все изменения были только косметическими, касающиеся их внешнего вида и качества изготовления элементов конструкции.
Данные аккумуляторы называются свинцово-кислотными, и в названии заключается описание принципа действия этих устройств.
Рисунок 19 века, на котором показан один из первых аккумуляторов в разрезе.
Итак, аккумулятор состоит из следующих основных частей:
- Корпуса;
- Крышки;
- Отрицательных электродов;
- Положительных электродов;
- Положительной клемы;
- Отрицательной клемы;
- Соединительных перемычек;
- Заливных пробок;
- Электролита
Далее рассмотрим каждый элемент конструкции.
Итак, корпус и крышка батареи состоит из нейтрального к кислоте пластика.
Отрицательные пластины, впрочем, как и положительные состоят из металлического свинца и выполнены в виде решётки.
В отрицательной пластине, промежутки свинцовой решётки заполнены металлическим свинцом, в виде спрессованного порошка. В положительной – спрессованным порошком диоксида свинца (PbO2).
В промежутке между пластинами располагаются сепараторы, которые представляют собой микропористые пластины, сделанные из эбонита или ревертекса. Оба материала можно считать неким вариантом резины, и делаются они из каучука.
Задача сепараторов заключается в том, чтобы разделять положительные и отрицательные электроды и препятствовать их короткому замыканию, которое может произойти в результате вибраций двигателя и всего автомобиля.
Обе клеммы сделаны из металлического свинца и через них происходит подсоединение батареи к бортовой сети машины.
Читайте также: Что делать если разрядился аккумулятор в машине — проверенные способы как вернуть жизнь АКБ
Соединительные перемычки, так же выполнены из свинца и служат для объединения разных банок в единую батарею.
Для чего нужна заливная пробка, легко догадаться из названия этой детали. Она служит для заливки электролита в банки АКБ.
Ну и последняя в списке, но при этом одна из самых главных деталей аккумулятора является электролит. Он состоит из 30 % раствора серной кислоты (h3SO4) и дистиллированной воды.
Принцип работы АКБ
Принцип работы аккумулятора основан на электрохимической реакции окисления свинца в растворе серной кислоты и воды.
При разрядке батареи на положительной пластине происходит окисление металлического свинца, при этом на отрицательной пластине восстанавливается уже диоксид свинца.
При зарядке происходит обратный процесс, количество диоксида свинца на отрицательной пластине уменьшается, а на положительной пластине увеличивается количество металла.
Так же при разрядке АКБ уменьшается количество серной кислоты в электролите и увеличивается количество воды. При зарядке так же происходит обратный процесс.
Особенности конструкции современных АКБ
youtube.com/embed/4klbAhYLQnU?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>
Не смотря на то что, принципиально, аккумуляторы, за более чем 150 лет, не изменились, современность внесла серьёзные изменения в технологию их изготовления и в материалы, из которых они делаются.
Рассмотрим их по отдельности:
- Пластины
Сегодня на наиболее качественных батареях небольшие изменения претерпел материал пластин. Теперь пластины делают не из чистого свинца, а из его сплава с серебром. При этом появилась возможность снизить массу батареи на треть, а срок её службы увеличить на 20 %.
Кроме этого, изменилась сама технология их изготовления. Если первые пластины производились путём их литья, то сегодня их делают из тонкого свинцового листа, путём штамповки. Такой метод дешевле и при этом пластины получаются прочнее и тоньше.
- Сепараторы
Одной из причин выхода АКБ из строя является короткое замыкание положительных и отрицательных пластин.
Замыкание происходит из-за того, что из пластин осыпается активная зона и внизу банок она замыкает. Во избежание этого сепараторы делают в виде конвертов, запаянных снизу, под пластинами. Таким образом, когда активная зона осыпается она остаётся внутри конверта и не замыкает.
В материал же самих сепараторов сегодня добавляется стекловолокно. Это так же позволяет делать их тоньше и прочнее.
- Электролит
Как было указано выше, электролит представляет собой раствор серной кислоты и воды. Под действием низких температур, как известно вода замерзает, однако с электролитом этого не происходит.
Но он всё равно заметно загустевает и теряет свои свойства, из-за чего ёмкость батареи заметно снижается. Что бы избежать этого, сегодня, в электролит добавляют разнообразные присадки.
- Гелевые электролиты
Аккумуляторы с гелиевыми электролитами можно считать вершиной эволюции кислотных батарей и именно поэтому для них, отведен отдельный раздел. Такие АКБ называются попросту, гелевыми. В этих устройствах электролит модифицирован настолько, что представляет собой нечто наподобие желе.
Такие АКБ называются попросту, гелевыми. В этих устройствах электролит модифицирован настолько, что представляет собой нечто наподобие желе.
Такая модификация, в комплексе с другими вышеописанными инновациями дала поистине волшебные результаты. Батареи стали практически вечными, невосприимчивыми к переворачиванию, практически не теряющими свои свойства зимой и при этом на много легче по массе.
Читайте также: Как правильно менять Антифриз в машине
Правда цена по сравнению с аккумуляторами старого поколения возросла от 5 до 10 раз. Но это того стоит. И всё равно стоят они не запредельные деньги, где-то в пределах 100 – 200 условных единиц.
Параметры и характеристики аккумуляторной батареи
Параметры и характеристики аккумуляторов зашифрованы в их маркировке и сейчас мы разберём, что она обозначает.
Этот вопрос мы рассмотрим на примере самой распространённой АКБ 6СТ-55.
Итак, в названии аккумулятора, цифра 6 обозначает, что АКБ состоит из 6-и банок.
- СТ – обозначает что батарея стартерная.
- 55 – обозначает ёмкость батареи, которая составляет 55 Ампер*час.
Для того что бы понимать какой аккумулятор вам нужен, необходимо знать два параметра:
- Тип ДВС;
- Объём двигателя вашей машины;
Далее рассмотрим для каких двигателей, какие аккумуляторы подходят. Это таблица для бензиновых моторов:
- Двигатели объёмом до 1,6 литра. Для них подходят АКБ 6СТ-45;
- Двигатели объёмом от 1,6 до 2,5 литров. Для них подходит 6СТ-55;
- Двигатели объёмом от 2,5 до 3 литров. Для них подходит 6СТ-60;
- Двигатели объёмом от 3 до 3,5 литров. Для них подходит 6СТ-75;
- Двигатели объёмом более 3,5 литров. Для них подходит 6СТ-90.
Для дизельных силовых агрегатов эти параметры несколько иные:
- Двигатели объёмом до 1,5 литра. Для них подходит 6СТ-55;
- Двигатели объёмом от 1,5 до 2,0 литров. Для них подходит 6СТ-60;
- Двигатели объёмом от 2-х до 2,7 литров.
 Для них подходит 6СТ-75;
Для них подходит 6СТ-75; - Двигатели объёмом от 2,7 до 3,5 литров. Для них подходит 6СТ-90;
- Двигатели объёмом от 3,5 до 6,5 литров. Для них подходит 6СТ-132;
- Двигатели объёмом более 6,5 литров. Для них подходит 6СТ-192 и больше.
Как можно увидеть, из-за разных принципов работы дизельных и бензиновых двигателей для них используются аккумуляторы разной ёмкости.
Для дизельных силовых агрегатов вам потребуются более ёмкие батареи.
Аккумуляторы будущего
Как уже упоминалось выше современные батареи по принципу действия точно такие же, как те, что были разработаны в середине 19-го века.
Однако технологии не стоят на месте и, судя по всему, в самое ближайшее время для двигателей внутреннего сгорания (ДВС) появятся АКБ, созданные на новых принципах. Далее они будут бегло перечислены.
- Гелевые аккумуляторы
Об этих батареях достаточно подробно было рассказано выше. Эти батареи уже продаются, и их любой может купить.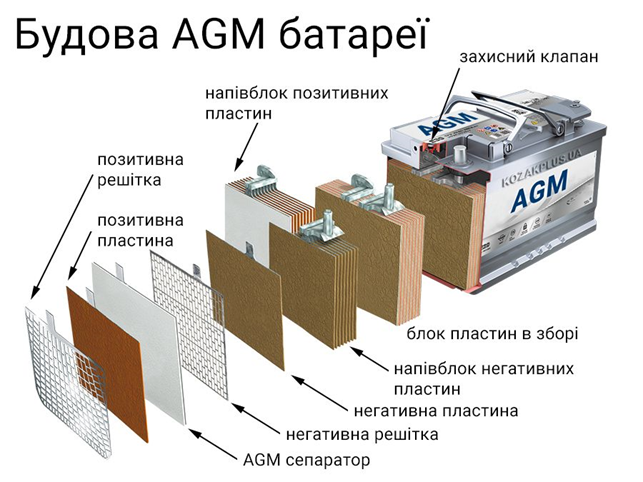
Гелевая АКБ
- Литий-ионные аккумуляторы
Эти батареи широко известны по мобильным телефонам и иным гаджетам. Однако, сегодня, существуют разработки и для автомобилей. Но, не смотря на все свои достоинства, в автотехнике данный вид АКБ не прижился из-за ряда принципиальных недостатков.
- Во-первых, они резко теряют свою мощность из-за низкой температуры.
- Во-вторых, для зарядки таких батарей требуется строгое соответствие зарядному току, что требует переделки электронной части генераторов.
- Ну и самое главное, данные АКБ имеют стоимость в 15 раз дороже обычного кислотного аккумулятора.
Литий-ионная АКБ, чешской компании Варта
- Графен-полимерные аккумуляторы
Это, пожалуй, самые перспективные батареи для использования, как в автомобилях, оснащённых ДВС, так и электрической силовой установкой. В производстве этих АКБ использованы нанотехнологии.
Эти аккумуляторы имеют поистине чудесные свойства. Они имеют ёмкость, практически в три раза больше литий-ионных и при этом на много меньшую стоимость, так как в их производстве не используется дорогостоящий литий. Кроме этого они не теряют своих свойств под действием низких температур.
Опытная графен-полимерная АКБ
Резюме: Выше перечислены только три самых раскрученных или правильней будет сказать, распиаренные технологии.
В мире ведутся работы над батареями, известно что в разработке более тридцати новых схем. Не исключено, что среди этих ещё испытывающихся аккумуляторов могут оказаться некоторые с ещё более интересными свойствами. Как говорится поживем — увидим.
Устройство и принцип работы аккумулятора автомобиля
Аккумулятор — это важнейшая деталь машины, поэтому поддержание батареи в исправном состоянии будет являться залогом эффективного запуска двигателя, а также бесперебойной работы бортовых потребителей электричества. Чтобы правильно эксплуатировать АКБ необходимо ознакомиться с основными принципами работы этого устройства. В этой статье будут подробно рассказано, как устроен автомобильный аккумулятор.
Чтобы правильно эксплуатировать АКБ необходимо ознакомиться с основными принципами работы этого устройства. В этой статье будут подробно рассказано, как устроен автомобильный аккумулятор.
Содрежание
- Из чего состоит аккумулятор
- Как устроен аккумулятор
- Принцип работы аккумулятора
- Особенности конструкций
Из чего состоит аккумулятор
Автомобильный элемент питания собирается на заводе из многих элементов, поэтому для понимания принципа работы источника электрического тока необходимо знать назначение каждого компонента. Аккумуляторная батарея состоит из следующих частей.
Корпус. Современная АКБ изготавливается из ударопрочного полипропилена. Этот материал хорошо переносит не только повышенные механические нагрузки и вибрации, но и устойчив к воздействую кислоты, которая в виде раствора заполняет внутренние полости батареи. Кроме этого полипропилен устойчив к большим перепадам температуры. Корпус АКБ разделён на 6 герметически отделённых между собой секций, в которые, в процессе изготовления батареи, устанавливаются свинцовые электроды и сепараторы.
Сепараторы. Сепараторы устанавливаются между электродами и служат диэлектриками, которые надёжно предохраняет элементы батареи от короткого замыкания. Эти элементы также изготавливаются из кислотоустойчивого полимера, который не разрушается при воздействии агрессивной среды в течение всего времени эксплуатации АКБ.
Электроды. В большинстве выпускаемых аккумуляторных батарей используются свинцовые пластины с различными примесями, в ячейках которых находится масса, состоящая из свинцового порошка и серной кислоты. Пластины современных аккумуляторов могут быть изготовлены из свинца легированного кальцием, что позволяет значительно увеличить ресурс батареи.
Электролит. Электролит представляет собой раствор серной кислоты и дистиллированной воды. Эта жидкость необходима для того, чтобы электрический ток свободно протекал от отрицательных электродов к положительным. В дорогих батареях вместо жидкого электролита он может быть запечатанным использован гель. Благодаря этим качествам гелевые аккумуляторы выпускаются в виде полностью необслуживаемых изделий.
Благодаря этим качествам гелевые аккумуляторы выпускаются в виде полностью необслуживаемых изделий.
Клеммы. У всех батарей имеются клеммы, они могут быть разных типов стандартные (европейские), ASIA (тонкие конусы для азиатских автомобилей) и винтовые (для американских автомобилей). Изредка можно встреть батареи с четырьмя клеммами на корпусе.
Дополнительный функционал:
- У необслуживаемых батарей вместо стандартных шести пробок по бокам имеются 2 клапана сброса давления (в случае закипания электролита через них будет сбрасываться газ).
- Некоторые аккумуляторы оснащены «глазком», с помощью которого можно легко определить степень заряженности и уровень электролита.
Как устроен аккумулятор
Аккумуляторная батарея устроена таким образом, чтобы в результате подачи на её клеммы постоянного тока происходило эффективное накапливание электрической энергии. Автомобильная АКБ состоит из 6 изолированных друг от друга ёмкостей, в которых находятся отрицательные и положительные пластины, отделённые между собой сепараторами.
Каждая такая банка позволяет аккумулировать электрический ток напряжением до 2,1 В. Для получения стандартного напряжения бортовой сети автомобиля, применяется схема последовательного подключения таких электрических элементов. Немаловажной особенностью современных кислотных аккумуляторов является полная герметизация корпуса изделия. Несмотря на невозможность обслуживания устройств накопления электроэнергии этого типа, их функциональность и безопасность использования находится на более высоком уровне по сравнению с изделиями с пробками.
Принцип работы аккумулятора
Автомобильный свинцовый аккумулятор представляет собой восстанавливаемый химический элемент питания, в котором образование электричества происходит в результате реакции между двуокисью свинца, губчатым свинцом и раствором серной кислоты.
При подаче постоянного тока на клеммы аккумулятора на отрицательных пластинах образуется чистый свинец, а на положительных – диоксид свинца. При подключении батареи к различным устройствам и агрегатам, потребляющим электроэнергию, происходит обратный процесс, при котором на отрицательных электродах образуется сульфат свинца, а из электролита высвобождается чистая вода.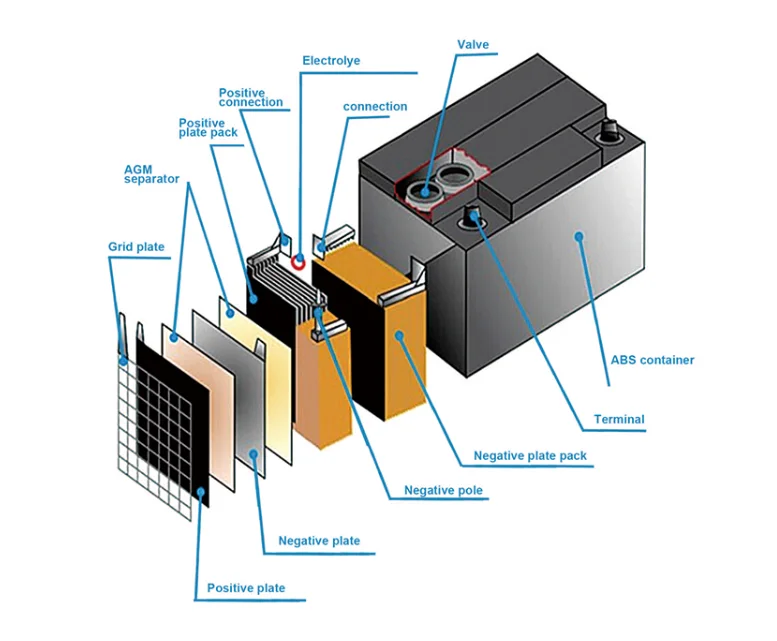
В зависимости от типа аккумуляторной батареи такая последовательность может повторяться тысячи раз, прежде чем произойдёт сульфатация или разрушение пластин.
Особенности конструкций
Аккумуляторные батареи могут существенно отличаться друг от друга. К особенностям конструкции АКБ можно отнести:
- Размер аккумулятора.
- Состав металлического сплава пластин.
- Вид электролита.
- Расположение электрических выводов на корпусе.
От размера пластин и количества электролита в каждой банке будет зависеть ёмкость АКБ, поэтому изделия, устанавливаемые для запуска дизельных установок грузовых автомобилей, могут в несколько раз превышать по массе и объёму батареи для легковых авто.
От вида свинцового сплава будет зависеть внутреннее электрическое сопротивление батареи и устойчивость элемента к воздействию агрессивной среды. Также состав металла будет влиять на интенсивность испарения влаги, поэтому для необслуживаемых моделей пластины изготавливаются из легированного кальцием свинца.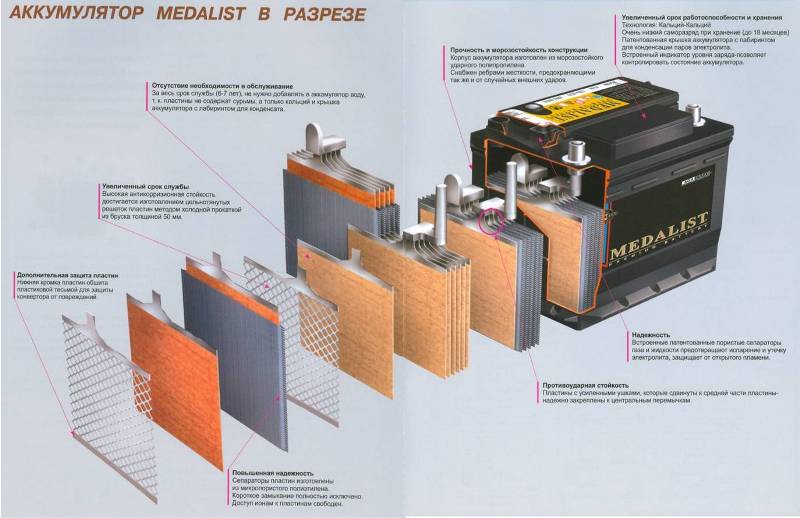
От вида электролита, применяемого в банках аккумулятора, также зависит большое количество параметров батареи. Жидкий раствор замерзает при низких температурах воздуха, а при кипении приводит к испарению воды, поэтому замена его на гель позволяет существенно увеличить ресурс изделий. Гелевые аккумуляторы значительно лучше переносят глубокий разряд, что позволяет использовать их не только в качестве пусковых устройств, но и для питания силовых электрических установок.
Аккумуляторы могут отличаться и по расположению клемм на корпусе. Этот параметр следует обязательно учитывать при подборе новой АКБ, иначе потребуется удлинять плюсовой провод автомобиля, подключаемый к источнику питания.
Аккумуляторная батарея автомобиля — назначение, устройство и типы
Главная / Учебник по устройству автомобиля / Глава 10. Электрооборудование и электросистемы » Подраздел 10.2 Аккумуляторная батарея (АКБ). Назначение, устройство и типы
Назначение аккумуляторной батареи
Аккумуляторная батарея обеспечивает электрическим током все потребители, пока двигатель не работает или работает на очень малых оборотах, также является резервным источником питания в случае выхода из строя генератора.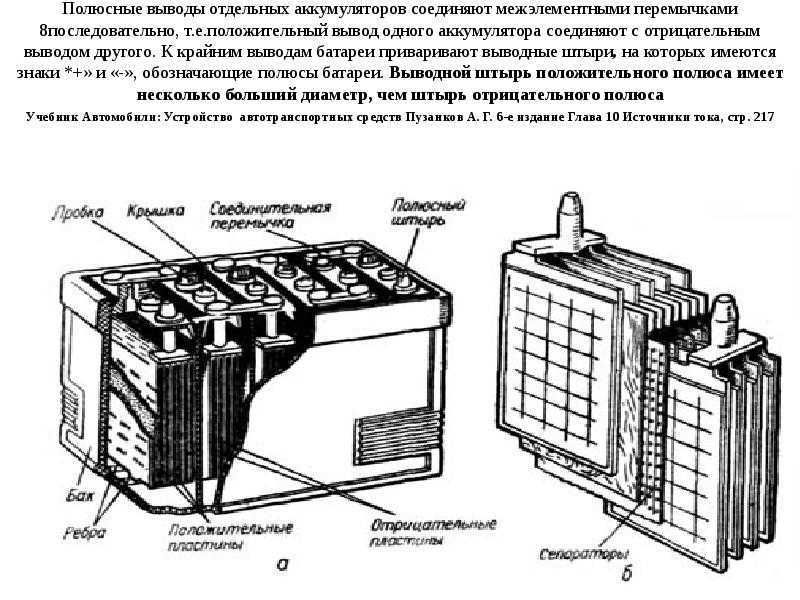
Внимание
В случае выхода из строя генератора не стоит затягивать с его ремонтом, необходимо сразу решать возникшую проблему. Длительное использование исключительно АКБ может вывести ее из строя, причем в самый неподходящий момент.
Одним из основных функциональных назначений АКБ является пуск двигателя с помощью стартера.
Устройство аккумуляторной батареи
В аккумуляторной батарее происходит преобразование химической энергии в электрическую. Химия в том, что взяли и поместили в раствор серной кислоты две пластины, состоящие из свинца, и на пластинах сделали выводы (рисунок 10.1). Подсоединили к выводам два провода от генератора, начали вращать его, чтобы тот выделял электрический ток и зарядили АКБ (пока аккумулятор заряжается, он является потребителем тока). В данном случае электрическая энергия преобразовалась в химическую – аккумулятор зарядился. Отсоединили от выводов генератор и подсоединили, например, лампочку, и она загорелась! Потому что начался процесс преобразования химической энергии в электрическую. Прелесть данной конструкции в том, что процессы зарядки и разрядки можно производить многократно. И если соблюдать основные, довольно несложные, правила эксплуатации АКБ, она может прослужить долгое время.
Прелесть данной конструкции в том, что процессы зарядки и разрядки можно производить многократно. И если соблюдать основные, довольно несложные, правила эксплуатации АКБ, она может прослужить долгое время.
Простейший аккумулятор состоит из двух пластин, помещенных в корпус (его еще называют банкой), этот корпус заполнен раствором серной кислоты (который называется электролитом) и закрыт сверху крышкой. В крышке имеются отверстия, через которые выведены по два вывода от каждой из пластин (положительный и отрицательный).
Рисунок 10.1 Принцип работы аккумуляторной батареи.
Любая АКБ состоит из нескольких (чаще шести) простейших батарей, описанных выше. Почему именно шести? Бортовая сеть автомобиля рассчитана на 12 вольт, а значит и аккумуляторная батарея должна выдавать столько же. Ввиду своих габаритных размеров одна банка (две пластины) обеспечивает напряжение приблизительно в 2 вольта. Для получения 12 вольт положительные и отрицательные пластины соединяют последовательно и делают два общих вывода – положительный и отрицательный (смотрите рисунок 10. 2).
2).
Примечание
Аккумуляторная батарея должна иметь такие габаритные размеры, чтобы оптимально вписаться в ограниченное пространство моторного отсека автомобиля.
Рисунок 10.2 Устройство аккумуляторной батареи.
На многих современных автомобилях для предотвращения кражи головного модуля аудиосистемы существует своеобразная защита, которая блокирует аудиомагнитолу после отключения отрицательной клеммы от аккумуляторной батареи. Чтобы магнитола заработала, в нее необходимо ввести определенный код – ключ. Если вы приобретаете новый автомобиль, данный код вам вручат в салоне, если покупаете машину с рук, необходимо уточнить у владельца наличие такого кода.
Примечание
Стоит помнить, что в некоторых современных автомобилях после отключения АКБ и повторного подключения бортовой компьютер может вывести сообщение об ошибке, которое можно сбросить с помощью специализированного оборудования на СТО.
Типы АКБ
По принципу необходимости обслуживания аккумуляторные батареи разделяют на: обслуживаемые и необслуживаемые. Одним из подтипов обслуживаемых стали малообслуживаемые АКБ. На данный момент применение обслуживаемых АКБ сведено к минимуму. Названия типов аккумуляторных батарей говорят сами за себя.
Одним из подтипов обслуживаемых стали малообслуживаемые АКБ. На данный момент применение обслуживаемых АКБ сведено к минимуму. Названия типов аккумуляторных батарей говорят сами за себя.
Основа свинцово-кислотных АКБ, о которых идет речь в данной главе, — жидкий электролит. Однако технологии производства батарей шагнули далеко вперед и сейчас довольно часто можно встретить АКБ, выполненные на базе технологии AGM, в которой сам электролит абсорбирован в стеклянных волокнах. Также не стоит забывать и о набирающих популярность гелевых АКБ (GEL), в них электролит загущен с помощью силикагеля до гелеобразного состояния.
Из-за большого многообразия типов АКБ возникло много споров относительно эффективности и стойкости каждого из них. Если по существу, то нет одного, идеального для всех эксплуатационных условий аккумулятора. Ибо, выигрывая в чем-то одном, любой тип АКБ обязательно существенно проигрывает в чем-нибудь другом. Так, например, столь популярные необслуживаемые «кальциевые» аккумуляторы имеют очень низкие показатели саморазряда и не требуют к себе какого-либо внимания, однако они очень сильно «боятся» глубоких разрядов (как пример, при многократных коротких поездках в зимний период). С такими разрядами АКБ такого типа придет в непригодность за очень короткий период эксплуатации. А вот малообслуживаемые АКБ глубоких разрядов не боятся, но взамен требуют регулярной доливки дистиллированной воды (в среднем, раз в полгода).
С такими разрядами АКБ такого типа придет в непригодность за очень короткий период эксплуатации. А вот малообслуживаемые АКБ глубоких разрядов не боятся, но взамен требуют регулярной доливки дистиллированной воды (в среднем, раз в полгода).
Примечание
Во время зарядки АКБ происходит закипание электролита, но закипание не в бытовом понимании этого слова, просто происходит расщепление воды на кислород и водород (появляются пузырьки). Составная часть электролита – вода – выкипает, а плотность электролита, соответственно, растет. Чтобы привести плотность электролита в норму, доливают дистиллированную воду.
Внимание
Одной из существенных опасностей при плановой зарядке АКБ является выделение водорода из электролита. И вроде мало, но и взорваться может. Поэтому при обслуживании и эксплуатации АКБ необходимо соблюдать все меры предосторожности.
Основные характеристики АКБ
Полярность указывает на расположение отрицательного и положительного выводов батареи. Полярность бывает прямой и обратной.
Полярность бывает прямой и обратной.
Примечание
Чтобы узнать, какая полярность на вашей АКБ, установите ее к себе той стороной, ближе к которой смещены выводы. Посмотрите, какой из выводов обозначен знаком «+», а какой — знаком «-». Если «+» находится слева, значит полярность прямая, если справа – обратная.
Номинальная емкость (обозначается С20) — количество электричества (в А·ч), которое способна отдать АКБ при 20-часовом режиме разряда током, численно равным 0,05 номинальной емкости до напряжения на выводах 10,5 В при температуре электролита 25 °С.
Внимание
Следует всегда помнить о том, что на автомобиль следует устанавливать АКБ той емкости, которая указана заводом-изготовителем транспортного средства. В принципе, ничего страшного не случится, и первое время будет радовать резвый пуск двигателя, но не стоит забывать о том, что возможности генератора не безграничны, а условия эксплуатации автомобиля могут быть очень суровы. Как следствие, батарея большей емкости будет постоянно недополучать энергию для восстановления — не будет заряжаться на 100%, что в скором времени приведет к выходу ее из строя.
Резервная емкость (обозначается Cр) – время разряда в минутах полностью заряженной батареи током 25 А до напряжения 10,5 В при температуре электролита 25 °С.
Примечание
Резервная емкость в 1,63 раза больше номинальной в числовом выражении (так, для АКБ емкостью 55 А·ч она составляет приблизительно 90 минут). Это время, в течение которого полностью заряженная батарея может обеспечивать электроэнергией минимальное количество потребителей, необходимых для безопасного движения автомобиля в случае отказа генератора.
Ток холодной прокрутки (Iх.п.) – по ГОСТу (ДСТУ) 959-2002 – это ток разряда, который способна отдать батарея при температуре электролита минус 18 °С в течение 10 секунд при напряжении не менее 7,5 В. Чем выше данный параметр, тем лучше двигатель будет пускаться зимой, однако по причине увеличения нагрузки на стартер может снизиться его ресурс.
Примечание
Величина тока холодной прокрутки зависит от методики ее измерения. Примерное соответствие значений тока холодной прокрутки, определенного по разным стандартам, приведено в таблице ниже.
Примерное соответствие значений тока холодной прокрутки, определенного по разным стандартам, приведено в таблице ниже.
| DIN 43559, ГОСТ 959-91 | 170 | 200 | 225 | 255 | 280 | 310 | 335 | 365 | 395 | 420 |
| EN 60095-1, ГОСТ 959-2002 (Россия) | 280 | 330 | 360 | 420 | 480 | 520 | 540 | 600 | 640 | 680 |
| SAE J537 | 300 | 350 | 400 | 450 | 500 | 550 | 600 | 650 | 700 | 750 |
Одним из основных показателей, характеризующих рабочее состояние АКБ, является плотность электролита. Она должна быть всегда в определенном диапазоне. Если АКБ малообслуживаемая, то летом плотность немного понижают, а вот зимой, чтобы исключить вероятность замерзания электролита, повышают.
Примечание
Плотность электролита измеряется специальным прибором – ареометром.
При покупке АКБ
Допустим, вы решили заменить источник питания. Придя, например, в магазин автозапчастей, определились с моделью. Теперь внимательнее. Спросите сначала АКБ сухозаряженный (без электролита) или залитый электролитом и заряженный. В первом случае срок хранения на складе не должен превышать трех лет, во втором – полугода.
Посмотрите на дату изготовления АКБ и если с даты производства прошло более одного года, выполните, по возможности, следующие проверки:
- осмотрите корпус на наличие повреждений;
Для залитых и заряженных
- уровень электролита должен находиться между метками «min» и «max» (корпус из полупрозрачного пластика) или быть выше примерно на 15 – 20 мм от верхнего торца пластин;
- плотность электролита должна составлять 1,25–1,26 г/см3 при 25±5 °С;
Маркировка АКБ
Рисунок 10.3 Маркировка АКБ по отечественному стандарту.
Рисунок 10.4 Маркировка АКБ по европейскому стандарту EN 60095-1.
Рисунок 10.5 Маркировка АКБ по американскому стандарту SAE J537.
Для всех
- цвет индикатора заряженности (если такой есть в наличии) должен быть зеленым;
- напряжение на выводах без нагрузки должно быть не менее 12,6 В.
Внимание
Так или иначе, но в наличии должна быть инструкция по эксплуатации на русском или украинском языке и гарантийный талон с указанными условиями гарантии.
Не стесняйтесь требовать от продавца выполнения описанных выше проверок, ведь автомобильная АКБ это не батарейка в плеер, и приобретается не на один месяц, причем от качества АКБ зависит работа всех электрических систем автомобиля.
Подраздел 10.1 Общие сведения | Система пуска. Стартер, его устройство и работа График технического обслуживания автомобиля | Подраздел 10.3 Обслуживание АКБ. Техника безопасности при обслуживании АКБ |
Please enable JavaScript to view the comments powered by Disqus.
comments powered by Disqus
принцип работы аккумуляторной батареи, устройство АКБ автомобиля, типы устройств
Независимые элементы питания сейчас стали одними из наиболее востребованных устройств, изобретённых людьми. Конструкция большинства гаджетов и их назначение часто предполагает отсутствие непрерывного доступа к электросети, поэтому и стали необходимыми такие устройства, как аккумуляторы. Они дают возможность пользоваться нужными приборами в любых требуемых условиях.
Содержание
- Что называют аккумулятором
- Разряд элемента питания
- Цикл заряда батареи
- Типы соединения аккумуляторов
- Параллельное соединение
- Последовательный способ
- Типы источников тока
- Основные характеристики
- Устройство электродов
- Проводящее вещество
- Области применения АКБ
Что называют аккумулятором
Аккумулятором в самом общем значении этого понятия называется техническое приспособление, которое используется для накопления какого-либо вида энергии с целью её последующей равномерной отдачи в течение достаточно длительного периода времени (в отличие от конденсатора, который отдаёт накопленный заряд моментально). Конденсатор сохраняет непосредственно электрический заряд, в отличие от аккумулятора, который при зарядке преобразует электрическую энергию в энергию химической реакции, а когда будет работать под нагрузкой, превратит накопленную химическую энергию в электрическую.
Конденсатор сохраняет непосредственно электрический заряд, в отличие от аккумулятора, который при зарядке преобразует электрическую энергию в энергию химической реакции, а когда будет работать под нагрузкой, превратит накопленную химическую энергию в электрическую.
Принцип работы аккумуляторной батареи заключается в том, что постоянно происходит химическая реакция между жидкостью-электролитом и металлическими пластинами-электродами. Единичные аккумуляторы очень слабы и не могут давать ток, достаточный для работы большинства устройств. Поэтому чаще всего они объединяются в аккумуляторные батареи, в которых используется последовательное или параллельное соединение отдельных элементов питания.
Разряд элемента питания
Конструкция подобных источников питания предполагает наличие двух клемм: плюса и минуса. Их работа происходит таким образом: при отсутствии нагрузки электрическая цепь разомкнута, а при подключении к полюсам какого-либо устройства цепь замыкается и начинается разрядка АКБ. Ток разряда, протекающий по батарее в таких условиях, возникает за счёт перемещения между электродами ионов: анионов и катионов.
Ток разряда, протекающий по батарее в таких условиях, возникает за счёт перемещения между электродами ионов: анионов и катионов.
Более подробно процесс разрядки батареи удобнее всего будет рассмотреть на конкретном примере. Катод (положительный электрод в источнике тока) состоит из гидрата закиси никеля, в который для улучшения проводимости добавляется графитовый порошок.
Для изготовления анода (отрицательного электрода) в батареях такого типа применяются железные сетки с губчатым кадмием. Электролитом в таком устройстве будет смесь гидроксидов калия и лития. Оксид-гидроксид никеля в таком щелочном источнике питания вступает в химическое взаимодействие с атомами кадмия и молекулами воды. В результате такой реакции образуются гидроксиды кадмия и лития, а также выделяется электроэнергия.
Цикл заряда батареи
Для начала зарядки от клемм аккумулятора необходимо отключить нагрузку. На свободные клеммы батареи подаётся постоянный ток со значением напряжения большим, чем выходное напряжение заряжаемого устройства.
При осуществлении зарядки следует строго соблюдать полярность, то есть должны совпадать положительные и отрицательные контакты батареи и зарядного устройства. Важно учитывать, что устройство для зарядки необходимо выбирать с большей мощностью, чем сам аккумулятор, для того, чтобы преодолевать сопротивление оставшейся в нём энергии и производить электрический ток с направлением, противоположным току разряда. В результате обратимые химические реакции, протекающие в АКБ, поменяют своё направление.
Для рассмотрения примера можно взять также никель-кадмиевую батарею. В реакцию вступают гидроксиды кадмия и никеля, образовавшиеся при цикле разряда. Продуктами этой реакции будут оксид-гидроксид никеля, вода и восстановленный кадмий.
Из всего вышесказанного следует, что во время рабочего цикла меняется только химический состав электродов. Электролит лишь создаёт требуемую для протекания реакций среду. С течением времени он может испаряться, что не самым лучшим образом скажется на продолжительности работы батареи. Рассмотренный принцип работы верен для любого типа аккумуляторов, будет изменяться только химический состав электродов и электролита.
С течением времени он может испаряться, что не самым лучшим образом скажется на продолжительности работы батареи. Рассмотренный принцип работы верен для любого типа аккумуляторов, будет изменяться только химический состав электродов и электролита.
Типы соединения аккумуляторов
Отдельные аккумулирующие элементы позволяют получать малые напряжение и силу тока. Например, чаще всего значение напряжения будет находиться в пределах 1−2 вольта. Для работы большинства устройств таких значений явно недостаточно. Чтобы повысить получаемое напряжение или силу тока, нужно устроить соединение аккумуляторов в батарею. Нужно подробнее остановиться на описании этих способов.
Параллельное соединение
Для соединения аккумулирующих элементов в батарею или нескольких АКБ требуется соединять их положительные клеммы с положительными, а отрицательные с отрицательными. К нагрузке присоединяются соединённые выводы всех элементов. При таком способе соединения напряжение в цепи будет таким же, как у каждой батареи по отдельности (если использовать батареи с одинаковым напряжением). А ёмкость станет равна сумме ёмкостей всех входящих в батарею элементов. Соответственно, вырастет и сила тока, которую такое устройство будет способно давать за определённый период до полной разрядки.
А ёмкость станет равна сумме ёмкостей всех входящих в батарею элементов. Соответственно, вырастет и сила тока, которую такое устройство будет способно давать за определённый период до полной разрядки.
Последовательный способ
При использовании последовательного способа соединения АКБ следует связывать разнополярные контакты. Положительную клемму одного устройства соединяют с отрицательной клеммой другого, а электрическая схема подключается к свободным контактам первой и последней батарей. Итоговое выходное напряжение при применении такого вида соединения будет равняться сумме выходных напряжений всех задействованных источников электрического тока.
Например, чтобы получить АКБ с выходным напряжением двенадцать вольт, следует соединить последовательно четыре источника с напряжением три вольта или десяток аккумуляторов с выходным напряжением 1,2 вольта. Общая ёмкость собранных при помощи последовательного соединения АКБ будет равна ёмкости каждого аккумулятора по отдельности, то есть не изменится.
Типы источников тока
АКБ различаются по своему предназначению, характеристикам, тому как устроен аккумулятор и материалам, используемым при их изготовлении. На сегодняшний день в мире производится более трёх десятков типов различных аккумуляторов, основное различие между которыми заключается в химическом составе электродов, а также используемым видом электролита. Так, к примеру, в группу литий-ионных аккумуляторов входит двенадцать различных моделей. Наиболее популярными из всех производимых являются следующие типы:
- свинцово-кислотные;
- литиевые;
- никель-кадмиевые.
На них приходится значительная часть рынка элементов питания. Для лучшего представления о том, из каких материалов могут изготавливаться современные аккумуляторы стоит привести их полный список:
- железо;
- свинец;
- титан;
- литий;
- кадмий;
- кобальт;
- никель;
- цинк;
- ванадий;
- серебро;
- алюминий;
- целый ряд прочих металлов, которые, правда, используются крайне редко.

Применение при производстве различных материалов оказывает значительное влияние на итоговые эксплуатационные показатели и, как следствие, на область возможного использования. Например, литий-ионные АКБ часто устанавливаются в мобильные компьютеры и другие гаджеты.
В то время как никель-кадмиевые аккумуляторы в основном используются как альтернатива простым одноразовым батарейкам. В теории аккумуляторные батареи любого типа могут сочетаться с любым устройством. Дело лишь в целесообразности и себестоимости производства.
Основные характеристики
Выше были рассмотрены материалы, применяющиеся при изготовлении перезаряжаемых элементов питания, основные принципы их работы и способы соединения. Теперь можно перейти к их эксплуатационным качествам. Важнейшими эксплуатационными характеристиками являются:
- Плотность энергии АКБ. Этот показатель равен отношению полного количества электроэнергии, которую аккумулятор способен отдать, к его массе или объёму.

- Ёмкостью называют максимальный отдаваемый аккумулятором заряд во течение цикла разрядки, до достижения минимального значения напряжения на клеммах. В метрической системе такая величина выражается в кулонах (Кл), но в повседневной жизни гораздо чаще применяется внесистемная единица ампер-час (Ah) или, для слабых элементов питания миллиампер-час. Также в некоторых случаях может использоваться показатель, называемый энергетической ёмкостью. Он выражается в джоулях (система СИ) или в ватт-часах. Ёмкость показывает прибор какой мощности и в течение какого времени может питаться от конкретной АКБ.
- Температурный режим — диапазон значений температуры окружающей среды, в котором производитель рекомендует использование этого аккумулятора. При значительном отклонении от рекомендуемого изготовителем диапазона эксплуатационных температур, сильно возрастает вероятность того, что источник питания придёт в негодность. Это можно объяснить влиянием пониженных и повышенных температур на скорость течения химических реакций, а также на изменение давления внутри батареи.

- Саморазрядом АКБ называют потерю заряда, происходящую в заряженной батарее, при условии отсутствия нагрузки, подключённой к контактам. Величина этого показателя определяется, в основном, конструкцией батареи. Она может со временем возрастать из-за нарушения изоляции межу электродами по целому ряду причин.
Все эти параметры аккумуляторных батарей предоставляют наибольший интерес для конечного пользователя.
Устройство электродов
В качестве примера можно использовать свинцово-кислотную батарею. Каждая ячейка такого аккумулятора содержит пару электродов и разделительные пластины, которые изготовляются из пористого материала, не вступающего в химическое взаимодействие с кислотой. Такие пластины призваны препятствовать короткому замыканию погруженных в электролит электродов, и называются сепараторами.
Электроды в таких аккумуляторах выполняются в виде плоских свинцовых решёток.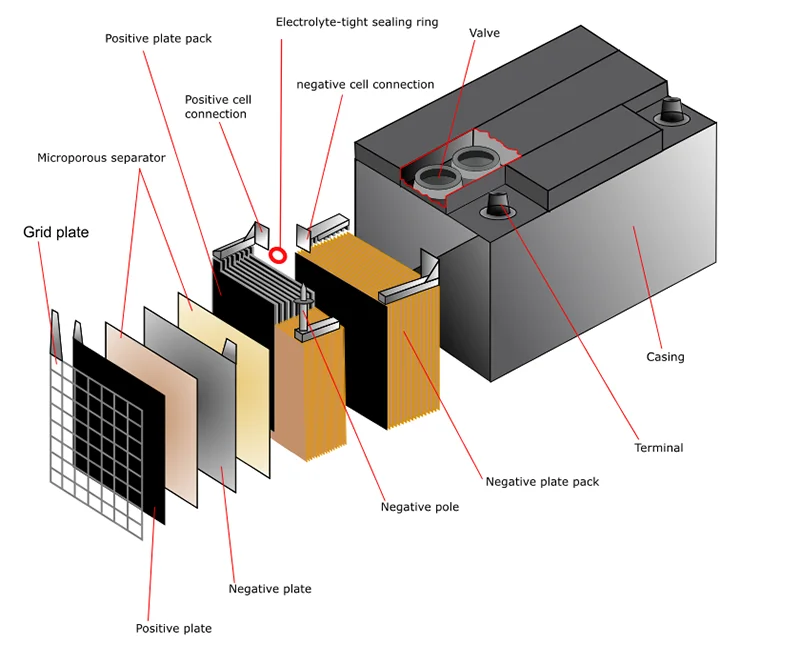 В ячейки таких решёток запрессовывается порошкообразная двуокись свинца (в пластинах-анодах) и металлический свинец в порошковой форме (в пластинах-катодах). Применение порошков обусловлено стремлением увеличить площадь поверхности раздела на границе электролит — электрод, что значительно повышает ёмкость такого источника тока.
В ячейки таких решёток запрессовывается порошкообразная двуокись свинца (в пластинах-анодах) и металлический свинец в порошковой форме (в пластинах-катодах). Применение порошков обусловлено стремлением увеличить площадь поверхности раздела на границе электролит — электрод, что значительно повышает ёмкость такого источника тока.
Имеются экспериментальные образцы аккумуляторов, в которых свинцовые решётки замешены электродами, состоящими из сплетённых нитей углеволокна, которые покрываются тончайшим свинцовым напылением. Такая технология позволяет использовать значительно меньше свинца за счёт распределения его по большой площади, что делает аккумуляторную батарею не только миниатюрнее и легче, но и повышает её эффективность. КПД выше, чем у традиционных, а время зарядки сильно снижено.
Проводящее вещество
Пластины электродов и сепараторов опущены в электролит, в качестве которого в свинцово-кислотных аккумуляторах используется серная кислота, разведённая дистиллированной водой. Такая вода применяется для приготовления раствора потому, что она не оказывает влияния на кислотность среды. Проводимость получаемого таким образом раствора зависит лишь от концентрации серной кислоты и комнатных условиях будет максимальной при значении плотности жидкости-электролита в 1,23 грамма на кубический сантиметр.
Такая вода применяется для приготовления раствора потому, что она не оказывает влияния на кислотность среды. Проводимость получаемого таким образом раствора зависит лишь от концентрации серной кислоты и комнатных условиях будет максимальной при значении плотности жидкости-электролита в 1,23 грамма на кубический сантиметр.
Проводимость электролита обратно пропорциональна внутреннему сопротивлению источника питания, и, соответственно, повышение проводимости снижает потери энергии и увеличивает КПД. Стоит отметить, что в областях холодного климата часто используют повышенные до 1,29−1,31 грамма на кубический сантиметр концентрации серной кислоты. Это делается для предотвращения замерзания электролита. Ведь образующийся лёд может повредить корпус аккумулятора.
В батареях, которые устанавливаются в бытовые источники бесперебойного питания, системы сигнализации и другие бытовые приборы, жидкий электролит иногда сгущается до состояния пасты раствором силиката натрия.
Но принцип работы АКБ остаётся тем же.
Области применения АКБ
Аккумуляторные батареи получили широчайшее распространение во всех видах технических устройств. Без них не обходится ни одно портативное электронное устройство: от наручных часов до ноутбуков. Даже в простых электрических фонарях производители предпочитают использовать встроенные АКБ вместо сменных элементов питания.
Не стали исключением и автомобили. В машинах привычных конструкций автомобильный аккумулятор используется для запуска двигателя и бесперебойного питания бортовой электрики и электроники. В набирающих всё большую популярность гибридных и электромобилях аккумуляторы играют ещё более важную роль. Причём в этом случае требования, предъявляемые к устройству АКБ автомобиля, ещё выше.
Крайне важны такие параметры: ток запуска, глубина разряда и максимальное количество циклов перезарядки, которое способен выдержать аккумулятор.
Можно смело утверждать, что современный образ жизни был бы невозможен без аккумуляторных батарей.
устройство, принцип работы, характеристики автомобильного аккумулятора
Знаете ли вы, что первые автомобили были именно электрическими и использовали свинцово-кислотные аккумуляторы? То, что мы привыкли считать машинами будущего – электромобили – появились до изобретения двигателя внутреннего сгорания (ДВС). С тех пор прошло больше 100 лет, но современный АКБ автомобильный изменился только качественно, оставшись принципиально таким же, как и столетие назад.
Сегодня аккумулятор в автомобиле считается расходником, требующим периодической замены. Сколько именно проработает АКБ – вопрос к качеству изготовления, режиму работы, даже к состоянию дорог, но рано или поздно его меняют на «свежий». Какие функции он выполняет, какие характеристики может иметь, как выбирать и как продлить жизнь аккумулятору – читайте в этой статье.
Содержание
- Что такое аккумулятор (АКБ) и для чего он нужен?
- Устройство и принцип работы АКБ
- Виды аккумуляторов
- Классификация по составу активного вещества
- Классификация по типу электролита
- Технические (рабочие) характеристики автомобильных аккумуляторов
- Номинальная емкость аккумулятора
- Пусковой ток
- Полярность
- Исполнение корпуса
- Тип и размер клемм
- Тип крепления
- Рейтинг ТОП аккумуляторов
- Советы по эксплуатации и обслуживанию АКБ
- Заключение
Что такое аккумулятор (АКБ) и для чего он нужен?
Современные автомобили всё больше становятся похожи на сложные электронные гаджеты: умное управление, всевозможные «помощники», автоматическая парковка и даже автопилот – это только небольшая часть той цифровой «начинки», которой богат автомобиль. И всё это счастье постоянно нуждается в электроэнергии, которую нужно постоянно откуда-то добывать. Именно хранилищем энергии, откуда ее можно взять в любой момент, и выступает АКБ. Да, он выполняет свою четкую функцию: накапливает заряд, затем отдает и дальше снова накапливает. Отличный вариант!
И всё это счастье постоянно нуждается в электроэнергии, которую нужно постоянно откуда-то добывать. Именно хранилищем энергии, откуда ее можно взять в любой момент, и выступает АКБ. Да, он выполняет свою четкую функцию: накапливает заряд, затем отдает и дальше снова накапливает. Отличный вариант!
Само понятие аккумулятора нам уже настолько привычно, что глупо спрашивать, зачем он нужен. Однако на удивление мало людей могут точно сказать, для чего именно служит аккумуляторная батарея в автомобиле.
Ее назначение можно описать в трех пунктах.
- Аккумулятор обеспечивает энергию для запуска двигателя на старте.
- Аккумулятор служит резервным источником энергии, когда она требуется сверх того, что может дать генератор (например, при включении автомобильного кондиционера).
- Аккумулятор питает электроприборы, когда двигатель выключен и генератор не работает. Например, видеорегистратор, сигнализацию, свет и т.д.
Устройство и принцип работы АКБ
Устройство автомобильного аккумулятора
Тот, кто хоть раз держал в руках аккумулятор автомобиля, знает, как много весит это устройство. Причина в том, что корпус его плотно заполнен элементами, содержащими свинец.
Причина в том, что корпус его плотно заполнен элементами, содержащими свинец.
Устройство аккумулятора.
Для легковых автомобилей, требующих 12-вольтных АКБ, используется стандартная схема компоновки.
- Шесть элементов по 2 вольта (их обычно называют банками) объединены в общий корпус.
- Каждый из элементов состоит из положительных и отрицательных электродов: свинцовых решеток, в которые «впечатано» активное вещество. Электроды разделены между собой сепараторами, так что не соприкасаются друг с другом.
- И всё это залито электролитом – смесью воды и серной кислоты.
Активное вещество на решетках отличается по составу: для анода (положительного электрода) используется диоксид свинца, для катода (это отрицательный электрод) – губчатый свинец. В обоих случаях к свинцовым компонентам добавлены вспомогательные вещества (лигатуры), улучшающие работу аккумулятора.
Принцип работы.
Принцип работы АКБ
В том виде, который описан выше, аккумулятор считается «заряженным». При подключении к выводам батареи любого устройства, требующего энергии, начинается реакция свинцовых компонентов с оксидом серы и водой. Сера и свинец вступают в реакцию и преобразуются в сульфат свинца и воду. Кислоты в электролите становится меньше, воды – больше, плотность электролита снижается и через некоторое время концентрации серы не хватает на то, чтобы реагировать со свинцовыми компонентами. Аккумулятор разряжается.
При подключении к выводам батареи любого устройства, требующего энергии, начинается реакция свинцовых компонентов с оксидом серы и водой. Сера и свинец вступают в реакцию и преобразуются в сульфат свинца и воду. Кислоты в электролите становится меньше, воды – больше, плотность электролита снижается и через некоторое время концентрации серы не хватает на то, чтобы реагировать со свинцовыми компонентами. Аккумулятор разряжается.
Процессы разряда и заряда АКБ
При подаче электроэнергии для зарядки АКБ происходит обратный процесс — сульфат свинца, осевший на пластинах, разлагается на оксид свинца и серную кислоту, которая выделяется обратно в электролит. Восстанавливается изначальная плотность электролита, а на пластинах остается активное вещество – батарея заряжена. Ниже представлен короткий и понятный видео-урок по устройству и принцип работы аккумуляторной батареи.
youtube.com/embed/tI_TR8BSNKs?feature=oembed&wmode=opaque» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>
Виды аккумуляторов
В попытке улучшить характеристики автомобильных аккумуляторов инженеры перепробовали множество способов. В итоге сегодня мы имеем различные типы АКБ, которые различаются по химическому составу активных компонентов и конструкции.
Классификация по составу активного вещества
В первых аккумуляторах использовались свинцовые пластины, однако такая конструкция довольно быстро перестала устраивать инженеров и потребителей: тяжелая, малоэффективная, недолговечная.
- Первым улучшением стало добавление сурьмы к свинцу, что серьезно продлило срок службы батареи.
- Следующий этап – уменьшение процентного содержания сурьмы до оптимальной концентрации. Такой подход позволил создать малообслуживаемые аккумуляторы: в них уже намного реже требовался долив воды.

- Затем для покрытия пластин начал использоваться металлический кальций – так появились кальциевые АКБ (они же Са-Са). Кальций серьезно изменил параметры эксплуатации батарей: в прежних моделях потери воды из-за электролиза на 12 В требовали постоянного долива, а кальциевые лигатуры позволили повысить этот порог до 16 В. Благодаря этому появилась возможность делать необслуживаемые аккумуляторы в полностью герметичном, неразборном корпусе.
Но кальциевые батареи имеют и огромный минус: чувствительность к полному разряду. Сульфат кальция, который оседает на электродах, не разлагается полностью при зарядке, а это значит, что один глубокий разряд батареи способен ее «убить».
Самым современным решением стали гибридные аккумуляторы (они же Са+): кальциевые добавки есть только на положительном электроде (поскольку именно на нём происходит разложение воды при электролизе), а отрицательный покрыт малосурьмянистым свинцом.
Классификация по типу электролита
Обычная жидкостная технология, при которой в аккумулятор заливался раствор кислоты и воды, вызывала много нареканий. Например, чувствительность к наклонам и вибрации. Необходимость обслуживать аккумулятор тоже не добавляла удовольствия от его эксплуатации. В общем, этой технологии было, куда расти.
Например, чувствительность к наклонам и вибрации. Необходимость обслуживать аккумулятор тоже не добавляла удовольствия от его эксплуатации. В общем, этой технологии было, куда расти.
На смену пришла AGM технология. В AGM аккумуляторе электролит «связывается» волокнистыми прослойками-сепараторами. Таким образом аккумулятор получает дополнительные преимущества: сепараторы сжимают активный слой и не дают ему отставать от пластин, имеют большую проводимость, чем жидкость и способствуют выдаче более мощного тока.
Технические (рабочие) характеристики автомобильных аккумуляторов
У АКБ для автомобиля довольно много рабочих параметров, которые важны при выборе батареи. Ошибешься хоть в одном из них – и аккумулятор нельзя будет использовать. Основные характеристики.
- Емкость, Ач (ампер*час).
- Пусковой ток, А (ампер).
- Полярность.
- Исполнение корпуса.
- Тип клемм.
- Тип крепления.
Номинальная емкость аккумулятора
Емкостью батареи называют количество электроэнергии, которую аккумулятор может отдавать в течение определенного времени. Измеряется в Ач (ампер в час). Это один из основных параметров не только автомобильного, а вообще любого аккумулятора. Чем выше этот показатель, тем дольше батарея сможет поддерживать работу электроприборов автомобиля во время стоянки.
Измеряется в Ач (ампер в час). Это один из основных параметров не только автомобильного, а вообще любого аккумулятора. Чем выше этот показатель, тем дольше батарея сможет поддерживать работу электроприборов автомобиля во время стоянки.
Для обычного легкового автомобиля с двигателем до 2 л. обычно нужна батарея 60 Ач, и чем больше оборудования в машине, тем более емким должен быть аккумулятор. При выборе лучше ориентироваться на рекомендации автопроизводителя, и если хочется взять АКБ с большей емкостью, то превышать рекомендуемую не более, чем на 5 Ач.
Пусковой ток
Он же ток холодной прокрутки – показатель того, как аккумулятор справится с самой сложной задачей: запуском двигателя на морозе. Определяется мощностью тока, которую батарея может выдать в течение первых 30 секунд при температуре «-18» градусов. Чем выше этот показатель, тем больше шансов завести свою машину зимним утром.
Например, для запуска бензинового двигателя понадобится минимум 255А, для дизельного – не менее 300А. Именно за увеличение мощности пускового тока сражаются конструкторы аккумуляторов, и именно за более высокую пусковую мощность автолюбители ценят AGM аккумуляторы. Можно даже сказать, что чем выше пусковой ток батареи – тем выше ее качество вообще.
Именно за увеличение мощности пускового тока сражаются конструкторы аккумуляторов, и именно за более высокую пусковую мощность автолюбители ценят AGM аккумуляторы. Можно даже сказать, что чем выше пусковой ток батареи – тем выше ее качество вообще.
Полярность
Полярность называют расположение клемм на корпусе аккумулятора. Это важная характеристика, поскольку неправильно выбранный АКБ просто невозможно будет подключить.
Чтобы определить полярность, нужно поставить аккумулятор так, чтобы нормально читались надписи на крышке («лицом» к себе), и посмотреть, с какой стороны находится плюсовая клемма.
- Плюсовая клемма справа – полярность обратная, она же европейская, она же маркируется как «R» или «0».
- Плюсовая клемма слева – полярность прямая, она же российская, она же «L» или «1».
Есть аккумуляторы с универсальной полярностью, то есть клеммы располагаются посредине коротких сторон корпуса или по диагонали. Однако такие модели встречаются редко.
Чаще всего на автомобили российского производства нужны аккумуляторы с прямой полярностью, а на европейского и азиатского – с обратной.
Исполнение корпуса
Конструкторы, создавая автомобили, разрабатывали и все комплектующие к ним. В итоге традиционно появились два типа корпусов аккумуляторов: европейский и азиатский.
- У АКБ с европейским типом корпуса клеммы находятся в углублении, так что их верхний край не выступает над плоскостью крышки. Иногда клеммы даже прикрыты специальными крышечками, так что дополнительно защищены от внешних факторов.
- Азиатский тип корпуса – это коробка, у которой клеммы «растут» из верхней крышки. То есть, именно верхний край клемм является самой высокой точкой аккумулятора.
Важен ли этот фактор? Конечно, удобней использовать такой АКБ, который предусмотрен производителем. Но в крайнем случае исполнением корпуса можно пренебречь, если остальные характеристики совпадают.
Нужно только помнить, что европейские производители указывают габаритные размеры аккумулятора по корпусу, а вот азиатские могут указывать высоту батареи с учетом клемм или без них.
Тип и размер клемм
Еще одна характеристика, с которой нужно свериться при выборе аккумулятора – толщина клемм для подключения. Они бывают двух типов: стандартные и тонкие.
- Стандартные клеммы, они же европейские, более толстые: плюсовая 19,5 мм, минусовая 17,9 мм в диаметре;
- Тонкие клеммы, они же азиатские: плюсовая 12,7 мм, минусовая 11,1 мм в диаметре.
В обоих стандартах плюсовая клемма всегда толще, чтобы не перепутать полярность подключения.
Тип крепления
И, наконец, днищевое крепление, оно же «юбка» аккумулятора – это планки с отверстиями под крепеж, расположенные в нижней части корпуса.
Каким бы тяжелым ни был аккумулятор, крепить его надо. Поэтому тип крепления важен при выборе, ведь он влияет на общие габариты корпуса. Существует 3 типа крепления.
- Верхнее крепление специальной прижимной скобой, без фиксации за днище, маркируется В00.
- Крепление по двум сторонам, когда ланки есть только на широких сторонах корпуса, а на торцевых отсутствует, маркируется В01.

- Крепление по периметру, когда «юбка» идет по всем четырем сторонам, маркируется В13.
В принципе, если в автомобиле предусмотрено только верхнее крепление, поставить ему можно любую батарею, лишь бы вошла по размеру, если нет другого выхода. А вот в обратную сторону эта лазейка не работает, придется подбирать подходящее днищевое крепление.
Рейтинг ТОП аккумуляторов
Много брендов, много советов, трудный выбор – с такими проблемами сталкиваются покупатели. Предлагаем небольшой, наш, субъективный рейтинг торговых марок АКБ.
- Первое место по уровню качества и долговечности по праву занимают ОЕМ аккумуляторы. ОЕМ – это аналог детали, которая была установлена с завода.
 Конечно, за аккумулятор, на котором гордо красуется логотип Mercedes или Honda, придется выложить намного больше, чем за любой другой бренд, но результат того стоит. Самые популярные на рынке бренды аккумуляторов – Varta и Bosch. Они заслужили репутацию надежных безотказных батарей, добросовестно отрабатывающих каждую вложенную копейку.
Конечно, за аккумулятор, на котором гордо красуется логотип Mercedes или Honda, придется выложить намного больше, чем за любой другой бренд, но результат того стоит. Самые популярные на рынке бренды аккумуляторов – Varta и Bosch. Они заслужили репутацию надежных безотказных батарей, добросовестно отрабатывающих каждую вложенную копейку. - Среди любителей заплатить поменьше, а получить побольше особо ценится бренд Topla. Это, конечно, не Бош, но вполне может порадовать долгой службой.
- А замыкают наш хит-парад бюджетные бренды Sada, Styer, Bi-Power и Ista. Они хоть и не дорогие, но вполне способны порадовать стабильной работой. Можно вспомнить о них, когда аккумулятор нужен срочно, а денег мало.
Советы по эксплуатации и обслуживанию АКБ
Чтобы аккумулятор проработал как можно дольше, нужно уделять ему совсем немного внимания. Вот несколько советов по эксплуатации автомобильного АКБ.
Вот несколько советов по эксплуатации автомобильного АКБ.
- Глубокий разряд – враг батареи. Каждый раз, когда аккумулятор разряжается «в ноль», происходит необратимая сульфатация электродов, особенно от этого страдают кальциевые батареи. Периодически желательно полностью заряжать бат специальным зарядным устройством и ни в коем случае не допускать полной разрядки.
- Второй враг – вибрация. От сильной тряски и регулярных ударов с пластин осыпается активный слой. AGM аккумуляторы меньше от этого страдают, жидкостные – больше.
- Клеммы аккумулятора склонны к окислению, что ухудшает контакт. Периодически нужно обращать внимание на состояние клемм и при необходимости очищать их от окислов.
- Обращайте внимание на корпус батареи. Грязь, масло, влага способствуют утечке тока и саморазряду.
- Неполадки в электросети могут вывести из строя и батарею. Особенно проблемы со стартером и генератором – смежными элементами.
- Вздутый корпус со следами электролита говорит о том, что пора покупать новый АКБ.
 Поврежденным аккумулятором пользоваться нельзя!
Поврежденным аккумулятором пользоваться нельзя!
Заключение
Нормально работающий автомобильный аккумулятор избавляет от множества проблем и нервотрёпки. Работоспособность батареи особенно важна зимой, когда нагрузки возрастают в несколько раз. Именно поэтому автовладельцы стараются менять «уставший» АКБ во время осеннего ТО: и спокойней, и дешевле, не придется лишний раз этим заниматься. А вы давно проверяли свой аккумулятор?
Принцип работы и устройство аккумулятора автомобиля
В автомобилях одним из главных источников электропитания является аккумуляторная батарея. От её характеристик зависит качественный запуск двигателя при любых условиях. Чтобы обеспечить для АКБ надёжную и длительную эксплуатацию, необходимо знать её устройство изнутри, а также разбираться в её работе.
Содержание
- Назначение аккумулятора в автомобиле
- Параметры АКБ
- Устройство аккумулятора
- Принцип работы
Назначение аккумулятора в автомобиле
Аккумулятор включён в цепь с бортовым компьютером и иными потребителями электроэнергии автомобиля. Подпитывается он от генератора во время работающего двигателя внутреннего сгорания. Инженеры обеспечили следующий функционал для батареи:
Подпитывается он от генератора во время работающего двигателя внутреннего сгорания. Инженеры обеспечили следующий функционал для батареи:
- Простой и быстрый пуск двигателя внутреннего сгорания. Ток поступает на стартер, начинающий вращать коленвал.
- Подаётся напряжение на потребителей. Если мотор заглушён, то вместо генератора напряжение отбирается от АКБ.
- Обеспечивается помощь генератору, если нагрузка от потребителей в бортовой сети оказывается высокой, например, в вечернее время, когда включён лобовой свет, работают дворники, обогрев кресел, стёкла, запущен вентилятор печки и пр.
Не каждый генератор способен выдавать стабильные параметры по току, поэтому аккумуляторную батарею используют для сглаживания пиковых значений.
В основном батарея в легковом автомобиле, закреплённая хомутами, располагается радом с двигателем в подкапотном пространстве. Это позволяет минимизировать длину проводки между источником тока и потребителями. В грузовиках блок обязательно надёжно зафиксирован с рамой, чтобы содержащийся внутри кислотный раствор не смог выплеснуться наружу. С этим прибором необходимо соблюдать максимальную осторожность.
В грузовиках блок обязательно надёжно зафиксирован с рамой, чтобы содержащийся внутри кислотный раствор не смог выплеснуться наружу. С этим прибором необходимо соблюдать максимальную осторожность.
Параметры АКБ
Для среднестатистического легкового автомобиля с ДВС промышленность выпускает аккумуляторы с рабочим напряжением 12 В. Такого значения вполне хватает для питания сети в машине. Бортовая сеть большинства грузовиков рассчитана на 24 В. Иногда в ней используется пара обычных двенадцативольтовых источников питания, подсоединённых последовательно.
Для мототехники характерным является использование питания на 6 В. Это позволяет снизить габариты ИП и обеспечить оптимальность работы ненагруженной бортовой сети.
Важным значением для АКБ является её ёмкость. Этот параметр измеряется в ампер-часах и может варьироваться у разных моделей от 45 до 130 Ач. В большинстве легковых машин используются агрегаты на 55–65 Ач. Дизельные ДВС более «прожорливые» по энергии, поэтому в них при прочих равных условиях будет стоять батарея на 5–10 Ач мощней, чем в аналогичном авто на бензине.
Пусковой ток для автомобильных аккумуляторов может быть в пределах 300–1300 А.
Основные требования, которые предъявляются к автомобильным источникам питания, могут быть такими:
- наибольший пусковой ток;
- минимальный саморазряд;
- небольшие габариты;
- необслуживаемость (либо минимальное вмешательство).
Одним из конструкционных значений является полярность. Это расположение клемм на внешней стороне корпуса. Для азиатских, европейских и американских моделей встречается несколько вариантов установки контактов.
Устройство аккумулятора
Конструкция большинства источников постоянного тока в легковой машине оказывается идентичной. Чаще всего попадаются свинцово-кислотные батареи с жидким электролитом внутри. Устройство такой АКБ у автомобиля можно описать схематично.
Блок двенадцативольтового прибора состоит из шести независимых банок, соединённых последовательно. Они все заключены в единый пластиковый корпус, изолирующий внутреннее устройство вашего автомобильного кислотного аккумулятора от внешней среды. Прочный каркас является стойким к механическим повреждениям снаружи и длительно противостоит возможному воздействию раствора кислоты.
Прочный каркас является стойким к механическим повреждениям снаружи и длительно противостоит возможному воздействию раствора кислоты.
Так как устроен прибор внутри в виде комплекта банок, выдающих по 2 В, то его называют батареей. Для каждой банки есть комплект положительных и отрицательных электродов, чередующихся внутри и не касающихся друг друга. Они изготовлены из токопроводящей свинцовой решётки, обработанной снаружи активной смазкой.
Пластины не должны контактировать между собой, чтобы не образовалось короткое замыкание. Для надёжности производители отделяют их сепараторами.
Электроды изготовлены из свинцовых сплавов, в состав которых могут входить вещества, обеспечивающие качественную проводимость тока и повышающие длительность эксплуатации устройства.
Дополнительными химическими элементами в свинцовых пластинах, кроме металла, выступают сурьма или кальций. Легирующие добавки снижают саморазряд и расход воды в процессе работы. Чаще всего на прилавках можно найти такие аккумуляторы:
- Малосурьмянистые.
 Они относятся к малообслуживаемым конструкциям. В составе электродов используется сурьма до 6%.
Они относятся к малообслуживаемым конструкциям. В составе электродов используется сурьма до 6%. - Кальциевые. В них корпус и крышка лишены пробок, так как это необслуживаемые конструкции, а в электродах используется также кальций.
- Гибридные. Модели АКБ, в которых минусовой электрод изготовлен из сплава свинец + кальций, а плюсовой изготовлен из сплава свинец + сурьма.
Встроенная внутрь решётка может быть изготовлена по различным технологиям, например, просечкой или литьём. Крупные производители патентуют свою конструкцию, защищая её. Для улучшения прочности разработчики могут усиливать решётки направляющими либо опорными рамами. Внутри расположение бывает вертикальное или в шахматном порядке.
Подготовленная жидкость, располагающаяся между электродами, представляет собой водяной раствор серной кислоты с плотностью около 1,28 г/мл. Она называется электролитом. В более прогрессивных моделях используется не жидкость, а гелеобразная масса. Для сгущения применяется оксид кремния.
Принцип работы
Основные процессы, проходящие внутри, скрыты от глаз автомобилистов. Даже не все автовладельцы знают принцип работы у аккумулятора легкового автомобиля. Однако даже при наличии школьных знаний химии можно понять суть проходящих внутри манипуляций как все работает.
Во время зарядки на отрицательном электроде идёт простая химическая реакция, во время которой высвобождаются два электрода, и из иона кислотного остатка плюс атом свинца образуется сульфид свинца. На положительном электроде два высвободившихся электрона добавляются к оксиду свинца, ионам водорода и ионам кислотного остатка. В результате формируются вода и сульфид свинца. Принцип основной работы вашего автомобильного аккумулятора подразумевает, что при разрядке идут обратные процессы.
Накопление заряда может происходить как от генератора, так и от внешнего источника. Саморазряд происходит постепенно. Необходимо учитывать, что при понижении окружающей температуры химические процессы существенно замедляются. Электролит в разряженном состоянии на морозе может даже замёрзнуть, поэтому не стоит доводить АКБ зимой до глубокой разрядки.
Саморазряд происходит постепенно. Необходимо учитывать, что при понижении окружающей температуры химические процессы существенно замедляются. Электролит в разряженном состоянии на морозе может даже замёрзнуть, поэтому не стоит доводить АКБ зимой до глубокой разрядки.
Как работает батарея — Любопытно
Представьте себе мир без батареек. Все те портативные устройства, от которых мы так зависим, были бы такими ограниченными! Мы смогли бы донести наши ноутбуки и телефоны только до предела досягаемости их кабелей, что сделало бы это новое работающее приложение, которое вы только что загрузили на свой телефон, довольно бесполезным.
К счастью, у нас есть батарейки. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
Изобретение батареи в том виде, в каком мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать точку зрения другого итальянского ученого, Луиджи Гальвани. В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенных на латунных крючках, дергались, если их проткнуть зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.
Вольта, поначалу впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит из двух разных типов металла (крючков, на которых висят лягушки, и другого металла зонда) и просто передается через них, а не через них. из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
Батарея Алессандро Вольта: груда цинковых и серебряных листов с вкраплениями ткани или бумаги, пропитанной соленой водой. Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.
Вольта также обнаружил, что, используя различные металлы в куче, можно увеличить величину напряжения. Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. ‘ (мера электрического потенциала) названа в его честь.
Я сам, если не считать шуток, поражаюсь тому, как мои старые и новые открытия… чистого и простого электричества, вызываемого контактом металлов, могли вызвать такой ажиотаж.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра, да и с дергающимися лягушачьими лапками?
Химия батареи
Батарея представляет собой устройство, которое накапливает химическую энергию и преобразует ее в электричество. Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Так откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Электроды
Чтобы создать поток электронов, вам нужно куда-то, чтобы электроны текли из , и куда-то, чтобы электроны текли к . Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
В батарее Вольта анодом был цинк, от которого электроны текли по проводу (при подключении) к серебру, которое было катодом батареи. Он сложил множество этих элементов вместе, чтобы сделать общую кучу и поднять напряжение.
Но откуда анод получает все эти электроны? И почему они так счастливы, что их весело отправляют на катод? Все сводится к химии, которая происходит внутри клетки.
Происходит несколько химических реакций, которые нам нужно понять. На аноде электрод вступает в реакцию с электролитом, в результате которой образуются электроны. Эти электроны накапливаются на аноде. Тем временем на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин для реакции, включающей обмен электронами, представляет собой реакцию восстановления-окисления, чаще называемую окислительно-восстановительной реакцией. Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности/эффективности реакции либо производить, либо поглощать электроны — ее сила в перетягивании каната электронами.
- Стандартные потенциалы для полуреакций
Ниже приведен список полуреакций, которые включают высвобождение электронов либо из чистого элемента, либо из химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет Е 0 нуля).
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах.Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 подскажут вам, каким образом будет протекать общая реакция: реакция с более отрицательное значение E 0 пожертвует свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном является напряжением ячейки.
Итак, если вы возьмете литий и фтор и сумеете соединить их, чтобы сделать элемент батареи, вы получите максимальное напряжение, теоретически достижимое для гальванического элемента. Этот список также объясняет, почему в куче Вольта цинк был анодом, а серебро катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996).
 .
.Стандартные потенциалы полуреакций восстановления
(по отношению к стандартному водородному электроду при 25°C)
В° (В) Li + (водный) + e − Li(s) –3,040 Be 2+ (водн.) + 2e − Be(s) –1,99 Al 3+ (водн.) + 3e − Al(s) –1,676 Zn 2+ (водный) + 2e − Zn(s) –0,7618 Ag 2 S(s) + 2e − 2Ag(s) + S 2− (водн.) –0,71 Fe 2+ (водн.) + 2e − Fe(s) –0,44 Cr 3+ (водн.) + e − Cr 2+ (водн.) –0,424 Cd 2+ (водн.) + 2e − Cd(s) –0,4030 PbSO 4 (т) + 2e − Pb(т) + SO 4 2− (водн.  )
)–0,356 Ni 2+ (водн.) + 2e − Ni(s) –0,257 2SO 4 2− (водн.) + 4H + (водн.) + 2e − S 2 O 6 − 2048 (водн.) + 2H 2 O(л) –0,25 Sn 2+ (водн.) + 2e − Sn(s) −0,14 2H + (водн.) + 2e − H 2 (г) 0 Sn 4+ (водн.) + 2e − Sn 2+ (водн.) 0,154 Cu 2+ (водн.) + e − Cu + (водный) 0,159 AgCl(s) + e − Ag(s) + Cl − (водн.) 0,2223 Cu 2+ (водн.) + 2e − Cu(s) 0,3419 O 2 (г) + 2H 2 O(ж) + 4e − 4OH − (водн.  )
)0,401 H 2 SO 3 (водн.) + 4H + (водн.) + 4e − S(т) + 3H 2 O(л) 0,45 I 2 (s) + 2e − 2I − (aq) 0,5355 MnO 4 2− (водн.) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH − 906 0,6 O 2 (г) + 2H + (водн.) + 2e − H 2 O 2 (водный) 0,695 H 2 SeO 3 (водн.) + 4H + + 4e − Se(s) + 3H 2 O(ж) 0,74 Fe 3+ (водн.) + e − Fe 2+ (водн.) 0,771 Ag + (водный) + e − Ag(s) 0,7996 NO 3 − (водн.  ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)0,94 Br 2 (водн.) + 2e − 2Br − (водн.) 1,087 MnO 2 (т) + 4H + (водн.) + 2e − Mn 2+ (водн.) + 2H 2 O(л) 1,23 О 2 (г) + 4H + (водн.) + 4e − 2H 2 O(л) 1,229 CR 2 O 7 2- (AQ) + 14H + (AQ) + 6E — 2CR 3+ (AQ) + 7H 22 2 3333333333333333 (AQ) + 7H 2 2 333333333333333333333333 3+ (AQ) + 7H
22 2 33333333. 3+ (AQ) + — 2 3+ (AQ).
1,36 Cl 2 (г) + 2e − 2Cl − (водн.) 1,396 Се 4+ (водн.  )+е − Се 3+ (водный)
)+е − Се 3+ (водный)1,44 PBO 2 (S) + HSO 4 — (AQ) + 3H + (AQ) + 2E — PBSO 4 (S) + 2H 2H 3 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2. 1,69 H 2 O 2 (водн.) + 2H + (водн.) + 2e − 2H 2 O(л) 1,763 F 2 (г) + 2e − 2F − (водный) 2,87 Источник: UC Davis ChemWiki
Любые два проводящих материала, вступающих в реакции с разными стандартными потенциалами, могут образовать электрохимическую ячейку, потому что более сильный сможет отбирать электроны у более слабого. Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Разница в стандартном потенциале между электродами примерно равна силе, с которой электроны перемещаются между двумя электродами. Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение батареи, у нас есть два варианта. Мы могли бы выбрать разные материалы для наших электродов, которые придадут клетке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе. Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда ячейки объединены другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через ячейки, но не как их напряжение.
Электролит
Но электроды — это только часть батареи. Помните бумажки Вольта, смоченные в соленой воде? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электроны имеют отрицательный заряд, и поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ сбалансировать движение этого заряда. Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Поскольку химическая реакция на аноде приводит к образованию электронов, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
В то же время катод также должен уравновешивать отрицательный заряд электронов, которые он получает, поэтому происходящая здесь реакция должна втягивать положительно заряженные ионы из электролита (в качестве альтернативы она может также высвобождать отрицательно заряженные ионы из электрода в электролит).
Таким образом, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для передачи положительно заряженных ионов, чтобы сбалансировать отрицательный поток. Этот поток положительно заряженных ионов столь же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств. Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Теперь, если бы всем ионам, выпущенным в электролит, было позволено полностью свободно перемещаться через электролит, они в конечном итоге покрыли бы поверхности электродов и засорили бы всю систему. Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Показывать метки во время анимации
Начать анимацию
При использовании батареи возникает непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит). Если этот непрерывный поток остановлен — если цепь разомкнута, например, когда ваш фонарик выключен — поток электронов остановится. Заряды будут накапливаться, и химические реакции, управляющие батареей, прекратятся.
По мере использования батареи и протекания реакций на обоих электродах производятся новые химические продукты. Эти продукты реакции могут создать своего рода сопротивление, которое может помешать протеканию реакции с той же эффективностью. Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Зарядка аккумулятора
Некоторые распространенные батареи предназначены только для одноразового использования (известные как первичные или одноразовые батареи). Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и она закончилась и запылилась. Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и она закончилась и запылилась. Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Но. Преимущество этого потока ионов и электронов в том, что он имеет место в некоторых типах батарей с соответствующими электродными материалами, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь. . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
Когда мы подключаем почти разряженную батарею к внешнему источнику электроэнергии и отправляем энергию обратно в батарею, она обращает вспять химическую реакцию, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а также электроны, принятые катодом, обратно к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а также электроны, принятые катодом, обратно к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Показывать метки во время анимации
Начать анимацию
Однако процесс не идеален. Замена отрицательных и положительных ионов из электролита обратно на соответствующий электрод по мере перезарядки батареи происходит не так аккуратно и красиво, как электрод изначально. Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
В течение нескольких циклов зарядки и разрядки форма кристаллов батареи становится менее упорядоченной. Это усугубляется, когда батарея разряжается/перезаряжается с высокой скоростью, например, если вы едете на своем электромобиле большими рывками, а не постоянно. Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Эффект памяти и саморазряд
Почти полностью обратимые реакции разрядки и перезарядки также способствуют так называемому «эффекту памяти». Когда вы перезаряжаете некоторые типы перезаряжаемых батарей, предварительно не разрядив их в достаточной степени, они «вспоминают», на каком уровне они были в предыдущих циклах разрядки, и не заряжаются должным образом.
В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как соль затем снова растворяется, а металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Способ формирования некоторых кристаллов очень сложен, и способ осаждения некоторых металлов во время перезарядки также удивительно сложен, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие. Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т. д., и наша батарея накапливает плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.
Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т. д., и наша батарея накапливает плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.
Еще один аспект перезаряжаемых батарей заключается в том, что химический состав, делающий их перезаряжаемыми, также означает, что они имеют более высокую склонность к саморазряду. Это когда внутри элемента батареи происходят внутренние реакции, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы батареи и заставляет ее умирать при хранении.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда, около 2–3 % в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны — они имеют тенденцию терять 4–6 %. в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.
в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.
Напряжение, ток, мощность, мощность… в чем разница?
Все эти слова в основном описывают мощность батареи, верно? Ну вроде. Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в движение батарею, проталкивает электроны через ячейку. Это также известно как электрический потенциал и зависит от разности потенциалов между реакциями, происходящими на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем большую работу может совершить одно и то же число электронов.
Ток = количество электронов, проходящих через любую точку цепи в данный момент времени. Чем больше сила тока, тем больше работы он может совершить при том же напряжении. Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем выше скорость, с которой батарея может работать — это соотношение показывает, насколько важны напряжение и ток для определения того, для чего подходит батарея.
Емкость = мощность батареи как функция времени, которая используется для описания периода времени, в течение которого батарея сможет питать устройство. Аккумулятор большой емкости сможет работать в течение более длительного периода, прежде чем разрядится или разрядится. У некоторых аккумуляторов есть небольшая грустная особенность: если вы попытаетесь извлечь из них слишком много слишком быстро, вовлеченные химические реакции не смогут продолжаться, и емкость уменьшится! Таким образом, мы всегда должны быть осторожны, когда говорим о емкости батареи и помнить, для чего она будет использоваться.
Другой популярный термин — «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане. Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане. Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для некоторых приложений, таких как хранение электроэнергии на возобновляемой электростанции, такой как ветряная или солнечная электростанция, высокая плотность энергии не является большой проблемой, так как у них, скорее всего, будет достаточно места для хранения батарей. Основной целью такого использования было бы просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Видео: Как работают аккумуляторы? (TED-Ed/YouTube). Посмотреть подробности и расшифровку.
Посмотреть подробности и расшифровку.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) можно использовать в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию. Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы кладете их вместе в элемент батареи. Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Другие комбинации дадут лишь струйку тока, но они будут поддерживать эту струйку на века. Например, нам не нужно большое количество тока для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Например, нам не нужно большое количество тока для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Еще одна причина для использования различных комбинаций металлов заключается в том, что часто для получения требуемого напряжения необходимо сложить два или более аккумуляторных элемента, и оказывается, что некоторые комбинации электродов складываются гораздо лучше, чем другие комбинации. Например, литий-железо-фосфатные аккумуляторы (разновидность литий-ионных аккумуляторов), используемые в электромобилях, объединяются вместе для создания высоковольтных систем (100 и даже более вольт), но вы никогда не сделаете этого с теми никель-кадмиевыми аккумуляторами Walkman, которые получают горячий!
Наши различные потребности со временем привели к разработке огромного количества типов батарей. Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Эта тема является частью нашей серии статей о батареях, состоящей из четырех частей. Для дальнейшего чтения см. Типы аккумуляторов, литий-ионные аккумуляторы и аккумуляторы будущего. Принцип работы батареи
Для дальнейшего чтения см. Типы аккумуляторов, литий-ионные аккумуляторы и аккумуляторы будущего. Принцип работы батареи
: как работает батарея?
Принцип работы батареи
Работа батареи основана на реакции окисления и восстановления электролита с металлами. Когда два разнородных металлических вещества, называемых электродами, помещают в разбавленный электролит, в электродах происходят реакции окисления и восстановления соответственно в зависимости от сродства к электрону металла электродов. В результате реакции окисления один электрод получает отрицательный заряд, называемый катодом, а в результате реакции восстановления другой электрод получает положительный заряд, называемый анодом.
Катод образует отрицательную клемму, тогда как анод образует положительную клемму батареи. Чтобы правильно понять основной принцип батареи , во-первых, мы должны иметь некоторое базовое понятие о сродстве электролитов и электронов. На самом деле, когда два разнородных металла погружают в электролит, между этими металлами возникает разность потенциалов.
Установлено, что при добавлении в воду определенных соединений они растворяются и образуют отрицательные и положительные ионы. Этот тип соединения называется электролитом. Популярными примерами электролитов являются почти все виды солей, кислот, оснований и т. д. Энергия, высвобождаемая при принятии электрона нейтральным атомом, известна как сродство к электрону. Поскольку атомная структура разных материалов различна, сродство к электрону у разных материалов будет разным.
Если два разных металла погрузить в один и тот же раствор электролита, один из них получит электроны, а другой отдаст электроны. Какой металл (или металлическое соединение) получит электроны, а какой потеряет электроны, зависит от сродства этих металлов к электрону. Металл с низким сродством к электрону получит электроны от отрицательных ионов раствора электролита.
С другой стороны, металл с высоким сродством к электрону высвобождает электроны, и эти электроны выходят в раствор электролита и присоединяются к положительным ионам раствора. Таким образом, один из этих металлов приобретает электроны, а другой теряет электроны. В результате будет разница в концентрации электронов между этими двумя металлами.
Таким образом, один из этих металлов приобретает электроны, а другой теряет электроны. В результате будет разница в концентрации электронов между этими двумя металлами.
Эта разница в концентрации электронов вызывает разность электрических потенциалов между металлами. Эту разность электрических потенциалов или ЭДС можно использовать в качестве источника напряжения в любой электронике или электрической цепи. Это общий и основной принцип работы батареи и принцип работы батареи .
Все аккумуляторные элементы основаны только на этом основном принципе. Давайте обсудим один за другим. Как мы уже говорили ранее, Алессандро Вольта разработал первый аккумуляторный элемент, и этот элемент широко известен как простой гальванический элемент. Этот тип простой ячейки может быть создан очень легко. Возьмите одну емкость и наполните ее разбавленной серной кислотой в качестве электролита. Теперь погружаем в раствор один цинковый и один медный стержень и соединяем их снаружи электрической нагрузкой. Теперь ваш простой гальванический элемент готов. Ток начнет течь через внешнюю нагрузку.
Теперь ваш простой гальванический элемент готов. Ток начнет течь через внешнюю нагрузку.
Цинк в разбавленной серной кислоте отдает электроны следующим образом:
Эти ионы Zn + + переходят в электролит, и каждый из ионов Zn + + оставляет два электрона в стержне. В результате описанной выше реакции окисления цинковый электрод остается отрицательно заряженным и, следовательно, действует как катод. Следовательно, концентрация ионов Zn + + вблизи катода в электролите увеличивается.
Согласно свойствам электролита, разбавленная серная кислота и вода уже диссоциировали на положительные ионы гидроксония и отрицательные ионы сульфата, как указано ниже:
Из-за высокой концентрации ионов Zn + + вблизи катода ионы H 3 O + отталкиваются к медному электроду и разряжаются, поглощая электроны из атомов медного стержня. На аноде происходит следующая реакция:
В результате реакции восстановления, протекающей на медном электроде, медный стержень заряжается положительно и, следовательно, действует как анод.
Ячейка Даниэля
Ячейка Даниэля состоит из медного сосуда, содержащего раствор сульфата меди. Сам медный сосуд действует как положительный электрод. В медный сосуд помещают пористый сосуд с разбавленной серной кислотой. Амальгамированный цинковый стержень, погруженный в серную кислоту, действует как отрицательный электрод.
Разбавленная серная кислота в пористом сосуде вступает в реакцию с цинком, в результате чего выделяется водород. Реакция протекает следующим образом:
Образование ZnSO 4 в пористом сосуде не влияет на работу ячейки до тех пор, пока не отложатся кристаллы ZnSO 4 . Газообразный водород проходит через пористый сосуд и реагирует с раствором CuSO 4 следующим образом:
Образующаяся при этом медь осаждается на медном сосуде.
История батареи
В 1936 году, в середине лета, во время строительства новой железнодорожной линии недалеко от города Багдад в Ираке была обнаружена древняя гробница. Мощам, найденным в этой гробнице, было около 2000 лет. Среди этих реликвий было несколько глиняных кувшинов, запечатанных сверху смолой. Железный стержень, окруженный цилиндрической трубкой, сделанной из обернутого медного листа, выступал из этой запечатанной вершины.
Мощам, найденным в этой гробнице, было около 2000 лет. Среди этих реликвий было несколько глиняных кувшинов, запечатанных сверху смолой. Железный стержень, окруженный цилиндрической трубкой, сделанной из обернутого медного листа, выступал из этой запечатанной вершины.
Когда первооткрыватели наполнили эти горшки кислой жидкостью, они обнаружили разницу потенциалов между железом и медью около 2 вольт. Предполагалось, что эти глиняные кувшины представляют собой батарейки возрастом 2000 лет. Они назвали горшок как Парфянская батарея .
В 1786 году итальянский анатом и физиолог Луиджи Гальвани с удивлением обнаружил, что, когда он прикасался к мертвым лягушачьим лапкам двумя разными металлами, мышцы лапок сокращались.
Он не мог понять истинной причины, иначе он был бы известен как первый изобретатель аккумуляторной батареи. Он думал, что реакция может быть связана со свойством тканей.
После этого Алессандро Вольта реализовал то же явление на картоне, пропитанном соленой водой вместо лягушачьих лапок.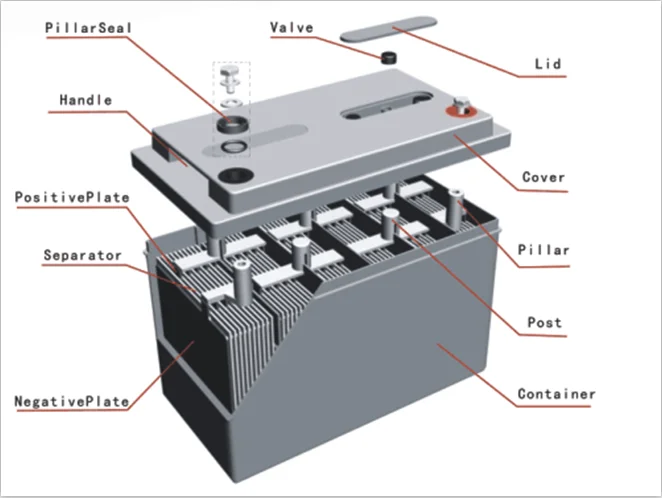 Он поместил медный диск и цинковый диск с куском картона, смоченным в соленой воде, между ними и обнаружил разницу потенциалов между медью и цинком.
Он поместил медный диск и цинковый диск с куском картона, смоченным в соленой воде, между ними и обнаружил разницу потенциалов между медью и цинком.
После этого в 1800 году он разработал первую гальваническую батарею (батарею), состоящую из чередующихся медных и цинковых дисков с кусочками картона, пропитанными рассолом между ними. Эта система могла производить измеримый ток. Мы считаем Вольтов столб Алессандро Вольта первым «мокрым аккумулятором». Так началась история батареи . С того времени и по сегодняшний день батарея остается предпочтительным источником электроэнергии во многих сферах нашей повседневной жизни.
Основная проблема с вольтовой батареей заключалась в том, что она не могла подавать ток в течение длительного времени. Британский изобретатель Джон Ф. Даниэлл решил эту проблему в 1836 году. Он изобрел более совершенную версию аккумуляторной батареи, известную как элемент Даниэля. Джон Ф. Даниэлл погрузил один цинковый стержень в сульфат цинка в одном контейнере и один медный стержень в сульфат меди (II) в другом контейнере.
U-образный солевой мост соединяет растворы этих двух контейнеров. Ячейка Даниэля могла производить 1,1 вольта, и этот тип батареи работал намного дольше, чем батарея Вольта. В 1839 году сэр Уильям Роберт Гроув, первооткрыватель и человек науки, сконструировал топливный элемент. Он смешал водород и кислород в растворе электролита и создал электричество и воду. Топливный элемент не давал достаточной мощности, но это было полезно. Бунзен (1842 г.) и Гроув (1839 г.) усовершенствовали батарею, в которой для подачи электричества использовались жидкие электроды.
В 1859 году Гастон Планте; впервые разработал свинцово-кислотный аккумулятор. Свинцово-кислотная батарея была первой формой перезаряжаемой вторичной батареи. Свинцово-кислотные аккумуляторы до сих пор используются во многих промышленных целях. Он по-прежнему наиболее популярен для использования в качестве автомобильного аккумулятора. В 1866 году французский инженер Жорж Лекланш разработал аккумулятор нового типа. Это была углеродно-цинковая батарея с жидкостным электролитом, известная как элемент Лекланша.
Это была углеродно-цинковая батарея с жидкостным электролитом, известная как элемент Лекланша.
Измельченный диоксид марганца, смешанный с небольшим количеством углерода, образует положительный электрод, а цинковый стержень — отрицательный. В качестве жидкого электролита он использовал раствор хлорида аммония. Через несколько лет сам Жорж Лекланш усовершенствовал свою конструкцию, заменив жидкий раствор хлорида аммония хлоридом аммония.
Таким образом, он изобрел первую сухую камеру. В 1901 году Томас Альва Эдисон открыл щелочной аккумулятор. Первичная батарея Томаса Эдисона имела железо в качестве материала анода (-) и оксид никеля в качестве материала катода (+). Вышеупомянутое содержимое является лишь частью бесконечной истории батареи .
Пошаговое развитие в истории аккумуляторов
| Разработчик/изобретатель | Страна | Год | Изобретение |
| Luigi Galvani | Italy | 1786 | Animal Electricity |
| Alessandro Volta | Italy | 1800 | Voltaic Pile |
John F.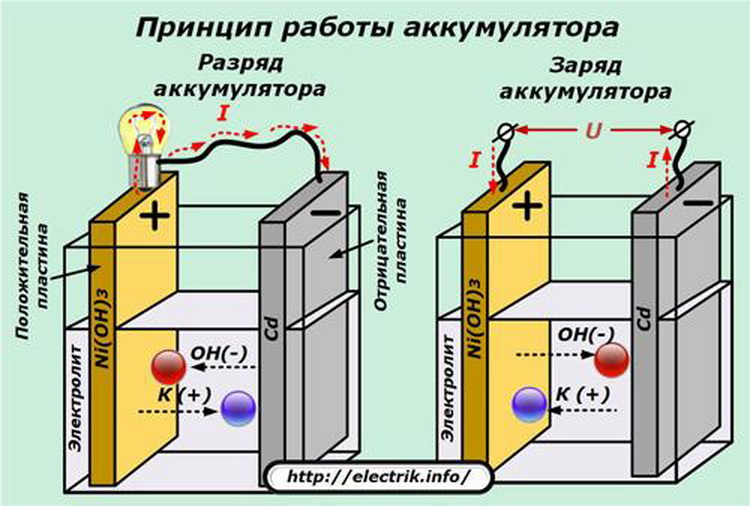 Daniell Daniell | Britain | 1836 | Daniell Cell |
| Сэр Уильям Роберт Гроув | Великобритания | 1839 | Топливный элемент |
| Роберт Бунзен | Германия | 1842 | used liquid electrodes to supply electricity |
| Gaston Plante | France | 1859 | Lead Acid Battery |
| Georges Leclanche | France | 1866 | Leclanche Cell |
| Thomas Alva Edison | Соединенные Штаты Америки | 1901 | Щелочной аккумулятор |
Как работают батареи — принцип работы, хранение и старение — батарея Greenway
0769-27282088
Сервисный центр
Dongguan Greenway Battery Co., Ltd.
ФАКС:(+86) 769 2229 0098
粤ICP备11070025号
Эл.
Аккумулятор представляет собой устройство, которое накапливает энергию в виде химического вещества и при необходимости преобразует ее в электрическую энергию.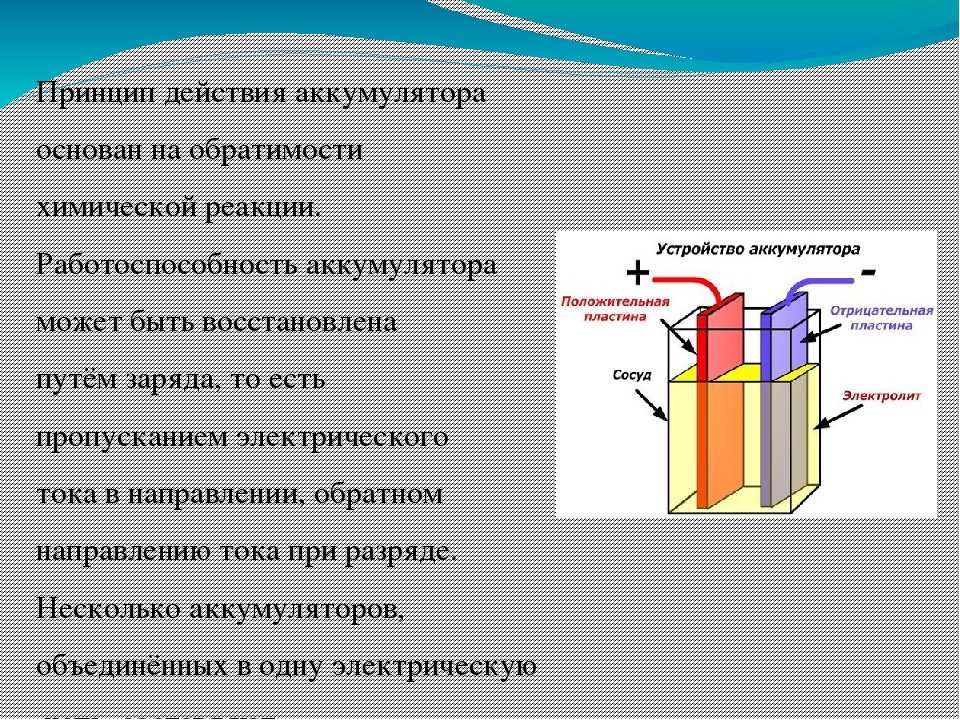 А это обычные батарейки — те, что очень знакомой цилиндрической формы. Не существует батареи, которая хранит электрическую энергию, и каждая батарея хранит энергию в какой-то другой форме. Чтобы узнать больше о том, как работают батареи, мы рекомендуем вам продолжить чтение, чтобы узнать об этом и узнать все, что вам нужно знать о работе батареи.
А это обычные батарейки — те, что очень знакомой цилиндрической формы. Не существует батареи, которая хранит электрическую энергию, и каждая батарея хранит энергию в какой-то другой форме. Чтобы узнать больше о том, как работают батареи, мы рекомендуем вам продолжить чтение, чтобы узнать об этом и узнать все, что вам нужно знать о работе батареи.
Каков принцип работы батареи?
+Когда два разнородных металла, называемых электродами, помещают в разбавленный электролит, в электродах происходят реакции окисления и восстановления в зависимости от электронного контакта металла электродов. В результате реакции окисления один электрод получает отрицательный заряд, называемый катодом. Другой электрод получает положительный заряд, называемый анодом, благодаря реакции восстановления. Катод образует отрицательную клемму, а анод — положительную клемму элемента или батареи.
Чтобы понять фундаментальный принцип батареи, вам необходимо понять основную концепцию сродства к электронам. Когда два, в отличие от металлов, помещаются в электролит, между этими металлами возникает разность потенциалов.
Когда два, в отличие от металлов, помещаются в электролит, между этими металлами возникает разность потенциалов.
Обнаружено, что при добавлении в воду определенных соединений они растворяются и образуют положительные и отрицательные ионы. Этот тип соединения известен как электролит. Энергия, возникающая при принятии электрона нейтральным атомом, называется сродством к электрону. Если два разных типа металлов поместить в один и тот же раствор электролита, то один получит электроны, а другой в конечном итоге отдаст электроны. И какой металл получит электроны, а какой потеряет, зависит от сродства к электрону. Металл с меньшим сродством будет приобретать электроны от -ve ионов раствора электролита.
С другой стороны, металл с высоким сродством к электрону в конечном итоге высвобождает электроны. Следовательно, между этими двумя металлами будет ключевая разница в концентрации электронов. Эта разница приводит к разнице электрических потенциалов, образующейся между металлами. Эту разность или ЭДС можно использовать в качестве источника напряжения в любой электрической цепи. Это общий принцип работы аккумулятора.
Эту разность или ЭДС можно использовать в качестве источника напряжения в любой электрической цепи. Это общий принцип работы аккумулятора.
Как батарея сохраняет энергию?
Существует два основных типа химических аккумуляторов: перезаряжаемые или вторичные элементы, первичные элементы и неперезаряжаемые. Что касается хранения энергии, а также разрядки электричества, они идентичны. Вопрос только в том, допускают ли используемые химические процессы многократную зарядку и разрядку.
Все гальванические элементы имеют два электрода. Область между электродами заполнена электролитом — ионной жидкостью, проводящей электричество. Электрод — анод — позволяет электронам выходить из него. Другой — катод — их принимает. Энергия запасается в специальных соединениях, входящих в состав анода, катода и электролита, например, цинка, меди и SO4.
Анод подвергается реакции окисления: во время разряда два или более ионов соединяются с анодом, образуя соединение, а также высвобождают 1 или более электронов. А катод подвергается реакции восстановления, при которой материал, из которого сделан катод, образует соединения с ионами и свободными электронами.
А катод подвергается реакции восстановления, при которой материал, из которого сделан катод, образует соединения с ионами и свободными электронами.
Как умирает батарея?
Когда активное вещество в пластинах не может поддерживать поток разряда, аккумулятор «умирает». Как правило, автомобильный (или ранний) аккумулятор «стареет» по мере того, как активный материал положительной пластины осыпается (или отслаивается) из-за нормального расширения и сжатия, которые происходят во время циклов разрядки и зарядки. Это приводит к тому, что пластина теряет емкость, и коричневый осадок, называемый шламом или «грязью», накапливается на дне корпуса, а также замыкает пластину ячейки. Это повредит аккумулятор как можно быстрее.?
В жаркую погоду дополнительными причинами выхода из строя являются положительный рост решетки, повреждение металла положительной сетки, отрицательная усадка сетки, коробление пластины или потеря воды. Глубокие разряды, вибрация, нагрев, быстрая зарядка и перезарядка — все это стимулирует процесс «старения». Около 50% преждевременных отказов автомобильных аккумуляторов вызваны отсутствием технического обслуживания, испарением из-за сильного геотермального тепла или потерей воды для нормальной подзарядки из-за перезарядки. Положительный рост сетки и недозарядка, вызванная сульфатацией, могут привести к преждевременным отказам.
Около 50% преждевременных отказов автомобильных аккумуляторов вызваны отсутствием технического обслуживания, испарением из-за сильного геотермального тепла или потерей воды для нормальной подзарядки из-за перезарядки. Положительный рост сетки и недозарядка, вызванная сульфатацией, могут привести к преждевременным отказам.
Срок службы батареи зависит от ее химического возраста, который превышает время после сборки батареи. Химический возраст батареи определяется сложной комбинацией нескольких факторов, включая температурную историю и режим зарядки. Все перезаряжаемые батареи годны к употреблению и химически не эффективны с возрастом. По мере химического старения литий-ионных аккумуляторов объем удерживаемого ими заряда уменьшается, сокращается срок службы аккумулятора и снижается максимальная производительность.
Заключение
Вот и все. Здесь мы рассмотрели основную идею о том, как работают батареи. Энергия запасается в специальных соединениях, из которых состоят анод, катод и электролит. Аккумулятор достигает заряженного состояния во время перезарядки или сборки устройства. Во время разряда химическое вещество на аноде высвобождает электроны, а ионы в электролите подвергаются реакции окисления. Многие электрохимические и термические процессы происходят одновременно, и даже самые практичные комбинации элементов, упакованные в виде аккумуляторов, не могут полностью отразить все процессы. Таким образом, приближение основных реакций является лишь кратким описанием того, что происходит на самом деле, но также помогает объяснить основной принцип работы батареи.
Аккумулятор достигает заряженного состояния во время перезарядки или сборки устройства. Во время разряда химическое вещество на аноде высвобождает электроны, а ионы в электролите подвергаются реакции окисления. Многие электрохимические и термические процессы происходят одновременно, и даже самые практичные комбинации элементов, упакованные в виде аккумуляторов, не могут полностью отразить все процессы. Таким образом, приближение основных реакций является лишь кратким описанием того, что происходит на самом деле, но также помогает объяснить основной принцип работы батареи.
литий-ионный аккумулятор аккумулятор для электровелосипеда литиевый аккумулятор
Предыдущая статья:
Как восстановить пробитые аккумуляторы — Хранение и восстановление
Следующая статья:
Угольно-цинковая батарея – преимущества и ограничения
Как работает батарея?
Энергия не может быть создана или уничтожена, но ее можно сохранить в различных формах. Один из способов его хранения — в виде химической энергии в батарее. При подключении к цепи батарея может производить электричество.
Один из способов его хранения — в виде химической энергии в батарее. При подключении к цепи батарея может производить электричество.
Батареи преобразуют химическую энергию в электрическую |
Батарея имеет два вывода: положительный (катод) и отрицательный (анод). Если вы соедините две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
В батарее происходит химическая реакция
Простой пример. Батарейка с лимонными ячейками
Начнем с очень простой батарейки, в которой используется, например, лимон, в который вставлены два разных металлических предмета. оцинкованный гвоздь и медная монета или проволока. Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая создает небольшую разность потенциалов.
оцинкованный гвоздь и медная монета или проволока. Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая создает небольшую разность потенциалов.
Поскольку атомы меди (Cu) притягивают электроны больше, чем атомы цинка (Zn), если вы поместите кусок меди и кусок цинка в контакт друг с другом, электроны перейдут от цинка к меди. Когда электроны концентрируются на меди, они будут отталкиваться друг от друга и останавливать поток электронов от цинка к меди. С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь по проводу.
ЛИМОННАЯ БАТАРЕЯ | Как работает лимонная батарейка? Лимонная батарея состоит из лимона и двух металлических электродов из разных металлов, таких как медная монета или проволока, и оцинкованного (оцинкованного) гвоздя. Энергия для батареи исходит не от лимона, а от химического превращения цинка (или другого металла). Цинк окисляется внутри лимона, обменивая часть своих электронов, чтобы достичь более низкого энергетического состояния, а высвобождаемая энергия обеспечивает энергию. Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе. Если предположить, что используются цинковые и медные электроды (например, медная монета и оцинкованный гвоздь), то один лимон может генерировать примерно 0,9 Вольт. Слева последовательная цепь лимонов показывает, что вырабатывается 3,41 вольта. ПРИМЕЧАНИЕ: Можно использовать картофель, яблоки, квашеную капусту или любые другие фрукты или овощи, содержащие кислоту или другой электролит, но лимоны предпочтительнее из-за их более высокой кислотности. Например, в картофеле электролитом является фосфорная кислота, а в лимонах — лимонная кислота. |
В лимонной батарее происходит как окисление (потеря электронов), так и восстановление (приобретение электронов). Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Zn —> Zn2 + + 2 e-
На медном катоде ионы водорода (сольватированные протоны из кислого раствора в лимоне) восстанавливаются с образованием молекулярного водорода:
2H++ 2e—> h3
Что заставляет электроны двигаться?
Когда вы отпускаете мяч, который держите в руках, он падает на землю, потому что гравитационное поле Земли тянет мяч вниз. Точно так же заряженные частицы, такие как электроны, должны совершить работу, чтобы переместиться из одной точки в другую. Количество работы на единицу заряда называется разностью электрических потенциалов между двумя точками. Единица разности потенциалов называется вольт.
Разность потенциалов между катодом и анодом определяется химической реакцией. Внутри батареи электроны подталкиваются химической реакцией к положительному концу, создавая разность потенциалов.
Именно эта разность потенциалов заставляет электроны двигаться по проводу.
Разность потенциалов может быть положительной или отрицательной, подобно гравитационной энергии, движущейся вверх или вниз по склону. В батарее поток электронов направлен вниз… электроны могут течь вверх, как в случае с зарядным устройством.
Почему внутри батареи электроны не перемещаются от анода к катоду?
Электролит в батарее не дает одиноким электронам двигаться прямо от анода к катоду внутри батареи. Когда клеммы соединены токопроводящим проводом, электроны могут легко течь от анода к катоду.
В каком направлении движутся электроны в проводе?
Электроны заряжены отрицательно, поэтому они будут притягиваться к положительному концу батареи и отталкиваться от отрицательного конца. Когда батарея подключена к устройству, которое позволяет электронам течь через нее, они текут от отрицательного (анодного) к положительному (катодному) выводу.
Когда батарея подключена к устройству, которое позволяет электронам течь через нее, они текут от отрицательного (анодного) к положительному (катодному) выводу.
Кто изобрел гальванический элемент (батарейку)?
ПЕРВАЯ БАТАРЕЯ VOLTA | Аккумулятор производства Volta считается первым гальваническим элементом. Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом. Теперь у нас есть две клеммы, и ток будет течь, если мы их соединим. Реакции в этой ячейке следующие: цинк Zn —> Zn2+ + 2e- серная кислота 2H+ + 2e- —> h3 Медь не вступает в реакцию, действуя как электрод для химической реакции. |
Как работает современный аккумулятор (угольно-цинковый аккумулятор)?
Сухой угольно-цинковый элемент или батарея упакованы в цинковую банку, которая служит как контейнером, так и отрицательной клеммой (анодом). Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Цинк окисляется в соответствии со следующим полууравнением. Диоксид марганца смешивают с угольным порошком для увеличения электропроводности. Реакция выглядит следующим образом: 2MnO2(т) + 2 e- + 2Nh5Cl(водн.) —> , а CL сочетается с Zn2+. В этой полуреакции марганец восстанавливается из степени окисления (+4) в (+3). Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как: Zn(тв) + 2MnO2(тв) + 2Nh5Cl(вод) —> Mn2O3(тв) + Zn(Nh4)2Cl2 (вод) + h3O(ж) Аккумулятор имеет Э. |
Какие существуют типы батарей?
В разных типах батарей используются разные типы химикатов и химических реакций. Некоторые из наиболее распространенных типов батарей:
Щелочные батареи | Используется в батареях Duracell® и Energizer® и других щелочных батареях. Электроды цинково-марганцево-оксидные. Электролит представляет собой щелочную пасту. |
Свинцово-кислотный аккумулятор | Используются в автомобилях. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. |
Литиевая батарея | Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литиевая батарея | Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литий-ионный аккумулятор | Эти батареи используются в портативных компьютерах, сотовых телефонах и другом портативном оборудовании с интенсивным использованием. |
| Никель-кадмиевая или никель-кадмиевая батарея | Электроды никель-гидроксидно-кадмиевые. Электролит — гидроксид калия. |
| Цинк-угольная батарея или стандартная угольная батарея – | Цинк и углерод используются во всех обычных или стандартных сухих батареях AA, C и D. Электроды изготовлены из цинка и углерода, а паста из кислотных материалов между ними служит электролитом. Электроды изготовлены из цинка и углерода, а паста из кислотных материалов между ними служит электролитом. |
ССЫЛКИ И ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Potato Power: Руководство для учителя
История батареи
Электрохимические реакции
Углеродно-цинковая батарея в цинковой батарее 9065?
Как работают батареи Анимированное руководство по науке о батареях
Оценка
Вопросы:
М многократный
Выбор вопросов
1. В
аккумулятор плюсовая клемма называется:
а) анод
б) катод
в) электролит
г) провод
2.
Что заставляет электроны течь по проводу:
а) гравитационный потенциал выталкивает электроны через провод
б) кислоты проталкивают электроны по проводу
в) разность потенциалов между анодом и катодом толкает электроны
по проводу
г) электроны текут не по проводу, а по электролиту
3.
Какое утверждение о лимонной батарейке верно?
а) Энергия для батареи исходит не от лимона, а
скорее химическое изменение цинка (или другого металла)
б) Батарея состоит из двух металлических электродов разной
металлы, такие как медная монета или проволока и оцинкованный гвоздь.
в) В лимонной батарейке происходит как окисление (потеря электронов), так и восстановление
(приобретение электронов).
г) все вышеперечисленное верно
4.
Какой тип батареи используется в ноутбуках и мобильных телефонах?
а) Щелочная батарея
б) Цинк-угольная батарея
в) Литий-ионный аккумулятор
г) свинцово-кислотный аккумулятор
5.
Каковы основные компоненты первой электрохимической ячейки Вольта?
а) Цинк, угольный стержень и серная кислота в качестве электролита
б) Цинк, медь и лимонный сок в качестве электролита
в) Медь, цинк и серная кислота в качестве электролита
г) Цинк, графит и серная кислота в качестве электролита
Как работают батареи? | Живая наука
Батарея работает, замыкая цепь внутри электрического устройства.
(Изображение предоставлено: Mrs_ya | Shutterstock)
Батарейки повсюду. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на широкое распространение в повседневной жизни людей, батареи часто остаются незамеченными. Подумайте об этом: вы действительно знаете, как работает батарея? Не могли бы вы объяснить это кому-то другому?
Вот краткое изложение научных данных об источниках энергии, питающих смартфоны, электромобили, кардиостимуляторы и многое другое. [Викторина: электрические и газовые транспортные средства]
Анатомия аккумулятора
Большинство аккумуляторов состоят из трех основных частей: электродов, электролита и сепаратора, по словам Энн Мари Састри, соучредителя и генерального директора компании Sakti3 из Мичигана. запуск аккумуляторной технологии.
В каждой батарее два электрода. Оба сделаны из проводящих материалов, но выполняют разные роли. Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разряда.
Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разряда.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы. Ионы соединяются с материалами, из которых состоят электроды, вызывая химические реакции, которые позволяют батарее генерировать электрический ток. [Взгляд изнутри на то, как работают батареи (инфографика)]
Типичные батареи питаются за счет химической реакции. [Посмотреть полную инфографику] (Изображение предоставлено Карлом Тейтом, художником по инфографике)
Последняя часть батареи, сепаратор, довольно проста. Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Как это работает
Чтобы представить, как работает батарейка, представьте, что вы вставляете щелочные батарейки типа двойных АА в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь. Химическая энергия, хранящаяся в батарее, преобразуется в электрическую энергию, которая уходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но уже на противоположном конце от исходного.
Все части батареи работают вместе, чтобы фонарик загорелся. Электроды в батарее содержат атомы некоторых проводящих материалов. Например, в щелочной батарее анод обычно сделан из цинка, а диоксид марганца выступает в качестве катода. А электролит между и внутри этих электродов содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, происходящих в электродах, известна под общим названием окислительно-восстановительные (окислительно-восстановительные) реакции. В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к высвобождению электронов из атомов электрода, сказал Састри.
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате два электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, когда расходуются электроны (которые отрицательно заряжены). Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду. Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Когда вы щелкаете выключателем фонарика, все меняется. Теперь у электронов есть путь к катоду. Но сначала они должны пройти через основание лампы вашего фонаря. Цепь замыкается, когда электрический ток снова входит в батарею через верхнюю часть батареи на катоде.
Перезаряжаемые и неперезаряжаемые
Для первичных батарей, например, в фонарике, реакции, подпитывающие батарею, со временем перестанут происходить, а это означает, что электроны, обеспечивающие заряд батареи, больше не будут создавать электрический ток. Когда это происходит, батарея разряжается или «разряжается», сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставляют батарею производить энергию, необратимы, объяснил Састри. Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, можно обратить вспять, подав в батарею электрическую энергию. Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Одними из наиболее распространенных сегодня вторичных батарей являются литий-ионные (Li-ion) батареи, которые питают большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе. Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и беспроводные электроинструменты. Свинцово-кислотные (Pb-кислотные) батареи обычно используются для питания автомобилей и других транспортных средств для запуска, освещения и зажигания.
Все эти перезаряжаемые батареи работают по одному и тому же принципу, сказал Састри: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, а анод и катод возвращаются в исходное состояние. [10 ведущих прорывных технологий]
[10 ведущих прорывных технологий]
Батарейный жаргон
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при обсуждении аккумуляторов:
Напряжение : Когда речь идет о батареях, напряжение — также известное как номинальное напряжение элемента — описывает величину электрической силы или давления, при котором свободные электроны перемещаются от положительного полюса батареи к отрицательному, объяснил Састри. . В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (большая электрическая сила). Батарейки в фонарике обычно имеют напряжение 1,5 вольта. Однако, если фонарик использует две последовательно соединенные батареи, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные аккумуляторы, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольта. Но обычно в автомобильном аккумуляторе шесть таких элементов соединены последовательно, поэтому вы, вероятно, слышали, что такие батареи называются 12-вольтовыми.
Но обычно в автомобильном аккумуляторе шесть таких элементов соединены последовательно, поэтому вы, вероятно, слышали, что такие батареи называются 12-вольтовыми.
Литий-кобальт-оксидные батареи — наиболее распространенный тип литий-ионных батарей в бытовой электронике — имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер, или ампер, является мерой электрического тока или количества электронов, протекающих через цепь в течение определенного периода времени.
Емкость : Емкость или емкость элемента измеряется в ампер-часах, что представляет собой количество часов, в течение которых батарея может обеспечивать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райс. Факультет электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно подавать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и считается разряженной.
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей удельная мощность важна, потому что она говорит вам, как быстро автомобиль может разгоняться от 0 до 60 миль в час (97 км/ч). Инженеры постоянно пытаются придумать способы сделать батареи меньше, не уменьшая их плотность мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна выдать батарея, деленное на объем или массу батареи, сказал Састри. Это число соответствует вещам, которые оказывают большое влияние на пользователей, например, сколько времени вам нужно, чтобы зарядить свой мобильный телефон, или как далеко вы можете проехать на своем электромобиле, прежде чем остановиться, чтобы включить его.
Подписывайтесь на Элизабет Палермо @ techEpalermo . Подпишитесь на Live Science @livescience , Facebook & Google+ .
Дополнительные ресурсы
- Ассоциация стандартов IEEE: стандарты аккумуляторов
- Агентство по охране окружающей среды: ресурсосбережение — аккумуляторы
- All-Battery.com: Таблица размеров (открывается в новой вкладке)
6
Элизабет — заместитель редактора Live Science, пишет о науке и технологиях. Она получила степень бакалавра искусств в Университете Джорджа Вашингтона. Элизабет путешествовала по Америке, изучая политические системы и культуры коренных народов, а также обучая английскому языку учащихся всех возрастов.
Литий-ионная батарея Принцип работы и применение — StudiousGuy
Литий-ионная батарея — это тип перезаряжаемой батареи, в которой используются заряженные частицы лития для преобразования химической энергии в электрическую. М. Стэнли Уиттингем, британо-американский химик, известен как отец-основатель литий-ионных аккумуляторов. Он разработал концепцию перезаряжаемых батарей в конце 19 века. 70-е годы. В 2019 году М. Стэнли Уиттингем, Джон Гуденаф и Акира Йошино были удостоены Нобелевской премии по химии за свою работу. По способности к перезарядке литий-ионные аккумуляторы можно разделить на две большие категории, а именно первичные и вторичные. Первичные литий-ионные аккумуляторы не подлежат перезарядке, а вторичные литий-ионные аккумуляторы можно перезаряжать.
70-е годы. В 2019 году М. Стэнли Уиттингем, Джон Гуденаф и Акира Йошино были удостоены Нобелевской премии по химии за свою работу. По способности к перезарядке литий-ионные аккумуляторы можно разделить на две большие категории, а именно первичные и вторичные. Первичные литий-ионные аккумуляторы не подлежат перезарядке, а вторичные литий-ионные аккумуляторы можно перезаряжать.
Указатель статей (щелкните, чтобы перейти)
Принцип работы литий-ионной батареи
Литий-ионные батареи работают по принципу кресла-качалки. Здесь преобразование химической энергии в электрическую происходит с помощью окислительно-восстановительных реакций. Обычно литий-ионный аккумулятор состоит из двух или более электрически соединенных гальванических элементов. Когда батарея заряжена, ионы стремятся двигаться к отрицательному электроду или аноду. Когда аккумулятор полностью разряжается, ионы лития возвращаются обратно к положительному электроду, то есть к катоду. Это означает, что во время процесса зарядки и разрядки ионы лития перемещаются между двумя электродами батареи, поэтому принцип работы литий-ионной батареи называется принципом кресла-качалки.
Работа литий-ионной батареи
Батарея обычно состоит из двух электродов, а именно анода и катода. Катод образует положительную клемму батареи, а анод предназначен для отрицательной клеммы. Катод литий-ионной батареи в основном состоит из соединения лития, а основным элементом анода является графит. Когда батарея подключена к источнику питания, ионы лития имеют тенденцию перемещаться от катода к аноду, то есть от положительного электрода к отрицательному электроду. Это называется зарядкой аккумулятора. Во время фазы разрядки батареи движение ионов лития меняется на противоположное от анода к катоду, то есть от отрицательного электрода к положительному, и электрическая энергия передается на подключенную нагрузку.
Использование литий-ионных аккумуляторов
Сотовые устройства
Почти все сотовые устройства, такие как мобильные телефоны, ноутбуки, беспроводные телефоны и т. д., используют литий-ионные аккумуляторы. Это связано с тем, что литий-ионные аккумуляторы компактны, легки и пригодны для повторного использования. Следовательно, они идеально подходят для портативных устройств. Кроме того, такие типы батарей обеспечивают быструю скорость зарядки, что позволяет пользователю часто получать доступ к устройствам без помех.
Следовательно, они идеально подходят для портативных устройств. Кроме того, такие типы батарей обеспечивают быструю скорость зарядки, что позволяет пользователю часто получать доступ к устройствам без помех.
Power Banks
Power Bank — это портативный гаджет, который помогает пользователю удобно заряжать электронные устройства, такие как мобильные телефоны, смарт-часы и т. д., в любом месте и в любое время. Для этой цели в Power Bank обычно используются литий-ионные и литий-полимерные аккумуляторы.
Электромобили
Ряд электромобилей, таких как электромобили, электрические велосипеды, электрические скутеры, электрические велосипеды и т. д., используют для своей работы литий-ионные батареи. Это связано с тем, что литий-ионные аккумуляторы имеют высокое отношение мощности к весу, большую устойчивость к колебаниям температуры и давления и более высокую плотность энергии, чем свинцово-кислотные аккумуляторы. Кроме того, они легкие, портативные, эффективные и более безопасные, чем традиционные батареи.
Медицинские устройства
Медицинские устройства, такие как слуховые аппараты, хирургические инструменты, диагностические аппараты, кардиостимуляторы, дефибрилляторы, роботы-помощники, инфузионные насосы, мониторы частоты сердечных сокращений и пульса и т. д., используют литий-ионные батареи для различных диагностических и цели лечения. К преимуществам использования литий-ионных аккумуляторов в медицинских гаджетах можно отнести высокое быстродействие, быструю скорость зарядки, малый вес, безопасность и др.
Камеры
Литий-ионные аккумуляторы широко используются в цифровых зеркальных фотокамерах, поскольку они способны обеспечивать большую мощность в течение сравнительно более длительного времени, чем традиционные аккумуляторы. Кроме того, литий-ионные аккумуляторы предпочтительнее, потому что они легкие, а значит, не делают гаджет громоздким. В некоторых камерах также используются перезаряжаемые литий-ионные батареи, что позволяет пользователю повторно использовать их и повышает надежность.
ИБП
ИБП (система бесперебойного питания) — это устройство, обеспечивающее резервное питание в течение определенного периода времени в случае отключения или сбоя питания. В таких устройствах обычно используется комбинация литий-ионных аккумуляторов. Это связано с тем, что использование литий-ионных аккумуляторов в устройствах ИБП уменьшает занимаемую площадь на 50-80%. Кроме того, система ИБП на основе литий-ионных аккумуляторов весит на 60–80 % меньше, чем обычное устройство ИБП на основе свинцово-кислотных батарей.
Роботы
Литий-ионные аккумуляторы очень популярны в области робототехники и автоматизации. Они используются для питания роботов-гуманоидов, а также промышленных роботов.
Преимущества литий-ионных аккумуляторов
1. Литий-ионные аккумуляторы имеют значительно более низкую скорость саморазряда по сравнению с другими типами аккумуляторов.
2. Обладают высокой плотностью энергии.
3. В литий-ионных батареях отсутствует эффект памяти.
В литий-ионных батареях отсутствует эффект памяти.
4. Средний срок службы литий-ионных аккумуляторов в десять раз больше, чем у традиционных свинцово-кислотных аккумуляторов.
5. Высокая скорость зарядки литий-ионных аккумуляторов.
6. Литий-ионные аккумуляторы эффективно работают в экстремальных условиях, таких как высокое давление и колебания температуры.
7. Литий-ионные аккумуляторы легкие и компактные. Как правило, вес литий-ионных аккумуляторов примерно на 50-60% меньше, чем у стандартных свинцово-кислотных аккумуляторов.
8. Установка литий-ионных аккумуляторов сравнительно проста.
9. Аккумуляторы этого типа гибкие, менее громоздкие и безопасные в использовании.
10. Литий-ионные аккумуляторы доступны в различных формах и размерах.
11. Уровень напряжения литий-ионного аккумулятора не падает и поддерживается постоянно на протяжении всего использования.
12. Емкость литий-ионного аккумулятора примерно на 25-50% больше, чем у свинцово-кислотного аккумулятора.


 Для них подходит 6СТ-75;
Для них подходит 6СТ-75;


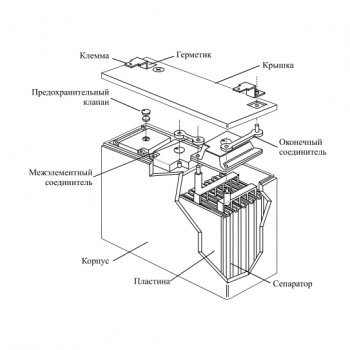 Но принцип работы АКБ остаётся тем же.
Но принцип работы АКБ остаётся тем же.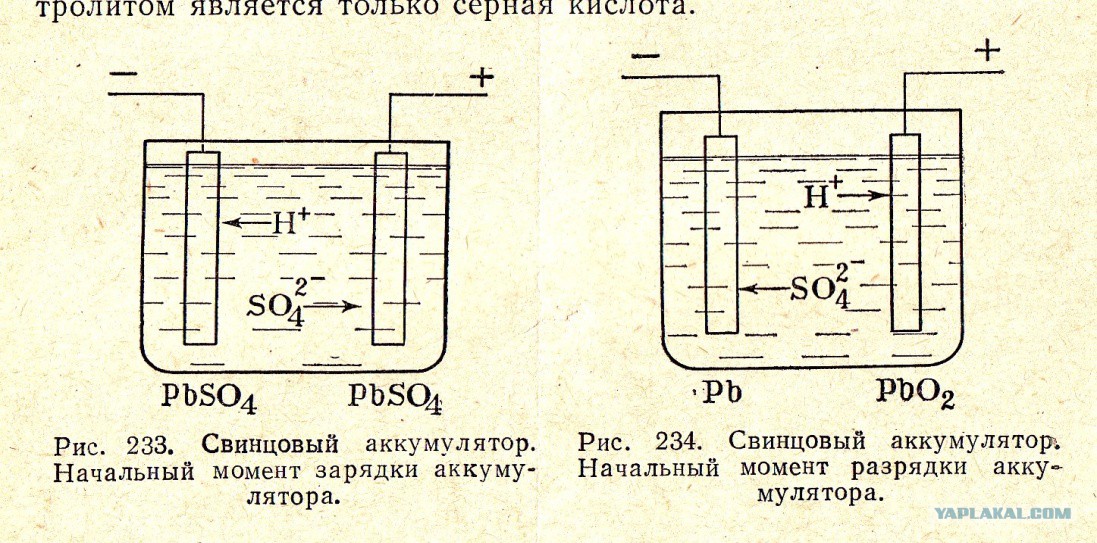 Можно смело утверждать, что современный образ жизни был бы невозможен без аккумуляторных батарей.
Можно смело утверждать, что современный образ жизни был бы невозможен без аккумуляторных батарей.
 Чаще всего на автомобили российского производства нужны аккумуляторы с прямой полярностью, а на европейского и азиатского – с обратной.
Чаще всего на автомобили российского производства нужны аккумуляторы с прямой полярностью, а на европейского и азиатского – с обратной.

 Конечно, за аккумулятор, на котором гордо красуется логотип Mercedes или Honda, придется выложить намного больше, чем за любой другой бренд, но результат того стоит. Самые популярные на рынке бренды аккумуляторов – Varta и Bosch. Они заслужили репутацию надежных безотказных батарей, добросовестно отрабатывающих каждую вложенную копейку.
Конечно, за аккумулятор, на котором гордо красуется логотип Mercedes или Honda, придется выложить намного больше, чем за любой другой бренд, но результат того стоит. Самые популярные на рынке бренды аккумуляторов – Varta и Bosch. Они заслужили репутацию надежных безотказных батарей, добросовестно отрабатывающих каждую вложенную копейку. Поврежденным аккумулятором пользоваться нельзя!
Поврежденным аккумулятором пользоваться нельзя! Они относятся к малообслуживаемым конструкциям. В составе электродов используется сурьма до 6%.
Они относятся к малообслуживаемым конструкциям. В составе электродов используется сурьма до 6%. E 0 измеряется в вольтах.
E 0 измеряется в вольтах. .
. )
) )
) ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l) )+е − Се 3+ (водный)
)+е − Се 3+ (водный)


 Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли.
Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли. Д.С. около 1,5 В.
Д.С. около 1,5 В. 