Содержание
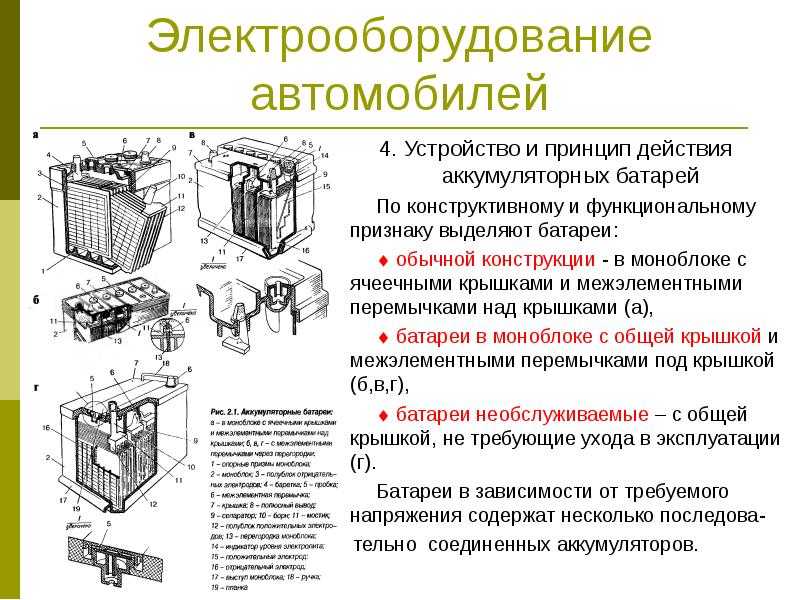
4. Назначение аккумуляторной батареи
Аккумуляторная
батарея предназначена для питания
основных потребителей на остановках,
в аварийных режимах и при малых скоростях
движения поезда.
Основные
потребители цепи сигнализации, защиты
и управления могут получать питание от
аккумуляторной батареи не только на
остановках но и при внезапном выходе
из строя генератора во время движения,
кроме того аккумуляторная батарея
выполняет функцию защиты – она снимает
величину коммутационных перенапряжений
возникающих при отключении потребителей
во время работы генератора. Эти
перенапряжения могут оказать отрицательное
воздействие на цепи питания потребителей,
поэтому эксплуатация с отключенной
батареей запрещается.
Аккумуляторная
батарея расположена под вагоном в
специальных ящиках, оборудованных
вентиляционными решетками для удаления
взрывоопасной смеси образующейся при
зарядке аккумуляторов.
Аккумулятором
называется химический источник тока,
который способен накапливать и сохранять
электроэнергию, полученную от вагонного
генератора или из вне от зарядного
устройства, а потом отдавать ее.
Аккумуляторные
батареи бывают кислотные (свинцовые) а
также щелочные (никель-железные и
никель-кадмиевые). Щелочные аккумуляторные
батареи дешевле и обладают повышенной
механической прочностью не выходят из
строя в результате низких температур
имеют повышенный срок службы и не требуют
тщательного ухода. Основной недостаток
– низкий КПД.
5. Щелочные аккумуляторы.
Назначение,
устройство и принцип работы
В
заряженных щелочных аккумуляторах
активная масса положительных пластин
состоит из гидрооксида никеля, а активная
масса отрицательных пластин из губчатого
железа. Электролит содержит 20% едкого
калий. Для увеличения срока службы в
электролит добавляют едкий литий.
Устройство
щелочного никельного аккумулятора
состоит из полублока. Полублок состоит
из 10-ти положительных и 11-ти отрицательных
соединенных шпильками или сваркой
пластин. Сепараторами служат эбонитовые
палочки. Металлический корпус электрически
соединен с полублоком отрицательных
пластин и установлен в резиновый
изолирующий чехол. Полюсные выводы с
Полюсные выводы с
резьбовыми наконечниками, служащими
для крепления межаккумуляторных
перемычек изолированы от крышки корпуса
эбонитовыми шайбами и имеют уплотняющие
сальники. Электролит заливают через
отверстие с клапаном для выхода газов.
Между собой аккумуляторы сгруппированы
и подвешены по 3 в 14-ти деревянных ящиках.
6. Уход за аккумуляторными батареями
в пути
следования в зимний период
Осмотреть
ящик на целостность. Ящик должен быть
закрыт.
Вентиляционные
решетки должны быть очищения от снега
и грязи (деревянным предметом).
7. Для чего служит регулятор напряжения генератора (рнг)
РНГ
служит для воздействия, на величину
тока возбуждения поддерживая напряжение
генератора неизменным.
Любой
генератор имеет измерительное устройство
контролирующее изменение напряжения
от заданной величины и исполнительного
устройство, которое, получив сигнал от
измерительного устройства воздействует
на величину тока возбуждения и приводит
напряжение генератора к норме.
Принцип действия и устройство аккумуляторных батарей автомобиля
Принцип действия и устройство аккумуляторных батарей автомобиля
Аккумуляторная батарея предназначена для питания электрической энергией всех потребителей при неработающем двигателе и при работе его с малой частотой вращения коленчатого вала, а также для пуска двигателя стартером.
На автомобилях используют стартерные свинцово-кислот-ные аккумуляторные батареи. Такие батареи способны кратковременно отдавать ток большой величины, что необходимо при пуске двигателя стартером.
Аккумуляторная батарея состоит из трех, шести или двенадцати последовательно соединенных аккумуляторов напряжением 2В каждый. Аккумуляторные батареи выпускаются на 6, 12 и 24В. Простейший свинцово-кислотный аккумулятор представляет собой пластмассовый сосуд, в который опущены две свинцовые пластины и залит электролит из химически чистой (аккумуляторной) серной кислоты и дистиллированной воды. Если через такой аккумулятор пропускать постоянный электрический ток, то в нем будет протекать химическая реакция с образованием на положительной пластине двуокиси свинца, а на отрицательной — чистого губчатого свинца (Рb). Плотность электролита по мере заряда аккумулятора будет повышаться за счет выделения серной кислоты и поглощения воды. Напряжение на клеммах аккумулятора также будет повышаться. Такой процесс называется зарядом аккумулятора. При включении заряженного аккумулятора во внешнюю цепь будет происходить обратная химическая реакция с отдачей электрической энергии на питание включенных потребителей. По мере разряда пластины аккумулятора будут покрываться сернокислым свинцом, плотность электролита и напряжение аккумулятора будут уменьшаться. Такой процесс называется разрядом аккумулятора. После разряда необходимо вновь зарядить аккумулятор от источника постоянного тока. Поскольку при заряде и разряде аккумулятора изменяется плотность электролита, то по плотности электролита определяют степень раз-ряженности (заряженности) аккумулятора.
Если через такой аккумулятор пропускать постоянный электрический ток, то в нем будет протекать химическая реакция с образованием на положительной пластине двуокиси свинца, а на отрицательной — чистого губчатого свинца (Рb). Плотность электролита по мере заряда аккумулятора будет повышаться за счет выделения серной кислоты и поглощения воды. Напряжение на клеммах аккумулятора также будет повышаться. Такой процесс называется зарядом аккумулятора. При включении заряженного аккумулятора во внешнюю цепь будет происходить обратная химическая реакция с отдачей электрической энергии на питание включенных потребителей. По мере разряда пластины аккумулятора будут покрываться сернокислым свинцом, плотность электролита и напряжение аккумулятора будут уменьшаться. Такой процесс называется разрядом аккумулятора. После разряда необходимо вновь зарядить аккумулятор от источника постоянного тока. Поскольку при заряде и разряде аккумулятора изменяется плотность электролита, то по плотности электролита определяют степень раз-ряженности (заряженности) аккумулятора.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Таким образом, действие аккумулятора основано на превращении электрической энергии в химическую при заряде и, наоборот, химической энергии в электрическую — при разряде.
Основными параметрами аккумулятора являются напряжение и емкость.
Напряжение на выводных штырях исправного и полностью заряженного аккумулятора около 2 В. Допускается в процессе эксплуатации разряжать аккумуляторы до 1,7 В.
Количество электричества в ампер-часах (А-ч), полученное от аккумулятора при его разряде до допустимого напряжения, называется емкостью, которую определяют как произведение силы разрядного тока в амперах на время разряда в часах. Емкость зависит от количества и размеров пластин аккумуляторов, силы разрядного тока, плотности и температуры электролита, а также степени заряженности, технического состояния и срока службы аккумулятора (батареи).
Номинальной емкостью аккумуляторной батареи называется наименьшее количество электричества в ампер-часах, которое должна отдать новая, полностью заряженная батарея при непрерывном разряде ее током, равным 0,05 номинальной емкости до напряжения 1,7 В при температуре электролита 25 °С. Номинальная емкость в основном зависит от размеров и количества пластин в аккумуляторе.
Каждый тип стартерной аккумуляторной батареи имеет свое условное обозначение, которое наносится на межэлементном соединении (перемычке) или на баке и означает:
— первое число (3, 6 или 12)—количество последовательно соединенных аккумуляторов в батарее;
— СТ или ТСТ — назначение батареи: стартерная или стартерная для тяжелых условий эксплуатации, соответственно;
— число после букв — номинальную емкость батареи, выраженную в ампер-часах.
Остальные буквы означают:
— Э, П, Т — материал бака, соответственно: эбонит, пластмасса асфальтопековая, термопластмасса;
— М, МС, Р, PC — материал сепаратора, соответственно: мипласт, мипласт со стекловолокном, мипор, мипор со стекловолокном.
Например, условное обозначение батареи 6СТ-90ЭМС указывает, что батарея состоит из шести последовательно соединенных аккумуляторов, стартерная, номинальная емкость батареи 90 А-ч, бак эбонитовый, а сепараторы двойные — мипласт со стекловолокном.
На автомобилях ГАЗ-66 и ГАЗ-53А устанавливается аккумуляторная батарея 6СТ-75ЭМС. Батарея состоит из шести последовательно соединенных аккумуляторов, размещенных в шестикамерном эбонитовом баке. Каждый аккумулятор включает в себя пять положительных и шесть отрицательных пластин. Положительные и отрицательные пластины представляют собой свинцовые решетки, заполненные активной массой, которая и участвует в химических реакциях при зарядах и разрядах аккумулятора. После сложной технологической обработки пластин активная масса положительных пластин превращается в двуокись свинца (РЬОг) (темно-коричневого цвета), а отрицательных — в губчатый свинец (Рb) (серого цвета).
Однородные пластины аккумулятора соединяются между собой с помощью бареток 5 и образуют полублоки положительных и отрицательных пластин. Чтобы предотвратить соприкосновение разноименных пластин, между ними установлены прокладки — сепараторы. Ребристая сторона сепаратора всегда обращена к положительной пластине. При такой установке сепараторов обеспечивается лучший доступ электролита в поры активной массы положительных пластин, что повышает работоспособность аккумулятора.
Чтобы предотвратить соприкосновение разноименных пластин, между ними установлены прокладки — сепараторы. Ребристая сторона сепаратора всегда обращена к положительной пластине. При такой установке сепараторов обеспечивается лучший доступ электролита в поры активной массы положительных пластин, что повышает работоспособность аккумулятора.
Рис. 1. Аккумуляторная батарея:
1 — отрицательная пластина; 2 — сепаратор: 3 — положительная пластина; 4 — предохранительный щиток; 5 —баретка: 6 — штырь: 7 — плюсовая клемма; 8 — бак аккумуляторной батареи; 9 — уплотнительная мастика: 10 — пробка; 11 — крышка аккумулятора; 12 — межэлементное соединение; 13 — вентиляционное отверстие; 14 — минусовая клемма
Для защиты кромок сепараторов и пластин от .механических повреждений при замере плотности и уровня электролита сверху положен предохранительный щиток из кислотостойкого материала.
Сверху каждый аккумулятор закрывается крышкой II с двумя отверстиями для полюсных штырей от положительных и отрицательных пластин. В крышках также выполнены резьбовые отверстия под пробку для залива электролита и штуцеры с вентиляционными отверстиями для автоматической установки уровня электролита. На некоторых батареях 6СТ-75ЭМС штуцера может и не быть. У них вентиляционное отверстие выполнено в пробке. Стыки между крышкой и баком залиты мастикой.
В крышках также выполнены резьбовые отверстия под пробку для залива электролита и штуцеры с вентиляционными отверстиями для автоматической установки уровня электролита. На некоторых батареях 6СТ-75ЭМС штуцера может и не быть. У них вентиляционное отверстие выполнено в пробке. Стыки между крышкой и баком залиты мастикой.
На дне бака выполнены ребра, на которые опираются полублоки пластин. В пространстве между ребрами скапливается осыпающаяся со временем активная масса (шлам), что на гарантийный срок исключает за.мыкание разноименных пластин.
Аккумуляторы соединяют между собой с помощью межэлементных соединений, которые привариваются к штырям полублоков. Крайние штыри аккумуляторной батареи выполняют роль плюсовой и минусовой клемм.
Камеры аккумуляторов изолированы друг от друга. Через резьбовые отверстия крышек в аккумуляторы заливается электролит.
Плотность электролита должна соответствовать климатическому району, в котором эксплуатируется батарея.
Минусовая клемма батареи соединена с массой автомобиля через выключатель батареи, а плюсовая — с бортовой сетью. Для уменьшения падения напряжения на проводах и их нагрева батарея подсоединена к сети проводами большого сечения.
Для уменьшения падения напряжения на проводах и их нагрева батарея подсоединена к сети проводами большого сечения.
На автомобилях ЗИЛ-131 и ЗИЛ-130 используется батарея 6СТ-ЭМС. По устройству она аналогична батарее 6СТ-75ЭМС, но имеет в каждом аккумуляторе по шесть положительных и семь отрицательных пластин, что увеличивает ее емкость.
На автомобиле ЗИЛ-131 к батарее могут придаваться гидростатические пробки, которые исключают попадание воды в аккумуляторы при преодолении глубокого брода.
На автомобиле «Урал-375Д» устанавливается батарея типа 6СТЭН-140М. Ее особенностью является наличие деревянного ящика, в котором размещаются шесть эбонитовых баков. Клеммы выведены на панель ящика и защищены съемной коробкой. Емкость батареи повышена за счет увеличения количества и площади пластин.
Аккумулятор — Энергетическое образование
Энергетическое образование
Меню навигации
ИСТОЧНИКИ ЭНЕРГИИ
ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕ
ИНДЕКС
Поиск
Рис. 1. 9-вольтовая батарея. [1]
1. 9-вольтовая батарея. [1]
Аккумулятор — это устройство, которое накапливает энергию и затем разряжает ее путем преобразования химической энергии в электричество. Типичные батареи чаще всего производят электричество химическим путем за счет использования одного или нескольких гальванических элементов. [2] В батареях может использоваться и использовалось множество различных материалов, но наиболее распространенными типами батарей являются щелочные, литий-ионные, литий-полимерные и никель-металлогидридные. Батареи могут быть соединены друг с другом последовательно или параллельно.
Существует большое разнообразие аккумуляторов, доступных для покупки, и эти разные типы аккумуляторов используются в разных устройствах. Большие батареи используются для запуска автомобилей, в то время как гораздо меньшие батареи могут питать слуховые аппараты. В целом, аккумуляторы чрезвычайно важны в повседневной жизни.
Ячейки
Ячейка — это отдельная единица, которая каким-то образом производит электричество.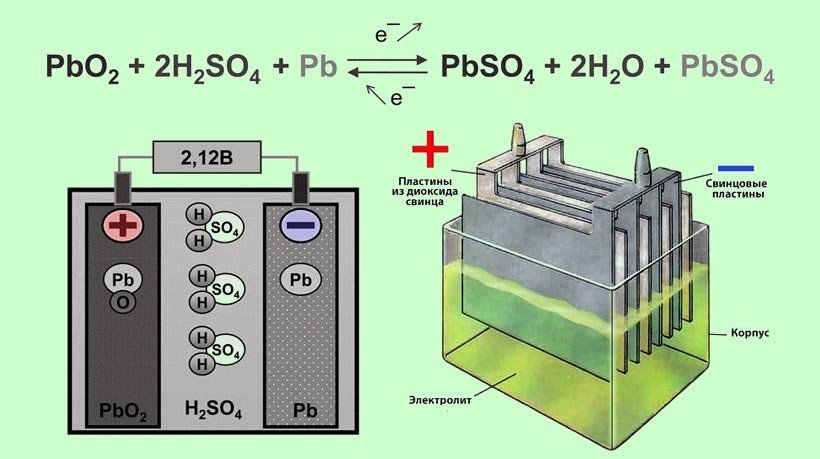 Вообще говоря, клетки генерируют энергию посредством термического, химического или оптического процесса.
Вообще говоря, клетки генерируют энергию посредством термического, химического или оптического процесса.
Типичный элемент имеет две клеммы (называемые электродами ), погруженные в химическое вещество (называемое электролитом ). Два электрода разделены пористой стенкой или перемычкой , которая позволяет электрическому заряду проходить с одной стороны на другую через электролит. Анод — отрицательная клемма — получает электроны, а катод — положительная клемма — теряет электроны. Этот обмен электронами позволяет создать разницу в потенциале или разнице напряжений между двумя терминалами, позволяя электричеству течь. [2]
В аккумуляторе может быть огромное количество элементов, от одного элемента в батарее типа АА до более 7100 элементов в аккумуляторе Tesla Model S мощностью 85 кВтч. [3]
Рис. 2. Схема в разрезе, показывающая строение щелочной батареи. [4]
Первичные элементы («сухие»)
В этих элементах химическое взаимодействие между электродами и электролитом вызывает необратимое изменение, то есть они не подлежат перезарядке .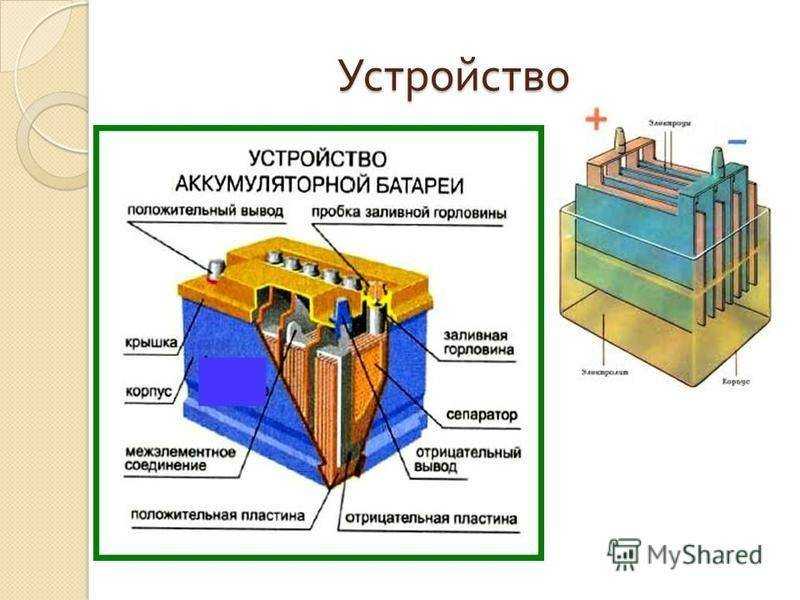 [2] Эти батареи предназначены для одноразового использования, что приводит к большему количеству отходов при использовании этих батарей, поскольку они утилизируются через относительно короткий период времени.
[2] Эти батареи предназначены для одноразового использования, что приводит к большему количеству отходов при использовании этих батарей, поскольку они утилизируются через относительно короткий период времени.
Вторичные элементы («влажные»)
Элементы этого типа (обозначаемые как влажные из-за использования жидкого электролита) генерируют ток через вторичный элемент в направлении, противоположном направлению первого/нормального элемента. Это заставляет химическое действие идти в обратном направлении, эффективно восстанавливаясь, а это означает, что они перезаряжаемый . [2] Эти батареи могут быть более дорогими при покупке, но они производят меньше отходов, поскольку их можно использовать несколько раз.
Емкость батареи
Батареи часто оцениваются по выходному напряжению и емкости. Емкость — это продолжительность работы конкретной батареи в Ач (ампер-часах) [2] :

Аккумуляторы также можно классифицировать по их энергоемкости. Это делается либо в ватт-часах, либо в киловатт-часах.
Моделирование Phet
Университет Колорадо любезно разрешил нам использовать следующее моделирование Phet. Эта симуляция исследует, как батареи работают в электрической цепи:
Для дополнительной информации
Для получения дополнительной информации см. соответствующие страницы ниже:
- Серийная цепь
- Параллельная цепь
- Постоянный ток
- Диспетчерский источник электроэнергии
- Электрическая сеть
- Электрогенератор
- Или исследуйте случайную страницу!
Список литературы
- ↑ 2.0 2.1 2.2 2.3 2.4 Р.Т. Пейнтер, «Основные электрические компоненты и счетчики», в Введение в электричество , 1-е изд.
 Нью-Джерси: Прентис-Холл, 2011, гл. 3, с. 3.4, стр. 89-94.
Нью-Джерси: Прентис-Холл, 2011, гл. 3, с. 3.4, стр. 89-94. - ↑ Технологические исследования металлов. (По состоянию на 28 июля 2015 г.). Going Natural: решение графитовой проблемы Теслы [онлайн], доступно:
- ↑ Гиперфизика. (По состоянию на 28 июля 2015 г.). Углеродно-цинковые батареи [онлайн], доступно: http://hyperphysics.phy-astr.gsu.edu/hbase/electric/battery.html
История и развитие аккумуляторов
Батареи прошли долгий путь с момента их появления в 250 г. до н.э. Предоставлено: Flickr/Patty, CC BY-NC-SA.
Аккумуляторы настолько распространены сегодня, что почти невидимы для нас. Тем не менее, это замечательное изобретение с долгой и легендарной историей и столь же захватывающим будущим.
Аккумулятор представляет собой устройство, в котором хранится химическая энергия, преобразуемая в электричество. По сути, батареи представляют собой небольшие химические реакторы, в ходе реакции которых образуются энергичные электроны, готовые пройти через внешнее устройство.
Батарейки давно с нами. В 1938 году директор Багдадского музея обнаружил в подвале музея то, что сейчас называют «Багдадской батареей». Анализ датировал его примерно 250 г. до н.э. и месопотамского происхождения.
Этот самый ранний пример батареи вызывает споры, но предлагаемые варианты использования включают гальваническое покрытие, обезболивание или религиозное покалывание.
Американский ученый и изобретатель Бенджамин Франклин впервые употребил термин «батарея» в 1749 году, когда проводил эксперименты с электричеством, используя набор связанных конденсаторов.
Первая настоящая батарея была изобретена итальянским физиком Алессандро Вольта в 1800 году. Вольта сложил диски из меди (Cu) и цинка (Zn), разделенные тканью, смоченной в соленой воде.
Провода, подключенные к любому концу стека, давали непрерывный стабильный ток. Каждая ячейка (набор медных и цинковых дисков и рассол) производит 0,76 Вольт (В). Полученное значение, кратное этому значению, определяется количеством ячеек, сложенных вместе.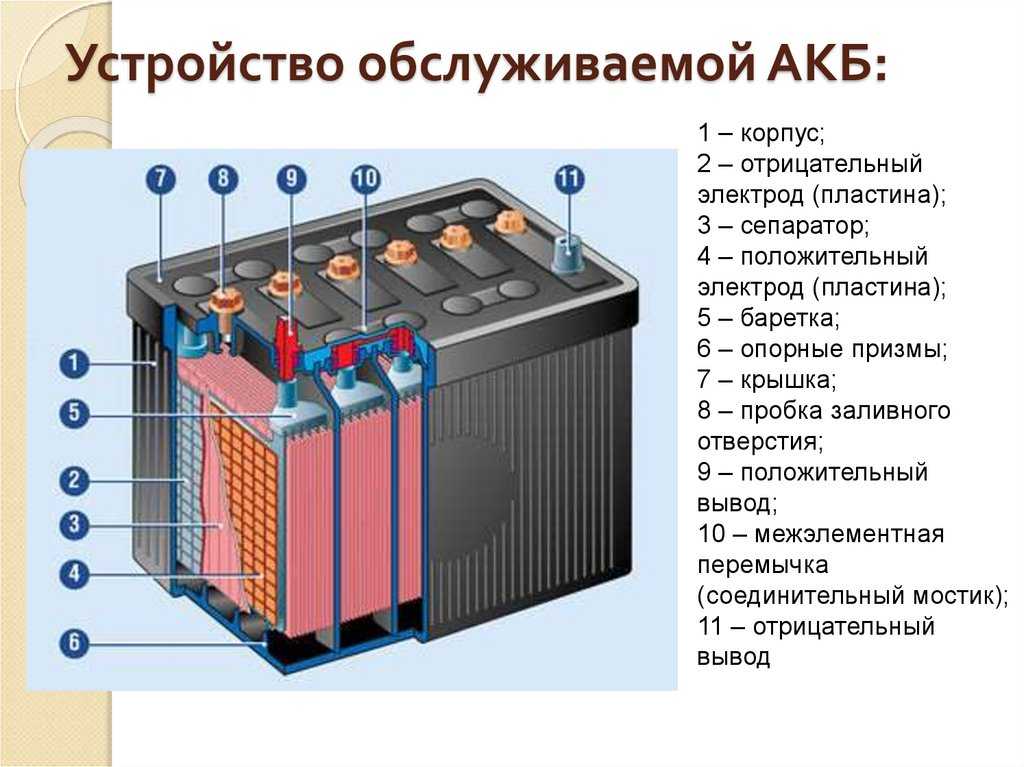
Один из самых долговечных аккумуляторов — свинцово-кислотный — был изобретен в 1859 г.и до сих пор является технологией, используемой для запуска большинства автомобилей с двигателями внутреннего сгорания. Это самый старый пример перезаряжаемой батареи.
Сегодня аккумуляторы бывают самых разных размеров: от мегаваттных, которые аккумулируют энергию солнечных ферм или подстанций, чтобы гарантировать стабильное энергоснабжение целых деревень или островов, до крошечных аккумуляторов, подобных тем, которые используются в электронных часах.
Аккумуляторы основаны на различных химических веществах, которые генерируют базовое напряжение элемента, как правило, в диапазоне от 1,0 до 3,6 В. Последовательное расположение элементов увеличивает напряжение, а их параллельное соединение увеличивает подачу тока. Этот принцип используется для суммирования требуемых напряжений и токов вплоть до мегаваттных размеров.
В настоящее время многие ожидают, что аккумуляторная технология сделает еще один скачок: разрабатываются новые модели с достаточной емкостью для хранения энергии, вырабатываемой бытовыми солнечными или ветровыми системами, а затем для питания дома в более удобное (обычно ночное) время в течение дня. несколько дней
несколько дней
Как работают батареи?
Когда аккумулятор разряжается, в ходе химической реакции образуются дополнительные электроны. Примером реакции, в результате которой образуются электроны, является окисление железа с образованием ржавчины. Железо реагирует с кислородом и отдает электроны кислороду с образованием оксида железа.
Стандартная конструкция батареи состоит из двух металлов или соединений с разным химическим потенциалом, разделенных пористым изолятором. Химический потенциал — это энергия, запасенная в атомах и связях соединений, которая затем передается движущимся электронам, когда им позволяют двигаться через подключенное внешнее устройство.
Проводящая жидкость, такая как соль и вода, используется для переноса растворимых ионов от одного металла к другому во время реакции и называется электролитом.
Металл или соединение, которое теряет электроны во время разряда, называется анодом, а металл или соединение, которое принимает электроны, называется катодом. Этот поток электронов от анода к катоду через внешнее соединение — это то, что мы используем для работы наших электронных устройств.
Этот поток электронов от анода к катоду через внешнее соединение — это то, что мы используем для работы наших электронных устройств.
Первичные и перезаряжаемые батареи
Если реакцию, вызывающую поток электронов, нельзя обратить вспять, батарею называют первичной. Когда один из реагентов расходуется, батарея разряжается.
Наиболее распространенной основной батареей является углеродно-цинковая батарея. Было обнаружено, что когда электролит представляет собой щелочь, батареи служат намного дольше. Это щелочные батареи, которые мы покупаем в супермаркете.
Проблема утилизации таких первичных батарей заключалась в том, чтобы найти способ их повторного использования путем перезарядки батарей. Это становится все более важным по мере того, как батареи становятся больше, а их частая замена становится коммерчески невыгодной.
Один из первых аккумуляторов, никель-кадмиевый аккумулятор (NiCd), также использует щелочь в качестве электролита. В 19Было разработано 89 никель-металловодородных аккумуляторов (NiMH), которые имели более длительный срок службы, чем никель-кадмиевые аккумуляторы.
Аккумуляторы этих типов очень чувствительны к перезарядке и перегреву во время зарядки, поэтому скорость заряда контролируется ниже максимальной скорости. Сложные контроллеры могут ускорить заряд, не занимая менее нескольких часов.
В большинстве других более простых зарядных устройств процесс обычно занимает ночь.
Портативные устройства, такие как мобильные телефоны и портативные компьютеры, постоянно нуждаются в максимальном и максимально компактном хранении энергии. Хотя это увеличивает риск резкого разряда, этим можно управлять с помощью ограничителей скорости тока в батареях мобильных телефонов из-за общего небольшого размера.
Но по мере того, как предполагается более широкое применение батарей, безопасность большого формата и большого количества элементов становится все более важным фактором.
Первый большой шаг вперед: литий-ионные аккумуляторы
Новые технологии часто требуют более компактных, более емких, безопасных перезаряжаемых аккумуляторов.
В 1980 году американский физик профессор Джон Гуденаф изобрел новый тип литиевой батареи, в которой литий (Li) мог мигрировать через батарею от одного электрода к другому в виде иона Li+.
Литий является одним из самых легких элементов в таблице Менделеева и имеет один из самых больших электрохимических потенциалов, поэтому эта комбинация создает одни из самых высоких возможных напряжений в самых компактных и легких объемах.
Это основа для литий-ионного аккумулятора. В этой новой батарее литий сочетается с переходным металлом, таким как кобальт, никель, марганец или железо, и кислородом, образуя катод. Во время перезарядки при приложении напряжения положительно заряженный ион лития с катода мигрирует к графитовому аноду и становится металлическим литием.
Поскольку литий обладает сильной электрохимической движущей силой, которая может окисляться, если ему это позволяют, он мигрирует обратно к катоду, снова становясь ионом Li+, и отдает свой электрон обратно иону кобальта. Движение электронов в цепи дает нам ток, который мы можем использовать.
Движение электронов в цепи дает нам ток, который мы можем использовать.
Второй большой скачок вперед: нанотехнологии
В зависимости от переходного металла, используемого в литий-ионном аккумуляторе, элемент может иметь более высокую емкость, но может быть более реактивным и восприимчивым к явлению, известному как тепловой разгон.
В случае с батареями из оксида лития-кобальта (LiCoO 2 ), произведенными Sony в 1990-х годах, это привело к возгоранию многих таких батарей. О возможности изготовления аккумуляторных катодов из наноразмерного материала и, следовательно, о большей реакционной способности не могло быть и речи.
Но в 1990-х годах Гуденаф снова совершил огромный скачок в технологии аккумуляторов, представив стабильный литий-ионный катод на основе литиевого железа и фосфата.
Этот катод термически стабилен. Это также означает, что наноразмерный фосфат лития-железа (LiFePO 4 ) или феррофосфат лития (LFP) теперь можно безопасно превращать в элементы большого формата, которые можно быстро заряжать и разряжать.
В настоящее время для этих новых элементов существует множество новых применений, от электроинструментов до гибридных и электрических транспортных средств. Пожалуй, самым важным применением станет хранение бытовой электроэнергии для домашних хозяйств.
У первого мобильного телефона была большая батарея и короткое время автономной работы — современные мобильные телефоны и смартфоны требуют меньших батарей, но более продолжительной работы.
Электромобили
Лидером в производстве аккумуляторов нового формата для автомобилей является компания по производству электромобилей Tesla, у которой есть планы по строительству «гига-заводов» для производства этих аккумуляторов.
Размер блока литиевых батарей для Tesla Model S составляет впечатляющие 85 кВтч.
Этого также более чем достаточно для бытовых нужд, поэтому было так много слухов о том, что основатель Tesla Илон Маск готовится раскрыть на этой неделе.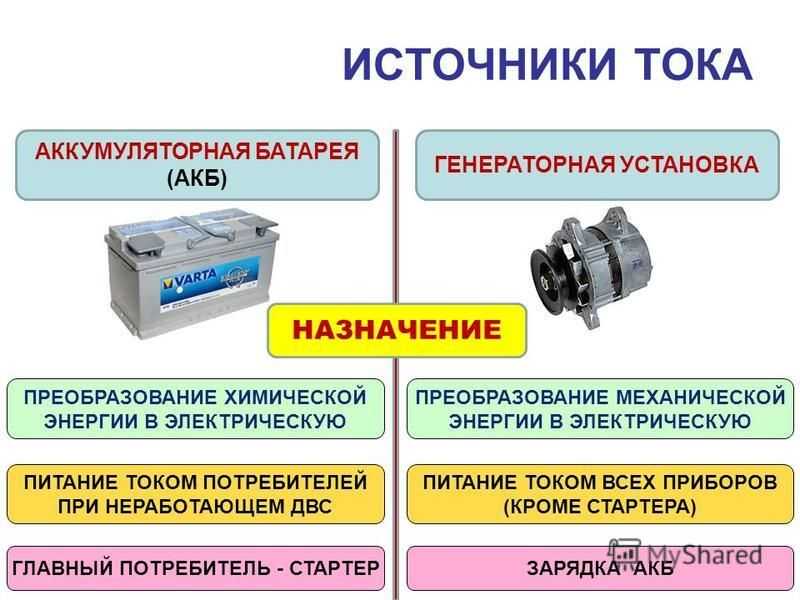
Модульная конструкция аккумуляторной батареи может создавать форматы аккумуляторных батарей, которые в некоторой степени взаимозаменяемы и подходят как для транспортных средств, так и для бытового применения без необходимости перепроектирования или реконструкции.
Возможно, мы станем свидетелями смены поколений в производстве и хранении энергии благодаря постоянно совершенствующимся возможностям скромной батареи.
Источник:
Разговор
Эта история опубликована с разрешения The Conversation (под лицензией Creative Commons-Attribution/Без производных).
Цитата :
История и развитие аккумуляторов (2015, 30 апреля)
получено 15 апреля 2023 г.
с https://phys.org/news/2015-04-history-batteries.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.


 Нью-Джерси: Прентис-Холл, 2011, гл. 3, с. 3.4, стр. 89-94.
Нью-Джерси: Прентис-Холл, 2011, гл. 3, с. 3.4, стр. 89-94.