|
Общие сведения о металлах Категория: Технология металлов Общие сведения о металлах Изучение свойств химических элементов позволило разделит их на две основные группы: металлы и неметаллы (металлоиды). Металлы отличаются характерным «металлическим» блеском, ковкостью, высокой теплопроводностью и электропроводностью, непрозрачностью. При нормальной, комнатной, температуре все металлы (кроме ртути) являются твердыми веществами. Неметаллы не имеют перечисленных свойств. У них отсутствует блеск, они хрупки, плохо проводят тепло и электричество. Ярко выраженными металлическими и неметаллическими свойствами обладают далеко не все элементы. Относя тот или иной элемент к металлам или неметаллам, отмечают лишь, какие свойства— металлические или неметаллические — выражены сильнее. Примерно две трети всех элементов представляют собой металлы. В технике химически чистые металлы не используются. Это объясняется двумя причинами: во-первых, трудностью их получения в промышленном производстве и, во-вторых, отсутствием в них технически полезных свойств. Значительно большее распространение получили так называемые металлические материалы. Все металлические материалы можно разделить на две группы. Технически чистые металлы — металлы, в состав которых; помимо химически чистого элемента, в небольших количествах входят другие элементы. Сплавы — сложные материалы, получаемые путем сплавления одного металла с другими металлами или неметаллами. Сплавам можно придать самые разнообразные свойства. Поэтому в технике, особенно в машиностроении, они нашли большее применение, чем технически чистые металлы. Наиболее распространенными металлическими материалами в промышленности являются сплавы железа с углеродом — стали и чугуны. Такие сплавы получили наименование черные металлы. Помимо этого, широко используются в технике цветные металлы — медь, алюминий, магний, никель, цинк, олово, свинец и главным образом их сплавы. Изготовляя сплавы с разными количественными соотношениями элементов, можно придать им различные свойства, необходимые для нормальной работы детали или конструкции. Кроме этого, есть иной путь получения необходимых свойств — это изменение состояния или структуры (строения) металла или сплава различными методами. Так, например, железо в обычных, нормальных, условиях является металлом с ярко выраженными магнитными свойствами — изделия из железа притягиваются к магниту. Однако, если железо нагреть до температуры свыше 768°, оно потеряет полностью магнитные свойства и снова их приобретет, как только температура станет меньше 768°. Можно повлиять на состояние металла или сплава таким образом, что вновь приобретенные ими свойства сохранятся надолго. Например, путем ковки или прокатки меди при комнатной температуре можно повысить ее прочность примерно в 2— 2,5 раза. При помощи специальной тепловой обработки сплава, называемой термической, о которой подробно будет рассказано ниже, можно изменять структуру сплава, в результате чего сильно изменятся и его качества. Реклама:Читать далее:Внутреннее строение металлов и сплавов
Статьи по теме:
Главная → Справочник → Статьи → Блог → Форум
|
|
|
Общие сведения о металлах и сплавах
ГЛАВА I
ОСНОВЫ ОБЩЕЙ ТЕХНОЛОГИИ МЕТАЛЛОВ
§ 1. Общие сведения о металлах и сплавах
Общие сведения о металлах и сплавах
Металлы имеют ряд общих характерных физических свойств. Они обладают
металлическим блеском, т. е. свойством отражать свет, хорошо проводят
электрический ток и тепло. Все металлы, кроме золота и меди, белого и
серого цвета с различными оттенками. Наилучшим проводником
электрического тока является серебро, второе место по электропроводности
занимает медь, широко применяющаяся в электротехнике. Электропроводность
алюминия также высока, и в настоящее время он используется наряду с
медью для изготовления электрических проводов. Характерным свойством
металлов является пластичность, т. е. свойство тела менять форму под
действием внешних сил и сохранять приобретенную форму после прекращения
действия этих сил. На этом свойстве основаны различные способы обработки
металлов: прокатка, ковка, штамповка, волочение, получение деталей
методом выдавливания. Все металлы, кроме ртути, при комнатной
температуре находятся в твердом состоянии.
В технике широкое распространение получили как чистые элементы-металлы,
так и их сплавы. Сплавы представляют собой сочетание одного металла и
других металлических или неметаллических элементов. Наиболее
распространенную в машиностроении группу сплавов составляют сплавы
железа с углеродом. Такие сплавы получили название черных металлов.
Медь, алюминий, магний, олово, цинк, свинец и их сплавы составляют
группу цветных металлов.
Применение металлов и сплавов для различных производственных нужд
определяется их механическими свойствами: твердостью, прочностью,
пластичностью, ударной вязкостью и т. д.
Твердость характеризуется способностью металла противостоять
проникновению в него другого, более твердого тела. Испытание на
твердость производится большей частью путем вдавливания твердого тела в
испытуемый материал. Наиболее распространенными методами измерения
твердости являются
следующие: измерение твердости по Бринеллю,
Роквеллу и Виккерсу.
При измерении твердости металла по Бринеллю под действием плавно
увеличивающейся нагрузки в испытуемый металл вдавливают стальной шарик и
после снятия нагрузки измеряют диаметр отпечатка, оставшегося на
поверхности образца. Деление величины нагрузки (в килограммах) на
площадь поверхности сферического отпечатка (в квадратных миллиметрах)
дает число твердости НВ.
Замер твердости по Роквеллу производится алмазным конусом
стандартного типа или стальным закаленным шариком диаметром
1,588 мм. Твердость по Роквеллу измеряется в условных единицах.
Замер твердости по Виккерсу производят при помощи алмазного наконечника,
имеющего правильную форму четырехгранной пирамиды, который под действием
нагрузки вдавливается в испытуемый образец. После снятия нагрузки
измеряют диагонали полученного на образце отпечатка. Число твердости
определяют путем деления нагрузки на площадь боковой поверхности
полученного пирамидального отпечатка.
Пределом прочности при растяжении называют величину, численно равную
наибольшей нагрузке, отмеченной во время испытания образца на
растяжение, разделенной на площадь первоначального поперечного сечения
образца. Предел прочности при растяжении сгв выражается в кгс/мм2.
Испытанием на растяжение определяют прочность металлов, работающих на
растяжение. Для этой цели отливают образец и устанавливают его на
разрывную машину. При возрастании нагрузки (разрывного усилия)
наблюдается удлинение образца. Результаты испытания удобно изображать в
виде диаграммы (рис. 1). По вертикальной оси откладывают нагрузку Р,
которую постепенно увеличивают, а по горизонтальной оси откладывают
величину удлинения образца
ΔI.
Из диаграммы видно, что сначала образец удлиняется пропорционально
нагрузке; начиная от точки А, удлинение растет быстрее и от точки С
образец удлиняется без увеличения наг-рузки. При дальнейшем увеличении
При дальнейшем увеличении
нагрузки образец удлиняется более интенсивно и при определенной
растягивающей силе Рмах удлинение увеличивается даже при последующем
уменьшении нагрузки.
Относительным удлинением при разрыве б называют
остающееся приращение длины образца, отнесенное к первоначальной
расчетной длине; оно определяется в процентах.
Относительным сужением при разрыве я]) называется
уменьшение поперечного сечения образца в месте разрыва, выраженное в
процентах от первоначального сечения.
Пределом текучести (физический) сТ называется напряжение, при котором,
несмотря на деформацию образца, указатель нагрузки на разрывной машине
остается неподвижным или указывает ее падение. В случае отсутствия явно
выраженной текучести применяется понятие условного предела текучести при
пластической деформации 0,2% — при котором впервые появляется остаточное
удлинение 0,2%; выражают его в кгс/мм2.
Пределом пропорциональности (условный) называется напряжение, при
котором впервые получается нарушение пропорциональности между
напряжением и удлинением на определенную, заранее обусловленную
величину; выражается к кгс/мм2.
Ударной вязкостью называется работа, затраченная на разрушение образца
ударом, отнесенная к 1 см2 площади образца в месте излома; выражается в
кгс/см2.
Части периодической таблицы
Когда элементы объединяются в соединения, существует два основных типа
склеивание, которое может возникнуть. Ионные связи образуются при наличии
перенос электронов от одного вида к другому с образованием
заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим
взаимодействия и ковалентных связей , которые возникают, когда атомы
обмениваться электронами для получения нейтральных молекул. В общем
металл и неметаллы объединяются, образуя ионные соединения , а
неметаллы соединяются с другими неметаллами с образованием ковалентных соединений
(молекулы).
Поскольку металлы находятся левее в таблице Менделеева, они
имеют низкую энергию ионизации
и низкое сродство к электрону,
поэтому они относительно легко теряют электроны и с трудом приобретают их.
У них также относительно мало валентных электронов, и они могут образовывать ионы (и
тем самым удовлетворяют правилу октета) легче, теряя свою валентность
электроны с образованием положительно заряженных катионы .
- Металлы основной группы обычно образуют заряды, такие же, как
номер их группы: то есть металлы группы 1А, такие как
натрий и калий образуют заряды +1, металлы группы 2А, такие как
магний и кальций образуют заряды 2+, а металлы группы 3А, такие как
так как алюминий образует заряды 3+. - Металлы, следующие за переходными металлами (по направлению к
в нижней части групп 4A и 5A) могут потерять либо свои крайние с
и p электронов, образующих заряды, идентичные их
номер группы, или они могут потерять только p электронов, в то время как
сохраняя свои два s электронов, образуя заряды, которые являются
номер группы минус два. Другими словами, олово и свинец в Группе
Другими словами, олово и свинец в Группе
4А может образовывать 4+ или 2+ заряда, тогда как висмут из группы 5А может
образуют заряд 5+ или 3+. - Переходные металлы обычно способны образовывать 2+ заряда
потеряв свою валентность с электронов, но может и потерять
электроны со своих d орбиталей, чтобы сформировать другие заряды.
Большинство переходных металлов могут образовывать более одного возможного заряда.
в ионных соединениях.
Неметаллы находятся правее в периодической таблице и имеют
высокая энергия ионизации и
высокое сродство к электрону, поэтому
они относительно легко приобретают электроны и с трудом их теряют.
Они также имеют большее количество валентных электронов и уже
близко к полному октету из восьми электронов. неметаллы
приобретают электроны до тех пор, пока они не будут иметь такое же количество электронов, как
ближайший благородный газ (группа 8A), образующий отрицательно заряженный анионы
которые имеют заряды, равные номеру группы минус восемь. То есть,
То есть,
неметаллы группы 7А образуют заряды 1-, неметаллы группы 6А образуют заряды 2-
заряды, а металлы группы 5А образуют 3-заряды. Группа 8А
элементы уже имеют восемь электронов на своих валентных оболочках и имеют
мало склонны либо приобретать, либо терять электроны, и не легко
образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в правильном порядке, называемом кристалл
решетки силами притяжения между противоположно заряженными
катионы и анионы. Эти силы притяжения очень сильны, и
поэтому большинство ионных соединений имеют очень высокие температуры плавления. (Для
Например, хлорид натрия, NaCl, плавится при 80°С, а оксид алюминия,
Al 2 O 3 , плавится при 2054C.) Ионные соединения
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут свободно двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворены в
вода.
Когда неметаллы объединяются с другими неметаллами, они, как правило, разделяют
электроны в ковалентных связях вместо образования ионов, что приводит к
образование нейтральных молекул. (Имейте в виду, что поскольку водород
тоже неметалл, соединение водорода с другим неметаллом
также будет образовывать ковалентную связь.) Молекулярные соединения могут быть
газами, жидкостями или твердыми веществами с низкой температурой плавления и включают широкий спектр
веществ. (См.
Галерея молекул для
примеры.)
Когда металлы соединяются друг с другом, связь обычно описывается
как металлическая связка (вы могли догадаться). В этом
В модели каждый атом металла отдает один или несколько своих валентных электронов
создать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Так как электроны в электроне
море может свободно двигаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы.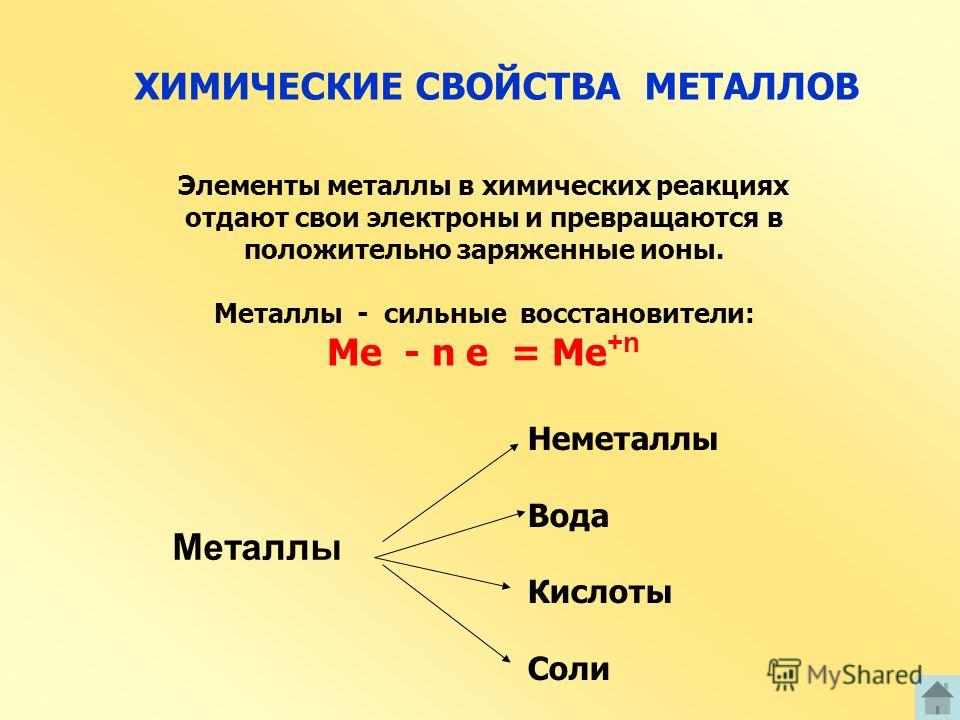 Атомы металлов могут
Атомы металлов могут
двигаться мимо друг друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях за счет притяжения между катионами и
анионы), позволяя металлу забиваться в листы или вытягиваться в
проволока. Различные металлы можно очень легко комбинировать, чтобы получить
сплавы , которые могут иметь сильно отличающиеся физические свойства от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
что намного тверже самого железа; хром, ванадий, никель и
к железу также часто добавляют другие металлы для получения различных сталей.
типы. Латунь представляет собой сплав меди и цинка, который используется
в сантехнике, электрических деталях и музыкальных инструментах.
Бронза — это сплав меди и олова, который намного тверже, чем
медь; когда бронза была открыта древними цивилизациями, это ознаменовало
значительный шаг вперед по сравнению с использованием менее прочных каменных орудий.
Металлы (полный список) — определение, типы, физические и химические свойства и примеры с видео
Металлы — это природные соединения земной коры, в которых они обычно находятся в виде металлических руд, связанных как друг с другом, так и со многими другие элементы. Они также естественным образом присутствуют в горных породах, омываемых поверхностными и подземными водами, и в атмосферной пыли.
Они также естественным образом присутствуют в горных породах, омываемых поверхностными и подземными водами, и в атмосферной пыли.
Содержание
- Что такое металлы?
- Примеры металлов
- Список всех металлов
- Свойства металлов
- Часто задаваемые вопросы – Часто задаваемые вопросы
Что такое металлы?
Металлы — это вещества, которые естественным образом образуются под поверхностью Земли. Большинство металлов блестящие или блестящие. Металлы неорганические, а это значит, что они сделаны из веществ, которые никогда не были живыми.
Примеры металлов
Металл очень прочен и долговечен и поэтому используется для изготовления многих вещей. Они используются для изготовления автомобилей, спутников, кухонной утвари и т. д.
Большинство металлов твердые, но некоторые нет. Натрий и калий — это такие металлы, которые можно резать ножом, тогда как ртуть — это жидкий металл при комнатной температуре. Железо имеет твердую природу.
Железо имеет твердую природу.
Рекомендуемые видео
Типы металлов (полный список)
Когда все металлы должны рассматриваться как группа, преимущество может быть получено, если их названия приведены в табличной форме.
| Серийный номер | Атомный номер | Символ | Металлические элементы |
| 1 | 3 | Ли | Литий |
| 2 | 4 | Быть | Бериллий |
| 3 | 11 | На | Натрий |
| 4 | 12 | мг | Магний |
| 5 | 13 | Ал | Алюминий |
| 6 | 19 | К | Калий |
| 7 | 20 | Са | Кальций |
| 8 | 21 | Sc | Скандий |
| 9 | 22 | Ти | Титан |
| 10 | 23 | В | Ванадий |
| 11 | 24 | Кр | Хром |
| 12 | 25 | Мн | Марганец |
| 13 | 26 | Фе | Железо |
| 14 | 27 | Ко | Кобальт |
| 15 | 28 | Ni | Никель |
| 16 | 29 | Медь | Медь |
| 17 | 30 | Цинк | Цинк |
| 18 | 31 | Га | Галлий |
| 19 | 37 | руб | Рубидий |
| 20 | 38 | Старший | Стронций |
| 21 | 39 | Д | Иттрий |
| 22 | 40 | Зр | Цирконий |
| 23 | 41 | № | Ниобий |
| 24 | 42 | Пн | Молибден |
| 25 | 43 | ТК | Технеций |
| 26 | 44 | Ру | Рутений |
| 27 | 45 | Рх | Родий |
| 28 | 46 | Пд | Палладий |
| 29 | 47 | Аг | Серебро |
| 30 | 48 | CD | Кадмий |
| 31 | 49 | В | Индий |
| 32 | 50 | Сн | Олово |
| 33 | 55 | цезий | Цезий |
| 34 | 56 | Ба | Барий |
| 35 | 57 | Ла | Лантан |
| 36 | 58 | Се | Церий |
| 37 | 59 | Пр | Празеодим |
| 38 | 60 | Нд | Неодим |
| 39 | 61 | вечера | Прометий |
| 40 | 62 | См | Самарий |
| 41 | 63 | ЕС | Европий |
| 42 | 64 | Гд | Гадолиний |
| 43 | 65 | Тб | Тербий |
| 44 | 66 | Дай | Диспрозий |
| 45 | 67 | Хо | Гольмий |
| 46 | 68 | Er | Эрбий |
| 47 | 69 | Тм | Тулий |
| 48 | 70 | Ыб | Иттербий |
| 49 | 71 | Лу | Лютеций |
| 50 | 72 | Хф | Гафний |
| 51 | 73 | Та | Тантал |
| 52 | 74 | Вт | Вольфрам |
| 53 | 75 | Ре | Рений |
| 54 | 76 | ОС | Осмий |
| 55 | 77 | Ир | Иридий |
| 56 | 78 | Пт | Платина |
| 57 | 79 | Золото | Золото |
| 58 | 80 | рт. ст. ст. | Меркурий |
| 59 | 81 | Тл | Таллий |
| 60 | 82 | Пб | Свинец |
| 61 | 83 | Би | Висмут |
| 62 | 84 | По | Полоний |
| 63 | 87 | Пт | Франций |
| 64 | 88 | Ра | Радий |
| 65 | 89 | Ас | Актиний |
| 66 | 90 | Т | Торий |
| 67 | 91 | Па | Протактиний |
| 68 | 92 | У | Уран |
| 69 | 93 | Нп | Нептуний |
| 70 | 94 | Пу | Плутоний |
| 71 | 95 | Ам | Америций |
| 72 | 96 | См | Кюриум |
| 73 | 97 | Бк | Берклиум |
| 74 | 98 | См. | Калифорния |
| 75 | 99 | Эс | Эйнштейний |
| 76 | 100 | фм | Фермиум |
| 77 | 101 | Мд | Менделевий |
| 78 | 102 | № | Нобелий |
| 79 | 103 | Лр | Лоуренсиум |
| 80 | 104 | Рф | Резерфордий |
| 81 | 105 | Дб | Дубниум |
| 82 | 106 | Сг | Сиборгиум |
| 83 | 107 | Бх | Борий |
| 84 | 108 | Гс | Хассиум |
| 85 | 109 | Мт | Мейтнерий |
| 86 | 110 | Дс | Дармштадтиум |
| 87 | 111 | Рг | Рентгений |
| 88 | 112 | Сп | Коперниций |
| 89 | 113 | Нх | Нихоний |
| 90 | 114 | Фл | Флеровиум |
| 91 | 115 | Мак | Московиум |
| 92 | 116 | ур. | Ливермориум |
Физические свойства металлов
- Все металлы являются хорошими проводниками тепла и электричества. Кухонная утварь и утюг состоят из металлов, так как они хорошо проводят тепло.
- Пластичность — это способность материала растягиваться в проволоку. Эта способность позволяет металлам втягиваться в провода и в сочетании с их долговечностью находить применение в качестве кабельных проводов и для пайки. Поскольку из металла можно вытянуть провода, мы можем сказать, что металлы пластичны.
- Ковкость – свойство веществ, позволяющее раскатывать их в плоские листы. Алюминиевые листы используются в производстве самолетов из-за их легкости и прочности. Прочие металлические листы применяют в автомобильной промышленности, для изготовления посуды и т. д. Поэтому металлы ковкие.
- Металлы звонкие, потому что они издают глубокий или звенящий звук при ударе другим твердым предметом.
- Обычно все металлы имеют блестящий вид, но эти металлы также можно отполировать до блестящего вида.

Химические свойства металлов
- Реакция с водой: Только высокореакционноспособные металлы реагируют с водой, но не все металлы. Например, натрий бурно реагирует с водой и кислородом, выделяя при этом большое количество тепла. Вот почему натрий хранят в керосине, чтобы он не контактировал с влагой или кислородом.
- Реакция с кислотами: Газообразный водород образуется при взаимодействии металлов с кислотами. Например, когда цинк реагирует с соляной кислотой, образуется хлорид цинка и газообразный водород.
- Реакция с основаниями: Не все металлы реагируют с основаниями, и когда они реагируют, образуются соли металлов и газообразный водород. Когда цинк реагирует с сильным гидроксидом натрия, он дает цинкат натрия и газообразный водород.
- Реакция с кислородом: Оксиды металлов образуются при горении металлов в присутствии кислорода. Эти оксиды металлов являются основными по своей природе.
 Например: при сжигании полоски магния в присутствии кислорода образуется оксид магния, а при растворении оксида магния в воде образуется гидроксид магния.
Например: при сжигании полоски магния в присутствии кислорода образуется оксид магния, а при растворении оксида магния в воде образуется гидроксид магния.
Часто задаваемые вопросы – Часто задаваемые вопросы
Что такое металлы?
Металл в химии — это элемент, который легко образует положительные ионы (катионы) и имеет металлические связи. Иногда металлы представляются облаком делокализованных электронов и решеткой положительных ионов.
Что такое металл или неметалл?
Металл — это компонент, материал или сплав, обычно твердый, прозрачный, блестящий и обладающий хорошей электрической и тепловой проводимостью. Металлы обычно податливы, что гарантирует, что их можно неограниченно долго ковывать или прессовать без разрушения или растрескивания, а также легкоплавкие или пластичные
Какой самый твердый металл в мире?
Вольфрам — самый твердый металл с наивысшей прочностью на растяжение, но он хрупкий и при контакте разрушается.




 Эти свойства медь сохранит до тех пор, пока мы не подвергнем ее нагреву до температуры свыше 270°.
Эти свойства медь сохранит до тех пор, пока мы не подвергнем ее нагреву до температуры свыше 270°. Другими словами, олово и свинец в Группе
Другими словами, олово и свинец в Группе
 Например: при сжигании полоски магния в присутствии кислорода образуется оксид магния, а при растворении оксида магния в воде образуется гидроксид магния.
Например: при сжигании полоски магния в присутствии кислорода образуется оксид магния, а при растворении оксида магния в воде образуется гидроксид магния.