Содержание
Углеводороды — Что такое Углеводороды?
AИ-95
0
AИ-98
0
109898
Соединения углеводородов отличаются друг от друга количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Углеводороды (hydrocarbon) – это органические соединения, состоящие из углерода и водорода.
Углеводороды служат фундаментальной основой органической химии: молекулы любых других органических соединений рассматривают как их производные.
Соотношения между углеродом и водородом в углеводородах колеблются в широких пределах (10-90 %).
Соединения углеводородов отличаются друг от друга количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе встречаются в сырой нефти.
Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация углеводородов
Алканы (парафины) – углеводороды общей формулы CnH2n+2, в молекулах которых атомы углерода связаны между собой σ-связью, а остальные их валентности предельно насыщены атомами водорода.
Отсюда другое название алканов – предельные углеводороды.
Первым представителем данного гомологического ряда является метан СН4.
Алкены (олефины) относятся к непредельным углеводородам общей формулы CnH2n.
В молекуле алкена кроме σ-связей содержится одна π-связь.
Первый представитель гомологического ряда – этилен С2Н4, поэтому алкены называют также «этиленовыми углеводородами».
Диеновые углеводороды содержат в молекуле 2 двойные связи.
Общая формула СnН2n-2.
Первым представителем ряда является бутадиен СН2=СН–СН=СН2.
Алкинами называются углеводороды общей формулы CnH2n-2, молекулы которых содержат тройную связь.
Первый представитель гомологического ряда – ацетилен С2Н2, поэтому алкины называют также «ацетиленовыми углеводородами».
Молекулы циклоалканов содержат циклы разной величины, атомы углерода в которых связаны между собой только σ-связью.
Общая формула СnH2n.
Циклоалкены содержат одну двойную связь и имеют общую формулу СnН2n-2.
Углеводороды, имеющие кратные связи, легко вступают в реакции присоединения по месту разрыва π-связей.
Ароматические углеводороды (арены) – углеводороды общей формулы CnH2n-6.
Первые представители ароматических углеводородов были выделены из природных источников и обладали своеобразным запахом, поэтому и получили название «ароматические».
Важнейшим представителем ароматических углеводородов является бензол С6Н6.
В молекуле бензола 6 атомов углерода, соединяясь σ-связями, образуют правильный шестиугольник.
В результате сопряжения 6 свободных р-электронов образуется единое π-электронное облако над и под плоскостью кольца.
Природные источники углеводородов
Каменный уголь – плотная осадочная порода черного, иногда сepo-черного цвета, дающая на фарфоровой пластинке черную черту.
Каменный уголь представляет собой продукт глубокого разложения остатков растений, погибших миллионы лет назад (древовидных папоротников, хвощей и плаунов, а также первых голосеменных растений).
В органическом веществе угля содержится 75-92 % углерода, 2,5-5,7 % водорода, 1,5-15 % кислорода.
Международное название элемента углерода происходит от лат. carbō («уголь»).
Природный газ – полезное ископаемое, основным компонентом которого является метан СН4 (75-98 %).
В природном газе содержатся также его ближайшие гомологи: этан С2Н6, пропан С3Н8, бутан С4Н10 и следовые количества более тяжелых легкокипящих углеводородов.
Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его количество в природном газе.
Содержание сероводорода и его органических производных (тиолов) в природном газе в сумме может достигать 5-25 %.
Попутные нефтяные газы – газы, которые находятся в природе над нефтью или растворены в ней под давлением.
Их состав может быть выражен примерным соотношением компонентов: метан – 31 %, этан – 7,5 %, пропан – 21,5 %,
бутан – 20 %, пентан и гексан (легкокипящие жидкости) – 20 %.
С каждой тонной добытой нефти выделяется около 50 м3 газов, которые вплоть до середины 20го в. сжигали в факелах, причиняя двойной ущерб – теряли ценное сырье и загрязняли атмосферу.
Первым предприятием в России, на котором стали использовать попутные нефтяные газы, стала Сургутская ГРЭС.
6 основных энергоблоков, работающих на попутном газе, были введены в строй в 1985-1988 гг.
В настоящее время попутные нефтяные газы улавливают и используют как топливо (в том числе и автомобильное) и ценное химическое сырье.
Нефть – смесь углеводородов от светло-бурого до черного цвета с характерным запахом.
Нефть намного легче воды и в ней не растворяется.
В зависимости от происхождения нефть может содержать большое количество алифатических, циклических или ароматических углеводородов.
Так, например, бакинская нефть богата циклоалканами и содержит сравнительно небольшое количество алифатических предельных углеводородов.
Значительно больше алканов в грозненской, ферганской, а также нефти штата Пенсильвания (США).
Пермская нефть содержит ароматические углеводороды.
В небольших количествах в состав нефти могут входить также кислородсодержащие соединения, как, например, альдегиды, кетоны, эфиры и карбоновые кислоты.
#Углеводороды
Последние новости
Новости СМИ2
Произвольные записи из технической библиотеки
Используя данный сайт, вы даете согласие на использование файлов cookie, помогающих нам сделать его удобнее для вас. Подробнее.
Определение ароматических углеводородов в воде
Одну из главных фракций органических загрязнений водной среды образуют токсичные ароматические углеводороды — непредельные циклические соединения ряда бензола и их производные, полициклические ароматические углеводороды.
Летучие ароматические углеводороды (легкие фракции нефти) – толуол, ксилол, бензол, нафталин и др., обладающие повышенной токсичностью для живых организмов, легко разрушаются и удаляются из воды и почвы. Полициклические ароматические углеводороды (ПАУ) чрезвычайно устойчивы в любой среде и трудно поддаются разрушению. Бензол и его гомологи оказывают более быстрое токсическое действие на организм, чем полициклические ароматические углеводороды (ПАУ). Последние действуют медленнее, но более длительное время, являясь хроническими токсикантами.
Последние действуют медленнее, но более длительное время, являясь хроническими токсикантами.
К группе ПАУ относятся сотни химических веществ. В европейских странах рекомендуется контролировать в водных объектах 16 веществ из группы ПАУ: нафталин, аценафтилен, аценафтен, флуорен, антрацен, фенантрен, флуорантен, бенз(а)антрацен, хризен, пирен, бенз(а)пирен, дибенз(ah)антрацен, бенз(g, h,i)перилен, бенз(а)флуорантен, бенз(k)флуорантен и индено(1,2,3-cd)пирен. В России имеет ПДК только одно соединение этого класса — бенз(а)пирен, наиболее стойкий и сильный канцероген среди ПАУ, который является индикатором наличия канцерогенных ПАУ в окружающей среде.
Подробная информация об услуге в разделеАнализ воды
Гигиенические нормативы ароматических углеводородов в воде
| Наименование вещества | Наименование документа | ПДК, мг/л | Класс опасности |
| Бензол | ГН 2.1.5.2280-07 | 0,001 | 1 |
| Толуол | ГН 2. 1.5.2280-07 1.5.2280-07 | 0,024 | 4 |
| Этилбензол | ГН 2.1.5.2280-07 | 0,002 | 4 |
| о-Ксилол | ГН 2.1.5.1315 | 0,05 | 3 |
| м-, п-Ксилолы | ГН 2.1.5.1315 | 0,05 | 3 |
| Бенз(а)пирен | ГН 2.1.5.2280-07 | 0,00001 | 1 |
Определение полициклических и летучих ароматических углеводородов в природных объектах относится к числу сложных аналитических задач. Для их решения применяются современные методы анализа: хромато-масс-спектрометрия (ГХ-МС), газовая хроматография (ГХ) и высокоэффективная жидкостная хроматография (ВЭЖХ).
В нашей испытательной лаборатории анализ воды на содержание летучих и полициклических ароматических углеводородов производится в соответствии с требованиями следующих методик:
- МУК 4.1.650-96 Методические указания по газохроматографическому определению ацетона, метанола, бензола, толуола, этилбензола, пентана, о-, м-, п-ксилола, гексана, октана и декана в воде
Методика обеспечивает выполнение измерений в диапазоне концентраций 0,005 — 20 мг/дм3 с погрешностью, не превышающей ± 13 % при доверительной вероятности 0,95. Измерения концентрации анализируемых соединений выполняют методом газовой хроматографии с пламенно-ионизационным детектированием.
Измерения концентрации анализируемых соединений выполняют методом газовой хроматографии с пламенно-ионизационным детектированием.
Метод основан на извлечении соединений из воды газовой экстракцией при нагревании в замкнутом объеме и последующем анализе равновесной паровой фазы. Измерения выполняются на газовом хроматогафе Agilent 6850 Series II Network GC System с парофазным пробоотборником и пламенно-ионизационным детектором.
Нижний предел измерения 0,025 мкг.
Определению ароматических углеводородов не мешают галоген-, азот- и серосодержащие соединения.
- ПНД Ф 14.1:2:4.70-96 Методика измерений массовых концентраций полициклических ароматических углеводородов в питьевых, природных и сточных водах методом высокоэффективной жидкостной хроматографии
Настоящий нормативный документ устанавливает методику количественного химического анализа различных типов вод с целью измерения массовых концентраций полициклических ароматических углеводородов (ПАУ). Методика распространяется на следующие объекты анализа: воды питьевые, в том числе расфасованные в емкости; воды природные, в том числе поверхностных и подземных источников водоснабжения; воды сточные производственные, хозяйственно-бытовые, ливневые и очищенные. Методика может быть использована для анализа проб снежного покрова и талых вод. Измерения массовых концентраций ПАУ выполняют методом ВЭЖХ с флуоресцентным детектированием после экстракции из водной пробы гексаном и концентрирования экстракта упариванием.
Методика распространяется на следующие объекты анализа: воды питьевые, в том числе расфасованные в емкости; воды природные, в том числе поверхностных и подземных источников водоснабжения; воды сточные производственные, хозяйственно-бытовые, ливневые и очищенные. Методика может быть использована для анализа проб снежного покрова и талых вод. Измерения массовых концентраций ПАУ выполняют методом ВЭЖХ с флуоресцентным детектированием после экстракции из водной пробы гексаном и концентрирования экстракта упариванием.
Перечень и диапазоны измерения определяемых ПАУ
| Наименование ПАУ | Диапазоны измерений, мкг/дм3 | |
| Питьевые и природные воды | Сточные воды | |
| Нафталин | 0,02 — 10 | 0,1 — 500 |
| Аценафтен | 0,006 — 0,2 | 0,025 — 50 |
| Флуорен | 0,006 — 0,2 | 0,025 — 100 |
| Фенантрен | 0,006 — 0,2 | 0,025 — 250 |
| Антрацен | 0,001 — 0,02 | 0,004 — 100 |
| Флуорантен | 0,02 — 0,5 | 0,1 — 250 |
| Пирен | 0,02 — 0,5 | 0,1 — 250 |
| Бенз(а)антрацен | 0,006 — 0,13 | 0,025 — 50 |
| Хризен | 0,003 — 0,075 | 0,015 — 50 |
| Бенз(в)флуорантен | 0,006 — 0,13 | 0,025 — 20 |
| Бенз(к)флуорантен | 0,001 — 0,02 | 0,004 — 20 |
| Бенз(а)пирен | 0,001 — 0,02 | 0,004 — 20 |
| Дибенз(а, h)антрацен | 0,006 — 0,13 | 0,025 — 5 |
| Бенз(q, h, i)перилен | 0,006 — 0,13 | 0,025 — 5 |
| Инден(1,2,3-cd)пирен | 0,02 — 0,5 | 0,1 — 10 |
Допускается выполнять анализ с более высоким содержанием ПАУ при условии соответствующего разбавления экстракта.
В нашем «Испытательном центре «НОРТЕСТ» определение ПАУ методом высокоэффективной жидкостной хроматографии успешно выполняется на жидкостном хроматографе высокой эффективности фирмы Shimadzu (Япония) с основным флуориметрическим и контрольным спектрофотометрическим детекторами.
Не знаете, какой анализ выбрать? Наши специалисты помогут!
Позвоните нам: +7 (495) 108-24-26 или заполните форму
Заявка на анализ
Телефон*
Сообщение
Я согласен(а) наобработку персональных данных
Определение источников эмиссии полициклических ароматических углеводородов в атмосферном воздухе | Шашков
1. Цымбалюк К.К., Деньга Ю.М., Антонович В.П. Определение полициклических ароматических углеводородов (ПАУ) в объектах окружающей среды (Обзор). Методы и объекты химического анализа. Київський національний університет імені Тараса Шевченка. 2013. Т. 8. № 2. P. 50—62.
2. Цибарт А.С., Геннадиев А.Н. Полициклические ароматические углеводороды в почвах: источники, поведение, индикационное значение (обзор). Почвоведение. Федеральное государственное бюджетное учреждение «Российская академия наук». 2013. № 7. P. 788.
Почвоведение. Федеральное государственное бюджетное учреждение «Российская академия наук». 2013. № 7. P. 788.
3. Lima A.L.C., Farrington J.W., Reddy C.M. Combustion-derived polycyclic aromatic hydrocarbons in the environment — a review. Environ. forensics. Taylor & Francis, 2005. Vol. 6. № 2. P. 109—131.
4. Blumer M. Polycyclic aromatic compounds in nature. Sci. Am. JSTOR, 1976. Vol. 234. № 3. P. 34—45.
5. Хаустов А.П., Редина М.М. Индикаторные соотношения концентраций полициклических ароматических углеводородов для геоэкологических исследований природных и техногенных объектов. Геоэкология. Инженерная геология, гидрогеология, геокриология. Федеральное государственное бюджетное учреждение «Российская академия наук». 2016. № 3. P. 220—233.
6. Худолей В.В., Филов В.А. Проблема онкоэкологического мониторинга. Журн. эколог. химии. 1993. Vol. 3. № 1. P. 73—78.
7. ГОСТ Р ИСО 16362-2009 Определение содержания полициклических ароматических углеводородов в виде твердых частиц методом высокоэффективной жидкостной хроматографии.
8. ГОСТ Р ИСО 12884-2007 Определение общего содержания полициклических ароматических углеводородов (в газообразном со стоянии и в виде твердых взвешенных частиц). Отбор проб на фильтр и сорбент с последующим анализом методом хромато-масс спектрометрии.
9. ГОСТ Р ИСО 16000-12-2011 Отбор проб полихлорированных бифенилов (ПХБ), полихлорированных дибензо-пара-диоксинов (ПХДД), полихлорированных дибензофуранов (ПХДФ) и полициклических ароматических углеводородов (ПАУ).
10. М-МВИ-52-99 ФР. 1.31.2004.01264 (1998) Методика выполнения измерений массовой концентрации полиароматических углеводородов в воздухе рабочей зоны и промышленных выбросах методом высокоэффективной жидкостной хроматографии.
11. Asif M. Geochemical applications of polycyclic aromatic hydrocarbons in crude oils and sediments from Pakistan. University of Engineering and Technology Lahore—Pakistan, 2010.
12. Хаустов А., Редина М. Индикаторные соотношения концентраций полициклических ароматических углеводородов в объектах сжигания угольного топлива и биомассы: Оригинальная научная (исследовательская) статья. Антропогенная трансформация природной среды. 2019. № 5. P. 64—71.
Антропогенная трансформация природной среды. 2019. № 5. P. 64—71.
13. Li C.K., Kamens R.M. The use of polycyclic aromatic hydrocarbons as source signatures in receptor modeling. Atmos. Environ. Part A. Gen. Top. Elsevier, 1993. Vol. 27. № 4. P. 523—532.
14. Gschwend P.M., Hites R.A. Fluxes of polycyclic aromatic hydrocarbons to marine and lacustrine sediments in the northeastern United States. Geochim. Cosmochim. Acta. 1981. Vol. 45. № 12. P. 2359—2367.
15. Manoli E., Kouras A., Samara C. Profile analysis of ambient and source emitted particle-bound polycyclic aromatic hydrocarbons from three sites in northern Greece. Chemosphere. 2004. Vol. 56. № 9. P. 867—878.
16. Mostert M.M.R., Ayoko G.A., Kokot S. Application of chemometrics to analysis of soil pollutants. TrAC – Trends Anal. Chem. Elsevier Ltd, 2010. Vol. 29. № 5. P. 430—445.
17. Zhang W., Zhang S., Wan C. et al. Source diagnostics of polycyclic aromatic hydrocarbons in urban road runoff, dust, rain and canopy throughfall. Environ. Pollut. Elsevier. 2008. Vol. 153. № 3. P. 594—601.
Environ. Pollut. Elsevier. 2008. Vol. 153. № 3. P. 594—601.
18. Ravindra K., Sokhi R., Van Grieken R. Atmospheric polycyclic aromatic hydrocarbons: Source attribution, emission factors and regulation. Atmos. Environ. 2008. Vol. 42. № 13. P. 2895—2921.
19. Pies C., Hoffmann B., Petrowsky J. et al. Characterization and source identification of polycyclic aromatic hydrocarbons (PAHs) in river bank soils. Chemosphere. Elsevier. 2008. Vol. 72. № 10. P. 1594—1601.
20. Roberto J., Lee W.-Y., Campos-Dнaz S.I. Soil-borne polycyclic aromatic hydrocarbons in El Paso, Texas: analysis of a potential problem in the United States/Mexico border region. J. Hazard. Mater. Elsevier. 2009. Vol. 163. № 2—3. P. 946—958.
21. Yunker M.B., Macdonald R.W., Vingarzan R. et al. PAHs in the Fraser River basin: a critical appraisal of PAH ratios as indicators of PAH source and composition. Org. Geochem. 2002. Vol. 33. P. 489—515.
22. Akyüz M., Çabuk H. Gas-particle partitioning and seasonal variation of polycyclic aromatic hydrocarbons in the atmosphere of Zonguldak, Turkey. Sci. Total Environ. Elsevier B.V. 2010. Vol. 408. № 22. P. 5550—5558.
Sci. Total Environ. Elsevier B.V. 2010. Vol. 408. № 22. P. 5550—5558.
23. Opuene K., Agbozu I.E., Adegboro O.O. A critical appraisal of PAH indices as indicators of PAH source and composition in Elelenwo Creek, southern Nigeria. Environmentalist. Springer. 2009. Vol. 29. № 1. P. 47—55.
24. Callén M.S., De la Cruz M.T., Lуpez J.M. et al. PAH in airborne particulate matter.: carcinogenic character of PM10 samples and assessment of the energy generation impact. Fuel Process. Technol. Elsevier. 2011. Vol. 92. № 2. P. 176—182.
25. Kong S., Ding X., Bai Z. et al. A seasonal study of polycyclic aromatic hydrocarbons in PM2. 5 and PM2. 5—10 in five typical cities of Liaoning Province, China. J. Hazard. Mater. Elsevier. 2010. Vol. 183. № 1—3. P. 70—80.
26. Kong S., Shi J., Lu B. et al. Characterization of PAHs within PM10 fraction for ashes from coke production, iron smelt, heating station and power plant stacks in Liaoning Province, China. Atmos. Environ. Elsevier, 2011. Vol. 45. № 23. P. 3777—3785.
Vol. 45. № 23. P. 3777—3785.
27. Guo H., Lee S.C., Ho K.F. et al. Particle-associated polycyclic aromatic hydrocarbons in urban air of Hong Kong. Atmos. Environ. 2003. Vol. 37. № 38. P. 5307—5317.
28. Galarneau E. Source specificity and atmospheric processing of airborne PAHs: implications for source apportionment. Atmos. Environ. Elsevier. 2008. Vol. 42. № 35. P. 8139—8149.
29. Saarnio K., Sillanpää M., Hillamo R. et al. Polycyclic aromatic hydrocarbons in size-segregated particulate matter from six urban sites in Europe. Atmos. Environ. Elsevier. 2008. Vol. 42. № 40. P. 9087—9097.
30. Tang N., Hattori T., Taga R. et al. Polycyclic aromatic hydrocarbons and nitropolycyclic aromatic hydrocarbons in urban air particulates and their relationship to emission sources in the Pan—Japan Sea countries. Atmos. Environ. Elsevier. 2005. Vol. 39. № 32. P. 5817—5826.
31. Schauer J.J., Rogge W.F., Hildemann L.M. et al. Source apportionment of airborne particulate matter using organic compounds as tracers. Atmos. Environ. Elsevier. 2007. Vol. 41. P. 241—259.
Atmos. Environ. Elsevier. 2007. Vol. 41. P. 241—259.
32. Brown A.S., Brown R.J.C. Correlations in polycyclic aromatic hydrocarbon (PAH) concentrations in UK ambient air and implications for source apportionment. J. Environ. Monit. 2012. Vol. 14. № 8. P. 2072—2082.
33. Корунов А.О., Халиков И.С., Сурнин В.А. и др. Загрязнение атмосферного воздуха городов Красноярского края полициклическими ароматическими углеводородами. Экологическая химия. 2020. Т. 29. № 2. P. 82—93.
34. Семенов М.Ю., Снытко В.А., Маринайте И.И. Исследование происхождения полициклических ароматических углеводородов в воде озера Байкал. Доклады Академии наук. Федеральное государственное бюджетное учреждение «Российская академия наук». 2017. Т. 474. № 6. P. 746—750.
35. Семенов М.Ю., Снытко В.А., Маринайте И.И. Новый метод оценки вкладов источников полициклических ароматических углеводородов в загрязнение объектов природной среды. Доклады Академии наук. Федеральное государственное бюджетное учреждение «Российская академия наук». 2015. Т. 463. № 1. P. 94.
2015. Т. 463. № 1. P. 94.
36. Katsoyiannis A., Sweetman A.J., Jones K.C. PAH molecular diagnostic ratios applied to atmospheric sources: A critical evaluation using two decades of source inventory and air concentration data from the UK. Environ. Sci. Technol. 2011. Vol. 45. № 20. P. 8897—8906.
37. Walker S.E., Dickhut R.M., Chisholm-Brause C. et al. Molecular and isotopic identification of PAH sources in a highly industrialized urban estuary. Org. Geochem. Elsevier, 2005. Vol. 36. № 4. P. 619—632.
38. Fabbri D., Vassura I., Sun C.G. et al. Source apportionment of polycyclic aromatic hydrocarbons in a coastal lagoon by molecular and isotopic characterisation. Mar. Chem. 2003. Vol. 84. № 1—2. P. 123—135.
39. Brändli R.C., Bucheli T.D., Ammann S. et al. Critical evaluation of PAH source apportionment tools using data from the Swiss soil monitoring network. J. Environ. Monit. Royal Society of Chemistry. 2008. Vol. 10. № 11. P. 1278—1286.
40. Hedberg E. et al. Chemical and physical characterization of emissions from birch wood combustion in a wood stove. Atmos. Environ. 2002. Vol. 36. № 30. P. 4823—4837.
Atmos. Environ. 2002. Vol. 36. № 30. P. 4823—4837.
углеводородов | Определение, типы и факты
структуры обычных углеводородных соединений
Смотреть все СМИ
- Ключевые люди:
- Пьер-Эжен-Марселлен Бертло
Джордж А. Ола
Шарль-Адольф Вюрц
- Похожие темы:
- стирол
бензол
олефин
ксилол
нафталин
Просмотреть весь связанный контент →
Самые популярные вопросы
Что такое углеводород?
Углеводород – это любой класс органических химических веществ, состоящий только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
химическое соединение
Узнайте больше о химических соединениях.
Какие углеводороды наиболее широко используются в современной жизни?
Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
нефть
Узнайте больше о нефти.
ископаемое топливо
Узнайте больше об ископаемом топливе.
Существуют ли различные виды углеводородов?
- Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств.
- Алифатические (от греческого aleiphar , «жир») углеводороды получают в результате химического распада жиров или масел. Они делятся на алканы, алкены и алкины.
- Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь.
- Ароматические углеводороды составляют группу родственных веществ, получаемых путем химического разложения экстрактов некоторых приятно пахнущих растений. Их относят либо к аренам, содержащим в качестве структурной единицы бензольное кольцо, либо к небензольным ароматическим углеводородам, обладающим особой стабильностью, но не содержащим бензольного кольца.

ароматическое соединение
Узнайте больше об ароматических соединениях.
Как использование углеводородов влияет на глобальное потепление и изменение климата?
Углеводороды составляют ископаемое топливо. Одним из основных побочных продуктов сжигания ископаемого топлива является двуокись углерода (CO 2 ). Постоянно растущее использование ископаемого топлива в промышленности, на транспорте и в строительстве добавило в атмосферу Земли большое количество CO 2 . Атмосферный CO 2 концентрации колебались между 275 и 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18-го века, но увеличилось до 316 ppmv к 1959 г. и выросло до 412 ppmv в 2018 г. CO 2 ведет себя как парниковый газ, т. е. поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
глобальное потепление
Узнайте больше о глобальном потеплении.
изменение климата
Узнайте больше об изменении климата.
Сводка
Прочтите краткий обзор этой темы
углеводород , любое из класса органических химических соединений, состоящих только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Многие углеводороды встречаются в природе. Помимо того, что они составляют ископаемое топливо, они присутствуют в деревьях и растениях, как, например, в виде пигментов, называемых каротинами, которые встречаются в моркови и зеленых листьях. Более 98 процентов натурального сырого каучука представляет собой углеводородный полимер, цепочечную молекулу, состоящую из множества связанных друг с другом звеньев. Структура и химический состав отдельных углеводородов в значительной степени зависят от типов химических связей, связывающих вместе атомы составляющих их молекул.
Структура и химический состав отдельных углеводородов в значительной степени зависят от типов химических связей, связывающих вместе атомы составляющих их молекул.
Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств. Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические углеводороды делятся на три основные группы в зависимости от типа содержащихся в них связей: алканы, алкены и алкины. Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь. Ароматические углеводороды — это те, которые значительно более стабильны, чем можно было бы предположить по их структуре Льюиса; обладают «особой устойчивостью». Они классифицируются либо как арены, содержащие в качестве структурной единицы бензольное кольцо, либо как небензольные ароматические углеводороды, обладающие особой стабильностью, но не имеющие в качестве структурной единицы бензольного кольца.
Ароматические углеводороды — это те, которые значительно более стабильны, чем можно было бы предположить по их структуре Льюиса; обладают «особой устойчивостью». Они классифицируются либо как арены, содержащие в качестве структурной единицы бензольное кольцо, либо как небензольные ароматические углеводороды, обладающие особой стабильностью, но не имеющие в качестве структурной единицы бензольного кольца.
Эта классификация углеводородов помогает связать структурные признаки со свойствами, но не требует отнесения конкретного вещества к одному классу. Действительно, молекула обычно включает структурные единицы, характерные для двух или более семейств углеводородов. Молекула, которая содержит как тройную углерод-углеродную связь, так и бензольное кольцо, например, будет проявлять некоторые свойства, характерные для алкинов, и другие, характерные для аренов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Алканы описываются как насыщенные углеводороды, а алкены, алкины и ароматические углеводороды считаются ненасыщенными.
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, удовлетворяющие общему выражению C n H 2 n + 2 (где n — целое число). Углерод с p 3 гибридизированы (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь С—С и С—Н является сигма (σ) связью ( см. химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые своей молекулярной формулой. Для С 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — означает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Изомеры, различающиеся порядком соединения атомов, имеют разное строение и называются конституциональными изомерами. (Старое название — структурные изомеры.) Соединения n -бутан и изобутан являются конституциональными изомерами и являются единственными возможными для формулы C 4 H 10 . Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Не существует простой арифметической зависимости между количеством атомов углерода в формуле и количеством изомеров. Теория графов использовалась для расчета количества конституционно-изомерных алканов, возможных для значений 9.0048 n в C n H 2 n + 2 от 1 до 400. Число конституциональных изомеров резко возрастает с увеличением числа атомов углерода. Верхнего предела возможного числа атомов углерода в углеводородах, вероятно, не существует. В качестве примера так называемого сверхдлинного алкана синтезирован алкан СН 3 (СН 2 ) 388 СН 3 , в котором 390 атомов углерода связаны в непрерывную цепь. Несколько тысяч атомов углерода соединены вместе в молекулах углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
Число конституциональных изомеров резко возрастает с увеличением числа атомов углерода. Верхнего предела возможного числа атомов углерода в углеводородах, вероятно, не существует. В качестве примера так называемого сверхдлинного алкана синтезирован алкан СН 3 (СН 2 ) 388 СН 3 , в котором 390 атомов углерода связаны в непрерывную цепь. Несколько тысяч атомов углерода соединены вместе в молекулах углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
| молекулярная формула | количество конституциональных изомеров |
|---|---|
| С 3 Н 8 | 1 |
| С 4 Н 10 | 2 |
| С 5 Н 12 | 3 |
| С 6 Н 14 | 5 |
| С 7 Н 16 | 9 |
| С 8 Н 18 | 18 |
| С 9 Н 20 | 35 |
| С 10 Н 22 | 75 |
| С 15 Н 32 | 4347 |
| С 20 Н 42 | 366 319 |
| С 30 Н 62 | 4 111 846 763 |
Необходимость дать каждому соединению уникальное имя требует более широкого разнообразия терминов, чем доступно с описательными префиксами, такими как n — и изо-. Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Правила IUPAC присваивают названия неразветвленным алканам в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , CH 3 CH 3 и CH 3 CH 2 CH 3 соответственно Префикс n — не используется для неразветвленных алканов в систематической номенклатуре IUPAC; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан. Названия неразветвленных алканов, начиная с пятиуглеродных цепей, состоят из латинской или греческой основы, соответствующей количеству атомов углерода в цепи, за которой следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением CH 2 группы составляют гомологический ряд.
| формула алкана | имя | формула алкана | имя |
|---|---|---|---|
| СН 4 | метан | СН 3 (СН 2 ) 6 Ч 3 | октановое число |
| CH 3 CH 3 | этан | CH 3 (CH 2 ) 7 CH 3 | нонан |
| СН 3 СН 2 СН 3 | пропан | СН 3 (CH 2 ) 8 CH 3 | деканировать |
| СН 3 СН 2 СН 2 СН 3 | бутан | CH 3 (CH 2 ) 13 CH 3 | пентадекан |
| СН 3 (СН 2 ) 3 СН 3 | пентан | CH 3 (CH 2 ) 18 CH 3 | икозан |
| CH 3 (CH 2 ) 4 CH 3 | гексан | CH 3 (CH 2 ) 28 CH 3 | триаконтан |
| CH 3 (CH 2 ) 5 CH 3 | гептан | CH 3 (CH 2 ) 98 CH 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепочки атомов углерода в молекуле, называемой материнской. Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
При наличии двух или более идентичных заместителей используются повторяющиеся префиксы (ди-, три-, тетра- и т. д.) вместе с отдельным локантом для каждого заместителя. Различные заместители, такие как этил (―CH 2 CH 3 ) и метильную (―CH 3 ) группы приведены в алфавитном порядке. Реплицирующиеся префиксы игнорируются при упорядочении по алфавиту. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.
Метил и этил являются примерами алкильных групп. Алкильная группа получается из алкана путем удаления одного из его атомов водорода, в результате чего остается потенциальная точка присоединения. Метил — единственная алкильная группа, полученная из метана, а этил — единственная из этана. Есть два С 3 H 7 и четыре C 4 H 9 алкильные группы. Правила IUPAC для обозначения алканов и алкильных групп охватывают даже очень сложные структуры и регулярно обновляются. Они однозначны в том смысле, что, хотя одно соединение может иметь более одного правильного названия IUPAC, нет никакой возможности, чтобы два разных соединения имели одно и то же название.
углеводород | Определение, типы и факты
структуры обычных углеводородных соединений
Посмотреть все СМИ
- Ключевые люди:
- Пьер-Эжен-Марселлен Бертло
Джордж А. Ола
Шарль-Адольф Вюрц
- Похожие темы:
- стирол
бензол
олефин
ксилол
нафталин
Просмотреть весь связанный контент →
Популярные вопросы
Что такое углеводород?
Углеводород – это любой класс органических химических веществ, состоящий только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
химическое соединение
Узнайте больше о химических соединениях.
Какие углеводороды наиболее широко используются в современной жизни?
Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
нефть
Узнайте больше о нефти.
ископаемое топливо
Узнайте больше об ископаемом топливе.
Существуют ли различные виды углеводородов?
- Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств.
- Алифатические (от греческого aleiphar , «жир») углеводороды получают в результате химического распада жиров или масел.
 Они делятся на алканы, алкены и алкины.
Они делятся на алканы, алкены и алкины. - Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь.
- Ароматические углеводороды составляют группу родственных веществ, получаемых путем химического разложения экстрактов некоторых приятно пахнущих растений. Их относят либо к аренам, содержащим в качестве структурной единицы бензольное кольцо, либо к небензольным ароматическим углеводородам, обладающим особой стабильностью, но не содержащим бензольного кольца.
ароматическое соединение
Узнайте больше об ароматических соединениях.
Как использование углеводородов влияет на глобальное потепление и изменение климата?
Углеводороды составляют ископаемое топливо. Одним из основных побочных продуктов сжигания ископаемого топлива является двуокись углерода (CO 2 ). Постоянно растущее использование ископаемого топлива в промышленности, на транспорте и в строительстве добавило в атмосферу Земли большое количество CO 2 . Атмосферные концентрации CO 2 колебались от 275 до 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но к 1959 г. они увеличились до 316 ppmv.и вырос до 412 частей на миллион по объему в 2018 году. CO 2 ведет себя как парниковый газ, то есть он поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
Атмосферные концентрации CO 2 колебались от 275 до 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но к 1959 г. они увеличились до 316 ppmv.и вырос до 412 частей на миллион по объему в 2018 году. CO 2 ведет себя как парниковый газ, то есть он поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
глобальное потепление
Узнайте больше о глобальном потеплении.
изменение климата
Узнайте больше об изменении климата.
Сводка
Прочтите краткий обзор этой темы
углеводород , любое из класса органических химических соединений, состоящих только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Многие углеводороды встречаются в природе. Помимо того, что они составляют ископаемое топливо, они присутствуют в деревьях и растениях, как, например, в виде пигментов, называемых каротинами, которые встречаются в моркови и зеленых листьях. Более 98 процентов натурального сырого каучука представляет собой углеводородный полимер, цепочечную молекулу, состоящую из множества связанных друг с другом звеньев. Структура и химический состав отдельных углеводородов в значительной степени зависят от типов химических связей, связывающих вместе атомы составляющих их молекул.
Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств. Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические углеводороды делятся на три основные группы в зависимости от типа содержащихся в них связей: алканы, алкены и алкины. Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь. Ароматические углеводороды — это те, которые значительно более стабильны, чем можно было бы предположить по их структуре Льюиса; обладают «особой устойчивостью». Они классифицируются либо как арены, содержащие в качестве структурной единицы бензольное кольцо, либо как небензольные ароматические углеводороды, обладающие особой стабильностью, но не имеющие в качестве структурной единицы бензольного кольца.
Эта классификация углеводородов помогает связать структурные признаки со свойствами, но не требует отнесения конкретного вещества к одному классу. Действительно, молекула обычно включает структурные единицы, характерные для двух или более семейств углеводородов. Молекула, которая содержит как тройную углерод-углеродную связь, так и бензольное кольцо, например, будет проявлять некоторые свойства, характерные для алкинов, и другие, характерные для аренов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Алканы описываются как насыщенные углеводороды, а алкены, алкины и ароматические углеводороды считаются ненасыщенными.
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, удовлетворяющие общему выражению C n H 2 n + 2 (где n — целое число). Углерод с p 3 гибридизированы (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь С—С и С—Н является сигма (σ) связью ( см. химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые своей молекулярной формулой. Для С 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — означает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Изомеры, различающиеся порядком соединения атомов, имеют разное строение и называются конституциональными изомерами. (Старое название — структурные изомеры.) Соединения n -бутан и изобутан являются конституциональными изомерами и являются единственными возможными для формулы C 4 H 10 . Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Не существует простой арифметической зависимости между количеством атомов углерода в формуле и количеством изомеров. Теория графов использовалась для расчета количества конституционно-изомерных алканов, возможных для значений 9.0048 n в C n H 2 n + 2 от 1 до 400. Число конституциональных изомеров резко возрастает с увеличением числа атомов углерода. Верхнего предела возможного числа атомов углерода в углеводородах, вероятно, не существует. В качестве примера так называемого сверхдлинного алкана синтезирован алкан СН 3 (СН 2 ) 388 СН 3 , в котором 390 атомов углерода связаны в непрерывную цепь. Несколько тысяч атомов углерода соединены вместе в молекулах углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
| молекулярная формула | количество конституциональных изомеров |
|---|---|
| С 3 Н 8 | 1 |
| С 4 Н 10 | 2 |
| С 5 Н 12 | 3 |
| С 6 Н 14 | 5 |
| С 7 Н 16 | 9 |
| С 8 Н 18 | 18 |
| С 9 Н 20 | 35 |
| С 10 Н 22 | 75 |
| С 15 Н 32 | 4347 |
| С 20 Н 42 | 366 319 |
| С 30 Н 62 | 4 111 846 763 |
Необходимость дать каждому соединению уникальное имя требует более широкого разнообразия терминов, чем доступно с описательными префиксами, такими как n — и изо-. Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Правила IUPAC присваивают названия неразветвленным алканам в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , CH 3 CH 3 и CH 3 CH 2 CH 3 соответственно Префикс n — не используется для неразветвленных алканов в систематической номенклатуре IUPAC; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан. Названия неразветвленных алканов, начиная с пятиуглеродных цепей, состоят из латинской или греческой основы, соответствующей количеству атомов углерода в цепи, за которой следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением CH 2 группы составляют гомологический ряд.
| формула алкана | имя | формула алкана | имя |
|---|---|---|---|
| СН 4 | метан | СН 3 (СН 2 ) 6 Ч 3 | октановое число |
| CH 3 CH 3 | этан | CH 3 (CH 2 ) 7 CH 3 | нонан |
| СН 3 СН 2 СН 3 | пропан | СН 3 (CH 2 ) 8 CH 3 | деканировать |
| СН 3 СН 2 СН 2 СН 3 | бутан | CH 3 (CH 2 ) 13 CH 3 | пентадекан |
| СН 3 (СН 2 ) 3 СН 3 | пентан | CH 3 (CH 2 ) 18 CH 3 | икозан |
| CH 3 (CH 2 ) 4 CH 3 | гексан | CH 3 (CH 2 ) 28 CH 3 | триаконтан |
| CH 3 (CH 2 ) 5 CH 3 | гептан | CH 3 (CH 2 ) 98 CH 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепочки атомов углерода в молекуле, называемой материнской. Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
При наличии двух или более идентичных заместителей используются повторяющиеся префиксы (ди-, три-, тетра- и т. д.) вместе с отдельным локантом для каждого заместителя. Различные заместители, такие как этил (―CH 2 CH 3 ) и метильную (―CH 3 ) группы приведены в алфавитном порядке. Реплицирующиеся префиксы игнорируются при упорядочении по алфавиту. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.
Метил и этил являются примерами алкильных групп. Алкильная группа получается из алкана путем удаления одного из его атомов водорода, в результате чего остается потенциальная точка присоединения. Метил — единственная алкильная группа, полученная из метана, а этил — единственная из этана. Есть два С 3 H 7 и четыре C 4 H 9 алкильные группы. Правила IUPAC для обозначения алканов и алкильных групп охватывают даже очень сложные структуры и регулярно обновляются. Они однозначны в том смысле, что, хотя одно соединение может иметь более одного правильного названия IUPAC, нет никакой возможности, чтобы два разных соединения имели одно и то же название.
углеводород | Определение, типы и факты
структуры обычных углеводородных соединений
Посмотреть все СМИ
- Ключевые люди:
- Пьер-Эжен-Марселлен Бертло
Джордж А. Ола
Шарль-Адольф Вюрц
- Похожие темы:
- стирол
бензол
олефин
ксилол
нафталин
Просмотреть весь связанный контент →
Популярные вопросы
Что такое углеводород?
Углеводород – это любой класс органических химических веществ, состоящий только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
химическое соединение
Узнайте больше о химических соединениях.
Какие углеводороды наиболее широко используются в современной жизни?
Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
нефть
Узнайте больше о нефти.
ископаемое топливо
Узнайте больше об ископаемом топливе.
Существуют ли различные виды углеводородов?
- Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств.
- Алифатические (от греческого aleiphar , «жир») углеводороды получают в результате химического распада жиров или масел.
 Они делятся на алканы, алкены и алкины.
Они делятся на алканы, алкены и алкины. - Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь.
- Ароматические углеводороды составляют группу родственных веществ, получаемых путем химического разложения экстрактов некоторых приятно пахнущих растений. Их относят либо к аренам, содержащим в качестве структурной единицы бензольное кольцо, либо к небензольным ароматическим углеводородам, обладающим особой стабильностью, но не содержащим бензольного кольца.
ароматическое соединение
Узнайте больше об ароматических соединениях.
Как использование углеводородов влияет на глобальное потепление и изменение климата?
Углеводороды составляют ископаемое топливо. Одним из основных побочных продуктов сжигания ископаемого топлива является двуокись углерода (CO 2 ). Постоянно растущее использование ископаемого топлива в промышленности, на транспорте и в строительстве добавило в атмосферу Земли большое количество CO 2 . Атмосферные концентрации CO 2 колебались от 275 до 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но к 1959 г. они увеличились до 316 ppmv.и вырос до 412 частей на миллион по объему в 2018 году. CO 2 ведет себя как парниковый газ, то есть он поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
Атмосферные концентрации CO 2 колебались от 275 до 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но к 1959 г. они увеличились до 316 ppmv.и вырос до 412 частей на миллион по объему в 2018 году. CO 2 ведет себя как парниковый газ, то есть он поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
глобальное потепление
Узнайте больше о глобальном потеплении.
изменение климата
Узнайте больше об изменении климата.
Сводка
Прочтите краткий обзор этой темы
углеводород , любое из класса органических химических соединений, состоящих только из элементов углерода (C) и водорода (H).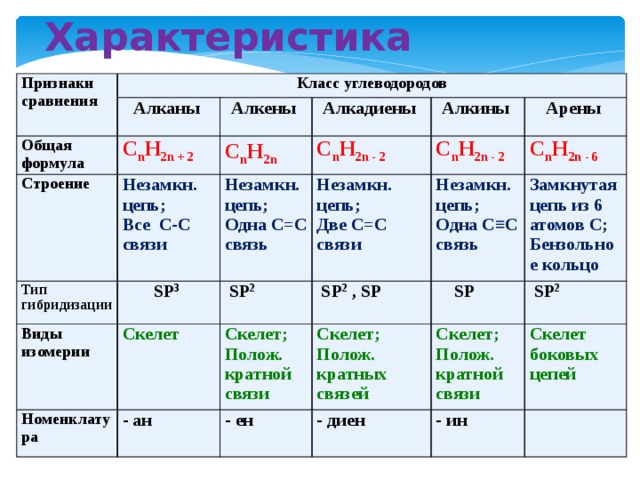 Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Многие углеводороды встречаются в природе. Помимо того, что они составляют ископаемое топливо, они присутствуют в деревьях и растениях, как, например, в виде пигментов, называемых каротинами, которые встречаются в моркови и зеленых листьях. Более 98 процентов натурального сырого каучука представляет собой углеводородный полимер, цепочечную молекулу, состоящую из множества связанных друг с другом звеньев. Структура и химический состав отдельных углеводородов в значительной степени зависят от типов химических связей, связывающих вместе атомы составляющих их молекул.
Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств. Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но соединения, которые они описывают, различаются на основе структуры, а не происхождения.
Алифатические углеводороды делятся на три основные группы в зависимости от типа содержащихся в них связей: алканы, алкены и алкины. Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь. Ароматические углеводороды — это те, которые значительно более стабильны, чем можно было бы предположить по их структуре Льюиса; обладают «особой устойчивостью». Они классифицируются либо как арены, содержащие в качестве структурной единицы бензольное кольцо, либо как небензольные ароматические углеводороды, обладающие особой стабильностью, но не имеющие в качестве структурной единицы бензольного кольца.
Эта классификация углеводородов помогает связать структурные признаки со свойствами, но не требует отнесения конкретного вещества к одному классу. Действительно, молекула обычно включает структурные единицы, характерные для двух или более семейств углеводородов. Молекула, которая содержит как тройную углерод-углеродную связь, так и бензольное кольцо, например, будет проявлять некоторые свойства, характерные для алкинов, и другие, характерные для аренов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Алканы описываются как насыщенные углеводороды, а алкены, алкины и ароматические углеводороды считаются ненасыщенными.
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, удовлетворяющие общему выражению C n H 2 n + 2 (где n — целое число). Углерод с p 3 гибридизированы (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь С—С и С—Н является сигма (σ) связью ( см.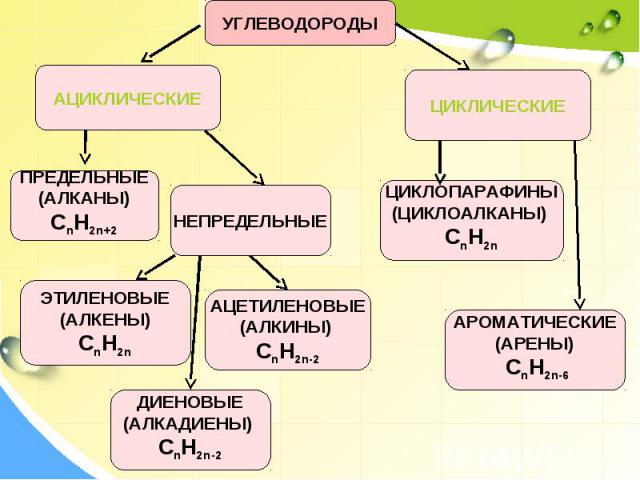 химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые своей молекулярной формулой. Для С 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — означает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Изомеры, различающиеся порядком соединения атомов, имеют разное строение и называются конституциональными изомерами. (Старое название — структурные изомеры.) Соединения n -бутан и изобутан являются конституциональными изомерами и являются единственными возможными для формулы C 4 H 10 . Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Не существует простой арифметической зависимости между количеством атомов углерода в формуле и количеством изомеров. Теория графов использовалась для расчета количества конституционно-изомерных алканов, возможных для значений 9.0048 n в C n H 2 n + 2 от 1 до 400. Число конституциональных изомеров резко возрастает с увеличением числа атомов углерода. Верхнего предела возможного числа атомов углерода в углеводородах, вероятно, не существует. В качестве примера так называемого сверхдлинного алкана синтезирован алкан СН 3 (СН 2 ) 388 СН 3 , в котором 390 атомов углерода связаны в непрерывную цепь. Несколько тысяч атомов углерода соединены вместе в молекулах углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
| молекулярная формула | количество конституциональных изомеров |
|---|---|
| С 3 Н 8 | 1 |
| С 4 Н 10 | 2 |
| С 5 Н 12 | 3 |
| С 6 Н 14 | 5 |
| С 7 Н 16 | 9 |
| С 8 Н 18 | 18 |
| С 9 Н 20 | 35 |
| С 10 Н 22 | 75 |
| С 15 Н 32 | 4347 |
| С 20 Н 42 | 366 319 |
| С 30 Н 62 | 4 111 846 763 |
Необходимость дать каждому соединению уникальное имя требует более широкого разнообразия терминов, чем доступно с описательными префиксами, такими как n — и изо-. Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Правила IUPAC присваивают названия неразветвленным алканам в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , CH 3 CH 3 и CH 3 CH 2 CH 3 соответственно Префикс n — не используется для неразветвленных алканов в систематической номенклатуре IUPAC; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан. Названия неразветвленных алканов, начиная с пятиуглеродных цепей, состоят из латинской или греческой основы, соответствующей количеству атомов углерода в цепи, за которой следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением CH 2 группы составляют гомологический ряд.
| формула алкана | имя | формула алкана | имя |
|---|---|---|---|
| СН 4 | метан | СН 3 (СН 2 ) 6 Ч 3 | октановое число |
| CH 3 CH 3 | этан | CH 3 (CH 2 ) 7 CH 3 | нонан |
| СН 3 СН 2 СН 3 | пропан | СН 3 (CH 2 ) 8 CH 3 | деканировать |
| СН 3 СН 2 СН 2 СН 3 | бутан | CH 3 (CH 2 ) 13 CH 3 | пентадекан |
| СН 3 (СН 2 ) 3 СН 3 | пентан | CH 3 (CH 2 ) 18 CH 3 | икозан |
| CH 3 (CH 2 ) 4 CH 3 | гексан | CH 3 (CH 2 ) 28 CH 3 | триаконтан |
| CH 3 (CH 2 ) 5 CH 3 | гептан | CH 3 (CH 2 ) 98 CH 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепочки атомов углерода в молекуле, называемой материнской. Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
При наличии двух или более идентичных заместителей используются повторяющиеся префиксы (ди-, три-, тетра- и т. д.) вместе с отдельным локантом для каждого заместителя. Различные заместители, такие как этил (―CH 2 CH 3 ) и метильную (―CH 3 ) группы приведены в алфавитном порядке. Реплицирующиеся префиксы игнорируются при упорядочении по алфавиту. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.



 Они делятся на алканы, алкены и алкины.
Они делятся на алканы, алкены и алкины. Они делятся на алканы, алкены и алкины.
Они делятся на алканы, алкены и алкины.