Содержание
Металловедение (Гуляев А. П.)
Металловедение (Гуляев А. П.)
Оглавление
|
Строение сплавов — презентация онлайн
Похожие презентации:
Металлические сплавы
Материаловедение
Понятие о сплавах и методах их получения
Металлические сплавы
Металловедение. Теория сплавов
Понятия о металлических сплавах. Лекция 4
Лекция 4
Типичные твердые фазы металлических сплавов
Основы строения сплавов. (3)
Типичные твердые фазы металлических сплавов
Материаловедение как наука
1. Строение сплавов
2. Сплав – вещество полученное сплавлением нескольких компонентов Компоненты –химически чистые вещества из которых состоят все
фазы
сплава
3. Взаимодействие компонентов в сплаве: 1.Образование физико-механических смесей 2.Образование твердых растворов 3.Образование
химических соединений
4. Физико-механические смеси компонентов
Они имеют следующие особенности
— Состав – который соответствует
среднеарифметическому содержанию исходных
компонентов
— Две кристаллических решетки такие же как и у
основных компонентов
— Интервал температур плавления
— Свойства значения которых соответствуют
среднеарифметическому содержанию исходных
компонентов
5. Физико-механические смеси компонентов
6. Твердые растворы
Они имеют следующие особенности
Состав – который имеет интервал
растворимости
Кристаллическую решетку такую же как и
основной компонент (растворитель
Интервал температур плавления
Свойства мало отличающиеся от свойств
исходных компонентов
7.
 Твердые растворы замещения внедрения вычитания
Твердые растворы замещения внедрения вычитания
Твердые растворы вычитания
12. Искажения кристаллической решетки при образовании твердых растворов
13. Микроструктура твердого раствора
14. Химические соединения
Они имеют следующие особенности
Состав – который может быть выражен простой
химической формулой An Bm
Кристаллическую решетку отличающуюся от
решеток исходных компонентов
Собственную постоянную температуру плавления
Свойства резко отличающиеся от свойств исходных
компонентов
16. Микроструктура химических соединений
17. Диаграммы состояния Диаграмма состояния – графическое изображение всех фазовых превращений происходящих в сплаве
20. Правило фаз (Гиббса)
C=K–Ф+Р
С –степень свободы системы
К – количество компонентов
Ф – число фаз
Р – число независимых
переменных
С=К–Ф+1
22. Процесс кристаллизации сплава
C=K–Ф+1
0-1
С = к- ф +1 =2 -1 + 1 = 2
1-2
С = к – ф + 1 = 2 – 2 + 1 =1
2-х
С = к – ф + 1 = 2 – 1 + 1 =2
25.
 Эвтектика – физико-механическая смесь кристаллов различных фаз кристаллизирующихся из жидкости одновременно при постоянной
Эвтектика – физико-механическая смесь кристаллов различных фаз кристаллизирующихся из жидкости одновременно при постоянной
температуре
26. Строение эвтектики
28. Строение сплавов с эвтектическим превращением и ограниченной растворимостью компонентов
29. Структура вторичных фаз
31. Схема микроструктуры сплава после перитектического превращения
32. Сплав меди с цинком — латунь
33. Лекция 7
34. Диаграммы состояния с промежуточными фазами
Промежуточными называются фазы, которые
образуются в интервале концентраций между
граничными твердыми растворами на основе чистых
компонентов.
Эти фазы могут быть постоянного состава (химические
соединения) или переменного состава (твердые
растворы).
От граничных твердых растворов промежуточные
фазы всегда отделены двухфазными областями
35. Диаграмма состояния с химическим соединением
36. Структурная диаграмма с химическим соединением
39.
 Диаграмма состояния Al — Cu
Диаграмма состояния Al — Cu
40. Диаграмма состояния Cu — Mg
42. Лекция 8
43. Диаграммы состояния с полиморфными превращениями в компонентах
44. Диаграммы состояния железа с легирующими элементами
45. Диаграммы с эвтектоидным (а) и перитектоидным (б) превращениями
46. Диаграмма с эвтектическим и эвтектоидным превращениями
47. Диаграмма состояния железо-углерод
48. Диаграмма с перитектическим и перитектоидным превращениями
49. Зависимость свойств сплава от типа диаграммы состояния
50. Зависимость технологических свойств сплава от его фазового состава
English
Русский
Правила
Структура сплавов* | Природа
Структура сплавов*
Скачать PDF
Скачать PDF
- Опубликовано:
- В.
 Л. Брэгг
Л. Брэгг
Природа
том 131 , страницы 749–753 (1933)Цитировать эту статью
3253 Доступ
8 цитирований
Сведения о показателях
Аннотация
КОГДА один металл сплавляется с другим, в ряде различных относительных пропорций обычно появляется несколько новых структур (фаз) сплава, которые отличаются друг от друга и от структур любого чистого металла. На диаграмме обычного типа состав сплава представлен по горизонтальной шкале, начиная с чистого металла А с левой стороны и заканчивая чистым металлом В с правой стороны; температуры нанесены вертикально. В типичном случае добавление небольших количеств металла B в металл A не изменяет своей характерной структуры, атомы остаются в том же относительном расположении. Атомы B замещают соответствующее количество атомов A , по-видимому, случайным образом, и единственное наблюдаемое изменение — это однородное сжатие или расширение решетки A . Таким образом, слева на диаграмме имеется более или менее протяженная однофазная область. По мере увеличения доли B достигается предел, при котором Структура A больше не может поглощать атомов B таким образом, и после этой точки появляется новая фаза. Новая фаза, более богатая компонентом В , имеет иное расположение атомов, что подтверждается рентгеноструктурным анализом. В определенном диапазоне составов две фазы сосуществуют и каждая постоянна по составу, при этом количество первой фазы уменьшается, а второй увеличивается при прохождении через двухфазную область слева направо.
В типичном случае добавление небольших количеств металла B в металл A не изменяет своей характерной структуры, атомы остаются в том же относительном расположении. Атомы B замещают соответствующее количество атомов A , по-видимому, случайным образом, и единственное наблюдаемое изменение — это однородное сжатие или расширение решетки A . Таким образом, слева на диаграмме имеется более или менее протяженная однофазная область. По мере увеличения доли B достигается предел, при котором Структура A больше не может поглощать атомов B таким образом, и после этой точки появляется новая фаза. Новая фаза, более богатая компонентом В , имеет иное расположение атомов, что подтверждается рентгеноструктурным анализом. В определенном диапазоне составов две фазы сосуществуют и каждая постоянна по составу, при этом количество первой фазы уменьшается, а второй увеличивается при прохождении через двухфазную область слева направо. Первая фаза, наконец, исчезает, и вступает новая область одной фазы, за которой попеременно следуют двухфазные и однофазные области. Последняя однофазная область справа включает в качестве предельного случая чистый металл Б .
Первая фаза, наконец, исчезает, и вступает новая область одной фазы, за которой попеременно следуют двухфазные и однофазные области. Последняя однофазная область справа включает в качестве предельного случая чистый металл Б .
Авторы
- W. L. BRAGG
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Повышение растворимости Fe в наночастицах ZnO, полученных методом соосаждения
- Мухаммад Мушараф
- Шумайла Карамат
- Зияд Альмохаймед
Журнал сверхпроводимости и нового магнетизма (2021)
Кристалл | Определение, типы, структура и факты
кристалл
Посмотреть все средства массовой информации
- Ключевые люди:
- Николаус Стено
Ральф Уолтер Грейстоун Вайкофф
Макс фон Лауэ
Жорж Фридель
Торберн Улоф Бергман
- Похожие темы:
- жидкокристаллический
плеохроизм
двойное преломление
симметрия
полиморфизм
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
Узнайте, как форма кристаллов определяет различные минералы в семейства
Посмотреть все видео к этой статье
кристалл , любой твердый материал, в котором атомы компонентов расположены определенным образом и регулярность поверхности которого отражает его внутреннюю симметрию.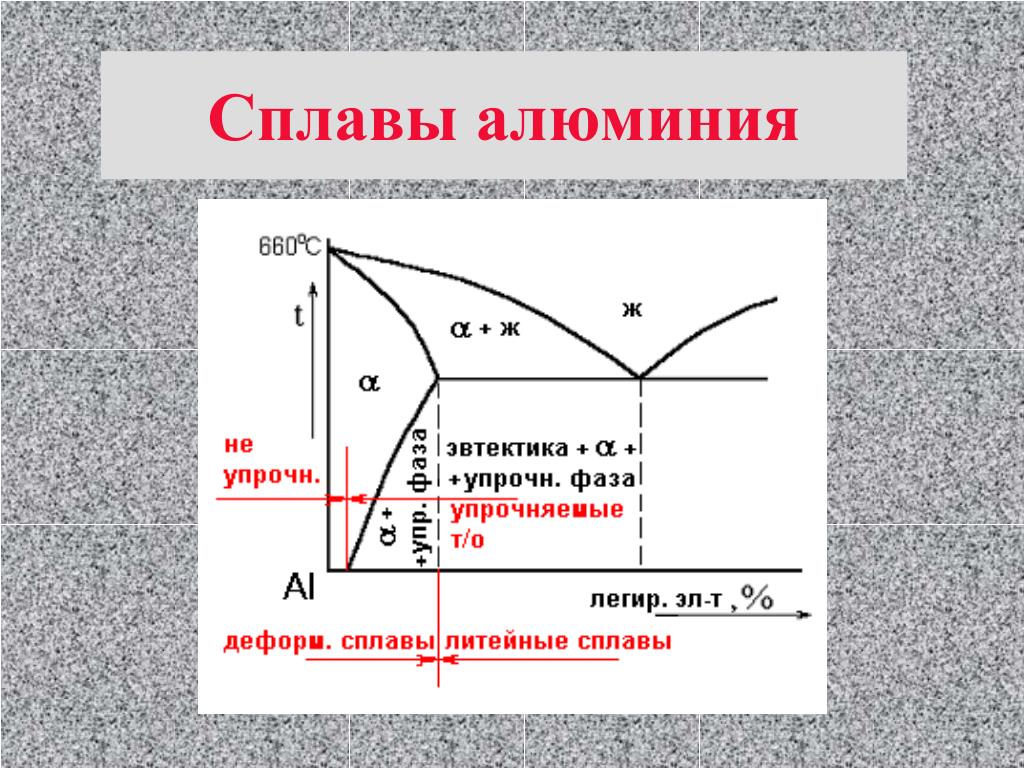
Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако после проверки определение становится менее простым. Кусочек сливочного масла, например, после хранения в холодильнике становится твердым и явно твердым. Пролежав сутки на кухонном столе, тот же кубик становится довольно мягким, и неясно, следует ли по-прежнему считать масло твердым. Многие кристаллы ведут себя как масло в том смысле, что они тверды при низких температурах, но мягки при более высоких температурах. Они называются твердыми при всех температурах ниже их точки плавления. Возможное определение твердого тела — это объект, который сохраняет свою форму, если его не трогать. Актуальным вопросом является то, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет свою форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы измерения твердых тел
Основными единицами твердых тел являются либо атомы, либо атомы, объединившиеся в молекулы.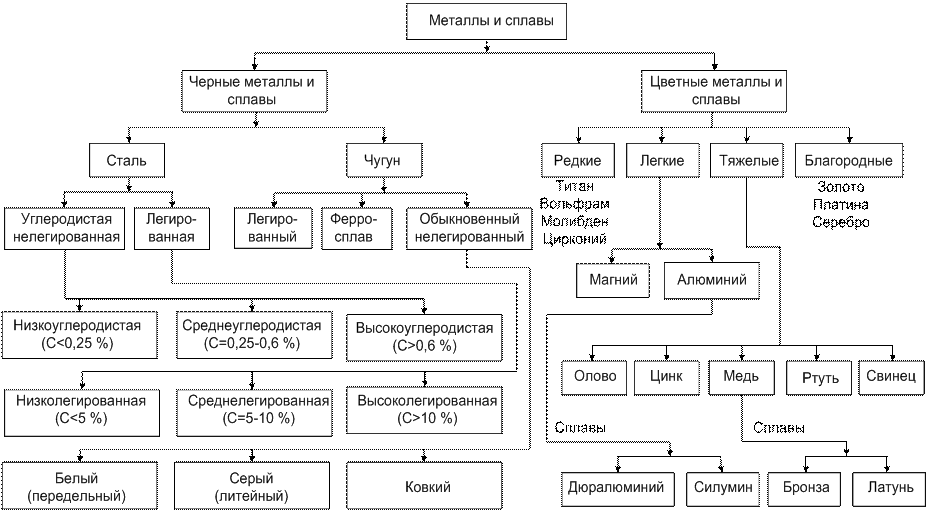 Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Все занятые оболочки атома аргона (Ar), например, заполнены, что приводит к сферической форме атома. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена лишь частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо является магнитом. Ковалентная связь между двумя атомами углерода (C) является самой прочной связью в природе. Эта сильная связь делает алмаз самым твердым телом.
Эта сильная связь делает алмаз самым твердым телом.
Викторина «Британника»
Наука: правда или вымысел?
Твердое тело называется кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, место каждого атома точно известно во всем кристалле. У большинства жидкостей отсутствует дальний порядок, хотя у многих есть ближний порядок. Ближний радиус определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях первые соседние атомы расположены так же, как и в соответствующей твердой фазе. Однако на расстояниях, которые составляют много атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти специальные вещества называются жидкими кристаллами. Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые тела, имеющие ближний порядок, но не имеющие дальнего порядка, называются аморфными. Почти любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние). Это условие нестабильно, и твердое тело со временем кристаллизуется. Если время кристаллизации исчисляется годами, то аморфное состояние оказывается стабильным. Стекла являются примером аморфных твердых тел. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) существует тот же ближний порядок, но направления связей меняются на более удаленных от любого атома расстояниях. Аморфный кремний — это разновидность стекла. Квазикристаллы — еще один тип твердых тел, в которых отсутствует дальний порядок.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Большинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла. На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и твердые молекулярные вещества.


 ТЕОРИЯ СПЛАВОВ
ТЕОРИЯ СПЛАВОВ СТРОЕНИЕ СПЛАВОВ
СТРОЕНИЕ СПЛАВОВ Упрощенные методы изучения многокомпонентных систем
Упрощенные методы изучения многокомпонентных систем Четыре основных превращения в стали
Четыре основных превращения в стали Распределение легирующих элементов в стали
Распределение легирующих элементов в стали ЖАРОСТОЙКИЕ И ЖАРОПРОЧНЫЕ СТАЛИ И СПЛАВЫ
ЖАРОСТОЙКИЕ И ЖАРОПРОЧНЫЕ СТАЛИ И СПЛАВЫ Хладноломкость тугоплавких металлов
Хладноломкость тугоплавких металлов Алюминиевые сплавы для поковок и штамповок
Алюминиевые сплавы для поковок и штамповок Л. Брэгг
Л. Брэгг 